基因组编辑:基因敲除、突变、标记和安全港敲除的HDR供体
 |
|
Ed Davis博士。 |
基因组编辑——在目标基因组位点进行特定改变——对生物学和医学研究人员来说至关重要(Bogdanove&Voytas,2011;van der Oost,等., 2013). 两种流行的基因组编辑技术利用细菌系统进行适应性免疫或植物致病:CRISPR(C类有光泽,R(右)有规律地我间隔,S公司短(hort)P(P)雄激素缺乏的R(右)重剑)和TALEN(T型赎金A类激活器-L(左)艾克E类效应器N个核酸酶)和)。两者都能在几乎任何基因组序列上启动双链断裂(DSB),并用于基因敲除、基因缺陷纠正、基因标记和转基因敲除。GeneCopoeia提供了一套广泛的基因组编辑工具,包括CRISPR sgRNAs和TALEN。我们还为同源定向修复(HDR)供体提供了许多类型的克隆和克隆载体,这是特定基因组编辑应用所必需的。在本技术说明中,我们描述了基因组编辑捐赠者的目的,如何使用它们,以及GeneCopoire如何为您提供适合您的基因组编辑项目的任何类型的捐赠者。
什么是捐赠者?
HDR供体是一种DNA分子,它使用HDR(也称为同源重组或HR)将遗传信息转移到染色体上,广泛用于基因敲除、突变、基因标记、启动子交换和转基因。HDR由CRISPR或TALEN介导的特定站点DSB发起。细胞通过两种机制中的任何一种修复DSB(图1):第一种是非同源末端连接(NHEJ),在没有同源模板的情况下导致小的插入或删除(“indels”)。indel生成的这种倾向经常导致移码突变,并被用来敲除基因。
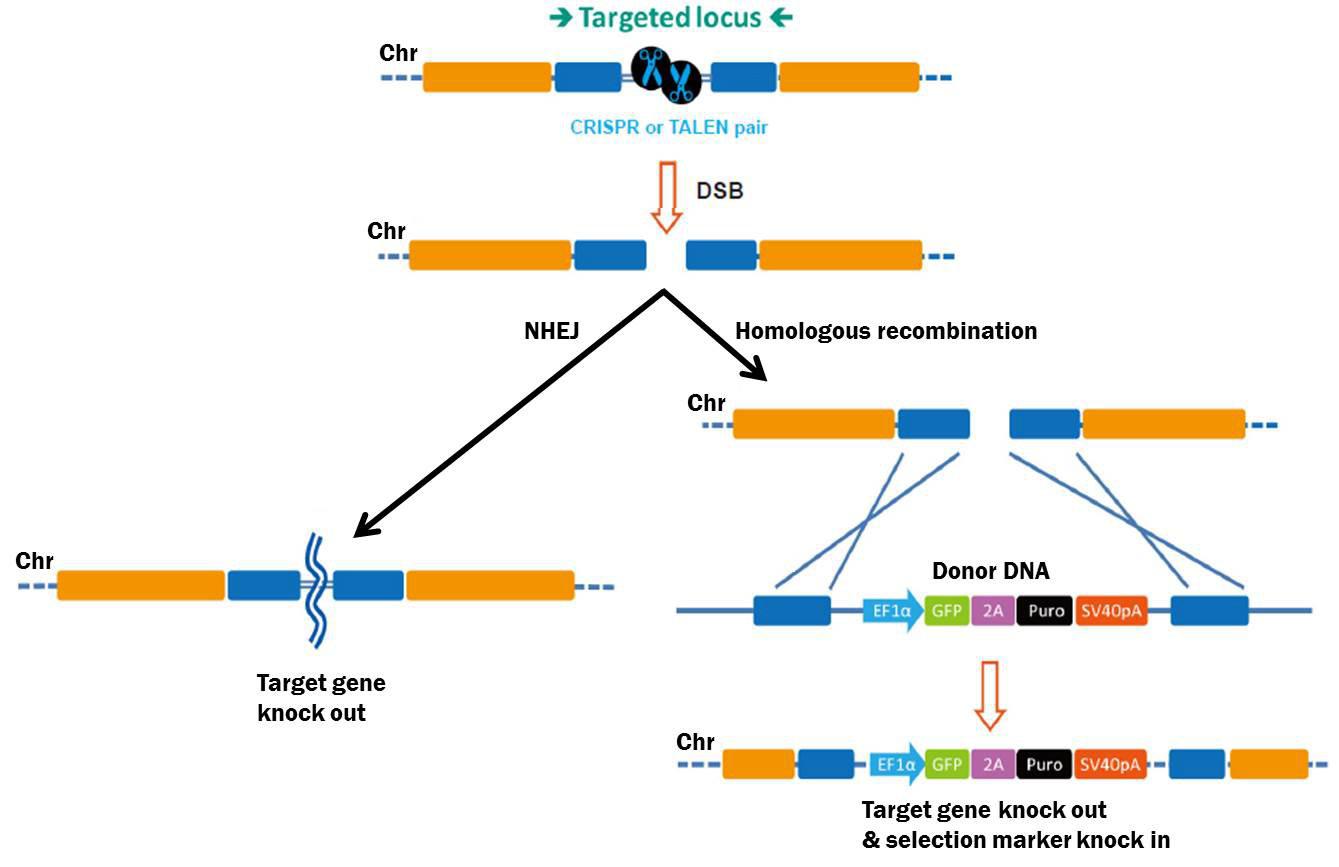
图1。基因组编辑工具诱导的DSB修复途径。左:NHEJ。右图:存在供体模板的HDR。
用于DSB修复的第二个主要途径是HDR。与NHEJ相比,HDR相对无误。除了姐妹染色单体外,外源DNA也可以用作HDR模板。HDR供体由与DSB两侧序列相同的左右“臂”组成(图1)。重组“复制”供体的信息并将其“粘贴”到染色体上。研究人员几乎可以在手臂之间放置任何DNA序列——一个可选择的标记、荧光报告等——HDR将允许这些额外的序列被复制或“敲入”到染色体上。
为什么使用HDR捐赠者?
除基因敲除外,大多数基因组编辑应用程序都需要HDR供体。没有捐赠者的DSB会导致NHEJ诱导的移码突变,从而敲除基因。然而,基因敲除可以从捐赠者那里受益。首先,捐赠者可以精确设计确保基因敲除的突变。在NHEJ中,indels仍然可以保留三分之一的原始开放阅读框,有时还可以表达功能蛋白。此外,HDR供体允许药物选择或荧光分选,使研究人员能够避免对大量克隆进行耗时和劳动密集型筛选,特别是对转染效率低的培养细胞系。
因此,决定是否使用donor-as以及哪种类型的donor-s取决于应用程序,如下所述。
HDR捐赠者应用程序
基因敲除
基因敲除不需要HDR供体,基因敲除HDR供者在转基因动物中没有用处,因为在转基因动物里,药物选择或荧光分选是不可能的。然而,在细胞培养中,基因敲除供体是有价值的。这些捐助者结构简单。通常,左右同源臂位于CRISPR或TALEN靶位点的侧面,这样,这些靶位点的一部分被删除并替换为携带药物选择标记的盒,如果需要,还可以替换为荧光报告子(图2)。或者,捐赠者淘汰策略可能包括删除整个外显子或基因。由于大多数敲除都需要修饰两个等位基因,因此两个供体,除了含有两个不同的药物选择标记外,每个供体都是相同的,可能有助于使用双重药物选择进行克隆分离。

图2。淘汰HDR捐赠者策略示例。含HDR供体药物选择标记物(Puro)和荧光报告物(GFP)。药物选择和荧光分选增强了获得基因敲除的能力。注:为了简单起见,只显示了一个等位基因。
在搜索基因特异性的人和小鼠CRISPR或TALEN基因敲除克隆时,可以从GeneCopoeia订购基因敲除供体。下面,我们将讨论敲入式捐赠应用程序,这些应用程序作为定制项目从GeneCopoeia订购
条件性基因敲除
当研究人员想要敲除一个基因时,需要有条件的基因敲除,但只能在期望的时间,在选定的组织中,或在特定的生理条件下。一种流行的条件敲除策略将loxP位点放置在外显子(一种“floxed”等位基因)两侧的每个内含子中。固定的等位基因在Cre重组酶表达之前一直是活性的。Cre导致loxP位点之间的重组和外显子的缺失(图3)。

图3。有条件的淘汰供体。上图:在外显子两侧有loxP位点的等位基因供体。药物选择和荧光分选允许分离带有漂浮等位基因的克隆。随后用Cre重组酶处理导致必要外显子的缺失。注:为了简单起见,只显示了一个等位基因。
与标准敲除供体一样,有条件敲除由药物选择标记物或荧光报告物辅助(图3)。然而,对于条件敲除,在表达Cre之前,该基因必须保持正常功能。因此,我们将药物选择标记放入其中一个内含子。
基本对更改
基因组编辑最有价值的应用之一是引入单碱基对变化。这对于将突变引入感兴趣的基因或修复疾病突变都很有用。
通常使用两种不同类型的供体将碱基对改变引入染色体。第一种方法使用带有可选标记的供体克隆,如果需要,还可以使用荧光报告子。对于用于细胞培养的这种供体,携带耐药性和荧光报告基因的盒被放置在附近的内含子中(图4)。
第二种诱变供体是单链寡核苷酸(ssODN),其位点两侧约有40-80个同源核苷酸。ssODN供体的主要优点是HDR导致内源性序列的“无疤痕”替换;没有修改其他序列。该方法的一个例子是使用带有CRISPR的ssODN来纠正小鼠中导致白内障的突变(Wu等人,2013)。然而,ssODN供体在细胞培养实验中没有提供选择或荧光分类的优势来识别正确修改的克隆,因此,具有选择和荧光标记的供体克隆将更有用,特别是在转染不好的细胞系中。

图4。诱变供体策略示例。顶部:单个碱基对改变的施主。药物选择和荧光分选可以分离出具有突变等位基因的克隆。注:为了简单起见,只显示了一个等位基因。
帧内融合标记
基因组编辑供体的下一个流行应用是蛋白质的帧内融合标记。例如,假设您想在内源性蛋白质中添加一个C末端GFP标记。你可以使用CRISPR或TALEN和供体将GFP敲到基因天然染色体位点的3'端(图5)。与条件敲除和突变的供体一样,选择标记通常放置在附近的内含子中,以便在细胞培养中分离正确修改的克隆。

图5。供体介导的融合标记。供体包含3'标记,位于终止密码子的上游。药物选择和荧光分选有助于克隆分离。注:为了简单起见,只显示了一个等位基因。
安全港转基因诺金
我们将在本技术说明中讨论的最后一种捐赠者是用于人类AAVS1或小鼠Rosa26“安全港”位点的转基因敲除。这些位点允许转基因插入而不会对细胞或动物产生任何有害影响,并确保稳定一致的转基因表达,而随机整合的转基因通常不会出现这种情况(DeKelver等人,2010;Zambrowicz等人,1997)。安全港整合具有许多潜在用途,例如将非人类基因整合到人类细胞中,或用稳定整合的ORF拯救敲除表型。GeneCopiea为安全港位点整合提供先进的解决方案,包括带有经过验证的CRISPR和TALEN试剂的试剂盒,以及用于在AAVS1或Rosa26同源臂之间自行插入感兴趣的转基因的载体。此外,由于GeneCopoeia收集了大量的人和鼠ORF克隆,我们提供了36000多个安全港Knockin ORF克隆(图6)。这些克隆包含整合在安全港同源臂之间的人类或小鼠序列验证ORF。
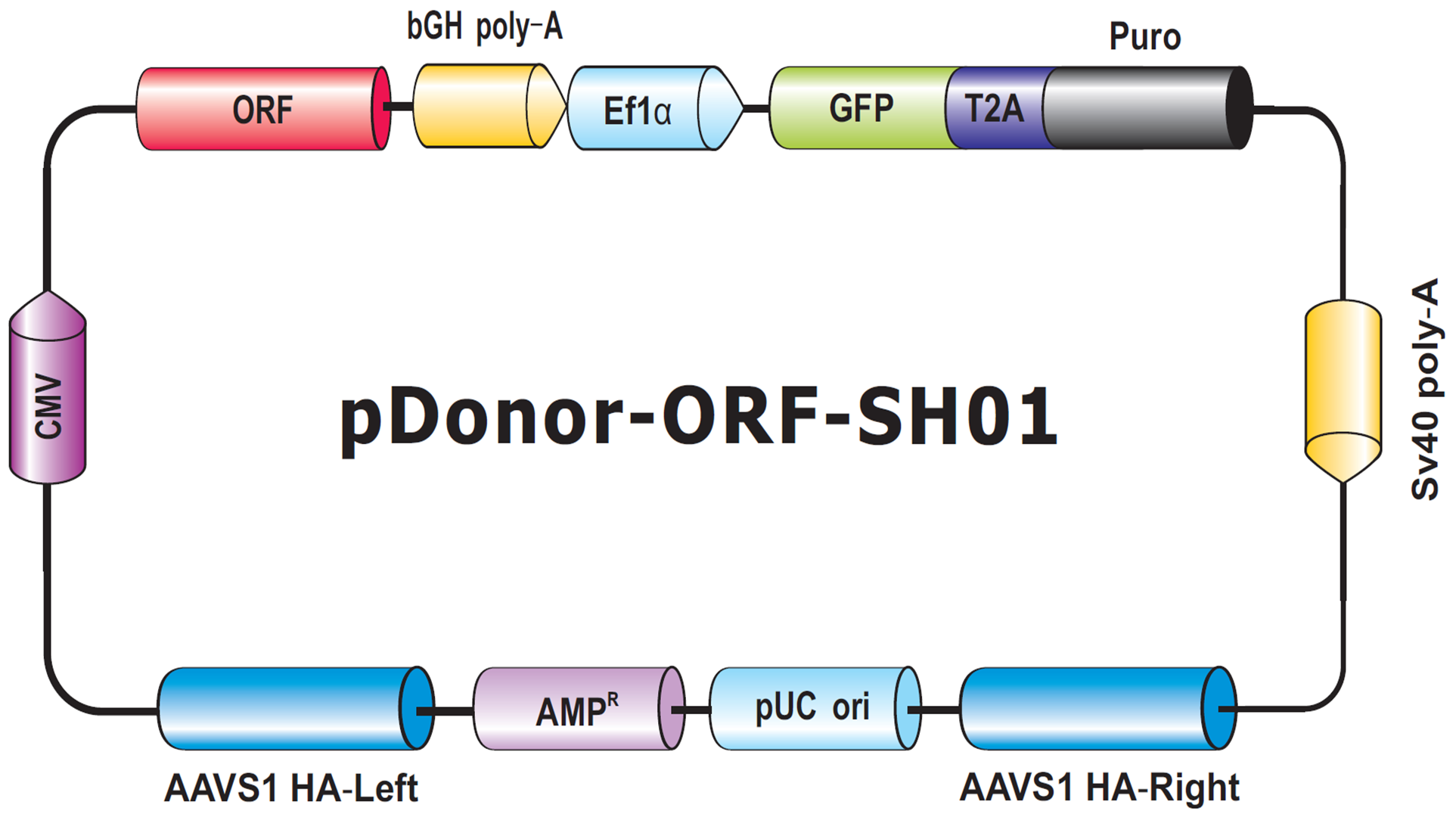
图6。基因组-CRISPTM(TM)人类AAVS1 Safe Harbor Knockin克隆主干。ORF与选择盒一起放置在AAVS1左右同源臂之间。
结论
在本技术说明中,我们描述了HDR供体在基因组编辑中的策略。GeneCopoeia提供了许多HDR供体解决方案,包括自己动手的供体克隆载体。然而,供体载体设计很复杂,因此我们鼓励您使用我们的定制供体克隆服务,我们的专家基因组编辑团队将为您设计、构建和交付序列验证克隆。此外,我们可以构建稳定的细胞系或含有CRISPR或TALEN介导修饰的转基因小鼠。有关HDR供体载体和克隆的更多信息,请访问我们的网站:https://www.genecopoeia.com/product/downer/。您也可以致电1-866-360-9531或发送电子邮件给我们inquiry@genecopoeia.com。
工具书类
Bogdanove&Voytas(2011年)。TAL效应器:可定制的DNA靶向蛋白质。科学类 333, 1843.
范德奥斯特,等. (2013). 基因组手术的新工具。科学类 339, 768.
德克尔弗,等. (2010). 功能基因组学、蛋白质组学和调节性DNA分析在等基因环境中使用锌指核酸酶驱动的转基因进入人类基因组中的安全港位点。基因组研究 20, 1133.
吴,等。(2013). 利用CRISPR-Cas9纠正小鼠遗传病。细胞干细胞 13, 659.
赞布罗维茨,等. (1997). ROSAβ-geo 26基因陷阱株中重叠转录物的破坏导致β-半乳糖苷酶在小鼠胚胎和造血细胞中广泛表达。程序。国家。阿卡德。科学。美国 94, 3789.
版权所有©2016
GeneCopoeia公司。
www.genecopoeia.com
TNGE5-062216号 |

