TALEN或CRISPR敲除vs.shRNA或siRNA敲除
 |
|
Ed Davis博士。 |
基因组编辑技术的最新进展——利用TALEN或CRISPR对基因进行有针对性的永久性改变——彻底改变了分子遗传学。他们还为用户提供了在这些相对较新的技术和使用短发夹RNA(shRNA)或短干扰RNA(siRNA)的更成熟的RNA干扰(RNAi)介导的敲除方法之间的选择。在本技术说明中,我们探讨了两种消融基因功能的方法之间的差异,以及一种技术比另一种更合适的情况。
RNAi介导的基因沉默
在高等真核生物中,RNAi介导的敲除是耗尽细胞中感兴趣的基因产物的最常见策略。然而,RNAi通常不会完全关闭该基因。本质上,短(约20-25个核苷酸)双链RNA分子要么由发夹形成前体(shRNAs)生成,要么由外源性(siRNAs。经Dicer处理后,单链RNA碱基与靶mRNA结合(Ketting,2013)。根据生物体的不同,RNA干扰介导的基因沉默由精氨酸蛋白通过mRNA降解或翻译抑制进行(图1)。最终结果是基因表达的转录后下调,而不改变遗传密码(Mittal,2004)。一些功能性RNA或蛋白质仍然存在,并在较低水平上被翻译。因此,减少基因功能的RNAi策略被称为“击倒”。基因功能降低,但并未消除。
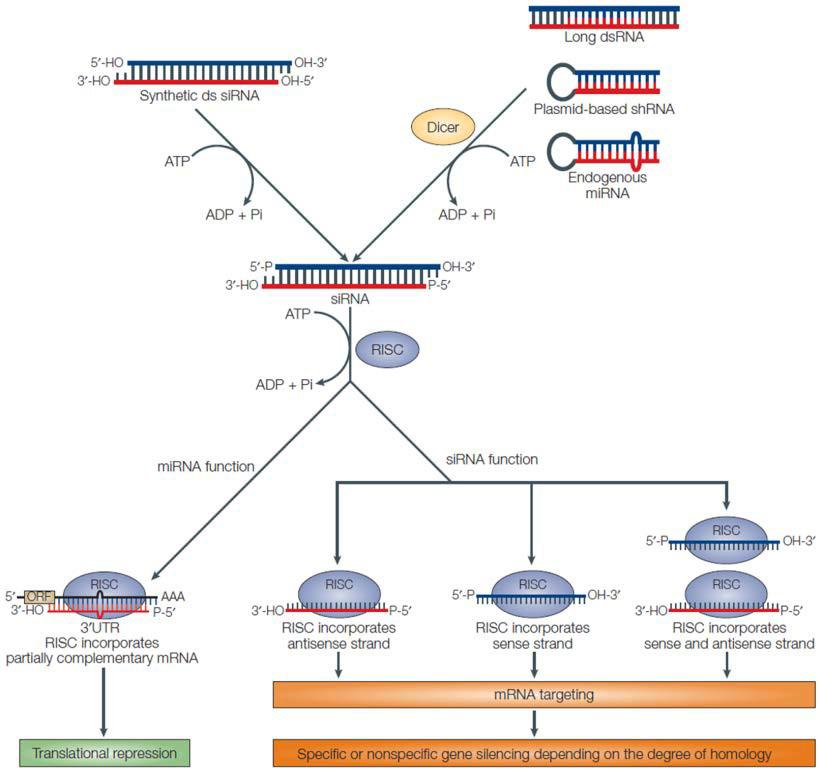
图1。RNAi途径的总体方案。摘自Mittal(2004)。
基因敲除的基因组编辑
相比之下,基因组编辑改变了遗传密码,通常会导致“基因敲除”或基因功能的完全消除。这一过程始于染色体上产生双链断裂(DSB)(Bogdanove&Voytas,2011)。最近,开发了两种高效生成DSB的工具:转录激活物样效应器核酸酶(TALENs)和簇状、规则间隔回文重复相关(CRISPR-Cas)蛋白(Bogdanove&Voytas,2011;Jinek等,2012;Shalem等,2014;Wang等,2014)。这两种工具均适用于导致植物致病(TALEN)或保护基因组免受插入突变(CRISPR-Cas)的细菌系统。TALEN是由融合到限制性内切酶FokI的位点特异性DNA结合蛋白组成的嵌合蛋白。CRISPR-Cas使用一个位点特异性的20核苷酸单引导RNA(sgRNA)将Cas9核酸酶带到其目标位点。对于TALEN和CRISPR-Cas,核酸酶切割靶的两条DNA链。这种断裂必须修复,否则细胞就会死亡,所以真核细胞的反应主要有两种机制(图2)。第一种是非同源末端连接(NHEJ),重新连接两个自由染色体末端。然而,NHEJ容易出错,通常会导致小的插入或缺失,从而破坏或敲除基因。或者,细胞可以通过同源重组(HR)修复DSB,这为研究人员提供了更多的基因敲除选项。可以引入定义的缺失,可以创建插入突变,或者改变单个碱基,等等。
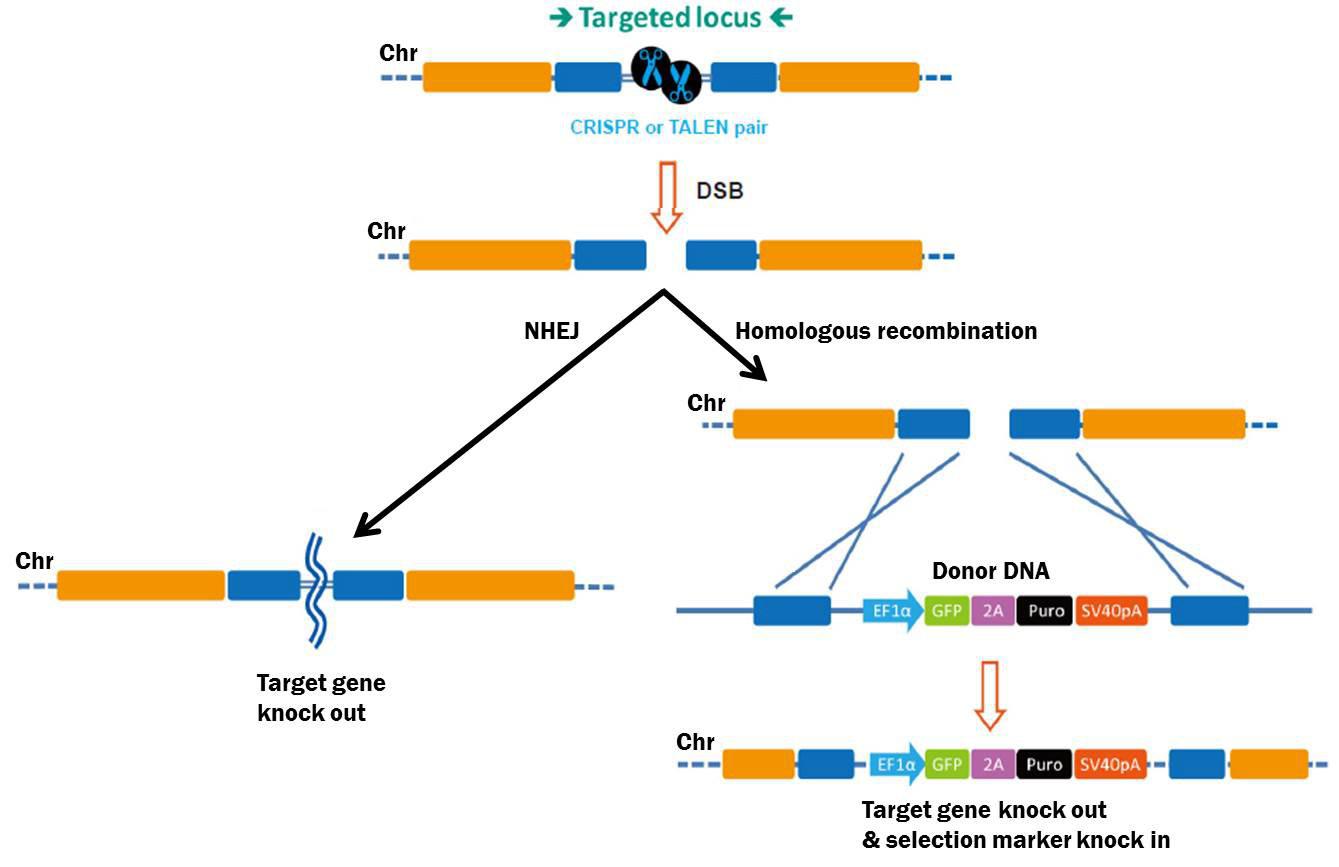
图2。基因组编辑工具诱导的DSB修复途径。左图:非多孔端接。右:供体模板存在下的同源重组。
RNAi与基因组编辑的比较
那么,哪种策略更好:RNAi介导的敲除,还是基因组编辑介导的基因敲除?这取决于实验目标(表1)。事实上,有些人混淆了这两种策略,将基因组编辑称为“击倒”。这种混淆可能是由于这样一个事实,即在基因组编辑变得可行之前的许多年里,在高等真核生物中消除基因功能的最实用策略是使用RNAi。因此,研究人员已经习惯了“击倒”一词。
| 方法 |
敲门
向下 |
敲门
外面的 |
遗传的
代码 |
更改
表达
水平 |
克隆
隔离,隔离
必修的 |
RNA干扰
(shRNA、siRNA) |
√ |
|
|
√ |
|
基因组编辑
(TALEN、CRISPR) |
|
√ |
√ |
√ |
√ |
表1。基因消融中RNA干扰和基因组编辑方法的比较。
基本上,当改变遗传密码是不可取的时,RNAi介导的敲除比基因组编辑更可取。例如,你可能想暂时降低基因功能,这样你就可以暂时将siRNA转染到细胞中。在几代人的时间里,siRNAs丢失,恢复了正常的基因功能。或者,你可以将shRNAs稳定地整合到基因组中,并从可诱导的启动子表达它们。然后你可以降低基因的表达,然后在所需的时间和/或在特定组织中反复恢复。此外,与基因组编辑介导的基因敲除不同,shRNA-介导的敲除不需要分离单个克隆,因此涉及的工作较少。最后,完全消除基因功能可能会损害细胞,但部分损失不会。
或者,为了获得真正的基因空等位基因,基因组编辑更可取(Wang等人,2013)。此外,可能需要引入一个特定的点突变,或将预先存在的突变纠正回野生型。最后,你可能想给你喜欢的基因添加一个融合标签,并从其内源性位点表达它。这些目标完全取决于基因组编辑方法。
GeneCopoeia为RNA干扰和基因组编辑提供先进的全方位服务解决方案,从shRNAs和TALEN或CRISPR质粒的设计和构建,一直到稳定细胞系和转基因小鼠的产生。请访问我们的网站了解更多信息:www.genecopoeia.com。
工具书类
Bogdanove&Voytas(2011年)。TAL效应器:可定制的DNA靶向蛋白质。科学类333, 1843.
Jinek等人(2012年)。一种可编程的双RNA引导的DNA内切酶,用于适应性细菌免疫。科学类337, 816.
Ketting(2011)。RNAi的许多方面。开发单元20, 148.
米塔尔(2004)。提高哺乳动物RNA干扰的效率。Nat.Rev.基因。5, 355.
Shalem等人(2014年)。在人类细胞中进行基因组级CRISPR-Cas9敲除筛查。科学类343, 84.
Wang等人(2013)。TALEN介导的小鼠Y染色体编辑。自然生物技术。31, 530.
Wang等人(2014)。使用CRISPR-Cas9系统对人类细胞进行基因筛查。科学类343, 80.
版权所有©2014 GeneCopoeia,Inc。
电子邮件:查询@genecopoipe.com
电话:+1(866)360-9531
TNGE1-021814公司 |