 |
Ed Davis博士。 |
摘要
基因组编辑——在目标基因组位点进行特定改变的能力——对生物学和医学研究人员来说至关重要(Bogdanove&Voytas,2011;van der Oost,et al.,2013)。最近出现了两种利用细菌系统进行植物致病或适应性免疫的基因组编辑技术:TALEN(转录激活物样效应器核酸酶)和CRISPR(集群、规则间隔、短回文重复)。TALEN和CRISPR都使用在几乎任何基因组目标序列上启动双链断裂(DSB)的内切酶,并用于许多应用,包括基因敲除、转基因敲入、基因标记和遗传缺陷纠正。在本综述中,我们讨论并比较了基因组编辑技术、使用已发表的案例研究进行基因组编辑的应用程序,以及GeneCopoeia基因组编辑技术和服务如何加速您的研究。
介绍
什么是基因组编辑?
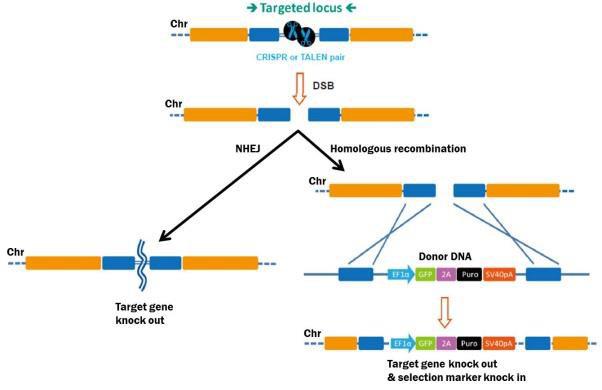
严格来说,基因组编辑意味着对遗传密码进行稳定、永久和可遗传的改变,以实现许多潜在目标。该过程从在目标站点刺激DSB开始。如果没有修复,DSB是致命的,所以真核细胞有几种反应机制(图1)。第一种是同源重组(HR),细胞利用断裂染色体的同源拷贝作为修复模板。人力资源是一个相对无错误的过程。模板通常是G2有丝分裂期间的姐妹染色单体,但也可以来自外源导入的DNA片段,它可以将所需的DNA序列“敲入”到目标位点。
|
|
图1。基因组编辑工具诱导的DSB修复途径。左图:非多孔端接。右图:HR在捐赠者模板面前。
DSB修复的第二个主要机制是非同源末端连接(NHEJ),这是在没有同源模板可用时发生的。NHEJ只是断裂染色体末端的重新连接。然而,NHEJ很容易出错,并且经常导致在中断位置进行小的插入或删除(“indels”)。索引可以通过引起框架移位,从而破坏基因,从而导致基因敲除。
|
基因组编辑工具也可用于基因表达的非永久性变化,方法是将其作为转录激活物或阻遏物的融合物进行调整。虽然这是这些工具的一个流行应用程序,但本综述将不涉及它。
RNAi介导的敲除是高等真核生物中最常见的基因功能消融策略。然而,RNAi和基因组编辑之间有一些关键的区别。首先,RNAi并没有完全关闭该基因(Ketting,2013)。相反,基因表达在转录后下调,而不改变遗传密码(Mittal,2004)。一些功能性RNA或蛋白质残留并被翻译。因此,RNAi策略是“敲门”向下”. 基因功能降低,而不是消除。另一方面,在基因组编辑中,遗传密码发生了改变,基因表达的衰减通常是完全的,导致“敲门”外面的”. 是否使用RNAi或基因组编辑来减弱基因表达取决于实验的目标。(表1)。
| 方法 |
敲门向下 |
敲门外面的 |
遗传的代码 |
更改表达水平 |
克隆隔离,隔离必修的 |
| RNA干扰(shRNA、siRNA) |
√ |
|
|
√ |
|
| 基因组编辑(TALEN、CRISPR) |
|
√ |
√ |
√ |
√ |
表1。基因消融中RNA干扰和基因组编辑方法的比较。
基因组编辑技术
人才
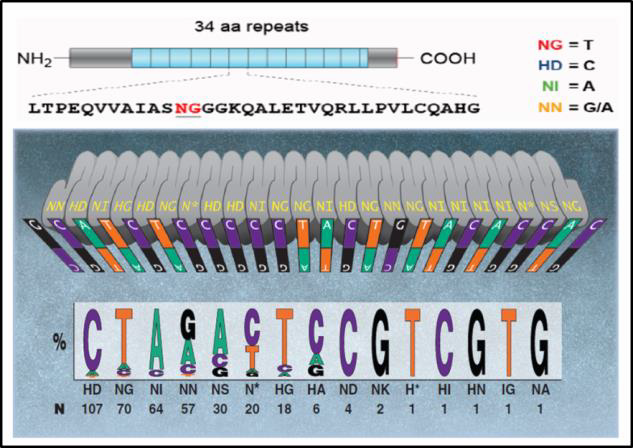
在自然界中,TAL是感染植物的细菌的DNA结合蛋白(Bogdanove&Voytas,2011)。DNA结合由34 bp的氨基酸重复序列介导,氨基酸12和13的重复序列不同。这些“重复可变直接序列”或RVD促进TALEN DNA结合特异性。每个RVD结合一个核苷酸,并确定了DNA结合代码(图2)。
|
| 图2。人才的DNA结合代码。改编自Bogdanove&Voytas(2011)。
TALEN由两种DNA结合蛋白组成。每个都融合到FokI限制性内切酶的一个结构域,并识别17-18 bp的目标序列。FokI的活性需要二聚体,因此,当两个设计合理的TAL(位于预期断裂位点的对面和相反的链上,中间大约有18个核苷酸)聚集在一起时,FokI就会切断DNA。由此产生的DSB由NHEJ或HR进行修复,如上所述。
|
CRISPR公司
CRISPR的机制不同于TALEN,具有相同的最终结果。CRISPR的天然功能是破坏侵入细菌的噬菌体以获得适应性免疫。对于基因组编辑,化脓链球菌Cas9核酸酶在与单一导向RNA(sgRNA)结合之前是不活跃的。sgRNA包含20个核苷酸基因组序列。当Cas9-sgRNA复合物紧跟着5'N-G-G3'“PAM”位点时,它可以识别基因组中的该序列。识别后,sgRNA与PAM对面的链杂交,Cas9产生DSB(图3)。
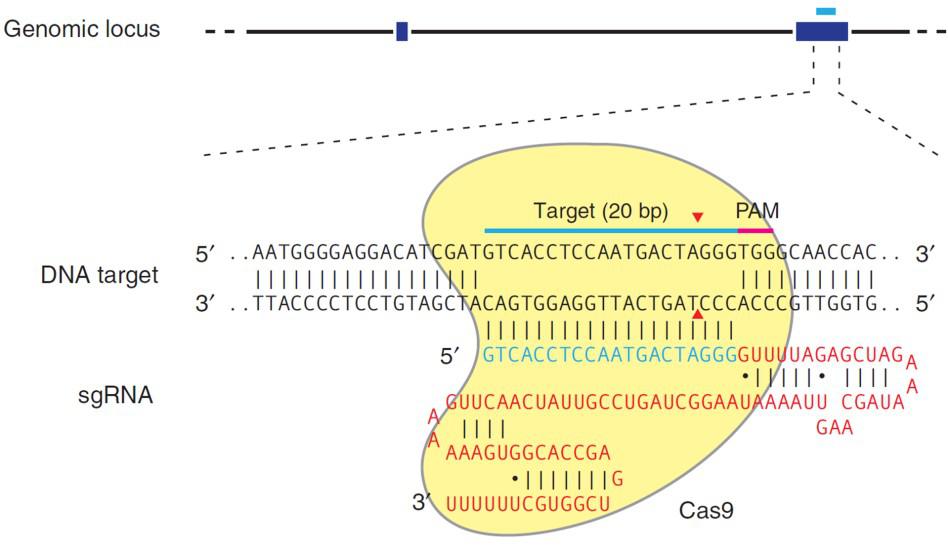
| 图3。sgRNA将Cas9募集到靶基因座。红色序列,sgRNA支架。蓝色,目标序列。PAM由红色条指示。sgRNA靶序列与PAM位点对面的链结合。Cas9切割PAM第三和第四核苷酸5'之间的两条sDNA链。红色箭头:DNA链切割的位置。来自Ran等人(2013)。 |
|
基因组编辑应用程序
由于基因组编辑始于DSB,因此许多应用都是可能的。最常见的是基因敲除。在最简单的水平上,无论是TALEN对,还是Cas9核酸酶与单一导向RNA的组合,都会产生DSB,导致容易出错的修复。偶尔会出现小的插入,但NHEJ更常见的结果是形成不同长度的小缺失(图3)。
|
| 图4。TALEN活动导致目标站点特定的插入或删除。来自Wang等人(2013)。
受特定TALEN对或CRISPR sgRNA的影响,移码频率差异很大。文献中关于效率的报告,以携带突变的细胞系克隆的百分比来衡量,范围从0%到70%以上。 |
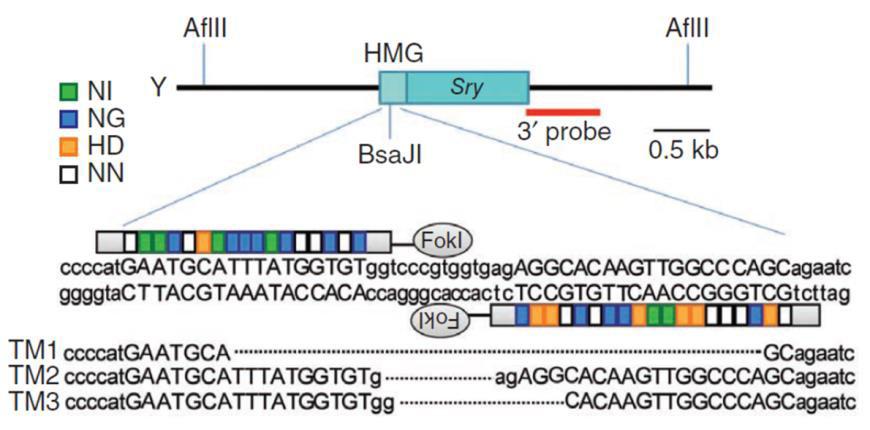
敲除也可以通过同源供体实现(图5)。在最简单的情况下,sgRNA被设计成剪切所有剪接变体共同的最早蛋白质编码区。它可以是与无助攻击倒相同的目标序列。供体的构造使得插入选择/报告盒会导致sgRNA结合位点的缺失,从而将基因敲除,同时防止供体分裂。供体与Cas9/sgRNAs共同引入。转染后2-3天,选择供体中的耐药基因(如嘌呤霉素),鉴定单个耐药菌落,然后筛选正确的插入。
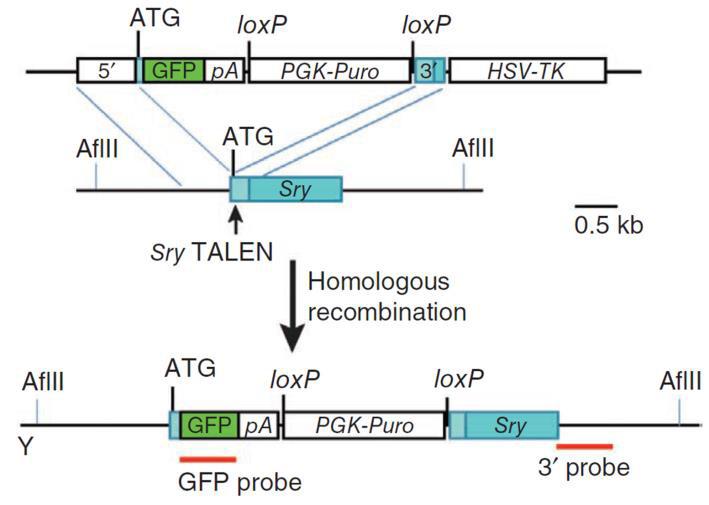
|
|
图5。使用供体质粒敲除小鼠Sry基因。顶部。供体质粒由带有GFP和嘌呤霉素抗性基因的盒组成。盒的两侧是与小鼠Sry靶区同源的序列。克隆被设计成将盒插入启动子ATG和其余基因之间。底部。TALEN与供体质粒的共导入导致供体和Sry位点之间的重组,导致内源性序列替换为被盒中断的序列和基因敲除。来自Wang等人(2013)
|
GeneCopoeia通过NHEJ介导的indels或供体克隆,携带客户敲除基因所需的所有试剂。这些克隆包括针对感兴趣区域表达TALEN对或sgRNAs的克隆、Cas9克隆、为淘汰构建的供体克隆以及其他应用。我们的CRISPR克隆为非病毒和慢病毒格式,用于难以转染的细胞系。
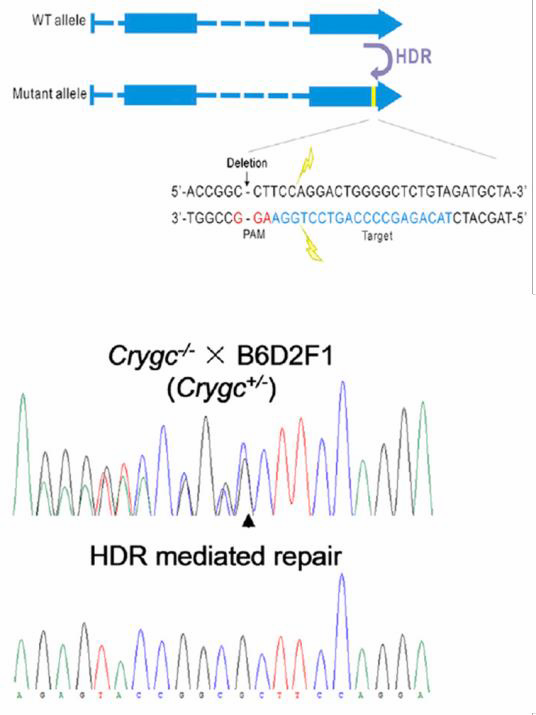
| 图6。应用CRISPR治疗遗传性白内障和转基因小鼠中的ssODN。来自Wu等人(2013)
其他基因组编辑应用需要同源供体。一种是引入单碱基改变,这可以使用供体质粒或单链来实现寡核苷酸(ssODN)。在ssODN策略中,一个寡核苷酸携带碱基变化和40-90个同源核苷酸侧翼目标区域。该方法工作效率高。李劲松的实验室使用带有ssODN的CRISPR来纠正导致小鼠白内障的单碱基突变(Wu等人,2013;图6)。
|
|
我应该使用哪个,TALEN还是CRISPR?
TALEN和CRISPR都是高效的基因组编辑技术。然而,每种技术都有其局限性,在选择一种技术而非另一种技术时,需要考虑这些因素。一方面,TALEN对胞嘧啶甲基化敏感,因此必须设计甲基C特异性RVD进行识别。然而,CRISPR对甲基化不敏感。此外,TALEN切割效率往往低于CRISPR。另一方面,与CRISPR相比,TALEN往往不太容易发生脱靶突变,尽管最近技术的改进,如使用双缺口酶、截短的引导RNA和Cas9-Fok I融合,提高了CRISPR靶位点的特异性。
结论
在GeneCopoeia,我们提供全套基因组编辑产品和服务。这些始于TALEN和CRISPR克隆的设计和建造,但我们的专业知识并不止于此。我们还提供TALEN和CRISPR克隆的功能验证。此外,我们将构建稳定的细胞系和携带您感兴趣的修改的转基因小鼠。根据我们在哺乳动物ORF和启动子克隆方面的长期专业知识,我们建立了一个包含40000多个人类和小鼠敲除靶点的数据库,可以从我们的网站上方便地购买。我们的专家还可以帮助您使用要求苛刻的自定义基因组编辑应用程序。立即联系我们inquiry@genecopoeia.com!有关更多信息,请访问我们的基因组编辑页面:https://www.genecopoeia.com/product/genome-editing/
工具书类
Bogdanove&Voytas(2011年)。《科学》3331843。Ran等人(2013年)。自然协议82281。van der Oost等人(2013年)。科学339768。Wang等人(2013)。自然生物技术。31, 530.Wang等人(2014)。《科学》343,80。Wu等人(2013)。细胞干细胞13,659。
| 版权所有©2014GeneCopoeia公司。www.genecopoeia.com拉格1-080614 |













