基因组
发布时间: 2022年3月29日 通过 医学博士Joshua Denny和博士Lawrence Tabak。
将近四年前,NIH为 我们所有人 研究项目 这个具有历史意义的项目正在美国建立一个由来自各种背景的至少100万参与者合作伙伴组成的重要研究社区。 它的统一目标是推进精准医疗,这是一种专门针对个人而非普通患者的新兴医疗形式。 作为这一历史性努力的一部分,许多参与者提供了用于全基因组测序的DNA样本,该样本提供了几乎所有个人基因组成的信息。
本月早些时候 我们所有人 研究计划达到了一个重要的里程碑。 我们从我们的合作伙伴那里发布了第一组近10万个全基因组序列。 序列存储在 我们所有人 研究员工作台 是一个强大的基于云的分析平台,注册研究人员可以广泛访问这些数据。
这个 我们所有人 研究计划及其许多参与合作伙伴正在引领医学研究中实现更公平的代表性。 这些新的基因组信息中,约有一半来自于认同某个种族或少数民族群体的人。 这一点非常重要,因为到目前为止,在大型基因组研究中,超过90%的参与者是欧洲血统。 这种多样性的缺乏产生了巨大的影响,加深了健康差距,阻碍了科学发现充分惠及所有人。
Researcher Workbench还包含来自许多参与者的电子健康记录、Fitbit设备和调查响应的信息。 另一个巧妙的功能是,该平台链接到美国人口普查局的美国社区调查数据,以提供更多有关参与者所在社区的详细信息。
这种独特而全面的数据组合将是改变我们对健康和疾病的理解的关键。 例如,鉴于Research Workbench中的大量数据和多样性,新的疾病无疑正在等待 未覆盖和定义 许多新的遗传变异也在等待鉴定,这些变异可能更好地预测疾病风险和 对治疗的反应 .
为了加快发现过程,这些数据被广泛而明智地提供。 为了保护参与者的隐私,该计划删除了数据中的所有直接标识符,并对寻求访问的研究人员提出了严格要求。 在完成培训并同意该项目严格的负责任使用规则后,美国各地已有1500多名科学家通过他们的机构进入研究人员工作台。 其中一些研究人员已经发现了促进精确医学的新方法,例如寻找预测如何最好地 预防青光眼患者视力下降 .
除了为研究提供基因组数据外, 我们所有人 参与者有机会获得 他们的个人DNA结果 ,对他们来说是免费的。 到目前为止,该项目已经为超过10万名参与者提供了遗传血统和特征结果。 今年晚些时候,计划开始分享遗传病风险和药物-基因相互作用方面的健康相关DNA结果。
基因组数据的首次发布对于该项目和更广泛的健康研究来说是一个巨大的里程碑,但它也只是一个开始。 该计划的基因组中心继续生成基因组数据,并每周处理约5000个额外的参与者DNA样本。
最终目标是从至少100万或更多生活在美国的人那里收集健康数据,并且有足够的时间参与这项工作。 无论您是想贡献自己的DNA和健康信息,参与研究,还是支持 我们所有人 研究项目作为合作伙伴,很容易参与。 通过参与这一历史性项目,你可以帮助建立一个更好、更公平的健康研究和精确医学未来。
注: Joshua Denny,医学博士,医学硕士。 ,是美国国立卫生研究院全民研究计划的首席执行官。
链接 :
我们所有人 研究项目 (国家卫生研究院)
我们所有人 研究中心
加入 我们所有人 (国家卫生研究院)
发布时间: 新闻
标签: 我们所有人 , 我们所有人的研究计划 , 我们所有人研究人员工作台 , 大数据 , 队列 , 数据保护 , 多样性 , DNA , DNA测序 , 环境健康风险 , 电子健康记录 , 种族 , 菲比特 , 基因组 , 基因组学 , 青光眼 , 健康差异 , 精密医学 , 比赛 , 研究隐私 , 美国人口普查局 , 全基因组测序
发布时间: 2021年1月19日 通过 弗朗西斯·柯林斯博士
最近,我很高兴与麻省理工大学博德学院(Broad Institute of MIT)和哈佛大学(Harvard)的埃里克·兰德(Eric Lander)一起参加了一个关于基因组学未来的视频讨论; 查尔斯·罗蒂米,NIH国家人类基因组研究所; 以及马里兰大学基因组科学研究所的克莱尔·弗雷泽。 2021年1月13日 事件 庆祝第一个完整的细菌基因组诞生25周年、人类基因组发表20周年和第一个人类宏基因组诞生15周年。 我也很高兴地向大家报告,两天后,当选总统乔·拜登(Joe Biden)请我继续担任国家卫生研究院院长,并提名兰德(Lander)领导白宫科技政策办公室(White House Office of Science and Technology Policy),担任我国第一位内阁级科学顾问。
发布时间: 导演专辑 , 导演相册-照片
标签: 细菌基因组 , 查尔斯·罗蒂米 , 克莱尔·弗雷泽 , 埃里克·兰德 , 基因组 , 基因组学 , 人类基因组 , 人类宏基因组 , 乔·拜登 , NIH主管 , 科学和技术政策局 , 科学顾问
发布时间: 2020年8月13日 通过 弗朗西斯·柯林斯博士
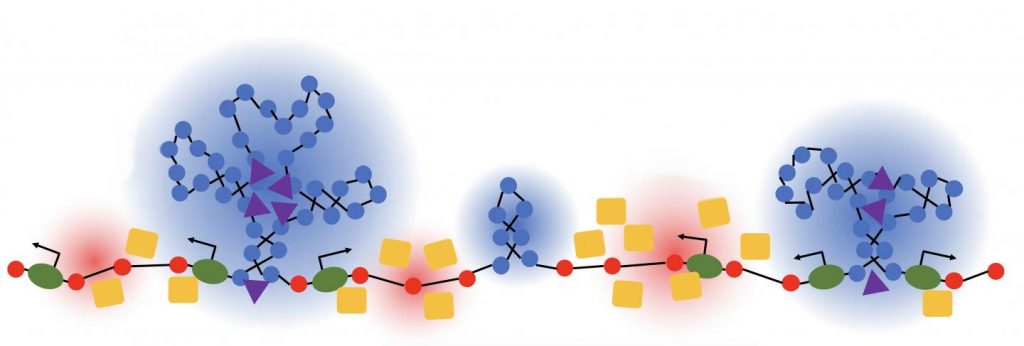
描述:染色质“森林”的3D模型。每个球体代表约10个核小体的树状结构域,核小体是DNA包装的基本结构单元。 较大的域为绿色; 较小的是红色的。学分:伊利诺伊州埃文斯顿西北大学
这一郁郁葱葱的五颜六色可能会激起人们去探索热带雨林的白日梦。 但是你在这里看到的是一个新模型,它使研究人员能够探索同样令人惊奇的事情:一条6英尺长的DNA链是如何被塞进人类细胞的微观细胞核中的。 将那么多DNA放入细胞核就像 适合帝国大厦长度的螺纹 在你的指甲下面!
科学家们已经知道了一段时间,答案在于DNA是如何折叠成卷轴状复合体的,这种复合体称为 染色质 ,但该过程的许多细节仍有待解决。 最近,由伊利诺伊州埃文斯顿西北大学Vadim Backman和Igal Szleifer领导的NIH资助的团队通过将复杂的数学建模与光学成像相结合,开发出了染色质折叠的新模型。 在杂志上发表的一项研究中 科学进展 [1] 研究小组发现,染色质沿着染色质主干折叠成各种树状结构域,他们将其比作生长在森林地面上的树木聚集。 上面你看到的彩色球体代表不同大小的树。
早期的染色质折叠模型表明DNA折叠成规则有序的纤维。 在这项新的研究中,西北大学的研究人员使用了他们自己专门设计的部分波谱显微镜。 这个高性能系统,再加上电子成像,使他们能够深入观察活细胞内部,“感知”染色质包装的实时变化。 使他们对染色质的新观点如此有趣的是,它表明我们的DNA以一种比最初想象的更加无序和不可预测的方式包装。
描述:示意图显示了转录和染色质堆积之间的相互作用。 非活性高DNA密度(蓝色)区域和活性低DNA密度(红色)区域。 水平染色质主干包括RNA聚合酶(绿色)、激活因子(黄色)和抑制因子(紫色)。 作者:Huang等人,Sci。 2020年12月 正如巴克曼指出的那样,可以合理地假设森林里会长满大小和形状各异的树。 但您无法预测每棵树的确切位置或其特定的大小和配置。 染色质内这些树状结构似乎也是如此。 它们的精确位置和大小因细胞而异,似乎不可预测。
鉴于染色质在影响基因表达和功能方面的重要性,这种看似随机的DNA堆积结构可能令人惊讶。 但研究人员认为,这种可变性可能有其优点。
这个想法是这样的:如果我们所有的细胞都以完全相同的方式对压力条件(如高温或有毒暴露)作出反应,而这种方式恰好是次优的,那么整个组织或器官可能会失灵。 但是,如果染色质结构的差异导致每个细胞对相同刺激的反应有所不同,那么一些细胞可能更容易在压力下存活甚至茁壮成长。 这是细胞对冲赌注的一种内置方式。
这些新发现为人类基因组提供了一个全新的三维视图。 它们还可能激发创新战略,以了解和抗击癌症以及其他疾病。 而且,虽然我们中的大多数人可能不会在短期内冒险进入雨林,但这项工作确实给了我们下次在我们自己的林区享受户外美景时需要考虑的事情。
参考 :
[1] 3D基因组的物理和数据结构 .Huang K,Li Y,Shim AR,Virk RKA,Agrawal V,Eshein A,Nap RJ,Almassalha LM,Backman V,Szleifer I.Sci Advv.2020年1月10日; 6(2):每年4055。
链接 :
脱氧核糖核酸(DNA )(美国国家人类基因组研究所/NIH)
4D核小体 (普通基金/NIH)
瓦迪姆·贝克曼 (伊利诺伊州埃文斯顿西北大学)
伊加尔·斯泽利弗 (伊利诺伊州埃文斯顿西北大学)
NIH支持:国家癌症研究所
发布时间: 新闻
标签: 3D基因组 , 3D基因组结构 , 细胞 , 染色质 , 染色质结构 , DNA , DNA包装 , 基因组 , 基因组学 , 成像 , 数学模型 , 显微镜 , 模型 , 核小体 , 核 , 部分波谱仪 , RNA聚合酶
发布时间: 2020年6月18日 通过 弗朗西斯·柯林斯博士
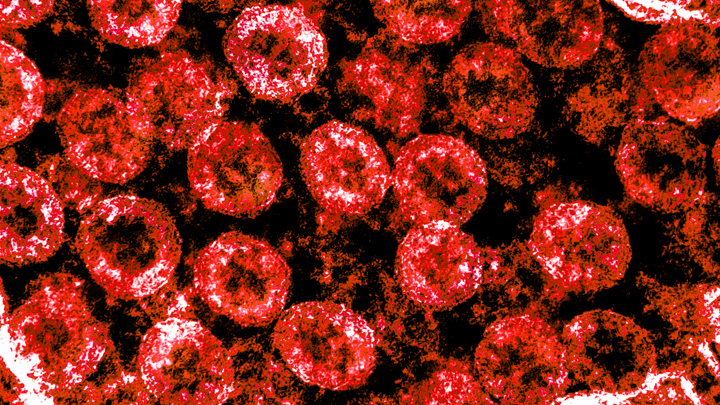
描述:从患者身上分离出的SARS-CoV-2病毒颗粒的显微照片。 信贷:美国国立卫生研究院变态反应和传染病研究所 许多感染新型冠状病毒的人只有轻微的疾病,有时甚至没有任何症状。 但其他人出现呼吸衰竭,需要氧气支持,甚至需要呼吸机帮助他们康复[1]。 很明显,这种情况在男性身上发生的频率高于女性,在老年人或慢性病患者身上也会发生。 但是,为什么年轻且看起来健康的人有时也会出现呼吸衰竭呢?
一项新的研究表明,这个问题的部分答案可能存在于我们每个人携带的基因中[2]。 虽然需要更多的研究来精确定位潜在的基因和机制 全基因组关联 )这项研究刚刚发表在 新英格兰医学杂志 研究发现,人类基因组中两个区域的基因变异与严重的新型冠状病毒肺炎相关,相应地,与新型冠状腺炎相关的死亡风险更大。
已知这两段DNA携带一些有趣的基因,包括决定血型的基因和在免疫系统中发挥各种作用的基因,这两段基因被认为具有感染新型冠状病毒的风险。 事实上,研究结果表明,A型血患者如果感染新型冠状病毒,需要氧气支持或呼吸机的风险将增加50%。 相比之下,O型血患者患严重新型冠状病毒肺炎的风险似乎降低了50%左右。
这些新发现首次从德国基尔市克里斯蒂安·阿尔布雷希特大学科学家安德烈·弗兰克(Andre Franke)和挪威奥斯陆大学医院的汤姆·卡尔森(Tom Karlsen)领导的一项大型研究中确定了具有统计学意义的新冠肺炎严重性易感基因。 他们的研究包括在意大利和西班牙的七个医疗中心接受严重新冠肺炎和呼吸衰竭治疗的1980人。
为了寻找可能在严重疾病中起作用的基因变体,该团队分析了850多万名患者的基因组数据,即所谓的单核苷酸多态性(SNP)。 在基因组中发现的这些单个“字母”核苷酸替换绝大多数都没有健康意义,但它们有助于确定基因变异的位置,这些变异更多地出现在与特定性状或条件相关的基因变异中,在本例中是与新冠肺炎相关的呼吸衰竭。 为了找到它们,研究人员将重症新冠肺炎患者的SNP与来自相同人群的1200多名健康献血者的SNP进行了比较。
该分析确定了两个在严重新冠肺炎患者中比在健康人群中更常见的地方。 其中一个位于第3染色体上,包含六个具有潜在相关功能的基因簇。 例如,基因组的这一部分编码一种已知与之相互作用的转运蛋白 血管紧张素转换酶2(ACE2 )是一种表面受体,可使新型冠状病毒SARS-CoV-2与人类细胞结合并感染人类细胞。 它还编码一系列趋化因子受体,在我们肺部气道的免疫反应中发挥作用。
另一个关联信号出现在9号染色体上,正好位于决定血型的基因组区域。 你是属于A型、B型、AB型还是O型血型,取决于你的基因如何指导你的血细胞产生(或不产生)一组特定的蛋白质。 研究人员确实发现了血型与新冠肺炎风险之间的关系。 他们指出,这一领域还包括一种与白细胞介素-6水平升高相关的基因变体,白细胞介素-6在炎症中发挥作用,也可能对新冠肺炎产生影响。
这些发现是在非常困难的临床条件下两个月内完成的,显然需要进一步研究以更全面地了解其含义。 事实上,Franke、Karlsen和他们的许多同事都是新冠肺炎宿主遗传学倡议的一部分,该倡议是一项持续的国际合作努力,旨在了解新冠肺炎易感性、严重性和结局的遗传决定因素。 一些 NIH研究小组 他们最近发起了一项研究,在美国和加拿大5000名新冠肺炎患者中寻找信息丰富的基因变异。
希望这些和其他尚未发现的结果将为更彻底地了解新型冠状病毒生物学指明方向。 他们还建议,基因测试和一个人的血型可能为识别那些可能面临更大严重疾病风险的人提供有用的工具。
工具书类 :
[1] 中国2019年冠状病毒病疫情的特点和重要教训:中国疾病预防控制中心72-314例病例报告摘要 Wu Z、McGoogan JM等,2020年2月24日。 [印刷前在线发布]
[2] 重度Covid-19与呼吸衰竭的全基因组关联研究 Ellinghaus D、Degenhardt F等。 2020年6月17日。
链接 :
新冠肺炎宿主遗传学倡议
安德烈·弗兰克 (德国基尔基督教阿尔布雷茨大学)
汤姆·卡尔森 (挪威里克什皮塔莱奥斯陆大学医院)
发布时间: 新闻
标签: ACE2公司 , 血 , 血型 , 加拿大 , 趋化因子受体 , 新冠肺炎 , 基因变体 , 基因 , 基因组 , 全基因组关联研究 , 基因组学 , 全球水资源系统 , 白介素-6 , 免疫系统 , 白细胞介素-6 , 意大利 , 新型冠状病毒 , 氧气支架 , 大流行 , 呼吸衰竭 , SARS-CoV-2型 , 严重新型冠状病毒肺炎 , 西班牙 , 敏感性 , 新冠肺炎宿主遗传学倡议 , A型 , O型 , 美国 , 通风机
发布时间: 2019年9月3日 通过 弗朗西斯·柯林斯博士
图片来源:Sharon Isern,steampunkphage.com。 四年前,巴西卫生官员发现,蚊子携带的寨卡病毒可能会导致严重的出生缺陷和其他严重的健康问题,这促使美洲各地作出重大努力,通过控制蚊子和发布旅行建议来遏制感染。 到2017年年中,辛勤的工作似乎取得了回报,新的寨卡病毒感染报告几乎停止。
但事实证明,Zika可能比以前想象的更难控制。 新的研究表明,就在疫情最严重的时期似乎已经结束的时候,古巴爆发了一场之前隐藏的寨卡病毒大规模疫情。 这一发现表明,寨卡病毒可能会持续很长一段时间,单靠蚊子控制可能会减缓但不一定会阻止这种潜在的毁灭性传染病的发展。
在对抗全球流行病时,追踪危险病毒从一个地方传播到另一个地方至关重要。 但有些病毒比其他病毒更难监测,美洲的寨卡病毒就是这样。 尽管这种病毒可能会伤害未出生的孩子,但许多感染寨卡病毒的人从来没有感到恶心到去看医生。 那些经常出现与登革热和基孔肯雅热等其他流行热带疾病重叠症状的人,很难识别寨卡。
这就是为什么在巴西,Zika于2014年初抵达美洲,这一意想不到的病毒入侵者在一年多的时间里没有被发现。 到那时,它已经不知不觉地传播到 洪都拉斯 很可能在2014年末至2015年间迅速传播至其他中美洲国家和墨西哥。
在美国,即使在严密的监测下,2016年佛罗里达州发生的寨卡病毒小规模局部疫情也有三个月左右未被发现[1]。 然后,2017年,佛罗里达州官员开始注意到一些奇怪的事情:前往古巴的人中出现了新的寨卡病毒感染病例。
这真的令人惊讶,因为与大多数其他加勒比岛屿不同,古巴被认为避免了疫情爆发。 更重要的是,到那时,美洲的寨卡疫情已经减缓到涓涓细流,促使世界卫生组织将其列为国际关注的全球公共卫生紧急事件。
鉴于古巴的观察,一些人怀疑美洲的寨卡疫情是否真的结束了。 其中包括NIH支持的研究团队,包括康涅狄格州纽黑文市耶鲁大学公共卫生学院的内森·格鲁堡; Sharon Isern和Scott Michael,佛罗里达州迈尔斯堡海湾海岸大学; 以及加利福尼亚州拉霍亚斯克里普斯研究所的Kristian Andersen,她与佛罗里达州卫生部密切合作,其中包括Andrea Morrison。
发布于 单元格 在疫情似乎已经结束后,该团队记录了古巴以前未报告的疫情[2]。 有趣的是,西班牙的另一个研究小组最近也对古巴的Zika进行了类似的观察[3]。
在 单元格 研究人员表示,在2017年6月至2018年10月期间,155例病例中,只有两例(高达98%的旅行相关寨卡病毒感染病例)可追溯到古巴。 进一步分析表明,古巴的疫情可能与其他加勒比国家的疫情规模相似。
他们的估计表明,古巴可能有数千例寨卡病例,2017年可能有5000多例确诊和报告。 唯一的区别是时间。 古巴爆发寨卡病毒大约是在加勒比海其他地区感染消退后一年。
为了填补更多的空白,研究人员利用2017年和2018年从古巴返回的9名佛罗里达州感染者的寨卡病毒基因组。 测序数据支持2016年夏天从其他加勒比岛屿多次将寨卡病毒引入古巴。
疫情在病毒传播到古巴大约一年后达到顶峰,与其他地方的情况类似。 但是,在巴西疫情被发现后,由于地方当局开展了有效的蚊子控制运动,古巴疫情可能推迟了一年。 虽然缺乏信息,包括寨卡病毒感染是否导致出生缺陷,但一旦加勒比海其他地区的紧急情况似乎结束,病毒开始流行,这些努力可能就会放松。
这些发现再次提醒我们,1947年在乌干达的寨卡森林首次发现的寨卡病毒,多年来一直被认为是一种无关紧要的病毒[4],但决不是 已被淘汰 事实上,这种未被认识和延迟的寨卡病毒爆发增加了旅行者无辜地将病毒传播到世界其他地区的风险。
令人鼓舞的消息是,有了旅行监测数据和基因组工具——开放科学的支持——现在可以检测到此类疫情。 通过将资源和数据结合起来,将有可能开发出更有效和更具响应性的监测框架,以在未来发现新出现的健康威胁。
与此同时,正在继续开发寨卡病毒疫苗,目前正在进行十多项临床试验,以寻求各种疫苗接种策略。 随着寨卡病毒大流行在美洲得到解决,这些研究可能更难进行,因为如果没有主动感染,就不可能证明疗效。 但是,正如本文所示,我们必须为这种独特而可怕的病毒的未来爆发做好准备。
工具书类 :
[1] 基因组流行病学显示寨卡病毒多次传入美国 Grubaugh等人《自然》。 2017年6月15日; 546(7658):401-405.
[2] 旅行监测和基因组学揭示了疫情减弱期间隐藏的寨卡病毒爆发 Grubaugh ND、Saraf S、Gangavarapu K、Watts A、Tan AL、Oidtman RJ、Magnani DM、Watkins DI、Palacios G、Hamer DH; GeoSentinel监视网络、Gardner LM、Perkins TA、Baele G、Khan K、Morrison A、Isern S、Michael SF、Andersen。 KG等人。 2019年8月22日; 178(5):1057-1071.e11。
[3] 反映古巴寨卡病毒疫情:来自欧洲进口疾病诊所的观点 Almuedo-Riera A、Rodriguez-Valero N、CamprubíD、Losada Galvan I、Zamora-Martinez C、Pousibet-Puerto J、SubiráC、Martinez MJ、Pinazo MJ、Muñoz J.Travel Med Infect Diss。 2019年7月至8月; 30:125-127.
[4] 寨卡疫情:对医学和公共卫生的严峻挑战 .Morens DM,Fauci AS.传染病杂志。 2017年12月16日; 216(补充件10):S857-S859。
链接 :
视频: 发现隐藏的寨卡病毒爆发 (佛罗里达海湾海岸大学,迈尔斯堡)
寨卡病毒 (国家过敏和传染病研究所/NIH)
寨卡病毒疫苗 (NIAID)
佛罗里达州无寨卡病毒 (佛罗里达州塔拉哈西卫生部)
格鲁堡实验室 (耶鲁大学公共卫生学院,康涅狄格州纽黑文)
安达信实验室 (斯克里普斯研究所,加利福尼亚州拉霍拉)
NIH支持:国家过敏和传染病研究所; 国家转化科学促进中心
发布时间: 新闻
标签: 巴西 , 加勒比海的 , 基孔肯亚 , 古巴 , 登革热 , 流行病学 , 基因组 , 基因组测序 , 全球卫生 , 蚊子 , 蚊虫控制 , 蚊媒疾病 , 旅行 , 病毒性流行病 , 病毒 , 齐卡 , 寨卡病毒
发布时间: 2019年1月2日 通过 弗朗西斯·柯林斯博士
祝大家新年快乐! 当我们许多人忙于包装礼物时,杂志 科学类 宣布了2018年备受期待的科学突破。 如果你错过了公告[1],这是生物医学科学又一辉煌的一年。
2018年的年度突破在于生物医学科学及其在不同模式生物中跟踪生命一细胞发展的能力。 这种新发现的能力为我们提供了机会,可以比以往任何时候都更系统地了解生命的生物学基础。 其中 科学 “初创”突破,一半以上与生物医学科学和NIH支持的研究有密切联系。
听起来很有趣吗? 让我们仔细看看2018年进行的一些令人惊叹的科学,首先是 科学 年度突破。
每个细胞的发育 几千年来,生物学家一直想知道单个细胞是如何发育成完整的多细胞生物的,比如青蛙或老鼠。 但是,如果没有必要的工具来系统地、一次一个细胞地研究发展,解决这个谜团几乎是不可能的。 在过去的十年里,这种情况终于开始改变。 我强调了其中一些问题的出现 功能强大的工具 在我的博客上以及它们被应用的有趣方式 研究开发 .
在过去的几年里,所有这些技术进步都达到了顶点。 研究人员(其中许多人是NIH资助的)使用复杂的细胞标记技术、核酸测序和计算策略,从发育中的生物体中分离出数千个细胞,对其遗传物质进行排序,并确定其在发育中生物体中的位置。
仅在2018年,就发表了开创性的单细胞分析论文,连续追踪了20多种细胞类型,这些细胞类型来自于受精的斑马鱼卵,青蛙器官的早期形成,甚至是Axolotl蝾螈新肢体的形成。 这只是令人惊讶的发现的开始,这些发现将有助于我们了解人类发展中的步骤,有时甚至是错误的步骤,并提出防止错误的最佳方法。 事实上,目前正在努力逐细胞获取人体的详细信息,包括国际人类细胞图谱和NIH支持的 人类生物分子地图集项目 .
RNA药物进入诊所 二十年前,研究人员安德鲁·费尔(Andrew Fire)和克雷格·梅洛(Craig Mello)表明,某些小的非编码RNA分子可以通过一种称为RNA干扰(RNAi)的过程选择性地阻止我们细胞中的基因“开启”。 这项工作,这些NIH受赠人获得了 2006年诺贝尔生理学或医学奖 由于各种非编码RNA分子具有沉默致病基因表达的潜力,很快引发了对其的商业兴趣。
经过艰苦的努力,第一种RNA基因药物终于问世 上市 2018年。 它被称为Onpattro™(patisiran),该药物使用RNAi治疗外周神经疾病,这种疾病可以使成年人患上一种罕见的疾病,即遗传性甲状旁腺素介导的淀粉样变。 这种坚持不懈的成功可能会推动这类新型生物药物的进一步发展,以潜在的更高精确度治疗各种疾病,从癌症到心血管疾病。
快速化学结构测定 :去年10月,两个研究小组几乎同时发表论文,描述了一种快速得令人难以置信的新成像技术,用于确定较小有机化合物的结构, 或原子分辨率的“小分子”。小分子是分子生物学、药理学和药物开发的重要组成部分。事实上,我们目前的大多数药物都是小分子。
这些论文的新闻让许多研究人员兴奋不已,我强调 其中一个 在我的博客上。 它描述了一种称为微晶电子衍射(MicroED)的技术。 它使这些NIH支持的研究人员能够在不到半个小时的时间内获得粉末状的小分子(孕酮就是一个例子),并生成关于其化学结构的高分辨率数据! MicroED的简便和快速不仅可以彻底改变研究人员研究各种疾病过程的方式,还可以帮助确定大量小分子中哪些可以成为成功的治疗方法。
细胞如何整理其内容 :大约十年前,研究人员发现,我们细胞中的许多蛋白质,特别是在受到压力时,会凝结成局限的水滴。 这种所谓的相分离允许蛋白质以更高的浓度聚集,并促进与其他蛋白质的反应。 国家卫生研究院很快开始支持几个研究小组的开创性工作,以探索相分离对细胞生物学的影响。
在过去的几年里,相分离的研究已经开始。研究表明,这种现象在划分细胞内的化学反应时至关重要,而无需划分膜。 仅在2018年,就发表了几篇主要论文,研究进展已经表明,相分离不仅是细胞的基本组织原理,也是生物学最近的主要突破之一。
法医谱系学成熟 :去年四月,加利福尼亚州萨克拉门托市警方宣布,他们逮捕了一名嫌疑人,这名嫌疑人参与了长达十年的追捕臭名昭著的金州杀手的行动。 尽管这条消息令人兴奋,但他们如何抓到被控凶手更令人感兴趣。 警方掌握了金门杀手的DNA,但他们无法确定他的身份,也就是说,直到他们发现了他的一位亲属上传到公共家谱数据库的DNA档案。
虽然法医家谱学有点超出我们的任务范围,但NIH帮助推动了家族史的收集,并利用DNA研究家谱。 事实上,我的博客介绍了NIH支持的工作,这些工作在 众包600年人类历史 .
研究人员在得到许可的情况下,使用了8600万家谱爱好者的在线个人资料,收集了500多万家谱。 最大的一次共有1300多万人! 通过合并众包数据和公共数据中的每棵树,他们可以追溯到15世纪和克里斯托弗·哥伦布时代的11代左右。 虽然他们可能还没有抓到一名被指控的凶手,但这些大型数据集对我们的家庭结构、基因和寿命提供了一些新的见解。
古代人类杂种 :每年,研究人员都会从西伯利亚偏远的杰尼索娃洞穴挖掘出数千块骨头碎片。其中一个这样的发现后来被称为杰尼索瓦11号,简称“丹尼”。
哦,丹尼的那块骨头讲述了一个多么引人入胜的基因组故事。 丹尼至少13岁,大约9万年前住在西伯利亚。 几年前,一个国际研究小组发现 线粒体DNA 丹尼的细胞中有一个尼安德特人,一个已经灭绝的人类亲戚。
2018年,丹尼的家谱变得更加有趣。 该团队公布的新数据显示,丹尼是女性,更重要的是,她是尼安德特人母亲和父亲的第一代混血儿,父亲属于另一个灭绝的人类亲戚杰尼索娃人。 顺便说一句,杰尼索娃人是第一批几乎完全基于基因组学的人类亲属。 他们大约在39万年前与尼安德特人分道扬镳。 直到大约40000年前,这两人还占领了欧亚大陆西部的尼安德特人和东部的杰尼索娃人。
丹尼独特的家谱使她成为有史以来发现的两个不同早期人类群体的第一个直系后代。 虽然NIH没有直接支持这项研究 尼安德特人基因组 提供了必要的资源。
尽管这些突破令人兴奋,但它们只是触及了生物医学研究进展的表面。 每一个科学领域都在产生引人注目的突破,这些突破充满了希望和改善数百万美国人生活的承诺。 因此,让我们从2019年开始,以更令人惊叹的科学结束这十年!
参考 :
[1] “ 2018年年度突破 ,“科学,2018年12月21日。
NIH支持:这些突破代表了多年来涉及许多研究人员的研究成果以及多个NIH研究所的支持。
发布时间: 新闻
标签: 2018年年度突破 , 安德鲁·法厄 , axolotl蝾螈 , 生物医药 , 细胞生物学 , 克雷格·梅洛 , 丹尼索娃 , 发育生物学 , 法医家谱 , 青蛙 , 基因组 , 遗传性甲状旁腺素介导淀粉样变 , 人类细胞图谱 , 微型ED , 尼安德特人 , 诺贝尔奖 , 非编码RNA , Onpatrro公司 , 帕提西兰 , 相分离 , 罕见疾病 , 核糖核酸 , RNA干扰 , RNA干扰 , 科学年度突破 , 单细胞分析 , 小分子 , 斑马鱼
发布时间: 2018年10月4日 通过 弗朗西斯·柯林斯博士
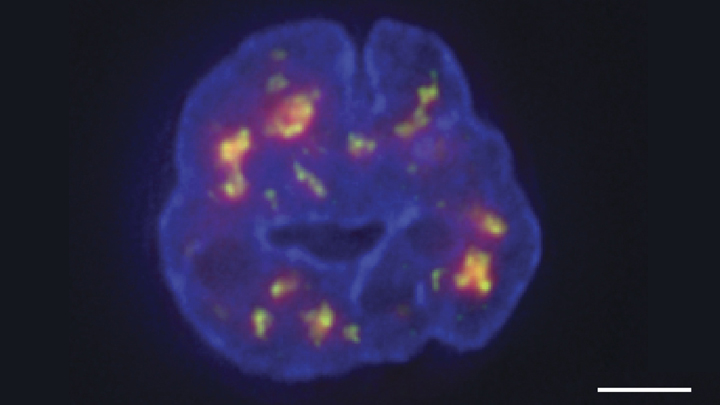
学分: Chen等人,2018年
近几年来,研究人员已经了解了很多关于六英尺多的人类DNA是如何被仔细包装进 微小的细胞核 测量值不到0.00024英寸。 在这些狭窄的条件下,我们已经越来越多地了解到DNA如何扭曲、旋转和在空间上定位细胞核内数千个基因,以及这种定位对健康和疾病意味着什么。
得益于NIH资助的研究团队开发的一项新技术,现在有了一种更精细的观点[1]。 上图展示了人类白血病细胞的细胞核(蓝色)。 弥漫的橙红色云层突出了化学标记的DNA,这些DNA是在靠近微小核斑点(绿色)的地方发现的。 你需要仔细观察才能看到细胞核斑点,但长期以来,细胞核中的这些结构标志一直被认为是重要细胞机制的储存场所。
发布时间: 生活快照
标签: 3D基因组图 , 细胞生物学 , 细胞核 , 染色质 , 染色体 , DNA , 基因组 , 基因组组织 , 核散斑体 , 圣地亚哥·拉蒙-卡哈尔 , 转录 , TSA-序列 , 酪胺
发布时间: 2017年6月6日 通过 弗朗西斯·柯林斯博士
由康涅狄格州纽黑文耶鲁大学医学院Keith Choate提供
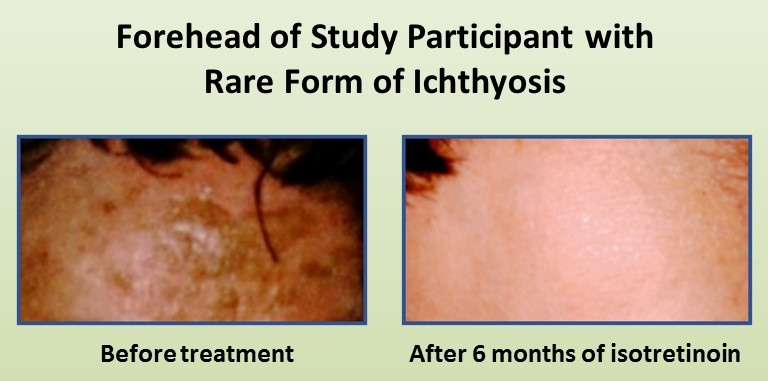
皮肤是人体最大的器官,然而我们常常想当然地认为它能使我们保持健康。 然而,那些患有一种罕见的鳞状皮肤疾病的人却并非如此,这种疾病被称为鱼鳞病,鱼鳞病是以希腊语中的鱼类“ichthys”命名的。
每年,全世界有16000多名婴儿出生时患有鱼鳞病[1],到目前为止,研究人员已经鉴定出50多个基因突变导致了各种类型和亚型的鱼鳞病。 现在,NIH资助的一个研究小组发现了另一种遗传原因,这对治疗有重要意义。 这一新发现暗示了一个基因的拼写错误,该基因编码一种酶,该酶在构建有助于保持皮肤湿润的神经酰胺脂肪分子中发挥着关键作用。 如果没有健康的神经酰胺,皮肤会形成干燥的鳞状斑块,使人们容易受到感染和其他健康问题的影响。
两名新出现鱼鳞病的患者接受了异维甲酸(Accutane)治疗,这是一种常见的痤疮处方药,发现他们的症状几乎完全消失。 总之,研究结果表明,异维甲酸的作用不仅在于促进皮肤细胞的快速更新,还在于刺激患者的皮肤促进神经酰胺的生成,尽管这是通过不同的生物途径实现的。
发布时间: 健康 , 科学类
标签: 异庚烷 , 痤疮药物 , 神经酰胺 , 皮肤病学 , 皮肤干燥 , 外显子 , 外显子组测序 , 遗传学 , 基因组 , 鱼鳞病 , 异维甲酸 , KDSR公司 , 鱼鳞病及相关皮肤疾病国家注册 , 进行性对称性红角化病 , PSEK公司 , 罕见疾病 , 皮肤 , 皮肤病 , 皮肤健康
发布时间: 2017年5月4日 通过 弗朗西斯·柯林斯博士
杰西·狄克逊
杰西·迪克森(Jesse Dixon)小时候经常在餐桌上听父母讨论如何进行实验和他们自己的研究实验室。 他的父亲杰克是一位国际知名的生物化学家,也是霍华德·休斯医学研究所的前副总裁兼首席科学官。 他的母亲克劳迪娅·肯特·狄克逊(Claudia Kent Dixon)现已退休,在研究作为细胞膜构建块的脂质分子方面做了开创性的工作。
因此,当杰西·狄克逊开始追求事业时,他追随父母的脚步,选择了科学。 但是,加利福尼亚州拉霍亚市索尔克研究所的研究员迪克森通过研究基因组学,以了解染色体结构为重点,绘制了一条不同的研究路线。 Dixon现在获得了2016年美国国立卫生研究院院长早期独立奖,该奖项旨在研究基因组的三维结构,以及基因组结构的变化如何导致癌症等疾病,甚至导致人与人之间的身体差异。
发布时间: 健康 , 科学类
标签: 2016年NIH董事早期独立奖 , 3D基因组结构 , 染色质 , 染色质结构 , CRISPR公司 , CRISPR/案例9 , DNA , DNA包装 , 编码器 , DNA元素百科全书 , 增强剂 , 基因编辑 , 基因组 , 基因组学 , 组蛋白 , TAD公司 , 拓扑关联域
发布时间: 2017年4月6日 通过 弗朗西斯·柯林斯博士
基思·马格特
为了更多地了解DNA和遗传是如何工作的,基思·马格特(Keith Maggert)在近30年的研究生涯中,花了大量时间研究DNA基因组内部发生的变化,以及DNA基因组的细微变化。这就是稳定的酶为DNA添加化学标记的地方, 打开或关闭单个基因,而不改变其基本序列。 Maggert真正感兴趣的是,这些“表观遗传”修饰是通过细胞分裂来维持的,甚至可以在许多代中从父母传给孩子。 和许多研究人员一样,他想知道它是如何发生的。
马格特认为这个故事比科学家们意识到的还要多。 他现在是图森市亚利桑那大学医学院的副教授,他怀疑细胞核中一种叫做核仁的显著亚细胞结构也具有强大的表观遗传效应。 Maggert提出,核仁的不同之处在于它不会逐个影响基因,这是当前表观遗传学研究的重点。 他认为,在某些情况下,它的表观遗传效应可以激活许多先前沉默或“关闭”的基因,使细胞和个人走上不同的健康或疾病之路。
马格特获得了2016年美国国立卫生研究院院长变革研究奖,以追求这一潜在的新范式。 如果正确,它将改变该领域的当前思维,并提供一个令人兴奋的新视角来追踪表观遗传学及其对广泛人类疾病的贡献,包括癌症、心血管疾病和神经退行性疾病。
发布时间: 健康 , 科学类
标签: 2016年NIH主任变革研究奖 , 心血管疾病 , 细胞生物学 , 细胞分裂 , 细胞应激 , DNA , 黑腹果蝇 , 表观遗传修饰 , 表观遗传沉默 , 表观遗传理论 , 表观遗传学 , 眼睛颜色 , 果蝇 , 基因组 , 基因组学 , 继承 , 神经退行性病变 , 核仁 , 核糖体DNA , 核糖体 , 亚细胞组织
下一页