1 Singh A、Tetreault L、Kalsi-Ryan S、Nouri A、Fehlings MG。外伤性脊髓损伤的全球流行率和发病率。临床流行病学2014;6:309-31.
2 Musubire AK、Meya DB、Bohjanen PR、Katabira ET、Barasukana P等。撒哈拉以南非洲非创伤性脊髓损伤的系统综述和资源有限环境下的诊断算法。前Neurol2017;8:618.
三。 Hagen EM、Rekand T、Gilhus NE、Grönning M。外伤性脊髓损伤——发病率、机制和病程。Tidsskr Nor Laegeforen公司2012;132:831-7.
4 van Middendorp JJ、Goss B、Urquhart S、Atresh S、Williams RP等。创伤性脊髓损伤的诊断和预后。全球脊柱J2011;1:1-8。
5 Simon F,Oberhuber A。脊髓缺血和再灌注损伤:检测缺血后截瘫的实验策略。神经再生研究2016;11:414-5.
6 Marsala M、Sorkin LS、Yaksh TL。大鼠短暂脊髓缺血:脊髓血流特征、细胞外氨基酸释放和并发组织病理学损伤。大脑血流代谢杂志1994;14:604-14.
7 Alizadeh A、Dyck SM、Karimi-Abdolrezaee S。外伤性脊髓损伤:病理生理学、模型和急性损伤机制概述。前Neurol2019;10:282.
8 Hassannejad Z、Shakouri-Motlagh A、Mokhatab M、Zadegan SA、Sharif-Alhoseini M等。动物实验中创伤脊髓损伤后的少突胶质细胞生成和轴突再生:系统综述。神经科学2019;402:37-50.
9 Carlson SL、Parrish ME、Springer JE、Doty K、Dossett L。撞击伤后脊髓的急性炎症反应。实验神经学1998;151:77-88.
10 李恩,梁国健。脊髓损伤中的少突胶质前体细胞:综述和更新。生物识别Res Int2015;2015:235195.
11 Arnold SA,Hagg T。脊髓损伤慢性期的抗炎治疗可改善成年小鼠的运动功能。神经创伤杂志2011;28:1995-2002.
12 Ray SK、Hogan EL、Banik NL。钙蛋白酶在脊髓损伤病理生理学中的作用:钙蛋白酶抑制剂的神经保护作用。Brain Res版本2003;42:169-85.
13 Ray SK、Samantaray S、Smith JA、Matzelle DD、Das A、Banik NL。急慢性脊髓损伤中半胱氨酸蛋白酶的抑制。神经治疗学2011;8:180-6.
14 Plemel JR、Keough MB、Duncan GJ、Sparling JS、Yong VW等。脊髓损伤后再髓鞘化:是修复的目标吗?神经生物学进展2014;117:54-72.
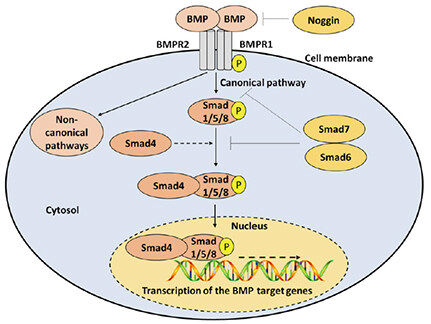
15 王润,格林J,王泽,邓Y,乔M,等。骨形态发生蛋白(BMP)信号在发育和人类疾病中的作用。基因疾病2014;1:87-105.
16 Enzmann GU、Benton RL、Woock JP、Howard RM、Tsoulfas P等。植入损伤脊髓的神经干、胶质细胞和神经元前体细胞表达noggin的后果。实验神经学2005;195:293-304.
17 Horbelt D、Denkis A、Knaus P。转化生长因子β超家族信号:背景问题。国际生物化学杂志-细胞生物学2012;44分469-74秒。
18 赫尔丁·CH,穆斯塔卡斯·A。Smads在TGFβ信号传导中的作用。细胞组织研究2012;347:21-36.
19 Imamura T、Takase M、Nishihara A、Oeda E、Hanai J等。Smad6抑制TGF-β超家族的信号传导。自然1997年;389:622-6.
20 Hanyu A、Ishidou Y、Ebisawa T、Shimanuki T、Imamura T等。Smad7的N结构域对于特异性抑制转化生长因子-β信号传导至关重要。J细胞生物学2001;155:1017-27.
21 Hata A、Lagna G、Massague J、Hemmati-Brivanlou A。Smad6通过与Smad4肿瘤抑制因子特异性竞争抑制BMP/Smad1信号传导。基因开发1998;12:186-97.
22 Zimmerman LB,De Jesús-Escobar JM,Harland RM。Spemann组织者信号noggin结合并使骨形态发生蛋白4失活。单元格1996;86:599-606.
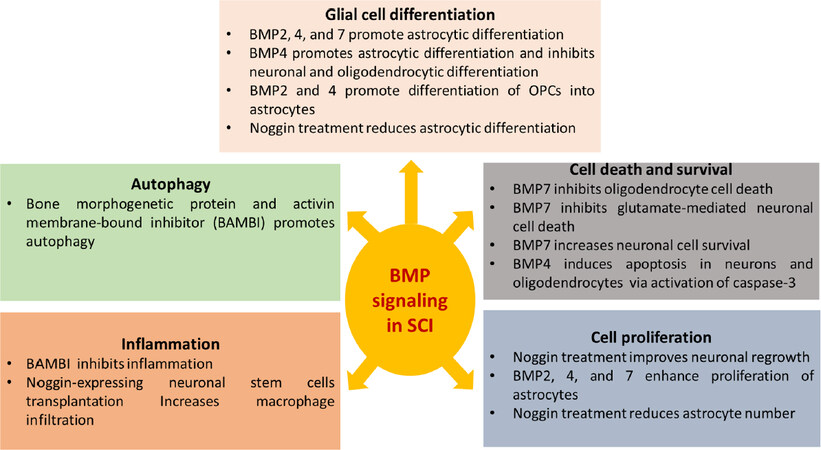
23 松浦一世、谷口J、Hata K、Saeki N、Yamashita T。BMP抑制可促进脊髓损伤后轴突生长和功能恢复。神经化学杂志2008;105:1471-9。
24 de Rivero Vaccari JP、Marcillo A、Nonner D、Dietrich WD、Keane RW。脊髓损伤后骨形态发生蛋白7(BMP7)治疗的神经保护作用。神经科学快报2009;465:226-9.
25 Song P,Xia X,Han T,Fang H,Wang Y,等。骨髓间充质干细胞通过BMP/Smad信号通路介导Id2和Olig表达,促进神经干细胞分化为少突胶质细胞。Biosci代表2018;38:英国标准20180303。
26 Sahni V、Mukhopadhyay A、Tyseling V、Hebert A、Birch D等。BMPR1a和BMPR1b信号传导对脊髓损伤后的胶质增生症具有相反的作用。神经科学2010;30:1839-55.
27 Setoguchi T、Yone K、Matsuoka E、Takenouchi H、Nakashima K等。成年大鼠脊髓创伤诱导的BMP7表达。脑研究2001;921:219-25.
28 Chen J、Leong SY、Schachner M。成年小鼠脊髓受压损伤后神经元和胶质细胞中细胞命运决定因子的差异表达。欧洲神经学杂志2005;22:1895-906.
29 Cui ZS,Zhao P,Jia CX,Liu HJ,Qi R,等。BMP-2/4在脊髓损伤中的局部表达和作用。基因分子研究2015;14:9109-17.
30 Kim JH、Lee YW、Park YM、Park KA、Park SH等。完全横断性脊髓损伤后胍丁胺诱导的胶原瘢痕区伴随表面翻正反射恢复。脊椎(Phila Pa 1976)2011;36:2130-8.
31 Park YM、Lee WT、Bokara KK、Seo SK、Park SH等。胍丁胺通过调节神经元和胶质细胞中BMP-2/4/7的表达对脊髓损伤后功能恢复的多方面影响。公共科学图书馆一号2013;8:e53911。
32 Dmitriev AE、Farhang S、Lehman RA、Ling GS、Symes AJ。用于脊髓损伤脊柱融合的骨形态发生蛋白-2鞘内穿透并引发功能性信号级联。脊椎J2010;10:16-25.
33 Ahmed S、Gull A、Khuro T、Aqil M、Sultana Y。胶质细胞:各种中枢神经系统疾病的细胞和药物治疗的潜在靶点。当前药物设计2017;23:2389-99.
34 Okada S、Hara M、Kobayakawa K、Matsumoto Y、Nakashima Y。脊髓损伤后星形胶质细胞反应性和星形胶质细胞增生。神经科学研究2018;126:39-43.
35 王浩,宋庚,庄浩,邱C,阿卜杜勒马库德A,等。神经系统疾病中胶质瘢痕的肖像。国际免疫病理药理学杂志2018;31:2058738418801406.
36 Wang Y,Cheng X,He Q,Zheng Y,Kim DH,等。挫伤脊髓的星形胶质细胞通过增加骨形态发生蛋白的表达抑制成年少突胶质前体细胞的少突胶质细胞分化。神经科学2011;31:6053-8。
37 Xiao Q,Du Y,Wu W,Yip HK。骨形态发生蛋白介导细胞反应,并与诺金一起调节脊髓损伤后星形胶质细胞的分化。实验神经学2010;221:353-66.
38 Setoguchi T、Nakashima K、Takizawa T、Yanagisawa M、Ochiai W等。通过移植表达BMP抑制剂的胎儿神经前体细胞治疗脊髓损伤。实验神经学2004;189:33-44.
39 北HA、Pan L、McGuire TL、Brooker S、Kessler JA。β1-整合素改变室管膜干细胞BMP受体定位并减轻脊髓损伤后的星形胶质细胞增生。神经科学2015;35:3725-33.
40 吕洪志,王玉霞,邹杰,李毅,傅斯林,等。神经前体细胞源性少突胶质前体细胞移植到正常和损伤脊髓后的分化。区别2010;80:228-40.
41 Karimi-Abdolrezaee S,Billakanti R。脊髓损伤后的反应性星形胶质细胞增生症——有益和有害影响。摩尔神经生物醇2012;46:251-64.
42 Parikh P,Hao Y,Hosseikhani M,Patil SB,Huntley GW等。通过激活成年神经元中的骨形态发生蛋白/Smad1信号通路来再生损伤脊髓中的轴突。美国国家科学院程序2011;108页:E99-107。
43 Glick D、Barth S、Macleod KF。自噬:细胞和分子机制。病理学杂志2010;221:3-12.
44 莱文B、克罗默G。自噬在疾病发病机制中的作用。单元格2008;132:27-42.
45 张XJ、陈S、黄克星、乐WD。为什么要评估自噬通量?中国药理学报2013;34:595-9。
46 Wong YC,Holzbaur EL。神经退行性变中的自噬体动力学一目了然。细胞科学杂志2015;128:1259-67.
47 Liu S、Sarkar C、Dinizo M、Faden AI、Koh EY等。脊髓损伤后的自噬中断与内质网应激和神经细胞死亡相关。细胞死亡病2015;6:e1582。
48 Saraswat Ohri S、Bankston AN、Mullins SA、Liu Y、Andres KR等。阻断少突胶质细胞的自噬限制脊髓损伤后的功能恢复。神经科学2018;38:5900-12.
49 周克力,陈德华,金HM,吴坤,王雪英,等。骨化三醇对大鼠实验性脊髓损伤的影响。脊髓2016;54:510-6.
50 张德,宣杰,郑碧波,周玉林,林毅,等。二甲双胍通过自噬流量刺激促进脊髓损伤后功能恢复。摩尔神经生物醇2017;54:3327-41.
51 Chen HC、Hsu PW、Tzaan WC、Lee AW。联合服用维生素C和E对实验性脊髓损伤后氧化应激状态和程序性细胞死亡途径的影响。脊髓2014;52:24-8.
52 Tramullas M、Lantero A、Díaz A、Morchón n、Merino D等。BAMBI(骨形态发生蛋白和激活素膜结合抑制剂)揭示了转化生长因子β家族参与疼痛调节。神经科学2010;30:1502-11.
53 Trivedi A、Olivas AD、Noble-Haeusslein LJ。炎症和脊髓损伤:浸润白细胞是损伤和修复过程的决定因素。临床神经科学研究2006;6:283-92.
54 杨勇,郭C,廖B,曹J,梁C,何X。在实验性脊髓损伤中,BAMBI通过激活自噬抑制炎症。国际分子医学杂志2017;39:423-29.
55 Almad A、Sahinkaya FR、McTigue DM。脊髓损伤后少突胶质细胞的命运。神经治疗学2011;8:262-73.
56 王X,徐JM,王YP,杨莉,李振杰。BMP-7对肿瘤坏死因子α诱导少突胶质细胞凋亡的保护作用。国际神经科学发展杂志2016;53:10-17。
57 Hart CG、Dyck SM、Kataria H、Alizadeh A、Nagakannan P等。骨形态发生蛋白-4的急性上调调节内源性细胞反应并促进脊髓损伤中的细胞死亡。实验神经学2020;325:113163.