摘要
神经内分泌前列腺癌(NEPC)是去势抵抗前列腺癌(CRPC)的一种更具侵袭性的亚型。虽然PHF8可以促进前列腺癌细胞增殖,但PHF8是否参与前列腺癌的发生和发展尚不清楚。通过比较有无转基因小鼠前列腺癌Phf8(第8页)基因敲除后,我们系统地研究了PHF8在前列腺癌发展中的作用。我们发现PHF8在腺癌的发生和发展中起着最小的作用。然而,PHF8对NEPC至关重要,因为PHF8不仅在NEPC中高表达,而且在无NEPC的动物中也高表达Phf8(第8页)未能开发NEPC。从机制上讲,PHF8转录通过去甲基化和去除细胞启动子区的抑制性组蛋白标记上调FOXA2FOXA2公司基因,上调的FOXA2随后调节NEPC发育相关基因的表达。由于PHF8和FOXA2在患者或患者衍生异种移植物的NEPC组织中高度表达,PHF8与FOXA2的水平可以单独或联合作为NEPC生物标记物,以PHF8或FOXA2为靶点可能是NEPC治疗的潜在治疗策略。©2020作者。病理学杂志由John Wiley&Sons,Ltd.代表大不列颠及爱尔兰病理学会出版。
关键词:前列腺癌、神经内分泌、PHF8、FOXA2、组蛋白、去甲基化酶、表观遗传、转录因子、TRAMP小鼠、组织芯片
介绍
神经内分泌前列腺癌(NEPC)是去势抵抗前列腺癌(CRPC)的一种更具侵袭性的亚型,因此NEPC患者的总体生存率极低[1]. 尽管NEPC仅占原发性前列腺癌的一小部分(0.5–2%)[2]雄激素剥夺疗法(ADT)等治疗,尤其是使用第二代抗雄激素药物苯扎鲁胺和阿比特龙,通常会诱导神经内分泌分化,导致高达30%的NEPC转移性去势抵抗肿瘤[三]. 与其他前列腺癌亚型相比,NEPC表达特异性神经内分泌标记物,包括突触素(SYP)、嗜铬粒蛋白A(CgA)和神经元特异性烯醇化酶(NSE),同时缺乏雄激素受体(AR)和前列腺特异性抗原(PSA)[4]. 由于对NEPC发展和进展中的分子机制了解有限,除了铂基化疗外,NEPC治疗的选择很少。
尽管NEPC细胞的起源仍存在争议,但NEPC的发育可能涉及不同的分子机制。先前的研究表明,NEPC可能起源于神经内分泌细胞[5]、癌症干细胞[6],p63阳性基底细胞[7]或通过反分化的CRPC腺癌细胞[8,9]尤其是在ADT的压力下[10,11]. 有令人信服的证据表明,RB1和p53等肿瘤抑制因子的缺失是神经内分泌谱系形成所必需的[12]. 此外,包括MYCN在内的几个转录因子[13],BRN2[14],福克斯2频道[15]、和ASCL1[16]以及表观遗传调控因子,如REST[17]和EZH2[18]与NEPC开发有关。值得注意的是,FOXA2是Forkhead盒转录因子FOXA家族的成员,被认为是小细胞NEPC的特异性标记物[19,20]. 此外,使用转基因小鼠前列腺癌(TRAMP)小鼠模型进行的研究结果表明,FOXA2与HIF1α共同作用,驱动NEPC发育所必需的转录程序[15]从而将FOXA2确立为NEPC的驱动因素。
PHF8(植物同源域指状内含蛋白8),也称为KDM7B,是一种组蛋白脱甲基酶。PHF8的N端植物同源结构域(PHD)负责识别/结合二甲基化和三甲基化组蛋白H3赖氨酸4(H3K4me2/3),这些组蛋白通常在转录起始位点富集,而其C端JmjC结构域具有组蛋白去甲基酶活性,催化H3K9me1/2中甲基的去除,H3K27me2和H4K20me1[21]. PHF8与促进包括前列腺癌在内的多种恶性肿瘤有关[22],食管癌[23],和肺癌[24]. 我们之前使用了一个基于前列腺癌细胞系的模型来证明PHF8作为AR辅活化因子可以促进CRPC的进展[25]. 在本研究中,我们使用了建立良好的TRAMP小鼠模型Phf8(第8页)敲除以证明PHF8的关键作用和PHF8介导的NEPC发育的潜在分子机制。
材料和方法
动物和实验程序
所有涉及动物的实验均按照国际法(EEC理事会指令86/609,OJ L 358)进行。1987年12月12日;《实验动物的护理和使用指南》,美国国家研究委员会,1996年),并由陆军医科大学动物护理和使用委员会批准。转基因TRAMP(转基因小鼠前列腺腺癌,C57BL/6)和Phf8(第8页)5~6周龄的敲除小鼠取自南京大学(中国江苏南京)模型动物研究中心。这些动物被安置在陆军医科大学大坪医院实验动物中心(中国重庆)。通过交叉口Phf8(第8页)敲除雌性小鼠(Phf8(第8页)
X−/−)TRAMP雄性小鼠,Phf8(第8页)敲除TRAMP小鼠(Phf8(第8页)‐KO;TRAMP)。第12周处死小鼠(n个 = 每组5个),25(n个 = 每组5个),37(n个 = 每组8个),以及42个(n个 = 每组7人)。
组织学分析
从处死动物身上解剖前列腺,将其固定在10%福尔马林中24小时,然后石蜡包埋进行苏木精-伊红(h&E)染色。前列腺病变(包括NEPC)的组织学分析基本上如前所述[26]. 简而言之,使用光学显微镜(BX53;日本东京奥林巴斯)对载玻片进行观察并拍照,两位认证病理学家(QM和HX)根据以下规范对组织学特征进行双盲分类:(1)正常组织(NT);(2) 低级别PIN(前列腺上皮内瘤变,LGPIN);(3) 高档PIN(HGPIN);(4) 高分化腺癌;(5)未分化腺癌(UD‐腺癌,根据病理特征分类为NEPC病变:多形性、高核质比和腺分化缺失)。对于每个前列腺,以10倍放大率捕获十个随机场,并将其进一步分为四个象限。在每个象限中,使用最先进的组织学特征进行组织学分类。因此,确定了每个实验组中每个亚型病变的数量,并比较了不同实验组中不同亚型病变所占的百分比。
细胞系、试剂和患者衍生异种移植物(PDX)组织系
前列腺癌细胞系PC-3和LNCaP来自上海生物科学研究院细胞库(中国科学院上海),NE1.3细胞由李文良博士(休斯顿德克萨斯大学健康科学中心;MD Anderson癌症中心UT健康生物医学研究生院)。所有细胞均在经销商推荐的培养基中生长。PDX组织线(LTL-545和LTL-313HR)由Yuzhuo Wang教授(活肿瘤实验室,http://livingtomarlab.com/). 将标本皮下移植到NPG小鼠体内(北京维塔尔生物科技有限公司,中国北京)。将移植的肿瘤从处死的小鼠上切下,用10%福尔马林固定,石蜡包埋进行免疫染色和检测。
siRNA转染与shRNA感染
使用siRNA(中国广东省广州市瑞宝生物科技有限公司)瞬时敲除细胞中的PHF8,并以打乱的siRNA作为对照。针对菲律宾法郎如下所示:si菲律宾法郎‐1(CCGGAGAGATGCGAACCGTA和CAGCCTTAACATCGAGATGCA);硅菲律宾法郎‐2(TCGGCGAAACCAAGAGAGAGCAAA和CAGGTGATGAAGACGAATTT)。一般来说,siRNAs(150 n米)根据制造商的协议(Thermo Fisher,Waltham,MA,USA),使用Lipo2000将其转染到500万个细胞中,并在转染后48小时对细胞进行分析。为了提高敲除效率,将四个各自的特异性siRNA合并用于转染。为了通过使用shRNA感染稳定击倒,菲律宾法郎shRNA(靶向序列:GCTCTTTCCAGAAAGCAAAGT)被克隆到pYr‐LVsh‐EGFP‐Puro载体(长沙盈润生物技术有限公司,中国湖南省长沙市)中。PC‐3、LNCaP和NE1.3细胞感染EV(空载体作为对照)或菲律宾法郎shRNA慢病毒和嘌呤霉素用于筛选感染细胞。
体内肿瘤发生测定
PC-3电池(1×107每50μl)含(sh菲律宾法郎)或无(EV)感染菲律宾法郎shRNA与Matrigel(1:1)混合,然后皮下注射到6至7周龄裸鼠的侧翼。每2天记录肿瘤的大小,并使用长度×宽度公式计算体积2/2.由于pYr‐LVsh‐Puro载体包含EGFP序列以及来源于EV和sh的异种移植瘤,因此使用全身荧光评估最终肿瘤大小第8页可使用全身荧光成像系统检测PC-3细胞(Maestro体内成像系统;美国马萨诸塞州沃尔瑟姆市PerkinElmer)。将移植的肿瘤解剖、称重,用10%福尔马林固定,石蜡包埋进行免疫染色检查。评估肺转移、EV和sh的差异菲律宾法郎PC-3电池(3×106每50μl)注射到6至7周龄裸鼠的尾静脉中,并让肿瘤生长19天,然后处死小鼠。肺被解剖,用PBS冲洗,石蜡包埋切片。
患者和组织样本
所有涉及人类参与者的程序都是按照机构研究委员会的道德标准以及1964年《赫尔辛基宣言》及其后来的修正案或类似的道德标准进行的。所有患者样本均由病理科采集,并经陆军医科大学大坪医院研究伦理委员会批准,并获得每位患者的书面知情同意书。为了评估PHF8在ADT诱导的NED中的作用,从我们的数据库中专门选择了7名患者作为队列。所有这些患者在前列腺穿刺活检后均接受ADT和阿比特龙、恩扎鲁胺或多西紫杉醇治疗,治疗后确定NEPC或NE区域。这些患者的临床信息见补充材料表S1(第一阶段)为了确定腺癌、CRPC-Adeno和NEPC组织中PHF8和FOXA2的水平,前文描述了一种腺癌组织微阵列(TMA)[27],一个由王玉卓教授善意提供的PDX组织微阵列,以及另外六个CRPC-腺组织(补充材料,表S2系列)使用我们队列中的上述七种NEPC或NED组织。总共包括59例腺癌患者、13例CRPC-Adeno患者和10例NEPC或NED患者。
免疫组织化学染色
将嵌入标本切片,安装在玻璃载玻片上,然后按照前面所述进行免疫染色[27]. 抗AR的一级抗体(ab108347,1:200;Abcam,Cambridge,MA,USA)、PSA(sc‐7316,1:50;Santa Cruz Biotechnology,Dallas,TX,USA,TX)、SYP(17785‐1‐AP,1:400;Proteintech,Rosemont,IL,USA;CD56(14255‐1AP,1:1600;Proteitech)、CgA(60135‐1g,1:600;Protientech)、PHF8(ab36068,1:200,Abcam)、Large‐T(554149,1:100;使用了BD,Lake Franklin,NJ,USA)和FOXA2(sc374376,1:50;Santa Cruz Biotechnology)。如前所述对染色强度进行评分[28]由认证病理学家(QM和HX)进行,并使用光学显微镜进行成像(BX53;日本东京奥林巴斯)。
免疫荧光染色
在福尔马林固定的石蜡包埋切片上进行CK5和CK18或PHF8和FOXA2的免疫荧光染色。将切片与针对CK5(ab52635,兔,Abcam,1:400)、CK18(66187‐1‐lg,小鼠,Proteintech,1:200)、PHF8(ab36068,兔,Abcam,1:200)和FOXA2(sc374376,小鼠,Santa Cruz Biotechnology,1:50)的一级抗体孵育。用于检测的二级抗体是与Alexa Fluor 488(1:200;中国北京中山金桥生物科技有限公司)结合的山羊抗兔抗体和与Alexa-Fluor 594(1:200,中山金桥生技有限公司)接合的山羊抗鼠抗体。在37°C下用DAPI对切片进行15分钟的复染(KGA215;KeyGenBioTECH,中国江苏省南京市),并使用共焦显微镜(LSM700;Zeiss,Oberkochen,德国)获得图像。
细胞数估计
PC-3、LNCaP和NE1.3细胞感染或不感染菲律宾法郎shRNA和/或FOXA2公司将质粒接种到96孔板中。在指定的时间点,使用细胞计数试剂盒-8(CCK-8)分析评估细胞数量。简而言之,抽吸培养基并用PBS冲洗细胞,然后在37°C下应用CCK‐8试剂(10μl/孔)2小时。采用分光光度法测量450 nm处的吸光度(Bio‐Rad,Hercules,CA,USA)。
克隆测定
PC‐3细胞感染或不感染菲律宾法郎将有或无PHF8过度表达的shRNA和LNCaP细胞接种在每孔1000(PC-3)或2000(LNCaP)细胞的六孔板中,按指示处理,并在37°C下培养14天,每7天更换一次培养基。实验结束时,用甲醇固定细胞,用结晶紫染色,并计算菌落数。
Transwell分析
评估细胞迁移和侵袭在体外,我们使用了24孔Transwell腔室,有或没有Matrigel。有或无PC-3和LNCaP电池菲律宾法郎将shRNA胰蛋白酶化并以5×10的密度接种到顶室4每孔200μl Dulbecco改良Eagle培养基中的细胞数。底部腔室含有800μl培养基(10%胎牛血清)。在37°C下孵育24小时(PC-3)或48小时(LNCaP)后,用棉签小心地清除附着在膜顶部的细胞,而用10%福尔马林固定底部室中的细胞,并在室温下用结晶紫染色3分钟并计数。
伤口愈合分析
带有或不带有shRNA的PC-3细胞菲律宾法郎接种到六孔板中并培养24小时。使用无菌10μl移液管尖端在融合细胞单层中划痕,用PBS冲洗细胞一次,然后在无血清培养基中培养细胞。用倒置显微镜(CK40F200;奥林巴斯)在不同时间点(0、24和48小时)拍摄划痕图像。
荧光素酶检测
12孔板中的细胞转染1μgFOXA2公司‐Luc矢量,100 ng雷尼利亚荧光素酶载体及其质粒表达菲律宾法郎,使用脂多糖胺。将转基因细胞培养48 h,并将细胞裂解液用于双荧光素酶分析(E1910;美国威斯康星州麦迪逊市普罗米加)。将10微升细胞裂解物装入96孔板中,并根据制造商的说明,使用Veritas Microplate光度计(美国马萨诸塞州沃尔瑟姆的Thermo Fisher)测量荧光素酶活性。雷尼利亚荧光素酶活性用于使转染效率正常化。
免疫印迹
通过SDS‐PAGE分离细胞裂解物,然后进行免疫印迹分析,如前所述[27,28]具有PHF8抗体(ab36068,1:1000;Abcam,美国马萨诸塞州剑桥市)、SYP抗体(17785‐1‐AP,1:2000;Proteintech,美国伊利诺伊州罗斯蒙特市)、CgA抗体(60135‐1lg,1:600;Proteitech)、CD56抗体(14255‐1AP,1:200;Proteiotech)、FOXA2抗体(ab256493,1:1000,Abcam)和β-actin抗体(3700s,1:5000;Cell Signaling Technology,美国马萨州波士顿市)。
染色质免疫沉淀(ChIP)分析和定量聚合酶链反应(qPCR)
根据制造商的说明(53009;Active Motif,Carlsbad,CA,USA),使用磁性ChIP试剂盒进行ChIP分析。总之,细胞用1%甲醛固定;染色质通过酶消化破碎。抗PHF8(ab36068;Abcam)、H3K9me1(ab8896;Abcam)、H3 K9me2(ab1220;Abca姆)、H3+27me2(ab24684;Abcam2)和H4K20me1(ab9051;Abcam-)的抗体用于免疫沉淀。洗涤和反向交联后,沉淀的DNA被纯化并通过qPCR扩增。提取的RNA被反转录成cDNA,并在iCycle系统(Bio-Rad,Hercules,CA,USA)中使用SYBR Green Master Mix(Invitrogen,Carlsbad,CA,US)进行qPCR。PCR数据使用GraphPad Prism(GraphPad-Software,San Diego,CA,USA)进行分析。所用PCR引物的序列列于补充材料表第3章.
RNA‐seq分析
从肿瘤组织中提取总RNA,所述肿瘤组织来源于Phf8(第8页)‐第37周使用Trizol试剂(Invitrogen)的KO TRAMP小鼠或对照TRAMP小鼠。RNA‐seq由上海NovelBio生物医药科技有限公司(中国上海)进行。每个样本包含来自每组三只小鼠的混合RNA,并与等量的RNA混合,以最小化样本之间的差异。利用HISAT2筛选RNA‐seq读取并映射到小鼠基因组(GRCm38,NCBI)[29]. HTSeq用于计算基因计数[30]. 利用DESeq2进行差异表达基因分析[31]根据以下标准:折叠变化>2或折叠变化<0.5;FDR<0.05。对来自Hallmark通路数据库的数据进行基因集富集分析(GSEA)[32]. 原始数据可以从GEO下载GSE157621标准(https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE157621).
统计分析
所有统计分析均使用SPSS 19.0(IBM,Amonk,NY,USA)。数据以平均值±标准偏差表示。如果数据遵循正态分布,则通过t吨‐测试或配对t吨‐测试或χ2通过单因素方差分析,然后采用最小显著性差异法进行均值比较,分析各组间的差异。对于不符合正态分布的数据,使用了非参数统计检验。采用Kendall秩相关分析对PHF8和FOXA2的表达进行相关性分析。一P(P)小于0.05的值被认为具有统计学意义。
结果
PHF8在NEPC发展中起重要作用,但不影响肿瘤的发生
这个Phf8(第8页)敲除雄性小鼠(博士8
−/年小鼠)按上述方法生成[33]. 与之前的观察结果一致Phf8(第8页)对大体形态表型或生育率没有影响(数据未显示)。此外,对25周龄、37周龄和53周龄对照组C57和Phf8(第8页)
−/年雄性小鼠表明Phf8(第8页)敲除并不影响前列腺的发育,这表明PHF8在生理条件下对前列腺的稳态不是必需的(补充材料,图S1(第一阶段)A–C)。CK5(基底细胞的标志物)和CK18(管腔上皮细胞的标志物)的双重免疫荧光染色进一步证实了这一观察结果(补充材料,图S1(第一阶段)D–F)。
TRAMP小鼠模型已被广泛用于前列腺癌研究,因为它密切反映了人类前列腺癌的发病机制。随着病毒SV40癌蛋白在前列腺上皮中的转基因表达,TRAMP小鼠在10-12周龄时产生PIN,在18-20周龄时形成侵袭性前列腺癌[34,35]. 在它们的一生中,大约20%的TRAMP小鼠发展为NEPC[5]. 为了研究PHF8在前列腺癌发生和发展中的潜在作用,我们将女性Phf8(第8页)基因敲除小鼠(Phf8(第8页)
X−/−)用雄性TRAMP小鼠获得雄性Phf8(第8页)敲除TRAMP小鼠(TRAMP/Phf8(第8页)‐KO)。然后我们比较了TRAMP中的前列腺病变/Phf8(第8页)‐第12、25和37周时,KO雄性小鼠和TRAMP雄性小鼠。前列腺病变分为正常、LGPIN或HGPIN、WD‐Adeno或UD‐Adeno,并按前述方法进行分析[36]. 同样根据之前的研究[26]我们将UD‐腺瘤归类为NEPC病变,因为我们的H&E染色显示UD‐)腺瘤病变中的细胞表现出NEPC样特征,包括多形性、高核质比和腺体分化缺失。图1A–C显示对照TRAMP和TRAMP前列腺病变的典型H&E染色/Phf8(第8页)分别在第12周、第25周和第37周对雄性小鼠进行KO,图1D至F显示每个阶段的相应病变状态。在两个TRAMP中均观察到LGPIN和HGPIN/Phf8(第8页)‐WT和TRAMP/Phf8(第8页)‐KO小鼠(n个 = 5) 第12周。25周时,两组均观察到腺癌病变(n个 = 5) 和37(n个 = 8) ,TRAMP略有增加/Phf8(第8页)‐科威特。有趣的是,虽然在一个TRAMP中发现了NEPC病变/Phf8(第8页)‐第25周(1/5)的WT小鼠和第37周(2/8)的两只TRAMP小鼠,没有TRAMP/Phf8(第8页)KO小鼠在同一时间段内出现NEPC损伤。即使在42周时,TRAMP中也未发现NEPC损伤/Phf8(第8页)‐KO小鼠(n个 = 7,数据未显示)。这些结果表明Phf8(第8页)特别阻止了NEPC的发展。为了进一步证实我们的H&E结果,我们对腺癌标记AR和NEPC标记SYP和CD56进行了免疫染色。AR阳性腺癌在对照组和Phf8(第8页)25周时敲除TRAMP小鼠(数据未显示)。然而,SYP和CD56阳性的NEPC仅见于TRAMP对照组,而在Phf8(第8页)‐第37周的KO小鼠(补充材料,图S2系列). 此外,在对照组小鼠中发现25周时有一只小鼠发生腹腔转移,37周时有三只小鼠发生九次转移(三次转移至肾脏,一次转移至肺部,两次转移至肝脏,两次移动至腹腔,一次移动至睾丸)。然而,未发现转移Phf8(第8页)同一时间段内的KO小鼠。与之前报告的结果一致[15],几乎所有的转移灶都是NE癌,AR染色缺失,SYP、CD56和CgA染色阳性(补充材料,图第3章A–G)。值得注意的是,转移性NE中PHF8的水平要高得多(补充材料,图第3章H) 。这些结果综合起来表明,PHF8在NEPC的发展中起着重要作用,但与腺癌的发生和发展关系不大。
图1。
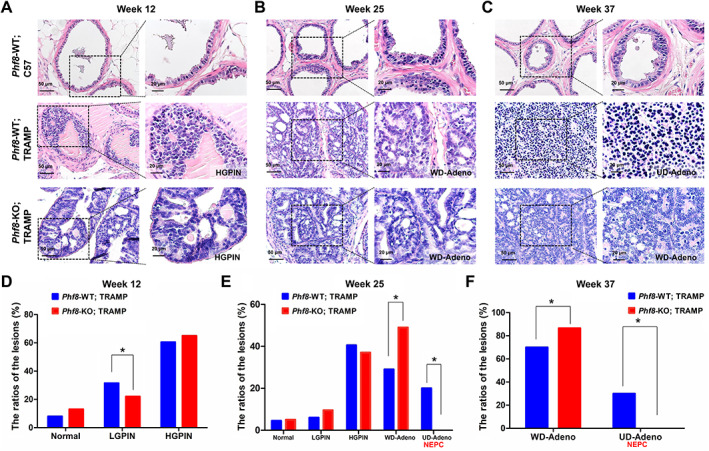
肿瘤发生Phf8(第8页)KO TRAMP小鼠。(A–C)第12周(A)、第25周(B)和第37周(C)小鼠前列腺病变的主要组织学分类。(D–F)统计结果(χ2试验)之间的组织学分析Phf8(第8页)‐重量和Phf8(第8页)‐第12周(D)、第25周(E)和第37周(F)时的KO TRAMP小鼠。
PHF8敲除削弱了NEPC特征
为了进一步研究PHF8对NEPC发育的影响,我们对来源于Phf8(第8页)‐KO和对照TRAMP小鼠(数据保存在GSE157621标准). 该分析确定了2092个差异表达基因(折叠变化>2,或折叠变化<0.5;FDR<0.05),TRAMP中623下降,1469上升/Phf8(第8页)‐KO小鼠(图2安培). 我们还比较了一组70个被视为NEPC标识符的基因中32个基因的表达[11]; 结果表明,肿瘤起源于Phf8(第8页)KO细胞更代表腺癌(图2B型). 使用AR信号特征“HALLMARK_ANDROGEN_RESPONSE”进行基因集富集分析(GSEA)的结果表明,PHF8的缺失影响AR信号通路(FDR)q个 = 0.043,图2摄氏度)年AR目标的变化证明了这一点Phf8(第8页)‐敲除肿瘤(图二维). 然后我们对常见的改变基因进行了生物信息学分析,这些基因在Phf8(第8页)使用Beltran发布的数据集,KO小鼠与对照TRAMP小鼠相比,NEPC患者中的表达显著上调等[11]. 值得注意的是,参与NEPC发展的两个重要转录因子ASCL1和FOXA2位列其中(图第二版). 与RNA‐seq结果一致,免疫染色显示FOXA2是NEPC发育的重要转录因子[15,19]在TRAMP衍生的肿瘤中显著减少/博士8‐KO小鼠(图2楼).
图2。
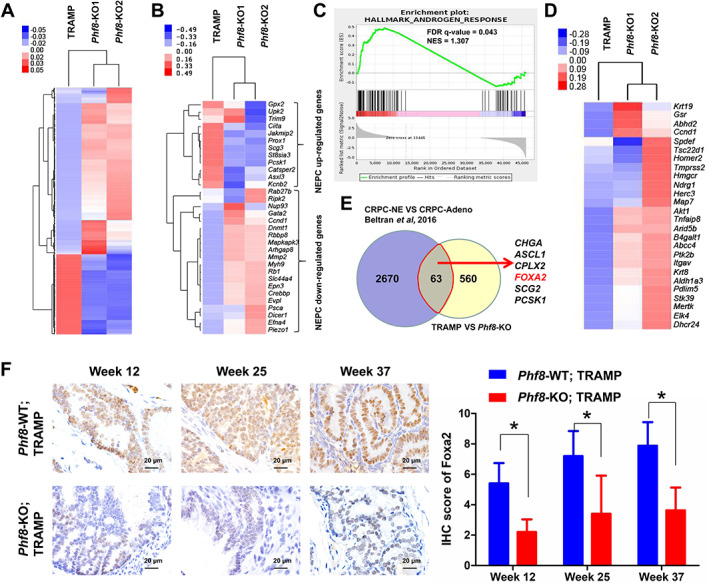
Phf8(第8页)敲除抑制NEPC特征。(A) 全球变化基因表达热图Phf8(第8页)‐KO TRAMP小鼠与对照TRAMP小鼠的比较。(B) Beltran揭示的集成70基因NEPC分类器中选定基因簇的热图等[11]在两组中。(C) 上述小鼠中HALLMARK_ANDROGEN_RESPONSE基因集的GSEA富集图。(D) 两组AR靶基因表达热图。(E) 维恩图显示了在Phf8(第8页)与对照TRAMP小鼠相比,KO小鼠,但通过使用Beltran在NEPC患者中显著上调等的已发布数据集[11]. (F) 前列腺样本中FOXA2的免疫染色Phf8(第8页)KO TRAMP小鼠和对照TRAMP小鼠(非参数试验)。
PHF8在NEPC细胞增殖和转移中的作用
考虑到包括神经母细胞瘤、NEPC、肺和膀胱小细胞癌在内的高级神经内分泌癌都更具侵袭性[37],我们想确定PHF8是否在NEPC的肿瘤生长和侵袭性中发挥任何作用。为此,我们使用AR阴性、NEPC样PC-3细胞中的特定小发夹RNA(shRNAs)敲除PHF8(约70%)(图3A、B). 图中的结果3C、D表示击倒菲律宾法郎抑制细胞增殖和集落形成。这些发现被进一步证实体内数据显示菲律宾法郎使用shRNA减小了大小(图第三方),体积(图第三层)和重量(图第三代移动通信)在裸鼠体内移植PC-3肿瘤。此外,Transwell和伤口愈合试验的结果表明,PHF8能够增强迁移和侵袭(图3H、I). 最后,我们向PC-3细胞注射(sh菲律宾法郎)或不带(EV)第8页敲除尾静脉并监测肺部肿瘤结节的数量和大小。当注射EV感染的PC-3细胞时,所有小鼠(10/10,100%)的肺部都出现了转移性结节。然而,6只注射了EV感染PC‐3细胞的小鼠(6/10,60%)的肺部不仅出现了较少而且较小的肿瘤结节菲律宾法郎(图3J型). 此外,在一个对照组中观察到一个肾肿瘤结节,但在注射了感染sh的PC‐3细胞的小鼠中没有观察到菲律宾法郎(图3公里). 这些数据也支持PHF8在NEPC细胞增殖、迁移和侵袭中发挥重要作用的观点。此外,我们还研究了PHF8对腺癌细胞系(LNCaP)的影响。我们发现增殖(补充材料,图S4系列B) ,入侵(补充材料,图S4系列C) 和迁移(补充材料,图S4系列D) 当PHF8被shRNA(补充材料,图S4系列A) ●●●●。相反,PHF8过度表达使LNCaP细胞对抗雄激素治疗(比卡鲁胺和恩扎鲁胺治疗,补充材料,图S4系列G、 H),伴有NSE表达增加(补充材料,图S4系列E、 F)。这些观察结果还表明,PHF8的功能不是细胞类型特异性的。
图3。
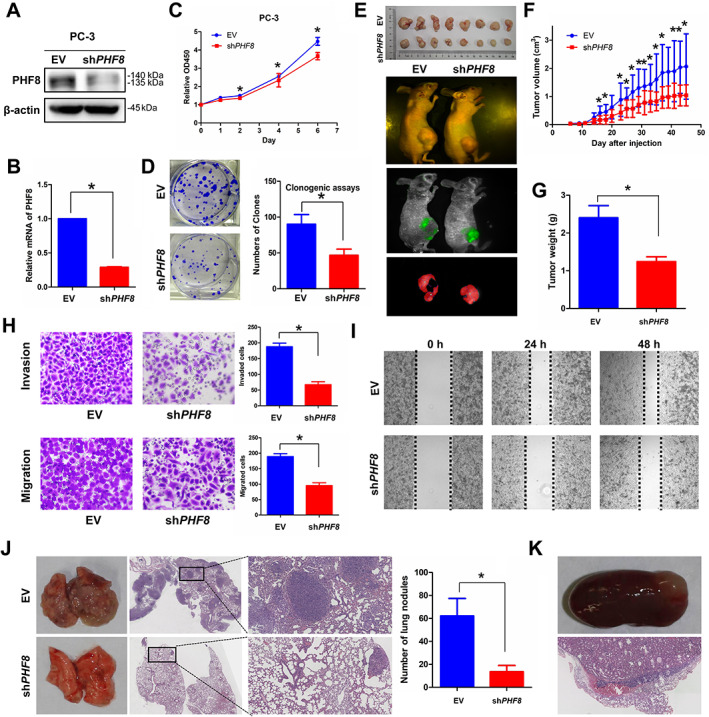
shRNA介导菲律宾法郎敲除抑制前列腺癌的增殖、侵袭和迁移。(A,B)PHF8的表达通过(A)免疫印迹和(B)RT-qPCR检测菲律宾法郎以空载体为对照,shRNA在PC-3中敲除。(C) 感染EV或sh的PC-3细胞菲律宾法郎在96孔板中播种,在第0天、第1天、第2天、第4天和第6天使用CCK‐8估计细胞数量。(D) 带或不带PC-3电池菲律宾法郎敲除(shRNA)接种在每孔1000个细胞的六孔板中。细胞用甲醇固定并用结晶紫染色。(E–G)携带EV小鼠的肿瘤大小‐和sh菲律宾法郎‐每2天记录一次感染的PC-3异种移植物(E),并在处死前使用全身荧光成像系统成像(F)。收集肿瘤并称重(G)。(H) 带或不带PC-3电池第8页将敲除(shRNA)接种在含有或不含有Matrigel的24孔Transwell室中,并培养24小时。估计细胞入侵和迁移。(一) 带或不带PC-3电池菲律宾法郎敲除(shRNA)接种在六孔板中,通过划痕愈合试验评估细胞迁移。带或不带(J,K)PC-3电池菲律宾法郎通过尾静脉注射敲除(shRNA),采集肺部(J)和肾脏(K),并对切片进行H&E染色。一t吨使用了试验。
PHF8通过转录上调FOXA2促进NEPC发育
为了研究PHF8调节NEPC发育的分子机制,我们首先检查了PHF8是否调节与NEPC发育相关的转录因子和调节因子的表达。为此,使用了两个具有NEPC表型的前列腺癌细胞系PC-3和NE1.3。当这些细胞用第8页特异性小干扰RNA(siRNAs),两者的mRNA水平菲律宾法郎和FOXA2公司而其他基因则没有显著下调(图4A、B类). 免疫印迹分析发现菲律宾法郎不仅显著下调了PHF8和FOXA2的水平,还导致NEPC标记物SYP、CD56和CgA的显著降低(图4C、D). 此外,免疫荧光分析显示,FOXA2和PHF8共同定位于细胞核中,并且在菲律宾法郎击倒细胞(图第四版). 与此一致的是,IHC染色还显示,在来源于shRNA介导的PC-3细胞的肿瘤中,FOXA2和NEPC标记物(SYP和CD56)减少菲律宾法郎击倒(图4英尺). 由于PHF8的敲除和过度表达下调和上调了FOXA2公司启动子调节荧光素酶活性(图4G,高),我们得出结论,PHF8转录调节FOXA2表达。更重要的是,染色质免疫沉淀试验表明菲律宾法郎击倒还降低了PHF8的占用率FOXA2公司启动子,在启动子区域同时增加抑制性组蛋白标记物H3K9me1、H3K9 me2、H3K27me2和H4K20me1FOXA2公司基因(图4I型),表明PHF8以脱甲基酶活性依赖的方式上调FOXA2的表达。最后,我们证明了在感染sh的PC-3和NE1.3细胞中过表达FOXA2第8页能够挽救NEPC标记SYP、CgA和CD56(图4J、K)以及菲律宾法郎击倒(图4升,M)表明PHF8主要或至少部分通过上调FOXA2促进NEPC的发展。
图4。
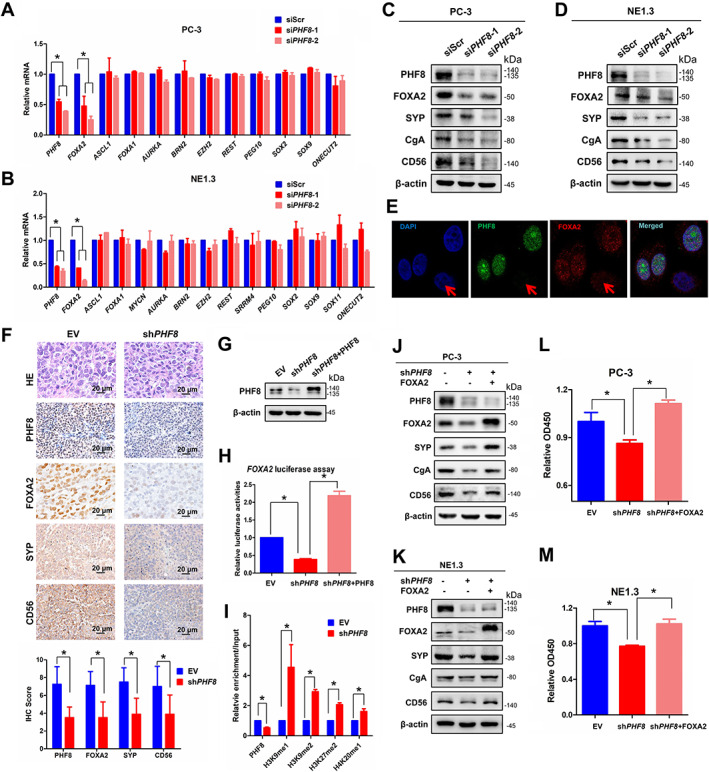
PHF8调节FOXA2的表达和转录。(A,B)NEPC发育过程中涉及的几个转录因子的mRNA水平在菲律宾法郎用干扰siRNA(siScr)作为(A)PC-3和(B)NE1.3细胞的对照,通过siRNA敲除(非参数测试)。(C,D)在siRNA介导后通过免疫印迹法检测FOXA2和NEPC标记(SYP和CD56)的表达第8页(si菲律宾法郎)敲除(C)PC-3和(D)NE1.3细胞。(E) 之后进行PHF8和FOXA2的双重免疫荧光染色分析菲律宾法郎使用siRNA敲除。红色箭头指示敲除细胞。(F) 在有或无PC-3细胞的异种移植中对FOXA2和NEPC标记物(SYP和CD56)的免疫染色菲律宾法郎击倒(shRNA)(非参数测试)。(G,H)PC‐3电池,带或不带菲律宾法郎敲除(shRNA)转染有FOXA2公司‐Luc构造和雷尼利亚荧光素酶载体和指示质粒。收集细胞裂解物以研究PHF8(G)的表达,并在48 h转染(h)后测量荧光素酶活性(非参数试验)。(一) 带或不带PC-3电池菲律宾法郎用PHF8、H3K9me1、H3K9me2、H3K17me2和H4K20me1抗体进行CHIP分析。免疫沉淀材料用于qPCR分析FOXA2公司(t吨‐测试)。(J,K)NEPC标记,包括SYP、CgA和CD56,当FOXA2在菲律宾法郎KD(shRNA)PC-3(J)和NE1.3(K)细胞。(L,M)CCK‐8分析用于研究FOXA2在细胞培养24小时后在菲律宾法郎KD(shRNA)PC-3(L)和NE1.3(M)细胞(非参数测试)。
PHF8和FOXA2可以作为NEPC的生物标志物
为了探讨PHF8在NEPC中的临床意义,我们首先分析了菲律宾法郎在可公开获取的大型数据库“癌症基因组图谱”(TCGA;http://www.cbioportal.org)发现NEPC队列中约30%的患者菲律宾法郎放大(图5A级),为NEPC中PHF8水平升高提供了分子解释。然后,我们比较了用阿比特龙、恩扎鲁胺或多西紫杉醇治疗前后收集的七个配对前列腺癌标本中PHF8和FOXA2的水平。值得注意的是,免疫染色显示,所有七个肿瘤在治疗前均为腺癌,AR和PSA染色均为阳性,SYP、CD56和CgA染色为阴性,而大多数肿瘤在ADT后AR和PSA-阴性,SYP-、CD56、CgA阳性(补充资料,图第5页A) ●●●●。代表性免疫染色(图5亿)和总结结果(图5C、D)显示ADT诱导的NEPC中PHF8和FOXA2水平升高。为了进一步证实这一观点,我们通过IHC比较了不同患者来源异种移植物(PDX)样本中PHF8和FOXA2的水平。为了避免任何实验变化,我们放置了NEPC型(以SYP、CD56和CgA染色阳性为特征,AR染色阴性为特征)PDX标本和腺癌型(以SYP、CD56、CgA着色阴性,AR染色阳性为特点;补充材料,图第5章B) 患者样本放在同一张玻片上,并用PHF8和FOXA2抗体进行免疫染色。补充材料,图第5章显示NEPC病灶中PHF8和FOXA2的水平均远高于腺癌。同样,当对NEPC PDX(LTL-545)和CRPC PDX组织(LTL-313HR,其特征是SYP、CD56和CgA染色阴性,AR染色阳性)进行类似实验时,NEPC中PHF8和FOXA2的水平也高于CRPC。最后,59例腺癌、13例CRPC-Adeno和10例NEPC或NED标本中PHF8和FOXA2染色的IHC评分表明PHF8的表达(图第五版)和FOXA2(图5楼)NEPC组织比腺癌(Adeno)和CRPC-Adeno组织高很多。这些发现与Beltran公共数据集中NEPC和CRPC样本中PHF8和FOXA2的表达一致等[11](补充材料,图S6系列A、 B)。此外,PHF8的表达与FOXA2的表达呈正相关(补充材料,图S6系列C) ●●●●。此外,我们研究了42例前列腺癌标本中PHF8和FOXA2的表达与病理分级(Gleason评分)的关系(补充资料,图S6系列D–H)。我们的结果显示,与低级别肿瘤(Gleason评分小于或等于7)相比,PHF8(补充材料,图S6系列D–F)和FOXA2(补充材料,图S6系列E–G)在Gleason评分较高的肿瘤中显著升高(>7)。更重要的是,相关性分析揭示了前列腺癌样本中PHF8和FOXA2水平之间的正相关性(补充材料,图S6系列H) 热图进一步证实了这一发现(补充材料,图S6系列一) 反映了PHF8和FOXA2水平及其表达与恶性程度的关系。由于NEPC中PHF8和FOXA2的水平较高且相互正相关,因此我们建议PHF8与FOXA2水平升高可以单独或联合作为NEPC的诊断生物标志物。
图5。
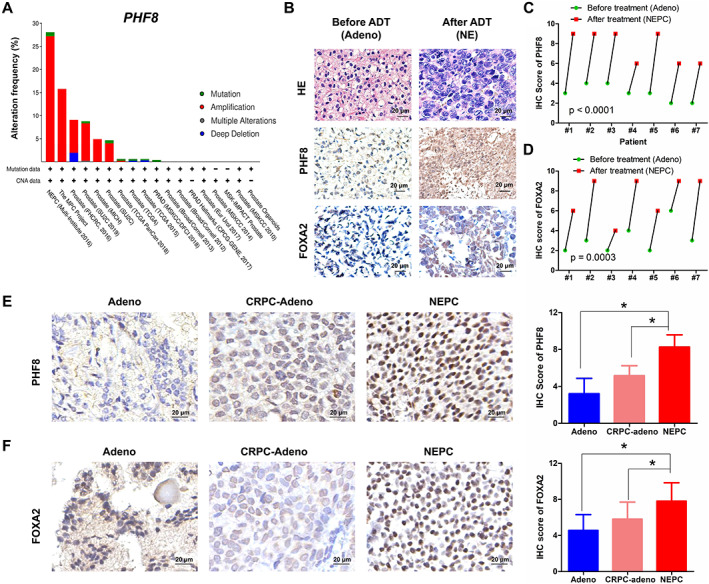
PHF8和FOXA2在腺癌和患者标本NEPC中的表达。(A) 的遗传变化菲律宾法郎来自BioPortal数据库的前列腺癌。(B) 对同一患者在ADT前后进行PHF8和FOXA2免疫染色。(C,D)B(配对)中(C)PHF8和(D)FOXA2的IHC得分统计结果t吨‐测试)。(E,F)腺癌、CRPC-Adeno和NEPC或NED样本中PHF8(E)和FOXA2(F)的免疫染色(非参数检验)。
讨论
我们目前的研究确定了前列腺癌中先前未知的PHF8/FOXA2轴及其在NEPC发展中的作用。自击倒后博士8PHF8对前列腺癌的发生和发展影响极小,但同时抑制了NEPC的发生和转移,我们得出结论,PHF8在NEPC的发展中起着独特的作用。基于PHF8通过去甲基化和去除FOXA2启动子区的抑制组蛋白标记来上调FOXA2转录FOXA2公司我们提出了一个工作模型来说明PHF8/FOXA2轴在NEPC发育中的作用(图6). 由于PHF8和FOXA2在NEPC细胞中均高表达,我们建议PHF8与FOXA2水平可以单独或联合作为NEPC生物标记物,以PHF8或FOXA2为靶点可能是NEPC治疗的潜在治疗策略。然而,PHF8和FOXA2在NEPC患者中的预后价值需要通过使用更大的样本队列进行进一步研究。
图6。
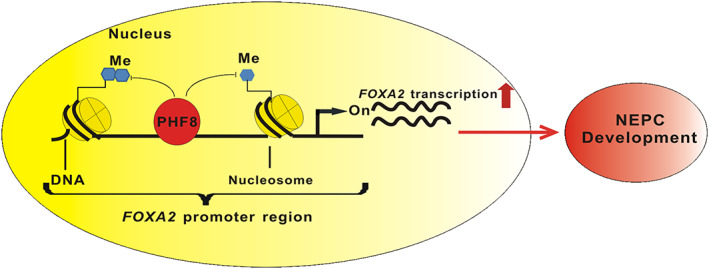
PHF8调节FOXA2和NEPC开发的拟议模型示意图。
NEPC的发展涉及多种因素,包括AURKA、MYCN、BRN2、SRRM4、REST、EZH2和FOXA2。例如,在NEPC中,AURKA和MYCN都得到了提升,它们共同促进NEPC的发展[13]. 已经证实AR抑制的BRN2可以在去势和苯扎鲁胺耐药前列腺癌模型中诱导神经内分泌分化[14]. RNA剪接因子SRRM4能够驱动腺癌细胞向NEPC进展,同时上调NEPC特异性生物标记物[38]. 另一方面,REST和EZH2都通过基因组的表观遗传修饰参与NEPC的进展[17,18]. 虽然FOXA2似乎参与了NEPC的发育,但其潜在的分子机制尚不清楚。通过使用不同的模型系统,包括组合Phf8(第8页)通过敲除和TRAMP小鼠模型、NEPC细胞系、NEPC-PDX和患者肿瘤组织,我们建立了PHF8/FOXA2轴并说明了其在NEPC发展中的作用。我们注意到,先前使用LNCaP细胞的研究结果表明,PHF8促进CRPC,但抑制神经内分泌分化[36]. 我们的发现与之前报道的结果之间的差异可能是使用了不同的细胞系和实验系统。在TRAMP模型系统中,PHF8在NEPC开发中发挥着不可或缺的作用,尽管它已经淘汰了Phf8(第8页)对腺癌的发展影响很小。因此,雄激素耗竭诱导LNCaP细胞NED的机制可能与TRAMP模型中NEPC发育的机制不同,进一步的研究将调和这些差异。TRAMP小鼠模型有一些固有的局限性,因为病毒抗原与人类前列腺癌没有天然联系,并且该模型会自发地发展出一些与人类NEPC不同的广泛神经内分泌肿瘤[5]. 然而,TRAMP模型仍然是研究NEPC进展的分子机制的有用手段,因为TRAMP小鼠中NEPC的形成部分是由于p53和RB1失活所致,而p53和RB1失活是人类前列腺癌NED期间发生的关键事件[12].
尽管我们证明了PHF8在NEPC开发中的关键作用,但仍有许多问题尚未解决。例如,PHF8表达的增加通过表观遗传学上调转录因子FOXA2来增强NEPC的发育,但PHF8上调的原因尚不清楚。最近有报道称,TRAMP小鼠的谱系追踪实验表明,NEPC可能来源于p63阳性的基底细胞,而不是先前存在的腺癌细胞[7]. 上调的PHF8是否与这些基底细胞有关尚不清楚。另一方面,Phf8(第8页)敲除完全抑制TRAMP小鼠NEPC的发育,而不影响C57小鼠CK5阳性基底细胞的发育;PHF8是否影响基底细胞的恶性转化有待进一步研究。此外,PHF8通过清除抑制性组蛋白标记上调FOXA2。目前尚不清楚PHF8是否直接或通过其他转录因子间接与染色体相互作用。使用GeneCards网站上的工具进行进一步分析(https://www.genecards.org/)提示转录因子TCF4和REST可能参与FOXA2的调控。也有报道称β-catenin被招募到TCF/LEF结合位点的启动子区FOXA2公司[39]我们的初步数据表明,PHF8可以与β-catenin复合(数据未显示)。此外,据报道,PHF8和REST可以共同占据相同的染色体区域。这些证据表明,PHF8可以通过与REST或β-catenin/TCF4络合,并随后清除启动子区的抑制组蛋白标记,从而上调FOXA2FOXA2公司基因。
总之,通过使用转基因和敲除小鼠,在体外细胞系,和体内我们揭示了表观遗传调节剂PHF8在NEPC发育中的关键作用,使PHF8成为致命NEPC的潜在治疗靶点。
作者贡献声明
JJ和JQ完全可以访问研究中的所有数据,并对数据的完整性和数据分析的准确性负责。JJ和JQ负责研究概念和设计。QL、JP、LAW、ZH、JX、XY、QX、YH、TT、GL和DT采集的数据。QL、JP、LAW、WL和LFW对数据进行了分析和解释。QL起草了手稿。JJ、JQ、DZ、WL和LFW批判性地修改了手稿中的重要知识内容。QL、GL和DT进行了统计分析。JJ和QL获得了资金。JJ和JQ监督了这项研究。
支持信息
补充图形图例
图S1。影响Phf8(第8页)敲除对C57小鼠前列腺发育的影响
图S2。腺癌标记物(AR)和NEPC标记物(SYP和CD56)以及PHF8和Large‐T的免疫染色Phf8(第8页)‐重量和Phf8(第8页)‐第37周的KO TRAMP小鼠
图S3。TRAMP小鼠转移病灶中腺癌标记物(AR)和NEPC标记物(SYP和CD56)以及PHF8和Large‐T的免疫染色
图S4。The effects of第8页抑制或过度表达LNCaP细胞的增殖、侵袭和迁移,以及对抗雄激素治疗的反应
图S5。患者样本和细胞系的免疫染色
图S6。表达式的比较(t吨‐测试)和Beltran公布数据集中PHF8和FOXA2的相关性(皮尔逊检验)等[11]
表S1。NEPC或NED患者的临床信息
表S2。CRPC-Adeno患者的临床信息
表S3。所用引物的序列
致谢
我们要感谢那些慷慨捐赠组织的患者,这些组织使这项研究成为可能。我们还感谢王玉卓教授提供PDX组织线和微阵列。本研究得到了国家自然科学基金项目[81772704和81972398(转JJ);81802558(转QL)]和陆军医科大学大学研究项目[2017XYY07和2018XLC1014(转JJ]的支持。
参与者信息
秦军,电子邮件:qinjun@sibs.ac.cn。
Jun Jiang,电子邮件:jiangjun_64@163.com。
工具书类
-
1Sella A、Konichezky M、Flex D、,等低PSA转移性雄激素非依赖性前列腺癌。欧洲泌尿学2000; 38:250–254.[内政部] [公共医学] [谷歌学者]
-
2Helpap B、Kollermann J、Oehler U。前列腺癌的神经内分泌分化:组织发生、生物学、临床相关性和未来治疗前景。Urol国际1999; 62:133–138.[内政部] [公共医学] [谷歌学者]
-
三。Beltran H、Tomlins S、Aparicio A、,等抗去势前列腺癌的侵袭性变体。临床癌症研究2014; 20:2846–2850.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
4Wang W,Epstein JI。前列腺小细胞癌。95例病例的形态学和免疫组织化学研究。病理学原版期刊2008; 32:65–71.[内政部] [公共医学] [谷歌学者]
-
5Chiaverotti T、Couto SS、Donjacour A、,等前列腺癌小鼠前列腺转基因腺癌模型中上皮癌和神经内分泌癌谱系的分离。美国病理学杂志2008; 172:236–246.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
6Palapattu GS、Wu C、Silvers CR、,等CD44,一种假定的前列腺癌干细胞标记物,在人类前列腺癌的神经内分泌肿瘤细胞中的选择性表达。前列腺2009; 69:787–798.[内政部] [公共医学] [谷歌学者]
-
7Lee DK、Liu Y、Liao L、,等神经内分泌前列腺癌细胞来源于p63表达的基底细胞,而不是小鼠体内预先存在的腺癌细胞。单元格Res2019; 29:420–422.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
8Stoyanova T、Cooper AR、Drake JM、,等起源于基底细胞的前列腺癌发展为由管腔样细胞繁殖的腺癌。美国国家科学院程序2013; 110:20111–20116.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
9Lee JK、Phillips JW、Smith BA、,等N‐Myc驱动由人类前列腺上皮细胞引发的神经内分泌前列腺癌。癌细胞2016; 29:536–547.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
10Lin D、Wyatt AW、Xue H、,等高保真患者源性异种移植物可加速前列腺癌的发现和药物开发。癌症研究2014; 74:1272–1283.[内政部] [公共医学] [谷歌学者]
-
11Beltran H、Prandi D、Mosquera JM、,等去势抵抗型神经内分泌前列腺癌的发散性克隆进化。自然·医学2016; 22:298–305.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
12Zhou Z、Flesken‐Nikitin A、Corney DC、,等转移性前列腺癌条件小鼠模型中p53和Rb缺乏的协同作用。癌症研究2006; 66:7889–7898.[内政部] [公共医学] [谷歌学者]
-
13Beltran H、Rickman DS、Park K、,等神经内分泌前列腺癌的分子特征和新药靶点的确定。癌症发现2011; 1:487–495.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
14主教JL、Thaper D、Vahid S、,等主神经转录因子BRN2是前列腺癌神经内分泌分化的雄激素受体抑制驱动因素。癌症发现2017; 7:54–71.[内政部] [公共医学] [谷歌学者]
-
15Qi J,Nakayama K,加的夫路,等HIF和FoxA2的Siah2依赖性协同活动调节神经内分泌表型和神经内分泌前列腺肿瘤的形成。癌细胞2010; 18:23–38.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
16Uysal‐Onganer P、Kawano Y、Caro M、,等Wnt‐11促进前列腺癌细胞的神经内分泌样分化、存活和迁移。摩尔癌症2010; 9:55[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
17Svensson C、Ceder J、Iglesias‐Gato D、,等REST介导雄激素受体对基因抑制的作用,并预测前列腺癌的早期复发。核酸研究2014; 42:999–1015.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
18Wee ZN、Li Z、Lee PL、,等EZH2介导的IFN‐γ‐JAK‐STAT1信号的失活是MYC驱动前列腺癌的有效治疗靶点。单元格代表2014; 8:204–216.[内政部] [公共医学] [谷歌学者]
-
19Mirosevich J、Gao N、Gupta A、,等Foxa蛋白在前列腺癌中的表达及作用。前列腺2006; 66:1013–1028.[内政部] [公共医学] [谷歌学者]
-
20Kim J、Jin H、Zhao JC、,等FOXA1抑制前列腺癌神经内分泌分化。癌基因2017; 36:4072–4080.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
21王Q、马S、宋恩、,等USP7稳定组蛋白去甲基化酶PHF8促进乳腺癌发生。临床研究杂志2016; 126:2205–2220.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
22比约克曼M、奥斯特林P、哈玛V、,等表观遗传酶的系统敲除鉴定出一种新的组蛋白去甲基化酶PHF8在前列腺癌中过度表达,对细胞增殖、迁移和侵袭产生影响。癌基因2012; 31:3444–3456.[内政部] [公共医学] [谷歌学者]
-
23孙X、邱JJ、朱S、,等食管鳞癌中PHF8组蛋白去甲基化酶的致癌特征。公共科学图书馆综合版2013; 8:e77353。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
24Shen Y,Pan X,Zhao H。组蛋白脱甲基酶PHF8是人类非小细胞肺癌的致癌蛋白。生物化学-生物物理研究委员会2014; 451:119–125.[内政部] [公共医学] [谷歌学者]
-
25.童丁、刘强、刘庚、,等HIF/PHF8/AR轴促进前列腺癌进展。肿瘤发生2016; 5:e283。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
26Monsef N、Helczynski L、Lundwall A、,等免疫反应性HIF-1α和HIF-2α在良性和恶性前列腺神经内分泌细胞中的定位。前列腺2007; 67:1219–1229.[内政部] [公共医学] [谷歌学者]
-
27刘强、童丁、刘庚、,等二甲双胍通过靶向肿瘤相关炎症浸润抑制前列腺癌进展。临床癌症研究2018; 24:5622–5634.[内政部] [公共医学] [谷歌学者]
-
28童丁、刘强、刘庚、,等二甲双胍通过抑制COX2/PGE2/STAT3轴抑制去势诱导的前列腺癌EMT。癌症快报2017; 389:23–32.[内政部] [公共医学] [谷歌学者]
-
29.Kim D,Langmead B,Salzberg SL.HISAT:一种具有低内存要求的快速拼接对准器。Nat方法2015; 12:357–360.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
30Anders S、Pyl PT、Huber W.HTSeq–一个用于处理高通量测序数据的Python框架。生物信息学2015; 31:166–169.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
31Anders S,Huber W.序列计数数据的差异表达分析。基因组生物学2010; 11:R106。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
32Balasubramaniam S、Comstock CE、Ertel A、,等异常的BAF57信号促进前转移表型。临床癌症研究2013; 19:2657–2667.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
33陈X、王S、周毅、,等Phf8组蛋白去甲基化酶缺陷通过mTOR途径导致认知损伤。国家公社2018; 9:114.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
34Greenberg NM、DeMayo F、Finegold MJ、,等转基因小鼠前列腺癌。美国国家科学院程序1995; 92:3439–3443.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
35.Gingrich JR、Barrios RJ、Foster BA、,等TRAMP模型中本地前列腺癌的病理进展。前列腺癌前列腺疾病1999; 2:70–75.[内政部] [公共医学] [谷歌学者]
-
36Kido LA、Montico F、Sauce R、,等TRAMP小鼠的抗炎治疗:延缓PCa进展。内分泌相关癌2016; 23:235–250.[内政部] [公共医学] [谷歌学者]
-
37Dardenne E、Beltran H、Benelli M、,等N‐Myc诱导EZH2介导的转录程序驱动神经内分泌前列腺癌。癌细胞2016; 30:563–577.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
38Li Y、Donmez N、Sahinalp C、,等SRRM4在雄激素受体途径抑制下驱动前列腺癌的神经内分泌转分化。欧洲泌尿学2017; 71:68–78.[内政部] [公共医学] [谷歌学者]
-
39Villacorte M、Suzuki K、Hirasawa A、,等β-连环蛋白信号调节子宫内膜增生形成过程中Foxa2的表达。癌基因2013; 32:3477–3482.[内政部] [公共医学] [谷歌学者]
关联数据
本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。
补充资料
补充图形图例
图S1。影响Phf8(第8页)敲除对C57小鼠前列腺发育的影响
图S2。腺癌标志物(AR)和NEPC标志物(SYP和CD56)以及PHF8和Large‐T的免疫染色博士8‐重量和Phf8(第8页)‐第37周的KO TRAMP小鼠
图S3。TRAMP小鼠转移病灶中腺癌标记物(AR)和NEPC标记物(SYP和CD56)以及PHF8和Large‐T的免疫染色
图S4。影响菲律宾法郎抑制或过度表达LNCaP细胞的增殖、侵袭和迁移,以及对抗雄激素治疗的反应
图S5。患者样本和细胞系的免疫染色
图S6。表达式的比较(t吨‐测试)和Beltran公布数据集中PHF8和FOXA2的相关性(皮尔逊检验)等[11]
表S1。NEPC或NED患者的临床信息
表S2。CRPC-Adeno患者的临床信息
表S3。所用引物的序列








