早期小鼠胚胎胚外和胚胎区中胚层迁移的不同表型
摘要
eLife摘要
介绍
结果
胚胎与胚外区域的中胚层迁移模式和细胞形状不同
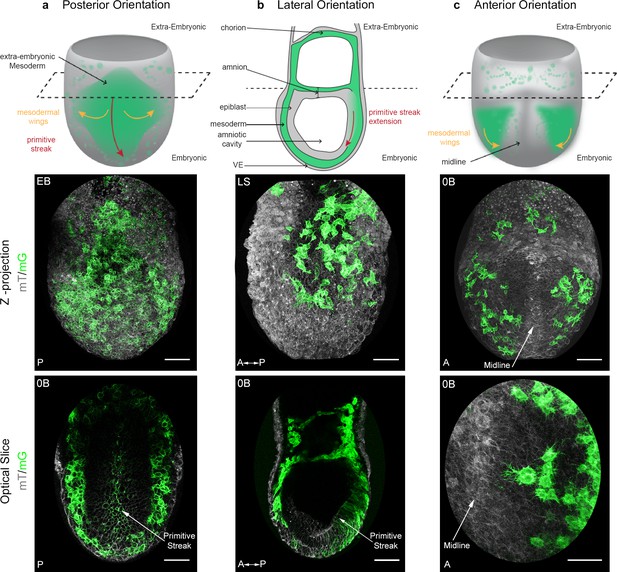
新生中胚层的镶嵌膜GFP标记允许通过胚胎活体成像跟踪单个细胞的迁移。
中胚层细胞向胚外和胚胎区域迁移。
“试错”轨迹。
跟踪中胚层迁移。
追踪中胚层的迁移。
跟踪胚胎和胚外中胚层的详细信息。
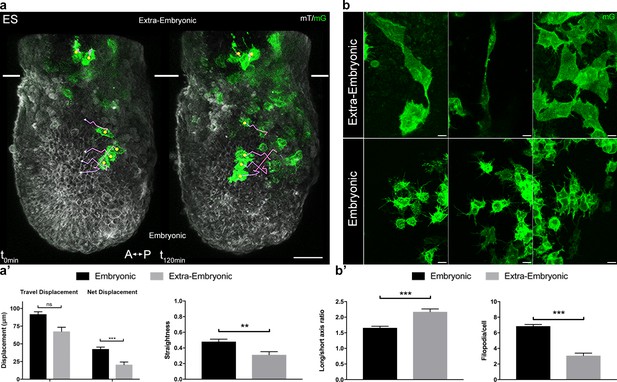
胚胎和胚外中胚层种群具有不同的形态和迁移模式。
-
图2-源数据1 胚胎和胚外中胚层细胞追踪:详细列出单个细胞追踪、体积和表面测量结果。 -
https://doi.org/10.7554/eLife.42434.012 -
图2-源数据2 胚胎和胚外中胚层形状测量。 -
https://doi.org/10.7554/eLife.42434.013 -
图2-源数据3 胚胎和胚外中胚层细胞丝状体:丝状体数量/细胞/时间点和丝状体长度测量。 -
https://doi.org/10.7554/eLife.42434.014
胚外中胚层迁移的特点是净位移低。
胚胎和胚外中胚层细胞形状、大小和丝状体的比较。
中胚层细胞根据与不同胚层的相互作用而具有不同的形态
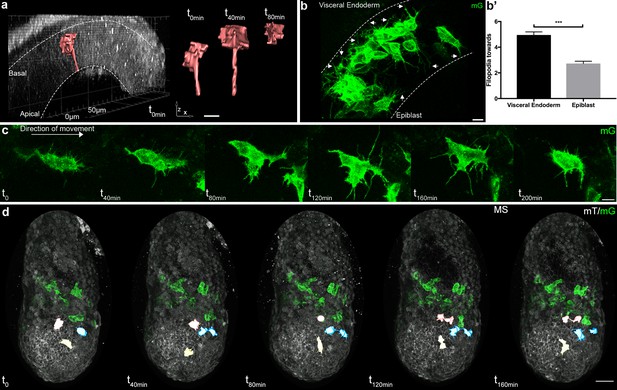
迁移中胚层的细胞形状变化。
-
图3-源数据1 中胚层细胞丝状体向内胚层和外胚层延伸。 -
https://doi.org/10.7554/eLife.42434.018 -
图3-源数据2 子细胞轨迹的量化。 -
https://doi.org/10.7554/eLife.42434.019 -
图3-源数据3 近距离细胞轨迹的量化。 -
https://doi.org/10.7554/eLife.42434.020 -
图3-来源数据4 碰撞后细胞轨迹的量化。 -
https://doi.org/10.7554/eLife.42434.021
中胚层向外胚层和内脏内胚层延伸丝状伪足。
搜索行为。
细胞间接触对中胚层内轨迹的影响
胚胎和胚外中胚层分子特征
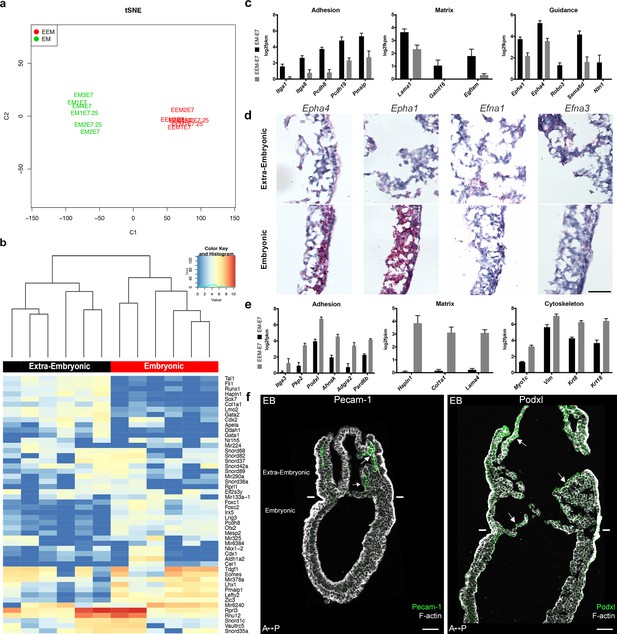
中胚层种群的转录组识别胚胎和胚外中胚层之间的差异。
-
图4——源数据1 用于RNA-seq的样品的描述和质量控制。 EM:胚胎中胚层; EEM:胚外中胚层。 -
https://doi.org/10.7554/eLife.42434.026 -
图4——源数据2 表达式级别。 包含使用rpkm-edgeR方法计算的log2 FPKM中的表达式级别的表。 -
https://doi.org/10.7554/eLife.42434.027 -
图4——源数据3 差分表达式的排名列表。 第1列:基因名称,第2列:log2 EM_E7.0和EEM_E7.0之间的折叠变化,第3列:log2EM_E7.25和EEM_E7.25之间的折叠改变,第4列:每百万次计数,第5列:F-test值,第6列:F-test值,第7列:F-stest FDR(Benjamini-Hochberg)。 -
https://doi.org/10.7554/eLife.42434.028
胚胎和胚外中胚层细胞具有不同的细胞骨架组成
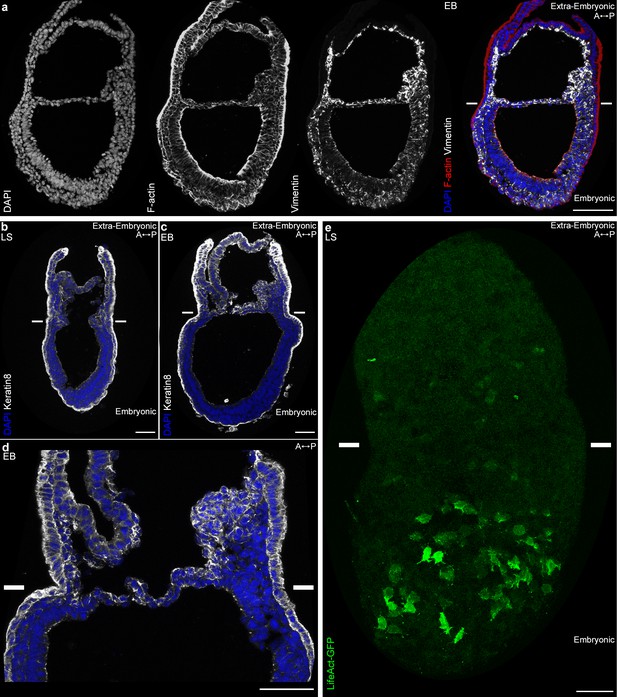
胚胎和胚外中胚层细胞具有不同的细胞骨架组成。
LifeAct-GFP在胚胎中胚层表达较高。
中胚层外植体。
罗亚 Δ中胚层 电子 xplant在细胞迁移之前经历了压实。
胚外中胚层迁移与Rho GTPases无关
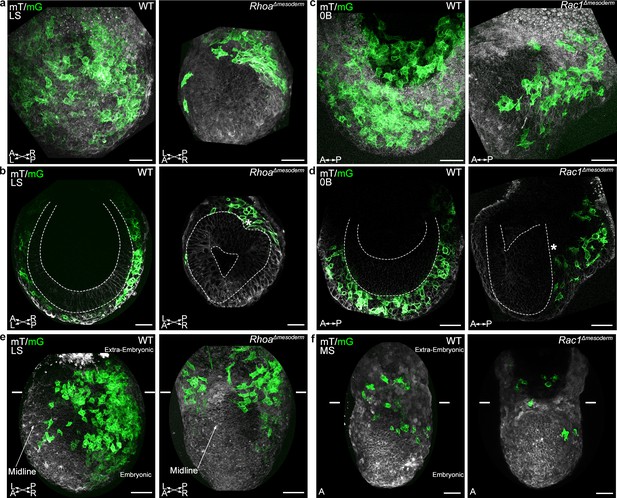
罗亚 和 种族1 中胚层特异性突变体显示胚胎中胚层迁移受损。
罗阿 Δ中胚层 胚胎在原始条纹附近有中胚层积累。
中胚层迁移跟踪 罗亚 Δ中胚层 胚胎。
中胚层迁徙追踪 罗亚 Δ中胚层 胚胎。
中胚层迁移跟踪 种族1 Δ中胚层 胚胎。
中胚层迁徙追踪 种族1 Δ 中胚层 胚胎。
讨论
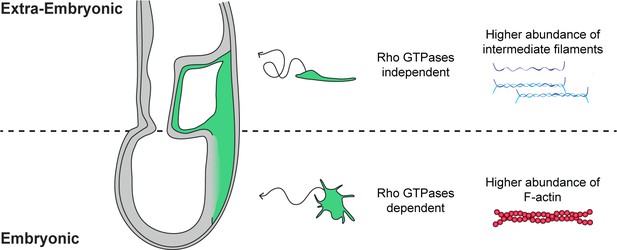
在小鼠胚胎原肠胚形成期间,胚胎和胚外中胚层细胞显示出不同的形状、轨迹、Rho-GTP酶依赖性和细胞骨架组成。
材料和方法
小鼠菌株和基因分型
胚胎培养和实时成像
抗体
胚胎分析
外植体培养和分析
图像分析
转录组分析
数据可用性
工具书类
-
原肠胚形成期间小鼠全胚胎的活体成像:外胚层和中胚层细胞的迁移分析 PLOS ONE系列 8 :e64506–e64512。 https://doi.org/10.1371/journal.pone.0064506
文章和作者信息
作者详细信息
基金
科学基金会-FNRS(PDR T008416)
伊莎贝尔·米吉奥特
Wallon卓越生命科学和生物技术(Welbio CR-2015S-02)
伊莎贝尔·米吉奥特
基金会擦除
伊莎贝尔·米吉奥特
伊拉斯穆斯·穆杜斯·菲尼克斯(研究生奖学金)
贝查拉·萨卡利
Fonds Alice et David van Buuren(研究生奖学金)
纳夫里塔·马蒂亚
Jaumotte-Demoulin基金会(研究生奖学金)
纳夫里塔·马蒂亚
Fonds De La Recherche Scientifique-FNRS(研究生奖学金)
贝查拉·萨卡利 纳夫里塔·马蒂亚
致谢
伦理学
版本历史记录
收到日期:2018年9月28日 接受日期:2019年3月11日 发布的记录版本: 2019年4月5日(第1版)
版权
韵律学
-
6,611 意见
-
650 下载
-
65 引用
下载链接
进一步阅读
-
发育生物学 结构生物学和分子生物物理学
受体酪氨酸激酶ROR2介导非经典WNT5A信号,以协调组织形态发生过程,该通路的功能障碍会导致罗比诺综合征、短趾B型和转移性疾病。 然而,ROR2功能所需的域和机制仍不清楚。 我们解决了ROR2胞外富含半胱氨酸(CRD)和Kringle(Kr)结构域的晶体结构,发现与其他CRD不同,ROR2 CRD缺乏结合脂质/脂质修饰蛋白质(如WNTs)的特征疏水囊,这表明了一种新的配体接受机制。 从功能上讲,我们表明ROR2 CRD(而非其他结构域)是促进WNT5A信号传导所必需的,并且至少足以促进WNT3A信号传导,CRD和邻近Kr中的Robinow突变会损害ROR2的分泌和功能。 此外,使用针对WNT受体Frizzled(FZ)家族的功能激活和干扰抗体,我们证明FZ参与WNT5A-ROR信号传导。 因此,ROR2通过其CRD作用于增强包括FZ在内的受体超复合物的功能,以转导WNT5A信号。 -
发育生物学 免疫学与炎症
心脏巨噬细胞在表型和功能上是异质的,这与它们的个体发育差异有关。 尽管进行了广泛的研究,但我们对不同巨噬细胞亚群在缺血/再灌注(I/R)损伤中的确切作用的理解仍然不完整。 我们在这里以CSF1R依赖性的方式研究了体内平衡和I/R损伤后巨噬细胞谱系和消融的组织巨噬细胞。 基因组中fms-内含子调控元件(FIRE)的缺失 Csf1r公司 该位点导致了特定的体内稳态和抗原呈递巨噬细胞的缺失,而不影响单核细胞衍生的巨噬细胞向梗死心脏的募集。 特定的稳态、单核细胞非依赖性巨噬细胞的缺失改变了免疫细胞对损伤的相互作用,并诱导炎性中性粒细胞极化,导致心脏重塑受损,但不影响梗死面积。 相反,持续的CSF1R抑制导致常驻和招募巨噬细胞群的耗竭。 I/R后的不良重塑加剧,导致梗死面积增加和心功能恶化。 总之,常驻巨噬细胞参与炎症反应,改善心脏重塑,而招募的巨噬细胞决定I/R损伤后的梗死面积。 这些发现对心肌梗死背景下不同巨噬细胞群具有不同的有益影响。






