ACE2公司
发布时间: 2022年2月1日 通过 劳伦斯·塔巴克博士。
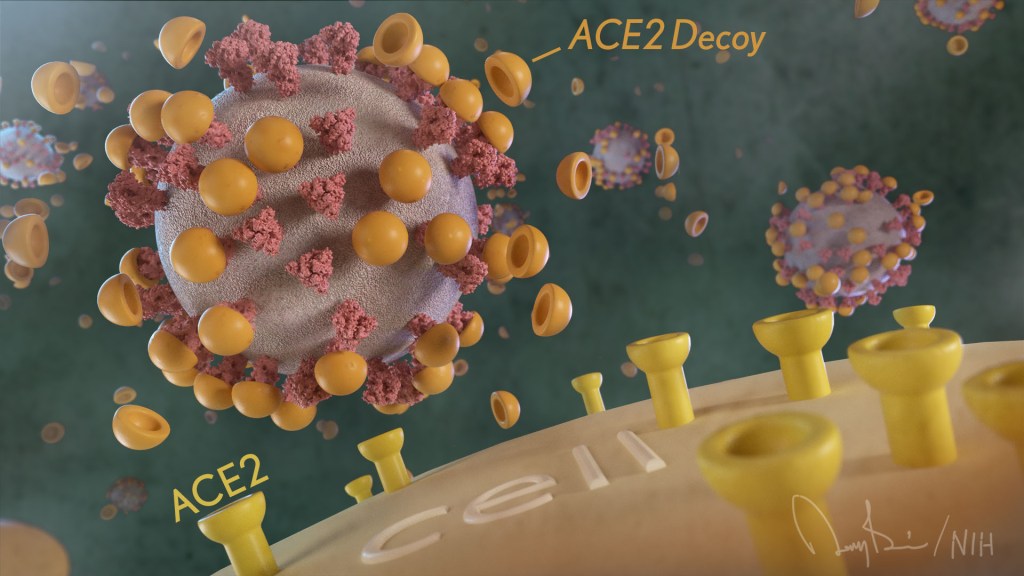
NIH继续支持开发一些非常创新的治疗方法,以控制SARS-CoV-2,这是导致新冠肺炎的冠状病毒。 一个创新的想法涉及一种分子诱饵来阻止冠状病毒。
怎么样? 诱饵是一种特殊设计的蛋白质颗粒,它模拟了 ACE2受体 ,一种位于细胞表面的蛋白质,病毒的尖峰蛋白与之结合是导致感染的第一步。
其想法是,当这些ACE2诱饵被用于治疗时,它们将粘附在冠状病毒的棘突蛋白上(见上图)。 SARS-CoV-2的尖刺被诱饵紧紧包裹,因此它能够与真正的ACE2结合并感染我们的细胞。
最近,研究人员在杂志上发表了他们的初步结果 自然化学生物学 早期数据看起来很有希望[1]。 他们在严重新型冠状病毒肺炎的小鼠模型中发现,静脉注射工程化的ACE2诱饵可预防肺部损伤和死亡。 虽然还需要更多的研究,但研究人员表示,诱饵疗法可能通过吸入器直接输送到肺部,单独使用或与其他新型冠状病毒治疗联合使用。
这一发现来自伊利诺伊大学芝加哥分校的一个研究小组,该小组由Asrar Malik和Jalees Rehman领导,与他们在伊利诺伊大学厄巴纳-香槟分校的同事密切合作。 研究人员对早期测试ACE2诱饵策略的临床试验产生了兴趣[2]。 然而,在早期的试验中,临床试验发现死亡率没有降低。 ACE2候选药物可溶并在体内降解,也被证明对中和病毒无效。
UIC团队没有放弃这个想法,而是决定尝试一下。 他们设计了一种新的可溶性ACE2,从结构上来说,它可能比原来的更好地充当诱饵。 他们的ACE2版本包含蛋白质氨基酸构建块的三个变化,与SARS-CoV-2尖峰蛋白的结合更紧密。 在实验室中,它似乎也能中和病毒以及 单克隆抗体 用于治疗新冠肺炎。
为了进行测试,他们在老鼠身上进行了研究。 正常小鼠不会因严重急性呼吸系统综合征冠状病毒2型而生病,因为病毒刺突不能很好地与小鼠版本的ACE2受体结合。 因此,研究人员在携带人类ACE2的小鼠身上进行了研究,结果发现,该小鼠出现了一种严重的急性呼吸综合征,与患有严重新型冠状病毒肺炎的人的症状有点相似。
在他们的研究中,使用来自华盛顿州的原始病毒分离物和首次在巴西检测到的伽玛变异体(P.1),他们发现注入治疗性ACE2蛋白的感染小鼠死亡率低得多,几乎没有严重急性呼吸综合征的迹象。 虽然该蛋白对两种病毒都有效,但感染更具攻击性的伽玛变异体需要更早的治疗。 经过治疗的老鼠也恢复了食欲和体重,表明它们正在恢复。
进一步的研究表明,诱饵结合到每一个测试变体的尖峰蛋白上,包括α、β、δ和Epsilon。 (Omicron在研究时还不可用。)事实上,与原始病毒相比,诱饵即使不能更好地结合到新的变体上,也同样有效。
研究人员将继续他们的临床前工作。如果一切顺利,他们希望将ACE2诱饵转移到临床试验中。 这种方法特别有希望的是,它可以与其他治疗方法结合使用,例如通过防止已经感染的病毒细胞生长或限制对感染的过度和破坏性免疫反应。
上周,美国17500多人因严重新型冠状病毒肺炎住院治疗。 我们必须继续尽我们所能挽救生命,这将需要许多创新的想法,如ACE2诱饵,使我们处于更好的地位,一劳永逸地战胜这种病毒。
工具书类 :
[1] 工程化ACE2诱饵减轻SARS-CoV-2变异体引起的肺损伤和死亡 . Zhang L、Dutta S、Xiong S、Chan M、Chan KK、Fan TM、Bailey KL、Lindeblad M、Cooper LM、Rong L、Gugliuzza AF、Shukla D、Procko E、Rehman J、Malik AB.Nat Chem Biol。 2022年1月19日。
[2] 重组人血管紧张素转换酶2(rhACE2)治疗新型冠状病毒肺炎(APN01-COVID-19)患者 ). 临床试验.gov。
链接 :
新冠肺炎研究 (国家卫生研究院)
加速新冠肺炎治疗干预和疫苗 (国家卫生研究院)
阿斯拉·马利克 (伊利诺伊大学芝加哥分校)
贾利斯·雷曼 (伊利诺伊大学芝加哥分校)
NIH支持:国家心脏、肺和血液研究所; 国家过敏和传染病研究所
发布时间: 新闻
标签: ACE2公司 , ACE2诱饵 , 阿尔法变体 , Beta变体 , 冠状病毒 , 新冠肺炎 , 新冠肺炎治疗 , 诱饵 , Delta变量 , 药物开发 , Epsilon变体 , 伽马变量 , 肺 , 老鼠 , 小鼠研究 , 新型冠状病毒 , 大流行 , SARS-CoV-2型 , 严重急性呼吸综合征 , 穗蛋白
发布时间: 2022年1月18日 通过 劳伦斯·塔巴克博士。
描述:冠状病毒冠状病毒SARS-CoV-2的尖峰蛋白(蓝色),是导致新型冠状病毒肺炎的病毒。 一旦病毒进入人体,尖峰蛋白就会被糖修饰,糖会附着在它的一些氨基酸上,形成O-聚糖。 关键O-聚糖的丢失可能会促进病毒向人类细胞的传播。 资料来源:美国国立卫生研究院国家过敏和传染病研究所 自从加入NIH以来,我担任过许多不同的领导职务。 但谢天谢地,有一个职位对我来说一直保持不变:实验室主任。 我在NIH的国家牙科和颅面研究所(NIDCR)经营自己的研究实验室。
我的实验室研究一种叫做O-糖基化的生化过程。 这是生活的基础,也是学习的乐趣。 我们的细胞经常被各种碳水化合物糖所修饰。 O-糖基化是指在细胞表面发现或分泌的糖分子被添加到蛋白质中的生化过程。 某些蛋白质上这些糖的存在或缺失在正常组织发育和一线人类免疫中起着基本作用。 它还与各种疾病有关,包括癌症。
我们的实验室最近加入了由我的NIDCR同事Kelly Ten Hagen领导的NIH科学家团队,以证明O-糖基化如何影响SARS-CoV-2(导致新型冠状病毒肺炎的冠状病毒)及其与细胞融合的能力,这是感染它们的关键一步。 事实上,我们的数据发表在杂志上 美国国家科学院院刊 ,表明一些变体似乎已经变异,以利用该过程发挥其优势[1]。
这项工作建立在病毒依赖棘突蛋白的基础上,棘突蛋白是病毒外表面的冠层,可以附着在人类细胞上。 一旦到达那里,刺突蛋白就必须被激活以融合并引发感染。 当我们自己的细胞产生的酶对刺突蛋白进行一系列切割或裂解时,就会发生这种情况。
第一次切割来自一种叫做呋喃的酶。我们和其他人早先有证据表明,O-糖基化可以影响呋喃切割的方式。 这让我们思考:O-糖基化会影响呋喃和尖峰蛋白之间的相互作用吗? 病毒尖峰的呋喃裂解区确实用糖装饰,糖的存在或缺失可能会影响呋喃激活尖峰。
我们还注意到,α和δ变异体携带一个突变,可以去除特定位置的氨基酸脯氨酸。 这很有趣,因为我们从早期的工作中了解到,GALNT酶(负责向蛋白质中添加大量糖分子)更喜欢靠近O-糖基化位点的脯氨酸。
它还表明,新变体中脯氨酸的丢失可能意味着O-糖基化降低,这可能会影响呋喃裂解的程度和SARS-CoV-2进入细胞的能力。 我应该注意的是,最近的Omicron变异体在当前的研究中没有进行检查。
在对果蝇和哺乳动物细胞进行详细研究后,我们在原始SARS-CoV-2病毒中证明,穗蛋白的O-糖基化减少了呋喃裂解。 进一步的实验表明,GALNT1酶向刺突蛋白添加糖,这种添加限制了弗林进行所需切割和激活刺突蛋白的能力。
重要的是,在α和δ变异体中发现的尖峰蛋白变化降低了GALNT1活性,使呋喃更容易开始其激活切割。 这表明GALNT1对病毒尖峰的糖基化可能限制对原始病毒的感染,并且α和δ变异至少部分地克服了这种影响,从而可能使病毒更具传染性。
基于这些研究,我们的团队在健康志愿者的呼吸道中寻找GALNT1的证据。 我们发现这种酶确实在这些细胞中大量表达。 有趣的是,这些细胞也表达 ACE2受体 SARS-CoV-2依赖于其感染人类细胞。
这里还值得注意的是,Omicron变异体携带着与我们在Alpha和Delta中研究的相同的尖峰突变。 Omicron还有另一个附近的变化,可能会进一步改变O-糖基化和furin对尖峰蛋白的裂解。Ten Hagen实验室正在研究这些线索,以了解Omicrons的这个区域如何影响尖峰糖基化,并最终影响这种毁灭性病毒感染人类细胞和传播的能力。
参考 :
[1] SARS-CoV-2尖峰的呋喃裂解受O-糖基化调控 .Zhang L、Mann M、Syed Z、Reynolds HM、Tian E、Samara NL、Zeldin DC、Tabak LA、Ten Hagen KG。PNAS。 2021年11月23日; 118(47).
链接 :
新冠肺炎研究 (国家卫生研究院)
凯利·腾·哈根 (国家牙科和颅面研究所/NIH)
劳伦斯·塔巴克 (NIDCR)
NIH支持:国家牙科和颅面研究所
发布时间: 新闻
标签: ACE2公司 , 阿尔法 , 阿尔法变体 , 生物化学 , 癌症 , 冠状病毒 , 新冠肺炎 , 新冠肺炎感染 , Delta变量 , 呋喃 , GALNT1公司 , 豁免权 , 传染性 , 新型冠状病毒 , O-糖基化 , Omicron变体 , 大流行 , SARS-CoV-2型 , 穗蛋白
发布时间: 2021年12月14日 通过 弗朗西斯·柯林斯博士
信贷:改编自辉瑞 , 2021年12月8日 引起新冠肺炎的冠状病毒SARS-CoV-2的新Omicron变种备受关注。 一个主要原因是Omicron已经积累了50多个突变,包括在 穗蛋白 是冠状病毒的一部分,mRNA疫苗教会我们的免疫系统攻击。 所有这些基因变化都增加了Omicron可能导致已经接受辉瑞或Moderna mRNA疫苗的人发生突破性感染的可能性。
那么,科学表明了什么? 首次出现的数据显示了一些令人鼓舞的结果。 尽管我们现有的信使核糖核酸疫苗仍然对奥密克戎有一定的保护作用,但在接种了两针信使核糖核酸疫苗的人中,针对这种变体的中和抗体似乎显著下降。
然而,实验室和现实世界中进行的初步研究结果表明,接受强化注射或第三剂疫苗的人可能会得到更好的保护。 虽然这些数据只是初步的,但他们认为,接种疫苗将有助于保护已经接种过疫苗的人在冬季月份免受奥米隆的突破性感染或可能的严重感染。
虽然Omicron上个月才在南非被发现,但研究人员一直在夜以继日地工作,以进一步了解这种变体。 上周,Omicron上出现了第一批科学数据,其中包括南非德班非洲健康研究所Alex Sigal领导的研究团队的有趣工作[1]。
在对Omicron活病毒的实验室研究中,研究人员表明,这种变异仍然依赖于 ACE2受体 感染人类肺细胞。 这真是个好消息。 这意味着,包括疫苗在内的已经开发的治疗工具,在对抗这种新变体方面通常仍然有用。
Sigal及其同事还测试了12名完全接种疫苗的人血浆中抗体中和Omicron的能力。 其中6人没有新冠肺炎病史。 其他六名患者在南非的第一波感染中感染了原始变异体。
正如预期的那样,样品对原始SARS-CoV-2变异体表现出很强的中和作用。 然而,先前接种过两剂辉瑞疫苗的人的抗体对Omicron产生了显著影响,显示中和能力下降了约40倍。
这种逃避免疫的行为还没有完成。 事实上,五个人的血液样本显示出相对良好的抗Omicron抗体水平。 除接种疫苗外,这五名患者之前都感染过SARS-CoV-2。 这些发现进一步证明了全面接种疫苗对预防先前感染过新冠肺炎的人再次感染的价值。
同样令人感兴趣的是辉瑞公司在新闻发布会上发布的第一份研究结果[2]。 辉瑞公司的研究人员还进行了实验室研究,以测试第二次注射一个月后19名患者的血液样本的中和能力,而另20名患者在一次强化注射后一个月的血液样本则是如此。
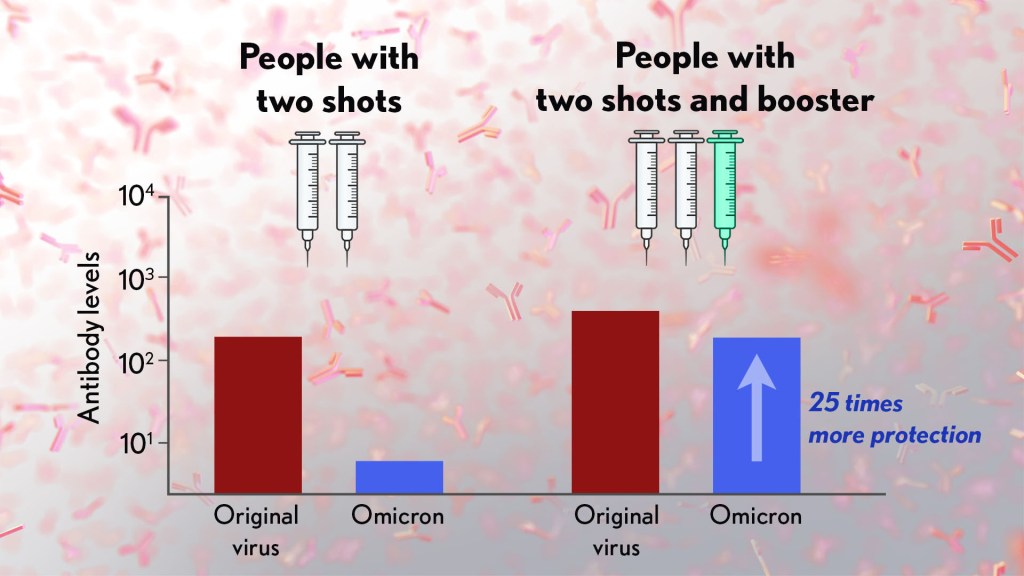
这些研究表明,与原始病毒相比,接受过两次注射的样本的中和能力下降了25倍以上。 再加上南非的数据,这表明两个剂量的系列可能不足以防止Omicron变异体的突破性感染。
更令人鼓舞的消息是,他们的研究继续表明,辉瑞疫苗的强化剂量提高了针对Omicron的抗体水平,与针对原始变体的两剂方案相当(如上图所示)。 虽然已经在努力开发Omicron特异性新型冠状病毒疫苗,但这些发现表明,通过加强注射,已经有可能获得对这种新变种的良好保护。
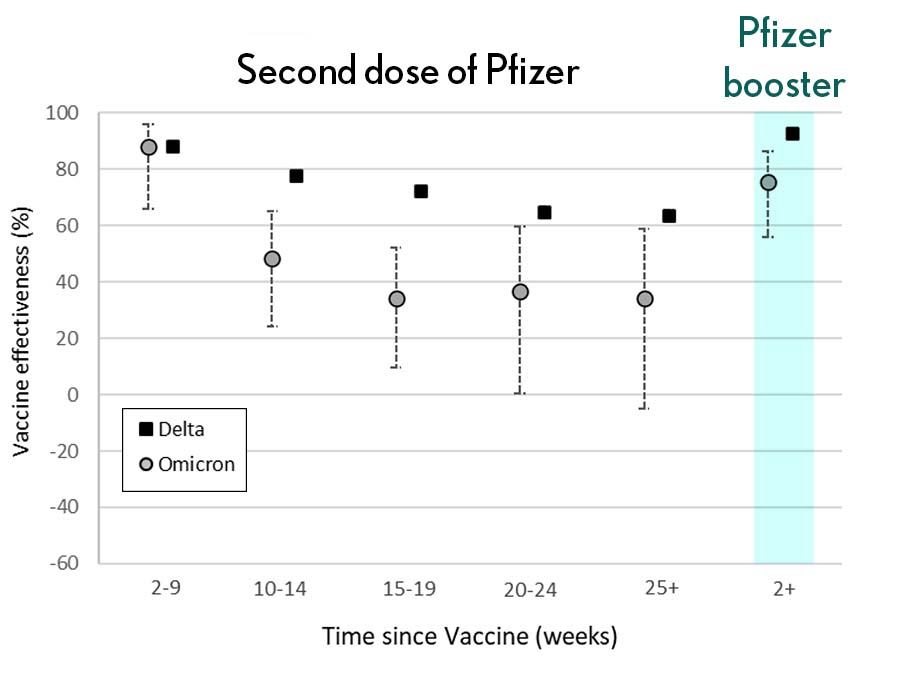
最近,来自英国的真实数据为助推器如何发挥作用提供了更多证据,而英国的Omicron案件正在迅速上升。 在预印本[3]中,安德鲁斯等人显示,两次注射辉瑞mRNA疫苗的有效性在四个月后呈下降趋势,约为40%。 这不太好,但请注意,40%比零要好得多。 因此,显然提供了一些保护。
来源:Andrews N等人,KHub.net 2021 最令人印象深刻(如图所示 Andrews N等人。 )一种助推器将疫苗的有效性大大提高到了80%左右。 这并没有达美航空高,但肯定是一个令人鼓舞的结果。 这些数据再次表明,即使助推器是由原始病毒设计的,但在暂停后增强免疫系统会增强对新病毒变体的免疫力。 你的免疫系统非常聪明。 您可以获得定量和定性的好处。
值得注意的是,Omicron变异体的基因组大部分没有突变,而这些突变是疫苗诱导免疫的其他方面的目标,包括 T细胞 这些细胞是人体第二道防线的一部分,通常病毒更难逃脱。 虽然T细胞不能预防感染,但它们有助于预防更严重的疾病和死亡。
值得注意的是,世界各地的科学家也在密切监测Omicron的严重程度。虽然这种变异似乎具有很高的传播性,而且得出严格结论还为时过早,但初步研究表明,这种变异实际上可能比Delta产生的疾病轻, 这是目前美国的主要菌株。
但仍有大量的研究要做,可能会改变我们对Omicron的看法。 这项研究需要时间和耐心。
然而,不会改变的是,疫苗是保护自己和他人免受新型冠状病毒感染的最佳方式。 (这些最新数据提供了一个更有力的理由,如果你符合条件,现在就可以获得助推器。)戴口罩,特别是在公共室内环境中,可以很好地防止所有SARS-CoV-2变种的传播。 如果你有症状或认为自己可能已经暴露在外,请进行测试,如果结果呈阳性,请呆在家里。 在我们等待更多答案的同时,使用所有可用的工具让自己、亲人和社区在这个假期保持快乐和健康,这一点与以往一样重要。
工具书类 :
[1] SARS-CoV-2 Omicron广泛但不完全地逃逸辉瑞BNT162b2诱导的中和作用,并需要ACE2进行感染 Sandile C等人。Sandile C.等人。medRxiv预印本。2021年12月9日。
[2] 辉瑞和BioNTech提供Omicron变体的更新 .辉瑞。 2021年12月8日。
[3] 针对Omicron(B.1.1.529)关注变种的新型冠状病毒疫苗的效力 Andrews N等人,KHub.net预印本,2021年12月10日。
链接 :
新冠肺炎研究 (国家卫生研究院)
西格尔实验室 (南非德班非洲卫生研究所)
发布时间: 新闻
标签: ACE2公司 , 助推器弹丸 , 突破性感染 , 新冠肺炎 , 新冠肺炎疫苗 , Delta变量 , mRNA疫苗 , 突变 , 中和抗体 , 新型冠状病毒 , 奥米克龙 , Omicron变体 , 大流行 , 辉瑞公司 , 辉瑞/生物科技疫苗 , SARS-CoV-2型 , 南非 , 穗蛋白 , T细胞 , 接种疫苗 , 变体
发布时间: 2021年12月7日 通过 弗朗西斯·柯林斯博士
随着Omicron现在在这么多人的脑海中浮现,世界各地的公共卫生官员和病毒学家都在密切关注SARS-CoV-2变异病毒的传播,并使用一切可能的手段来确定我们的新型冠状病毒疫苗对其的有效性。最终, 答案将取决于现实世界中发生的事情。 但它也将有助于建立一个现成的实验室手段来衡量疫苗的效果,而无需等待数月的现场结果。
考虑到后一个想法,我很高兴与大家分享美国国立卫生研究院资助的一项研究结果,该研究旨在了解与疫苗获得的对严重急性呼吸系统综合征冠状病毒2型的保护相关的免疫反应[1]。 这一发现基于对1000多名接种莫德纳信使核糖核酸疫苗的人的血液样本的分析,表明抗体水平确实与疫苗预防感染的效果有关,尽管有些不完美。
这种被称为“保护相关物”的免疫措施有可能支持更快批准新疫苗或更新疫苗。 它们也有助于展示疫苗在未参与疫苗初始测试的人群中的效果,如儿童、孕妇和有特定健康状况的人群。
发表在杂志上的最新研究 科学类 来自西雅图弗雷德·哈钦森癌症研究中心彼得·吉尔伯特领导的研究团队; David Montefiori,北卡罗来纳州达勒姆杜克大学; 国家过敏和传染病研究所NIH疫苗研究中心Adrian McDermott。
该团队从冠状病毒疗效(COVE)试验的现有数据开始。 这项在30000名美国成年人中进行的第三阶段研究发现,Moderna疫苗是安全的,约94%的疫苗能有效保护人们免受SARS-CoV-2症状感染[2]。
研究人员想了解提供如此高水平的新型冠状病毒保护的潜在免疫反应。 他们还试图开发一种方法,在实验室中测量这些反应,并快速显示疫苗的效果。
为了了解更多信息,吉尔伯特的团队对COVE参与者第二次接种疫苗时的血样进行了测试,四周后再次进行了测试。 其中两项测试测量了结合抗体(bAbs)的浓度 棘突蛋白 冠状病毒表面的装饰物。 另外两人测量了更广泛的保护性中和抗体(nAbs)的浓度,该抗体通过发现于人类细胞表面的ACE2受体阻止SARS-CoV-2感染人类细胞。
四项测试中的每一项都显示,未感染新冠肺炎的疫苗接种者的抗体水平始终高于感染者。 这与预期相符。 但这些数据也使研究人员能够确定与各种疾病防护水平相关的特定抗体水平。
对于抗体水平最高的人群,该疫苗提供了98%的保护。 那些水平低1000倍左右的人仍然得到了很好的保护,但他们的疫苗效力降低到了78%左右。
根据检测的任何抗体,抗体水平在前10%的疫苗接种者与抗体检测不到的接种者相比,估计的新冠肺炎风险大约低10倍。 总的来说,研究结果表明抗体水平测试可用于预测mRNA疫苗的疗效,并可用于指导对当前疫苗方案的修改。
为了理解这一发现的重要性,考虑到对于像Moderna或Pfizer这样的两剂量疫苗,使用这种保护相关性的试验可能在短短两个月内产生足够的数据[3]。 因此,这样的试验可能会显示疫苗是否在3到5个月内达到其基准。 相比之下,即使是以标准方式进行的快速临床试验也至少需要7个月才能完成。 同样重要的是,依赖于这种保护相关性的试验需要更少的参与者。
由于所有四项测试都表现得同样好,研究人员表示,可以想象,一次抗体检测可能足以预测疫苗在临床试验中的效果。 当然,这类试验需要后续的实际研究来验证预测的疫苗效力是否与实际免疫保护相匹配。
需要注意的是,美国食品药品监督管理局(FDA)需要批准在任何疫苗试验中采用此类保护相关性之前使用这些保护相关性。 但是,到目前为止,关于中和抗体反应与保护作用相关的全部证据是COVE试验数据的主要贡献者,这一点令人印象深刻。
中和抗体水平也正在考虑用于未来的冠状病毒疫苗试验。 事实上,对于辉瑞公司针对5-11岁儿童的mRNA疫苗EUA,FDA接受了预先规定的成功标准,其依据是该年龄组中和抗体反应与16-25岁儿童一样好[4]。
抗体水平也被考虑在内,以决定是否需要注射助推器。 然而,值得注意的是,抗体水平不够精确,无法帮助决定是否有任何特定的人需要新冠肺炎疫苗。 这些建议是基于自最初免疫以来经过的时间。
在假期到来之前,获得助推器是一个非常好的主意。 Delta变种仍然是美国的主要变种,我们需要减缓其传播速度。 大多数专家认为,疫苗和加强针也将对奥密克戎变异株提供一些保护,尽管我们需要的证据还有一两周的时间。 美国疾病控制与预防中心(CDC)建议18岁及以上的人在接种第二剂信使核糖核酸疫苗后至少六个月或接种单剂强生疫苗后两个月接种新冠肺炎加强针[5]。 你可以选择接种相同或不同的疫苗。 而且,有一个 靠近你的地方 那就是提供机会。
工具书类 :
[1] mRNA-1273新型冠状病毒肺炎疫苗疗效临床试验的免疫相关分析 . Gilbert PB、Montefiori DC、McDermott AB、Fong Y、Benkeser D、Deng W、Zhou H、Houchens CR、Martins K、Jayashankar L、Castellino F、Flach B、Lin BC、O’Connell S、McDanal C、Eaton A、Sarzotti-Kelsoe M、Lu Y、Yu C、Borate B、van der Laan LWP、Hejazi NS、Huynh C、Miller J、El Sahly HM、Baden LR、Baron M、De La Cruz L、Gay C、Kalams S、Kelley CF、, Andrasik议员、Kublin JG、Corey L、Neuzil KM、Carpp LN、Pajon R、Follmann D、Donis RO、Koup RA; 免疫检测小组§; Moderna,Inc.团队§; 冠状病毒疫苗预防网络(CoVPN)/冠状病毒效力(COVE)团队§; 美国政府(USG)/CoVPN生物统计学团队§。 科学。 2021年11月23日:eab3435。
[2] mRNA-1273 SARS-CoV-2疫苗的疗效和安全性 Baden LR、El Sahly HM、Essink B、Kotloff K、Frey S、Novak R、Diemert D、Spector SA、Rouphael N、Creech CB、McGettigan J、Khetan S、Segall N、Solis J、Brosz A、Fierro C、Schwartz H、Neuzil K、Corey L、Gilbert P、Janes H、Follmann D、Marovich M、Mascola J、Polakowski L、Ledgerwood J、Graham BS、Bennett H、Pajon R、Knightly C、Leav B、Deng W、, 周H、韩S、Ivarsson M、Miller J、Zaks T; COVE研究小组。 《新英格兰医学杂志》,2021年2月4日; 384(5):403-416.
[3] 由政府领导的努力,以确定新冠肺炎疫苗保护的相关因素 Koup RA、Donis RO、Gilbert PB、Li AW、Shah NA、Houchens CR.Nat Med.2021年9月; 27(9):1493-1494.
[4] 对5-11岁儿童接种BNT162b2 Covid-19疫苗的评估 Walter EB、Talaat KR、Sabharwal C、Gurtman A、Lockhart S、Paulsen GC、Barnett ED、Muñoz FM、Maldonado Y、Pahud BA、Domachowske JB、Simöes EAF、Sarwar UN、Kitchin N、Cunliffe L、Rojo P、Kuchar E、Rämet M、Munjal I、Perez JL、Frenck RW Jr、Lagkadinou E、Swanson KA、Ma H、Xu、Koury K、Mather S、Belanger TJ、Cooper D、Türeci Dormitzer公关, ⑩ahin U、Jansen KU、Gruber WC; C4591007临床试验组。 《新英格兰医学杂志》,2021年11月9日:NEJMoa2116298。
[5] 新冠肺炎疫苗强化注射 疾病控制和预防中心。 2021年11月29日。
链接 :
新冠肺炎研究 (国家卫生研究院)
新冠肺炎预防网络
战斗冠 (美国卫生与公共服务部)
彼特·吉尔伯托 (弗雷德·哈奇森癌症研究中心)
大卫·蒙地菲罗利 (北卡罗来纳州达勒姆杜克大学)
阿德里安·麦克德莫特 (国家过敏和传染病研究所/NIH)
NIH支持:国家过敏和传染病研究所
发布时间: 新闻
标签: ACE2公司 , 抗体 , 临床试验 , 冠状病毒疗效试验 , 保护的相关因素 , 海湾 , 新冠肺炎 , 新冠肺炎疫苗 , 豁免权 , 强生疫苗 , Moderna疫苗 , 中和抗体 , 新型冠状病毒 , Omicron变体 , 大流行 , 辉瑞/生物科技疫苗 , SARS-CoV-2型 , 穗蛋白
发布时间: 2021年11月18日 通过 弗朗西斯·柯林斯博士
美国每天约有7万人被确诊感染新冠肺炎。 很明显,这些新病例是由传染性更强的严重急性呼吸系统综合征冠状病毒2型德尔塔变种引起的,德尔塔变种是导致新冠肺炎的新型冠状病毒。 但是为什么Delta变异比其他病毒变异更容易从一个人传播到另一个人?
现在,NIH资助的一个团队发现了Delta的部分秘密,这不全是由于那些广泛研究的尖峰蛋白的突变,这些尖峰蛋白通过 ACE2受体 结果发现,在Delta基因组的N蛋白编码区内发现的一种特定突变也能使病毒将更多的RNA代码打包到受感染的宿主细胞中。 因此,功能齐全的新病毒颗粒的产生量增加,并可能继续感染其他人。
这项发现发表在杂志上 科学类 [1] 来自霍华德·休斯医学研究所、旧金山格莱斯顿研究所和加州大学伯克利分校创新基因组研究所的诺贝尔奖得主詹妮弗·杜德纳实验室。 格拉德斯通研究所的梅兰妮·奥特(Melanie Ott)是该团队的共同领导者。
杜德纳和奥特团队开发了一种令人兴奋的新工具来研究冠状病毒的变体。 这是一种被称为病毒样颗粒(VLP)的实验室构建物。 这些特制VLP含有SARS-CoV-2的所有结构蛋白(如上所示),但不含遗传物质。 因此,它们是真实病毒的非感染性复制品,可以在任何实验室中安全地进行研究。科学家不必像处理整个病毒时那样,在配备高度生物安全性的实验室中预留时间。
VLP还允许研究人员探索冠状病毒其他必需蛋白的变化,而不仅仅是其表面的尖峰蛋白。 事实上,根据世界卫生组织(WHO)的定义,所有受关注的SARS-CoV-2变异体在一种称为核衣壳(N蛋白)的病毒蛋白中的七种氨基酸的同一段中都携带至少一种突变。 这种蛋白质还没有被广泛研究,它是病毒发挥自身功能所必需的。 它还与病毒包装和释放感染性RNA的能力有关。
在 科学类 Doudna及其同事对N蛋白进行了更深入的研究。 他们通过开发一种特殊的系统来实现这一点,该系统使用VLP将病毒RNA信息包装并传递到人类细胞中。
其工作原理如下:VLP包括SARS-CoV-2的所有四种结构蛋白,包括尖峰蛋白和N蛋白。 此外,它们还含有RNA序列,使病毒能够识别细胞内的遗传物质,从而将其包装成下一代病毒颗粒。
虽然这些颗粒从外表上看起来就像SARS-CoV-2,但它们内部却缺少绝大多数病毒基因组。 但它们还有另一个关键成分:一个RNA片段,它可以使被VLP入侵的细胞发光。 事实上,VLP传递的RNA信息越多,细胞就会发光越亮。 它使研究人员能够发现成功的入侵,同时也可以量化细胞中特定VLP的RNA数量。
研究人员随后产生了SARS-CoV-2 VLP,包括四种突变,这些突变普遍存在于更易传播的相关变异体的N蛋白中。 就在那时,他们发现这些变异产生了10倍以上的RNA信息,并将其传递到细胞中。
增加的RNA也符合在感染Delta变异体的人群中观察到的结果。 他们在鼻子和喉咙中产生的病毒是感染老年变异病毒的人的10倍。
但是这些发现与真实病毒中发生的情况相符吗? 为了找到答案,研究人员和他们的同事在一个高级生物安全实验室测试了Delta变种中发现的N蛋白突变。事实上,他们的研究表明,感染的人类肺细胞中的突变病毒产生的感染性病毒约是SARS-CoV-2变种的50倍。
研究结果表明,N蛋白可能是新冠肺炎有效治疗的重要靶点,追踪N蛋白中新出现的突变也可能对识别新的关注病毒变体很重要。 这个新系统是一个强大的工具,也可以用来探索未来新出现的变种如何影响这场可怕的流行病的进程。
参考 :
[1] 使用类病毒颗粒快速评估SARS-CoV-2进化变体 Syed AM、Taha TY、Tabata T、Chen IP、Ciling A、Khalid MM、Sreekumar B、Chen PY、Hayashi JM、Soczek KM、Ott M、Doudna JA。 科学。 2021年11月4日:eabl6184。
链接 :
新冠肺炎研究 (国家卫生研究院)
杜德纳实验室
NIH支持:国家过敏和传染病研究所
发布时间: 新闻
标签: ACE2公司 , 冠状病毒 , 新冠肺炎 , Delta变量 , 模型系统 , N蛋白 , 新型冠状病毒 , 核衣壳 , 大流行 , 核糖核酸 , SARS-CoV-2型 , 严重急性呼吸系统综合征冠状病毒2型传播 , 穗蛋白 , 结构蛋白 , 变体 , 类病毒颗粒 , VLP(VLP)
发布时间: 2021年6月22日 通过 弗朗西斯·柯林斯博士
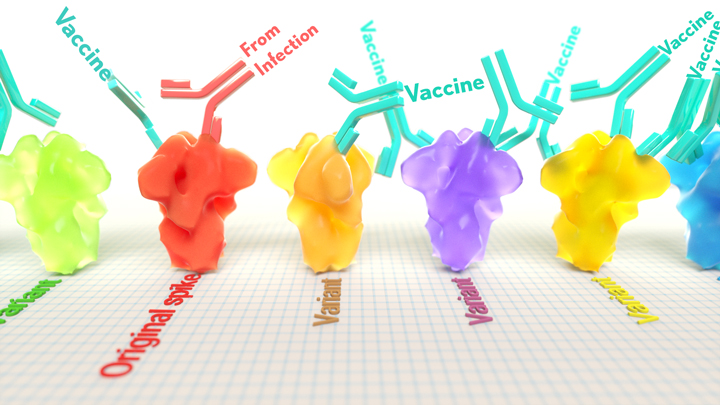
随着疫情接近尾声,一个关键问题是更准确地确定人们接触SARS-CoV-2,即新冠肺炎病毒(COVID-19)多长时间后,将产生针对这种危险冠状病毒的中和抗体。 随着新的SARS-CoV-2“关注变种”在世界各地出现,寻找答案也可能变得复杂,可能会找到方法 逃避获得性免疫力 ,增加了新疫情爆发的可能性。
现在,美国国立卫生研究院支持的一项新研究表明,这个问题的答案将因个体抗SARS-CoV-2抗体的产生方式而异:在自然获得性感染过程中或从新冠肺炎疫苗中产生抗体。 新证据表明,针对mRNA疫苗产生的保护性抗体将针对更广泛的SARS-CoV-2变异体,其关键部分具有“单字母”变化 穗蛋白 与从感染中获得的抗体相比。
这些结果进一步证明,获得性免疫力患者对新出现的SARS-CoV-2变异体可能有不同程度的保护。 更重要的是,这些数据提供了进一步的证据,证明那些感染了新冠肺炎并已康复的人仍然可以从接种疫苗中受益。
这些最新发现来自杰西·布鲁姆、艾莉森·格里尼和他们在西雅图弗雷德·哈钦森癌症研究中心的团队。 在早些时候的一项研究中,同一团队专注于 受体结合域 )是钉住SARS-CoV-2外表面的棘突蛋白的关键区域。 这种RBD尤其重要,因为病毒利用其棘突蛋白的这一部分锚定另一种称为 ACE2公司 在感染人类细胞之前。 这使得RBD成为自然获得的抗体和疫苗产生的抗体的主要靶点。 西雅图研究小组之前的研究使用了一种称为深度突变扫描的方法,绘制出RBD中所有可能的突变,这些突变会改变病毒结合ACE2和/或RBD导向抗体攻击目标的能力。
在他们发表在杂志上的新研究中 科学转化医学 Bloom、Greaney和他的同事们再次研究了数千种可能的RBD变体,以了解抗体可能如何在那里击中目标[1]。 这一次,他们想根据RBD定向抗体的获得方式来探索它们之间的差异。
他们再次转向深度突变扫描。 首先,他们创建了所有3800个可能的RBD单氨基酸突变体的库,并将这些库暴露于从接种过疫苗的个体和以前感染过的未接种过疫苗个体中提取的样本中。 所有接种疫苗的人都接种了两剂Moderna mRNA疫苗。 这种疫苗的工作原理是刺激人体细胞产生棘突蛋白,从而启动免疫反应并产生抗体。
通过仔细检查结果,研究人员发现了接种过SARS-CoV-2疫苗和未接种过SARS CoV-2的人获得性免疫力之间的重要差异。 具体而言,与感染引发的抗体相比,mRNA疫苗引发的抗体更集中于RBD,而感染往往针对棘突蛋白的其他部分。 重要的是,与自然感染引发的抗体相比,疫苗引发的抗体针对RBD上更广泛的地方。
这些发现表明,对严重急性呼吸系统综合征冠状病毒2型的自然免疫和疫苗产生的免疫在识别新的病毒变体方面会有所不同。 此外,在疫苗的帮助下获得的抗体可能更有可能针对新的SARS-CoV-2变异体,即使变异体携带RBD中的新突变。
目前尚不完全清楚为什么疫苗和感染合法抗体反应存在这些差异。 在这两种情况下,RBD导向的抗体都是通过免疫系统对病毒尖峰蛋白的识别和反应获得的。 西雅图研究小组认为,这些差异可能是因为疫苗呈现的病毒蛋白构象略有不同。
此外,mRNA的传递可能会改变抗原呈现给免疫系统的方式,导致产生抗体的差异。 第三个不同之处是,自然感染只会使身体接触呼吸道中的病毒(除非病情非常严重),而疫苗则被输送到肌肉中,在肌肉中,免疫系统可能有更好的机会看到病毒并作出积极反应。
无论潜在的原因是什么,重要的是要考虑到人类经常受到其他常见冠状病毒的感染和再感染,这些病毒是导致普通感冒的原因。 年复一年地感染季节性冠状病毒感冒并不罕见。 这至少在一定程度上是因为这些病毒 倾向于进化 为了逃避获得性免疫力,SARS-CoV-2目前正在进行中。
到目前为止,好消息是,与普通感冒的情况不同,我们现在已经开发出多种新型冠状病毒疫苗。 证据继续表明,获得性疫苗免疫仍能提供 实质性保护 反对目前在全球传播的新变体。
人们希望,从疫苗获得的免疫力将确实产生对SARS-CoV-2的长期保护,并结束这场大流行。 这些新发现令人鼓舞地指向这一方向。 它们还可以作为一个重要的提醒,提醒你,如果你还没有准备好接种疫苗,无论你是否感染了新冠肺炎。 我们赢得这场病毒竞赛的最大希望是现在让尽可能多的人接种疫苗。 这将挽救生命,并减少出现更多可能逃避现有疫苗保护的变种的可能性。
参考 :
[1] 与SARS-CoV-2感染的抗体相比,mRNA-1273疫苗诱导的抗体与受体结合域的结合更广泛 Greaney AJ、Loes AN、Gentles LE、Crawford KHD、Starr TN、Malone KD、Chu HY、Bloom JD。 《科学与运输医学》,2021年6月8日。
链接 :
新冠肺炎研究 (国家卫生研究院)
布鲁姆实验室 (西雅图弗雷德·哈钦森癌症研究中心)
NIH支持:国家过敏和传染病研究所
发布时间: 新闻
标签: ACE2公司 , 获得性免疫力 , 卫生机构 , 普通感冒 , 冠状病毒 , 新冠肺炎 , 新冠肺炎感染 , 新冠肺炎疫苗 , 深部突变扫描 , Moderna疫苗 , mRNA疫苗 , 新型冠状病毒 , 大流行 , RBD公司 , 受体结合域 , SARS-CoV-19变种 , SARS-CoV-2型 , 穗蛋白 , 疫苗 , 关注的变体
发布时间: 2021年6月8日 通过 弗朗西斯·柯林斯博士
除了SARS-CoV-2、COVID-19病毒引起的肺炎、血栓和其他严重的健康问题外,一些研究还发现了另一个令人不安的联系。 一些人在急性新冠肺炎感染后会发展为糖尿病。
发生什么事了? 美国国立卫生研究院支持的两项新研究,现已在期刊上作为预先证据提供 细胞代谢 [1,2],有助于回答这个重要问题,证实SARS-CoV-2可以靶向并损害人体的胰岛素生成细胞。
1型糖尿病 在以下情况下发生 β细胞 胰腺分泌的胰岛素不足,无法让身体在饭后以最佳方式代谢食物。 由于胰岛素不足,血糖水平升高,这是糖尿病的特征。
早期的实验室研究表明,SARS-CoV-2可以感染人类β细胞[3]。 他们还表明,这种危险的病毒可以在这些胰岛素分泌的β细胞中复制,产生更多的自我复制并传播到其他细胞[4]。
最新的研究建立在这些早期研究的基础上,以发现更多关于新冠肺炎和糖尿病之间的联系。 这项工作涉及两个由NIH资助的独立团队,一个由加州帕洛阿尔托斯坦福大学医学院的彼得·杰克逊领导,另一个由纽约威尔康奈尔医学院的陈水兵领导。实际上,我是陈团队研究的合著者之一, 其中一些研究是在我位于马里兰州贝塞斯达的NIH国家人类基因组研究所实验室进行的。
这两项研究都证实了死于新冠肺炎患者尸检样本中的胰岛β细胞感染。 Jackson团队的进一步研究表明,冠状病毒可能优先感染胰岛素分泌的β细胞。
这也有生物学意义。 胰腺中的β细胞和其他细胞类型表达 ACE2受体蛋白 TMPRSS2酶蛋白和神经纤维蛋白1(NRP1),所有这些都是SARS-CoV-2 取决于 进入并感染人类细胞。 事实上,Chen团队在尸检胰腺组织的研究中,在胰岛素生成的β细胞和其他几种类型的胰腺细胞中都发现了冠状病毒的迹象。
新发现还表明,冠状病毒感染改变了胰岛的功能,胰岛是含有β细胞的胰腺组织。 两个研究小组都报告了SARS-CoV-2感染导致胰岛组织胰岛素生成和释放减少的证据。 杰克逊团队还发现,感染直接导致一些非常重要的β细胞死亡。 令人鼓舞的是,他们表明通过阻断NRP1可以避免这种情况。
除了失去β细胞外,感染似乎也改变了存活细胞的命运。 陈的团队进行了单细胞分析,以仔细观察SARS-CoV-2感染后胰腺细胞内基因活性的变化。 这些研究表明,β细胞经历了一个转分化过程,在这个过程中它们似乎得到了重新编程。
在这个过程中,细胞开始产生更少的胰岛素和更多的胰高血糖素,这是一种鼓励肝脏中的糖原分解为葡萄糖的激素。 他们还开始产生更高水平的一种叫做胰蛋白酶1的消化酶。 重要的是,他们还表明,这种转分化过程可以被一种化学物质(称为转ISRIB)逆转,这种化学物质可以减少细胞对应激的重要反应。
这种β细胞转分化的后果尚不清楚,但预计会加重胰岛素缺乏症并升高血糖水平。 需要更多的研究来了解严重急性呼吸系统综合征冠状病毒2型是如何到达胰腺的,以及免疫系统在由此造成的损伤中可能发挥什么作用。 最重要的是,这项工作再次提醒人们,保护自己、家人和社区免受新冠肺炎感染的重要性,如果你还没有接种疫苗,就接种疫苗,并鼓励你的亲人也这样做。
工具书类 :
[1] SARS-CoV-2感染诱导β细胞转分化 Tang等人,Cell Metab 2021年5月19日; S1550-4131(21)00232-1。
[2] SARS-CoV-2感染人胰腺β细胞并引起β细胞损伤 .Wu等人.细胞元。 2021年5月18日; S1550-4131(21)00230-8。
[3] 基于人类多能干细胞的平台,用于研究SARS-CoV-2在人类细胞和类器官中的向性和病毒感染模型 Yang L,Han Y,Nilsson Payant BE,Evans T,Schwartz RE,Chen S等。细胞干细胞。 2020年7月2日; 27(1):125-136.e7。
[4] SARS-CoV-2在人类内分泌和外分泌胰腺细胞中感染和复制 Müller JA、GroßR、Conzelmann C、Münch J、Heller S、Kleger A等人,Nat Metab。 2021年2月; 3(2):149-165.
链接 :
新冠肺炎研究 (国家卫生研究院)
1型糖尿病 (国家糖尿病、消化和肾脏疾病研究所/NIH)
杰克逊实验室 (斯坦福医学,加利福尼亚州帕洛阿尔托)
陈水兵实验室 (Weill Cornell Medicine,纽约市)
NIH支持:国家糖尿病、消化和肾脏疾病研究所; 国家人类基因组研究所; 国家普通医学科学研究所; 国家癌症研究所; 国家过敏和传染病研究所; 尤妮斯·肯尼迪·施莱弗国家儿童健康与人类发展研究所
发布时间: 新闻
标签: ACE2公司 , β细胞 , 冠状病毒 , 新冠肺炎 , 糖尿病 , 胰高血糖素 , 糖原 , 胰岛素 , 新型冠状病毒 , 尼泊尔卢比1 , 胰腺 , 胰腺β细胞 , 大流行 , SARS-CoV-2型 , 单细胞分析 , TMPRSS2型 , 转分化 , 1型糖尿病
发布时间: 2021年4月27日 通过 弗朗西斯·柯林斯博士
截至去年10月,巴西马瑙斯市每四名居民中就有三人感染了SARS-CoV-2,这是导致新冠肺炎的病毒[1]。 然而,尽管人们希望在亚马逊地区这个拥有220万人口的城市实现“群体免疫”,但该病毒在2020年末和2021年初再次爆发,导致了第二波疾病和死亡[2]。 这怎么可能?
这个答案为病毒进化提供了一个教训,尤其是当SARS-CoV-2等传染性病毒在一个基本上未经检查的人群中复制和传播时。 在该杂志最近的一项研究中 科学类 研究人员将该市严重急性呼吸系统综合征冠状病毒2型的死灰复燃与一种名为P.1的新型严重急性呼吸系统综合征冠状病毒2型“令人担忧的变种”的出现和迅速传播联系起来[3]。 这种变体携带一系列独特的突变,不仅可以偷偷通过人类免疫系统重新感染人类,而且传播力是早期变体的两倍左右。
为了理解这是怎么可能的,考虑到每次冠状病毒SARS-CoV-2在感染者体内复制自己时,都有可能出错。 每一个错误都会产生一个新的变体,它可能会继续复制自己。 在大多数情况下,这些随机错误几乎没有后果。 这是行动中的进化。
但有时会发生拼写变化,这对病毒有利。 在免疫系统受到抑制的患者的特殊情况下,病毒有足够的机会产生异常高的突变。 携带有益突变的变异体可以比其他变异体复制更多的自身,使其能够建立数量并传播,从而导致更多感染。
在新冠肺炎大流行的晚期阶段,这种快速传播的新变种仍然引起严重关注。 其中包括起源于 南非 ; B.1.1.7出现在 大不列颠联合王国 ; 现在是来自巴西马瑙斯的P.1。
在这项新研究中,英国伦敦帝国理工学院的努诺·法里亚(Nuno Faria)和萨米尔·巴特(Samir Bhatt)以及巴西圣保罗大学的埃斯特·塞尔迪拉·萨比诺(Ester Cerdeira Sabino)及其同事对2020年11月和12月在马瑙斯采集的184名患者样本中的SARS-CoV-2基因组进行了测序。 这项研究是在巴西-英国虫媒病毒发现、诊断、基因组学和流行病学中心(CADDE)的赞助下进行的,该中心是一个专注于病毒基因组学和公共卫生流行病学的项目。
这些基因组数据表明,P.1变异体获得了17个新突变。 其中10个位于棘突蛋白中,棘突蛋白是病毒与人类细胞结合的片段,也是当前新型冠状病毒疫苗的靶点。 事实上,这项新的研究揭示了其中三种棘突蛋白突变使得P.1棘突更容易与人类结合 ACE2受体 ,这是SARS-CoV-2的首选切入点。
2020年12月6日,通过基因组监测发现了第一例P.1变异病例,随后迅速传播。 通过进一步的进化分析,该团队估计P.1一定是在2020年11月中旬出现的,在短时间内没有被发现。
为了更好地理解P.1变异体是如何导致新冠肺炎爆发的,研究人员开发了一个数学模型,将基因组数据与死亡率数据相结合。 该模型表明,P.1的传播能力可能是早期变体的1.7至2.4倍。 他们还估计,以前感染了非P.1变异体的人对随后感染P.1的保护率只有54%至79%。
研究人员还观察到P.1变异体出现后死亡率增加。 然而,目前尚不清楚这是否意味着P.1天生就比早期变体更致命。 死亡率的增加可能主要与马瑙斯医疗系统因治疗这么多新冠肺炎患者而承受的额外压力有关。
这些发现再次提醒我们,基因组监测和国际数据共享对于快速检测和表征新出现的SARS-CoV-2变异的重要性。 值得注意的是,大约在巴西发现这种变异的同时,也有四名从日本来到巴西的人报告了这种变异。 P.1变体继续在巴西迅速传播。 在包括美国在内的37多个国家[4]也发现了该病,目前该病占新发病例的1%以上[5]。
毫无疑问,你想知道这对疫苗意味着什么,例如辉瑞和Moderna mRNA疫苗,这些疫苗已经用于美国1.4亿人的免疫(至少一剂)。 这里的消息令人鼓舞。 接受辉瑞疫苗的个人血清中的中和抗体滴度与原始SARS-CoV-2病毒相比,P.1仅略有降低[6]。 因此,预计该疫苗具有高度的保护性。 这是疫苗比自然感染提供更多保护的另一个例子。
美国在抗击新冠肺炎方面取得了真正显著的进展,但我们必须吸取马瑙斯的教训:这场可怕的疫情尚未结束。 虽然P.1变体目前仍处于较低水平,但“英国变体”B.1.1.7继续迅速传播,目前是美国最流行的变体,占新发病例的44%[6]。 幸运的是,信使核糖核酸疫苗也能很好地对抗B.1.1.7。
我们必须继续尽一切可能,单独或集体地防止这些新的严重急性呼吸系统综合征冠状病毒2型变种减缓甚至取消去年取得的进展。 我们需要保持警惕一段时间,同时鼓励我们的朋友、邻居和亲人接种疫苗。
工具书类 :
[1] 巴西亚马逊地区SARS-CoV-2大规模流行期间四分之三的发病率 Buss,L.F.、C.A.Prete,Jr.、C.M.M.Abrahim、A.C.Dye、V.H.Nascimento、N.R.Faria和E.C.Sabino等人(2021年)。 《科学》371(6526):288-292。
[2] 尽管血清流行率很高,但新冠肺炎在巴西马瑙斯再次流行 .萨比诺EC、巴斯LF、卡瓦略MPS、普雷特Jr CCA、克里斯皮姆MAE、弗雷吉NA、佩雷拉RHM、帕拉加KV、佩里克索托PS、克莱默MUG、Oikawa MJ、所罗门T、库库努巴ZM、卡斯特罗MC、桑托斯AAAS、纳西门托VH、佩雷拉·HS、弗格森NM、皮布斯OG、库查尔斯基A、布希MP、Dye C、法里亚NR Lancet。 2021年2月6日; 397(10273):452-455.
[3] 巴西马瑙斯P.1严重急性呼吸系统综合征冠状病毒2型谱系的基因组学和流行病学 Faria NR、Mellan TA、Whittaker C、Claro IM、Fraiji NA、Carvalho MDPSS、Pybus OG、Flaxman S、Bhatt S、Sabino EC等人,《科学》。 2021年4月14日:eabh2644。
[4] GRINCH研究新型冠状病毒单倍型的全球报告 PANGO世系。
[5] 冠状病毒数据跟踪器。 变量比例 疾病控制和预防中心。
[6] SARS-CoV-2 P.1株的抗体逃逸 .Dejnirattisai W,Zhou D,Supasa P,Liu C,Mongkolsapaya J,Ren J,Stuart DI,Screaton GR,等.Cell。 2021年3月30日:S0092-8674(21)00428-1。
链接 :
新冠肺炎研究 (国家卫生研究院)
巴西-英国虫媒病毒发现、诊断、基因组学和流行病学中心 (CADDE)
努诺·法里亚 (英国伦敦帝国理工学院)
萨米尔巴特 (帝国理工学院)
埃斯特·塞尔迪拉·萨比诺 (巴西圣保罗大学)
NIH支持:国家过敏和传染病研究所
发布时间: 新闻
标签: ACE2公司 , B.1.1.7节 , B.1.351节 , 巴西 , CADDE公司 , 冠状病毒 , 新冠肺炎 , 新冠肺炎感染 , 新型冠状病毒肺炎变种 , 进化 , 基因组流行病学 , 基因组监测 , 基因组学 , 群体免疫 , 马瑙斯 , 摩德纳 , mRNA疫苗 , 新型冠状病毒 , 第1页 , 大流行 , 辉瑞/生物科技疫苗 , 公共卫生 , 严重急性呼吸系统综合征冠状病毒2型 , 南非 , 穗蛋白 , 英国变体 , 疫苗 , 关注变量 , 病毒进化
发布时间: 2021年4月22日 通过 弗朗西斯·柯林斯博士
描述:在人类唾液腺细胞中发现SARS-CoV-2(粉红色)及其首选人类受体ACE2(白色)(绿色轮廓)。 图片来源:Paola Perez,美国国立卫生研究院国家牙科和颅面研究所华纳实验室 新冠肺炎主要被认为是一种影响肺部、上呼吸道和鼻腔的呼吸道疾病。 但新冠肺炎也会影响身体的其他部位,包括消化系统、血管和肾脏。 现在,一项新的研究增加了其他东西:嘴巴。
这项研究发表在杂志上 自然医学 表明SARS-CoV-2是导致新型冠状病毒肺炎的冠状病毒,可以主动感染口腔内的细胞 唾液腺 新的发现可能有助于解释为什么新冠肺炎可以通过唾液测试检测到,以及为什么约一半的新冠肺炎病例包括口腔症状,例如味觉丧失、口干和口腔溃疡。 这些结果还表明,口腔及其唾液可能在SARS-CoV-2在全身传播以及在人与人之间传播过程中起着重要而不被重视的作用。
最新研究来自NIH国家牙科和颅面研究所的布莱克·沃纳; 凯文·伯德,北卡罗来纳大学亚当斯牙科学院,教堂山; 以及他们的国际同事。 研究人员很好奇口腔是否在传播SARS-CoV-2中起作用。 他们已经意识到,当人们说话、咳嗽甚至唱歌时,传播的可能性更大。 他们还从诊断测试中得知,新冠肺炎患者的唾液中可能含有高水平的SARS-CoV-2。 但是口腔和唾液中的病毒是来自其他地方吗? 或者,SARS-CoV-2是否也在口腔内的细胞中感染和复制?
为了找到答案,研究小组调查了健康人的口腔组织,以寻找表达 ACE2受体蛋白和TMPRSS2酶蛋白 SARS-CoV-2依赖这两种病毒进入并感染人类细胞。 他们发现,这些蛋白质可能在所有类型唾液腺的原代细胞和口腔内层组织中单独表达。 事实上,我们牙齿周围的唾液腺和牙龈(牙龈)细胞的一小部分同时表达编码ACE2和TMPRSS2的基因。
接下来,该团队在检测的来自新冠肺炎患者的唾液腺组织样本中,检测到了略多于一半的SARS-CoV-2迹象。 样本包括一名死于新冠肺炎的患者和另一名患有急性疾病的患者的唾液腺组织。
研究人员还发现证据表明,冠状病毒正在积极复制,以制造更多的自身拷贝。 在轻度或无症状新型冠状病毒肺炎患者中,流到口腔唾液中的口腔细胞被发现含有SARS-CoV-2的RNA,以及其用于进入人类细胞的蛋白质。
研究人员随后收集了另一组35名志愿者的唾液,其中包括27名有轻微新冠肺炎症状的志愿者和另外8名无症状的志愿者。 在27名有症状的人中,唾液中携带病毒的人更有可能报告味觉和嗅觉丧失,这表明口腔感染可能导致这些新冠肺炎症状,尽管主要原因可能是鼻子中的嗅觉组织感染。
另一个重要问题是,SARS-CoV-2悬浮在唾液中时是否会感染其他健康细胞。 为了得到答案,研究人员将八名无症状新冠肺炎患者的唾液暴露在实验室培养皿中生长的健康细胞中。 两名受感染志愿者的唾液导致健康细胞感染。 这些发现增加了一种不幸的可能性,即即使是无症状的新型冠状病毒肺炎患者也可能在不知不觉中通过唾液将SARS-CoV-2传播给其他人。
总的来说,研究结果表明口腔在新冠肺炎感染和传播中所起的作用比先前认为的要大。 研究人员认为,携带病毒的唾液在吞咽或吸入时,可能会将病毒传播到喉咙、肺部或消化系统。 知道了这一点,人们希望更好地了解SARS-CoV-2是如何感染口腔的,这有助于找到新的方法来防止这种毁灭性病毒的传播。
参考 :
[1] SARS-CoV-2口腔和唾液感染 黄N、佩雷斯·P、加藤·T、米卡米·Y、奇奥里尼·JA、克莱纳·DE、皮塔卢加·S、休伊特·SM、波贝洛·PD、切尔托·D; NIH COVID-19尸检联合会; HCA口腔和颅面生物网络,Frank K,Lee J,Boucher RC,Teichmann SA,Warner BM,Byrd KM,et.al Nat Med.2021年3月25日。
链接 :
新冠肺炎研究 (国家卫生研究院)
唾液和唾液腺疾病 (国家牙科和颅面研究所/NIH)
布莱克·沃纳 (国家牙科和颅面研究所/NIH)
凯文·伯德 (北卡罗来纳大学亚当斯牙科学院教堂山分校)
NIH支持:国家牙科和颅面研究所 ; 国家糖尿病、消化和肾脏疾病研究所 ; 国家翻译科学促进中心
发布时间: 新闻
标签: ACE2公司 , 冠状病毒 , 新冠肺炎 , COVID-19变速箱 , 口干 , 牙龈 , 口 , 新型冠状病毒 , 口腔健康 , 大流行 , 唾液 , 唾液腺 , SARS-CoV-2型 , 吐 , TMPRSS2型
发布时间: 2021年3月18日 通过 弗朗西斯·柯林斯博士
David Veesler/学分:西雅图华盛顿大学医学院 David Veesler花了近20年的时间,对包括冠状病毒在内的各种病毒的感染部位进行近原子细节成像 智人 事实上,他在西雅图华盛顿大学的实验室是第一个阐明如今臭名昭著的3D建筑的实验室 穗蛋白 冠状病毒利用其进入人类细胞[1]。 他利用这些基本见解指导疫苗和治疗药物的设计,包括有前途的单克隆抗体。
现在,Veesler和他的实验室正在转向另一种哺乳动物,为下一代抗病毒治疗寻找新的线索,包括针对导致新冠肺炎的冠状病毒SARS-CoV-2。 在2020年国家卫生研究院院长先锋奖的支持下,Veesler将研究该订单的成员 翼手目 或者,更通俗地说,是蝙蝠。
为什么是蝙蝠? 韦斯勒说蝙蝠是非凡的生物。 它们是唯一能够持续飞行的哺乳动物。 它们很少得癌症,而且对于这种小动物来说,寿命异常长。 对于Veesler的研究来说,更重要的是,蝙蝠携带的病毒种类繁多,比任何其他哺乳动物都多。 尽管蝙蝠携带了所有这些病毒,但很少表现出生病的症状。 然而,它们是许多病毒的来源,这些病毒已经扩散到人类身上,造成了毁灭性的影响,包括狂犬病、埃博拉病毒、尼帕和亨德拉病毒、严重急性呼吸系统综合征冠状病毒(严重急性呼吸系统综合征冠状病毒),很可能还有严重急性呼吸系统综合征冠状病毒2型。
Veesler说,除了已经知道的蝙蝠的迷人品质之外,人类对这些飞行哺乳动物还有很多需要发现的地方,包括它们的免疫系统如何应对病毒入侵者的攻击。 例如,事实证明,蝙蝠的学习性或适应性免疫系统在很大程度上是未知领域。 因此,它提供了一个尚未开发的潜在有希望的病毒抑制剂来源,等待发掘、充分表征,然后用于指导新型抗病毒疗法的开发。
在他的研究中,Veesler将与研究世界各地蝙蝠的合作者合作,以确定其抗体产生的特征。 他想了解这些抗体是如何帮助蝙蝠耐受病毒和其他病原体的惊人能力的。 蝙蝠抗体的结构与人类抗体有什么不同? 而且,这些结构上的差异如何能成为对抗许多潜在致命病毒的新疗法的蓝图?
有趣的是,Veesler最初的拨款提议没有提到SARS-CoV-2或COVID-19。 这是因为他在中国武汉首次报道新型冠状病毒前几个月提交了这份报告。 但韦斯勒并不认为自己是一个有远见的人,他将研究范围扩大到蝙蝠。 多年来,他和其他人一直在研究密切相关的冠状病毒,这是受早期疫情的启发,包括2002年的SARS和2012年的中东呼吸综合征(MERS)(尽管MERS显然来自骆驼)。 研究人员没有看到SARS-CoV-2的到来,但他认识到未来可能爆发某种新型冠状病毒。
这些天来,Veesler实验室一直在努力研究SARS-CoV-2和人类对该病毒的免疫反应。 他的团队表明,SARS-CoV-2利用人类受体ACE2进入我们的细胞[2]。 他也是国际研究小组的成员,该小组从2003年感染SARS的人身上鉴定出一种人类抗体,称为S309。 这种抗体有望治疗新型冠状病毒[3],目前正在美国进行第三阶段临床试验。
在另一项最近的研究中,Veesler的团队绘制了数十种不同的人类抗体的图谱,这些抗体能够中和SARS-CoV-2,因为它们能够攻击已知尖峰蛋白以外的病毒靶点[4]。 这些发现可能为治疗新型冠状病毒肺炎的新型和有希望的抗体组合奠定基础,这些抗体不会因SARS-CoV-2尖峰蛋白的新变异而失效。 也许在未来,这种治疗鸡尾酒也可能包括改良的蝙蝠抗体。
工具书类 :
[1] 冠状病毒尖峰糖蛋白三聚体的冷冻电镜结构 Walls AC、Tortorici MA、Bosch BJ、Frenz B、Rottier PJM、DiMaio F、Rey FA、Veesler D.Nature。 2016年3月3日; 531(7592):114-117.
[2] SARS-CoV-2棘突糖蛋白的结构、功能和抗原性 Walls AC、Park YJ、Tortorici MA、Wall A、McGuire AT、Veesler D.Cell。 2020年4月16日; 181(2):281-292.e6。
[3] 人单克隆SARS-CoV抗体对SARS-CoV-2的交叉中和作用 .Pinto D、Park YJ、Beltramello M、Veesler D、Cortil D等,《自然》2020年5月18日【Epub提前出版】
[4] N末端结构域抗原定位揭示了SARS-CoV-2的易损位点 .McCallum M、Marco A、Lempp F、Tortorici MA、Pinto D、Walls AC、Whelan SPJ、Virgin HW、Corti D、Pizzuto MS、Veesler D等。 2021年1月14日。
链接 :
新冠肺炎研究 (国家卫生研究院)
Veesler实验室 (西雅图华盛顿大学)
Veesler项目信息 (美国国家卫生研究院报告员)
NIH主任先锋奖计划 (普通基金)
NIH支持:共同基金; 国家过敏和传染病研究所
发布时间: 创造性思维
标签: 2020年NIH董事先锋奖 , ACE2公司 , 适应性免疫系统 , 抗体 , 抗病毒药 , 蝙蝠 , 翼手目 , 冠状病毒 , 药物开发 , 免疫学 , 中东呼吸综合征 , 单克隆抗体 , 新型冠状病毒 , 非典 , SARS-CoV-2型 , 穗蛋白 , 结构生物学 , 变体 , 病毒学 , 病毒
下一页