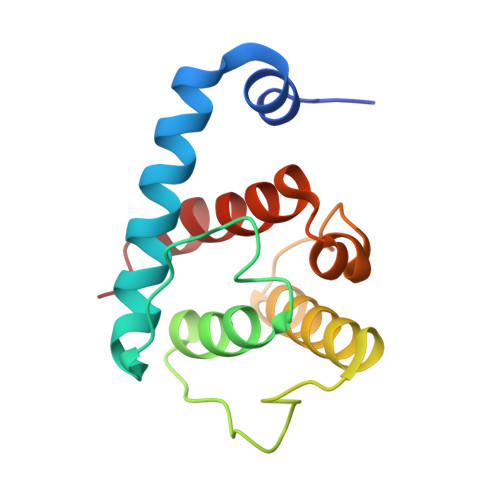
Paxillin Ld基序与Alpha-Parvin相互作用的结构分析
公共医学 : 18940607 内政部: https://doi.org/10.1016/j.str.2008.08.007 相关结构的主要引文: 2伏零电流 , 2伏零电流 , 2伏零电压 , 2VZI型 PubMed摘要: 适配器蛋白paxillin包含五个保守的富含亮氨酸(LD)基序,这些基序与多种局灶性黏附蛋白(如α-蛋白酶)相互作用。 在这里,我们报道了α-帕维蛋白C末端钙调素同源结构域(CH(C))的第一个晶体结构,分辨率为1.05 A,并表明它能够结合所有LD基序,对LD1、LD2和LD4具有一定的选择性。 具有这些LD基序的共晶结构揭示了它们与α-帕文-CH(C)上一个常见结合位点相互作用的分子细节,该结合位点位于典型褶皱边缘,包括部分CH-结构域间连接子。 令人惊讶的是,该结合位点可以在两个反平行方向上容纳LD基序。 综上所述,这些结果揭示了paxillin/alpa-parin系统中异常程度的结合简并,这可能有助于细胞内动态信号复合物的组装。