关键点
自噬是一种进化上保守的细胞过程,由饥饿和其他发育和环境因素引发。 自噬体的形成和成熟涉及细胞质在双膜结合囊泡中的隔离,并导致蛋白酶体依赖性的细胞溶质降解。 许多自噬所需的基因已经被鉴定出来,首先是在酵母中 酿酒酵母 然后在其他生物中通过同源性。 自噬的许多显微镜、药理学和生物化学检测方法已经开发出来。 对自噬所需基因的鉴定现在允许进行基因测试,以确定自噬是否参与了一个有趣的过程。 一些入侵细菌物种很容易被自噬破坏。 然而,有人认为 嗜肺军团菌 其他几种细菌可以破坏自噬成分以促进其生长。 抗病毒蛋白PKR激活的后果之一是细胞自噬增加,这可能使自噬成为细胞抗病毒反应的一个组成部分。 然而,一些阳性RNA病毒在双膜结合囊泡上复制其基因组,这些囊泡被认为来自自噬结构。 至于其他细胞对微生物的防御,一些细菌和病毒似乎已经进化出抑制或破坏自噬的机制。
摘要
主要
图1。 GFP–Atg5表达的人类细胞自噬的免疫电镜观察。
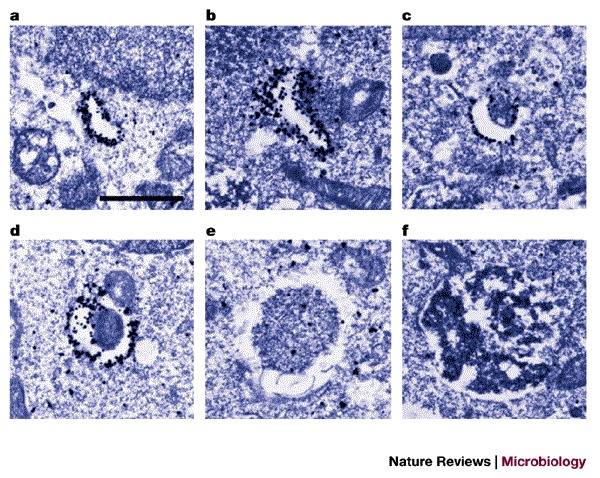
表1。
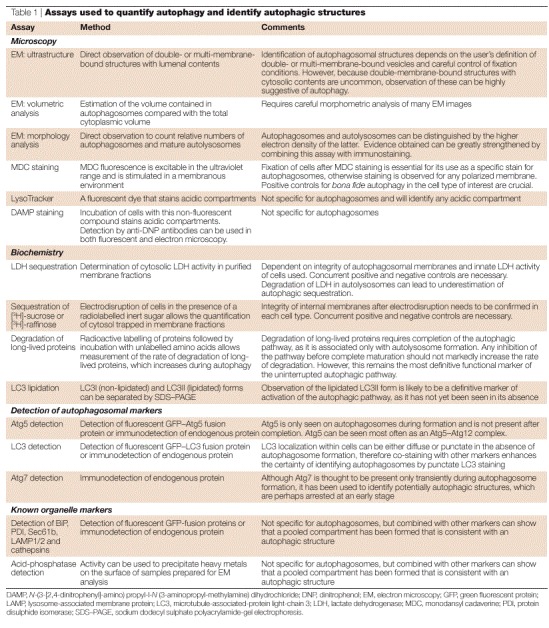
图2。 自噬途径。
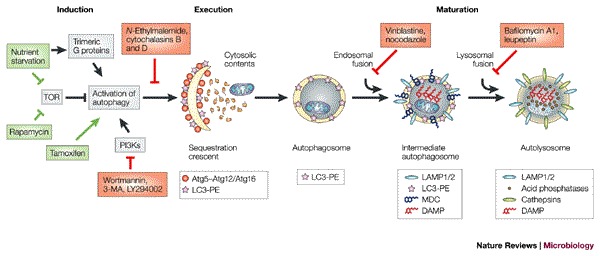
图3。 细菌的自噬隔离。
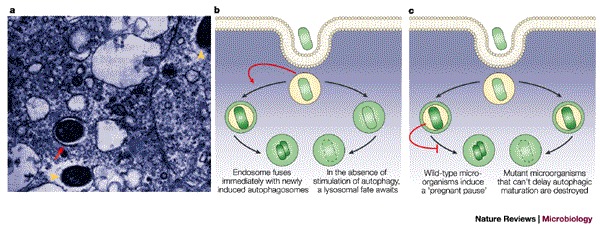
表2。
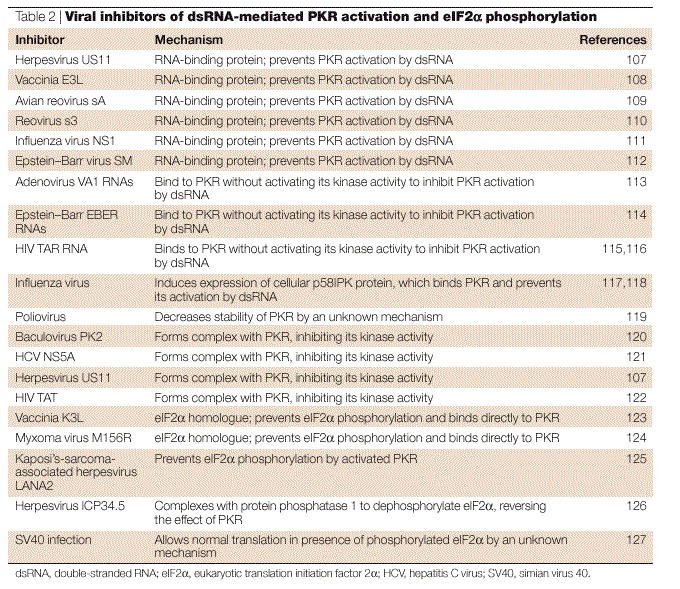
图4。 脊髓灰质炎病毒感染期间形成双膜结合囊泡。
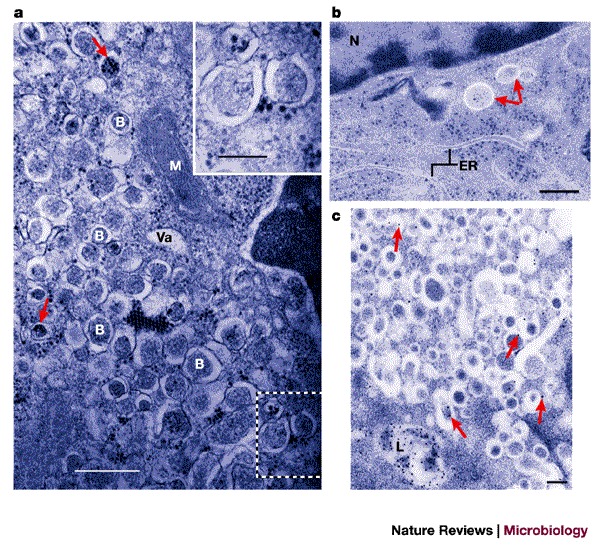
图5。 EAV感染期间双膜结合囊泡的形成以及EAV蛋白nsp2和nsp3的表达。
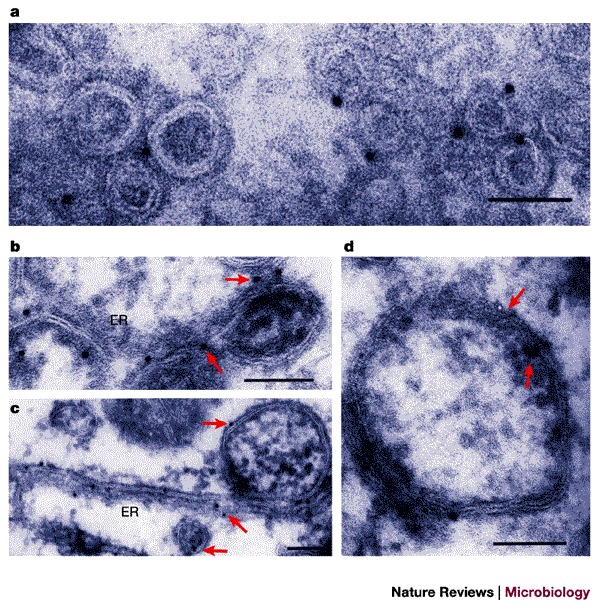
图6。 细菌和病毒对自噬途径或其成分的潜在破坏。
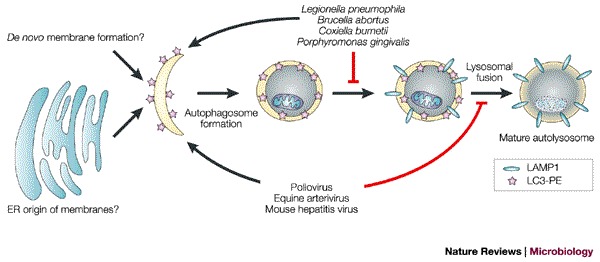
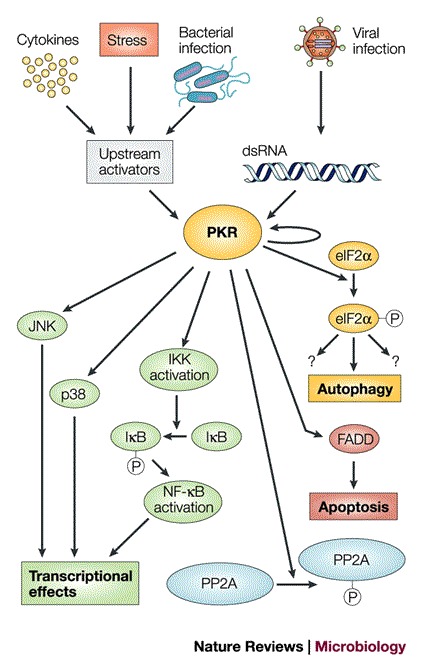
方框1 |涉及PKR的信号通路。
致谢
词汇表
道厄 一个被捕的舞台 秀丽隐杆线虫 在饥饿或过度拥挤的条件下可能形成的发展。 过氧化物酶 一种执行多种代谢功能的单膜结合细胞器。 雷帕霉素 一种抑制T和B细胞增殖的免疫抑制大环内酯,最初从 吸水链霉菌 . 塔莫西芬 用于治疗乳腺癌的雌激素拮抗剂。 俄卡达酸 一种作为肿瘤促进剂的蛋白磷酸酶的特异性抑制剂。 奥卡代酸是导致腹泻性贝类中毒的毒素。 泛素化 泛素标记的蛋白质可以被蛋白酶体识别并降解。 CATHEPSIN公司 在酸性pH范围内发挥最佳作用的溶酶体蛋白酶。 COPII公司 新合成的用于分泌的蛋白质被分类到内质网出口处包裹有COPII成分的囊泡中。
传记
相关链接
数据库
Entrez公司
本地链接
传染病信息
更多信息
竞争性利益
工具书类
-
1 Stromhaug PE,Klonsky DJ。探讨自噬的分子机制。 交通。 2001; 2:524–531。 doi:10.1034/j.1600-0854.2001.20002.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
2 Klonsky DJ等。酵母自噬相关基因的统一命名。 开发单元。 2003; 5:539–545. doi:10.1016/S1534-5807(03)00296-X。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
三。 Liang XH,等。beclin 1诱导自噬和抑制肿瘤发生。 自然。 1999; 402:672–676. doi:10.1038/45257。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
4 Melendez A等人。自噬基因对秀丽线虫的雌雄发育和寿命延长至关重要。 科学。 2003; 301:1387–1391. doi:10.1126/science.1087782。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
5 Otto GP,Wu MY,Kazgan N,Anderson OR,Kessin RH。大型自噬是盘基网柄变形虫多细胞发育所必需的。 生物学杂志。 化学。 2003; 278:17636–17645。 doi:10.1074/jbc。 M212467200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
6 Doelling JH、Walker JM、Friedman EM、Thompson AR、Vierstra RD。APG8/12-激活酶APG7是拟南芥正常养分循环和衰老所必需的。 生物学杂志。 化学。 2002年; 277:33105–33114. doi:10.1074/jbc。 M204630200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
7 Hanaoka H等人。拟南芥自噬基因的破坏加速了叶片衰老和饥饿诱导的黄化。 植物生理学。 2002年; 129:1181–1193. doi:10.1104/pp.011024。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
8 Smith JD,de Harven E.单纯疱疹病毒和人巨细胞病毒在WI-38细胞中的复制。 J.维罗尔。 1978年; 26:102–109. doi:10.1128/jvi.26.1.102-109.1978。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
9 Guidotti LG等。急性HBV感染期间病毒清除不破坏感染细胞。 科学。 1999; 284:825–829. doi:10.1126/science.284.5415.825。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
10 Schaible UE等。墨西哥利什曼原虫的寄生性液泡通过两条独立的途径从宿主细胞胞浆中获取大分子。 细胞科学杂志。 1999; 112:681–693. doi:10.1242/jcs.112.5.681。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
11 Swanson MS,Fernandez–Moreia E.巨噬细胞中微生物繁殖策略:怀孕暂停。 交通。 2002年; 3:170–177. doi:10.1034/j.1600-0854.2002.030302.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
12 Kuma A、Mizushima N、Ishihara N、Ohsumi Y。约350-kDa Apg12–Apg5–Apg16多聚物复合物的形成,由Apg16寡聚作用介导,对酵母的自噬至关重要。 生物学杂志。 化学。 2002年; 277:18619–18625. doi:10.1074/jbc。 M111889200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
13 Stromhaug PE、Berg TO、Fengsrud M、Seglen PO。 大鼠肝细胞自噬体的纯化和表征。 生物化学。 J.1998年; 335:217–224页。 doi:10.1042/bj3350217。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
14 Kopitz J、Kisen GO、Gordon PB、Bohley P、Seglen PO。 分离的大鼠肝细胞对胞浆酶的非选择性自噬。 《细胞生物学杂志》。 1990; 111:941–953. doi:10.1083/jcb.111.3.941。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
15 Mitchener JS、Shelburne JD、Bradford WD、Hawkins HK。剥夺血清和HeLa细胞中氨基酸诱导的细胞自噬细胞增多。 美国病理学杂志。 1976; 83:485–491. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
16 邓恩·瓦Jr。 自噬机制的研究:自噬空泡的形成。 《细胞生物学杂志》。 1990; 110:1923–1933年。 doi:10.1083/jcb.110.61923。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
17 Mizushima N等。使用Apg5缺陷小鼠胚胎干细胞解剖自噬体形成。 《细胞生物学杂志》。 2001; 152:657–668. doi:10.1083/jcb.152.4.657。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
18 Cutler NS,Heitman J,Cardenas ME。TOR激酶同系物在从酵母到哺乳动物的保守信号转导途径中发挥作用。 分子细胞。 内分泌。 1999; 155:135–142. doi:10.1016/S0303-7207(99)00121-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
19 Bursch W等。程序性细胞死亡的自噬和凋亡类型显示了细胞骨架丝的不同命运。 细胞科学杂志。 2000年; 113:1189–1198. doi:10.1242/jcs.113.7.1189。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
20 Ogier-Denis E,Bauvy C,Houri J,Codogno P。HT-29细胞中三聚体Gi3蛋白对大分子自噬隔离和N-连接糖蛋白细胞内转运双重控制的证据。 生物化学。 生物物理学。 Res.Commun公司。 1997; 235:166–170. doi:10.1006/bbrc.1997.6727。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
21 Petiot A、Ogier-Denis E、Blommaart EF、Meijer AJ、Codogno P。不同种类的磷脂酰肌醇3-激酶参与控制HT-29细胞中宏观自噬的信号通路。 生物学杂志。 化学。 2000年; 275:992–998. doi:10.1074/jbc.275.2.992。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
22 Pattinger S,Bauvy C,Codogno P.氨基酸通过控制人类结肠癌HT-29细胞中Raf-1的激活,干扰ERK1/2依赖性的宏观自噬控制。 生物学杂志。 化学。 2003; 276:16667–16674. doi:10.1074/jbc。 M210998200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
23 Holen I、Gordon PB、Seglen PO。 冈田酸和其他蛋白磷酸酶抑制剂抑制肝细胞自噬。 欧洲生物化学杂志。 1993; 215:113–122. doi:10.1111/j.1432-1033.1993.tb18013.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
24 Mizushima N,Sugita H,Yoshimori T,Ohsumi Y。人类新的蛋白质结合系统。 生物学杂志。 化学。 1998; 273:33889–33892. doi:10.1074/jbc.273.51.33889。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
25 Ohsumi Y.自噬的分子解剖:两个泛素样系统。 《自然》杂志分子细胞生物学版。 2001; 2:211–216。 doi:10.1038/35056522。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
26 Mizushima N等人,一种对自噬至关重要的蛋白质结合系统。 自然。 1998; 395:395–398. doi:10.1038/26506。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
27 Mizushima N,Yoshimori T,Ohsumi Y。作为Apg12结合酶的小鼠Apg10:通过结合介导的酵母双杂交方法进行分析。 FEBS信函。 2002年; 532:450–454. doi:10.1016/S0014-5793(02)03739-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
28 Tanida I、Tanika-Miyaki E、Komatsu M、Ueno T、Kominami E。酿酒酵母Apg7p的人类同源物是一种蛋白质激活酶,可用于多种底物,包括人类Apg12p、GATE-16、GABARAP和MAP-LC3。 生物化学杂志。 2002年; 276:1701–1706. doi:10.1074/jbc。 C000752200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
29 Kabeya Y等。LC3是酵母Apg8p的哺乳动物同源物,加工后定位于自噬体膜。 EMBO J.2000; 19:5720–5728。 doi:10.1093/emboj/19.21.5720。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
30 Punonen EL、Autio S、Marjomaki VS、Reunanen H.培养大鼠成纤维细胞中的自噬、组织蛋白酶L转运和酸化。 《组织化学杂志》。 细胞化学。 1992; 40:1579–1587. doi:10.1177/40.1326577。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
31 Nuoffer C、Balch WE。 GTPases:调节囊泡交通的多功能分子开关。 每年。 生物化学评论。 1994; 63:949–990. doi:10.1146/annurev.bi.63.070194.004505。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
32 Munafo DB,密歇根州科伦坡。自噬诱导导致GFP–Rab24亚细胞分布发生显著变化。 交通。 2002年; 3:472–482. doi:10.1034/j.1600-0854.2002.30704.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
33 Munafo DB,密歇根州科伦坡。研究自噬的新方法:通过氨基酸剥夺调节自噬体空泡大小。 细胞科学杂志。 2001; 114:3619–3629. doi:10.1242/jcs.114.20.3619。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
34 Beron W,Gutierrez MG,Rabinovitch M,Colombo MI。贝氏柯克斯体位于Rab7标记的具有自噬特征的小室中。 感染。 伊蒙。 2002年; 70:5816–5821. doi:10.1128/IAI.70.10.5816-5821.2002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
35 Biederbick A、Kern HF、Elsasser HP。 单丹磺酰尸胺(MDC)是一种特异的自噬空泡体内标记物。 《欧洲细胞生物学杂志》。 1995; 66:3–14. [ 公共医学 ] [ 谷歌学者 ] -
36 Seglen PO,Gordon PB。 氨基酸对离体大鼠肝细胞自噬隔离和蛋白质降解的控制。 《细胞生物学杂志》。 1984; 99:435–444. doi:10.1083/jcb.99.2.435。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
37 Kobayashi H,Sunako M,Hayashi M,Muroka Y.中国黄芪根瘤发育过程中类杆菌的DNA合成和断裂。 Biosci公司。 生物技术。 生物化学。 2001; 65:510–515. doi:10.1271/bbb.65.510。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
38 立克次体诱导的多形核白细胞中的Rikihisa Y.糖原自噬体。 阿纳特。 1984年记录; 208:319–327. doi:10.1002/ar.1092080302。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
39 Turco J,Winkler HH。 一氧化氮合酶途径在用肿瘤坏死因子-α和γ-干扰素治疗的L929细胞中抑制干扰素敏感型和干扰素耐药型普瓦泽基立克次体菌株生长中的作用。 感染。 伊蒙。 1993; 61:4317–4325. doi:10.128/iai.61.10.4317-325.1993。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
40 Turco J、Liu H、Gottlieb SF、Winkler HH。 一氧化氮介导抑制普氏立克次体感染小鼠成纤维细胞和小鼠巨噬细胞样细胞的能力。 感染。 伊蒙。 1998; 66:558–566. doi:10.1128/iai.66.2558-566.1998。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
41 Feng HM、Wen J、Walker DH。 南方立克次体感染:一种高度侵袭性血管病性立克次体病的小鼠模型。 美国病理学杂志。 1993; 142:1471–1482. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
42 Walker DH、Popov VL、Crocquet-Valdes PA、Welsh CJ、Feng HM。小鼠内皮细胞的细胞因子诱导的一氧化氮依赖性细胞内抗立克次体活性。 实验室投资。 1997; 76:129–138. [ 公共医学 ] [ 谷歌学者 ] -
43 Rich KA、Burkett C、Webster P.细胞质细菌可以作为自噬的靶点。 单元格。 微生物。 2003; 5:455–468. doi:10.1046/j.1462-5822.2003.00292.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
44 Hersh D等。沙门氏菌侵袭素SipB通过结合caspase-1诱导巨噬细胞凋亡。 程序。 美国国家科学院。 科学。 美国1999年; 96:2396–2401. doi:10.1073/pnas.96.5.2396。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
45 Hernandez LD、Pypaert M、Flavell RA、Galan JE。一种沙门氏菌蛋白通过诱导自噬导致巨噬细胞死亡。 《细胞生物学杂志》。 2003; 163:1123–1131. doi:10.1083/jcb.200309161。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
46 Progulske-Fox A等。牙龈卟啉单胞菌的毒力因子和心血管系统细胞的侵袭。 牙周病杂志。 1999年决议; 34:393–399. doi:10.1111/j.1600-0765.1999.tb02272.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
47 Dorn BR,Dunn WA,Jr,Progulske Fox A.牙龈卟啉单胞菌向人冠状动脉内皮细胞中的自噬体转运。 感染。 伊蒙。 2001; 69:5698–5708. doi:10.1128/IAI.69.95698-5708.2001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
48 Pizarro-Cerda J等。流产布鲁氏菌通过自噬途径转运,并在非专业吞噬细胞的内质网中复制。 感染。 伊蒙。 1998; 66:5711–5724. doi:10.1128/iai.66.12.5711-5724.1998。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
49 Pizarro-Cerda J、Moreno E、Sanguedolce V、Mege JL、Gorvel JP。流产毒菌可阻止溶酶体融合,并分布在自噬体样隔室中。 感染。 伊蒙。 1998; 66:2387–2392. doi:10.1128/iai.66.5.2387-2392.1998。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
50 Comerci DJ、Martinez-Lorenzo MJ、Sieira R、Gorvel JP、Ugalde RA。 病毒B机制在含流产布鲁氏菌液泡成熟中的重要作用。 单元格。 微生物。 2001; 3:159–168。 doi:10.1046/j.1462-5822.2001.00102.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
51 Delrue RM等。布鲁氏菌细胞内贩运相关基因的鉴定。 单元格。 微生物。 2001; 3:487–497. doi:10.1046/j.1462-5822.2001.00131.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
52 Dorn BR,Dunn WA,Jr,Progulske-Fox A.细菌与自噬途径的相互作用。 单元格。 微生物。 2002年; 4:1–10. doi:10.1046/j.1462-5822.002.00164.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
53 Sturgill-Koszycki S,Swanson MS。嗜肺军团菌复制液泡成熟为酸性内吞细胞器。 《实验医学杂志》,2000年; 192:1261–1272. doi:10.1084/jem.192.9.1261。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
54 Swanson MS,Isberg RR。嗜肺军团菌与巨噬细胞内质网的相关性。 感染。 伊蒙。 1995; 63:3609–3620. doi:10.1128/iai.63.9.3609-3620.1995。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
55 Joshi AD,Sturgill-Koszycki S,Swanson MS。点依赖和独立因子将嗜肺军团菌吞噬体从小鼠巨噬细胞内吞网络中分离出来的证据。 单元格。 微生物。 2001; 3:99–114. doi:10.1046/j.1462-5822.2001.00093.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
56 Coers J等人。鉴定在嗜肺军团菌细胞内生长所允许的细胞器的生物发生中发挥不同作用的Icm蛋白复合物。 微生物摩尔数。 2000年; 38:719–736. doi:10.1046/j.1365-2958.2000.02176.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
57 Berger KH,Isberg RR。嗜肺军团菌中的单一基因位点补充了细胞内生长的两种不同缺陷。 微生物摩尔数。 1993; 7:7–19. doi:10.1111/j.1365-2958.1993.tb01092.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
58 Berger KH、Merriam JJ、Isberg RR。与嗜肺军团菌dotA基因突变相关的细胞内靶向性改变。 微生物摩尔数。 1994; 14:809–822. doi:10.1111/j.1365-2958.1994.tb01317.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
59 Marra A、Blander SJ、Horwitz MA、Shuman HA。 人类巨噬细胞细胞内增殖所需嗜肺军团菌基因座的鉴定。 程序。 美国国家科学院。 科学。 美国1992年; 89:9607–9611. doi:10.1073/pnas.89.20.9607。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
60 Sexton JA,Vogel JP。细胞内病原体的IVB型分泌。 交通。 2002年; 3:178–185. doi:10.1034/j.1600-0854.2002.030303.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
61 Vogel JP、Andrews HL、Wong SK、Isberg RR。嗜肺军团菌毒力系统的共轭传递。 科学。 1998; 279:873–876. doi:10.1126/science.279.5352.873。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
62 Nagai H、Kagan JC、Zhu X、Kahn RA、Roy CR。细菌鸟嘌呤核苷酸交换因子激活军团菌吞噬体上的ARF。 科学。 2002年; 295:679–682. doi:10.1126/science.1067025。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
63 Tilney LG,Harb OS,Connely PS,Robinson CG,Roy CR。寄生细菌嗜肺军团菌如何修饰其吞噬体并将其转化为粗糙的内质网:对质膜转化为内质网膜的影响。 细胞科学杂志。 2001; 114:4637–4650. doi:10.1242/jcs.114.24.4637。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
64 卡根JC,罗伊CR。军团菌吞噬体从内质网出口位置拦截水泡交通。 自然细胞生物学。 2002年; 4:945–954. doi:10.1038/ncb883。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
65 Otto GP等。在盘基网柄菌中嗜肺军团菌的细胞内复制中,大型自噬是必不可少的。 微生物摩尔数。 2004; 51:63–72. doi:10.1046/j.1365-2958.2003.03826.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
66 Akporiaye ET、Rowatt JD、Aragon AA、Baca OG。 持续感染贝氏柯克斯体小鼠巨噬细胞样细胞系的溶酶体反应。 感染。 伊蒙。 1983; 40:1155–1162. doi:10.1128/iai.40.3.1155-1162.1983。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
67 Chen SY、Vodkin M、Thompson HA、Williams JC。 在没有宿主细胞的情况下,分离的贝氏柯克斯体在酸活化期间合成DNA。 《遗传学微生物学杂志》。 1990; 136:89–96. doi:10.1099/00221287-136-1-89。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
68 Burton PR、Stueckemann J、Welsh RM、Paretsky D。贝氏立克次体持续感染小鼠L细胞和绿猴肾(Vero)细胞的一些超微结构影响。 感染。 伊蒙。 1978年; 21:556–566. doi:10.1128/iai.21.2556-566.1978。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
69 哈克斯塔特T,威廉姆斯JC。 贝氏柯克斯体专性寄生真核细胞的生化策略。 程序。 美国国家科学院。 科学。 美国1981年; 78:3240–3244. doi:10.1073/pnas.78.5.3240。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
70 Heinzen RA,Hackstadt T,Samuel JE。贝氏柯克斯体的发育生物学。 微生物趋势。 1999; 7:149–154。 doi:10.1016/S0966-842X(99)01475-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
71 Heinzen RA,Scidmore MA,Rockey DD,Hackstadt T.与内吞和外吞途径的差异相互作用区分了贝氏柯克斯体和沙眼衣原体的寄生液泡。 感染。 伊蒙。 1996; 64:796–809. doi:10.1128/iai.64.3.796-809.1996。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
72 Zamboni DS、McGrath S、Rabinovitch M、Roy CR。贝氏柯克斯体表达IV型分泌系统蛋白,其功能类似于嗜肺军团菌Dot/Icm系统的成分。 微生物摩尔数。 2003; 49:965–976. doi:10.1046/j.1365-2958.2003.03626.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
73 Papini E,Zoratti M,Cover-TL。寻找幽门螺杆菌VacA的作用机制。 有毒。 2001; 39:1757–1767. doi:10.1016/S0041-0101(01)00162-3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
74 Molinari M等。幽门螺杆菌毒素诱导的液泡含有晚期内体和溶酶体标志物。 生物学杂志。 化学。 1997; 272:25339–25344. doi:10.1074/jbc.272.40.25339。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
75 Catrenich CE,Chestnut MH.幽门螺杆菌细胞毒素诱导哺乳动物细胞空泡的特征和起源.医学微生物学杂志。 1992; 37:389–395. doi:10.1099/00222615-37-6-389。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
76 Leib DA、Machalek MA、Williams BR、Silverman RH、Virgin HW。 通过敲除宿主抗性基因来恢复减毒病毒的特定表型。 程序。 美国国家科学院。 科学。 美国2000年; 97:6097–6101. doi:10.1073/pnas.100415697。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
77 Williams,B.R.通过PKR进行信号集成。 科学。 STKE 2001年 &它; http://stke.sciencemag.org/cgi/content/full/OC_sigtrans ; 2001/89/re2 >; (2001年)。 [ 内政部 ] [ 公共医学 ] -
78 Talloczy Z等。通过eIF2α激酶信号通路调节饥饿和病毒诱导的自噬。 程序。 美国国家科学院。 科学。 美国2002年; 99:190–195. doi:10.1073/pnas.012485299。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
79 Dales S,Eggers HJ,Tamm I,Palade GE。脊髓灰质炎病毒形成的电镜研究。 病毒学。 1965; 26:379–389. doi:10.1016/0042-6822(65)90001-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
80 Bienz K,Egger D,Pfjister T,Troxler M.脊髓灰质炎病毒复制复合物的结构和功能特征。 J.维罗尔。 1992; 66:2740–2747. doi:10.1128/jvi.66.5.2740-2747.1992。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
81 Bolton R等,通过链特异性荧光原位杂交显示脊髓灰质炎病毒正链和负链RNA的细胞内定位。 J.维罗尔。 1998; 72:8578–8585。 doi:10.1128/jvi.72.11.8578-8585.1998。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
82 Dubuisson J,Penin R,Moradpour D.丙型肝炎病毒蛋白与宿主细胞膜和脂质的相互作用。 趋势单元格。 生物杂志,2002年; 12:517–523. doi:10.1016/S0962-8924(02)02383-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
83 Miller DJ、Schwartz MD、Dye BT、Ahlquist P.将病毒RNA复制复合物重新定位到另一种细胞膜。 J.维罗尔。 2003; 77:12193–12202. doi:10.1128/JVI.77.22.12193-1202.2003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
84 Suhy DA、Giddings THJr、Kirkegaard K。通过脊髓灰质炎病毒感染和单个病毒蛋白重塑内质网:病毒诱导小泡的自噬样起源。 J.维罗尔。 2000年; 74:8953–8965. doi:10.128/JVI.74.19.8953-965.2000。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
85 Schlegel A,Giddings TH,Ladinsky MS,Kirkegaard K.脊髓灰质炎病毒感染期间诱导的细胞膜的细胞起源和超微结构。 J.维罗尔。 1996; 70:6576–6588. doi:10.1128/jvi.70.10.6576-6588.1996。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
86 Bravo A,Salas M.噬菌体F29复制蛋白p1聚合成原丝板。 EMBO J.1998; 17:6096–6105. doi:10.1093/emboj/17.20.6096。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
87 Serrano-Heras G,Salas M,Bravo A.噬菌体F29复制蛋白p1体内组装成膜相关多聚体结构。 生物学杂志。 化学。 2003; 278:40771–40777. doi:10.1074/jbc。 M306935200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
88 Lyle JM、Bullitt E、Bienz K、Kirkegaard K。RNA依赖性RNA聚合酶晶格的可视化和功能分析。 科学。 2002年; 296:2218–2222. doi:10.1126/science.1070585。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
89 Rust RC等。细胞COPII蛋白参与形成脊髓灰质炎病毒复制复合物的囊泡的产生。 J.维罗尔。 2001; 75:9808–9818. doi:10.1128/JVI.75.20.9808-9818.2001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
90 Hamasaki M,Noda T,Ohsumi Y。早期分泌途径有助于酵母自噬。 单元格结构。 功能。 2003; 28:49–54. doi:10.247/csf28.49。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
91 Ishihara N等人。自噬体的形成需要特定的早期Sec蛋白,而NSF/SNARE则需要空泡融合。 分子生物学。 单元格。 2001; 12:3690–3702. doi:10.1091/mbc.12.11.3690。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
92 Dubois-Dalcq M,Holmes KV,Rentier B.包膜RNA病毒的组装。 1984 [ 谷歌学者 ] -
93 Gosert R、Kanjanahaluethai A、Egger D、Bienz K、Baker SC。小鼠肝炎病毒的RNA复制发生在双层囊泡中。 J.维罗尔。 2002年; 76:3697–3708. doi:10.1128/JVI.76.8.3697-3708.2002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
94 Pederson KW、van der Meer Y、Roos N、Snijder EJ。 动脉病毒复制酶的开放阅读框1a编码亚单位诱导内质网衍生的双膜小泡携带病毒复制复合体。 J.维罗尔。 1999; 73:2016–2026. doi:10.128/jvi.73.3.2016-2026.1999。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
95 Goldsmith CS等。SARS冠状病毒的超微结构特征。 突发感染。 数字化信息系统。 2004; 10:320–326. doi:10.3201/eid1002.030913。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
96 Shi ST,等。小鼠肝炎病毒基因1产物的克隆化和膜结合以及感染细胞中从头合成的病毒RNA。 J.维罗尔。 1999; 73:5957–5969. doi:10.1128/jvi.73.7.5957-5969.1999。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
97 van der Meer Y、van Tol H、Locker JK、Snijder EJ。 ORF1a-编码的复制酶亚单位参与动脉病毒复制复合体的膜结合。 J.维罗尔。 1998; 72:6689–6698. doi:10.1128/jvi.72.8.6689-6698.1998。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
98 Prentice,E.、Jerome,W.G.、Yoshimori,T.、Mizushima,N.和Denison,M.R.冠状病毒复制复合体的形成利用了细胞自噬的成分。 生物学杂志。 化学。 2003年12月29日[Epub提前印刷]。 首次使用哺乳动物宿主遗传学来研究自噬所需基因的作用, APG5(APG5) 在RNA-病毒复制中; 在没有该基因的情况下,细胞外病毒的产量减少了1000倍。 -
99 van der Meer Y等。小鼠肝炎病毒非结构蛋白的定位和RNA合成表明晚期内体在病毒复制中的作用。 J.维罗尔。 1999; 73:7641–7657. doi:10.1128/jvi.73.9.7641-7657.1999。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
100 Snijder EJ、van Tol H、Roos N、Pedersen KW。非结构蛋白2和3在动脉病毒复制复合物形成过程中相互作用,修饰宿主细胞膜。 《病毒遗传学杂志》。 2001; 82:985–994. doi:10.1099/0022-1317-82-5-985。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
101 Gorbalenya AE、Koonin EV、Donchenko AP、Blinov VM。 NTP结合基序是参与阳性RNA病毒复制的高度分化的单系蛋白质组中最保守的序列。 《分子进化杂志》。 1989; 28:256–268. doi:10.1007/BF02102483。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
102 Tucker SP,Thornton CL,Wimmer E,Compans RW。极化人类肠上皮细胞的脊髓灰质炎病毒载体释放。 J.维罗尔。 1993; 67:4274–4282. doi:10.1128/jvi.67.7.4274-4282.1993。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
103 考夫曼RJ。基因表达的翻译控制。 2000年,第503-527页。 [ 谷歌学者 ] -
104 Harding HP、Zhang Y、Bertolotti A、Zeng H、Ron D.Perk对未展开蛋白反应期间的翻译调节和细胞存活至关重要。 分子细胞。 2000年; 5:897–904. doi:10.1016/S1097-2765(00)80330-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
105 Scheuner D等。未折叠蛋白反应和体内葡萄糖稳态需要翻译控制。 分子细胞。 2001; 7:1165–1176。 doi:10.1016/S1097-2765(01)00265-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
106 He B,Gross M,Roizman B。单纯疱疹病毒1的γ134.5蛋白具有蛋白磷酸酶1调节亚单位的结构和功能属性,并与感染细胞中的酶形成高分子量复合物。 生物学杂志。 化学。 1998; 273:20727–20743. doi:10.1074/jbc.273.33.20737。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
107 Poppers J,Mulvey M,Khoo D,Mohr I.通过单纯疱疹病毒1型Us11蛋白的富含脯氨酸的RNA结合域抑制PKR激活。 J.维罗尔。 2000年; 74:11215–11221. doi:10.1128/JVI.74.23.11215-11221.2000。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
108 Stark GR、Kerr IM、Williams BRG、Silverman RH、Schreiber RD。痘苗病毒E3L基因产物与PKR的调节区和底物结合区相互作用:对PKR自动调节的影响。 病毒学。 1998; 250:302–325. doi:10.1006/viro.1998.9365。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
109 Gonzalez-Lopez C,Martinez Costas J,Esteban M,Benavente J.禽呼肠孤病毒σA蛋白是双链RNA依赖性蛋白激酶抑制剂的证据。 维罗尔将军。 2003; 84:1629–1639. doi:10.1099/vir.0.19004-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
110 Lloyd RM,Shatkin AJ公司。 呼肠孤病毒多肽σ3的翻译刺激:取代VAI RNA并抑制真核启动因子2α亚基的磷酸化。 J.维罗尔。 1992; 66:6878–6884. doi:10.1128/jvi.66.12.6878-6884.1992。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
111 Lu Y,Wambach M,Katze MG,Krug RM。流感病毒NS1蛋白与双链RNA的结合抑制磷酸化elF-2翻译起始因子的蛋白激酶的激活。 病毒学。 1995; 214:222–228. doi:10.1006/viro.1995.9937。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
112 Poppers J、Mulvey M、Perez C、Khoo D、Mohr I.可调节PKR活化的溶性周期爱泼斯坦-巴尔病毒基因产物的鉴定。 J.维罗尔。 2003; 77:228–236. doi:10.1128/JVI.77.1.228-236.2003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
113 Patel G,Jones NC。杆状病毒产生的E1A蛋白在体外激活RNA聚合酶II和III定向转录。 《核酸研究》1990; 18:2909–2915. doi:10.1093/nar/18.10.2909。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
114 Clemens MJ等。小RNA对干扰素诱导的eIF-2α蛋白激酶的调节。 生物化学。 1994; 76:770–778. doi:10.1016/0300-9084(94)90081-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
115 Gunnery S,Mathews MB。 RNA结合和PKR活性的调节。 方法。 1998; 15:189–198. doi:10.1006/meth.1998.0623。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
116 Gunnery S、Rice AP、Robertson HD、Mathews MB。 人类免疫缺陷病毒1的Tat-responsive区域RNA可以阻止双链RNA活化蛋白激酶的激活。 程序。 美国国家科学院。 科学。 美国,1990年; 87:8687–8691. doi:10.1073/pnas.87.22.8687。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
117 Tan SL,Katze MG。甲型流感病毒NS1蛋白和干扰素诱导的PKR蛋白激酶之间复杂形成的生化和遗传证据。 《干扰素细胞因子研究杂志》,1998年; 18:757–766. doi:10.1089/jir.1998.18.757。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
118 Bilgin DD,Liu Y,Schiff M,Dinesh-Kumar SP.P58IPK,一种双链RNA依赖蛋白激酶PKR抑制剂的植物同源基因,在病毒发病中起作用。 开发单元。 2003; 4:651–661. doi:10.1016/S1534-5807(03)00125-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
119 Black TL、Safer B、Hovanesian A、Katze MG。细胞68000-Mr蛋白激酶在脊髓灰质炎病毒感染期间高度自磷酸化和活化,但显著降解:翻译调控的意义。 J.维罗尔。 1989; 第63:2244–2251页。 doi:10.128/jvi.63.5.2244-2251.1989。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
120 Dever TE等。病毒截短真核生物翻译起始因子2α激酶同源物对细胞翻译控制的破坏。 程序。 美国国家科学院。 科学。 美国1998年; 95:4164–4169. doi:10.1073/pnas.95.8.4164。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
121 Gale MJJr,Korth MJ,Katze MG。丙型肝炎病毒NS5A蛋白对PKR蛋白激酶的抑制:干扰素抵抗的潜在机制。 临床。 诊断。 维罗尔。 1998; 10:157–162. doi:10.1016/S0928-0197(98)00034-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
122 品牌SR、小林R、马修斯MB。 人类免疫缺陷病毒1型的Tat蛋白是干扰素诱导的病毒活化蛋白激酶PKR的底物和抑制剂。 生物学杂志。 化学。 1997; 272:8388–8395. doi:10.1074/jbc.272.13.8388。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
123 Carroll K,Elroy-Stein O,Moss B,Jagus R.重组痘苗病毒K3L基因产物阻止双链RNA依赖性启动因子2α特异性蛋白激酶的激活。 生物学杂志。 化学。 1993; 268:12837–12842. [ 公共医学 ] [ 谷歌学者 ] -
124 Ramelot TA等。粘液瘤病毒免疫调节蛋白M156R是真核翻译起始因子eIF2α的结构模拟物。 分子生物学杂志。 2002年; 322:943–954. doi:10.1016/S0022-2836(02)00858-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
125 Esteban M等。卡波西肉瘤相关疱疹病毒的潜伏蛋白LANA2抑制dsRNA-活化蛋白激酶诱导的凋亡,但不抑制RNase L激活。 《病毒遗传学杂志》。 2003; 84:1463–1470. doi:10.1099/vir.0.19014-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
126 He B,Gross M,Roizman B。单纯疱疹病毒1的γ134.5蛋白与蛋白磷酸酶1α复合,使真核生物翻译起始因子2的α亚基去磷酸化,并阻止双链RNA活化蛋白激酶阻断蛋白质合成。 程序。 美国国家科学院。 科学。 美国1997年; 94:843–848. doi:10.1073/pnas.94.3.843。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
127 Swaminathan S、Rajan P、Savinova O、Jagus R、Thimmapaya B。猿猴病毒40 large-T绕过elF-2α磷酸化引起的翻译障碍。 病毒学。 1996; 219:321–323。 doi:10.1006/viro.1996.0255。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
128 罗志清,伊斯伯格RR。通过细菌间蛋白转移鉴定嗜肺军团菌Dot/Icm系统的多底物。 程序。 美国国家科学院。 科学。 美国2004年; 101:841–846. doi:10.1073/pnas.0304916101。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]


