背景
子宫内膜异位症是一种常见的多因素妇科疾病,其特征是子宫外异常位置存在子宫内膜样组织。据估计,全世界10%至15%的育龄妇女患有子宫内膜异位症[1]. 该病有多种表现,如痛经、慢性盆腔疼痛、不孕症和癌性病变,可严重影响患者的生活质量[2,三]. 目前诊断子宫内膜异位症的金标准是腹腔镜手术[4]. 当生育年龄的女性可以选择通过其他治疗暂时缓解疼痛症状时,她们不太可能接受这样的侵入性手术。然而,目前可用的技术,包括成像方法或实验室开发的平台,都不是腹腔镜的合适替代品[5,6]. 因此,迫切需要更好地了解子宫内膜异位症进展的分子机制,并确定新的、更有效的诊断预测因子,以准确识别疾病,从而找到最佳治疗策略。
miRNAs是一种小的非编码RNA,长度约为20至24个核苷酸,通过与mRNAs的3′非翻译区(UTR)配对并触发RNA降解或翻译抑制,在转录后水平调节靶基因表达[7]. 这些miRNAs参与多种生物过程,如细胞迁移、侵袭和凋亡[8,9]. 作为转录调节因子,miRNAs的异常表达通常导致参与包括子宫内膜异位症在内的各种疾病的发生和发展的靶基因表达失调,这表明它们是很好的候选生物标志物和潜在的治疗靶点[10–12]. 然而,反映子宫内膜异位症进展的异位内膜的miRNA图谱尚不清楚。
为了解决这个问题,我们进行了当前的研究,以研究子宫内膜异位症进展中异位内膜差异表达miRNA的潜在分子机制及其临床相关性,探索其在诊断和治疗中的潜在临床应用。
材料和方法
临床标本
收集子宫内膜异位症患者的异位子宫内膜组织和血清,以及II–III级宫颈上皮内瘤变或子宫平滑肌瘤患者的正常子宫内膜组织及子宫切除术的血清。术前进行病理诊断,术后确认。所有临床标本均根据伦理和法律标准于2006年至2012年间从珠江医院(中华人民共和国广州)妇科获得。接受激素治疗或并发恶性肿瘤的患者被排除在外。子宫内膜异位症患者的特征在附加文件中描述1:表S1。
miRNA微阵列
安捷伦正常子宫内膜miRNA芯片21.0(n个 = 3) 和异位子宫内膜(n个 = 3) 由广东龙视生物医药有限公司建立,并通过GeneSpringGX软件11.0(Agilent)进行分析。
原代子宫内膜基质细胞的分离和细胞培养
如前所述,分离出原代正常和异位子宫内膜基质细胞[13]. 简单地说,异位子宫内膜组织被切碎并在含有胶原酶(1)的磷酸盐缓冲盐水(PBS)中消化 毫克/毫升,15 U/mg)和1%青霉素/链霉素60 在37度的轨道振动器中的最小值 摄氏度。将获得的均质细胞悬浮液置于T25细胞培养瓶中(Corning),并在杜尔贝科改良Eagle培养基(DMEM)/火腿F12(1:1)中与10%胎牛血清(FBS,Gibco)和生物抗生素(100 IU/mL青霉素和100 μg/mL链霉素)。通过免疫荧光染色检测波形蛋白(ab8978,Abcam)和细胞角蛋白(ab76126,Abcam)抗体的细胞纯度。在第3代和第5代之间使用原代子宫内膜基质细胞。
慢病毒稳定转染
含有miR-205-5p过表达序列的慢病毒及其阴性对照均购自GeneChem Inc.。用慢病毒-205转染原代异位子宫内膜基质细胞,并通过流式细胞仪选择表达绿色荧光蛋白信号的多克隆细胞进行进一步实验。
用寡核苷酸和质粒瞬时转染
miR-205-5p模拟物及其阴性对照物或miR-205-5 p抑制剂及其阴性对照由RiboBio Inc.设计和克隆。ANGPT2编码序列(无3′-UTR)克隆到pCDNA3.1(+)-载体(Invitrogen)中。空向量用作空白控件。siVASH1及其阴性对照siRNA由GenePharma Inc.设计和合成。然后根据制造商的方案,使用Lipofectamine 2000试剂(Invitrogen)转染miR-205-5p模拟物和抑制剂纤溶酶-ANGPT2和siANGPT2。对于RNA提取、western blot和体外功能检测,使用细胞48 转染后h。siANGPT2和siRNA的序列如附加文件所示1:表S2。
RNA提取和定量逆转录聚合酶链反应
使用miRNeasy Mini试剂盒(Qiagen,217004)从临床标本、血清样本、原代细胞和异种移植病灶中提取RNA。qRT-PCR是根据我们先前研究的方案进行的[14]. miRNAs和U6的特异性引物组购自RiboBio Inc.。miRNAs和mRNAs的表达分别归一化为U6和甘油醛-3-磷酸脱氢酶(GAPDH)。引物序列显示在附加文件中1:表S2。
免疫组织化学
如前所述,对临床标本和异种移植病灶进行免疫组织化学(IHC)分析[15]. 主要抗体为抗ANGPT2(ab56301,Abcam)和抗Annexin V抗体(ab14196,Abcam)。次要抗体为辣根过氧化物酶结合抗兔免疫球蛋白G抗体(ab6721,Abcam)。
原位杂交
如前所述进行原位杂交(ISH)[16]. 简单地说,与H孵育后2O(运行)2,37岁时用胃蛋白酶处理组织切片 2°C 最少清洗并预混合4次 37小时 摄氏度。37岁时与地高辛标记的miR-205-5p LNA探针(Exiqon)发生杂交 °C过夜。然后在37岁时清洗这些部分 °C,与生物素化小鼠抗地高辛孵育1 37小时 摄氏度。通过添加3,3-二氨基联苯胺并用苏木精复染来观察染色。
着色评估
两名独立的病理学家分别对IHC和ISH染色组织切片进行审查和评分。为了半定量评估组织切片中ANGPT2、膜联蛋白V和miR-205-5p的表达,如前所述,应用德国免疫反应评分[17]. 结合阳性染色细胞比例和染色强度计算免疫组化评分。染色强度按1至4分制评分,1分表示无染色,2分表示弱染色,3分表示中度染色,4分表示强染色。无染色得分为0;1~10%as1染色;11至50%作为2;51至80%作为3;81%至100%为4。将原始数据乘以数量分数和强度分数,转换为IHS。IHS为4或更大的组织被定义为高表达;IHS小于4的组织被定义为低表达。
动物模型
雌性裸鼠(6只 周龄)购自南方医科大学实验动物中心(中华人民共和国广州)。这些研究得到了南方医科大学动物研究伦理委员会的批准。如前所述,子宫内膜异位症小鼠模型在南方医科大学实验动物中心建立[10]. 简单地说,1 × 107将异位子宫内膜基质细胞与腺体细胞(1:1)混合皮下注射到每只裸鼠的侧翼(n个 = 6,每组)。病变大小(mm三)每4次测量一次 天数,按以下公式计算:体积 = (宽度)2 × 长度/2。小鼠被安乐死30 日后注射人异位子宫内膜细胞,评价子宫内膜异位症的程度。
蛋白质印迹分析
Western blot分析与我们之前的研究相同[14]. 附加文件中提供了详细的抗体信息1:表S3。
其他方式
根据制造商的方案进行荧光素酶报告试验、伤口愈合试验、ELISA试验、Transwell侵袭试验和凋亡试验。有关详细信息,请参阅附加文件2:补充材料和方法。
统计分析
统计分析采用SPSS V.13.0软件。数据表示为平均值 ± 标准偏差(SD)。双尾学生t吨组间比较采用方差分析(ANOVA)。分类变量采用Fisher或chi-square检验。多元相关分析采用偏相关分析。Cox回归模型用于单变量和多变量分析。当P(P) < 0.05.
结果
子宫内膜异位症中miR-205-5p作为负性病理miRNA的鉴定
为了确定子宫内膜异位症的miRNA差异,正常子宫内膜(EN)的miRNA表达谱(n个 = 3) 和异位子宫内膜(EC)(n个 = 3) 通过安捷伦miRNA微阵列21.0。使用2倍的更换和P(P) < 0.05作为阈值界限,我们发现16个miRNA在EN和EC之间存在显著差异(图1a) ●●●●。在用于微阵列分析的相同组织中,通过qRT-PCR验证了16个miRNA的差异表达。结果表明,4.89 ± miR-205-5p低水平的0.51倍,4.37 ± miR-4497低水平的0.53倍,4.13 ± miR-3154水平高0.38倍,和3.46 ± EC中miR-3926的水平是EN的0.39倍(图1b) ●●●●。miR-205-5p在4种代表性miRNAs中表现出最大的下调作用,表明miR-205-5可能是进一步研究的最佳候选。
图1。
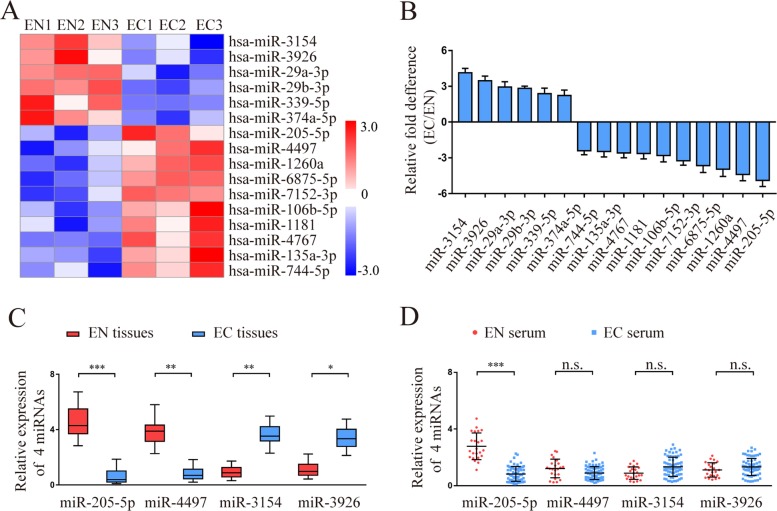
子宫内膜异位症中miR-205-5p作为负性病理miRNA的鉴定。一不同基因型间miRNA表达谱的差异(n个 = 3) 和EC(n个 = 3) 各组通过miRNA微阵列进行分析。热图显示,具有代表性的miRNA与子宫内膜异位症显著相关。EN1、EN2和EN3表示3个正常子宫内膜;EC1、EC2和EC3显示3个异位子宫内膜。b条通过qRT-PCR分析用于微阵列分析的子宫内膜中16种差异表达的miRNA的水平。c(c),d日通过qRT-PCR验证了来自EN的其他组织和血清中miR-205-5p、miR-4497、miR-3154和miR-3926的水平(n个 = 23)和EC(n个 = 68)组。EN,正常子宫内膜;EC,异位子宫内膜。误差条代表平均值 ± 3个独立实验的SD。n.s.,不重要*P(P) < 0.05; **P(P) < 0.01; ***P(P) < 0.001
为了进一步确认4种具有代表性的miRNAs(miR-205-5p、miR-4497、miR-3154、miR-3926)、其他组织和来自EN的血清样本的统计意义(n个 = 23)和EC(n个 = 68)组采用qRT-PCR进行分析。与EN组相比,EC组的组织和血清样本中miR-205的水平显著降低(图1c、 d)。综上所述,这些结果表明miR-205-5p的低水平表达可能与子宫内膜异位症的进展有关。
miR-205-5p在体外抑制子宫内膜异位症衍生的子宫内膜基质细胞的迁移和侵袭,但促进细胞凋亡
为了研究EN和EC间质细胞的功能差异,我们分离了两个原发性异位子宫内膜间质细胞EC109和EC520,以及两个原代正常子宫内膜间质细胞EN211和EN307。免疫荧光染色显示波形蛋白和细胞角蛋白均在EC和EN基质细胞中表达(附加文件三:图S1A)。此外,在E2和醋酸甲羟孕酮(MPA)的存在下,细胞从纺锤形转变为大型多边形细胞,并显著增加PRL分泌(附加文件三:图S1B&C),表明诱导的子宫内膜基质细胞在体外成功分化。总的来说,这些结果与之前的研究一致[18,19]表明分离的EC109、EC520、EN211和EN307细胞为子宫内膜基质细胞。
为了进一步探讨miR-205-5p在体外子宫内膜异位症中的抑制作用,我们构建了表达miR-205-5 p的慢病毒载体,并在慢病毒转染后建立了miR-205-5p过度表达EC109和EC520细胞(附加文件4:图S2A)。与阴性对照组(NC)相比,Lenti-miR-205-5p转染的EC109和EC520细胞中miR-205-5p表达增加了500倍以上(附加文件4:图S2B)。尽管在EC109和EC520细胞中miR-205-5p的内源性表达很低(附加文件4:图S2C),将miR-205-5p抑制剂瞬时转染到两个细胞中。然而,通过qRT-PCR(附加文件4:图S2D)。
创伤愈合试验表明,与对照细胞相比,miR-205-5p上调显著削弱了EC109和EC520细胞的迁移能力(图2a) ●●●●。Transwell侵袭试验表明,miR-205-5p的强制表达显著降低了EC109和EC520细胞的侵袭活性(图2b) ●●●●。相反,miR-205-5p过度表达的EC109和EC520细胞的凋亡率显著高于对照细胞(图2c) ●●●●。同时,正常子宫内膜间质细胞中miR-205-5p的敲除显示出与子宫内膜异位症衍生的子宫内膜基质细胞相似的功能表型(附加文件5:图S3)。更重要的是,western blot分析显示miR-205-5p过度表达显著上调Bax和E-Cad蛋白表达,但下调Bcl-2和Vimentin蛋白表达(附加文件6:图S4)。综上所述,这些结果表明miR-205-5p抑制子宫内膜异位症衍生子宫内膜基质细胞的迁移和侵袭,但促进其凋亡。
图2。
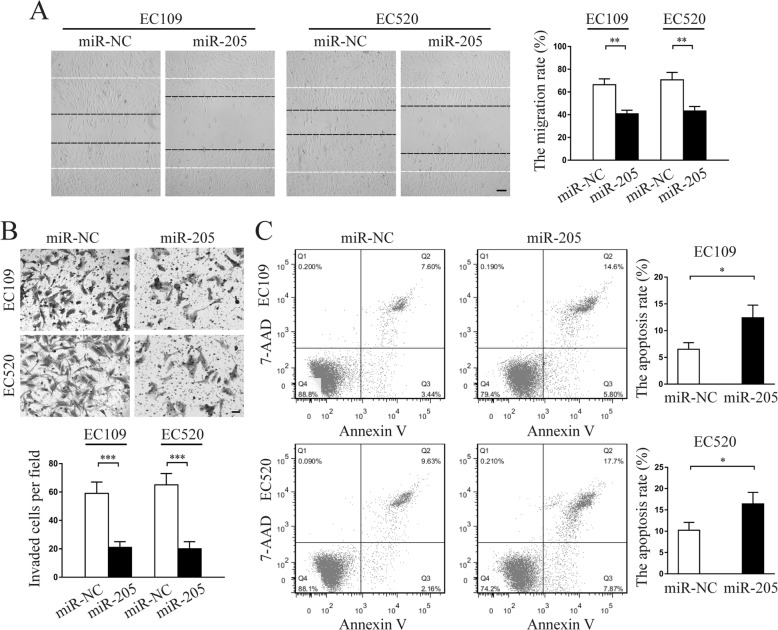
miR-205-5p在体外抑制EC109和EC520的迁移和侵袭,但促进其凋亡.
一显示了与NC相比,过度表达EC109和EC520的miR-205-5p伤口愈合试验的代表性显微照片。在0(白色虚线)和48处采集图像 h(黑色虚线)。计算了每个场的平均迁移率。比例尺,20 微米。b条显示了与NC相比,miR-205-5p过度表达EC109和EC520的Transwell侵袭试验的代表性显微照片。计算每个场的平均侵袭细胞数。比例尺,50 微米。c(c)与NC相比,显示了过度表达EC109和EC520的miR-205-5p细胞凋亡检测的代表性显微照片。分析每次的平均凋亡率。miR-205和miR-205-5p。误差条代表平均值 ± 三个独立实验的SD*P(P) < 0.05; **P(P) < 0.01; ***P(P) < 0.001
miR-205-5p在体内抑制子宫内膜异位症的进展
为了更好地评估体内miR-205-5p的生物学功能,我们将稳定表达miR-205-5 p或NC的EC109和EC520细胞接种到裸鼠体内,进行了体内子宫内膜异位症研究。miR-205-5p过度表达的EC109和EC520细胞形成明显较小的子宫内膜样病变(图三a) 与NC相比,病变异种移植物的生长明显减慢(图三b) ●●●●。qRT-PCR分析证实,与NC相比,miR-205-5p异种移植病灶中miR-205-5p水平增加(图三c) ●●●●。此外,Annexin V染色显示miR-205-5p过度表达的EC109和EC520细胞的病变异种移植物的凋亡细胞比NC多(图三d) 。此外,miR-205-5p过表达显著增加了子宫内膜异位症发病机制中相关炎症细胞因子的分泌,如白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、可溶性肿瘤坏死因子α受体1和2(sTNFR-1和2)以及高敏C反应蛋白(hs-CRP)(附加文件7:图S5)。这些结果表明,miR-205-5p在体内对子宫内膜基质细胞的子宫内膜异位症具有显著的抑制作用.
图3。
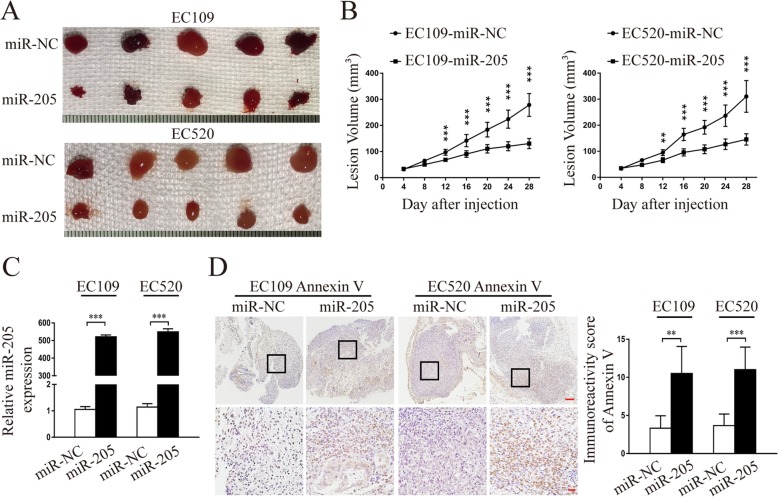
miR-205-5p抑制体内子宫内膜基质细胞产生的子宫内膜样病变的形成.
一裸鼠解剖病变的典型显微照片(n个 = 6,每组) 植入天数。b条子宫内膜样病变生长曲线。每隔4天测量病变大小。c(c)用qRT-PCR分析稳定转染miR-205-5p或miR-NC的EC109和EC520形成的解剖病变中miR-205-5 p的水平。d日解剖病变中Annexin V染色的代表性显微照片。比例尺:上面板,100 微米;下部面板,20 微米。miR-205和miR-205-5p。误差条代表平均值 ± 三个独立实验的SD**P(P) < 0.01; ***P(P) < 0.001
ANGPT2是miR-205-5p的直接靶点
使用多种算法(miRWalk、TargetScan、miRDB)识别miR-205-5p的候选靶点。因此,预测31个靶基因受miR-205-5p调控(图4a) ●●●●。在这些候选基因中,CDH11、ANGPT2、PLCB1、KPNA1和HIF1AN在正常子宫内膜基质细胞中低表达,经人类蛋白图谱(THPA)数据库证实,并被选为下一项研究的候选基因(图4b) ●●●●。为了进一步验证这一预测,进行了qRT-PCR分析,结果表明与miR-205-5p过度表达的EC109和EC520细胞相关的细胞和异种移植物中的CDH11、ANGPT2、PLCB1、KPNA1和HIF1AN表达在mRNA水平上均下调(图4c;其他文件8:图S6A)。其中,ANGPT2是最显著的下调基因。
图4。
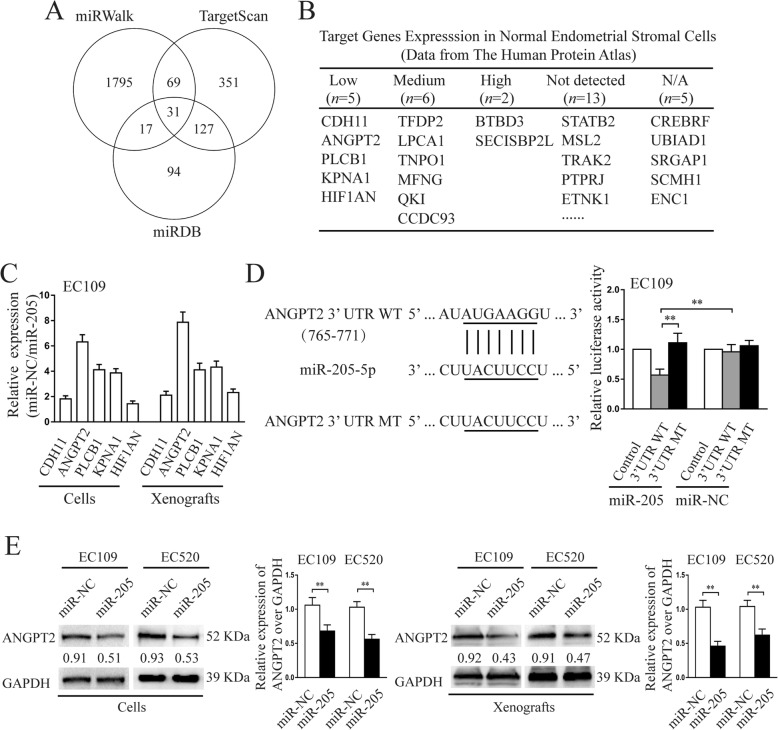
miR-205-5p通过其3′-UTR直接抑制ANGPT2的表达。一三种miRNA靶生物信息预测算法的重叠。b条预测靶点在正常子宫内膜基质细胞中的表达。数据来自人类蛋白质图谱。c(c)用qRT-PCR分析与miR-205-5p过度表达的EC109细胞相关的细胞和异种移植物中CDH11、ANGPT2、PLCB1、KPNA1和HIF1AN的RNA水平。d日miR-205-5p和ANGPT2的3′-UTR之间的RNA序列比对(左),以及miR-NC和miR-205-5p对EC109中含有野生型(WT)或突变型(MT)的荧光素酶报告基因活性的影响通过双荧光素酶报告基因测定进行测试(右)。e(电子)通过western blot分析检测慢载体转染的EC109和EC520细胞以及这些异位子宫内膜基质细胞建立的异种移植病灶中的ANGPT2蛋白水平。miR-205和miR-205-5p。误差条代表平均值 ± 三个独立实验的SD**P(P) < 0.01
为了检测miR-205-5p对假定靶点ANGPT2的调控,将ANGPT23′-UTR(野生型)或突变序列(突变型)中预测的miR-205-5 p结合位点克隆到荧光素酶报告质粒中,并评估其对EC109和EC520细胞中miR-205 5p的反应。结果显示,共转染的miR-205-5p模拟物显著降低了报告基因的表达,随后是ANGPT2的野生型3′-UTR,而如果随后是具有miR-205-5p突变推定靶位点的ANGPT2基因的3′-UTR,则报告基因的表达没有变化(图4d;其他文件8:图S6B)。因此,我们得出结论,ANGPT2是miR-205-5p的直接靶点。
为了证实miR-205-5p对ANGPT2蛋白水平的下调,进行了western blot分析,以检测经慢载体转染的EC109和EC520细胞以及这些异位子宫内膜基质细胞建立的异种移植病变中的ANGPT2蛋白水平。在miR-205-5p过度表达的EC109和EC520细胞中,ANGPT2蛋白水平显著下调(图4e) ●●●●。在miR-205-5p过表达的EC109和EC520细胞形成的相应异种移植物病变中观察到类似的结果(图4e) ●●●●。总的来说,miR-205-5p在体内外负调控了ANGPT2的表达。
ANGPT2是子宫内膜异位症miR-205-5p抑制作用的关键下游介体
为了探讨miR-205-5p在子宫内膜异位症中的作用是否是通过抑制ANGPT2介导的,我们检测了表达不含3′-UTR的ANGT2的质粒和特异性小干扰RNA-SiANGT2。先前的研究表明AKT和ERK通路与子宫内膜异位症的进展密切相关[20–22]提示我们确定miR-205-5p是否可以抑制AKT和ERK通路。因此,在Lenti-miR-205-5p处理的细胞中,miR-205-5p-、ANGPT2蛋白和AKT/ERK通路相关蛋白的表达被转染质粒ANGPT2和SiANGPT2-处理的细胞48 分别用qRT-PCR和western blot检测h(图5a、 b)。结果表明,ANGPT2的重新表达挽救了血管紧张素转换酶的表达,而ANGPT2的敲除则模拟了miR-205-5p介导的血管紧张素转化酶2和AKT/ERK通路激活的抑制。
图5。
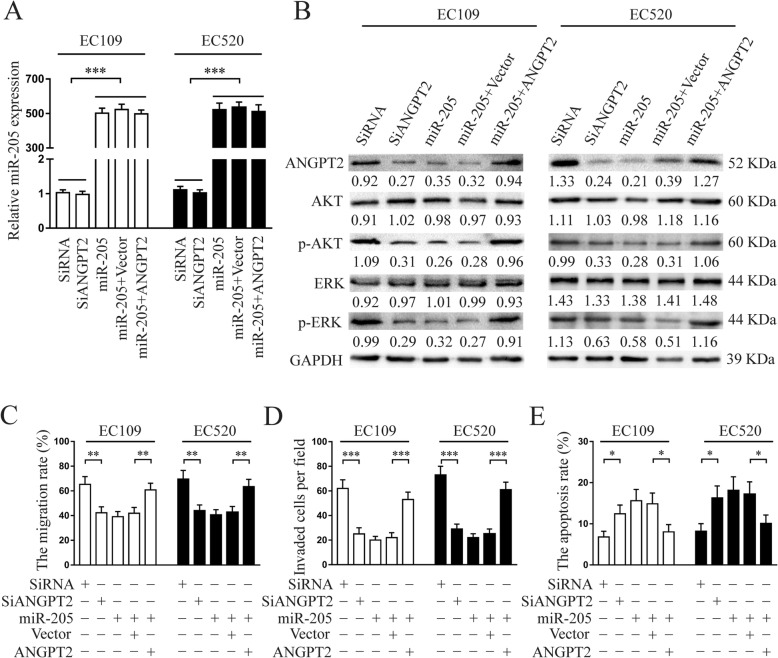
ANGPT2的重新表达可以缓解miR-205-5p对子宫内膜异位症的抑制作用。一用qRT-PCR分析经指定处理的细胞中miR-205-5p的水平。b条通过western blot分析检测转染质粒ANGPT2或载体对照的Lenti-miR-205-5p处理细胞和SiANGPT2-或SiRNA-处理细胞中ANGPT2和AKT/ERK通路相关蛋白的表达。c(c)–e(电子)通过伤口愈合、Transwell侵袭和细胞凋亡分析,ANGPT2的重新表达挽救了创伤,而ANGPT2的敲除模拟了miR-205-5p过度表达诱导的功能效应。miR-205和miR-205-5p。这些实验是在对48个 h.误差条代表平均值 ± 三个独立实验的SD*P(P) < 0.05; **P(P) < 0.01; ***P(P) < 0.001
进一步的体外研究证实,ANGPT2的重新表达显著减弱了miR-205-5p诱导的效应。同时,ANGPT2的敲除产生了与异位子宫内膜基质细胞中miR-205-5p过度表达相关的类似功能表型,包括抑制迁移和侵袭能力(图5c、 d;其他文件9:图S7A&B),以及促进细胞凋亡(图5e;其他文件9:图S7C)。总之,这些结果表明ANGPT2是子宫内膜异位症中miR-205-5p抑制作用的关键下游介质。
子宫内膜异位症组织中miR-205-5p与ANGPT2表达的临床相关性
我们首先使用特异性识别ANGPT2的抗体来检测上述68例EN和23例EC临床标本中的表达模式。如图所示6a、 在EC组织中ANGPT2蛋白的表达显著高于EN组织。我们进一步研究了人类子宫内膜异位症组织中ANGPT2和miR-205-5p的表达是否存在相关性。结果表明,ANGPT2蛋白的表达与EC组织中miR-205-5p水平呈负相关(图6b;其他文件1:表S4),表明miR-205-5p抑制了临床子宫内膜异位症进展中ANGPT2的表达。
图6。
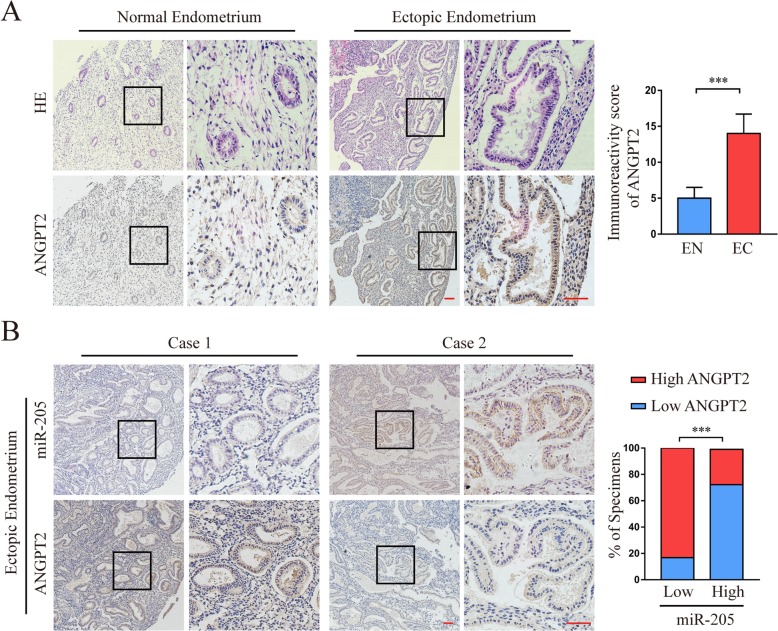
临床组织中miR-205-5p和ANGPT2表达的相关性。一ANGPT2的免疫反应性评分在EN(n个 = 23)和EC(n个 = 68)临床标本。b条EC临床标本中具有高和低ANGPT2表达以及低或高水平miR-205-5p的组织的代表性图像和百分比。比例尺,100 微米。EN,正常子宫内膜;EC,异位子宫内膜。miR-205和miR-205-5p。误差条代表平均值 ± 三个独立实验的SD***P(P) < 0.001
此外,我们分析了子宫内膜异位症患者的临床病理特征与miR-205表达之间的关系。痛经评分、CA125水平和子宫内膜异位症评分与miR-205-5p下调和ANGPT2上调显著相关(表1). 更重要的是,多变量分析证实miR-205-5p下调和ANGPT2评分上调也与子宫内膜异位症评分显著相关(表2). 综上所述,这些数据表明miR-205-5p和ANGPT2是反映子宫内膜异位症严重程度的有希望的生物标记物。
表1。
子宫内膜异位症临床病理因素与miR-205-5p和ANGPT2表达的相关性
|
miR-205-5p表达 |
ANGPT2表达 |
| 高 |
低 |
P(P)
|
高 |
低 |
P(P)
|
| 患者(n个) |
19 |
49 |
|
45 |
23 |
|
| 年龄(岁) |
31.26 ± 5.98 |
31.98 ± 6.36 |
0.67 |
32.18 ± 6.43 |
31 ± 5.85 |
0.464 |
| 血红蛋白(g/L) |
113.89 ± 15.08 |
114.80 ± 18 |
0.85 |
113.98 ± 18.07 |
115.65 ± 15.44 |
0.706 |
| 子宫内膜期(%) |
|
| 增殖期 |
78.95% |
83.67% |
|
82.22% |
82.61% |
|
| 分泌期 |
21.05% |
16.33% |
0.917 |
17.78% |
17.39% |
0.97 |
| 痛经疼痛评分(%) |
| 小于4分 |
57.89% |
30.61% |
|
28.89% |
56.52% |
|
| 4分以上 |
42.11% |
69.39% |
0.038 |
71.11% |
43.48% |
< 0.001 |
| 慢性盆腔疼痛评分(%) |
| 小于4分 |
42.11% |
36.69% |
|
31.11% |
47.83% |
|
| 4分以上 |
57.89% |
65.31% |
0.57 |
68.89% |
52.17% |
0.18 |
| E2(百万摩尔/升) |
369.58 ± 355.63 |
296.55 ± 301.26 |
0.245 |
276.76 ± 279 |
395.61 ± 373.30 |
0.054 |
| CA-125(千单位/升) |
34.31 ± 21.27 |
109.55 ± 140.91 |
0.001 |
116.67 ± 144.86 |
33.47 ± 21.40 |
< 0.001 |
| 子宫内膜异位症评分(%) |
| 低于16分 |
68.42% |
38.78% |
|
35.56% |
69.57% |
|
| 16分以上 |
31.58% |
61.22% |
0.028 |
64.44% |
30.43% |
0.008 |
表2。
子宫内膜异位症严重程度的单变量和多变量Cox回归分析总结
|
单变量分析 |
多元分析 |
| 东南方 |
B类 |
P(P)
|
东南方 |
B类 |
P(P)
|
| 年龄(岁) |
0.132 |
− 0.517 |
< 0.001 |
0.003 |
− 0.031 |
< 0.001 |
| 血红蛋白(g/L) |
0.025 |
− 0.001 |
0.971 |
0.059 |
0.001 |
0.552 |
| 子宫内膜期 |
1.034 |
−0.382 |
0.712 |
3.012 |
0.096 |
0.139 |
| 痛经疼痛评分 |
0.646 |
2.066 |
0.001 |
1.669 |
0.217 |
< 0.001 |
| 慢性盆腔疼痛评分 |
0.644 |
2.128 |
0.001 |
1.577 |
0.103 |
0.051 |
| E2(百万摩尔/升) |
0.017 |
0.011 |
0.313 |
0.12 |
0.001 |
0.121 |
| CA-125(kU/L) |
0.054 |
0.157 |
0.004 |
0.08 |
0.001 |
0.001 |
| miR-205-5p表达 |
0.573 |
2.228 |
< 0.001 |
1.688 |
1.628 |
< 0.001 |
| ANGPT2表达 |
0.67 |
−2.56 |
< 0.001 |
1.581 |
− 0.203 |
0.008 |
讨论
临床上普遍将子宫内膜异位症引起的疼痛误解为与月经相关的腹痛,以及腹腔镜的侵袭性和缺乏该疾病的实验室生物标记物,导致平均潜伏期为7至11 从症状出现到确诊的几年[23–25]. 2004年,Ballweg报告称,15岁之前女孩的子宫内膜异位症样症状增加 岁以及月经初潮较早的人[26],表明极有必要确定新的有效生物标志物,这些生物标志物可以在青春期女孩出现子宫内膜异位症症状时就对其进行筛查。生物标记物的识别将有助于为确诊患者制定个性化的诊断和治疗策略。最近,miRNAs因其组织特异性表达谱和微创诊断手段而被公认为有前景的生物标记物[27–29]. 在我们的研究中,通过组织芯片分析,miR-205-5p被确定为子宫内膜异位症的一种新型病理抑制因子。我们进一步证实,miR-205-5p可以通过与血管生成素-2(angiopoietin-2,ANGPT2)的3′-UTR结合,直接靶向其,并通过调节ANGPT2通路参与子宫内膜异位症的发生过程。更重要的是,我们的临床数据表明,miR-205-5p和ANGPT2都是反映子宫内膜异位症严重程度的有价值因素。这些结果为我们进一步探讨miR-205-5p-ANGPT2轴在子宫内膜异位症进展中的作用提供了足够的理由。
正常子宫内膜miRNA表达谱在整个月经周期内表现出动态变化[30]它们在生理系统中的含义可用于识别病理表型。子宫内膜异位症通常可分为两种类型:无症状型和有症状型,这取决于子宫内膜样组织的到达位置[31–33]. 正如预期的那样,异位子宫内膜的miRNA图谱比在位子宫内膜的更具代表性,这为确认症状性子宫内膜异位症的诊断提供了更有用的病理生理指纹。在此,我们发现,与正常子宫内膜患者相比,异位子宫内膜患者组织和血清中的miR-205-5p水平显著下调。此外,我们的研究数据通过体外原发性异位子宫内膜基质细胞迁移、侵袭和凋亡检测以及体内子宫内膜样异种移植物生长和凋亡证实了miR-205-5p的抑制作用。虽然子宫内膜异位症细胞很难转化为癌细胞,但其癌变行为,如侵入邻近器官和扩散到远处器官,经常出现在子宫内膜异位病中[34,35]. 有趣的是,以前的研究支持了我们的数据,即miR-205-5p在多种癌症类型中的过度表达诱导了与我们研究相似的体外和体内表型[36–38]表明miR-205-5p可能是一个理想的治疗靶点,有助于抑制癌症行为。
为了进一步探讨miR-205-5p参与人类子宫内膜异位症的分子机制,我们结合三种典型的miRNA预测算法和THPA数据库来确定miR-205-5 p的潜在靶点。THPA是一个在线平台,用于同时识别和量化人体生理和病理组织中潜在靶蛋白[39]. 与传统的miRNAs靶点qRT-PCR分析相比,THPA在人体组织中的数据量大且准确,可以作为一种更好的识别和定量工具,用于初步筛选靶蛋白。然后,我们将生物信息学方法和荧光素酶报告试验的预测结果结合起来。因此,ANGPT2被确定为miR-205-5p的新直接靶点。各种基因已被确定为miR-205-5p的直接靶点。例如,miR-205-5p直接靶向ERBB2和p63,导致对Her2阳性乳腺癌的标准治疗产生耐药性[40]. miR-205-5p在肝脏脂质代谢中靶向一个称为乙酰辅酶A羧化酶β(ACACβ)的脂质代谢相关基因[41]. Di Carlo等人最近的一项研究发现,使用免疫组织化学染色法,血管生成素-2(ANGPT2)在正常子宫内膜、在位子宫内膜和异位子宫内膜中逐渐下调[42]. 然而,到目前为止,ANGPT2影响子宫内膜异位症发病机制的潜在机制尚不清楚。ANGPT2是一种公认的血管不稳定因子,是许多人类疾病预后不良的生物标志物[43,44]. 我们的数据表明,miR-205-5p的过度表达可能导致异位子宫内膜基质细胞和异种移植病变中ANGPT2在mRNA和蛋白水平上的显著下调。同时,ANGPT2的重新表达和敲除可分别拯救和模拟miR-205-5p诱导的效应。此外,参与子宫内膜异位症进展的AKT和ERK通路的激活是miR-205-5p下调和ANGPT2上调的原因。
尽管几十年的研究已经发展出一套用于评估子宫内膜异位症严重程度的诊断生物标记物,但仍缺乏区分不同类型和程度子宫内膜异位的有效生物标记物。例如,CA-125是预测子宫内膜异位症严重程度的临床生物标志物[45]. 然而,CA-125水平与疾病进展的相关性并不高[46]. 其他一些正在实施的检测炎症生物标志物(如IL-8和IL-6)的方案仍不令人满意[47,48]. 基于普遍接受的月经倒退理论[49]子宫内膜细胞是异位子宫内膜异位病灶的来源。因此,在我们寻找子宫内膜异位症生物标记物的过程中,使用疾病的直接来源,包括外周血甚至尿液,可能是合理和合乎逻辑的。在我们的研究中,人类异位子宫内膜连续切片的ISH和IHC分析也显示miR-205-5p和ANGPT2之间存在不良关系。更重要的是,我们发现临床子宫内膜异位症严重程度评分也与miR-205-5p和ANGPT2表达密切相关,预测子宫内膜异位症严重程度也是根据多变量回归模型确定的。
结论
总之,我们的数据提供了证据,证明miR-205-5p在评估人类子宫内膜异位症的疾病严重程度时可能起到异位子宫内膜异位抑制物的作用。miR-205-5p的降低可能通过调节ANGPT2-AKT/ERK通路,有助于减少细胞凋亡,促进迁移和侵袭。新发现的miR-205-5p-ANGPT2-AKT/ERK信号轴阐明了子宫内膜异位症进展的关键分子机制,并为子宫内膜异位病的治疗提供了新的诊断和治疗靶点。
缩写
- 角度2
血管生成素-2
- UTR公司
未翻译区域
- 美国公共广播电视公司
磷酸盐缓冲盐水
- 定量RT-PCR
定量逆转录聚合酶链反应
- GAPDH公司
甘油醛-3-磷酸脱氢酶
- 国际控股公司
免疫组织化学
- ISH公司
原位杂交
- 标准偏差
标准偏差
- ZH
正常子宫内膜
- 欧盟委员会
异位子宫内膜
- THPA公司
人类蛋白质图谱
- 重量
野生型
- 机器翻译
突变型
- E2级
雌二醇
- 公共管理硕士
醋酸甲羟孕酮
- PRL公司
催乳素
- IL-1β
白细胞介素-1β
- 白介素-6
白细胞介素-6
- sTNFR-1型
可溶性肿瘤坏死因子α受体1
- sTNFR-2型
可溶性肿瘤坏死因子α受体2
- 超敏C反应蛋白
高敏C-反应蛋白
作者的贡献
MY和ZCF设计了实验并撰写了手稿。ZCF、LMJ和HYX进行了实验。WW、WS和WXF提供了实验指导。ZCF、CGB和PDX分析了数据。MY、LMJ、WS和LXX解释了实验结果。WW、LLM、CXZ和FWQ提供了临床样本。所有作者都对提交的手稿版本给予了最终批准。
基金
本研究得到了国家自然科学基金[批准号:81701418]和广东省科技规划项目[批准号为2014A020212667]的支持。
伦理批准和参与同意
这项人体研究得到了赫尔辛基世界医学协会宣言和中华人民共和国公共卫生部机构研究伦理委员会的批准。所有患者均获得书面知情同意书。所有动物研究均由南方医科大学动物研究伦理委员会批准。
脚注
出版商备注
Springer Nature在公布的地图和机构关联中的管辖权主张方面保持中立。
参与者信息
周晨飞,电子邮件:61509340@qq.com。
刘敏娟,电子邮件:799364639@qq.com。
Wei Wang,电子邮件:smugowwang@126.com。
Sha Wu,电子邮件:shawu99@outlook.com。
Yu-Xin Huang,电子邮件:15521280986@163.com。
陈国斌,电子邮件:cgbben1982@sina.com。
Li-Min Liu,电子邮件:286189460@qq.com。
董小鹏,电子邮件:pengdx2016@163.com。
王雪峰,电子邮件:15913130306@163.com。
Xu-Zi Cai,电子邮件:15102040415@163.com。
Xiao-Xuan Li,电子邮件:ixiaoxuan2008@126.com。
Wan-Qin Feng,电子邮件:583479163@qq.com。
Ying Ma,电话:8620 6278 2983,电子邮件:mayingwuzhuoyi@126.com。
工具书类
-
1Giudice LC。临床实践。子宫内膜异位症。《新英格兰医学杂志》,2010年;362(25):2389–2398. doi:10.1056/NEJMcp1000274。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
2Dunselman GA、Vermeulen N、Becker C、Calhaz-Jorge C、D'Hooghe T、De Bie B等。ESHRE指南:子宫内膜异位症妇女的管理。人类繁殖。2014;29(3):400–412. doi:10.1093/humrep/det457。[内政部] [公共医学] [谷歌学者]
-
三。Nnoaham KE、Hummelshoj L、Webster P、d'Hooghe T、de Cicco NF、de Cicoc NC等。子宫内膜异位症对生活质量和工作生产率的影响:一项跨十个国家的多中心研究。Fertil Steril,2011年;96(2):366–373. doi:10.1016/j.fertnstert.2011.05.090。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
4Giudice LC,Kao LC。子宫内膜异位症。柳叶刀。2004;364(9447):1789–1799. doi:10.1016/S0140-6736(04)17403-5。[内政部] [公共医学] [谷歌学者]
-
5Nisenblat V、Bossuyt PM、Shaikh R、Farquhar C、Jordan V、Scheffers CS等。子宫内膜异位症无创诊断的血液生物标记物。2016年版Cochrane数据库系统;5:CD012179。doi:10.1002/14651858.CD012179。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
6Gupta D、Hull ML、Fraser I、Miller L、Bossuyt PM、Johnson N等。子宫内膜异位症无创诊断的子宫内膜生物标记物。2016年Cochrane数据库系统修订版;4:CD012165。doi:10.1002/14651858.CD012165。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
7Lee YS、Nakahara K、Pham JW、Kim K、He Z、Sontheimer EJ等。果蝇Dicer-1和Dicer-2在siRNA/miRNA沉默途径中的不同作用。单元格。2004;117(1):69–81. doi:10.1016/S0092-8674(04)00261-2。[内政部] [公共医学] [谷歌学者]
-
8Ambros V.动物microRNA的功能。自然。2004;431(7006):350–355. doi:10.1038/nature02871。[内政部] [公共医学] [谷歌学者]
-
9Pitzler L、Auler M、Probst K、Frie C、Bergmeier V、Holzer T等。miR-126-3p促进基质依赖性血管周围细胞的附着、迁移和细胞间相互作用。干细胞。2016;34(5):1297–1309. doi:10.1002/stem.2308。[内政部] [公共医学] [谷歌学者]
-
10Hsu CY、Hsieh TH、Tsai CF、Tasai HP、Chen HS、Chang Y等。miRNA-199a-5p调节子宫内膜间充质干细胞中的VEGFA并参与子宫内膜异位症的发病机制。病理学杂志。2014;232(3):330–343. doi:10.1002/path.4295。[内政部] [公共医学] [谷歌学者]
-
11Hirakawa T、Nasu K、Abe W、Aoyagi Y、Okamoto M、Kai K等,子宫内膜异位症中表观遗传抑制的microRNA miR-503,诱导细胞凋亡和细胞周期阻滞,并抑制人类卵巢子宫内膜异位基质细胞的细胞增殖、血管生成和收缩性。人类繁殖。2016;31(11):2587–2597. doi:10.1093/humrep/dew217。[内政部] [公共医学] [谷歌学者]
-
12周M,付J,肖磊,杨S,宋Y,张X,等。miR-196a过表达激活MEK/ERK信号,抑制子宫内膜异位症患者在位子宫内膜的孕激素受体和蜕膜化。人类繁殖。2016;31(11):2598-2608。doi:10.1093/humrep/dew223。[内政部] [公共医学] [谷歌学者]
-
13Cho S、Mutlu L、Zhou Y、Taylor HS。芳香化酶抑制剂调节子宫内膜异位症患者子宫内膜细胞中let-7的表达和let-7f诱导的细胞迁移。Fertil Steril.2016年;106(3):673–680. doi:10.1016/j.fernstert.2016.05.020。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
14Wu L,Han L,Zhou C,Wei W,Chen X,Yi H,et al.TGF-β1诱导的CK17通过ERK1/2-MZF1信号通路增强癌干细胞样特性而非EMT促进宫颈癌转移。2017年FEBS期刊;284(18):3000–3017. doi:10.1111/febs.14162。[内政部] [公共医学] [谷歌学者]
-
15Liu D,Li L,Zhang XX,Wan DY,Xi BX,Hu Z,等。SIX1通过协调TGF-beta信号促进肿瘤淋巴管生成,TGF-Beta信号增加VEGF-C的表达。癌症研究2014;74(19):5597–5607. doi:10.1158/008-5472.CAN-13-3598。[内政部] [公共医学] [谷歌学者]
-
16Que T,Song Y,Liu Z,Zheng S,Long H,Li Z,et al.miRNA-637减少是一种不良预后标志物,通过直接靶向Akt1促进胶质瘤细胞生长、迁移和侵袭。致癌物。2015;34(38):4952–4963. doi:10.1038/onc.2014.419。[内政部] [公共医学] [谷歌学者]
-
17Remmele W,Schicketanz KH。人类乳腺癌中雌激素和孕酮受体含量的免疫组织化学测定。计算机辅助图像分析(QIC评分)与主观评分(IRS)病理研究实践。1993;189(8):862–866. doi:10.1016/S0344-0338(11)81095-2。[内政部] [公共医学] [谷歌学者]
-
18蔡毅,金浩,曹力,高清,陶杰。TAFI的过度表达促进子宫内膜异位症的上皮-间质转化。欧洲药理学评论。2017;21(24):5527–5533. doi:10.26355/eurrev_201712_13988。[内政部] [公共医学] [谷歌学者]
-
19Shuya L、Menkhorst E、Yap J、Li P、Lane N、Dimitriadis E.白血病抑制因子促进人类和小鼠子宫内膜基质细胞蜕膜化。公共科学图书馆一号。2011;6(9):e25288。doi:10.1371/journal.pone.0025288。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
20Leconte M、Nicco C、NgóC、Chéreau C、Chouzenoux S、Marut W等。mTOR/AKT抑制剂替米罗莫司可预防小鼠深度浸润性子宫内膜异位症。《美国病理学杂志》。2011;179(2):880–889. doi:10.1016/j.ajpath.2011.04.020。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
21Matsuzaki S,Darcha C.AKT和ERK信号通路之间的协同作用可能支持体外纤维化微环境中深层子宫内膜异位症的生长。人类繁殖。2015;30(7):1606–1616. doi:10.1093/humrep/dev108。[内政部] [公共医学] [谷歌学者]
-
22McKinnon BD、Kocbek V、Nirgianakis K、Bersinger NA、Mueller MD。子宫内膜异位症的激酶信号通路:非激素治疗的潜在靶点。Hum Reprod更新。2016;22(3):382–403. doi:10.1093/humupd/dmv060。[内政部] [公共医学] [谷歌学者]
-
23Rogers PA、D'Hooghe TM、Fazleabas A、Giudice LC、Montgomery GW、Petraglia F等。定义子宫内膜异位症研究的未来方向:2011年法国蒙彼利埃世界子宫内膜异位病大会的研讨会报告。生殖科学。2013;20(5):483–499. doi:10.1177/1933719113477495。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
24Greene R、Stratton P、Cleary SD、Ballweg ML、Sinaii N。4334名报告手术诊断子宫内膜异位症的女性的诊断经验。费蒂尔·斯特里尔,2009年;91(1):32–39. doi:10.1016/j.fernstert.2007.11.020。[内政部] [公共医学] [谷歌学者]
-
25Eisenberg VH,Weil C,Chodick G,Shalev V。子宫内膜异位症的流行病学:一项来自拥有200万成员的医疗保健提供者的大规模基于人群的数据库研究。北京奥组委。2018;125(1):55–62. doi:10.1111/1471-0528.14711。[内政部] [公共医学] [谷歌学者]
-
26子宫内膜异位症对女性健康的影响:比较历史数据显示,发病越早,病情越严重。最佳实践研究临床妇产科学。2004;18(2):201–218. doi:10.1016/j.bbobgyn.2004.01.003。[内政部] [公共医学] [谷歌学者]
-
27Wei WF、Zhou CF、Wu XG、He LN、Wu LF、Chen XJ等。TWIST2靶点MicroRNA-221-3p通过直接靶向THBS2促进宫颈癌转移。细胞死亡疾病。2017;8(12):3220. doi:10.1038/s41419-017-0077-5。[内政部] [PMC免费文章] [公共医学] [谷歌学者] [已缩回]
-
28Liang Z,Chen Y,Zhao Y,Xu C,Zhang A,ZhangQ,等。miR-200c通过体内外靶向MALAT1抑制子宫内膜异位症。癌症生物治疗。2017;8(1):251. doi:10.1186/s13287-017-0706-z。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
29Zhou Y,Huang T,Zhang J,Wong CC,ZhangB,Dong Y,等。TEAD1/4在胃肿瘤发生中发挥致癌作用,并受miR-4269负调控。致癌物。2017;36(47):6518–6530. doi:10.1038/onc.2017.257。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
30Rekker K、Saare M、Roost AM、Salumets A、Peters M。整个月经周期的循环microRNA谱。公共科学图书馆一号。2013;8(11):e81166。doi:10.1371/journal.pone.0081166。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
31Cheung KT、Trevisan J、Kelly JG、Ashton KM、Stringfellow HF、Taylor SE等。傅里叶变换红外光谱法鉴别子宫内膜异位症的光谱特征,与诱导间变异无关。分析师。2011;136(10):2047–2055. doi:10.1039/c0an00972e。[内政部] [公共医学] [谷歌学者]
-
32Kurotsuchi S、Iwase A、Goto M、Hariyama Y、Kikkawa F。子宫穿孔剖腹术后瘢痕子宫内膜异位症是扩张和刮宫术的并发症。妇科障碍。2009;279(6):941–943. doi:10.1007/s00404-009-0963-x。[内政部] [公共医学] [谷歌学者]
-
33Fuldeore MJ,Soliman AM。美国子宫内膜异位症的患病率和症状负担:来自59411名女性的横断面调查的国家估计。妇科产科调查。2017;82(5):453–461. doi:10.11159/000452660。[内政部] [公共医学] [谷歌学者]
-
34Anglesio MS、Papadopoulos N、Ayhan A、Nazeran TM、NoöM、Horlings HM等。无癌子宫内膜异位症的癌相关突变。《新英格兰医学杂志》2017;376(19):1835–1848. doi:10.1056/NEJMoa1614814。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
35Bloski T,Pierson R.子宫内膜异位症和慢性盆腔疼痛:揭开这一复杂状况背后的神秘面纱。护理妇女健康。2008;12(5):382–395. doi:10.1111/j.1751-486X.2008.00362.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
36De Cola A、Lamolinara A、Lanuti P、Rossi C、Iezzi M、Marchisio M等。锁定核酸对MiR-205-5p的抑制会损害乳腺癌细胞的转移潜能。细胞死亡疾病。2018;9(8):821. doi:10.1038/s41419-018-0854-9。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
37Gulei D、Magdo L、Jurj A、Raduly L、Cojocneanu-Petric R、Moldovan A等。沉默治疗者:miR-205-5p上调通过间接上调E-cadherin的表达抑制结肠癌细胞的上皮-间充质转化。细胞死亡疾病。2018;9(2):66. doi:10.1038/s41419-017-0102-8。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
38Vosgha H、Ariana A、Smith RA、Lam AK。miR-205同时靶向间变性甲状腺癌的血管生成和EMT。内分泌相关癌症。2018;25(3):323–337. doi:10.1530/ERC-17-0497。[内政部] [公共医学] [谷歌学者]
-
39Uhlen M、Oksvold P、Fagerberg L、Lundberg E、Jonasson K、Forsberg M等。面向基于知识的人类蛋白质图谱。国家生物技术。2010年;28(12):1248–1250. doi:10.1038/nbt1210-1248。[内政部] [公共医学] [谷歌学者]
-
40De Cola A、Volpe S、Budani MC、Ferracin M、Lattanzio R、Turdo A等。miR-205-5p介导的乳腺癌干细胞ErbB/HER受体下调导致靶向治疗耐药。细胞死亡疾病。2015;6:e1823。doi:10.1038/cddis.2015.192。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
41陶义夫,羌杰,鲍建伟,李海霞,尹国杰,徐鹏,等。miR-205-5p对尼罗罗非鱼脂质代谢中肝脏乙酰辅酶A羧化酶βmRNA的负调控。基因。2018;660:1–7. doi:10.1016/j.gene.2018.03.064。[内政部] [公共医学] [谷歌学者]
-
42Di Carlo C、Bonifacio M、Tommaselli GA、Bifulco G、Guerra G、Nappi C。在位和异位子宫内膜中的金属蛋白酶、血管内皮生长因子和血管生成素1和2。费蒂尔·斯特里尔,2009年;91(6):2315–2323. doi:10.1016/j.fertnstert.2008.03.079。[内政部] [公共医学] [谷歌学者]
-
43Lee SJ、Lee CK、Kang S、Park I、Kim YH、Kim SK等。血管生成素-2加重心肌梗死后的心脏缺氧和炎症。临床投资杂志。2018;128(11):5018–5033. doi:10.1172/JCI99659。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
44Keskin D,Kim J,Cooke VG,Wu CC,Sugimoto H,Gu C等。靶向缺氧肿瘤中的血管周细胞通过血管生成素-2增加肺转移。细胞报告2015;10(7):1066–1081. doi:10.1016/j.celrep.2015.01.035。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
45沈阿,徐S,马勇,郭华,李C,杨C,等。血清CA125、CA19-9和CA15-3对子宫内膜异位症的诊断价值:一项荟萃分析。2015年国际医学研究杂志;43(5):599–609。doi:10.1177/0300060515583076。[内政部] [公共医学] [谷歌学者]
-
46Maiorana A,Cicerone C,Niceta M,Alio L。子宫内膜异位症相关盆腔疼痛患者血清CA 125水平的评估。国际生物标志物杂志。2007;22(3):200–202. doi:10.1177/172460080702200306。[内政部] [公共医学] [谷歌学者]
-
47Scholl B、Bersinger NA、Kuhn A、Mueller MD。子宫内膜异位症疼痛症状与腹膜液炎性细胞因子浓度的相关性。妇科内分泌。2009;25(11):701–706。doi:10.3109/09513590903159680。[内政部] [公共医学] [谷歌学者]
-
48Vodolazkaia A、El-Aalamat Y、Popovic D、Mihalyi A、Bossuyt X、Kyama CM等。一组28种生物标记物用于子宫内膜异位症无创诊断的评估。人类繁殖。2012;27(9):2698–2711. doi:10.1093/humrep/des234。[内政部] [公共医学] [谷歌学者]
-
49日本桑普森。转移性或栓塞性子宫内膜异位症,由于月经将子宫内膜组织扩散到静脉循环中。《美国病理学杂志》。1927;3(2):93–110.43.[PMC免费文章] [公共医学] [谷歌学者]
关联数据
本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。








