结直肠癌(CRC)是成人癌症死亡的第三大主要原因 1 该病最初为良性腺瘤性息肉,随后发展为晚期腺瘤,并逐渐发展为浸润性癌。 CRC背后的驱动因素包括一系列连续累积的基因突变,其顺序如下“ APC-KRAS-TP53-DCC公司 ” 2 , 三 .
抑癌基因 TP53型 编码393个氨基酸的磷酸蛋白。 TP53是细胞周期阻滞、凋亡和DNA损伤反应的关键调节因子 4 重要的是, TP53型 是人类肿瘤中最常见的突变基因之一。 据报道,CRC中TP53突变的频率约为50%,突变主要影响五个“热点”密码子(175、245、248、273和282) 5 , 6 , 7 根据国际癌症研究机构(IARC)TP53数据库( 网址:http://p53.iarc.fr/ )这五个热点突变发生在CRC中,频率分别为10.5%、5.5%、10.6%、9.7%和4.8%。 值得注意的是,突变的TP53还表现出新的致癌功能,例如促进增殖和侵袭 4 在这里,我们关注的是R273H突变,它将密码子273处的氨基酸从精氨酸变为组氨酸。 据报道,这种突变会增加乳腺癌和肺癌中肿瘤细胞的增殖、迁移和侵袭 9 , 10 .
外泌体是纳米大小的分泌膜囊泡(30-100 直径为nm),具有“碟形”形态。 外泌体的生物发生机制尚未完全阐明。 一般来说,外泌体是由内胚体网络内多泡体(MVB)的腔内小泡(ILV)形成的。在晚期内胚体成熟期间,一些内容物优先分为30–100个 nm囊泡,芽状突起进入晚期内体的管腔; 这些囊泡被称为MVB。 转运(ESCRT)途径所需的内胚体分选复合体包括五种不同的复合体(ESCRTs-0、-I、-II、-III和Vps4),是MVB生物发生和内胚体货物蛋白分选为MVB的关键介体 11 .还报道了依赖CD63但不依赖ESCRT的另一种内体分选途径 12 一些MVB注定要降解,而其他MVB在MVB与质膜融合后出口 13 外显子包含蛋白质、脂类、mRNA和miRNA,作为传递细胞间通信信息的载体; 因此,外泌体在肿瘤微环境重塑中发挥作用 14 .
以前的研究表明,在 TP53型 -空单元格,而野生类型 TP53型 通过上调 TSAP6型 和 热电联产4C 15 , 16 另一项研究表明,CRC组织TP53蛋白表达、TSAP6(mRNA和蛋白)和血浆外体水平之间没有相关性。 此外,外显子释放独立于 TP53型 状态和 TSAP6型 HCT116中的mRNA水平 TP53型 -野生型和 TP53型 -空单元格 17 这些相互矛盾的发现促使我们对HCT116中纯化的外泌体进行全面的蛋白质组学分析 TP53型 -野生型, TP53型 -击倒和 TP53型 -突变细胞。
目前的调查结果表明 TP53型 -突变体(R273H)和 TP53型 -与对照组相比,空细胞分泌较小的外泌体 TP53型 -野生型细胞。 使用基于化学标签的等压标签进行相对和绝对定量(iTRAQ)程序,结合二维液相色谱和串联质谱(MS/MS)分析,确定外体蛋白组成。 此外,我们通过实验证实,两种蛋白的外泌体中的差异表达蛋白都减少了 TP53型 -突变体和 TP53型 -空细胞是外显子大小减小的部分原因。 因此,我们的研究揭示了TP53通过影响肿瘤微环境中的重要成分来调节致癌的新机制。
结果 TP53突变体(R273H)增强细胞增殖和迁移 HCT116结肠癌细胞表达野生型 TP53型 基因。 构建稳定表达 TP53型 R273H突变体,一种错义突变载体 TP53型 基因导入HCT116细胞[HCT116 TP53型 (R273H)-突变,MT]。 我们随后调查了 TP53型 R273H突变体对细胞增殖和迁移的影响。 我们确定,与表达空载体对照的细胞的生长相比,MT细胞的生长速率显著增加。 创伤愈合试验表明,与对照组相比,MT细胞的愈合速度更快( 补充图S1A、B ). Western blotting分析表明,与空载体对照组相比,MT细胞中的TP53水平显著增加,而HCT116- TP53型 (−/−) (KO)细胞不表达TP53( 补充图S1C ). 这些发现表明 TP53型 成功构建了突变体(R273H)细胞模型。
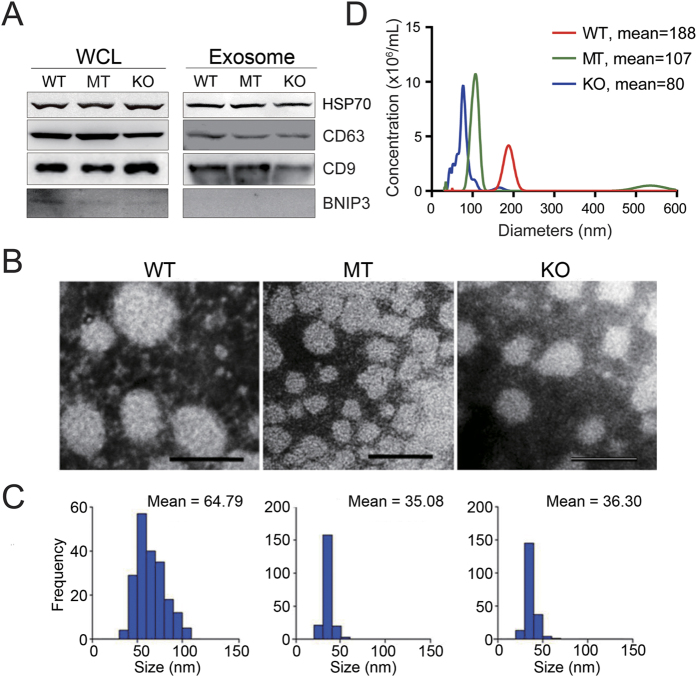
分泌的外泌体 TP53型 突变细胞和敲除细胞体积较小 HCT116野生型分泌的外显子 TP53型 使用传统的超速离心和纳米材料方法沉淀(WT)、MT和KO细胞。 Western blotting分析表明,纳米颗粒含有外显体特异性标记HSP70、CD63和CD9,但不含线粒体蛋白BNIP3( 图1A ). 透射电子显微镜显示,提取的外泌体呈光滑的碟状( 图1B ). 有趣的是,对每组200个外泌体直径的计算表明,WT、MT和KO囊泡的平均直径为64.79 ± 15.98, 35.08 ± 5.00和36.30 ± 5.33 分别为nm( 图1C ). 统计分析表明,WT和MT组与WT和KO组之间的大小差异显著( P(P) < 0.0001). Nanosight颗粒追踪技术进一步证实了这三种细胞的外显子大小变化,并确定了类似的趋势( 图1D ). 综上所述,我们的发现表明,MT和KO细胞分泌的外泌体明显小于WT细胞分泌外泌物。
图1。 从HCT116细胞中纯化的外显子 TP53型 状态显示出不同的大小。
( A类 )野生型无血清条件培养基中分离的全细胞裂解物(WCL)和囊泡的Western blot分析 TP53型 (重量), TP53型 (R273H)突变体(MT)和 TP53型 -空(KO)HCT116细胞。 检测外体标志物HSP70、CD63和CD9以及线粒体蛋白BNIP3。 实验至少进行了三次。 ( B类 )WT、MT和KO细胞外泌体的电子显微照片。 阴性图像表明,外泌体呈现出光滑的碟状形态。 比例尺为100 纳米。 ( C )根据电子显微图像计算200个外泌体的平均直径分布,并绘制所示大小的外泌物频率。 ( D类 )通过NanoSight颗粒追踪分析从三组中分离出的外显子的代表性大小分布。
iTRAQ-2D-LC-MS/MS外显子蛋白分析 为了确定改变的蛋白质组成是否与MT和KO细胞外泌体的缩小大小相对应,我们进行了全面的蛋白质组分析( 补充图S2A ). 为了尽量减少技术差异对真实生物差异的影响,我们分别引入了技术重复和生物重复。 对于生物副本,从MT细胞中分离出两批外泌体; 对于技术重复,在离线高pH RP-HPLC分离后,将每个肽分级分成两个相同的部分,以在随后的RP-HPLC-MS/MS分析期间确定变化。 如所示 补充图S2B、C 重复实验之间鉴定的蛋白质的R平方大于0.85,这意味着可接受的再现性和良好控制的实验过程。
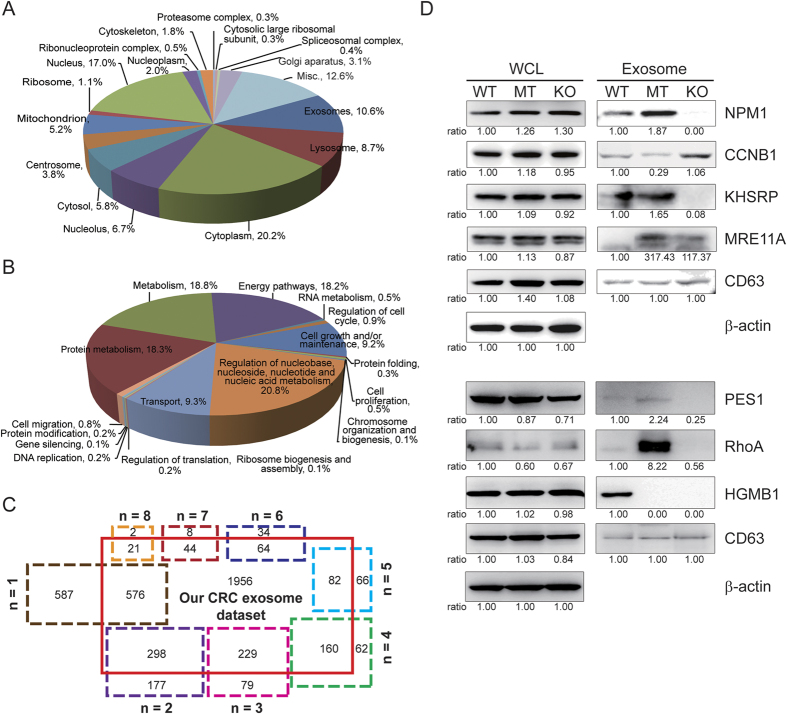
在iTRAQ实验中,当至少有两个匹配的肽高于MASCOT显著性水平时,就有3437个蛋白质组被可靠地鉴定出来。 总FDR控制在≤1%( 补充表S1 ). 具体来说,3430个蛋白质组被分配给一个基因。 我们最初通过基因本体(GO)注释我们识别的蛋白质。 细胞成分分类表明,胞外体、溶酶体、细胞质和核仁中的蛋白质高度富集( P(P) < 0.0001, 图2A ). 这些蛋白质主要参与蛋白质代谢、能量途径、RNA代谢、细胞周期调节以及细胞生长和维持的生物学过程( P(P) < 0.0001, 图2B ). 我们将我们确定的蛋白质组与之前从Vesiclepedia数据库中报告的CRC外显子蛋白进行了比较( http://www.microwescles.org/ 第3.1版)。 在我们的研究中,共有1474个(43.0%)重叠蛋白,而1956个蛋白首次被确认为CRC细胞的外体蛋白。 在我们的工作中,共有1015种已知的CRC外泌体蛋白未被鉴定( 图2C ).
图2。 3437个定量外体蛋白的生物信息学分析和Western blotting验证。
( A类 )基于基因本体注释的显著丰富的细胞成分分析饼图。 含有<0.3%总蛋白的分类被归类为杂项(Misc.)。 ( B类 )基于基因本体注释的生物过程分析饼图。 ( C )维恩图显示了我们的iTRAQ-2D-LC-MS/MS策略确定的蛋白质的存在、缺失或重叠,以及之前从8项蛋白质组学研究中获得的2489种CRC细胞外体蛋白。 根据这些已知的2489种蛋白质的识别数量,将其分为8类,范围从n到n = 1到n = 8.识别的计数越高,可靠性越高。 ( D类 )差异表达外体蛋白的Western blotting验证。 进行密度测定以量化每个通道,并在每个印迹下显示整个细胞裂解液中每个蛋白质与负载控制β-肌动蛋白或外显子中CD63的比率,WT细胞中的比率为参考值。 根据我们的定量蛋白质组学结果,CD63的表达在三种外泌体类型中相对一致,因此在本研究中它被用作外泌物部分的负载控制。 具有代表性的考马斯蓝染色SDS-PAGE凝胶如图所示 补充图S3 结果表明,这三种制剂中的外体蛋白水平相当。
通过将WT细胞的外体蛋白作为参考,共有3173个蛋白被成功定量。 在技术和生物复制中去除CV>0.5的蛋白质后,剩下3003个蛋白质( 补充表S2 ). 四个技术复制品的定量CV小于10.7%。
为了更严格地筛选生物学上有显著变化的蛋白质,我们采用了折叠变化≤0.63和≥1.60以及 P(P) ≤ 0.05. 最后,在WT和MT细胞外泌体(MT vs.WT, 补充表S3 )WT和KO细胞外泌体之间的494个蛋白质(KO vs.WT, 补充表S4 )以及MT和KO细胞外泌体之间的825个蛋白质(MT vs.KO, 补充表S5 ).
差异表达外体蛋白的Western blotting验证 为了证实iTRAQ-2D-HPLC-MS/MS结果,对特定的候选蛋白进行了蛋白质印迹分析( 图2D ). 与蛋白质组学结果类似,NPM1、KHSRP、PES1和RhoA在MT外泌体中的表达水平增加,而CCNB1在KO外泌体内的表达水平升高。 此外,与WT外显体相比,MRE11A在MT和KO外显体内的表达均增加,而HMGB1在WT外泌体中的表达更为强烈。 因此,蛋白质印迹分析中确定的变化趋势与我们的定量蛋白质组结果一致。
MT和KO外泌体中常见差异表达蛋白 为了研究MT和KO细胞中确定的外泌体尺寸减小的潜在机制,我们分析了MT和WT组以及KO和WT两组共享的41个差异表达蛋白( 补充表S6 ). 两组中41个蛋白中有17个下调,41个蛋白质中有14个上调; 其余蛋白在各组之间表现出不一致的表达趋势。
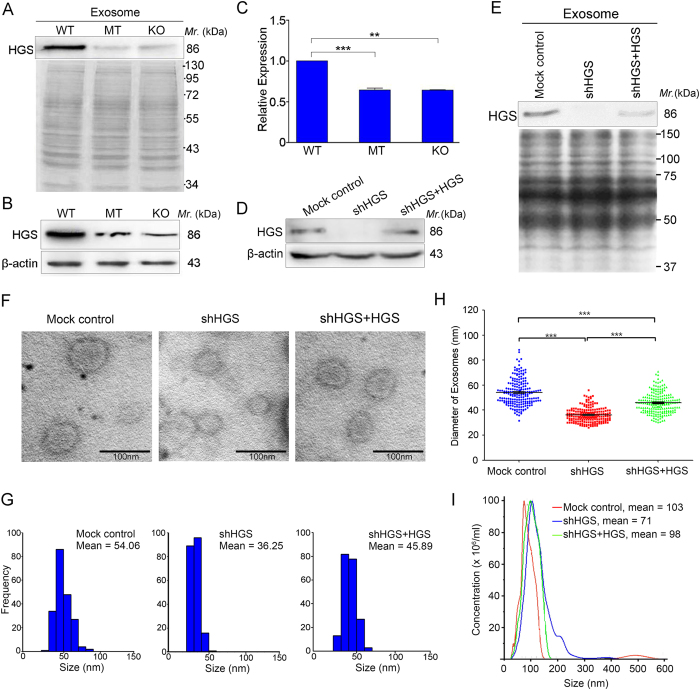
HGS的敲除降低外显子大小 在MT与WT和KO与WT细胞中具有一致改变的31种差异表达蛋白中,与MT和KO细胞分泌的外泌体相比,WT细胞分泌的外泌体中肝细胞生长因子调节的酪氨酸激酶底物(HGS)的表达水平增加(MT与WT,比率0.63;KO与WT。 重量,比率0.60)。 据报道,HGS与外体生物发生有关。 因此,我们随后研究了HGS与减少的外显子大小之间的关系。 我们最初证实了HGS在三种细胞系的外显子中的表达( 图3A ). 与WT外体相比,MT和KO外体中的HGS表达下调,这与我们的蛋白质组学结果一致。 其次,在三个细胞的全细胞裂解物中检测到HGS的表达。 如所示 图3B 与WT细胞相比,MT和KO细胞中的HGS也降低。 第三,进行qRT-PCR分析以确定其是否在转录水平上发生了失调。 我们确定 HGS公司 MT和KO细胞的mRNA显著降低( 图3C ),这表明 TP53型 可以调节 HGS公司 、和 TP53型 (R273H)突变体没有保留这种功能。
图3。 HGS缺失导致较小的外泌体。
( A类 )用蛋白质印迹法确认不同细胞系外显子中的HGS水平。 使用考马斯蓝染色SDS-PAGE凝胶作为加载控制。 ( B类 )Western blotting检测野生型全细胞裂解液中HGS蛋白水平 TP53型 (重量), TP53型 (R273H)-突变体(MT)和 TP53型 -空(KO)HCT116细胞。 β-actin作为内部对照。 ( C )实时PCR检测 HGS公司 WT、MT和KO细胞中的mRNA水平** P(P) < 0.01; *** P(P) < 0.001. ( D类 )HCT116细胞中HGS的敲除与拯救。 用慢病毒将pLKO.1-shHGS或模拟对照质粒稳定转染HCT116细胞。 在拯救实验中,通过pCMV6-Myc-DDK-HGS质粒转染,HGS在HCT116-shHGS细胞中体外表达。 β-actin作为内部对照。 ( E类 )Western blotting检测HGS敲除(HCT116-shHGS)、HGS恢复(HCT16-shHGS-HGS)和模拟对照细胞分泌的外泌体中HGS水平。 使用考马斯蓝染色SDS-PAGE凝胶作为加载控制。 ( F类 )从所示组收集的无血清条件培养基中分离出的外泌体的代表性电子显微照片。 比例尺,100 纳米; 直接放大,120000x。 ( G公司 )根据电子显微图像计算200个外泌体的平均直径分布,并绘制指示大小的外泌物频率。 (H) 各组外泌体大小分布的统计分析。 n个 = 每组200个外泌体*** P(P) < 0.0001. ( 我 )通过NanoSight颗粒追踪分析从指定组中分离出的外显子的代表性大小分布。
为了确定较低的HGS水平是否会降低外显子大小,我们敲除了内源性 HGS公司 在HCT116细胞中使用稳定的shRNA慢病毒系统( 图3D,E ). 结果表明,胞外体平均直径从54.06显著下降 ± 10.34至36.25 ± 5.62 HGS耗尽后nm( P(P) < 0.0001; 图3F、H ). 此外,与对照组相比,转染特定siRNA靶向HGS的HCT116细胞也分泌较小的外泌体( 补充图S4 ). 为了确定HGS是否足以确定对外显子大小的影响,通过添加shRNA-resistant HGS质粒进行拯救试验。 Western印迹表明,转染的总细胞裂解物中HGS的表达恢复到对照水平; 然而,外泌体中的蛋白质含量没有完全恢复( 图3D,E ). 电子显微镜分析表明,与HGS稳定敲除细胞(平均直径:45.89)相比,转染细胞中的外显子大小部分被挽救 ± 8.14 与36.25相比 ± 5.62 分别为nm, P(P) < 0.0001); 然而,胞外体的大小仍然小于模拟对照细胞(平均直径:45.89 ± 8.14 与54.06相比 ± 10.34 nm; P(P) < 0.0001; 图3F、H ). 此外,通过高分辨率NanoSight系统证实了模拟对照、HGS稳定敲除和拯救表达细胞中确定的外显子大小的改变( 图3G,I ). 因此,HGS水平较低可能导致外体较小,而HGS是维持外体大小的必要条件。
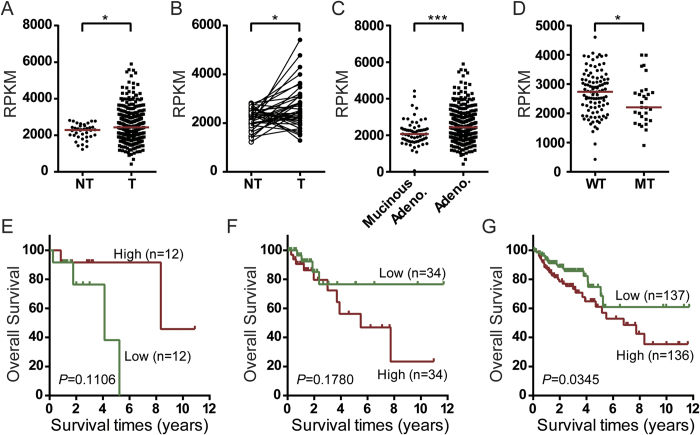
人类CRC组织中HGS mRNA表达与TP53状态相关 确定是否 HGS公司 临床人类样本中的mRNA也受到TP53突变的影响,我们分析了结肠癌患者(n = 459)摘自癌症基因组图谱(TCGA)。 我们最初比较了 HGS公司 在肿瘤组织和非肿瘤组织之间。 肿瘤组织中的水平显著增加(所有 P(P) < 0.05; 图4A、B ). 在结肠癌的不同病理亚型中,我们随后确定结肠粘液腺癌中的HGS水平显著低于结肠腺癌( P(P) < 0.0001; 图4C ). 此外,在结肠腺癌患者中 TP53型 经130例验证。 值得注意的是,我们确定HGS的表达在 TP53型 突变群( 图4D )这与我们在WT和MT细胞中的发现一致。
图4。 HGS转录表达与 TP53型 TCGA结肠癌RNA-Seq数据集中的状态。
在加州大学圣克鲁斯分校的基因组浏览器数据库(UCSC,hg19)中,HGS基因有两个转录物,uc002kbg.3和uc010wus.2。 前一个转录本包含主要转录本,其在CRC中的平均丰度是uc010wus的350倍以上。 此外,TP53基因有13个转录本。 Uc002gij.3是主要的全长变体,而其他转录物在CRC中几乎不表达。 因此,我们基于uc002kbg.3和uc002gij.3进行了这些分析。 ( A类 )HGS mRNA在结肠腺癌患者的肿瘤组织中显著上调(n = 392)与相邻的非肿瘤组织(n = 38). * P(P) < 0.05. ( B类 )配对结肠腺癌和非肿瘤组织(n = 38),观察到相同的趋势* P(P) < 0.05. ( C )对于两种病理类型的结肠癌,腺癌组织中HGS mRNA水平显著升高(n = 392)与粘液腺癌(n = 62). *** P(P) < 0.0001. ( D类 )在结肠腺癌中 TP53型 该基因在130例患者中得到验证。 HGS mRNA水平在 TP53型 突变组(MT,n = 29)与野生型组(WT,n = 101). * P(P) < 0.05. ( E类 )TP53突变结肠腺癌患者的Kaplan-Meier曲线(n = 48). ( F类 )野生型TP53结肠腺癌患者的Kaplan-Meier曲线(n = 68). ( G公司 )所有结肠腺癌患者的Kaplan-Meier曲线(n = 273). 对数秩检验在( E–G公司 ).
突变患者 TP53型 ,野生型 TP53型 所有有可用总生存率的病例,我们根据RPKM(每百万读记录千基读数)的中位数,将每组分为两个亚组,高水平和低水平 HGS公司 在肿瘤组织中。 重要的是,Kaplan-Meier曲线分析表明 HGS公司 与较短的生存时间有关 TP53型 突变群( 图4E ). 然而,在 TP53型 野生型组,HGS水平高的患者更容易活得更短( 图4F ). 当对所有病例进行分析时,高水平的HGS与较短的总生存期显著相关( P(P) = 0.0345, 图4G ).
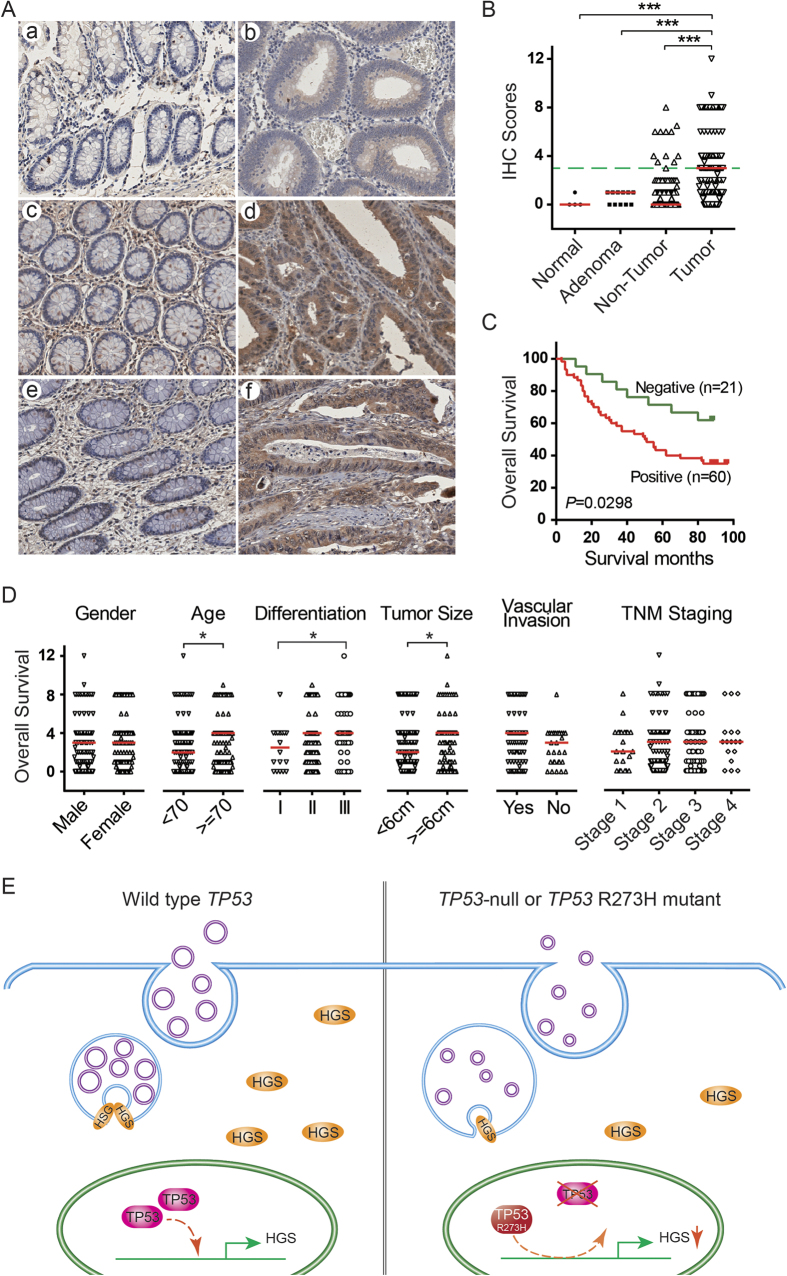
HGS过度表达与CRC预后不良相关 为了证实HGS在转录水平上的异常表达,在正常大肠粘膜(n = 4) ,管状腺瘤(n = 11) 235对恶性肿瘤及其毗邻的正常大肠组织。 正常大肠粘膜中几乎未检测到HGS。 HGS在良性管状腺瘤组织中呈阴性表达; 然而,略有增加( 图5A、B ). 在4.7%(11/235)的邻近非癌组织和45.1%(106/235)的CRC肿瘤中分别观察到HGS的细胞质免疫染色阳性。 与邻近的非肿瘤、管状腺瘤和正常大肠组织相比,CRC肿瘤组织中HGS的上调显著(均为 P(P) < 0.0001).
图5。 HGS蛋白在人CRC标本中的表达及临床病理特征。
( A类 )正常大肠粘膜(a)、管状腺瘤(b)、邻近非肿瘤组织(c、e)和CRC肿瘤(d、f)中HGS表达的代表性免疫组织化学图像(x200倍放大)。 ( B类 )免疫组织化学法测定正常大肠粘膜中HGS水平的分布(n = 4) 管状腺瘤(n = 11) 、邻近的非肿瘤组织和匹配的CRC肿瘤(n = 235)组。 短红线代表每组的中值。 绿色虚线表示阳性染色的阈值。 ( C )HGS阴性和阳性CRC患者的Kaplan-Meier曲线。 进行对数秩检验。 ( D类 )235例CRC患者HGS表达的临床病理特征分析。 短红线代表每组的中值*** P(P) < 0.0001; * P(P) < 0.05. ( E类 )角色示意图 TP53型 在CRC的胞外体生产中。 野生型 TP53型 刺激HGS的高水平表达。 作为MVB分选的关键分子,HGS识别并随后将货物引导至内腔。 在其他ESCRT复合物的配合下,成熟的MVB包含若干ILV,这些ILV与质膜形成并融合以释放其ILV,称为外泌体。 然而,当 TP53型 在密码子273(R273H)处缺失或突变,HGS表达降低。 在这种情况下,依赖HGS的ILV形成被抑制。 存在包含均匀较小ILV的放大MVB。 HGS对于维持外泌体的大小和控制外泌体的成分是必要的。
随后的Kaplan-Meier生存分析表明,细胞质HGS阳性表达水平与较短的总生存时间之间存在显著相关性( P(P) = 0.0298)在CRC患者中( 图5C ). 阳性表达组和阴性表达组的中位生存时间分别为50和87个月。 单变量和多变量Cox回归分析都证实了这些发现( 表1 ). 在单变量分析中,与HGS阴性表达组相比,HGS阳性患者的总生存率增加了2.27倍( P(P) = 0.0353). 其他重要危险因素包括血管浸润、肿瘤浸润深度、淋巴结转移、远处转移和TNM分期。 在多变量分析中,只有HGS表达(RR = 3.34中, P(P) = 0.0221),TNM分期(RR = 2.37, P(P) = 0.0006)和血管侵犯(RR = 5.50, P(P) = 0.0167)是死亡率的独立预后因素。
表1。 235例CRC患者HGS表达对总生存率的单变量和多变量生存分析。
相对风险(95%CI)
P(P) 价值
单变量
年龄(≥70岁vs.<70岁) 1.81 (0.99–3.33) 0.0549
性别(女性vs.男性) 1.18 (0.89–1.58) 0.2545
差异化(较差vs.中等vs.良好) 1.38 (0.87–2.18) 0.1731
肿瘤大小(≥6 与<6 厘米) 1.66 (0.93–2.94) 0.0850
血管侵犯(是与否) 2.27 (1.09–4.75) 0.0291
肿瘤浸润深度(T4 对比T3对比T1 + T2) 1.62 (1.12–2.33) 0.0095
淋巴结转移(N1b、c+N2与N0 + N1a) 2.41 (1.32–4.40) 0.0042
远处转移(M1 vs.M0) 10.19 (2.45–42.37) 0.0014
TNM分期(IV vs.III vs.II vs.I) 2.17 (1.34–3.50) 0.0016
HGS表达(阳性vs.阴性) 2.27 (1.06–4.86) 0.0353
多变量
血管侵犯(是与否) 5.50 (1.73–239.0) 0.0167
TNM分期(III和IV与I和II) 2.37 (1.32–4.25) 0.0006
HGS表达(阳性vs.阴性) 3.34 (1.19–9.41) 0.0221
还分析了临床病理特征与HGS表达水平之间的相关性( 图5D ). 老年患者HGS水平升高( P(P) = 0.0169),分化不良( P(P) = 0.0340)和更大的肿瘤尺寸( P(P) = 0.0259). HGS与性别、血管侵犯或TNM分期等其他特征无相关性。
讨论 在正常结肠组织逐步形成CRC的过程中 TP53型 突变是晚期腺瘤和癌之间紧随初始阶段的第二个关键遗传步骤 自动功率控制 基因突变 三 .由于突变体的功能获得 TP53型 ,这些突变与CRC的晚期肿瘤以及血管和淋巴管侵犯有关 18 , 19 Dukes D期肿瘤患者, TP53型 突变也与明显较差的结果相关 18 在本研究中 TP53型 HCT116细胞中突变体R273H促进增殖和迁移,这与以前的文献一致 9 , 10 , 20 , 21 , 22 .
迄今为止,已有8项蛋白质组学研究确定了CRC细胞中的外体蛋白。 外体蛋白的数量从111个到1148个不等 23 , 24 , 25 , 26 , 27 , 28 , 29 , 30 我们根据识别号的数量将2489个蛋白质分为8组,然后将这些数据与我们的CRC外显子数据集重叠(n = 3430)。 除了识别计数≥7且符合率>85%的两组外,其余六组与我们数据集中的蛋白质比例相似(范围为49.5%至74.4%)( 图2C ). 此外,我们的分析确定了1956个额外的蛋白质,而之前报道的1015个CRC外显子蛋白不包括在我们的数据集中。 未鉴定或新鉴定的蛋白质可能来自不同的CRC细胞系、胞外体分离方法和不同研究中使用的蛋白质组学技术。 然而,毫无疑问,我们的研究产生了迄今为止最大的CRC外显子数据集。
突变的癌基因可能改变外泌体分泌。 突变体KRAS显著影响CRC外显体蛋白质组的组成:来自突变体KRA细胞的外显体包含许多促肿瘤蛋白,包括KRAS 27 然而,在我们的研究中没有发现TP53蛋白,也没有发现先前报道的CRC外体蛋白,这表明TP53没有在细胞之间转移。
先前的研究表明,外泌体的产生依赖于 TP53型 状态,并受到其靶基因的刺激 TSAP6型 和 热电联产4C 辐照应力下 15 , 16 。随后的研究 Tsap6型 -空白小鼠证实外显子的产生在 Tsap6型 -空单元格 31 然而,最近的一项研究表明,TP53/TSAP6通路并不调节外泌体释放到CRC患者血浆中 17 TSAP6是一种糖基化铁还原酶,参与内体途径的调节 31 TSAP6在肺癌细胞、小鼠胚胎成纤维细胞和小鼠脾组织的外泌体中检测到 15 , 16 , 31 ; 然而,在CRC的DLD-1细胞的外泌体中仅发现一次 27 CHMP4C是ESCRT-III蛋白复合物的一种成分,受 TP53型 并在肺癌细胞的外泌体中发现 16 在CRC中,CHMP4C被认为是转移性SW620细胞与原代SW480细胞中差异表达的外体蛋白 30 然而,这些蛋白质在我们的研究中没有被鉴定出来。 这些蛋白在外显体中的出现可能是细胞类型特异性的。 在这种情况下,外显体的形成也可能依赖于细胞/组织环境和外部刺激。 因此,我们的研究表明 TP53型 改变CRC细胞外泌体的组成,而这种改变不是由 TSAP6型 和 热电联产4C 路径。
值得注意的是,我们确定与WT细胞相比,MT和KO细胞的外显子大小显著减小,这意味着 TP53型 通过一种新的机制调节外泌体的产生。 为了研究这一机制,我们将重点放在MT组与WT组以及KO组和WT组中具有一致变化的共享差异表达蛋白上。 在31种蛋白质中,由于HGS在内胚体通路中的作用,因此选择HGS进行进一步分析。 HGS是ESCRT-0复合体的关键组件,是MVB分拣所必需的。 HGS识别单泛素化蛋白质,随后将货物引导至内腔并招募ESCRT-I复合物 32 .沉默 HGS公司 据报道,在HeLa细胞中可以诱导产生增大的MVB,MVB通常包含直径小于40的均匀小ILV 纳米 33 . HGS公司 沉默也减少了50–100个囊泡的分泌 纳米和100–200 与对照细胞相比直径为nm 34 在本例中,ESCRT依赖型和CD63依赖型ILV形成上调 33 CD63用于将一些货物独立分拣至ILV 12 , 33 此外,以前的研究表明,依赖于ESCRT的ILV的大小或形成可能取决于泛素化货物的数量 33 , 35 .在没有HGS的情况下,ESCRT依赖的萌芽可能会继续; 然而,货物数量的减少导致小型ILV的形成 33 基于Uniprot数据库中翻译后修饰的注释,我们分析了泛素化蛋白在差异表达蛋白中的比例( 网址:http://www.uniprot.org/ ). 对于MT组与WT组,下调和上调蛋白中泛素化蛋白的比例分别为32.1%(17/70)和20.3%(16/79)( P(P) = 0.5541). 然而,对于KO组和WT组,泛素化蛋白在下调蛋白中显著富集[分别为22.6%(61/270)和8.0%(79/224), P(P) < 0.0001]. 这些发现表明MT和KO细胞中假定的泛素化蛋白载量减少。 此外,HGS耗竭导致胞外体生成减少,这与HCV感染细胞中丙型肝炎病毒(HCV)释放减少平行 36 在未接受抗逆转录病毒治疗的HIV-1感染患者的血浆中,外泌体的一些微小RNA含量水平,如miR-155和miR-223,但不是miR-92,与外泌体的丰度和大小呈强负相关 37 因此,不同的ILV尺寸表明ILV亚群及其货物具有不同的生成机制。
此外,我们的透射电镜和NanoSight分析结果表明,MT和KO细胞的外显子直径约为WT细胞直径的一半,其外显子丰度是WT细胞丰度的两倍以上( 图1D ). 因此,MT和KO细胞外泌体的总脂质含量与WT细胞相比保持不变。 然而,对于单个外泌体,最近的一项研究也表明,HGS耗竭以独立于ESCRT复合物的方式在内吞途径中导致LDL衍生胆固醇的积累 38 胆固醇含量增加可能有助于膜芽生并诱导小ILV形成 33 , 39 此外,已证明ESCRT复合物可诱导脂质相分离 40 因此,外显体中的脂质类型似乎随着外显体的大小而改变。
在这里,我们还发现HGS在 TP53型 (R273H)突变体和 TP53型 -空单元格。 此外,在结肠癌的临床标本中,我们还确定TP53突变与低水平HGS相关。 击倒 HGS公司 大幅度减小了胞外体的大小 HGS公司 表达恢复了外显子大小。 这些发现表明 HGS公司 是一个 TP53型 -负责控制CRC外显子大小的调控基因。 HGS不是已知的TP53靶基因。 TP53野生型临床标本中TP53和HGS mRNA水平无显著相关性(R = 0.1509, P(P) = 0.1172). 野生型TP53似乎以间接方式调节HGS的表达。 有趣的是,在TP53突变和野生型患者中,HGS mRNA的高水平分别表现出短期死亡趋势的降低和增加( 图4E,F ). 然而,在所有情况下,HGS mRNA在结肠癌中都是一个不利的预测因素( 图4G ). 这些发现表明,HGS mRNA表达的调节是一个复杂的过程,受人体内多种因素的驱动。 HGS的调节机制正在探索中。 然而,这些结果表明 TP53型 通过 HGS公司 ,而 TP53型 功能障碍可能损害这一主要机制并上调CD63依赖途径( 图5E ).
HGS公司 是胚胎发育和正常细胞内环境稳定所必需的基因。 携带纯合子零突变的小鼠 HGS公司 在第11天左右表现出胚胎致死性(E11) 41 HGS的过度表达降低了大鼠神经鞘瘤细胞中EGFR和EGF-介导的STAT3激活 42 基于非常有限的临床标本,HGS蛋白在不同来源的多种肿瘤(胃、结肠、肝脏、宫颈和黑色素瘤)中过度表达。 沉默 HGS公司 由于E-cadherin的上调和β-catenin信号的减少,HeLa细胞的增殖、肿瘤发生和转移潜能减弱 43 我们一致证明,随着CRC肿瘤的发生,HGS蛋白的表达逐渐增加。 此外,高水平的HGS蛋白与较差的肿瘤生物学行为相关,如分化较差、肿瘤较大和预后不良。 因此,HGS可能通过调节肿瘤微环境的组成部分参与肿瘤的进展。 我们实验室正在进行更多的调查。
总之,我们调查了 TP53型 CRC细胞系HCT116中肿瘤衍生外泌体的功能障碍。 我们发现这两种细胞分泌的外泌体尺寸减小 TP53型 (R273H)突变体和 TP53型 -空单元格与 TP53型 野生型细胞。 随后使用iTRAQ-2D-LC-MS/MS策略对外体蛋白进行了定量蛋白质组学分析,结果表明,作为ESCRT-0复合物的关键组成部分,HGS在外体中的表达下调,而HGS的表达上调的程度与外体蛋白的表达水平无关 TP53型 (R273H)突变细胞和空细胞。 进一步验证表明 TP53型 状态调节HGS表达,HGS对于维持大尺寸肿瘤源性外泌体是必要的。 似乎抑癌基因 TP53型 肿瘤微环境的重塑通过ESCRT依赖的外泌体分泌机制促进致癌。 HGS可能是CRC治疗干预的新生物标志物和靶点。
材料和方法 细胞培养与稳定细胞系的构建 人类结肠癌细胞HCT116是从美国类型培养物收集中心(美国马里兰州罗克维尔)获得的。 HCT116型- TP53型 (−/−) 这些细胞由Bert Vogelstein博士(美国马里兰州巴尔的摩约翰霍普金斯大学)提供。 细胞在添加10%胎牛血清的RPMI 1640培养基中培养(HyClone,Logan,UT,USA),100 U/ml青霉素和100 μg/ml链霉素。
pCMV6-Myc-DDK-AC表达质粒含有 TP53型 突变体(R273H)(分类号RC400073)和对照质粒购自Origene(美国马里兰州罗克维尔)。 HCT116细胞转染了 TP53型 根据制造商的说明,使用Lipofectamine 2000(美国加利福尼亚州卡尔斯巴德市生命技术公司)的突变和控制载体。 24天后 小时后,通过添加G418(Sigma-Aldrich,St.Louis,MO,USA)对细胞进行筛选。 选择14天后,收获稳定的细胞系(混合克隆)供使用。
为了稳定敲除HCT116细胞中肝细胞生长因子调节酪氨酸激酶底物(HGS)基因,特异性靶序列(5′-TGTACTTCACCTGAA-3′) 34 合成并并入慢病毒短发夹(sh)RNA载体pLKO.1。 慢病毒包装后,HCT116细胞被感染,随后用嘌呤霉素进行筛选。
为了恢复HCT116 shHGS稳定细胞中的HGS表达,使用Lipofectamine 2000转染pCMV6-Myc-DDK-HGS表达质粒(目录号RC200609,Origene)。
外显体分离 来自HCT116(缩写为WT)、HCT116的条件培养基- TP53型 (R273H)(缩写MT)和HCT116- TP53型 (−/−) (缩写为KO)细胞在 3000 15克 4时最小值 °C以去除细胞碎片。随后将上清液加入具有3000道尔顿MWCO的Amicon Ultra离心过滤器(Millipore,Bedford,MA)中,并在4 °C(摄氏度) , 4000 g至最终体积500 μL。 浓缩培养基与ExoQuick混合 TM(TM) 外显子沉淀溶液(System Biosciences,San Francisco,CA),比例为1:1(v/v),培养温度为4 °C过夜。 第二天,混合物在4 °C(摄氏度) , 1500 30克 min,并将沉淀重新悬浮以供进一步使用。
对于救援实验,24小时后 用pCMV6-Myc-DDK-HGS载体转染h后,HCT116-shHGS细胞用PBS冲洗三次,然后在无血清培养基中培养24小时 外体分离时间。
外泌体的透射电子显微镜 提取的外泌体在PBS中重新悬浮,安装在铜-甲壳虫型网格上,并使用2%磷钨酸进行10次负染 min。在清除多余液体后,对格栅进行空气干燥,然后使用CM120透射电子显微镜(荷兰飞利浦)在80℃下进行评估 千伏。
外体颗粒大小分布分析 如前所述测量外泌体的平均直径 27 简而言之,使用Image J软件测定了两种独立外显子制剂(共200个)的透射电镜图像中的200个外显子。
根据制造商的协议(英国马尔文Malvern Instruments公司),对NanoSight NS500进行实时高分辨率颗粒检测和尺寸测定。 利用纳米颗粒追踪分析系统比较不同细胞系外显子大小和丰度的变化。
蛋白质提取 细胞和分离的外泌体在RIPA缓冲液中溶解[25 mM Tris–HCl(pH 7.5),150 mM NaCl、1%NP-40、1%脱氧胆酸钠和0.1%十二烷基硫酸钠],加蛋白酶抑制剂鸡尾酒(罗氏应用科学公司,德国),冰敷30分钟 min,偶尔晃动。 通过在12000下离心除去不溶性组分 15克 4分钟 °C。 使用RC DC蛋白质测定法(Bio-Rad,Hercules,CA)测量蛋白质浓度。
蛋白质组测量 样品制备 如前所述,通过过滤辅助样品制备结合微波辅助蛋白质制备方法来消化胞外体蛋白质 44 , 45 .肽通过真空离心干燥并储存在−80 摄氏度。
根据制造商的协议(马萨诸塞州弗拉明翰市AB Sciex),用iTRAQ技术对消化后的样品进行标记,然后将这些样品平均汇总用于以下分析。
一维高氢RPLC分离 使用Waters(4.6)的高H RPLC柱对标记样品的混合液进行分馏 毫米 × 250 毫米,C18,3 微米)。 将样品加载到缓冲液A1(0.1%氨水溶液,pH)中的色谱柱上 = 10) 并用缓冲液B1洗脱(0.1%氨水在10%水和90%ACN中;pH = 10,流量 = 1 mL/min),梯度为5–90%,适用于60 min。将洗脱的肽收集在60个组分中,并合并在20个样品中。
LC-MS/MS分析 将每个样品分成两部分,随后在RP C18自填充毛细管LC柱(75 微米 × 100 毫米,3 微米)。 使用三重TOF5600质谱仪(AB-Sciex)分析样品。 洗脱梯度持续100 最小洗脱梯度为5–30%缓冲液B2(0.1%甲酸,99.9%ACN;流速,0.3 μL/min)用于分析。 MS数据是使用以下参数在高灵敏度模式下采集的。 每一次完整扫描均采集30次数据相关的MS/MS扫描。 使用滚动碰撞能量、电荷状态筛选(包括电荷状态为+2至+4的前驱体)和动态排除(排除持续时间为15 s) 已执行。
数据库搜索 根据Uniprot数据库的人类子集(84910个条目)搜索MS/MS光谱( 网址:http://www.uniprot.org/ )使用吉祥物软件版本2.3.02(英国矩阵科学)。 选择胰蛋白酶进行切割,最多允许两次错过切割。 将氨基甲酰化(C)和iTRAQ 4复合标签设置为固定修饰。 使用0.05 Da的肽和产物离子耐受性进行搜索。使用Scaffold软件通过以下过滤器使用诱饵数据库方法进一步过滤数据库搜索结果:蛋白质水平的假阳性率为1%,每个蛋白质有两个独特的肽。 如前所述过滤结果后,将MS/MS扫描的不同报告离子通道中的肽丰度归一化。 蛋白质丰度比基于独特的肽结果。 折叠变化≥1.6的蛋白质被认为发生了显著变化。
蛋白质印迹分析 总细胞裂解物(20 μg)或胞外体裂解物(15 μg)在10%SDS-PAGE上分离,并转移至聚偏二氟乙烯膜(Millipore)。 封闭后,用以下抗体对膜进行印迹:抗HSP70(分类号sc33575)、抗CD63(分类号sc15363)、抗NPM1(分类号sc4772)(德克萨斯州达拉斯圣克鲁斯)、抗BNIP3(分类号ab10433)、抗-CD9(分类号ab92726)(英国剑桥Abcam)、抗β-肌动蛋白(分类号4970)、抗CCNB1(分类号4135)、, 1:1000稀释度的抗MRE11(分类号#4895S)、抗HMGB1(分类编号#3935)、抗RhoA(分类号#1177)(Cell Signaling Technology,Danvers,MA,USA),以及1:500稀释度的防HGS(分类号WH0009146)、抗KHSRP(分类号HPA034739)和抗PES1(分类编号HPA062439)(Sigma-Aldrich)。 在强化洗涤后,用抗小鼠或兔辣根过氧化物酶偶联的二级抗体(细胞信号技术)以1:5000的稀释度开发膜。 使用Super Signal West Femto Maximum Sensitivity Substrate(Thermo Fisher Scientific,Waltham,MA,USA)和ImageQuant LAS4000系统(Fujifilm,Tokyo,Japan)对蛋白质带进行可视化。
细胞增殖试验 使用细胞计数试剂盒-8(CCK-8)(日本道津道)测定HCT116模拟对照细胞和HCT116-p53(R273H)细胞的生长。 将3000个细胞接种到96个培养皿中,然后用10个细胞进行培养 培养基中2μL CCK-8试剂 h.在450℃时检测吸光度值 在第1天、第2天、第3天、第4天和第5天,使用680型微孔板阅读器(Bio-Read)。
伤口愈合分析 细胞在6孔板中生长汇合。 人工伤口痕迹是通过用吸管尖端刮除融合细胞单层而形成的。 通过用PBS轻轻洗涤去除分离的细胞后,将细胞与无血清培养基一起孵育,使细胞能够迁移到开放区域。 细胞迁移到伤口区域的能力在0和24时进行评估 抓取至少三个随机选择的受伤部位的显微照片后h。 实验独立进行了三次。
定量实时逆转录酶-聚合酶链反应(qRT-PCR) 使用TRIzol试剂(Life Technologies)提取HCT116、HCT116-p53(R273H)和HCT116-p53中的总RNA (−/−) 细胞和互补DNA是使用SuperScript™III第一链合成系统(生命技术)生成的。 在CFX96 Touch™实时PCR检测系统(Bio-Read)上使用SYBR Premix二聚体橡皮擦(Perfect Real Time)试剂盒(日本志贺县Takara Bio)进行qRT-PCR检测。 β-肌动蛋白基因(ACTB)被用作内源性控制。 每项实验一式三份。 这些基因的基因特异性引物如下:HGS:正向5′-ACTGGAGGAGAAAGGCGAAG-3′,反向5′-GGACTCCAATCTGTCCAAC-3′; ACTB:正向5′-GGCACACACAATGAAG-3′,反向5′-GCCGATCACAGTACT-3′。 使用基因值与b-actin的比值以及随后的对照计算相对表达。
免疫组织化学染色 从上海奥多生物技术有限公司(中国上海)购买了福尔马林固定石蜡包埋的四个组织芯片,其中包括4个正常大肠粘膜、11个管状腺瘤和235对恶性肿瘤及其匹配的相邻正常大肠组织。 样本用抗HGS抗体染色(英国剑桥Abcam分类号ab56468),并使用Aperio ScanScope CS软件(美国加利福尼亚州Vista)捕获图像。 结果由两名独立的病理学家独立评估。 如前所述,对HGS染色强度和面积进行量化 46 使用染色指数,其中< = 3人被视为阴性,且> = 4例为阳性表达。
TCGA RNA测序数据挖掘、生物信息学和统计分析 从TCGA下载了公开的结肠癌RNA-Sequencing数据集。 使用459名患者的标准化转录(亚型)表达数据。 Mann-Whitney U检验用于比较两组之间的RPKM(每千基转录本每百万读映射的读数)。
使用FunRich工具进行基因本体(GO)注释和新的外体蛋白分析( http://funrich.org/ ). 为了评估不同组之间的差异,采用了Kruskal-Wallis单因素方差分析或Mann-Whitney秩检验。 采用Kaplan-Meier方法和log-rank分析比较存活曲线。 使用Cox回归模型进行单变量和多变量分析。 P(P) -值 < 0.05被认为具有统计学意义。 所有分析均使用SPSS 17.0版(IBM软件)进行。
其他信息 如何引用这篇文章 :孙,Y。 等。 一本小说 TP53型 路径影响 HGS公司 -大肠癌中介导的外体形成。 科学。 代表。 6 , 28083; doi:10.1038/srep28083(2016)。
致谢 这项工作得到了国家自然科学基金(81572365、81372591、81572840和81321091)、国家重点基础研究发展计划(2011CB910703、2014CBA02005、2014CBA02002和2014CBA02001)和中国科学技术部重点基础研究计划(2013FY114100)的资助。 我们要感谢国家生物医学分析中心Tao Zhou博士和Sa Zhang博士的电子显微镜协助; 北京化工大学魏婷婷博士协助NanoSight NS500分析; 北京国家生物科学研究所宋黄博士提供pLKO-shHGS质粒; 与北京协和医科大学基础医学研究所石磊博士进行建设性讨论。
脚注 作者贡献 X.Z、W.S.、Y.S.、Z.Z、Y.X和Q.Z构思并设计了实验。 Z.G.、L.Z.(Lin Zhu)、Q.J.、J.G.、L.Z.(Lanping Zhou)和F.L.进行了实验。 Y.S.、W.Z.和L.Z.(林周)对数据进行了分析。 Y.S.、W.Z.和X.Z.写了手稿。
工具书类
杰马尔A。 等。 全球癌症统计。 加州癌症杂志临床。 61, 69–90 (2011). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Fearon E.R.和Vogelstein B。 大肠肿瘤发生的遗传模型。 单元格 61, 759–767 (1990). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Markowitz S.D.和Bertagnolli M.M。 癌症的分子起源:结直肠癌的分子基础。 北英格兰。 医学杂志。 361, 2449–2460 (2009). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Brosh R.&Rotter V.当突变体获得新的能力:来自突变体p53领域的消息。 自然评论。 癌症 9, 701–713 (2009). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
纳卡拉蒂A。 等。 TP53基因的突变和多态性——结直肠癌作用综述。 突变 27, 211–218 (2012). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
于杰(Yu J.)。 等。 结直肠癌中新的复发突变基因和预后突变特征。 肠子 64, 636–645 (2015). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
癌症基因组图谱,N。人类结肠癌和直肠癌的综合分子特征。 自然 487, 330–337 (2012). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Bisio A.、Ciribilli Y.、Fronza G.、Inga A.和Monti P。 癌症进展的巴贝尔塔中的TP53突变体。 嗯,变种人。 35, 689–701 (2014). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
沃恩C.A。 等。 通过上调受体蛋白酪氨酸激酶Axl获得肺癌突变型p53的功能活性。 基因癌症 3, 491–502 (2012). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
李杰(Li J.)。 等。 突变株TP53 p.R273H和p.R273C而不是p.R273G会增强癌细胞恶性度。 嗯,变种人。 35, 575–584 (2014). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Henne W.M.、Buchkovich N.J.和Emr S.D。 ESCRT途径。 开发单元 21, 77–91 (2011). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
范·尼尔·G。 等。 在黑色素生成过程中,四跨肽CD63调节ESCRT非依赖性和依赖性的内体分选。 开发单元 21, 708–721 (2011). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Stoorvogel W.、Kleijmeer M.J.、Geuze H.J.和Raposo G。 外泌体的生物成因和功能。 交通 3, 321–330 (2002). [ 内政部 ] [ 公共医学 ][ 谷歌学者 ]
克莱顿A.和梅森M.D。 肿瘤免疫中的外显子。 货币。 昂科尔。 16, 46–49 (2009). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ][ 谷歌学者 ]
Yu X.、Harris S.L.和Levine A.J。 外泌体分泌的调节:p53蛋白的一种新功能。 癌症研究。 66, 4795–4801 (2006). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Yu X.、Riley T.和Levine A.J。 抑癌基因p53对内胚体隔室的调节。 FEBS J公司。 276, 2201–2212 (2009). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
席尔瓦·J·。 等。 外显子释放及其在结直肠癌中的预后价值分析。 基因染色体癌 51, 409–418 (2012). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
伊阿科佩塔B。 等。 结直肠癌TP53突变的功能类别:一项国际合作研究的结果。 安·昂科尔。 17, 842–847 (2006). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
麦格雷戈M.J。 等。 结直肠癌中P53异常表达缺乏预后或预测意义:来自VICTOR试验的结果。 抗癌研究。 35, 1641–1645 (2015). [ 公共医学 ][ 谷歌学者 ]
Yeudall W.A.公司。 等。 获得功能突变型p53上调CXC趋化因子并增强细胞迁移。 致癌作用 33, 442–451 (2012). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
科菲尔·C·R·。 等。 突变型p53相互作用组将nardilysin识别为p53R273H特异性结合伙伴,促进侵袭。 EMBO代表。 13, 638–644 (2012). [ 内政部 ][ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
王Z。 等。 p53在肝细胞癌细胞上皮-间质转化和转移中的关键作用。 公共科学图书馆 综合 8,e72846(2013)。 [ 内政部 ][ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
林俊伟(Lim J.W.)。 等。 SW480结肠癌细胞中全长APC蛋白的恢复可诱导外泌体介导的DKK-4分泌。 电泳 33, 1873–1880 (2012). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
崔D.S。 等。 人原发性和转移性结直肠癌细胞胞外囊泡的定量蛋白质组学。 J.Extracell公司。 囊泡 1,doi:10.3402/jev.v1i0.18704(2012)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
崔D.S。 等。 人类结直肠癌细胞微泡的蛋白质组分析。 蛋白质组研究杂志。 6, 4646–4655 (2007). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
陶罗·B·J。 等。 超速离心、密度梯度分离和免疫亲和捕获方法分离人结肠癌细胞系LIM1863衍生外泌体的比较。 方法 56, 293–304 (2012). [ 内政部 ] [ 公共医学 ][ 谷歌学者 ]
Demory Beckler M。 等。 突变型KRAS结肠癌细胞外泌体的蛋白质组分析确定突变型KRSA.Mol.细胞的细胞间转移。 蛋白质组学 12, 343–355 (2013). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
马蒂瓦南S。 等。 从人结肠癌细胞系LIM1215释放的A33免疫亲和纯化的外泌体的蛋白质组学分析揭示了组织特异性蛋白质特征。 分子细胞。 蛋白质组学 9, 197–208 (2010). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
陶罗·B·J。 等。 LIM1863结肠癌细胞衍生类有机物释放出两种不同的外显体。 分子细胞。 蛋白质组学 12, 587–598 (2013). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
纪H。 等。 人原发性和转移性结直肠癌细胞外显子的蛋白质组分析揭示了关键转移因子和信号转导成分的差异表达。 蛋白质组学 13, 1672–1686 (2013). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
莱斯帕诺A。 等。 TSAP6/Steap3-null小鼠的外显体分泌,包括DNA损伤诱导的p53依赖性分泌途径严重受损。 细胞死亡不同。 15, 1723–1733 (2008). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Henne W.M.、Stenmark H.和Emr S.D。 膜雕刻ESCRT途径的分子机制。 冷泉港。 透视。 生物。 5,doi:10.1101/cshperspect.a016766(2013)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ][ 谷歌学者 ]
Edgar J.R.、Eden E.R.和Futter C.E。 Hrs和CD63依赖的竞争机制产生不同大小的腔内小泡。 交通 15, 197–211 (2014). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
科伦坡M。 等。 ESCRT在胞外体生物发生、组成和分泌中的功能分析突出了胞外小泡的异质性。 J.细胞。 科学。 1265553–5565(2013年)。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
麦克唐纳·C、布奇科维奇·N·J、斯特林格·D·K、埃姆·S·D·和派珀·R·C。 货物泛素化对多泡体管腔内小泡的形成至关重要。 EMBO代表。 13, 331–338 (2012). [ 内政部 ][ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
塔迈K。 等。 通过Hrs-依赖性外体途径调节丙型肝炎病毒分泌。 病毒学 422, 377–385 (2012). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
休伯特A。 等。 病毒性HIV-1+患者血浆细胞外囊泡的丰度、大小和MicroRNA含量升高:与已知疾病进展标志物的相关性。 J.收购人。 免疫防御。 综合。 70, 219–227 (2015). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Du X.、Kazim A.S.、Brown A.J.和Yang H。 Hrs/Vps27在体内胆固醇转运中的重要作用。 单元格代表。 1, 29–35 (2012). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
王伟(Wang W.)、杨磊(Yang L.)和黄华伟(Huang H.W.)。 胆固醇在高曲率区域积聚的证据:对脂质混合物曲率弹性能的影响。 生物物理学杂志。 92, 2819–2830 (2007). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Boura E.、Ivanov V.、Carlson L.A.、Mizuuchi K.和Hurley J.H。 转运(ESCRT)复合物所需的内体分选复合物在支撑的脂质双层中诱导相分离的微结构域。 生物学杂志。 化学。 287, 28144–28151 (2012). [ 内政部 ] [ PMC免费文章 ][ 公共医学 ] [ 谷歌学者 ]
Komada M.和Soriano P。 Hrs是一种定位于早期内体的FYVE指状蛋白,与囊泡交通有关,是腹侧折叠形态发生所必需的。 基因开发。 13, 1475–1485 (1999). [ 内政部 ] [ PMC免费文章 ][ 公共医学 ] [ 谷歌学者 ]
Scoles D.R.、Qin Y.、Nguyen V.、Gutmann D.H.和Pulst S.M。 HRS抑制RT4大鼠神经鞘瘤细胞系EGF受体信号传导。 生物化学。 生物物理学。 Res.Commun公司。 335, 385–392 (2005). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
丰岛M。 等。 通过耗尽囊泡分选蛋白Hrs抑制肿瘤生长和转移:其对E-cadherin和beta-catenin的调节作用。 癌症研究。 67, 5162–5171 (2007). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
孙伟(Sun W.)。 等。 蛋白质组学中的微波辅助蛋白质制备和酶消化。 分子细胞。 蛋白质组学 5, 769–776 (2006). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Wisniewski J.R.、Zougman A.、Nagaraj N.和Mann M。 蛋白质组分析的通用样品制备方法。 自然方法 6, 359–362 (2009). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
孙毅(Sun Y.)。 等。 ABCC4拷贝数变异与食管鳞癌易感性相关。 致癌作用 1941年至1950年(2014年)。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。