介绍 甾醇载体蛋白-2(SCP2),也称为非特异性脂质转运蛋白,是一种与脂质代谢中许多拟议功能相关的脂质结合蛋白。 这个 Scp2系列 该基因包含两个转录起始位点,产生58kDa固醇载体蛋白-x(SCPX)和15kDa原-SCP2蛋白,这两个蛋白都在其C末端包含完整的13kDa SCP2蛋白或结构域序列[ 1 , 2 ]。 SCPX被部分裂解形成46kDa 3-酮酰基CoA硫酶和13kDa SCP2[ 三 ]而15kDa pro-SCP2经过翻译后处理,得到成熟的13kDa SCP2[ 4 ]。 SCP2通常可能参与脂质运输和代谢,因为已发现它与脂肪酸结合并参与脂肪酸代谢[ 5 – 7 ],脂肪酰基辅酶A[ 8 , 9 ],胆固醇酯[ 10 ]、磷脂[ 11 – 13 ]以及各种其他脂质。 SCP2被认为是一种可溶性固醇载体,因为它能够与固醇结合,并定位于多种细胞器,如过氧化物酶体、线粒体、内质网和胞浆[ 14 – 16 ].
SCP2作为一种脂质转运蛋白,已被证明在胆固醇的细胞内运动中起关键作用[ 17 – 19 ]通过将胆固醇从细胞内位置(如脂滴)运输到线粒体,在线粒体中,类固醇生成的第一个关键步骤发生了[ 20 ]。 在莱迪格细胞中,SCP2在过氧化物酶体中的作用被认为对睾酮的产生至关重要[ 21 ]。 SCP2水平的变化或缺乏SCP2表达与胆固醇和其他脂质的细胞内运输和代谢异常有关[ 22 , 23 ]。 因此,进一步研究SCP2的细胞内作用可能有助于更好地了解病理学和可能的药理途径,这些途径可用于治疗这些脂质相关异常。
本研究的动机来自我们的初步观察,即22-NBD-胆固醇没有定位于MA-10细胞的过氧化物酶体(见下文)。 这一发现出乎意料,因为之前的研究已经证实SCP2能够以高亲和力结合22-NBD-胆固醇[ 24 ],并且SCP2主要靶向过氧化物酶体[ 14 – 16 ]。 综合来看,这两项证据提出了关于SCP2是否参与22NBD胆固醇的细胞内靶向的问题。 鉴于这些初步观察结果的新颖性以及SCPX和SCP2在类固醇生物合成中发挥重要作用的证据,我们鼓励研究22-NBD-胆固醇过氧化物酶体定位缺乏的可能原因,以更好地了解这些蛋白质的功能。
我们的研究特别关注SCPX和SCP2在过氧化物酶体和线粒体中的作用。 SCPX和SCP2蛋白的C末端含有过氧化物酶体靶向PTS1信号[ 25 ]而N末端表现出预测线粒体靶向序列的典型特征[ 26 ]。 已经观察到,在15kDa pro-SCP2中发现的20个氨基酸N末端序列包含与已知线粒体靶向序列相似的特征[ 17 ]。 然而,这种假定的线粒体靶向序列的功能尚待实验验证。
该项目的目标是进一步研究SCPX和SCP2的亚细胞靶向,特别是这些蛋白质对过氧化物酶体和线粒体的可能双重靶向,以及这种靶向在胆固醇的细胞内运输中所起的作用。 SCPX和SCP2的亚细胞定位是通过创建标记在C端或N端的荧光融合蛋白来研究的,这些荧光融合蛋白分别包含假定的过氧化物酶体和线粒体靶向序列。 此外,我们还检测了SCPX和SCP2蛋白在MA-10细胞和小鼠睾丸中的分布,推测的线粒体靶向序列的功能,以及胆固醇与SCP2结合的特征。 我们假设SCPX和SCP2都将靶向过氧化物酶体和/或线粒体,SCPX与SCP2将结合胆固醇并协助非囊性甾醇转运和细胞内分布。
材料和方法 材料 原始全长cDNA克隆 Scp2系列 该基因作为EST克隆从GE Healthcare Dharmacon Inc.(美国科罗拉多州拉斐特)购买,并在实验室将该基因亚克隆到适当的载体中。 本研究中使用的抗体是针对15 kDa SCP2蛋白(Proteintech)的SCP2兔多克隆抗体 ™ :23006-1-AP; 芝加哥,伊利诺伊州,美国); 针对58kDa SCPX蛋白的兔单克隆抗甾醇载体蛋白2抗体(EPR9022;Abcam:ab140126;加拿大安大略省多伦多市); 兔抗COX IV多克隆抗体(线粒体负荷控制;Abcam:ab16056;加拿大安大略省多伦多市); 兔多克隆抗VDAC1/孔蛋白抗体(线粒体负荷控制;Abcam:ab15895;加拿大安大略省多伦多市); 兔多克隆抗HSP60抗体(H-300)(线粒体负荷控制;圣克鲁斯生物技术:sc-13966;美国德克萨斯州达拉斯); 兔多克隆抗CAT(过氧化氢酶)抗体(H-300)(过氧化物酶体标记;圣克鲁斯生物技术:sc-50508;德克萨斯州达拉斯,美国); 兔多克隆抗甘油醛3-磷酸脱氢酶(GAPDH)抗体(蛋白质负荷控制;Trevigen:2275-PC-100;盖瑟斯堡,马里兰州,美国); 小鼠单克隆抗PMP70抗体(Sigma-Aldrich:SAB4200181;加拿大安大略州奥克维尔); 小鼠抗VDAC1/孔蛋白抗体(20B12AF2;Abcam:ab14734;加拿大安大略省多伦多市); Alexa Fluor公司 ® 546驴抗兔免疫球蛋白G(IgG)(分子探针,加拿大安大略省伯灵顿); 抗兔IgG辣根过氧化物酶相关抗体(Cell Signaling Technology,Danvers,MA,USA); 和太平洋蓝 ™ 山羊抗鼠IgG(H+L),高度交叉吸附(生命科技: 第31582页 ; 加拿大安大略省伯灵顿市)。 Mito-DsRed-pero是一种双重亚细胞靶向蛋白标记物,定位于线粒体和过氧化物酶体,通过将ACBD2(线粒体靶向前序列)融合到DsRed荧光蛋白(Ds红色)的N末端,将过氧化物酶靶向PTS1信号肽融合到Ds红色的C末端,局部制备而成; DsRed-pero,DsRed与C末端PTS1信号肽; 和TSPO-DsRed,小鼠易位蛋白在其C末端融合到DsRed(Fan等人,未发表)。 22-NBD-胆固醇(22-(N-(7-硝基苯-2-氧-1,3-二唑-4-基)氨基)-23,24-二硝基-5-胆固醇-3β-Ol)购自Life Technologies(加拿大安大略省伯灵顿)。
序列选择、比对和RNA测序(RNA-seq) 小鼠SCPX序列最初从EST克隆(MMM1013-202763426,Dharmacon,Pittsburgh,PA,USA)获得,然后进行亚克隆以制备SCPX和SCP2融合蛋白。 同源人类 SCPX公司 基因与小鼠对齐 Scpx公司 使用聚类X,从文献中检索可变序列特征。 至于RNA-seq,使用Trizol试剂(Invitrogen;Thermo Fisher Scientific,Waltham,MA,USA)提取MA-10细胞的总RNA,制备Illumina HiSeq 2000配对-end(2×100 bp)文库,然后在麦吉尔大学和魁北克基因组创新中心对细胞的总转录物进行测序[ 27 ]。 使用该中心基因组分析工具包中的RNA-Seq分析管道进行数据分析。 使用SeqMonk软件包绘制和显示RNA-Seq数据( http://www.bioinformatics.bbsrc.ac.uk/projects/seqmonk/ ; Babraham生物信息学,英国剑桥)和UCSC基因组浏览器( 网址:http://genome.ucsc.edu )带有自定义曲目。
冷冻小鼠组织切片和细胞的免疫荧光染色 为了对小鼠组织切片进行免疫荧光染色,将野生型小鼠睾丸嵌入最佳切割温度(OCT)培养基中,并在古德曼癌症研究中心组织学核心设施(加拿大魁北克省蒙特利尔市麦吉尔大学)制备6μm冰冻切片。 染色方法与前面描述的方法类似[ 28 ]。 冷冻切片用SCPX或SCP2特异性抗体孵育,然后用荧光共轭Alexa Fluor ® 546头驴抗兔IgG(分子探针,加拿大安大略省伯灵顿市)。 在相同条件下,使用奥林巴斯Fluoview FV1000共焦激光扫描显微镜和反向荧光显微镜(奥林巴斯IX5;日本东京奥林巴斯公司)获得图像。 本研究中使用的小鼠是从Jackson实验室购买的C57BL/6J( 网址:https://www.jax.org ),饲养在麦吉尔大学健康中心(RI-MUHC,魁北克省蒙特利尔)的动物设施中,所有饲养程序均按照标准协议进行。 用CO处死2个月大的野生型小鼠 2 收集窒息患者及相关组织进行冰冻切片。 所有动物研究和程序均由麦吉尔大学动物护理和使用委员会批准,并按照加拿大动物护理委员会指南中的建议进行。
为了准备细胞的免疫荧光染色,MA-10细胞生长在一个35 mm的FluoroDish上 ™ 无菌培养皿(美国佛罗里达州萨拉索塔,世界精密仪器公司)。 用1X磷酸盐缓冲液(PBS)清洗细胞,用4%PFA溶液固定20分钟,用0.1%Triton X-100在PBS中渗透1分钟,并在PBS内由1%牛血清白蛋白(BSA)组成的封闭溶液中培养1小时。 细胞与SCPX或SCP2、PMP70或VDAC1特异性兔抗体在4°C下孵育过夜。 第二天,用1X PBS清洗细胞,并用荧光偶联Alexa Fluor 546驴抗兔IgG(分子探针;加拿大安大略省伯灵顿市)和太平洋蓝培养细胞 ™ 山羊抗鼠IgG在室温下1小时。 使用UltraCruz对细胞核进行复染 ™ 安装介质(圣克鲁斯生物技术:sc-24941;美国德克萨斯州达拉斯)。 细胞在Olympus Fluoview FV1000共聚焦激光扫描显微镜下观察,激发/发射波长如下:红色(DsRed),557/592 nm; 蓝色(DAPI),350/460 nm。 为了更好地观察同位化,蓝色通道中的图像被涂成了绿色。
亚细胞分离、蛋白质提取、SDS-PAGE凝胶电泳和免疫印迹技术 为了进行亚细胞分离,MA-10细胞在150mm的培养皿中生长到70%的汇合处,用PBS洗涤,然后收获用于进一步处理[ 29 ]。 简而言之,为了制备粗膜,用玻璃器皿将细胞均质,然后在隔离缓冲液1(225 mM甘露醇、75 mM蔗糖和30 mM Tris.HCI,pH 7.4)中进行3次冷冻和解冻循环。 在4°C下,在800 x g下离心匀浆5分钟。 收集的上清液(含细胞溶质蛋白)在4°C下以11000 x g的速度离心两次10分钟,以获得粗线粒体。将这些制剂重新悬浮在隔离缓冲液2中(250mM甘露醇、5mM HEPES[pH7.4]和0.5mM EGTA)。 为了证实粗线粒体部分的富集,我们进行了免疫印迹分析,使用抗COX IV、抗VDAC1和抗HSP60抗体作为线粒体负载对照,抗CAT(过氧化氢酶)抗体作为过氧化物酶体标记,抗GAPDH抗体作为全蛋白负载对照。
对于蛋白质提取,MA-10细胞在六孔细胞培养集群培养皿(Corning Incorporated,Corning,NY,USA)中生长,并使用250μL哺乳动物蛋白质提取试剂(M-PER)(Thermo Fisher Scientific,Burlington,ON,Canada)每孔收获细胞的总蛋白质, 然后在4°C下,在14000 x g下离心10分钟。 按照制造商的说明,使用Bradford染料分析法(美国加利福尼亚州Hercules的Bio-Rad Laboratories Inc.)测量蛋白质浓度,并在595 nm处测量吸光度。 十二烷基硫酸钠(SDS)-聚丙烯酰胺凝胶电泳(PAGE)和免疫印迹分析采用类似于前面描述的程序进行[ 27 ]。 简言之,25μg总蛋白提取物在4%–20%Tris–glycine梯度凝胶上电泳分离,转移到聚偏氟乙烯(PVDF)膜上,并在4°C的1X TBST缓冲液(50 mM Tris,150 mM NaCl,0.05%吐温20)中溶解的10%脱脂乳中隔夜封闭。 水平切割膜,以可视化GAPDH水平,作为负荷控制,切割位置由Novex Sharp预染色蛋白质标准(加拿大安大略省伯灵顿市赛默飞世尔科学公司)指导。 膜与SCPX、SCP2和GAPDH特异的一级抗体孵育,其次是二级抗体,即抗兔IgG辣根过氧化物酶相关抗体(美国马萨诸塞州丹佛市细胞信号技术公司)。 然后使用Amersham ECL Western Blotting Detection Reagent(GE Healthcare Life Sciences,Mississauga,ON,Canada)对蛋白质进行可视化,并使用富士图像读取器LAS4000(Fujifilm,Tokyo,Japan)捕获图像。
质粒构建 使用ECFP-Bak(质粒31501;含Bak蛋白的ECFP-N1)载体(Addgene,Cambridge,MA,USA)构建表达N末端标记SCPX和SCP2(pECFP-SCPX和pECFP_SCP2)的质粒,而pECFP-C1载体(Clontech Laboratories,Mountain View,CA,USA 用于创建标记为SCPX和SCP2的C末端(pSCPX-ECFP和pSCP2-ECFP)。 使用pEGFP-N1载体(加利福尼亚州山景城Clontech实验室)创建SCPX和SCP2假定线粒体靶向序列的荧光融合蛋白(pSCPX-mito-EGFP和pSCP2-mito-EGFP)。 表1 列出了构建每个质粒过程中使用的正向和反向引物(Integrated DNA Technologies,Coralville,IA,USA)、限制性内切酶(New England Biolabs,Ipswich,MA,USA。 进行聚合酶链反应(PCR)以扩增SCPX和SCP2序列,并围绕所需序列创建适当的限制性内切酶位点。 合适的限制性内切酶( 表1 )用于消化载体和插入物,并使用快速DNA连接试剂盒(瑞士巴塞尔Hoffman-La Roche有限公司)进行连接。 将连接的载体转化为亚克隆效率 ™ DH5α ™ 称职 大肠杆菌 Cells(生命技术公司;加拿大安大略省伯灵顿市赛默飞世尔科技公司),以及 E类 . 大肠杆菌 选择成功转化的细胞使用合适的抗生素( 表1 ). 进行PCR以验证载体中是否存在所需的DNA序列。 使用QIAprep Spin Miniprep Kit(荷兰文洛市齐根)分离质粒,并使用Sanger DNA测序(加拿大魁北克省蒙特利尔市麦吉尔大学基因组魁北克创新中心)进行测序,以确认未引入突变。 然后通过生长转化扩增质粒 E类 . 大肠杆菌 细胞在Luria Broth(LB)中过夜,然后使用HiSpeed Plasmid Maxi Kit或QIAprep Spin Miniprep Kit(荷兰文洛市齐根)分离核酸。
表1。 在构建含有 Scpx公司 和 Scp2系列 基因序列。
矢量 底漆顺序 限制性内切酶 抗生素
ECFP-Bak(ECFP-SCPX/2) 反向引物(SCPX):GCGCTCGAGTGCCTTCTGTCTTTGAAATC XhoI公司 卡那霉素
反向引物(SCP2):GCGCTCGAGTGGGTTTTCCCGAAGCTGC XhoI公司
正向引物(SCPX/2):CGCGAATTCTCACAGCTTAGCTGTGCCGG 限制酶
pECFP-C1(SCPX/2-eCFP) 反向引物(SCPX):GCGCTCGAGATGCTTCTGTCTTTGAAATC XhoI公司 卡那霉素
反向引物(SCP2):GCGCTCGAGATGGGTTTTCCCGAAGCTGC XhoI公司
正向引物(SCPX/2):CGCGAATTCGCAGCTTTAGCTTTGCCCGG 限制酶
SCP2-seq-F底漆 一 :AGCTGGCAGCTCGGGAAAACC
pEGFP-N1(SCPX/2-mito-EGFP) 线粒体seqx HindIII:GCTCAAGCTTATGCCTTCTGTCGCTTTG 印地安三世 卡那霉素
Mitoseqx-KpnI CGCGGTACCGGTCATGCCAACGCCCGACC公司 肯尼亚卢比
Mito-seq2-HindIII GCTCAAGCTTATGGGTTTTCCCGAGCTGC公司 印地安三世
米托塞克2-KpnI CGCGGTACCGGGTGGAGCAGCTGAAACC 肯尼亚卢比
细胞培养和转染 MA-10小鼠Leydig肿瘤细胞(由美国爱荷华州艾姆斯爱荷华大学M Ascoli博士善意提供)在Dulbecco改良鹰培养基(DMEM)/火腿F12(50:50)(Gibco ® ; Thermo Fisher Scientific(加拿大安大略省伯灵顿),补充5%胎牛血清(FBS)和2.5%马血清(HS)。 MA-10细胞在37°C和3.7%CO下培养 2 根据前面描述的方法,使用Opti-MEM还原血清培养基(Life Technologies;Thermo Fisher Scientific,加拿大安大略省伯灵顿市)和Lipofectamine 2000转染试剂(Thermo Fisher Screentific(加拿大安大拿州伯灵顿))将4μg质粒转染细胞[ 30 ].
活细胞激光共焦显微镜 MA-10细胞在35 mm FluoroDish上生长 ™ 无菌培养皿(美国佛罗里达州萨拉索塔市World Precision Instruments)与丝裂原-DsRed-pero质粒和SCPX或SCP2的N端或C端融合蛋白之一联合转染。 此外,为了研究SCPX和SCP2的预测线粒体靶向序列(前序列)的潜在作用,将这两个长度分别为66bp和60bp的前序列克隆到pEGFP-N1载体中,以产生两个质粒:pSCPX mito-EGFP和pSCP2 mito-EGFP。 将这些质粒共同转染到MA-10细胞中,以ACBD2-mito-DsRed作为线粒体标记。 使用Olympus Fluoview FV1000激光共聚焦显微镜(UPLSAP,×100)获得图像,以观察蛋白质的存在和亚细胞位置。
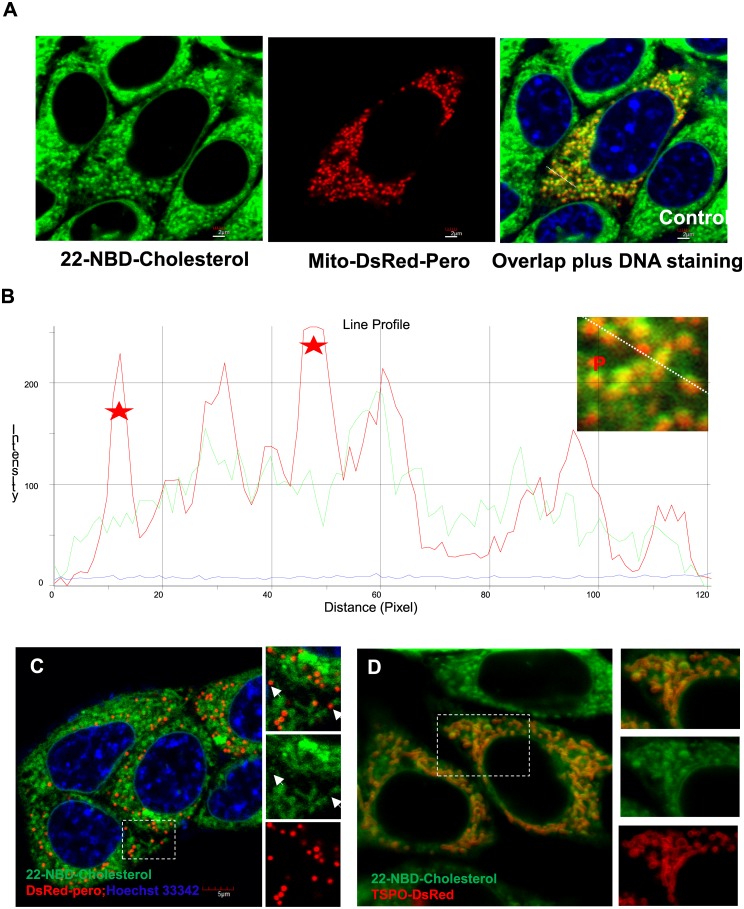
结果 22 NBD胆固醇不局限于过氧化物酶体 22-NBD-胆固醇通常被用作天然胆固醇荧光成像的荧光胆固醇类似物,并且已经证明它与SCP2具有高亲和力[ 24 ]。 鉴于SCP2主要针对过氧化物酶体[ 14 – 16 ]据推测,SCP2可能会介导22-NBD-胆固醇对过氧化物酶体的细胞内靶向。 以前已经证明过氧化物酶体对类固醇生物合成很重要,因为它们含有许多参与胆固醇合成初始步骤的酶。 进一步支持这一观点的是,过氧化物酶体缺乏病患者的胆固醇合成能力受损[ 32 , 33 ]。 用22-NBD-胆固醇处理MA-10细胞,用线粒体-DsRed-pero标记过氧化物酶体和线粒体,并用活细胞成像研究22-NBD胆固醇的亚细胞定位( 图1A ). 使用ImagePro Plus软件(Media Cybernetics,Rockville,MD,USA)测量荧光强度,通过过氧化物酶体绘制感兴趣区域(ROI),使用mito-DsRed pero标签检测( 图1B ). 令人惊讶的是,22-NBD-胆固醇的荧光没有与过氧化物酶体共定位,这表明22-NBD胆固醇没有定位于MA-10细胞中的过氧化物酶。 为了验证我们的观察结果,MA-10细胞与DsRed-pero-a过氧化物酶体标记物联合转染( 图1C )或TSPO-DsRed-线粒体标记( 图1D ),单独进行。 很明显,22-NBD-胆固醇仅定位于线粒体,如与TSPO-DsRed的共同定位所示; 易位蛋白(TSPO)是一种线粒体外膜蛋白[ 34 ]。 本研究将详细讨论从这些观察结果中提出的几个问题。
图1。 22-NBD-胆固醇与线粒体和过氧化物酶体的亚细胞定位。
(A) 用22-NBD-胆固醇染色的MA-10细胞的共焦激光显微镜图像(左),用丝裂原-DsRed-pero转染的细胞(中),以及22-NBD胆固醇和丝裂原DsRed-pero染色的重叠(右)。 (B) 比较线粒体和过氧化物酶体(P)的荧光强度分布(红色)和22-NBD-胆固醇的荧光强度(绿色)。 22-NBD-胆固醇(绿色)不与线粒体-DsRed-pero标记的过氧化物酶体定位,如MA-10细胞系中的小高强度点(红色)所示。 22-NBD-胆固醇和过氧化物酶体的荧光强度不相关的区域用红星标记。 (C) 22-NBD-胆固醇(绿色)与过氧化物酶体标记物DsRed-pero(红色)的显色。 图像右侧的面板显示了具有重叠绿色和红色通道、仅绿色通道和仅红色通道(从上到下)的高亮区域。 (D) 22-NBD-胆固醇(绿色)与线粒体标记TSPO-DsRed(红色)的颜色化。 图像右侧的面板显示了高亮显示的区域,其中绿色和红色通道重叠,仅绿色通道,仅红色通道(从上到下)。
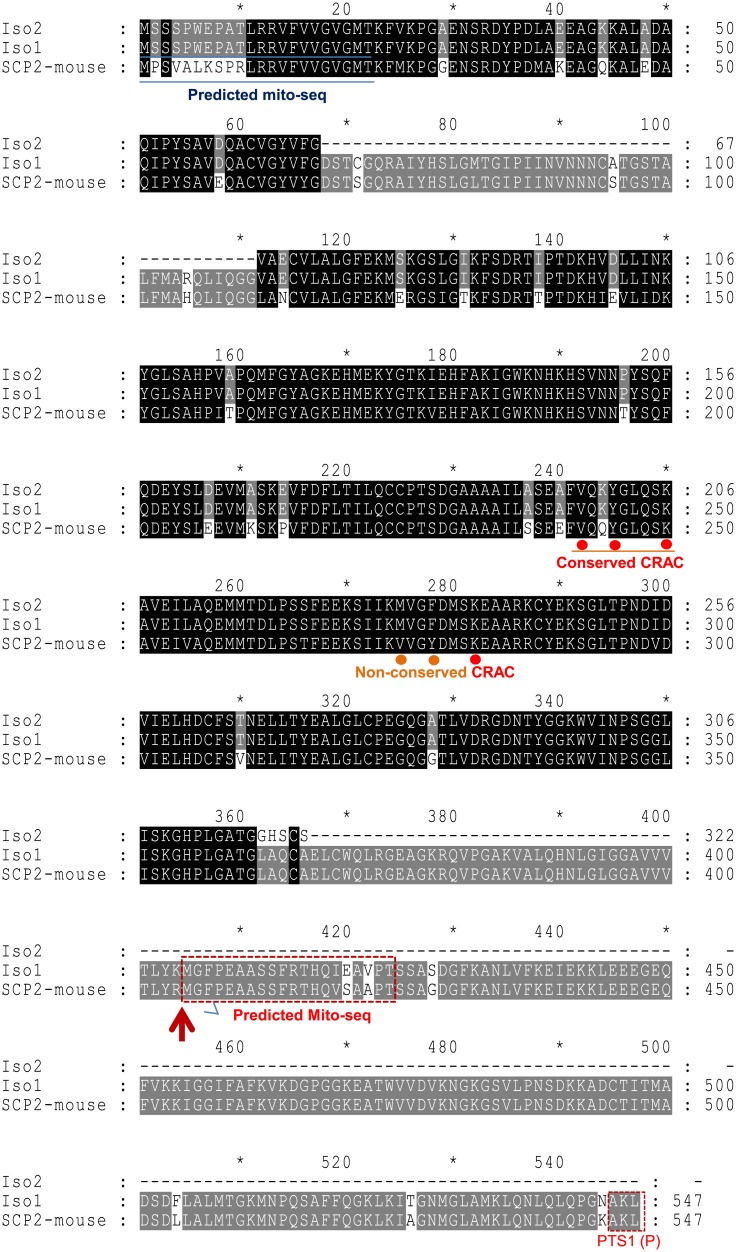
推测的SCPX和SCP2氨基酸序列比对和预测的线粒体靶向序列 从GenBank检索核酸序列及其相应的预测氨基酸序列(登录号: M62361型 和 M55421号 )人的亚型1和2 SCP2号机组 基因,也适用于小鼠 Scp2系列 基因( 图2 ). 这个 Scp2系列 基因编码SCPX和前SCP2蛋白,两者都包含SCP2蛋白质或C末端结构域的序列[ 25 ]。 具有pol II启动子的B2元件正好位于编码SCP2蛋白的序列之前[ 27 ]。 C端序列包含过氧化物酶体靶向PTS1信号[ 25 ]而N末端序列包含假定的线粒体靶向序列(mito-seq)( https://ihg.gsf.de/ihg/mitoprot.html ) [ 26 ]。 一个保守的胆固醇识别/相互作用氨基酸共识(CRAC)序列(CRAC:L/V-X[ 1 – 5 ]-Y-X轴[ 1 – 5 ]-基于与转位蛋白(18-kDa)的CRAC基序的比较,SCPX蛋白中均存在R/K)和一个非融合的CRAC模序,之前称为外周型苯二氮卓受体(PBR)[ 35 ].
图2。 小鼠氨基酸预测序列的序列比对与分析 Scp2系列 人类的基因和亚型1和2 Scp2系列 基因。
序列比对表明 Scp2系列 基因编码SCPX和前SCP2蛋白,这两种蛋白都包含SCP2蛋白质或C末端结构域的序列。 在SCPX和SCP2中,预测的线粒体靶向序列(有丝分裂或预序列)、过氧化物酶体靶向PTS1信号(PTS1[P])和CRAC基序遵循L/V-(X)1-5-Y-(X)1-5-R/K模式。 红色向上箭头表示预测的SCP2序列的开始(GenBank ID: M62361型 用于鼠标和 M55421号 对于人类),包含在虚线方框中高亮显示的拟议mito-seq。
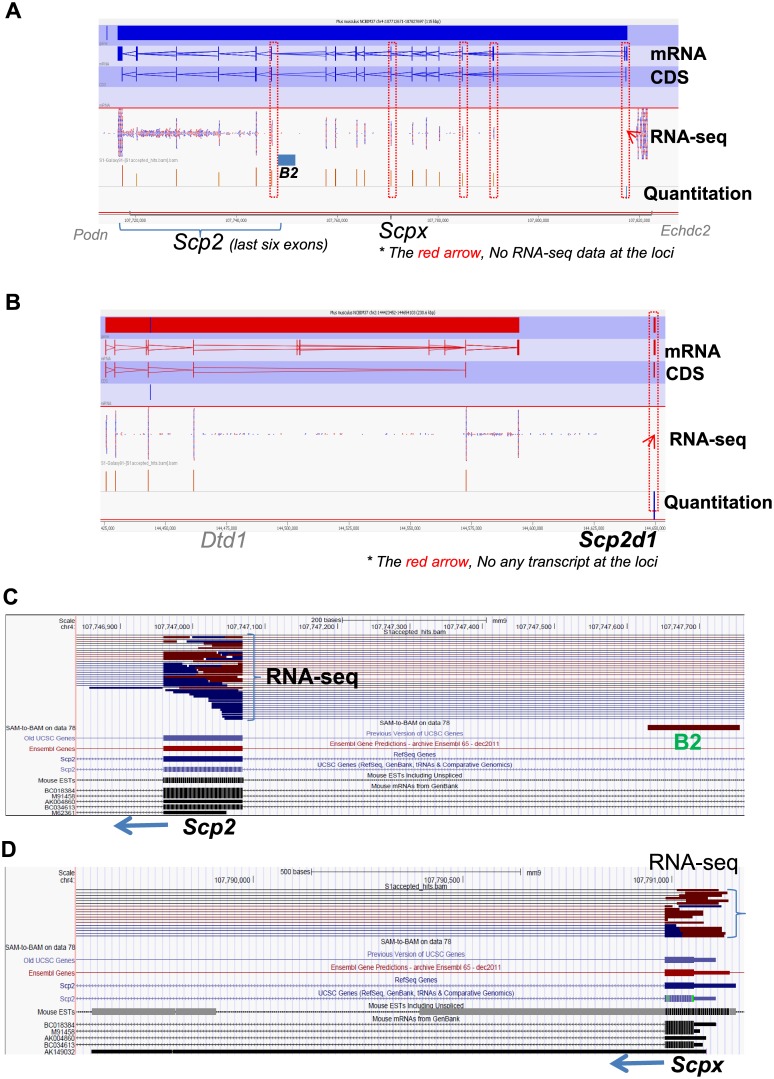
低mRNA表达 Scp2系列 RNA序列测定的基因 对MA-10细胞系的整个转录组进行测序,以确定 Scp2系列 基因。 从MA-10细胞收集总RNA,并使用Illumina HiSeq 2000和MiSeq技术(加拿大QC麦吉尔大学魁北克基因组创新中心)进行RNA-Seq。 然后使用Galaxy网络服务器(版本15.03.1)、SeqMonk(版本0.29.0)和UCSC基因组浏览器将RNA序列映射到基因组上。 RNA-Seq数据表明 Scp2系列 和 Scpx公司 转录物在MA-10细胞系中的表达相对较低( 图3A ). 作为阴性对照,在基因座上没有发现 第2页第1页 基因( 图3B ). 详细查看导致 Scp2系列 ( 图3C )和 Scpx公司 ( 图3D )转录本进一步证明了这些转录本的低表达。 B2衍生的pol II启动子的存在,可能在 Scp2系列 ,就在 Scp2系列 基因,也说明了( 图3C ).
图3。 低转录表达 Scp2系列 MA-10细胞系中的基因。
(A) RNA-Seq数据表明 Scp2系列 和 Scpx公司 转录物在MA-10细胞系中低表达。 (B) 在控制基因座没有发现 第2页第1页 基因,在RNA-seq中用作阴性对照。 (C) 详细查看 Scp2系列 该基因显示该外显子的低表达水平,并说明了位于该基因之前的B2衍生启动子。 (D) 详细查看 Scpx公司 显示该外显子的低表达水平。
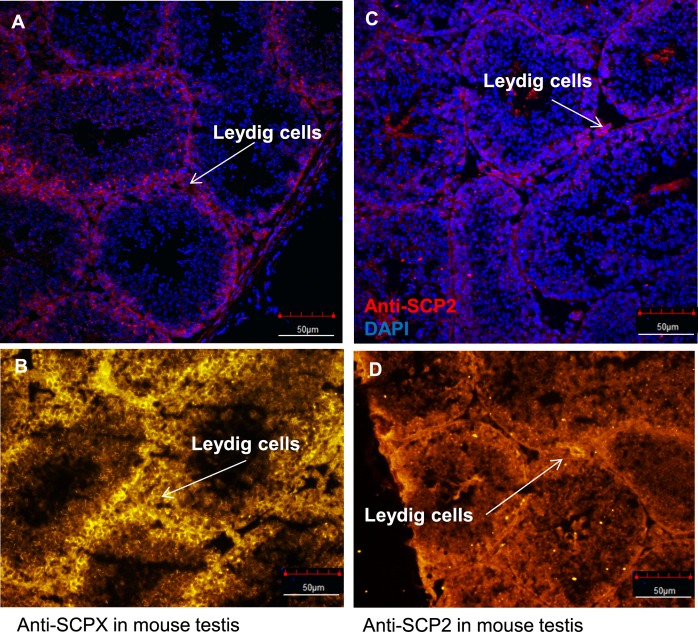
SCPX和SCP2在小鼠睾丸间质组织中的大量表达 采用共焦成像和常规表观荧光显微镜对免疫荧光染色进行评估,以研究SCPX和SCP2在野生型小鼠睾丸冷冻切片中的内源性分布。 发现SCPX在小鼠睾丸间质结缔组织中高度表达,该区域富含莱迪格间质细胞,但在生精小管的生殖细胞中几乎不表达( 图4A和4B ). SCP2在睾丸内的分布与SCPX相同,但表达水平较低( 图4C和4D ).
图4。 使用SCPX和SCP2特异性抗体对小鼠睾丸组织进行免疫荧光染色冰冻切片。
该分析旨在研究SCPX和SCP2在野生型小鼠睾丸中的内源性分布。 (A–B)SCPX在小鼠睾丸间质结缔组织中高度表达,该区域富含莱迪格细胞,但在生精小管的生殖细胞中不表达。 (C–D)SCP2与SCPX的分布相同,但表达水平较低。 比例尺,50μm。
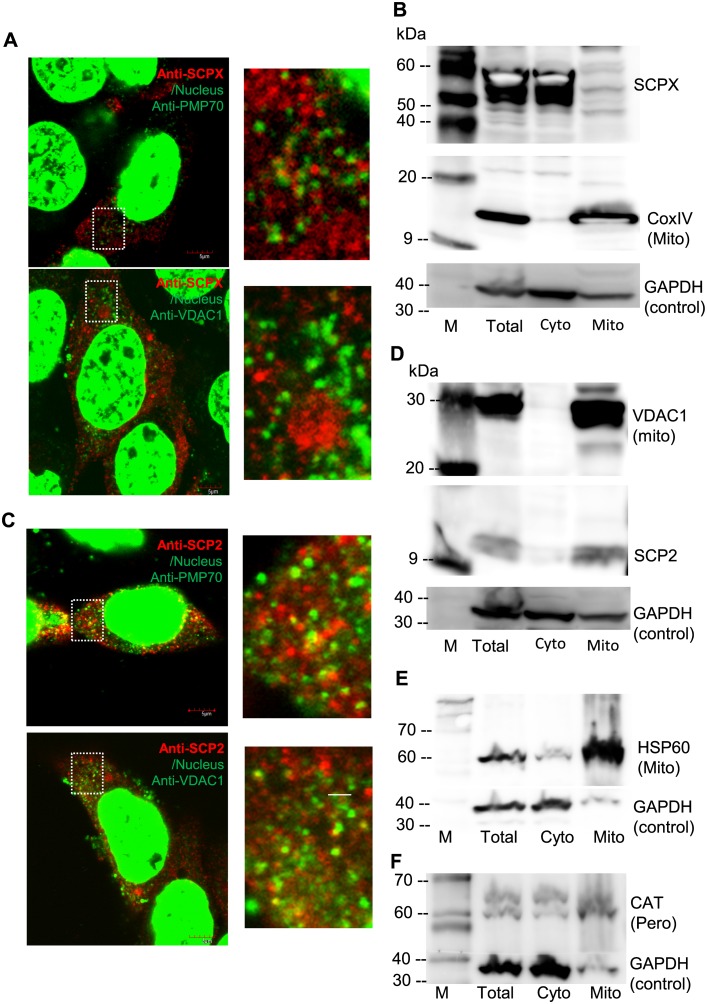
内源性SCPX和SCP2在MA-10细胞中的分布 免疫荧光染色检测SCPX和SCP2在MA-10细胞系中的内源性分布,DAPI染色染色细胞核。 发现内源性SCPX在胞浆中呈颗粒状分布,与线粒体标记蛋白抗VDAC1相比,更可能与过氧化物酶体标记蛋白抗PMP70共同染色( 图5A ). 然后使用SCPX、COXIV(线粒体对照)和GAPDH(全细胞裂解物负荷对照)特异性抗体对MA-10细胞的总蛋白提取物、细胞溶质部分和线粒体部分进行免疫印迹。 SCPX存在于总蛋白提取物和细胞溶质部分,但不存在于线粒体部分( 图5B ). 然而,内源性SCP2在与抗PMP70和抗VDAC1蛋白共同染色时均呈颗粒状分布( 图5C ). 使用SCP2、VDAC1(线粒体对照)和GAPDH(全细胞裂解物负荷对照)抗体进行免疫印迹。 SCP2存在于总蛋白提取物和线粒体部分中,但在细胞溶质部分中较少( 图5D ). 这些结果表明SCPX是一种过氧化物酶体蛋白,而SCP2可能与线粒体密切相关。此外,我们使用线粒体基质蛋白HSP60抗体通过免疫印迹分析验证了分离的亚细胞组分的纯度( 图5E )和过氧化物酶体基质标记蛋白过氧化氢酶(CAT)( 图5F ). 获得的数据表明,线粒体基质蛋白主要存在于线粒体、“有丝分裂”、亚细胞组分中,过氧化物酶体基质蛋白主要发现于细胞溶质、“细胞”和亚细胞组份中。
图5。 MA-10细胞内源性SCPX和SCP2蛋白的双重免疫荧光染色和免疫印迹分析。
(A) MA-10细胞(红色)、PMP70(过氧化物酶体标记蛋白,绿色)和VDAC1(线粒体标记蛋白,蓝色)内源性SCPX的双重免疫荧光染色。 用DAPI(涂成绿色)对细胞核进行复染。 比例尺,5μm。 (B) MA-10细胞裂解物亚细胞组分中内源性SCPX的免疫印迹分析。 COXIV用作线粒体标记蛋白,GAPDH用作全细胞裂解物负荷控制。 M、 蛋白质标记,以kDa表示; 全细胞裂解液总量; 细胞、胞质部分; 线粒体富集组分。 (C) MA-10细胞(红色)、PMP70(绿色)和VDAC1(绿色)内源性SCP2的双重免疫荧光染色。 nNucleus用DAPI(涂成绿色)复染。 比例尺,5μm。 (D) MA-10细胞裂解物亚细胞组分中内源性SCP2的免疫印迹分析。 VDAC1用作线粒体标记蛋白,GAPDH用作全细胞裂解物负载对照。 (E–F)对分离的MA-10亚细胞组分进行免疫印迹分析,确定线粒体基质蛋白HSP60(E)和过氧化物酶体基质蛋白过氧化氢酶(CAT)(F)。 GAPDH用作加载控制。 M、 蛋白质标记,以kDa表示; 全细胞裂解液总量; 细胞、细胞溶质组分; 线粒体富集组分。
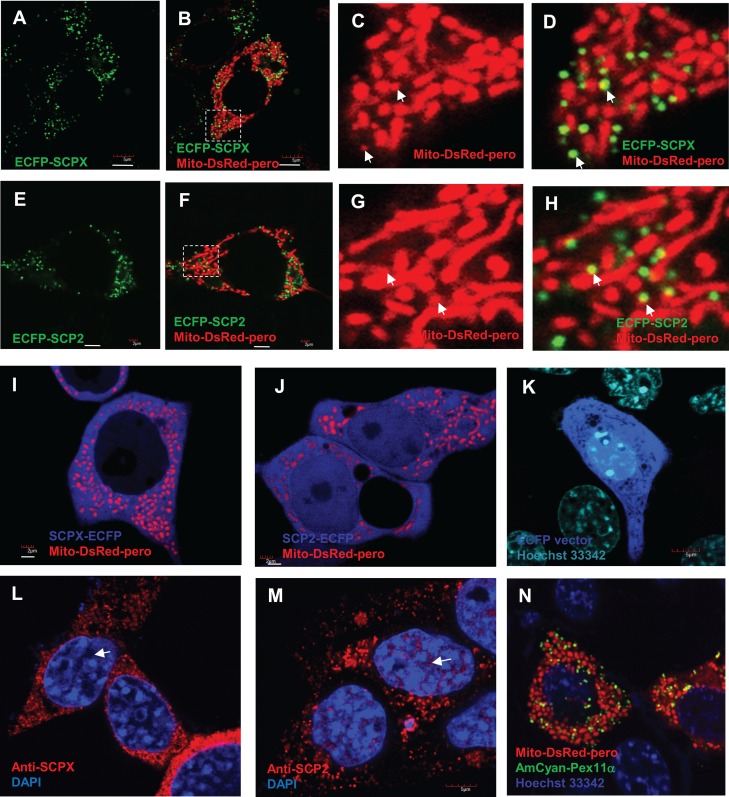
ECFP–SCPX/2的过氧化物酶体定位和SCPX/2-ECFP的细胞质定位 根据初步发现,22-NBD-胆固醇没有定位于MA-10细胞系中的过氧化物酶体( 图1 ),并且考虑到SCPX和SCP2都与过氧化物酶体有关 通过 它们的PTS1序列,而SCP2也与线粒体密切相关( 图5 )进行了进一步的研究,以阐明SCPX和SCP2蛋白的亚细胞定位,以及这些蛋白在22-NBD-胆固醇的细胞内定位中的作用。 将荧光ECFP标记融合到SCPX和SCP2蛋白的C端或N端,然后使用共焦激光显微镜通过活细胞成像研究这些融合蛋白的亚细胞定位。 C端蛋白融合产生SCPX–ECFP和SCP2–ECFP-荧光融合蛋白,阻断过氧化物酶体靶向PTS1信号,而N端融合产生ECFP–SCPX和ECFP-SCP2融合蛋白,阻止预测的线粒体靶向序列。 用mito-DsRed-pero和前面提到的一种荧光融合蛋白共同转染MA-10细胞,并用共焦激光显微镜观察荧光标记蛋白的细胞内定位。 观察到两种SCPX( 图6A-6D )和SCP2( 图6E-6H )当线粒体靶向序列受阻时,被靶向过氧化物酶体。 当过氧化物酶体靶向信号被阻断时,发现SCPX蛋白在细胞质中广泛存在,但在细胞核中不存在( 图6I )而SCP2蛋白则成为一种可溶性蛋白,存在于细胞质和细胞核中( 图6J ). 此外,仅由空载体ECFP-N1制成的荧光蛋白被发现分布在胞浆和细胞核中( 图6K ),这似乎还没有定论。 然而,SCPX和SCP2这两种内源性蛋白的免疫荧光染色表明SCP2存在核定位( 图6L和6M ). 如与过氧化物酶体标记物PEX11α共定位所示,丝裂原-DsRed-pero荧光蛋白定位于过氧化物体和线粒体( 图6N ). 对SCPX和SCP2中发现的信号序列的分子解剖表明,过氧化物酶体靶向PTS1信号足够强,可以确保蛋白质的过氧化物酶定位; 然而,N末端线粒体靶向序列的功能不足以将SCPX和SCP2蛋白定位到线粒体。
图6。 通过共焦激光显微镜对MA-10细胞中SCPX、SCP2和mito-DsRed-pero荧光融合蛋白的亚细胞定位进行活体细胞成像。
(A–H)ECFP–SCPX(A–D)和ECFP-SCP2(E–H)融合蛋白与mito-DsRed-pero共转染。 过氧化物酶体和线粒体双重标记物。 重叠表明ECFP–SCPX和ECFP-SCP2蛋白在过氧化物酶体中的定位(如白色箭头所示)。 比例尺,5μm。 (I–J)SCPX-ECFP(I)和SCP2-ECFP(J)蛋白与mito-DsRed-pero共转染。 当过氧化物酶体靶向信号被阻断时,SCPX–ECFP和SCP2-ECFP在细胞质中广泛分布,SCP2–ECFPs也分布在细胞核中。 比例尺,2μm。 (K) 使用Hoechst 33342进行核酸染色,单独转染ECFP-N1载体。 比例尺,5μm。 (L–M)使用SCPX和SCP2特异性抗体对MA-10细胞中的内源性SCPX与SCP2进行免疫荧光染色,其中SCP2的核染色用白色箭头表示。 (N) 丝裂原-DsRed-pero荧光融合蛋白与过氧化物酶体膜标记AmCyan-Pex11α的克隆化,除了线粒体定位外,还表明丝裂原DsRed-per的过氧化物酶定位。
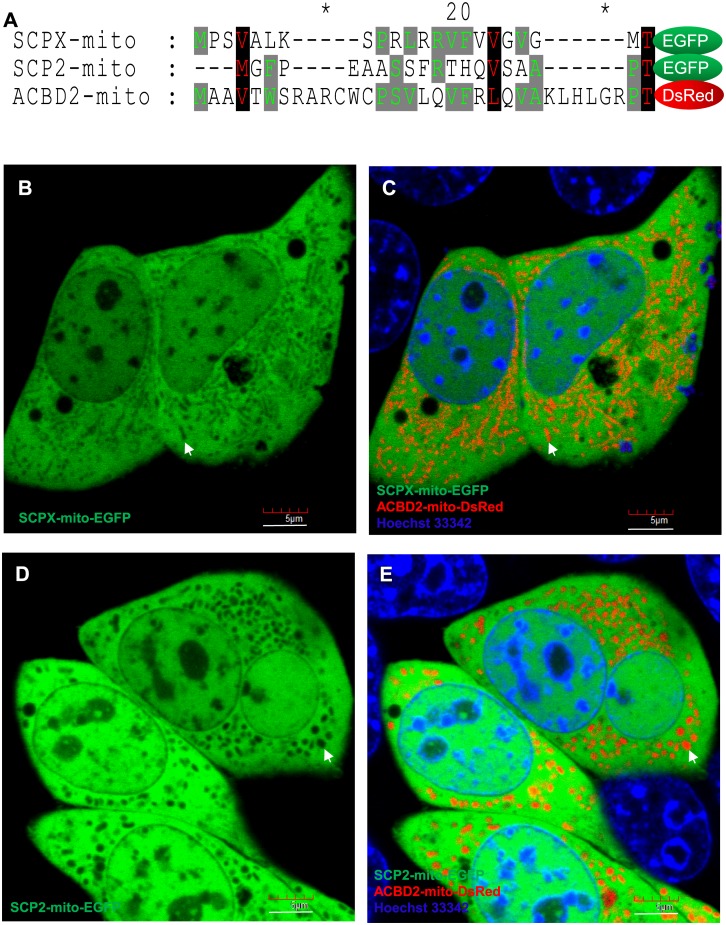
假定的线粒体靶向序列缺乏将融合蛋白导向线粒体的能力 以前的几份报告表明或提到pro-SCP2的N末端序列包含一个假定的线粒体靶向序列[ 14 , 17 , 36 ]。 SCPX(SCPX-mito)、SCP2(SCP2-mito)和ACBD2蛋白(ACBD2-mito;用作线粒体靶向序列控制)的预测线粒体靶向顺序的序列比对表明,与已知线粒体蛋白相比,SCPX-mito和SCP2-mit的一级序列具有相当大的相似性( 图7A ). 为了进一步表征假定的线粒体靶向序列的功能以及是否能够将SCPX和SCP2靶向线粒体,克隆了每个线粒体靶向顺序,以制备荧光融合蛋白SCPX-mito-EGFP和SCP2-mito-EGFP。 然后使用共焦激光显微镜和ACBD2-mito-DsRed研究这些荧光融合蛋白的亚细胞分布,作为阳性对照,ACBD2-mto-DsRed以前仅针对线粒体。 观察到SCPX-mito-EGFP( 图7B和7C )也不是SCP2-mito-EGFP( 图7D和7E )靶向线粒体,以ACBD2-mito-DsRed标记。 这可能是真的,前序列在协助C末端PTS1介导的过氧化物酶体靶向中发挥作用[ 36 ].
图7。 SCPX和SCP2的前序列在线粒体靶向中没有作用。
(A) SCPX(SCPX有丝分裂)和SCP2(SCP2有丝分裂)的预测线粒体靶向序列与已知线粒体蛋白ACBD2(ACBD2有丝分裂)的序列比对。 (B-E)用ACBD2-mito-DsRed作为阳性对照(红色),对SCPX-mito-EGFP(B-C)和SCP2-mito-EGFP(D-E)荧光融合蛋白(绿色)的亚细胞定位进行活细胞成像。 白色箭头,表示B和D中未染色的线粒体,C和E中分别用ACBD2-mito-DsRed染色的线粒体。 比例尺,5μm。
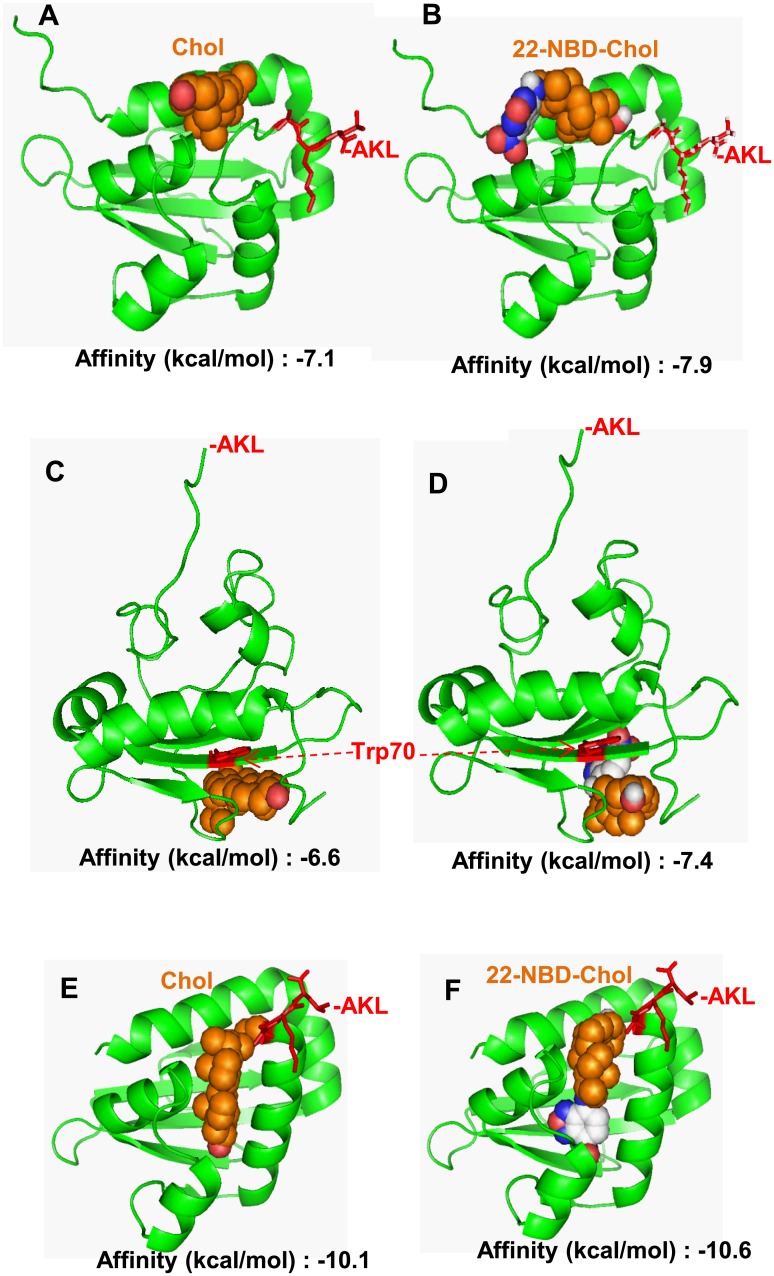
蛋白质同源性建模和小分子对接研究显示SCPX中的SCP2结构域和SCP2以非特异性方式结合22-NBD-胆固醇和胆固醇 预测来自SCPX和SCP2的小鼠SCP2结构域的假定3D结构 通过 Swiss-Model,一个优化的自动比较蛋白质建模服务器,使用兔固醇载体蛋白-2(PDB登录号:1C44)的X射线晶体学结构坐标( 图8A和8B )以及人甾醇载体蛋白-2的NMR结构(PDB登录号:1QND)( 图8C和8D ),均来自Brookhaven蛋白质数据库(36,37)。 突出显示了胆固醇结合区域附近的Trp70氨基酸[ 7 ]。 基于人类过氧化物酶体多功能酶2型(MFE2)的SCP2结构域,也获得了SCP2域的同源模型(PDB登录号:1IKT)( 图8E和8F ). 基于兔和人SCP2蛋白同源模型的分子对接分析( 图8A–8D )发现胆固醇和22-NBD-胆固醇都结合在SCP2疏水通道的外面。 只有使用MFE-2 SCP2结构域的分子对接研究显示胆固醇和22-NBD-胆固醇在通道内结合( 图8E和8F ). 这些结果表明,SCP2结构域以非特异性的方式结合胆固醇,最有可能是在其表面,但在某些情况下,它也有可能通过构象变化将胆固醇保持在疏水通道中。
图8。 小鼠SCP2结构域的同源性建模以及SCP2与其潜在配体胆固醇(Chol)和22-NBD-胆固醇(22-NBD-Chol)的分子对接研究。
(A–B)利用基于兔SCP2的X射线晶体学结构的同源模型进行分子对接研究(PBD:1C44)。 (C–D)分子对接研究,使用基于人类SCP2核磁共振结构的同源性模型(PBD:1QND)。 (E–F)使用基于人类过氧化物酶体多功能酶2型(MFE-2;PDB:1IKT)配体结合SCP2样结构域的X射线晶体学结构的同源模型进行分子对接研究。 显示了胆固醇(Chol)、22-NBD-胆固醇(22-NBD-Chol)、负责结合胆固醇的Trp70残基以及过氧化物酶体靶向PTS1信号(-AKL)。 Autodock-Vina计算的对接亲和力(kcal/mol)在每个相应构象下显示。
讨论 22-NBD-胆固醇和过氧化物酶体定位 22-NBD-胆固醇作为天然胆固醇荧光成像的荧光胆固醇类似物,可能模拟游离胆固醇的天然分布,如之前在Leydig细胞中所示,其中大多数过氧化物酶体在黄体生成素(LH)刺激之前未被游离胆固醇染色[ 37 ]。 尽管SCP2支持过氧化物酶体亚细胞定位 通过 其PTS序列和对22-NBD-胆固醇具有高结合亲和力[ 15 , 24 ],它不一定会导致22-NBD-胆固醇和过氧化物酶体之间的共定位。 然而,代谢研究表明22-NBD-胆固醇是胆固醇代谢氧化还原酶的底物,哺乳动物细胞色素P450侧链裂解酶(CYP11A1)是类固醇生物合成第一步的关键线粒体酶[ 38 ].
SCPX和SCP2在小鼠睾丸组织特异性表达及MA-10细胞亚细胞表达 男性睾丸能够将胆固醇转化为Leydig细胞内的类固醇激素,而Leydig起着重要的主导作用。 此外,SCP2与类固醇生成有关 通过 它影响细胞内胆固醇转运[ 17 ]。 尽管SCP2被认为是莱迪格细胞特异性蛋白[ 39 ]也发现在支持细胞中存在[ 40 ]。 因此,我们进行了额外的探索性实验,以研究SCPX和SCP2在小鼠睾丸中的存在和分布。 这些发现将有助于确定我们对MA-10小鼠Leydig肿瘤细胞中这些蛋白亚细胞定位的高分辨率观察与动物模型的相关性。 此外,Leydig细胞严重参与类固醇生成,因为它们是男性体内唯一能够合成和分泌睾酮的细胞[ 41 ]。 慢性黄体生成素(LH)治疗可增加大鼠Leydig细胞的睾酮合成 体内 ,伴随着SCP2的增加,尽管这些观察结果是否相关尚待确定[ 42 ]。 此外,急性LH刺激导致SCP2快速短暂增加,有人提出SCP2和过氧化物酶体在胆固醇转运到线粒体之前在睾酮生物合成中发挥作用[ 43 ]。 此外,LH缺乏导致Leydig细胞内过氧化物酶体和总SCP2减少,以及睾酮合成和分泌减少[ 21 , 43 ]。 这些发现都指向睾丸间质细胞过氧化物酶体和SCP2在睾丸睾酮生成中起关键作用[ 21 ].
免疫荧光染色的SCPX和SCP2均在睾丸间质中高表达,睾丸间质富含莱迪格细胞,但这两种蛋白在生精小管生殖细胞中均低表达。 这一发现加强了SCPX和SCP2参与类固醇生成的假设,因为Leydig细胞是已知的类固醇产生细胞。 尽管我们认识到正常小鼠Leydig细胞和MA-10小鼠Leyding肿瘤细胞系之间存在巨大差异, 选择该细胞系是为了进一步研究SCPX和SCP2的亚细胞分布,因为它是研究激素依赖性Leydig细胞类固醇生成的细胞和分子机制的成熟模型[ 27 , 29 , 44 – 46 ]。 虽然关于MA-10细胞系中SCP2的研究还不多,但之前的一项研究已经使用MA-10细胞来研究SCP2在类固醇生成中的作用,除了研究重点是分离的线粒体而不是整个细胞[ 47 ]。 根据我们对细胞的整个转录组进行的初步RNA-seq数据[ 27 ],我们发现了两者的成绩单 Scpx公司 和 Scp2系列 MA-10细胞低表达。 然而,这两种蛋白质的蛋白质水平似乎很高,足以在免疫印迹分析和免疫荧光染色中检测到,其中发现这些蛋白质与过氧化物酶体以及线粒体密切相关。 根据LH治疗或LH剥夺分别导致细胞过氧化物酶体数量增加或减少的观察结果,这些发现与之前的推测一致,即线粒体中睾丸类固醇的合成与过氧化物酶结合[ 48 ].
SCPX和SCP2的双重或多重细胞内定位 我们最初假设SCPX和SCP2都将靶向过氧化物酶体和线粒体,并在类固醇生物合成过程中结合胆固醇以协助线粒体胆固醇转运。 我们推测,ECFP荧光标记与SCPX和SCP2蛋白的N末端融合将导致它们定位于过氧化物酶体,因为荧光标记将阻断线粒体靶向序列。 我们的结果与这一假设一致,因为发现ECFP–SCPX和ECFP–SCP2与线粒体DsRed pero在过氧化物酶体处共同定位,证明了ECFP–SCPX和ECFP–SCP2对该细胞器的靶向性。 这些发现与蛋白C末端存在过氧化物酶体靶向PTS1信号相一致[ 25 ]它们表明,PTS1的强度足以将SCPX和SCP2单独靶向过氧化物酶体。 先前的研究发现,尽管SCP2的大多数存在于过氧化物酶体中,但在线粒体、内质网和胞浆中也检测到大量SCP2[ 14 – 16 ]。 然而,我们注意到,当N末端序列受阻时,ECFP–SCP2似乎只定位于过氧化物酶体,这表明SCP2的N末端序列可能在将蛋白质靶向这些其他细胞器方面发挥作用。 尽管SCPX在其N末端也包含一个假定的线粒体靶向序列,但先前的研究发现它仅局限于过氧化物酶体[ 17 ]与我们的观察一致,ECFP–SCPX仅在过氧化物酶体中发现。
我们还假设ECFP标签与SCPX和SCP2的C末端融合将导致这些蛋白质定位到线粒体,因为荧光标签会阻断过氧化物酶体靶向信号。 这个假设是基于这些蛋白质的N末端表现出线粒体靶向序列的典型特征的观察[ 26 , 49 ]。 虽然线粒体中没有检测到SCPX,但通过线粒体部分的免疫印迹研究,已在线粒体中发现SCP2[ 50 ],免疫金电子显微镜[ 16 ]和免疫荧光显微镜[ 51 ]。 然而,我们的结果与预期不同,因为SCPX–ECFP和SCP2–ECFP-成为分布在细胞质中的可溶性蛋白质,SCP2-ECFP也分布在细胞核中。 对这一观察结果的可能解释是,线粒体靶向序列可能不够强,无法将SCPX和SCP2蛋白仅靶向线粒体,或者可能其他位置的不同信号序列负责蛋白质的线粒体定位。
SCPX-mi-to-EGFP和SCP2-mi-EGFP融合蛋白在细胞质和细胞核中广泛定位,但在线粒体中没有定位,这证实了SCPX和SCP2单独的线粒体靶向序列不能将这些蛋白靶向线粒体。 这些结果与ACBD2-mito-DsRed的阳性对照进行了比较,ACBD2是已知的将ACBD2蛋白靶向线粒体的前序列。因此,SCPX和SCP2的线粒体靶向序列显然不具备将蛋白质靶向线粒体所需的效力。
胆固醇与22-NBD-胆固醇的SCP2结合 SCP2具有与胆固醇高亲和力的单一胆固醇分子结合位点[ 24 ]。 然而,还没有关于分离的天然SCP2与胆固醇复合的报道,这表明SCP2不结合胆固醇,或者分离过程导致结合胆固醇的损失[ 14 ].
我们对小鼠SCP2结构域的SCP2同源性建模以及胆固醇和22-NBD-胆固醇的分子对接研究表明,SCP2在其表面结合胆固醇和22-NBD-胆固醇,在结合亲和力方面没有显著差异。 此外,这些结果表明,SCP2在某些情况下具有将配体包含在其疏水性脂质结合通道中的潜力,这可能与蛋白质的构象可塑性相一致[ 52 ]。 SCP2对胆固醇或22-NBD-胆固醇的这种非特异性结合可能表示胆固醇分子被固定在蛋白质上的一个位置,在转运过程中很容易被其他分子丢失。 此外,SCP2对胆固醇、长链脂肪酸和长链脂肪酰辅酶a有一个共同的结合位点,对长链脂肪酸和长链脂酰辅酶as有第二个特异性结合位点,但对胆固醇没有作用[ 24 ]。 根据最近的两份报告,在SCP2基因敲除小鼠模型中观察到肝胆固醇积聚[ 22 , 23 ]。 很明显,SCP2以非特异性的方式在细胞膜之间的非囊性胆固醇转运中发挥作用,并且在补充类固醇组织中类固醇激素合成耗尽的线粒体胆固醇库中具有潜在作用。
结论 总之,SCPX和SCP2存在于MA-10细胞和小鼠睾丸间质Leydig细胞中; SCPX和SCP2通过C末端PTS1靶向过氧化物酶体; N末端线粒体靶向序列并非仅针对线粒体靶向SCPX和SCP2; 胆固醇与SCP2表面结合,而不是在疏水性脂质结合囊中。
总的来说,似乎过氧化物酶体中存在的SCP2可能不会特异性结合胆固醇。 然而,过氧化物酶体外的SCP2可以以非特异性的方式结合胆固醇,这可以解释最初观察到的22NBD胆固醇没有定位于过氧化物酶体的原因。 此外,这些发现有助于我们理解类固醇生物合成过程中的细胞内胆固醇转运 通过 SCP2,它还可以帮助揭示SCP2在涉及脂质异常的疾病中的作用。
致谢 我们想感谢C Therrien女士的组织冷冻切片。
资金筹措表 这项工作得到了加拿大卫生研究院(MOP125983)和加拿大生物化学药理学研究主席的资助。 麦吉尔大学健康中心研究所得到了魁北克圣母大学研究中心的资助。
工具书类
1 Seedorf U,Assmann G.(1991)大鼠肝脏固醇载体蛋白2 cDNA的克隆、表达和核苷酸序列。 生物化学杂志 266: 630–636. [ 公共医学 ] [ 谷歌学者 ]
2 Ohba T,Holt JA,Billheimer JT,Strauss JF III.(1995)人类固醇载体蛋白x/固醇载体蛋白质2基因有两个启动子。 生物化学-美国 34:10660–10668。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Atshaws BP,Petrescu AD,Starodub O,Roths JB,Kier AB,Schroeder F.(1999)转染小鼠L细胞成纤维细胞中58kDa固醇载体蛋白-2/3-氧酰基-CoA硫酶的表达和细胞内处理。 脂质研究杂志 40: 610–622. [ 公共医学 ] [ 谷歌学者 ]
4 Moncecchi D、Murphy EJ、Schroeder DP。 (1996)小鼠L细胞成纤维细胞中甾醇载体蛋白-2的表达改变胆固醇摄取。 BBA-血脂测定 1302: 110–116. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
5 Schroeder F、Myers-Payne SC、Billheimer JT、Wood WG。 (1995)探索脂肪酸和固醇载体蛋白的配体结合位点:乙醇的作用。 生物化学-美国 34: 11919–11927. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
6 Stolowich NJ、Frolov A、Atshaws B、Murphy EJ、Jolly CA、Billheimer JT等(1997)固醇载体蛋白-2脂肪酸结合位点:核磁共振、圆二色性和荧光光谱测定。 生物化学-美国 36: 1719–1729. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
7 Frolov A,Miller K,Billheimer JT,Cho TH,Schroeder F.(1997)固醇载体蛋白-2脂肪酸结合位点的脂质特异性和位置:荧光置换和能量转移研究。 脂质 32: 1201–1209. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
8 Seedorf U,Raabe M,Ellinghaus P,Kannenberg F,Fobker M,Engel T,et al.(1998)缺乏固醇载体蛋白-2/固醇载体蛋白质-x基因功能的小鼠中支链脂肪酰基辅酶A的缺陷过氧化物酶体分解代谢。 基因开发 12: 1189–1201. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
9 Frolov A,Cho TH,Billheimer JT,Schroeder F.(1996)甾醇载体蛋白-2,一种新的脂肪酰辅酶A结合蛋白。 生物化学杂志 271: 31878–31884. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
10 Chao H,Billheimer JT,Kier AB,Schroeder F.(1999)微粒体长链脂肪酰基-CoA转酰:固醇载体蛋白-2的差异效应。 BBA-Mol细胞生物学L 1439: 371–383. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
11 Gadella TW,Wirtz KW.(1991)非特异性脂质转移蛋白的低亲和力脂质结合位点。 对其行动模式的影响。 BBA-生物膜 1070: 237–245. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
12 Wirtz KWA,Gadella TWJ Jr.(1990)特异性和非特异性磷脂转移蛋白的特性和作用模式。 Experientia公司 46: 592–599. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
13 Wirtz KWA公司。 (1991)磷脂转运蛋白。 生物化学年度收益 60: 73–99. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
14 Gallegos AM、Atshaws BP、Storey SM、Starodub O、Petrescu AD、Huang H等(2001)固醇载体蛋白-2的基因结构、细胞内定位和功能作用。 程序脂质研究 40: 498–563. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
15 Starodub O、Jolly CA、Atshaws BP、Roths JB、Murphy EJ、Kier AB等人(2000)类固醇载体蛋白-2在内质网中的定位和在磷脂形成中的作用。 美国生理学杂志细胞博士 279:C1259–C1269。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
16 Keller GA、Scallen TJ、Clarke D、Maher PA、Krisans SK、Singer SJ。(1989)大鼠肝细胞中固醇载体蛋白-2的亚细胞定位:其主要定位于过氧化物酶体。 J细胞生物学 108: 1353–1361. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
17 Pfeifer SM、Furth EE、Ohba T、Chang YJ、Rennert H、Sakuragi N等(1993)甾醇载体蛋白2:在类固醇激素合成中的作用? 类固醇生物化学杂志 47: 167–172. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
18 Gallegos AM、Atshaws BP、Storey SM、McIntosh AL、Petrescu AD、Schroeder F.(2001)类固醇载体蛋白-2的表达改变了质膜脂质分布和胆固醇动力学。 生物化学-美国 40: 6493–6506. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 Puglielli L,Rigotti A,Greco AV,Santos MJ,Nervi F.(1995)甾醇载体蛋白-2参与了胆固醇从人成纤维细胞内质网向质膜的转移。 生物化学杂志 270年:18723年至18726年。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
20 Yamamoto R、Kallen CB、Babalola GO、Rennert H、Billheimer JT、Strauss JF第三。 (1991)编码人类固醇载体蛋白2的cDNA的克隆和表达。 美国国家科学院程序 88: 463–467. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
21 Mendis-Handagama SM,Watkins PA,Gelber SJ,Scallen TJ.(1992)黄体生成激素缺乏大鼠的莱迪格细胞过氧化物酶体和固醇载体蛋白-2。 内分泌学 131: 2839–2845. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
22 Klipsic D、Landrock D、Martin GG、McIntosh AL、Landroke KK、Mackie JT等(2015)SCP-2/SCP-X基因消融和饮食胆固醇对肝脏脂质积聚的影响。 美国生理学杂志胃肠测试肝脏生理学 309:G387–G399。 10.1152/ajpgi.00460.2014 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
23 Martin GG、Atshaws BP、Landrock KK、Landroke D、Schroeder F、Kier AB(2015)L-FABP、SCP-2/SCP-x或两者的缺失会诱导雌性小鼠的肝脏脂质积聚。 Arch Biochem生物物理 580: 41–49. 2016年10月10日/j.abb.2015.06.009 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
24 Stolowich N、Frolov A、Petrescu AD、Scott AI、Billheimer JT、Schroeder F.(1999)《胆固醇载体蛋白-2》 13 胆固醇和脂肪酸结合位点的C NMR研究。 生物化学杂志 274: 35425–35433. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
25 Mori T,Tsukamoto T,Mori H,Tashiro Y,Fujiki Y.(1991)大鼠肝脏非特异性脂质转运蛋白(固醇载体蛋白2)的分子克隆和推导氨基酸序列:一种分子量较高(60kDa)的蛋白质包含非特异性脂转运蛋白的一级序列作为其C末端部分。 《美国科学院院刊》 88: 4338–4342. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
26 Westerman J,Wirtz KW.(1985)牛肝脏非特异性脂质转移蛋白(固醇载体蛋白2)的一级结构。 Biochem Bioph Res公司 127: 333–338. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
27 Fan J,Papadopoulos V.(2012)通过SINE B2介导的MA-10 Leydig细胞中的天然反义转录物对易位蛋白(Tspo)的转录调控。 生殖生物学 86: 147, 1–15. 10.1095/生物制品.111.097535 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
28 Fan J,Campioli E,Midzak A,Culty M,Papadopoulos V.(2015)TSPO的条件性类固醇生成细胞靶向缺失揭示了其在生存能力和激素依赖性类固酮形成中的关键作用。 《美国科学院院刊》 112: 7261–7266. 10.1073/pnas.1502670112 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
29 Issop L,Fan J,Lee S,Rone MB,Basu K,Mui J,et al.(2014)激素刺激Leydig细胞类固醇生成中线粒体相关膜的形成:ATAD3的作用。 内分泌学 156:334–345。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
30 卡斯蒂略AF,范J,帕帕佐普洛斯V,波德斯塔EJ。 (2011)MA-10小鼠肿瘤Leydig细胞中类固醇生成急性调节蛋白天然反义转录物的激素依赖性表达。 公共科学图书馆 6:e22822 10.1371/日记本.0022822 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
31 Trott O,Olson AJ。 (2010)AutoDock Vina:通过新的评分功能、高效优化和多线程提高对接的速度和准确性。 计算机化学杂志 31: 455–461. 10.1002/jcc.21334 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 Krisans SK.(1992)过氧化物酶体在胆固醇代谢中的作用。 Am J Respir细胞分子生物学 7:358–364。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
33 Baum CL、Reschly EJ、Gayen AK、Groh ME、Schadick K.(1997)甾醇载体蛋白-2过度表达可增强固醇循环并抑制胆固醇酯合成和高密度脂蛋白胆固醇分泌。 生物化学杂志 272: 6490–6498. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
34 Papadopoulos V,Baraldi M,Guilarte TR,Knudsen TB,Lacapère JJ,Lindemann P,et al.(2006)转运蛋白(18kDa):基于其结构和分子功能的外周型苯二氮卓受体的新命名。 药物科学趋势 27:402–409。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35 Jamin N、Neumann JM、Ostuni MA、Vu TKN、Yao ZX、Murail S等(2005)外周型苯二氮卓受体胆固醇识别氨基酸一致序列的表征。 分子内分泌学 19: 588–594. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
36 Schroeder F、Frolov A、Starodub O、Atshaws BB、Russell W、Petrescu A等(2000)N末端前序列的前甾醇载体蛋白-2在结构、功能和过氧化物酶体靶向中的作用。 生物化学杂志 275: 25547–25555. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
37 Mendis-Handagama SMLC公司。 (2000)黄体生成激素刺激后成年大鼠Leydig细胞中的过氧化物酶体和细胞内胆固醇转运。 组织细胞 32: 102–106. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
38 Faletrov YV、Bialevich KI、Edimecheva IP、Kostsin DG、Rudaya EV、Slobozhanina EI等(2013)22-NBD-胆固醇作为胆固醇转化氧化还原酶的新型荧光底物。 类固醇生物化学杂志 134: 59–66. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
39 Stocco DM、Teeds KJ、Van Noort M、Rommerts FFG。 (1990)垂体切除术和人绒毛膜促性腺激素对成年大鼠Leydig细胞功能的影响。 内分泌杂志 126: 367–375. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
40 van Haren L、Teeds KJ、Ossendorp BC、van Heusden GP、Orly J、Stocco DM等(1992)甾醇载体蛋白2(非特异性脂质转运蛋白)定位于Leydig细胞和Sertoli细胞的膜部分,但不定位于生殖细胞。 BBA-血脂测定 1124: 288–296. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
41 Payne AH,Youngblood GL.(1995)Leydig细胞中类固醇生成酶表达的调节。 生殖生物学 52: 217–225. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
42 Mendis-Handagama SMLC,Watkins PA,Scallen TJ.(1998)慢性黄体生成激素治疗对成年大鼠Leydig细胞的影响。 组织细胞 30: 64–73. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
43 Mendis-Handagama SM(1997),促黄体生成素对莱迪格细胞结构和功能的影响。 组织病理学 12: 869–882. [ 公共医学 ] [ 谷歌学者 ]
44 Aghazadeh Y,Ye X,Blonder J,Papadopoulos V.(2014)蛋白质修饰调节14-3-3γ适配器蛋白在cAMP诱导的MA-10 Leydig细胞类固醇生成中的作用。 生物化学杂志 289: 26542–26553. 10.1074/jbc。 M114.569079型 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
45 Ascoli MARI.(1981)培养的Leydig肿瘤细胞的几种克隆系的特征:促性腺激素受体和类固醇生成反应。 内分泌学 108:88–95。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
46 Rone MB、Midzak AS、Martinez-Arguelles DB、Fan J、Ye X、Blonder J等(2014)。通过脂肪酸进入线粒体改变MA-10小鼠莱迪格细胞的类固醇生成。生物再现 91: 96, 1–14. 10.1095/生物制品.114.121434 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
47 Kilgore MW,Rommerts FFG,Wirtz KWA,Stocco DM。(1990)MA-10小鼠Leydig肿瘤细胞系亚克隆中类固醇生成的调节。 分子细胞内分泌 69: 9–16. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
48 Nenicu A、Lüers GH、Kovacs W、Bergmann M、Baumgart-Vogt E.(2007)人和小鼠睾丸中的过氧化物酶体:生殖细胞和睾丸不同体细胞类型中过氧化物酶体蛋白的差异表达。 生殖生物学 77:1060–1072。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
49 Moncecchi D,Pastuszyn A,Scallen TJ.(1991)小鼠肝脏固醇载体蛋白-2的cDNA序列和细菌表达。 生物化学杂志 266: 9885–9892. [ 公共医学 ] [ 谷歌学者 ]
50 Van Heusden GP,Bos K,Wirtz KW.(1990)大鼠组织中可溶性和膜结合非特异性脂质转移蛋白(固醇载体蛋白2)的出现。 BBA-血脂测定 1046: 315–321. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
51 Gallegos AM、Schoer JK、Starodub O、Kier AB、Billheimer JT、Schroeder F.(2000)固醇载体蛋白-2在胆固醇向线粒体转移中的潜在作用。化学物理脂质 105: 9–29. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
52 Filipp FV,Sattler M.(2007)脂质转运蛋白SCP2的构象可塑性。 生物化学-美国 46: 7980–7991. [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。