介绍 钙(Ca 2+ )是一种高度通用的信号分子,在细胞的生与死过程中控制多种功能( 贝里奇 等 , 2000 ). 最近的研究强调了钙的中枢功能 2+ 程序性细胞死亡的调控( 奥雷尼乌斯 等 , 2003 ; 里祖托 等 , 2003 ). 胞浆钙增加 2+ 细胞死亡的原因有多种,包括外膜损伤、阳离子通道过度激活或钙释放 2+ 储存于内质网(ER)( 萨莱 等 , 1999 ; 奥雷尼乌斯 等 , 2003 ). 越来越多的证据表明ER-Ca之间存在高度协调的沟通 2+ 储存和线粒体( 里祖托 等 , 1998 ). 凋亡刺激,如毒肽或神经酰胺,可诱发钙 2+ 从内质网释放,从而增加线粒体钙 2+ 浓度( 平通 等 , 2001 ). 在细胞死亡期间,线粒体Ca 2+ 信号激活通透性转换孔,导致线粒体去极化和细胞色素释放 c(c) ( 奥雷尼乌斯 等 , 2003 ). 值得注意的是,加州 2+ ER中的含量决定线粒体Ca的振幅 2+ 信号,从而调节细胞凋亡敏感性( Pinton和Rizzuto,2006年 ).
调节凋亡的蛋白质包括Bcl-2蛋白家族,该家族由抗凋亡和促凋亡成员组成。 许多这些蛋白质在线粒体水平上发挥作用,但最近这些蛋白质在内质网中的一个突出功能出现了( Pinton和Rizzuto,2006年 ). 具体地说,最近的证据表明,促凋亡和抗凋亡Bcl-2家族成员之间的微妙平衡微调了Ca 2+ ER中的浓度。而Bcl-2已被证明降低ER-Ca 2+ 含量,从而保护细胞免受凋亡( 福尤兹-优素福 等 , 2000 ; 平通 等 , 2000 ),促凋亡蛋白,如Bax和Bak,具有相反的功能( 斯科拉诺 等 , 2003 ).
TRPP2是瞬时受体电位(TRP)阳离子通道超家族的成员( 蒙特尔,2005年 )在常染色体显性多囊肾病(ADPKD)中突变( Mochizuki公司 等 1996年 ). ADPKD是最常见的遗传性疾病之一,由两种基因突变引起 PKD1系列 或 PKD2系列 ,分别编码多囊蛋白-1和TRPP2(以前称为多囊蛋白-2)的基因( Mochizuki公司 等 1996年 ; Boletta和Germino,2003年 ). TRPP2作为Ca发挥作用 2+ -渗透性阳离子通道,并在不同的亚细胞隔室中检测到:内质网、质膜和初级纤毛( Köttgen和Walz,2005年 ). 我们已经证明,TRPP2在内质网和质膜之间的转运是通过与衔接蛋白PACS-1和PACS-2的磷酸化依赖性相互作用来控制的( 科特根 等 , 2005 ). TRPP2的管制贩运是控制渠道功能的重要机制。 然而,人们对其在不同亚细胞隔室中的确切生物学功能知之甚少。 TRPP2参与各种生理功能,包括机械调节、增殖和精子引导。 然而,不同细胞室特异性TRPP2功能转化为特定细胞结果的机制尚不清楚( 科特根,2007年 ).
涉及离子通道功能障碍(通道病)的遗传病有助于揭示其中许多疾病的生理功能( 耶特斯 等 2004年 ; 尼留斯 等 , 2007 ). 细胞凋亡与膀胱生成有因果关系:编码Bcl-2和AP-2β的抗凋亡基因的缺失以及促凋亡c-Myc在小鼠中的过度表达导致肾囊性疾病( 静脉 等 , 1993 ; 莫瑟 等 , 1997 ; 特鲁德尔 等 , 1997 ). 据报道,在ADPKD患者和多囊肾病(PKD)的几种动物模型中,细胞凋亡率增加( 吴,1995 ; 埃克德 等 , 2002 ; 基普 等 , 2005 ; 布卡诺夫 等 , 2006 ; Starremans公司 等 , 2008 ). 因此,我们假设TRPP2可能起到抗凋亡离子通道的作用。 这似乎有点违反直觉,因为非选择性阳离子通道通常与促进细胞死亡而非存活有关( 米勒,2006 ). 然而,TRPP2在ER中的主要定位( 蔡 等 , 1999 )促使我们研究其在ER-Ca中的功能 2+ 通向凋亡的大门。 在本研究中,我们探讨了TRPP2在细胞内钙离子中的功能 2+ 信号转导并显示TRPP2作为调节钙离子的抗凋亡离子通道发挥作用 2+ 我们的研究结果不仅阐明了ER驻留TRPP2的一种新功能,还可能解释为什么Bcl-2的破坏会导致小鼠PKD。
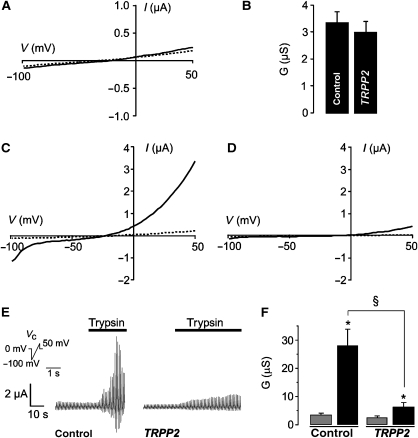
结果 TRPP2减少Cl − 由ER-Ca激活的电流 2+ 在中释放 爪蟾 卵母细胞 为了研究TRPP2的通道功能,我们在 爪蟾 在电压钳条件下监测卵母细胞的全细胞电流。 TRPP2不影响全细胞稳态导电性能( 图1A和B ). 这与最近的研究报告一致,即在不同细胞类型中异源表达时,质膜上没有检测到TRPP2通道活性( 陈 等 , 2001 ; 科特根 等 , 2005 ).
图1。
TRPP2通道功能 爪蟾 卵母细胞。 ( 一个 )表达TRPP2的卵母细胞(虚线)或注水对照细胞(实线)的电流-电压(I–V)关系。 ( B类 )来自(A)的分组数据。 根据欧姆定律计算整个电池的电导(G)。 ( C )对照卵母细胞在对照溶液中(虚线)或用胰蛋白酶刺激后(10μg/ml;实线)的电流-电压关系。 ( D类 )在对照溶液(虚线)或用胰蛋白酶刺激后表达TRPP2的卵母细胞的电流-电压关系(实线)。 ( E类 )胰蛋白酶诱导的对照细胞和表达TRPP2的细胞的全细胞电流的时间进程。 在电压钳条件下记录电流。 电压钳( V(V) c(c) )协议如图所示。 ( F类 )来自(E)的分组数据。 在峰值电流下计算胰蛋白酶诱导的全细胞电导(黑色条)(灰色条:对照溶液中的电导)。 * 和 § 指出所示的统计显著差异。
测试TRPP2是否在细胞内发挥作用,从而调节Ca 2+ 信号,我们测量了内源性钙 2+ -活化Cl − 卵母细胞电流监测胞浆钙的动态变化 2+ 浓度( 科特根 等 , 2003 ). 用胰蛋白酶激活的外向整流钙刺激内源性G蛋白偶联受体 2+ -活化Cl − 水注入对照卵母细胞中的电流( 图1C和E ). 然而,在表达TRPP2的卵母细胞中,这些Ca 2+ -活化Cl − 电流大大减少( 图1D和E ). 在表达TRPP2的卵母细胞中,胰蛋白酶诱导的全细胞电导显著降低( 图1F ; 对照组:27.88±5.79μ, n个 =9; TRPP2: 6.47±1.42μS, n个 =11). 胰蛋白酶受体 爪蟾 卵母细胞通过G传递信号 αq -磷脂酶C的蛋白介导活化导致IP 三 -诱导钙释放 2+ 从细胞内储存。 因此,钙的振幅降低 2+ -活化Cl − TRPP2表达细胞中的电流可能是由于参与该信号级联的蛋白质的丰度或活性降低,或者是由于可释放游离钙的减少 2+ 在ER Ca中 2+ 商店。 为了区分这些可能性,我们研究了TRPP2对钙的影响 2+ 几种哺乳动物细胞系中的信号传递。
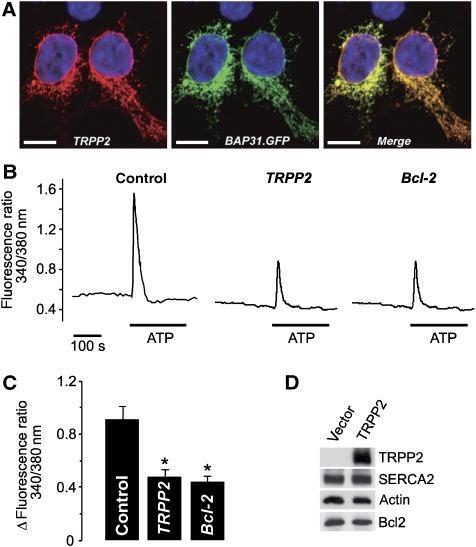
TRPP2定位于ER并减少Ca 2+ 从细胞内储存释放 在人类胚胎肾(HEK)293细胞中表达的TRPP2的间接免疫荧光显示,该蛋白在细胞内呈网状分布,与BAP31.GFP共定位,是ER的标记物( 图2A ). 为了确定TRPP2在ER中的功能,我们测量了细胞溶质Ca 2+ 浓度[Ca 2+ ] c(c) 在HEK 293细胞中使用比率Ca 2+ 成像。 基底[Ca 2+ ] c(c) 转染载体(对照)和表达TRPP2的细胞之间没有显著差异(分别为14.9±2.6 nM和14.3±2.4 nM, n个 =9). 然而,用ATP刺激嘌呤能GPCR显示Ca的振幅显著降低 2+ 表达TRPP2或Bcl-2的细胞信号( 图2B和C ; 对照组:183.31±17.75 nM, n个 =9,TRPP2:92.39±8.79 nM, n个 =9和Bcl-2:83.94±7.01 nM, n个 =8). 由于这些实验是在细胞外Ca标称缺失的情况下进行的 2+ ,胞浆Ca减少 2+ 信号反映钙的减少 2+ 从细胞内储存释放。 我们证实,TRPP2在HEK 293细胞中的表达不会改变肌内质网钙的水平 2+ ATP酶(SERCA)和Bcl-2,这两种蛋白质早先被证明影响ER-Ca 2+ 内容( 平通 等 , 2001 ; Pinton和Rizzuto,2006年 ; 图2D ).
图2。
TRPP2定位于ER并调节Ca 2+ 发出信号。 ( 一个 )用TRPP2和ER标记BAP31.GFP转染的HEK 293细胞(中间面板)用抗TRPP2抗体染色(左侧面板,比例尺:10μm;蓝色:用Hoechst 33342核染色)。 ( B类 )呋喃-2钙 2+ 测量:瞬时TRPP2或Bcl-2表达对钙的影响 2+ 从HEK 293细胞的细胞内储存释放。 在缺乏细胞外钙的情况下,用10μM ATP刺激嘌呤能受体 2+ . ( C )峰值Ca时(B)的组数据 2+ 增加(ATP诱导的峰值-基线)。 ( D类 )western blotting分析转染TRPP2编码质粒或空载体的HEK 293细胞裂解液中SERCA2和Bcl-2的水平。
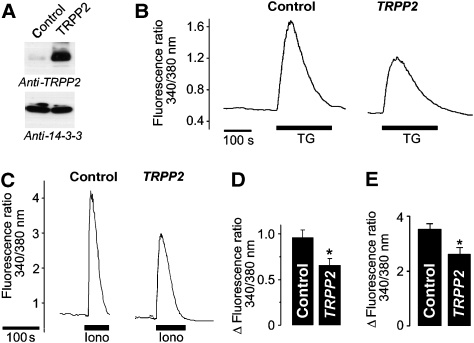
为了排除由于短暂过度表达的毒性而产生的细胞类型特异性效应和潜在人工制品,我们使用逆转录病毒基因转移(western blot,见 图3A ). 稳定表达TRPP2的HeLa细胞显示Ca显著减少 2+ G刺激后从细胞内储存释放 q个 -耦合受体,确认来自 爪蟾 卵母细胞和HEK 293细胞( 补充图1 ). 为了测试细胞溶质钙是否减少 2+ 信号是由于GPCR信号通路中蛋白质的调节或钙的减少 2+ ER中的浓度([Ca 2+ ] 急诊室 ),我们通过释放Ca绕过GPCR信号通路 2+ 以受体依赖的方式从细胞内储存(在缺乏细胞外钙的情况下 2+ ). thapsigargin对SERCA的抑制作用导致Ca的释放 2+ 由于被动泄漏,从ER。 As[钙 2+ ] 急诊室 确定Ca的驱动力 2+ 释放,细胞溶质钙的振幅 2+ 增加间接反映了ER Ca 2+ 内容。 与对照细胞相比,稳定表达TRPP2的HeLa细胞应用thapsigargin后的峰值振幅显著降低( 图3B 和D; 对照:184.23±22.81 nM和 TRPP2型 :112.64±17.08牛顿米, n个 =11). 同样,Ca 2+ 在表达TRPP2的HEK 293细胞中,离子载体离子霉素诱导的细胞内储存释放减少( 图3C 和E; 控制:2.27±0.35μM,以及 TRPP2型 :1.01±0.10μM, n个 =9). 因此,我们的数据表明TRPP2在降低ER Ca方面的作用 2+ 负载。 内质网钙的急性减少 2+ 浓度导致电容性钙活化 2+ 流入,流入( 霍弗 等 , 1998 ). 然而,以前的研究表明,ER-Ca的长期减少 2+ Bcl-2过表达水平下调电容性钙 2+ 流入,流入( 平通 等 , 2000 ). 我们研究了TRPP2表达对电容性钙的影响 2+ 进入HEK 293细胞。 在缺乏细胞外Ca的情况下,用thapsigargin耗尽储存物 2+ ,在钙恢复后观察到电容性内流 2+ 到镀液中。 在表达TRPP2的细胞中,电容性钙 2+ 进入被显著下调( 补充图2 ),添加到Bcl-2和TRPP2之间的功能相似性列表中。
图3。
TRPP2降低GPCR依赖性钙释放 2+ 来自ER( 一个 )用抗TRPP2抗体免疫印迹法检测TRPP2在HeLa稳定细胞系中的表达(对照:用空载体pLXSN产生的逆转录病毒转导的HeLa细胞; TRPP2型 :用编码TRPP2的逆转录病毒转导的HeLa细胞)。 分析14-3-3蛋白水平作为负荷控制。 ( B类 )Fura-2钙 2+ 测量:HeLa细胞中TRPP2稳定表达对钙释放的影响 2+ 使用thapsigargin(TG,10μM)从ER中提取。 ( C )TRPP2在HEK 293细胞中瞬时表达对钙释放的影响 2+ 使用离子霉素(Iono,5μM)从ER中提取。 (B)和(C)中的实验是在没有细胞外钙的情况下进行的 2+ . ( D类 )峰值Ca时(B)的组数据 2+ 增加(TG诱导的峰值−基线)( n个 =11). ( E类 )峰值Ca时(C)的分组数据 2+ 增加( n个 =9).
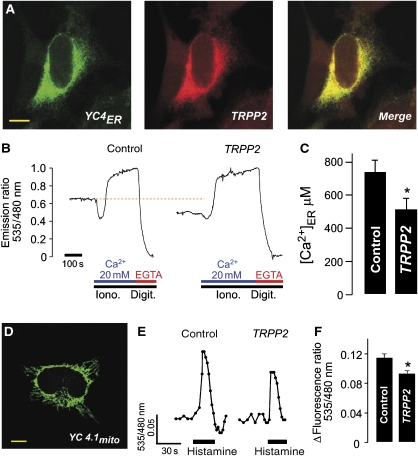
TRPP2降低Ca 2+ ER中的浓度 细胞溶质钙的数据 2+ 测量结果表明ER Ca降低 2+ 浓度,但不提供实际[Ca 2+ ] 急诊室 为了证实表达TRPP2的细胞中ER钙浓度降低的证据,我们测量了[Ca 2+ ] 急诊室 直接使用基因编码的ER靶向Ca 2+ 传感器(黄色Cameleon)( 宫崎骏 等 , 1997 ). 钙网织蛋白信号肽和KDEL序列靶向低亲和力钙 2+ 传感器YC4 急诊室 与TRPP2同处的ER( 图4A ). Cameleon染料由青色荧光蛋白(CFP)、钙调素、肌球蛋白轻链激酶(M13)的钙调素结合域和黄色荧光蛋白(YFP)组成。 钙 2+ 钙调素与M13的结合诱导其分子内相互作用,从而提高CFP与YFP之间的荧光共振能量传递效率。 因此,可以通过在440 nm处激发CFP并记录发射比535/480 nm的变化来观察钙结合( 图4B ). 我们直接测量了钙的稳态浓度 2+ 通过校准比例荧光信号(单位:Ca 2+ -暴露于特定细胞外钙的渗透性'细胞(10μM离子霉素,0.5μg/ml洋地黄素) 2+ 浓度( 图4B ). [加利福尼亚州 2+ ] 急诊室 在表达TRPP2的细胞中显著减少( 图4B 和C ; 对照:737.74±74.63μM, n个 =16和 TRPP2型 :511.91±70.93μM, n个 =18).
图4。
TRPP2降低[Ca 2+ ] 急诊室 和线粒体钙 2+ 信号。 ( 一个 )针对ER的Cameleon(YC4 急诊室 )与TRPP2(用抗TRPP2抗体免疫修饰)在HeLa细胞中共定位(比例尺:10μm)。 ( B类 )YC4归一化荧光发射比(535/480nm)的校准 急诊室 与空载体(对照)或TRPP2(10μM离子霉素,0.5μg/ml洋地黄素和20 mM钙 2+ 或5 mM EGTA)。 注意表达TRPP2(橙色虚线)的单元格中的稳态值降低。 ( C )稳定态钙 2+ ER中的浓度([Ca 2+ ] 急诊室 )根据(B)中描述的一系列实验计算出的对照细胞和表达TRPP2的细胞( n个 分别为16和18)。 ( D类 )以线粒体为靶点的骆驼(YC4.1 米托 )在HeLa细胞中表达(比例尺:10μm)。 ( E类 )YC4.1的荧光发射比(535/480nm) 米托 在转染TRPP2或空载体(对照)(10μM组胺)的细胞中记录。 ( F类 )峰值Ca时(E)的分组数据 2+ 增加。
线粒体Ca减少 2+ 信号 内质网和线粒体在物理和生理上是相互联系的( 里祖托 等 , 1998 ). 钙 2+ 从内质网释放的钙迅速被紧密并列的线粒体吸收。研究TRPP2对线粒体钙的影响 2+ 活细胞中的动力学,一种针对线粒体的卡梅隆染料(YC4.1 米托 )在HeLa细胞中表达( 阿尔诺多 等 , 2001 ) ( 图4D ). 表达TRPP2的细胞线粒体[Ca 2+ ]用组胺(10μM, 图4E和F ),反映了可释放Ca的减少量 2+ 在ER中。
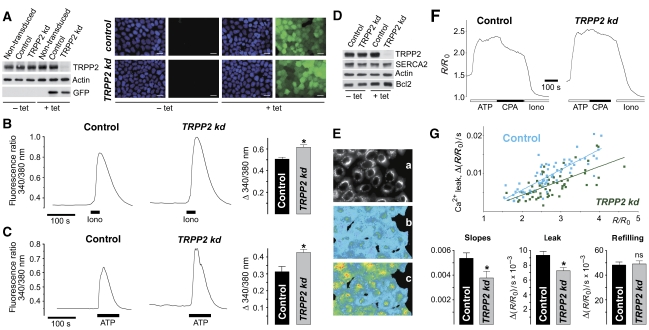
TRPP2敲除增加了可释放ER Ca的量 2+ 随后,我们研究了内源性TRPP2通道是否调节ER-Ca 2+ 负荷,正如我们在TRPP2过度表达时观察到的。 通过慢病毒基因转移,我们以四环素诱导的方式,生成了表达TRPP2定向(TRPP2敲除(kd))shRNA或非靶向shRNA(对照)盒的Madin–Darby犬肾上皮细胞(MDCK)多克隆系,每个细胞都结合了GFP标记。 在含有5μg/ml四环素的培养基中培养TRPP2 kd细胞4天,导致TRPP2几乎完全失去表达( 图5A和D ). 相反,添加四环素后,对照细胞中的TRPP2水平未受影响。 此外,GFP荧光信号的出现证明了shRNA盒在任一细胞系中的诱导表达( 图5A ). 分析在四环素存在下生长的细胞的胞浆钙 2+ 使用Fura-2成像的响应。 TRRP2-kd细胞具有显著较高的Ca振幅 2+ 离子霉素刺激的瞬变( 图5B )或ATP( 图5C )表明TRPP2的耗竭增加了可释放Ca的量 2+ 我们证实,在TRPP2缺失的细胞中,SERCA2和Bcl-2的稳态水平没有改变( 图5D ). 这些结果证实了我们之前通过TRPP2过度表达系统获得的结果。
图5。
MDCK细胞中TRPP2的消融降低ER-Ca 2+ 泄漏并导致可释放钙量增加 2+ . ( 一个 )条件表达MDCK细胞的分析 TRPP2型 -靶向(TRPP2 kd)或对照shRNA盒,以及GFP标记。 通过western blotting分析在没有(−tet)和存在(+tet)四环素的情况下生长的细胞制备的裂解物。 荧光显微镜(绿色)也观察到GFP的诱导表达。 细胞核用Hoechst 33342(蓝色)染色。 比例尺:10μm。 ( B类 )Fura-2细胞溶质钙 2+ 在缺乏细胞外钙的情况下,用2μM离子霉素(Iono)处理TRPP2缺失细胞(TRPP2 kd)和对照细胞后的成像 2+ 显示了代表性记录道和组数据(峰值-基线; n个 =7)。 ( C )除使用10μM ATP外,实验按(B)进行( n个 =6). ( D类 )western blotting分析对照组和TRPP2 kd细胞裂解液中SERCA2和Bcl-2的水平。 ( E类 )用低亲和力钙负载MDCK细胞 2+ 指示剂Mag-Fur-2AM和洋地黄素渗透分析钙的动力学 2+ 泵入ER及其泄漏。 图片显示了渗透(a)后定位于细胞内储存物中的Mag-Fura-2(340 nm波长激发)的荧光及其钙 2+ (b)和(c)重新填充之前和之后的加载状态(340/380nm比率以假彩色表示)。 ( F类 )图表显示了Ca的变化 2+ 细胞内储存物的负载状态(340/380nm比率 R(右) 除以最小比率 R(右) 0 )在对照组和TRPP2缺失(TRPP2 kd)细胞中。 通过添加1.5 mM ATP和Ca开始重新加注 2+ 30μM CPA抑制SERCA后观察到泄漏。 最小比率 R(右) 0 在用离子霉素(Iono;2μM)耗尽储存后发现。 ( G公司 )ER再填充和泄漏的统计分析 n个 =64个控制单元和 n个 =64个TRPP2-分别来自六个和七个独立测量的缺失细胞。 每个细胞的钙渗漏率与 R(右) / R(右) 0 在CPA治疗开始时,用Excel软件将数据拟合成线性回归线( 年 = bx公司 + 一 ,其中 b条 为0.0054, 一 为−0.005,相关性 第页 =0.835(对于对照细胞); b条 为0.0038, 一 为−0.0032,并且 第页 =0.661(对于TRPP2缺失的细胞)。 左边的条形图显示了两个回归斜率之间的差异及其标准误差( P(P) =0.025). 其余的条形图显示了泄漏和重新填充的平均速率及其标准误差。
接下来我们研究了TRPP2的耗竭是否影响钙 2+ 通过SERCA或被动Ca泵入ER 2+ 从这个细胞器泄漏。 在有利于其在细胞内蓄积的条件下,用低亲和力钙指示剂Mag-Fura-2 AM负载细胞,并用洋地黄素使其质膜渗透( 图5E ,面板a)。 在用含EGTA的缓冲液灌注细胞内储存物耗尽后,用钙重新填充储存物 2+ 通过ATP和Mg激活的SERCA的作用 2+ ER-localized Mag-Fura-2的340/380荧光比率增加证明了这一点( 图5E和F ). Ca公司 2+ 在应用ATP期间,储存物的负荷达到了稳定水平,但在用SERCA抑制剂环丙磺酸(CPA)取代ATP后,储存物负荷下降; 图5F ). 钙的计算速率 2+ 对照组和TRPP2缺失细胞的被动渗漏与钙呈正相关 2+ CPA治疗开始时的水平( 图5G ),而再充盈率和初始钙没有发现这种关系 2+ 级别(未显示数据)。 泄漏率对ER Ca的依赖性 2+ 两个细胞群体的负荷可以拟合成具有显著不同斜率的线性回归线(对照细胞为0.0054,TRPP2kd细胞为0.0038; 图5G ). 此外,尽管TRPP2缺失细胞的平均泄漏率明显小于对照细胞,但它们的平均再填充率几乎相同。 这些结果表明,TRPP2通道有助于钙的被动泄漏 2+ 而ER又可能是可释放Ca量增加的原因 2+ 在TRPP2缺失细胞中。
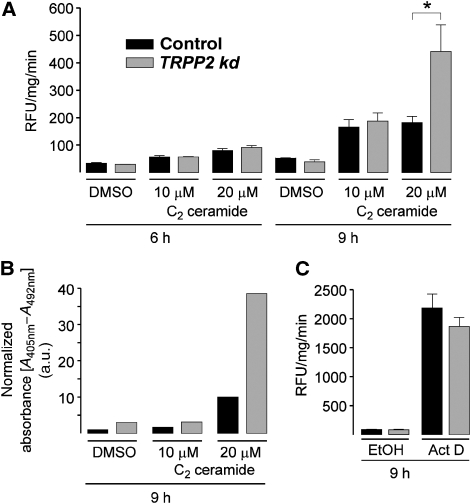
TRPP2敲除增强了对选择凋亡诱导物的敏感性 钙增加时 2+ 内质网的负荷使细胞对某些刺激(如神经酰胺)产生凋亡反应( 平通 等 , 2001 ),我们分析了TRPP2-depleted(TRPP2-kd)细胞的凋亡进程,并通过测定caspase 3活性来控制MDCK细胞。 用C处理细胞后,这种活性增加 2 -神经酰胺具有时间和剂量依赖性,表明诱导细胞凋亡( 图6A ). 重要的是,使用20μM C 2 -与对照细胞相比,神经酰胺9小时导致TRPP2kd细胞中caspase 3活性显著升高。 神经酰胺处理的TRPP2 kd细胞的细胞质部分也因凋亡DNA断裂而含有较高水平的核小体( 图6B ). 相反,与对照细胞相比,TRPP2 kd细胞对转录抑制剂放线菌素D诱导的凋亡不敏感( 图6C ). 这些结果表明,TRPP2的缺失增强了细胞对凋亡刺激的敏感性,这些凋亡刺激参与ER-Ca 2+ 网关,如神经酰胺( 里祖托 等 , 2003 )由于其ER Ca增加 2+ 负载。 我们的数据还表明,TRPP2 ER功能的缺乏可能是多囊肾细胞凋亡率增加的原因。
图6。
TRPP2的消融使细胞对神经酰胺而非放线菌素D诱导的凋亡敏感( 一个 )用10或20μM C诱导凋亡后,检测TRPP2缺失(TRPP2 kd;灰色条)和对照(黑色条)MDCK细胞中caspase 3样活性 2 -神经酰胺6或9小时。活性以每分钟相对荧光单位(RFU)表示,并归一化为1毫克总蛋白( n个 =4). ( B类 )用指定剂量的C 2 -用ELISA测定神经酰胺,并将其归一化为细胞裂解液中的总蛋白水平。 条形图显示了一个代表性测量的数据。 该试验重复三次,结果基本相同。 ( C )用0.5μg/ml放线菌素D(Act D)诱导TRPP2缺失细胞和对照细胞凋亡9 h。测定caspase 3样活性,如(A)所示( n个 =3).
讨论 TRPP2起Ca的作用 2+ -可渗透的阳离子通道,已被证明定位于不同的亚细胞隔室,在那里发挥不同的功能( 科特根,2007年 ). TRPP2是存在于质膜还是在内质网中并发挥作用的长期争议已被最近的证据所调和,即TRPP2的亚细胞定位和转运受与衔接蛋白的多重相互作用控制( Hidaka公司 等 2004年 ; 科特根 等 , 2005 ; Köttgen和Walz,2005年 ). 然而,目前尚不清楚TRPP2的不同室特异性功能如何调节特定的细胞结果。 这里,我们证明TRPP2调节ER-Ca 2+ 通过降低钙离子进入细胞凋亡途径 2+ ER中的浓度。
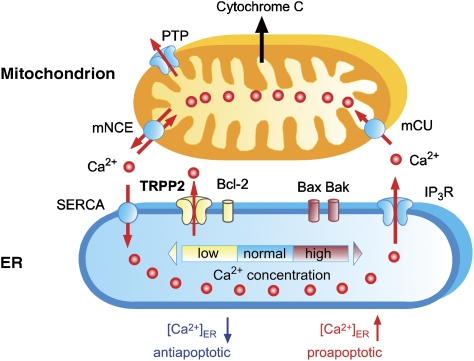
钙 2+ 长期以来被认为是凋亡途径中的关键信号分子( 奥雷尼乌斯 等 , 2003 ; 里祖托 等 , 2003 ). 由于钙的毒性 2+ 低钙离子 2+ 细胞质中必须保持浓度(10–100 nM)。 大部分细胞钙 2+ 存储在ER中。Ca 2+ 由SERCA泵入ER,并仅在短时间内通过IP的打开短暂释放 三 -或ryanodine受体( 贝里奇 等 , 2000 ). 释放的Ca的重要部分 2+ 被线粒体隔离,线粒体战略性地位于ER-Ca附近 2+ -释放通道( 里祖托 等 , 1998 ) ( 图7 ). 线粒体最终决定钙 2+ 信号被解码为生死信号。 从生命线索到死亡线索的转换涉及钙的巧合检测 2+ 和促凋亡刺激,并取决于线粒体Ca的振幅 2+ 瞬态( 萨莱 等 , 1999 ; Pinton和Rizzuto,2006年 ). 线粒体钙的含量 2+ 反过来,信号在很大程度上取决于ER-Ca 2+ 内容( 平通 等 , 2000 ). 值得注意的是,最近的几项研究表明,Ca 2+ ER的含量决定了细胞对凋亡应激的敏感性( 平通 等 , 2001 ; Pinton和Rizzuto,2006年 ). 降低ER Ca的程序 2+ 负荷,如钙的遗传消融 2+ -缓冲蛋白钙网蛋白或质膜钙过表达 2+ ATP酶,保护细胞免受凋亡( 中村 等 , 2000 ; 平通 等 , 2001 ). 相反,增加ER Ca的程序 2+ 负荷,如SERCA或钙网蛋白的过度表达,使细胞对凋亡应激敏感( 平通 等 , 2001 ; 阿诺多 等 , 2002 ).
图7。
ER-Ca的简化模型 2+ 通向凋亡的大门。 在生理条件下,Ca 2+ 内质网和线粒体之间持续循环 2+ ATP酶(SERCA)泵Ca 2+ 通过IP从ER释放 三 -选通信道(IP 三 R) ●●●●。 美国加利福尼亚州 2+ 单转运蛋白(mCU)介导Ca 2+ 线粒体和线粒体钠的摄取 + /钙 2+ 交换器(mNCE)释放Ca 2+ .凋亡刺激可释放钙 2+ 来自内质网,导致线粒体Ca 2+ 信号。 线粒体Ca的大小 2+ 信号和额外的促凋亡刺激决定细胞色素 c(c) 释放以触发细胞凋亡。 线粒体Ca的振幅 2+ 信号取决于Ca 2+ 内质网的含量,由活性钙之间的平衡维持 2+ SERCA和被动Ca泵送 2+ 从ER退出。TRPP2和Bcl-2降低Ca 2+ ER中的浓度([Ca 2+ ] 急诊室 )通过增加被动钙 2+ 退出通道。 这导致线粒体钙降低 2+ 信号,导致对凋亡的敏感性降低。 根据“变阻器模型”( Demaurex和Distelhorst,2003年 )、ER Ca 2+ 负荷由抗凋亡和促凋亡Bcl-2蛋白家族成员(分别为Bcl-2和Bax/Bak)之间的平衡调节。 在这里,我们将阳离子通道TRPP2作为一种新型抗凋亡因子引入到这个模型中(根据 Demaurex和Distelhorst,2003年 ).
此外,最近的数据显示,Bcl-2家族蛋白在调节稳态Ca中具有意想不到的功能 2+ ER中的浓度( Pinton和Rizzuto,2006年 ). 一系列优雅的研究表明,促凋亡和抗凋亡Bcl-2家族成员之间的平衡决定了ER Ca 2+ 内容。 抗凋亡蛋白Bcl-2的过度表达降低了ER-Ca 2+ 负载,从而保护细胞免受死亡( 福尤兹-优素福 等 , 2000 ; 平通 等 , 2000 ). 相反,促凋亡蛋白Bax和Bak的功能相反。 Bax和Bak缺乏小鼠的细胞由于ER-Ca减少而对凋亡产生抵抗 2+ 导致线粒体钙降低的负荷 2+ 信号( 斯科拉诺 等 , 2003 ) ( 图7 ).
在本研究中,我们证明TRPP2符合ER-Ca中蛋白质功能的标准 2+ 通向凋亡的大门。 在表达TRPP2的细胞中:(1)[Ca 2+ ] 急诊室 通过使用ER靶向钙的直接测量评估,减少 2+ 传感器; (2) IP(IP) 三 受体刺激导致细胞溶质和线粒体钙降低 2+ 信号; (3) 钙 2+ 使用诱导细胞凋亡的刺激物,如离子霉素或thapsigargin,从内质网的释放减少。 此外,TRPP2(4)的敲除降低了被动Ca 2+ ER泄漏,(5)增加Ca 2+ 储存耗尽后释放,(6)增加细胞凋亡敏感性。
这个 体内 本文提出的TRPP2功能的细胞机制的相关性得到了Bcl-2上公布的数据的支持。 该蛋白与TRPP2具有相同的ER细胞凋亡调控机制( 平通 等 , 2000 ). 更重要的是, Bcl-2型 -缺陷小鼠通过未知机制发展PKD( 静脉 等 , 1993 ). TRPP2和Bcl-2在ER-Ca水平上生理作用的相似性 2+ 内稳态为任一蛋白功能丧失时观察到的表型提供了一种机制联系。 从TRPP2的角度来看,这支持细胞凋亡在PKD发病机制中的重要作用; 从Bcl-2的角度来看,它可能解释了 Bcl-2型 -缺陷小鼠。 应该注意的是 Bcl-2型 -缺乏ADPKD的动物和ADPKD患者的动物表现出形态学上的差异,特别是肾脏大小,ADPKD中肾脏增大 Bcl-2型 击倒老鼠。 这种差异可能是由TRPP2的额外的室特异性功能解释的,包括调节增殖、细胞极性和分化( 科特根,2007年 ). 此外,可以想象,任一基因的发育模式和表达时间将影响囊性表型的特定形态特征。
Bcl-2改变ER Ca的机制 2+ 仍未解决。 尽管Bcl-2本身被认为是一个离子通道,但最近的证据支持Bcl-2与ER通道相互作用的观点,例如IP 三 受体,以减少ER Ca 2+ 内容( Pinton和Rizzuto,2006年 ). 我们有初步数据显示Bcl-2和TRPP2共同免疫沉淀(Möttgen,未发表的数据)。 有趣的是,TRPP2最近显示与IP交互 三 受体也是( 锂 等 , 2005 ). 因此,很容易推测TRPP2、Bcl-2和IP 三 受体可能会形成一种大分子复合物,调控ER-Ca 2+ 通向凋亡的大门。 测试IP是否 三 TRPP2介导的可释放钙的减少需要受体 2+ 从ER中,我们研究了IP中的商店发布 三 受体敲除细胞( 补充图3 ). 这些实验表明,IP 三 TRPP2介导的ER-Ca减少不需要受体 2+ 这表明TRPP2形成了一个新的独立ER泄漏通道。
除了在ER-Ca中的作用 2+ ER-resident TRPP2的功能可能在Ca中具有更广泛的意义 2+ -依赖性细胞过程。 最近有研究表明,ER Ca的增加 2+ 钙长期处理导致泄漏 2+ 动员剂,如thapsigargin、ATP或维生素D 三 化合物,上调自噬,溶酶体中细胞质成分降解的途径( 霍耶·汉森 等 , 2007 ). 这种作用可以通过螯合细胞内钙来阻止 2+ 或通过表达预先清空ER存储的ER靶向型Bcl-2。 实验诱导的内质网钙 2+ 泄漏导致细胞溶质钙激活 2+ /钙调蛋白依赖性激酶-β和随后对哺乳动物雷帕霉素靶点(mTOR)通路的抑制,雷帕霉素是自噬的主要负调控因子。 有趣的是,在ADPKD患者的囊性上皮细胞和几种疾病动物模型中,mTOR通路似乎异常激活(由 Walz,2006年 ). 因此,我们假设TRPP2可能通过增加钙离子浓度来促进mTOR通路的下调 2+ ER泄漏。
最近有人认为TRPP2可能作为钙 2+ ER中的释放通道,但本研究尚未解决生物后果( 库伦 等 , 2002 ). 作者报道,TRPP2的过度表达导致血管加压素诱导的钙增加 2+ 这与我们的发现形成了对比。 虽然我们最终无法解决这个差异,但我们试图证实我们的结果不仅仅取决于细胞类型或钙的模式 2+ 通过使用不同的细胞株和刺激,以及通过瞬时或稳定的方式表达TRPP2,从内质网释放。 重要的是,肾上皮细胞中TRPP2的敲低具有相反的效果。 最后,我们对胞浆钙的研究结果 2+ 信号由[Ca的直接测量支持 2+ ]在内质网和线粒体中,使用细胞器靶向的基因编码钙 2+ 传感器。
据报道,破坏细胞增殖率和凋亡率之间微妙平衡的过程会导致囊肿的形成( 博莱塔 等 , 2000 )并且最有可能在其他疾病表现中发挥重要作用,如血管瘤。 细胞凋亡是PKD的病理特征,有充分证据表明细胞凋亡在囊肿形成中具有中心作用。 PKD动物模型和ADKPD患者肾脏中早期肾小管上皮细胞凋亡增加( 吴,1995 ; 基普 等 , 2005 ; 道 等 , 2005 ; 布卡诺夫 等 , 2006 ; Starremans公司 等 , 2008 ). 据报道,细胞凋亡率增加 第1页 -和 第二页 -缺陷小鼠( 基普 等 , 2005 ; 斯塔雷曼斯 等 , 2008 ). 成熟的野生型肾脏几乎不存在凋亡 第1页 -缺陷动物包括少量细胞凋亡( 皮翁特克 等 , 2007 )囊肿和小管中的许多凋亡细胞( 斯塔雷曼斯 等 , 2008 ),取决于研究。 在三维胶原培养中,凋亡诱导导致肾小管上皮细胞中形成囊肿,而Bcl-2的过度表达抑制了该系统中的囊肿生成( 林 等 , 1999 ). 此外,最近的一项研究表明,在PKD动物模型中,抑制或消融caspase 3可减少肾上皮细胞的凋亡,并减轻囊肿的形成和肾衰竭( 道 等 , 2005 , 2008 ).
虽然细胞凋亡与PKD之间的联系已经建立,但PKD蛋白在细胞凋亡调控中的作用尚不清楚。 我们的结果表明,TRPP2是ER中的一个抗凋亡阳离子通道,并为其功能提供了分子机制。 这些数据也支持这样一个概念,即通道定位对其细胞功能至关重要,如钙 2+ 通过质膜上的阳离子通道内流可以促进细胞死亡。 因此,适配器蛋白如PACS-1/2和PIGEA-14对TRPP2 ER定位的严格调控( Hidaka公司 等 2004年 ; 科特根 等 , 2005 ; Köttgen和Walz,2005年 )可能决定肾小管上皮细胞对凋亡刺激的敏感性,并调节细胞死亡与增殖之间的平衡。 这一过程可能在发育和成熟肾单位的动态平衡中起重要作用。 多囊藻毒素-1是ADPKD中突变的另一种蛋白,与TRPP2形成异聚物复合物,也被证明可以保护细胞免受凋亡( 博莱塔 等 , 2000 ; 博卡 等 , 2006 ). 多囊蛋白-1配体的鉴定对于研究多囊蛋白1和TRPP2在内质网钙稳态和抗凋亡信号通路中的生理调节和功能相互作用至关重要。
材料和方法 材料 TRPP公司 前面描述了2个结构( 科特根 等 , 2005 ). 质粒pLXSN由D Miller(华盛顿州西雅图弗雷德·哈钦森癌症研究中心)善意提供。 质粒pMD-G和pMD-gp是R Mulligan的恩赐。 使用标准克隆技术生成用于cRNA合成的逆转录病毒转移载体pLXSN-TRPP2和psGEM-TRPP2。 用于电生理和钙 2+ 成像实验,无标签 TRPP2型 使用了构造。 黄色骆驼由宫崎骏(YC4)提供 急诊室 )和N Demaurex(YC4.1 米托 ) ( 宫崎骏 等 , 1997 ; 阿尔诺多 等 , 2001 ). 对于击倒实验,犬只 TRPP2型 -靶向和对照shRNAs(序列可根据要求提供)被克隆到pLVTH载体(Addgene质粒12262)中。 化学品来自Fluka、Sigma或Alexis生化公司。
细胞培养、转染、病毒生产和转导 HeLa、HEK-293和MDCK细胞在37°C下在补充有10%热灭活胎牛血清的DMEM中生长。 用Fugene 6或磷酸钙转染细胞,转染后2-5天进行实验。 用三种质粒(pMD-G、pMD-gp和逆转录病毒转移载体)共同转染HEK-293细胞,产生逆转录病毒。 细胞在8μg/ml聚合物存在下被感染,并用500μg/ml基因素进行筛选。 如前所述,通过慢病毒基因转移产生表达四环素阻遏物tTR-KRAB和shRNA盒的MDCK细胞( Wiznerowicz和Trono,2003年 ).
钙 2+ 成像 HeLa和HEK 293细胞被镀在30 mm玻璃盖玻片上,并安装在倒置显微镜(蔡司,Axiover 200 M,Fluar×40/1.3油浸物镜)台上的灌注室中。 在室温下用Fura-2 AM(分子探针;2μM)培养细胞30分钟,然后用改良的林格溶液(mM:145 NaCl,0.4 KH 2 人事军官 4 ,1.6 K 2 高性能操作 4 ,1氯化镁 2 ,1.3钙 2+ -葡萄糖酸盐,5葡萄糖; pH 7.4),持续10-20分钟。在标称钙缺乏的情况下使用药物和激动剂 2+ .钙 2+ -游离溶液(Ca 2+ -葡萄糖酸盐被5 mM EGTA替代)在触发钙离子前30 s灌流 2+ 从细胞内储存释放。 Fura-2在340 nm和380 nm处交替激发,并使用基于CCD的成像系统(Cool-SNAP fx,Roper Scientific Inc.)收集并记录在510 nm处过滤的荧光,该成像系统运行Metafluor软件(分子器件)。 对于每个实验,记录5-10个细胞的信号,这些信号的平均值被称为一个独立的实验。 Fura-2比率(340/380 nm)的校准按照以下所述进行 格林基维茨 等 (1985 ). 用条件表达shRNA和GFP的MDCK细胞进行Fura-2成像的方法基本相同。 然而,在这种情况下,分析中只包括具有预先确定的GFP信号中等和可比较强度的细胞(每次测量5-19个细胞)。
细胞内钙储备的再填充 2+ 并对其在渗透性MDCK细胞中的泄漏进行了分析。 将10μM Mag-Fur-2 AM(Biotium)在37°C的改良林格溶液中加载细胞1小时。 用细胞内缓冲液(ICB;125 mM KCl,19 mM NaCl,10 mM HEPES,1 mM EGTA,pH 7.3)短时间灌注负载细胞,并用15μg/ml洋地黄素在ICB中渗透2–3分钟。该程序去除了Mag-Fura-2的胞质部分和大部分GFP荧光。 随后用ICB清洗细胞13分钟,并用含有200 nM游离Ca的ICB清洗 2+ 在含有200 nM游离钙的ICB中加入1.5 mM ATP(钠盐)或30μM CPA,持续2分钟 2+ 和1.4 mM MgSO 4 在每个实验结束时,用2μM离子霉素在ICB中灌注细胞,以计算最小340/380比率( R(右) 0 ). ER Ca的最大速率 2+ 载荷和泄漏由 R(右) / R(右) 0 分别在6或10 s的时间跨度内计算。
[Ca的双发射比成像方法 2+ ]骆驼的使用来源于 宫崎骏 等 (1997 ). 使用激发过滤器和455DRLP二色镜(Chroma)在440±10 nm处激发细胞。 使用滤轮(Ludl Electronic Products)交替更换两个发射滤光片(Chroma,480DF15和535DF25),在两个发射波长下对骆驼的荧光发射进行成像。 荧光比率的变化 R(右) =(535 nm处的荧光强度−535 nm处的背景强度)/(475 nm处的荧光强度−475 nm处的背景强度)如前所述进行校准( 阿尔诺多 等 , 2001 ),使用公式
哪里 R(右) 最小值 和 R(右) 最大值 是在没有钙的情况下获得的比率 2+ 和饱和时[Ca 2+ ]分别是。 K(K) d日 是表观离解常数 n个 是Ca的希尔系数 2+ 已获得的校准曲线 就地 ( 阿尔诺多 等 , 2001 ).
细胞凋亡分析 C诱导血清饥饿MDCK细胞凋亡 2 -神经酰胺或放线菌素D。药物溶剂DMSO或乙醇(EtOH)用于对照治疗。 在60μM荧光底物Ac-DEVD-AMC存在下测量细胞裂解液中的caspase 3样活性。 在GeminiXS微孔板阅读器(分子器件)中,在380/460 nm的激发/发射波长下监测荧光增强45分钟。 请注意,使用任一凋亡诱导剂处理的细胞中的活性不应相互比较,因为它们是在GeminiXS阅读器的不同单位上测量的。 根据制造商的说明,使用Cell Death Detection ELISA Plus试剂盒(Roche)测量凋亡细胞胞质部分中的核小体数量,但不含BSA的裂解缓冲液用于测量裂解液中的总蛋白水平。
统计分析 数据以原始记录或平均值±标准误差表示( n个 =实验次数,除非另有说明)。 未配对学生 t吨 -使用适用的测试进行统计分析。 一个 P(P) -值<0.05表示具有统计学意义(用星号标记)。
致谢 我们感谢N Demaurex、A Miyawaki、R Sandford和D Gill提供的材料。 我们感谢B Wehrle和B Muller的技术援助,感谢A Köttgen、K Venkatachalam和C Borner的有益评论。 这项工作得到了德意志联邦基金会(DFG)(GW)和PKD基金会奖学金(MK)的支持。
工具书类
Arnaudeau S,Frieden M,Nakamura K,Castelbou C,Michalak M,Demaurex N(2002)钙网蛋白对内质网和线粒体中钙的摄取和释放进行差异调节。生物化学杂志277:46696–46705 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Arnaudeau S、Kelley WL、Walsh JV Jr、Demaurex N(2001)《线粒体循环钙》 2+ 并防止相邻内质网区域的耗竭。 生物化学杂志276:29430–29439 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Berridge MJ、Lipp P、Bootman MD(2000)钙信号的多功能性和普遍性。 Nat Rev Mol细胞生物学1:11–21 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Boca M、Distefano G、Qian F、Bhunia AK、Germino GG、Boletta A(2006)多囊藻毒素-1通过磷脂酰肌醇3-激酶/Akt信号通路诱导细胞凋亡抵抗。 美国社会学杂志肾病17:637–647 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Boletta A,Germino GG(2003)多囊蛋白在肾小管形成中的作用。 趋势细胞生物学13:484–492 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Boletta A、Qian F、Onuchic LF、Bhunia AK、Phakdeekitcharoen B、Hanaoka K、Guggino W、Monaco L、Germino GG(2000)PKD1基因产物多囊藻毒素-1诱导MDCK细胞对凋亡的抵抗和自发小管生成。 分子细胞6:1267–1273 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Bukanov NO、Smith LA、Klinger KW、Ledbetter SR、Ibraghimov-Beskrovnaya O(2006)用CDK抑制剂罗斯科汀长期阻断小鼠多囊肾病。 自然444:949–952 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Cai Y、Maeda Y、Cedzich A、Torres VE、Wu G、Hayashi T、Mochizuki T、Park JH、Witzgall R、Somlo S(1999),PKD2基因产物多囊蛋白-2的鉴定和表征。 生物化学杂志274:28557–28565 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Chen XZ,Segal Y,Basora N,Guo L,Peng JB,Babakhanlou H,Vassilev PM,Brown EM,Hediger MA,Zhou J(2001)天然致病性多囊蛋白-2突变体的转运功能,R742X。 生物化学与生物物理研究通讯282:1251–1256 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Demaurex N,Distelhorst C(2003)《细胞凋亡与钙的关系》。 科学300:65–67 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Ecder T、Melnikov VY、Stanley M、Korular D、Lucia MS、Schrier RW、Edelstein CL(2002)常染色体显性多囊肾病中的半胱氨酸天冬氨酸蛋白酶、Bcl-2蛋白和凋亡。 肾脏Int 61:1220–1230 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Foyouzi-Youssefi R、Arnaudeau S、Borner C、Kelley WL、Tschopp J、Lew DP、Demaurex N、Krause KH(2000)Bcl-2降低游离钙 2+ 内质网内的浓度。 美国国家科学院院刊97:5723-5728 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Grynkiewicz G,Poenie M,Tsien RY(1985)新一代Ca 2+ 荧光性能大大提高的指示剂。 生物化学杂志260:3440–3450 [ 公共医学 ] [ 谷歌学者 ]
Hidaka S,Konecke V,Osten L,Witzgall R(2004)PIGEA-14,一种影响多囊蛋白-2细胞内分布的新型卷曲蛋白。 生物化学杂志279:35009–35016 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Hofer AM、Fasolato C、Pozzan T(1998)《电容式电容器》 2+ 进入与内部钙的充盈状态密切相关 2+ 商店:一项同时测量I值的研究 中俄国际商用飞机有限责任公司 和腔内[Ca 2+ ]. 细胞生物学杂志140:325–334 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Hoyer-Hansen M、Bastholm L、Szyniarowski P、Campanella M、Szabadkai G、Farkas T、Bianchi K、Fehrenbacher N、Elling F、Rizzuto R、Mathiasen IS、Jaattela M(2007)《通过钙、钙调素依赖性激酶激酶-beta和Bcl-2控制大细胞自噬》。 分子细胞25:193–205 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Jentsch TJ、Hubner CA、Fuhrmann JC(2004)《离子通道:功能因功能障碍而解体》。 自然细胞生物学6:1039–1047 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Kip SN、Hunter LW、Ren Q、Harris PC、Somlo S、Torres VE、Sieck GC、Qian Q(2005)[加利福尼亚州] 2+ ] 我 减少可增加血管平滑肌细胞的细胞增殖和凋亡:与ADPKD表型相关。 Circ Res 96:873–880号 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Köttgen M(2007)TRPP2与常染色体显性多囊肾病。 Biochim生物物理学报1772:836–850 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Köttgen M、Benzing T、Simmen T、Tauber R、Buchholz B、Feliciangeli S、Huber TB、Schermer B、Kramer-Zucker A、Hopker K、Simmen-KC、Tschucke CC、Sandford R、Kim E、Thomas G、Walz G(2005)PACS蛋白质贩运TRPP2代表了一种新的离子通道调节机制。 浮雕J 24:705–716 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Köttgen M,Loffler T,Jacobi C,Nitschke R,Pavenstadt H,Schreiber R,Frische S,Nielsen S,Leipziger J(2003)P2Y6受体通过cAMP介导的转运的差异激活介导结肠NaCl分泌。 临床投资杂志111:371–379 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Köttgen M,Walz G(2005)多囊蛋白的亚细胞定位和贩运。 Pflugers Arch 451:286–293(普弗鲁格斯拱门451) [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Koulen P,Cai Y,Geng L,Maeda Y,Nishimura S,Witzgall R,Ehrlich BE,Somlo S(2002),多囊藻毒素-2是一种细胞内钙释放通道。 自然细胞生物学4:191-197 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Li Y,Wright JM,Qian F,Germino GG,Guggino WB(2005)多囊藻毒素2与I型肌醇1,4,5-三磷酸受体相互作用以调节细胞内钙 2+ 发出信号。 生物化学杂志280:41298–41306 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Lin HH,Yang TP,Jiang ST,Yang HY,Tang MJ(1999)Bcl-2过度表达可防止凋亡诱导的Madin–Darby犬肾脏单纯上皮囊肿的形成。 肾脏Int 55:168–178 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Miller BA(2006)TRP通道在氧化应激诱导的细胞死亡中的作用。 《成员生物学杂志》209:31–41 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Miyawaki A、Llopis J、Heim R、McCaffery JM、Adams JA、Ikura M、Tsien RY(1997)《钙的荧光指示剂》 2+ 基于绿色荧光蛋白和钙调蛋白。 自然388:882-887 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Mochizuki T,Wu G,Hayashi T,Sexonontos SL,Veldhuisen B,Saris JJ,Reynolds DM,Cai Y,Gabow PA,Pierides A,Kimberling WJ,Breuning MH,Deltas CC,Peters DJ,Somlo S(1996)PKD2,一种编码完整膜蛋白的多囊肾病基因。 科学272:1339-1342 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Montell C(2005)TRP阳离子通道超家族。 科学STKE 272:re3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Moser M、Pscherer A、Roth C、Becker J、Mucher G、Zerres K、Dixkens C、Weis J、Guay-Woodford L、Buettner R、Fassler R(1997)缺乏转录因子AP-2beta的小鼠肾上皮细胞凋亡增加。 基因开发11:1938–1948 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Nakamura K、Bossy-Wetzel E、Burns K、Fadel MP、Lozyk M、Goping IS、Opas M、Bleackley RC、Green DR、Michalak M(2000)内质网腔环境的变化影响细胞对凋亡的敏感性。 细胞生物学杂志150:731–740 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Nilius B、Owsianik G、Voets T、Peters JA(2007)疾病中的瞬时受体电位阳离子通道。 生理学修订版87:165–217 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Orrenius S,Zhivotovsky B,Nicotera P(2003)《细胞死亡的调节:钙-凋亡联系》。 Nat Rev Mol细胞生物学4:552–565 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Pinton P、Ferrari D、Magalhaes P、Schulze-Othoff K、Di Virgilio F、Pozzan T、Rizzuto R(2000)《细胞内钙负荷减少》 2+ 电容性钙的储存和下调 2+ Bcl-2过度表达细胞的内流。 细胞生物学杂志148:857–862 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Pinton P、Ferrari D、Rapizzi E、Di Virgilio F、Pozzan T、Rizzuto R(2001)The Ca 2+ 内质网的浓度是神经酰胺诱导细胞凋亡的关键决定因素:对Bcl-2作用的分子机制具有重要意义。 EMBO期刊20:2690–2701 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Pinton P、Rizzuto R(2006)Bcl-2和Ca 2+ 内质网内稳态。 细胞死亡差异13:1409–1418 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Piotek K,Menezes LF,Garcia Gonzalez MA,Huso DL,Germino GG(2007)一种关键的发育转换定义了Pkd1缺失后肾囊肿形成的动力学。 《国家医学》13:1490–1495 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Rizzuto R、Pinton P、Carrington W、Fay FS、Fogarty KE、Lifshitz LM、Tuft RA、Pozzan T(1998)与内质网的密切接触是线粒体钙的决定因素 2+ 回应。 科学280:1763-1766 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Rizzuto R、Pinton P、Ferrari D、Chami M、Szabadkai G、Magalhaes PJ、Di Virgilio F、Pozzan T(2003)《钙与细胞凋亡:事实与假设》。 癌基因22:8619–8627 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Scorrano L、Oakes SA、Opferman JT、Cheng EH、Sorcinelli MD、Pozzan T、Korsmeyer SJ(2003)BAX和BAK对内质网Ca的调节 2+ :凋亡的控制点。 科学300:135–139 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Starremans PG,Li X,Finnerty PE,Guo L,Takakura A,Neilson EG,Zhou J(2008)多囊肾病小鼠模型 第1页 .肾脏Int 73:1394–1405 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Szalai G,Krishnamurthy R,Hajnoczky G(1999)IP(3)连锁线粒体钙信号驱动的细胞凋亡。 EMBO期刊18:6349–6361 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Tao Y,Kim J,Faubel S,Wu JC,Falk SA,Schrier RW,Edelstein CL(2005)半胱氨酸蛋白酶抑制可减少多囊肾病患者肾小管的凋亡和增殖,减缓疾病进展。 美国国家科学院院刊102:6954–6959 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Tao Y,Zafar I,Kim J,Schrier RW,Edelstein CL(2008)Caspase-3基因缺失延长了多囊肾病患者的生存期。 《美国社会杂志》肾病19:749–755 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Trudel M、Lanoix J、Barisoni L、Blouin MJ、Desforges M、L’Italien C、D’Agati V(1997)C-myc诱导的多囊肾病细胞凋亡与Bcl-2和p53无关。 《实验医学杂志》186:1873–1884 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Veis DJ、Sorenson CM、Shutter JR、Korsmeyer SJ(1993)Bcl-2缺乏小鼠出现暴发性淋巴细胞凋亡、多囊肾和毛发色素减退。 手机75:229–240 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Walz G(2006)常染色体显性多囊肾病(ADPKD)的治疗方法:隧道尽头有曙光吗? 肾拨号移植21:1752-1757 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Wiznerowicz M,Trono D(2003),细胞基因的条件抑制:慢病毒载体介导的药物诱导RNA干扰。 《病毒杂志》77:8957–8961 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Woo D(1995)多囊肾病中肾组织的凋亡和丢失。 《新英格兰医学杂志》333:18–25 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。