简介 真核生物的高效转录需要RNA聚合酶II(pol II)转录机制和调节染色质修饰的因子之间的相互作用(综述见: 1 ). 组蛋白H3(H3K4)上赖氨酸4的三甲基化发生在共转录( 2 )与转录活性密切相关( 三 ). 酵母中的Set1p组蛋白甲基转移酶(HMT)复合物介导H3K4甲基化( 4–7 ). 近年来,已确定了进行此修改所需的几个因素。 现在很明显,组蛋白H2B的泛素化是Set1p使H3K4甲基化所必需的( 8 , 9 )和H3K79的Dot1p( 10 ). Bre1p-Rad6p E3-E2对介导H2B泛素化( 11 , 12 ).
Bur1/2激酶复合物参与转录延伸。 这个CDK–cyclin对可以磷酸化pol II最大亚单位的C末端结构域(CTD) 在体外 ( 13 ),但它似乎没有促进CTD磷酸化 体内 ( 14 ). 这种激酶复合物是H2B泛素化和H3K4三甲基化所必需的( 15 )可能涉及Rad6p的直接磷酸化( 16 ). 有趣的是,H3K4的单甲基化和双甲基化不受 BUR1/2(燃烧室1/2) 突变( 15 ). 与Bur1/2复合物一样,PAF复合物与转录延伸有关,对有效的H2B泛素化和H3K4甲基化至关重要,但对Rad6p的补充不重要( 17 , 18 ). PAF复合物由五个亚基(Paf1p、Rtf1p、Ctr9p、Leo1p和Cdc73p)组成,并与pol II相互作用( 19 , 20 ). 打嗝2 是PAF复合物有效补充染色质所必需的,但其发生机制尚不清楚( 15 , 16 ).
进化上保守的Ccr4-Not复合物由九个核心亚单位组成,与mRNA生产和加工的各个步骤有关(综述见: 21 , 22 ). 编码非蛋白的基因( 编号1-5 )最初被鉴定为转录起始的负调控因子。 观察到 不是 基因抑制对温度敏感的等位基因 SRB4级 ( 23 ),编码介体辅激活物复合体的一个基本亚单位( 24 ). 然而,各种报告也表明了Ccr4的积极作用——不复杂( 25–27 ). 例如,这种复合物是转录 注册护士 DNA损伤或复制应激后的基因( 27 ). 已经描述了Ccr4-非复杂组分与转录起始和延伸因子的遗传和物理相互作用(综述见: 21 , 22 ). 除此之外,Ccr4p和Caf1p代表酵母中主要的mRNA死亡酶( 28 ).
为了进一步研究Ccr4-Not复合物的作用,我们进行了全基因组筛查,以发现非必需基因缺失突变体,该突变体显示与缺失 编号4 在这里,我们描述了Ccr4不复杂的成分与 打嗝2 和 BUR1(燃烧室1) 。我们发现 不是 基因需要特别促进H3K4的三甲基化,而不是单甲基化或双甲基化。 删除 编号4 降低组蛋白H2B泛素化和PAF复合物募集,但不影响Bur1/2的激活或募集。 综上所述,我们的结果显示了Ccr4-Not复合物在染色质修饰中的新作用,并提出了其促进转录正调控的机制。
材料和方法 酵母遗传学、培养基和质粒 本研究中使用的酵母菌株及其相关基因型如 表1 通过PCR产物的同源重组构建敲除、TAP-和mycAVI标记菌株,并通过PCR、表型和/或western blot分析进行验证。 细胞常规培养在缺乏适当氨基酸的YPD或SC培养基中。 这个 镀锌1 -之前已经描述过LacZ融合和pGR422质粒( 29 , 30 ). 基于pRS306的 编号4 整合向量之前已出版( 27 ).
表1。
应变 基因型 来源
BY4741公司 MATa公司 his3Δ1 leu2Δ0 met15Δ0 ura3Δ0 欧洲SCARF
57公里 与BY4741同基因,但 not3:KanMX 欧洲SCARF
58公里 与BY4741同基因,但 not4:KanMX 欧洲SCARF
59公里 与BY4741同基因,但 不是5:KanMX 欧洲SCARF
60公里 与BY4741同基因,但 咖啡馆1:KanMX 欧洲SCARF
KMY61型 与BY4741同基因,但 caf40:KanMX 欧洲SCARF
KMY62型 与BY4741同基因,但 caf130:KanMX公司 欧洲SCARF
107公里 与BY4741同源,但 ccr4:KanMX 欧洲围巾
108公里 与BY4741同基因,但 咖啡馆4:KanMX 欧洲SCARF
109公里 与BY4741同基因,但 caf16:KanMX 欧洲SCARF
110公里 与BY4741同基因,但 caf120:KanMX 欧洲SCARF
MY1年 MATa公司 ura3-52,trp1-Δ1,leu2::PET56 gal2 gcn4-Δ1 ( 48 )
102公里 与MY1同源,但 不是1-1 M.Collart的礼物
114公里 与MY1同源,但 不是1-2 M.Collart的礼物
103公里 与MY1同源,但 not2:KanMX M.Collart的礼物
104公里 与MY1同源,但 not3:KanMX M.Collart的礼物
KMY97型 与MY1同源,但 注4:KanMX M.Collart的礼物
105公里 与MY1同源,但 不是5:KanMX M.Collart的礼物
W303-1B型 材料α leu2-3112他的3-11 trp1-1可以1-100 ade2-1 ura3-1 ( 52 )
KMY2(公里2) 与W303-1B同源,但 not4:KanMX ( 53 )
UCC7164型 MATa公司 ade2Δ::hisG his3Δ200 leu2Δ0 lys2Δ0 met15Δ0 trp1Δ63 ura3Δ0 ade2-TEL-VR adh4::ura3-TEL-VIIL F.van Leeuwen的礼物
UCC7183号 与UCC7164同基因,但 dot1:KanMX F.van Leeuwen的礼物
KMY81型 与UCC7164同基因,但 not4:KanMX 这项工作
161公里 与BY4741同基因,但 bur2:KanMX 欧洲SCARF
162公里 与BY4741同基因,但 spp1:KanMX 欧洲SCARF
YSB787型 MATa公司 bur1:HIS3 ura3-52 leu2Δ1 trp1Δ63 HIS3Δ200 lys2Δ202(pRS316-bur1) ( 14 )
140公里 与YSB787同源,但 not4:KanMX 这项工作
40公里 MATα mfa1Δ::MFA1pr-HIS3 HIS3Δ1 ura3Δ0 lys2Δ0 can1Δnot4:ura3 这项工作
133公里
非4:LEU2 CTR9-HA6:TRP1 ,YJJ1753 X的分离物 非4:LEU2 (KMY73)
这项工作
136公里 与KMY133同基因,但 not4:LEU2::not4:URA3 这项工作
YZS276型 hta1-htb1Δ::LEU2 hta2-htb2ΔHTA-Flag-htb1:HIS3 ( 9 )
YZS277型 与YZS276同基因,但 HTA标志-htb1-K123R ( 9 )
YNL019号 与YZS276同基因,但 not4Δ:KanMX B.Strahl的礼物
YSB770型 MATa公司 BUR1-HA3:TRP1 ura3-52 leu2Δ1 TRP1Δ63 his3Δ200 lys2Δ202 ( 14 )
YSB813型 MATa公司 BUR2-HA3:TRP1 ura3-52 leu2Δ1 TRP1Δ63 his3Δ200 lys2Δ202 ( 14 )
1999公里 与YSB770同基因,但 not4Δ:KanMX 这项工作
KMY41型 与KMY2同基因,但 非4L35A:URA3 ( 29 )
200公里 与YSB813同源,但 not4Δ:KanMX 这项工作
KMY201型 MATα mfa1Δ::MFA1pr-HIS3 bur2Δ:URA3 HIS3Δ1 URA3Δ0 lys2Δ0 can1Δ 这项工作
表型分析 这里,在SC-U−/+6-氮杂嘧啶(6-AU)(100 μg/ml)或SC−/+5FOA(0.1%)。 对于6-AU敏感性分析,用pRS316转化细胞。 3-4天后评估30°C下的生长情况。
体内 伸长率测定
用 镀锌1 -LacZ质粒在含有2%棉子糖的SC-U培养基中培养过夜,收集后转移到含有2%半乳糖的培养基中。 在指定的时间点采集样本。 如前所述进行RNA提取和northern blot分析( 27 ). 使用Redi-prime II试剂盒(Invitrogen)对跨越ORF的PCR产物探针进行放射性标记。
蛋白质印迹和抗体 从YPD中生长的细胞中提取样品,并按照前面所述制备提取物( 31 ). 蛋白质用SDS-PAGE分离,western blot分析。 从Abcam中获得了抗H3K4me1(Ab8895)、H3K4me2(Ab7766)、H3 K4me3(Ab8580)、H3C79me3(Ab2621)和H3的C末端(Ab1791)的抗体。 H3K36me2(#07–369)和H3K79me2(#107–366)抗体来自Upstate Biotechnology。 TBP抗血清是P.a.Weil赠送的一份礼物。 使用H5和H14抗体检测RNA pol II CTD的丝氨酸2、丝氨酸5磷酸化形式。 使用CTD特异性抗体8WG16检测RNA pol II。 用IgG-过氧化物酶结合物检测TAP标记蛋白。 分别用抗HA-tag(12CA5和3F10)或FLAG-tag(M2,sigma)的抗体检测Ctr9-HA、Bur1-HA、Bur-HA和FLAG-H2B。 免疫印迹 图2 使用ImageQuant软件对B进行量化,并用归一化后总H3水平的WT分数表示。
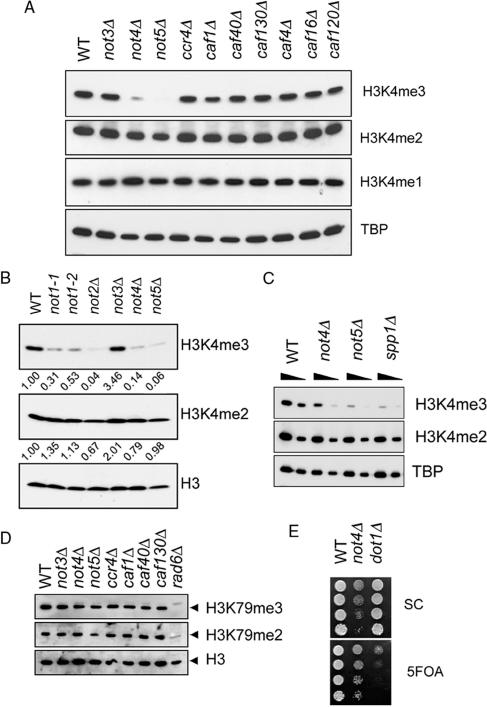
图2。
具体要求 不是 全球H3K4三甲基化的基因。 ( 一个 )组蛋白H3K4的单、二和三甲基化水平在基于对数增长的BY4741的裂解液中测定 CCR4-非 基因缺失菌株。 通过SDS-PAGE(15%)分离所示菌株的蛋白质提取物,并使用H3K4me1-、H3K4me2-和H3K4me3-特异性抗体进行蛋白质印迹。 TBP水平被确定为负荷控制。 ( B类 )基于MY1 不是 使用突变菌株测定H3K4me2、H3K4me3和总H3水平,如(A)所示。 使用ImageQuant软件量化H3K4me3和H3K4me2水平,并在归一化到总H3水平后表示为相对于WT。 ( C类 )BY4741中H3K4me2和H3K4me3水平的直接比较, 不是4 Δ, 不是5 Δ和 spp1型 Δ应变。 按照(A)进行分析。 ( D类 )所示BY4741缺失菌株中的H3K79me2和H3K79 me3水平。 按照(A)进行分析。 ( E类 )使用菌株进行沉默分析,包含 URA3公司 在7号染色体左臂的端粒区域,缺乏 编号4 或 DOT1公司 。在SC板或含有5FOA的SC板上以5倍连续稀释液发现细胞。
染色质免疫沉淀(ChIP) 细胞培养和提取物制备基本上按照前面所述进行,只需稍作修改( 27 ). 简言之,蛋白A偶联琼脂糖珠与上述抗体孵育30 在4°C下至少培养2分钟,清洗,然后用交联细胞提取物培养2–3分钟 4°C时为h。 清洗珠子,洗脱DNA,并在65°C下翻转交联剂过夜。 使用PCR纯化试剂盒(Qiagen)分离DNA,并通过SYBR-绿色定量PCR分析。 使用涂有链霉亲和素的Dyna-bads(Dynal)纯化Not4-mycAVI,并在反向交联之前经受严格的洗涤条件(TE中的3%十二烷基硫酸钠)。 如上所述进行了进一步分析。 数据表示为输入的百分比,HMR位点的一个区域作为控制。
Northern印迹分析和逆转录酶qPCR 如前所述进行RNA提取和Northern印迹( 27 ). 根据制造商的方案,使用等量的总RNA,使用随机六聚体和SuperScript II试剂盒(InVitrogen)制备cDNA。 使用基因组DNA稀释序列通过SYBR-绿色定量PCR分析确定cDNA水平。
串联亲和纯化 TAP-抗原介导的蛋白质纯化基本上如所述进行( 32 ). 简而言之,20 1个YPD培养物生长到OD600~2–3,在E缓冲液(20 mM HEPES-KOH pH值8350 mM氯化钠、10%甘油、0.1%吐温-20)。 在Beckman 50.2Ti转子(45 000 下午,45 最小值,4°C)。 一等分的裂解液被用于200多个样品的纯化 μl IgG琼脂糖柱(IgG-sepharose快速流动,Pharmacia)。 蛋白质通过在4°C下旋转2次而结合 h,然后用35清洗 ml E缓冲液和10 ml TEV蛋白酶裂解缓冲液(10 mM Tris-HCl pH值8150 mM氯化钠,0.1%吐温-20,0.5 mM EDTA和1 mM DTT)。 TEV蛋白酶(100 U) 卵裂在1 18°C下2 ml h.TEV洗脱液结合到100 结合缓冲液(10)中的μl钙调蛋白亲和树脂(Stratagene) mM Tris pH值8150 mM氯化钠,1 mM氧化镁,1 mM咪唑,2 mM氯化钙 2 ,0.1%吐温-20,10%甘油和10 mMβ-巯基乙醇)在4°C下旋转1次 h.用25-ml结合缓冲液清洗柱,并在洗脱缓冲液(10)中回收结合蛋白 mM Tris-HCl pH值8150 mM氯化钠,1 mM氧化镁,1 mM咪唑,2 mM EGTA、0.1%吐温-20、10%甘油和10 mMβ-巯基乙醇)。 如前所述,沉淀一部分纯化蛋白( 33 )在4–12%SDS-PAGE梯度凝胶(NuPage,Invitrogen)上分离,用Biosafe(BioRad)染色,并进行质谱分析。
串联质谱法 考马斯染色条带的凝胶内蛋白水解消化基本上如所述进行( 34 ),使用胰蛋白酶(罗氏)。 样品经过纳米流体(LC)色谱(安捷伦1100系列)并浓缩在C18预柱(100 μm内径,2 厘米)。 肽在分析柱上分离(75 μM内径,20 cm),流速为200 nl/min,60 最小线性乙腈梯度为0至80%。 LC系统直接连接到QTOF微型串联质谱仪(英国Micromass Waters)。 从400到1200进行了调查扫描 a.m.u./s和前体离子在MS/MS模式下以150计数的阈值进行测序。 使用Proteinx Global Server 2.1版(英国Micromass)或MASCOT软件(Matrixscience)针对SWISPROT和NCBI非冗余数据库处理数据并进行数据库搜索,前体离子和碎片离子的质量容限均为0.25-Da。 通过手动解释光谱,确认了识别的肽。
体外 甲基化测定
Set1p复合物(10-20 μl TEV洗脱液)来自WT或 不是4 Δ细胞与10 μg纯化组蛋白(Sigma)或2.5 μg H3K4(甲基化)尾肽(分别为Abcam、Ab7228、Ab1340、Ab7768和Ab1342),1.5 微居 三 缓冲液中的H-S-腺苷蛋氨酸(50 mM Tris-HCl pH值8,10 mM氯化镁 2 和10 mMβ-巯基乙醇)在30°C下保持30 用SDS-PAGE分离后,将凝胶干燥并暴露在X射线胶片上。
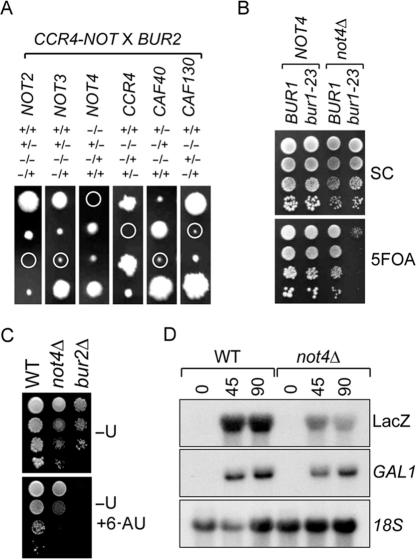
结果 Ccr4-Not和Bur1/2复合物在遗传上相互作用 为了更深入地了解Ccr4-Not复合物的功能,我们进行了一项全基因组调查,以发现与 编号4 我们通过RNA聚合酶II(K.W.M.、A.I.和H.T.M.T.,提交出版)鉴定了与转录延伸相关基因的几种相互作用。 最引人注目的是 编号4 和 打嗝2 .随后的四分体双缺失分析 打嗝2 和Ccr4-Not组分显示了与 编号2 和 CCR4号机组 ,但不包括 编号3,CAF40 和 130加元 ( 图1 A) ●●●●。 值得注意的是,Bur2p的细胞周期蛋白依赖性激酶伙伴Bur1p编码基因的缺失导致了强烈的生长缺陷,该菌株在用于基因筛查的文库中没有出现。 为了测试 编号4 和 BUR1(燃烧室1) 我们以一种直接的方式引入了一种基于质粒的WT或温度敏感突变体 BUR1(燃烧室1) ( 伯尔1-23 )进入任一 编号4 或 不是4 Δ应变,其中 BUR1(燃烧室1) 表示为 URA3型 质粒(pRS316)。 质粒混洗分析表明 编号4 和 伯尔1-23 ( 图1 B) ●●●●。
图1。
Ccr4-非复杂成分与 BUR1(燃烧室1) 和 打嗝2 并在转录延长中发挥作用。 ( 一个 )四分体分析 毛刺2 Δ(KMY201)和BY4741 Ccr4-未删除或 不是4 Δ(KMY40)乘以4741 毛刺2 Δ二倍体。 圆圈表示双敲除菌株。 指出了获得的单倍体菌株的相关基因型( B类 )质粒洗牌分析 伯尔1-23 和 不是4 Δ含有pRS316的双突变菌株- BUR1(燃烧室1) 这里,在含有0.1%5FOA的SC和SC上发现了指示菌株的10倍连续稀释液。 ( C类 )6-偶氮嘧啶敏感性试验。 这里,在含有6-AU(100)的SC-U和SC-U上发现了指示菌株的10倍连续稀释液 μg/ml)。 ( D类 ) 体内 一个富含GC的长报告子的转录延伸分析。 BY4741和 不是4 Δ(KMY58)菌株经 GAL1pr公司 -LacZ质粒(pGR422)在含有棉子糖的培养基中生长,并转移到含有半乳糖的培养液中培养0、45和90 LacZ和内源性的min.Northern blot分析 镀锌1 以18S rRNA为对照进行mRNA检测。
考虑到发现Bur1/2复合物在转录延长中起作用( 13 , 14 ), 不是4 Δ和 毛刺2 Δ菌株首先测试对6-AU的敏感性。与将Ccr4-Not complex与转录延伸联系起来的观察结果一致( 25 ),缺少单元格 编号4 或 打嗝2 对6-AU敏感( 图1 C) 。 令人惊讶的是,在Ccr4-Not基因缺失的6-AU敏感性和与 打嗝2 ( 25 ). 这表明这种合成致命性可能是由于转录延伸缺陷造成的。 为了扩展这些观察结果,我们研究了 编号4 用于长且富含GC的报告基因的转录。 这个实验装置以前曾被用于研究转录延伸缺陷( 29 , 35 ). 图1 D显示缺乏细胞 编号4 ,的 镀锌1 -启动子驱动的LacZ报告基因转录效率低下,而内源性 镀锌1 该基因表达到WT水平。 综上所述,这些实验表明,Ccr4-非复杂成分在遗传上与两者相互作用 打嗝2 和 BUR1(燃烧室1) 并证实了这种复合物在转录延伸中的作用( 25 ).
高效的H3K4三甲基化依赖于Ccr4-不复杂 Bur1/2复合物与H3K4的三甲基化调控有关( 15 , 16 ). 之间的遗传相互作用 NOT4、BUR2 和 BUR1(燃烧室1) 促使我们通过使用特定抗体分析H3K4me1、H3K4me2和H3K4-me3的全球水平,来研究Ccr4-Not复合物在这一过程中的参与。 删除的菌株 编号4 或 编号5 H3K4三甲基化显著减少,但单甲基或双甲基化没有减少( 图2 A) ●●●●。 然而,删除 编号3,CCR4 或任何Ccr4相关因素( CAF公司 s) 没有产生这种效果( 图2 A) ●●●●。 值得注意的是 CCR4-非 基因缺失表型在 不是3 Δ电池( 26 , 27 ; 图1 A和数据未显示)。
为了扩展这些观察结果 编号1 另一个的基因和缺失 不是 分析了不同遗传背景下的基因。 在允许的条件下 不是1 等位基因显示H3K4me3总体水平明显下降(定量结果显示降低了50-70%),而这些细胞的生长没有受到影响。 此外,删除 编号2、编号4 或 编号5 H3K4me3水平降低(86-94%降低; 图2 B) ●●●●。 相反,在这些菌株中只观察到H3K4me2水平略有下降( 图2 B) ●●●●。 据报道,缺乏Spp1p的Set1p复合物不能三甲基化H3K4( 36 , 37 ). 我们发现删除了 编号4 或 编号5 导致H3K4me3水平相当于删除 SPP1系列 ( 图2 C) 。 此外,H3K79me2和H3K79 me3在 CCR4-非 缺失菌株基本上没有受到影响( 图2 D) 尽管缺乏H3K79me2的细胞中H3K79 me2略有下降 编号5 观察到。 如预期,删除 RAD6型 导致H3K79me2和H3K79 me3水平严重下降( 10 ).
这些结果表明 不是 高效H3K4三甲基化的基因。 同样, BUR1(燃烧室1) 和 打嗝2 三甲基化需要,但H3K4的单甲基化或双甲基化不需要( 15 ). H3K79甲基化特异性HMT Dot1p在端粒附近基因沉默中起重要作用( 38 ). 删除 设置1 导致此过程中出现类似的缺陷( 4 , 39 ). 值得注意的是,端粒沉默的完整性不受 编号4 ( 图2 E) 。 这与端粒沉默不需要H3K4me3的概念一致( 37 )以及我们的观察结果 编号4 H3K4的三甲基化特别需要。
综上所述,这些结果表明 不是 -Ccr4-Not复合物的模块对于有效的H3K4三甲基化至关重要,但对于H3K79甲基化或端粒沉默则不重要。
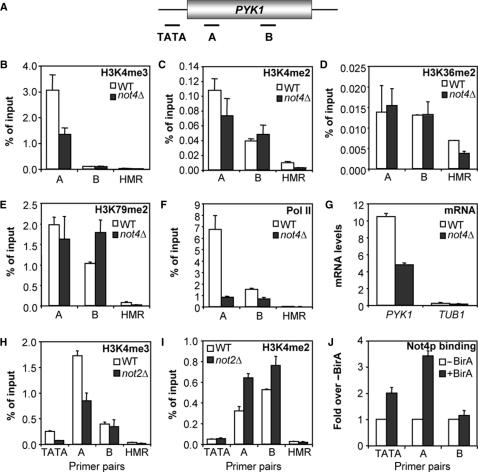
H3K4三甲基化 PYK1型 基因座受以下基因缺失的影响 编号4 调查 编号4 在组蛋白H3甲基化对活性基因的调控中,ChIP实验对组成活性和高表达的 PYK1型 使用WT和 不是4 Δ单元。 使用特异性抗体H3K4me3、H3K4me2、H3K36me2和H3K79me2在5′和中间区域的水平 PYK1型 检查ORF( 图3 A–E)。 否4 Δ细胞H3K4me3水平明显下降 位于 PYK1型 ORF与WT相比( 图3 B) ,而H3K4me2水平受缺失 编号4 ( 图3 C) 。 进一步的分析表明,H3K36me2和H3K79me2的水平在 不是4 Δ电池( 图3 D和E)。 此外,使用针对Rpb1p的CTD的抗体来测定pol II占用率,作为转录活性的测量。 同时, PYK1型 和 管1 通过定量RT-PCR测定WT和 不是4 Δ单元。 pol II协会与 PYK1型 ORF和 PYK1型 转录水平在缺乏 编号4 ( 图3 F和G)。 在这些结果的基础上,我们测定了因 编号2 的确,检查 不是2 Δ单元格确认了以下要求 编号2 特别是在H3K4me3的调节中( 图3 H和I)。 值得注意的是,在分析 PGK1系列 轨迹(未显示数据),符合更广泛的作用 编号4 调节H3K4me3水平。
图3。
编号4 是H3K4三甲基化所必需的,但不是 PYK1型 ORF公司。 ( 一个 )的示意图 PYK1型 (B–H)中使用的位点和扩增子。 ( B类 )ChIP分析 PYK1型 BY4741中的ORF和 不是4 Δ应变。 使用H3K4me3抗体对指数生长的细胞进行ChIP分析。 ( C类 )如(A)所示,使用H3K4me2抗体。 ( D类 )如(A)所示,使用H3K36me2抗体。 ( E类 )如(A)所示,使用H3K79me2抗体。 ( F类 )如(A)所示,使用CTD抗体(8WG16)。 ( G公司 )定量反转录酶PCR分析 PYK1型 和 管1 BY4741 WT和 不是4 Δ应变。 ( H(H) )MY1 WT中H3K4me3水平的ChIP分析 不是2 Δ单元。 ( 我 )MY1 WT中H3K4me2水平的ChIP分析 不是2 Δ单元。 ( J型 )Not4p被招募到 PYK1型 ORF。 用BirA表达质粒转化表达mycAVI-tagged Not4p的菌株,并进行ChIP分析。 将信号标准化为空质粒对照。
评估Not4p直接参与监管 PYK1型 表达,使用染色体表达的标记形式的ChIP分析 编号4 已执行。 编码蛋白(Not4p-mycAVI)被生物素化 体内 通过共同表达 大肠杆菌 -衍生BirA生物素连接酶( 40 ). 表型分析表明Not4p-mycAVI融合蛋白具有完全功能(数据未显示)。 用链亲和素包衣珠从含有表达BirA质粒或空载体的细胞染色质提取物中捕获生物素化Not4蛋白。 有趣的是,Not4p在 PYK1型 ORF和跨越TATA盒的区域( 图3 J) ,与Set1p复合物的三甲基化靶向区域一致(参见 图3 B和H)。 综上所述,这些ChIP实验证实了H3K4me3缺陷的特异性,并表明Not4p实际存在于 PYK1型 ORF公司。 此外,删除 编号4 导致pol II占用率和转录水平下降,表明对 PYK1型 通过H3K4的三甲基化通过Not4p表达。
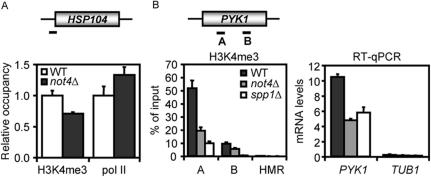
删除的细胞中H3K4me3水平降低 编号4 与RNA聚合酶II相关性的降低没有严格相关性 Set1复合物补充转录聚合酶的确切机制尚不完全清楚。 然而,有人认为,RNA pol II的CTD的七肽重复序列中丝氨酸2和5的磷酸化对这一点很重要( 2 , 7 ). 因此,H3K4me3在缺乏 编号4 可能是RNA pol II CTD磷酸化全局丢失的结果。 使用针对磷酸化丝氨酸2、丝氨酸5或总RNA pol II(分别为H5、H14和8WG16)的抗体进行的免疫印迹分析没有显示WT和 不是4 Δ单元格(数据未显示)。 这表明 编号4 调节H3K4me3水平独立于RNA pol II磷酸化。 可以说,H3K4三甲基化的缺失可能是RNA pol II募集减少的结果,而不是原因。 为了解决这个问题,我们调查了 热休克蛋白104 基因,该基因允许测定在转录中未降低的基因上的H3K4me3水平 不是4 Δ单元格(数据未显示)。 我们观察到 热休克蛋白104 尽管没有观察到的那么明显 PYK1型 ( 图4 A) ●●●●。 此外,我们发现RNA pol II占用率略有增加,这与转录率略有增加一致( 图4 A和未显示的数据)。 事实上,以前的观察表明H3K4甲基化不是 热休克蛋白 基因表达( 41 ). 总之,这一结果表明 不是4 Δ细胞不是RNA pol II结合减少的结果 就其本身而言 .
图4。
H3K4me3减少 不是4 Δ细胞不一定是由于RNA聚合酶II负载量减少( 一个 )H3K4me3和RNA pol II水平的ChIP分析 热休克蛋白104 轨迹。 数据表示为与WT相关。H3K4me3和8WG16抗体的ChIP效率分别为2–3%和0.15–0.2%。 ( B类 )删除 编号4 或 SPP1系列 导致H3K4me3和转录水平的类似下降 PYK1型 基因。 BY4741的染色质提取物, 不是4 Δ和 spp1型 使用H3K4me3特异性抗体对Δ菌株进行ChIP分析。 PYK1型 mRNA转录水平受缺失 编号4 或 SPP1.PYK1 BY4147总RNA中的mRNA, 不是4 Δ和 spp1型 采用定量反转录酶PCR对Δ菌株进行分析。
为了进一步研究H3K4me3在转录中的作用,我们比较了H3K4me3在 PYK1型 WT基因座, 不是4 Δ和 spp1型 Δ单元。 如所示 图4 B、 通过删除 编号4 或 SPP1系列 达到可比水平。 此外,删除 SPP1系列 导致mRNA水平下降,使人联想到 编号4 ( 图4 B) ●●●●。 mRNA水平也有类似的降低 PGK1系列 基因(数据未显示)。 这表明 PYK1型 和 PGK1系列 mRNA水平是H3K4三甲基化降低的结果。 综上所述,这些实验表明,H3K4me3水平的降低 不是4 Δ细胞不是RNA pol II结合减少的直接结果。
编号4 Set1p复合体的HMT活动不需要
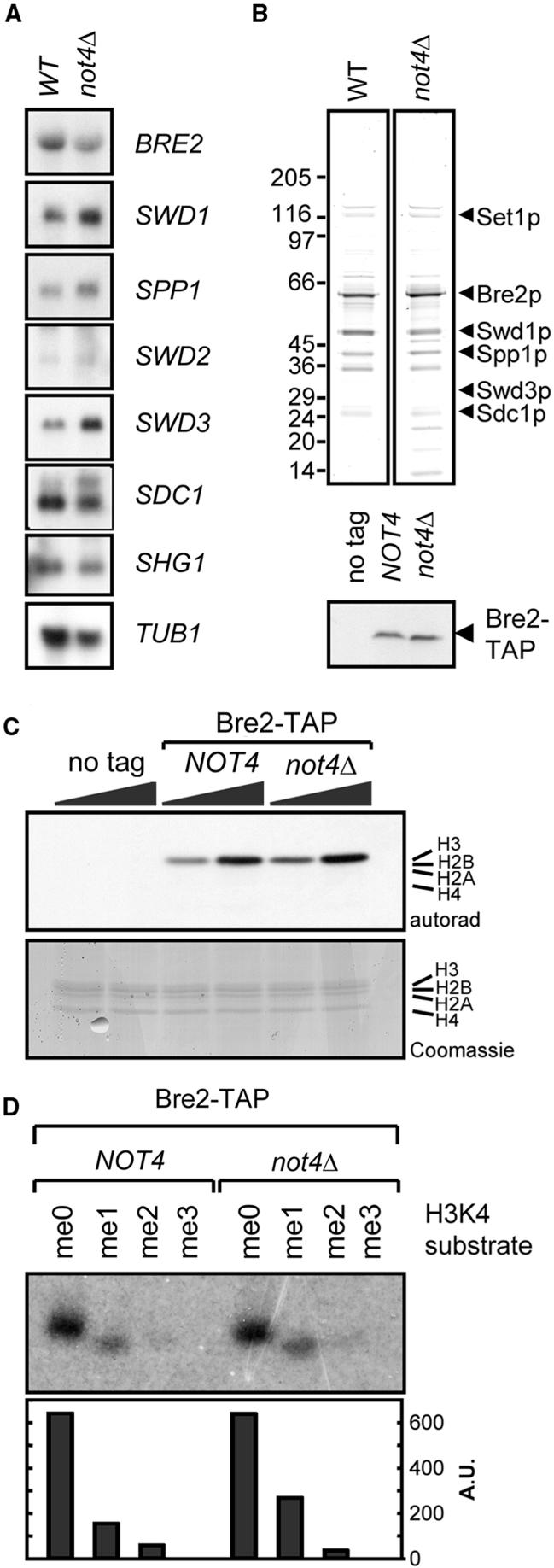
观察到的对H3K4me3水平的影响 不是4 Δ细胞可能是 编号4 需要转录对Set1p复合物完整性或活性至关重要的编码因子的基因。 例如,删除 SPP1系列 导致形成不能三甲基化H3K4的Set1p复合物( 16 ). 我们通过从WT和 不是4 Δ菌株通过Bre2p亚基的TAP标记版本。 此外,我们通过northern blot分析测试了含有或缺乏Set1p复合亚基的菌株的mRNA表达水平 编号4 这表明其亚基的转录水平和Set1p复合物的组成都不受 编号4 ( 图5 A和B)。 值得注意的是,从 不是4 Δ细胞被发现是非特异性溶酶体蛋白(数据未显示),这可能与WT或 不是4 Δ单元。 将可溶性组蛋白用作 在体外 HMT分析,从 不是4 可以检测到Δ细胞( 图5 C) 。 此外,(预甲基化)合成肽用于确定是否从 不是4 Δ细胞活跃于二甲基化底物的三甲基化。 值得注意的是,WT和 不是4 Δ细胞在修饰这种合成肽方面同样有效( 图5 D) ●●●●。
图5。
中的H3K4me3缺陷 不是4 Δ细胞独立于Set1p复合物的直接调节。 ( 一个 )Set1p复合物成分的mRNA水平。 从指数增长的BY4741和 不是4 Δ,并使用所示探针进行northern blot分析。 ( B类 )纯化的Set1p复合物的亚单位组成。 含有或缺乏菌株 编号4 并表达TAP标记的Bre2p用于纯化Set1p复合物(上面板)。 western blot分析检查Bre2-TAP蛋白的相等表达(下表)。 使用LC-MS/MS对所示蛋白质进行鉴定 不是4 与WT相比,Δ纯化。质谱显示,这些条带包含非相关溶酶体蛋白。 我们认为这是一种提纯的人工制品,可能是由于WT和 不是4 Δ单元。 ( C类 )使用纯化的Set1p复合物进行组蛋白甲基转移酶分析。 使用越来越多的Set1p复合物或模拟纯化对照物甲基化可溶性组蛋白(来自小牛胸腺) 在体外 样品在15%SDS-PAA凝胶上分离,用考马斯染色,干燥并暴露于X射线胶片。 ( D类 ) 体外 合成的预甲基化组蛋白H3-尾肽的甲基化。 前甲基肽被用作 在体外 使用从WT或 不是4 Δ单元。 样品在20%SDS-PAA凝胶上分离,干燥并暴露在X射线胶片上。 使用ImageQuant软件量化信号,并在背景校正后表示为任意单位。
综上所述,这些实验表明H3K4me3缺陷的机制 不是4 Δ细胞在转录、组成或内在活性和特异性水平上与Set1p复合物的放松调节不同。
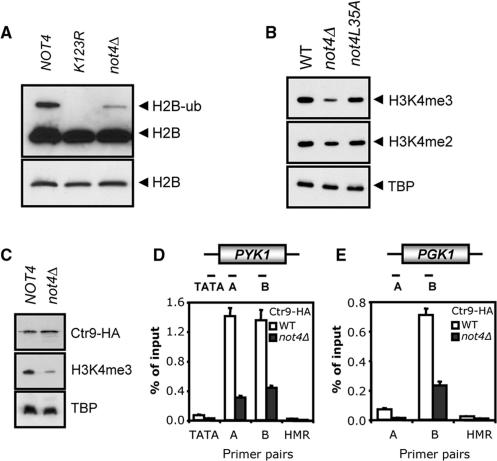
删除 编号4 减少组蛋白H2B的泛素化和PAF复合物的募集 高效H3K4甲基化需要H2B泛素化( 16 ). 为了研究Not4p在H2B泛素化中的作用,以质粒为基础的FLAG标记的H2B在 不是4 Δ单元。 在对数生长的WT细胞中可以检测到泛素化H2B,但在缺乏H2B的细胞中,泛素水平显著降低 编号4 如预期的那样,在表达FLAG标记的H2B-K123R的细胞中不能检测到泛素化的H2B( 图6 A、, 39 ). 有趣的是,Not4p含有环填充基序并显示泛素化活性 在体外 (K.W.M.、A.I.和H.T.M.T.,提交出版)。 因此,在表达Not4p非活性(L35A)突变体的细胞中测定H3K4me3状态,作为H2B泛素化的测量。 H3K4me3缺陷 不是4 Δ细胞被Not4p的L35A突变体完全补充,这表明H2B泛素化不需要它的RING-finger( 图6 B) ●●●●。 此外, 在体外 泛素化分析表明H2B不作为Not4p的底物(数据未显示)。
图6。
删除 编号4 减少H2B泛素化和PAF复合物招募。 ( 一个 ) 编号4 是高效H2B泛素化所必需的。 携带FLAG的指示菌株的提取物- HTB1型 质粒在12.5%SDS-PAGE凝胶上分离,并使用FLAG抗体进行western blot分析。 下部面板显示相同污点的暴露时间较短,表明荷载相等。 ( B类 )Not4p的泛素连接酶活性不参与H3K4me3水平的调节。 表达H3K4的细胞提取物的甲基化状态 编号4 或 非4L35A 内源性等位基因 编号4 基因座和细胞缺失 编号4 进行蛋白质印迹分析。 ( C类 )Ctr9-HA的表达单位为 编号4 和 不是4 Δ单元。 含或不含HA-tagged Ctr9p的表达菌株 编号4 western blotting法测定Ctr9-HA水平。 H3K4me3和TBP水平用作对照。 ( D类 和 E类 ) 编号4 PAF综合体招募到 PYK1型 和 PGK1系列 ORF。 对来自(C)的菌株进行ChIP分析 PYK1型 轨迹(放大子在上面板中有示意图)。 指数生长的细胞交联,并使用抗HA(12CA5)抗体进行ChIP。
体内 ,H2B泛素化依赖于PAF复合物对染色质的补充( 18 ). 为了评估Not4p在PAF复合体招募中的作用,表达HA-taged Ctr9p并含有或缺乏的菌株 编号4 建造完成。 Ctr9-HA在两个菌株中的表达水平相同,而H3K4me3在 不是4 Δ电池符合预期( 图6 C) 。 从指数增长的细胞中制备提取物,并进行ChIP分析。 而Ctr9-HA在以下组织的ORF中很容易检测到 PYK1型 和 PGK1系列 在WT细胞中,缺乏的细胞结合严重减少 编号4 ( 图6 D和E)。 综上所述,这些结果表明需要 编号4 在H2B泛素化中以及在调节PAF复合物向 PYK1型 和 PGK1系列 促进H3K4三甲基化的基因。
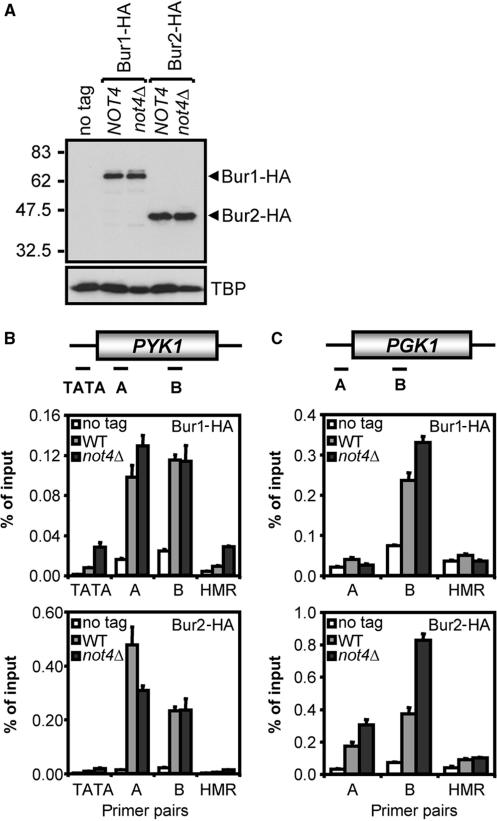
Ccr4-Not的功能与Bur1/2激酶平行或下游 PAF复合物的染色质结合取决于Bur1/2复合物( 15 , 16 ). 以下方面的要求 编号4 为了有效地招募PAF复合物,将Ccr4-Not复合物放置在含有Bur1/2激酶的途径中。 为了进一步研究这一点,表达HA-taged Bur1p或Bur2p的菌株,包含或不包含 编号4 ,以确定Bur1p和Bur2p的占用率。 HA-tagged版本的Bur1p和Bur2p在WT和 不是4 Δ电池( 图7 A) ●●●●。 对这些菌株的ChIP分析表明,Bur1p和Bur2p均与 PYK1型 和 PGK1系列 具有相似效率的位点( 图7 B和C)。 此外, 编号4 Bur1p激酶的活化并不需要,因为在缺乏的细胞中很容易检测到活性磷酸化形式的Bur1p 编号4 ( 图7 A) ●●●●。 这些结果使Ccr4-Not复合物平行于Bur1/2激酶或其下游,并在PAF复合物上游形成H3K4三甲基化途径。
图7。
Ccr4-Not在Bur1/2激酶下游或与之平行的功能不复杂。 ( 一个 )Bur1-HA和Bur2-HA在WT和 不是4 Δ单元。 表达含或不含HA标记Bur1p或Bur2p的细胞提取物 编号4 或非标记对照组,使用HA-tag、H3K4me3和TBP抗体进行western blot分析。 ( B类 )Bur1/2综合体的招募 PYK1型 基因座不依赖于 编号4 .WT和 不是4 表达HA标记的Bur1p或Bur2p的Δ细胞和no-tag对照细胞使用抗HA(12CA5)抗体进行ChIP分析(放大子如上图所示)。 ( C类 )如(B)所示,除了对 PGK1系列 轨迹。
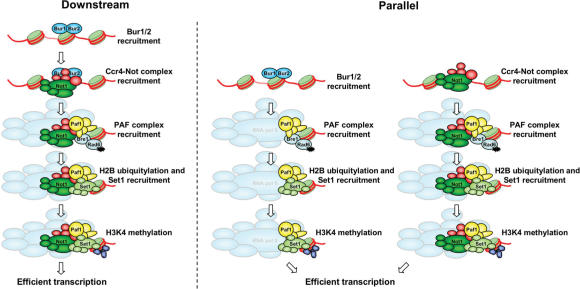
讨论 Ccr4-Not复合物在不同水平上参与mRNA的生物生成(在 21 , 22 ). 这里,我们展示了 不是 基因,与 CCR4型 和 CAF公司 H3K4的全球和基因特异性三甲基化需要基因( 图2 , 三 和 4 ). 此外,我们发现Ccr4-Not复合物在功能上与Bur1/2激酶复合物相连( 图1 ),这也是H3K4三甲基化所特别需要的( 20 ). Ccr4-Not复合物参与组蛋白修饰的机制与Set1p组蛋白甲基转移酶复合物的直接调控无关( 图5 ). 相反,在缺乏PAF复合物的细胞中,Ccr4-Not复合物在PAF复合物募集水平上与Bur1/2p平行或下游发挥作用,导致H2B的泛素化减少 编号4 ( 图8 ). 综上所述,我们的结果对Ccr4-Not复合物在全球H3K4三甲基化调控中的作用进行了详细研究。 此外,他们证实了Ccr4p-Caf1p模块的细胞质二苯醚酶活性与Ccr4-Not复合物的Not-proteins的核功能之间的功能区别( 42 ).
图8。
一个模型表明Ccr4-Not复合物如何通过调节PAF复合物的募集来建立H3K4三甲基化。 Ccr4-Not复合物可由Bur1/2激酶控制,以促进PAF复合物募集(下游)。 或者,Bur1/2和Ccr4-Not复合物在共享多个成分的不同途径中发挥作用,并独立调节PAF复合物的募集(平行)。
Bur1/2和Ccr4-Not配合物在建立H3K4三甲基化中的协同作用 H3K4三甲基化需要Bur1/2复合物( 15 )这涉及到Rad6p的磷酸化( 16 ). 编码Ccr4-Not复杂亚基的基因之间的遗传相互作用( 编号2、编号4 和 CCR4号机组 )和 BUR1(燃烧室1) 和 打嗝2 ,表明该复合物在转录延伸中的作用( 图1 ). 有趣的是,一些Ccr4-Not组分的缺失显示出6-AU敏感性,表明这种作用( 25 ). 值得注意的是,已公布的Ccr4-Not成分的6-AU敏感性与合成致死率之间存在严格的相关性 打嗝2 观察到。 由于Bur1/2复合物被证明参与H3K4me3水平的调节( 15 ),我们测定了缺乏编码Ccr4-Not成分基因的细胞中各种组蛋白H3赖氨酸甲基化标记的水平。 相比之下 不是 -基因缺失菌株中未观察到H3K4me3水平下降 ccr4号机组 Δ电池( 图2 )表明Ccr4p和Not模块通过不同的机制促进转录延长。 另一种解释可能是删除了Ccr4-Not组件 打嗝2 导致同一途径中随后的活性部分丧失,最终导致观察到的合成致死性。
通过观察发现,PAF复合物的募集和随后H2B的有效泛素化,而非Bur1/2复合物的招募依赖于 编号4 然而,其他修饰如H3K4单甲基化和二甲基化或H3K79二甲基化和三甲基化不受 编号4 这些结果表明,导致H3K4和H3K79甲基化的途径在Ccr4上游分叉的模型并不复杂,并且与最近的报告一致,该报告显示 打嗝2 仅H3K4三甲基化需要( 15 , 16 ). 或者,在缺乏泛素化H2B的细胞中观察到的残留程度 编号4 可能足以维持H3K79me2/3和H3K4me2,但不足以维持H3 K4me3水平。 支持这一假设的观察结果是 PAF1型 显示H3K4二甲基化但非三甲基化的显著水平( 43 ,数据未显示)。
Ccr4-Not复合物对H3K4三甲基化的调节和PAF复合物的参与 Set1p复合物(或COMPASS)代表酵母中H3K4的唯一HMT( 4–6 ). 观察到Set1p复合物的转录、亚单位组成、活性和特异性不受Not4p的影响,这表明Ccr4-not复合物在调节H3K4三甲基化的途径中进一步上游发挥作用。 发现Not4p物理上存在于 PYK1型 ORF与H3K4三甲基标记和PAF复合物一致,表明Ccr4-Not复合物在这种修饰的调节中起着直接作用。 Ccr4-Not复合体向该区域的募集可能有助于H3K4me3标记的定位。对Ccr4-Not复合体控制H3K4me3水平的机制的另一个重要见解来自于观察到 编号4 而Bur1p和Bur2p的招募和激活不受影响( 图6 和 7 ). 已知Bur1/2激酶在PAF复合物募集的上游起作用( 15 ). 因此,Ccr4-Not复合物既可以作用于Bur1/2激酶的下游,也可以通过平行途径调节PAF复合物的募集( 图8 ). 有趣的是,Not3p和Not5p都是磷酸蛋白( 44 ),但与Bur1/2复合物的联系仍未探索。 在平行通路中,Bur1/2和Ccr4-Not复合物在PAF复合物向染色质的补充中相互独立。 引人注目的是,删除了 打嗝2 或 编号4 只导致H2B泛素化、PAF复合物募集和随后的H3K4三甲基化的部分损失( 15 , 图2 和 6 ).
先前的实验将PAF复合物与Ccr4p物理联系起来( 45 ). 然而,我们和其他人未能检测到PAF复合物成员或Ccr4-Not纯化中的Bur1p/2p( 46 ,数据未显示)。 此外,删除 PAF1型 导致HU敏感表型和对 注册护士 基因转录( 47 ). 有趣的是,这也可以用于删除 CCR4-非 基因( 27 )和删除 打嗝2 (数据未显示),表明这些复合物之间存在功能相互作用。 另外,组蛋白密码的其他成分的改变也可能有助于Ccr4-Not complex对H3K4me3水平的调节。 尽管如此,显然需要进一步的实验来阐明Ccr4-Not和PAF复合物之间的联系。
Ccr4-Not复合物对转录的正调控和负调控 我们的结果支持Ccr4-Not复合物在转录的正调控中的全局作用。 此外,这种复合物成分的突变导致多种基因的去表达( 26 , 48 ). 这些看似矛盾的观察结果可能与PHD指状蛋白识别H3K4-甲基化组蛋白的最新发现相一致( 49–51 ). 这些结构域被认为是将染色质修饰复合物,如NURF和mSin3a-HDAC1复合物招募到H3K4-甲基化染色质( 49 , 51 ). 酵母含有15个PHD指,位于多种染色质修饰复合物中,这些基序对H3K4me2和H3K4me3显示出不同的相对亲和力( 50 ). 因此,H3K4三甲基化的特定损失可能会改变特定基因的染色质调节复合体的平衡。 Ccr4-Not复合物的唯一功能不太可能是通过PAF复合物的募集来调节H3K4三甲基化。 除了Ccr4p和Caf1p亚基在mRNA二烯基化中的作用外,多项观察结果表明,非蛋白能直接影响TFIID功能(在 21 , 22 ). 这表明Ccr4-Not复合物整合了mRNA表达的几个步骤。 Ccr4-Not基因缺失的功能性后果可能是基因特异性的,例如,我们在 PYK1型 和 热休克蛋白104 基因。 总之,这些发现为Ccr4-Not复合物对基因转录既有负面影响也有正面影响的观察结果提供了解释。
总之,我们已经确定了Ccr4-Not复合体在调节H3K4三甲基化水平中的作用,其作用与Bur1/2激酶平行或下游,以促进PAF复合体的招募和随后的H2B泛素化。 这些结果提供了Ccr4-Not复合物在转录调控和组蛋白甲基化标记中的作用之间的联系。
致谢 我们感谢M.Collart、F.van Leeuwen、J.Jaehning、W.W.Pijnappel、S.Buratowski、P.A.Weil、G.P.Prelich、A.Aguilera和B.Strahl博士慷慨分享试剂,感谢G.S.Winkler和F.C.Holstege博士对手稿的批评性阅读,感谢Timmers实验室成员的有益讨论、技术建议和帮助。 感谢N.J.Krogan博士和B.Strahl博士在发表之前分享结果。 这项工作得到了荷兰科学研究组织(NWO-MW Pionier#900-98-142和NWO-CW#700-50-034)、欧盟(提高人类潜力RTN2-2001-00026和STREP LSHG-CT-2004-502950)和EMBO(ASTF 184.00-02)的资助。 支付开放获取出版费用的资金由乌得勒支大学医学中心提供。
利益冲突声明 。未声明。
参考文献
1 Berger SL.转录调控中的组蛋白修饰。 货币。 操作。 基因。 2002年开发; 12:142–148. doi:10.1016/s0959-437x(02)00279-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Ng HH、Robert F、Young RA、Struhl K。通过延长Pol II靶向募集Set1组蛋白甲基化酶,提供了近期转录活动的局部标记和记忆。 分子细胞。 2003; 11:709–719. doi:10.1016/s1097-2765(03)00092-3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Santos-Rosa H、Schneider R、Bannister AJ、Sherriff J、Bernstein BE、Emre NC、Schreiber SL、Mellor J、Kouzarides T。活性基因在组蛋白H3的K4处三甲基化。 自然。 2002年; 419:407–411. doi:10.1038/nature01080。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
4 Krogan NJ、Dover J、Khorrami S、Greenblatt JF、Schneider J、Johnston M、Shilatifard A.COMPASS,端粒沉默基因表达所需的组蛋白H3(赖氨酸4)甲基转移酶。 生物学杂志。 化学。 2002年; 277:10753–10755. doi:10.1074/jbc。 C200023200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
5 Nagy PL、Griesenbeck J、Kornberg RD、Cleary ML。组蛋白H3的甲基化需要从酿酒酵母中纯化的三羟类复合物。 程序。 美国国家科学院。 科学。 美国2002年; 99:90–94. doi:10.1073/pnas.221596698。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
6 Roguev A、Schaft D、Shevchenko A、Pijnappel WW、Wilm M、Aasland R、Stewart AF。酿酒酵母Set1复合物包括Ash2同源物和甲基化组蛋白3赖氨酸4。 EMBO J.2001; 20:7137–7148. doi:10.1093/emboj/20.24.7137。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
7 Dehe PM、Dichtl B、Schaft D、Roguev A、Pamblanco M、Lebrun R、Rodriguez-Gil A、Mkandawire M、Landsberg K等。Set1复合体内的蛋白质相互作用及其在组蛋白3赖氨酸4甲基化调控中的作用。 生物学杂志。 化学。 2006; 281:35404–35412. doi:10.1074/jbc。 M603099200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
8 Dover J、Schneider J、Tawiah-Boateng MA、Wood A、Dean K、Johnston M、Shilatifard A.通过COMPASS实现组蛋白H3的甲基化需要通过Rad6实现组蛋白H2B的泛素化。 生物学杂志。 化学。 2002年; 277:28368–28371. doi:10.1074/jbc。 C200348200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9 Sun ZW,Allis CD。组蛋白H2B的泛素化调节酵母中H3甲基化和基因沉默。 自然。 2002年; 418:104–108. doi:10.1038/nature00883。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
10 Ng HH,Xu RM,Zhang Y,Struhl K。组蛋白H3赖氨酸79的高效Dot1介导甲基化需要Rad6对组蛋白H2B的泛素化。 生物学杂志。 化学。 2002年; 277:34655–34657. doi:10.1074/jbc。 C200433200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
11 Wood A、Krogan NJ、Dover J、Schneider J、Heidt J、Boateng MA、Dean K、Golshani A、Zhang YF等。Bre1,一种用于Rad6招募和底物选择的E3泛素连接酶 在发起人处。 分子细胞。 2003; 11:267–274. doi:10.1016/s1097-2765(02)00802-x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
12 Hwang WW、Venkatasubrahmanyam S、Ianculescu AG、Tong A、Boone C、Madhani HD。 组蛋白H2B单泛素化和细胞大小控制所需的保守环指蛋白。 分子细胞。 2003; 11:261–266. doi:10.1016/s1097-2765(02)00826-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
13 Murray S,Udupa R,Yao S,Hartzog G,Prelich G。Bur1细胞周期蛋白依赖性激酶对RNA聚合酶II羧基末端结构域的磷酸化。 分子细胞。 《生物》2001; 21:4089–4096。 doi:10.1128/MCB.211.4089-4096.2001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
14 Keogh MC、Podolny V、Buratowski S.Bur1激酶是RNA聚合酶II有效转录延伸所必需的。 分子细胞。 生物.2003; 23:7005–7018. doi:10.1128/MCB.23.197005-7018.2003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
15 Laribee RN、Krogan NJ、Xiao T、Shibata Y、Hughes TR、Greenblatt JF、Strahl BD。BUR激酶通过募集PAF延伸复合物选择性调节H3 K4三甲基化和H2B泛素化。 货币。 生物学2005; 15:1487–1493. doi:10.1016/j.cub.2005.07.028。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
16 Wood A、Schneider J、Dover J、Johnston M、Shilatifard A。Rad6/Bre1组蛋白H2B单泛素化和COMPASS组蛋白甲基化需要Bur1/Bur2复合物。 分子细胞。 2005; 20:589–599. doi:10.1016/j.molcel.2005.09.010。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
17 Krogan NJ、Dover J、Wood A、Schneider J、Heidt J、Boateng MA、Dean K、Ryan OW、Golshani A等。Paf1复合物是COMPASS和Dot1p实现组蛋白H3甲基化所必需的:将转录延伸与组蛋白甲基化联系起来。 分子细胞。 2003; 11:721–729. doi:10.1016/s1097-2765(03)00091-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
18 Wood A、Schneider J、Dover J、Johnston M、Shilatifard A。Paf1复合物对于Rad6-Bre1复合物的组蛋白单泛素化至关重要,它通过COMPASS和Dot1p指示组蛋白甲基化。 生物学杂志。 化学。 2003; 278:34739–34742. doi:10.1074/jbc。 C300269200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 Mueller CL,Jaehning JA公司。 Ctr9、Rtf1和Leo1是Paf1/RNA聚合酶II复合物的组成部分。 分子细胞。 生物杂志,2002年; 22:1971–1980. doi:10.1128/MCB.22.71-1980.2002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
20 Squazzo SL、Costa PJ、Lindstrom DL、Kumer KE、Simic R、Jennings JL、Link AJ、Arndt KM、Hartzog GA。Paf1复合物在物理和功能上与体内转录延伸因子相关。 EMBO J.2002; 21:1764–1774. doi:10.1093/emboj/21.7.1764。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
21 Collart MA,Timmers HT.真核生物Ccr4-不复杂:一个整合mRNA代谢和细胞信号通路的调节平台? 掠夺。 核酸研究分子生物学。 2004; 77:289–322. doi:10.1016/S0079-6603(04)77008-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
22 Denis CL,Chen J.CCR4-NOT复合物在mRNA代谢中发挥着不同的作用。 掠夺。 核酸研究分子生物学。 2003; 73:221–250. doi:10.1016/s0079-6603(03)01007-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
23 Lee TI、Wyrick JJ、Koh SS、Jennings EG、Gadbois EL、Young RA。 RNA聚合酶II全酶启动转录过程中正负调控因子的相互作用。 分子细胞。 《生物》1998; 18:4455–4462. doi:10.1128/mcb.18.8.4455。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
24 Holstege FC、Jennings EG、Wyrick JJ、Lee TI、Hengartner CJ、Green MR、Golub TR、Lander ES、Young RA。 剖析真核生物基因组的调控电路。 单元格。 1998; 95:717–728. doi:10.1016/s0092-8674(00)81641-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
25 Denis CL,Chiang YC,Cui Y,Chen J.遗传证据支持酵母CCR4-NOT复合物在转录延长中的作用。 遗传学。 2001; 158:627–634. doi:10.1093/遗传学/158.2627。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
26 Liu HY、Badarinarayana V、Audino DC、Rappsilber J、Mann M、Denis CL。NOT蛋白是CCR4转录复合物的一部分,对基因表达有积极和消极的影响。 EMBO J.1998; 17:1096–1106. doi:10.1093/emboj/17.4.1096。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
27 Mulder KW、Winkler GS、Timmers HT。RNR基因的DNA损伤和复制应激诱导转录依赖于Ccr4-Not complex。 核酸研究2005; 33:6384–6392. doi:10.1093/nar/gki938。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
28 Tucker M、Valencia-Sanchez MA、Staples RR、Chen J、Denis CL、Parker R。与转录因子相关的Ccr4和Caf1蛋白是酿酒酵母中主要细胞质mRNA死亡酶的组成部分。 单元格。 2001; 104:377–386. doi:10.1016/s0092-8674(01)00225-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
29 Rondon AG,Jimeno S,Garcia-Rubio M,Aguilera A.真核生物THO/TREX复合物是有效转录延伸所必需的分子证据。 生物学杂志。 化学。 2003; 278:39037–39043. doi:10.1074/jbc。 M305718200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
30 Gardner RG、Nelson ZW、Gottschling DE。Ubp10/Dot4p调节泛素化组蛋白H2B的持久性:在端粒沉默和一般染色质中的不同作用。 分子细胞。 生物学2005; 25:6123–6139. doi:10.1128/MCB.25.14.6123-6139.2005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
31 库什尼罗夫VV。 从酵母中快速可靠地提取蛋白质。 酵母。 2000年; 16:857–860. doi:10.1002/1097-0061(20000630)16:9<857::AID-YEA561>3.0.CO; 2-B类。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
32 Logie C,Peterson CL.酵母SWI/SNF复合物的纯化和生化特性。 方法酶制剂。 1999; 304:726–741. doi:10.1016/s0076-6879(99)04044-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
33 Wessel D,Flugge UI。 一种在含有洗涤剂和油脂的稀溶液中定量回收蛋白质的方法。 分析。 生物化学。 1984; 138:141–143. doi:10.1016/0003-2697(84)90782-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
34 Kinter M,Sherman NE。串联质谱法蛋白质序列鉴定。 纽约:威利父子公司; 2000 [ 谷歌学者 ]
35 Krogan NJ、Kim M、Tong A、Golshani A、Cagney G、Canadien V、Richards DP、Beattie BK、Emili A等。酿酒酵母中组蛋白H3的Set2甲基化与RNA聚合酶II的转录延伸有关。 分子细胞。 生物.2003; 23:4207–4218. doi:10.1128/MCB.23.12.4207-4218.2003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
36 Morillon A,Karabetsou N,Nair A,Mellor J.组蛋白H3的动态赖氨酸甲基化定义了基因转录的调节阶段。 分子细胞。 2005; 18:723–734. doi:10.1016/j.molcel.2005.05.009。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
37 Schneider J、Wood A、Lee JS、Schuster R、Dueker J、Maguire C、Swanson SK、Florens L、Washburn MP等。COMPASS对组蛋白H3三甲基化的分子调控和基因表达的调控。 分子细胞。 2005; 19:849–856. doi:10.1016/j.molcel.2005.07.024。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
38 van Leeuwen F,Gafken PR,Gottschling DE。Dot1p通过核小体核心的甲基化调节酵母中的沉默。 单元格。 2002年; 109:745–756. doi:10.1016/s0092-8674(02)00759-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
39 Corda Y、Schramke V、Longhese MP、Smokvina T、Paciotti V、Brevet V、Gilson E、Geli V。Set1p和检查点蛋白Mec3p在DNA修复和端粒功能中的相互作用。 自然遗传学。 1999; 21:204–208. doi:10.1038/5991。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
40 van Werven FJ,Timmers HT。在酿酒酵母中使用生物素标记可提高染色质免疫沉淀的敏感性。 2006年《核酸研究》; 34:e33。 doi:10.1093/nar/gkl003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
41 Zhao J,Herrera-Diaz J,Gross DS。组蛋白被激活的热休克因子引起的域宽位移独立于Swi/Snf,与RNA聚合酶II密度无关。 分子细胞。 生物学2005; 25:8985–8999. doi:10.1128/MCB.25.20.8985-899.2005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
42 Bai Y、Salvadore C、Chiang YC、Collart MA、Liu HY、Denis CL。CCR4-NOT复合物的CCR4和CAF1蛋白在物理和功能上与NOT2、NOT4和NOT5分离。 分子细胞。 《生物学》,1999年; 19:6642–6651. doi:10.1128/mcb.19.10.6642。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
43 Schlichter A,Cairns BR。Set1的组蛋白三甲基化由RRM、自身抑制和催化结构域协调。 EMBO J.2005; 24:1222–1231. doi:10.1038/sj.emboj.7600607。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
44 Lenssen E,Oberholzer U,Labarre J,De Virgilio C,Collart MA。酿酒酵母Ccr4-not complex有助于通过Ras/cAMP途径控制Msn2p依赖性转录。 摩尔微生物。 2002年; 43:1023–1037. doi:10.1046/j.1365-2958.2002.02799.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
45 Chang M、French-Cornay D、Fan HY、Klein H、Denis CL、Jaehning JA。 含有RNA聚合酶II、Paf1p、Cdc73p、Hpr1p和Ccr4p的复合物在蛋白激酶C信号传导中起作用。 分子细胞。 《生物学》,1999年; 19:1056–1067. doi:10.1128/mcb.19.2.1056。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
46 Gavin AC、Bosche M、Krause R、Grandi P、Marzioch M、Bauer A、Schultz J、Rick JM、Michon AM等。通过蛋白质复合物的系统分析实现酵母蛋白质组的功能组织。 自然。 2002年; 415:141–147. doi:10.1038/415141a。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
47 Betz JL、Chang M、Washburn TM、Porter SE、Mueller CL、Jaehning JA。 Paf1/RNA聚合酶II复合物突变的表型分析揭示了与细胞周期调节、蛋白质合成、脂质和核酸代谢的联系。 分子遗传学。 基因组学。 2002年; 268:272–285. doi:10.1007/s00438-002-0752-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
48 Collart MA、Struhl K.NOT1(CDC39)、NOT2(CDC6)、NOT3和NOT4编码一种不同影响TATA-元件利用的全局负转录调节器。 基因发展1994; 8:525–537. doi:10.101/gad.8.5.525。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
49 Shi X、Hong T、Walter KL、Ewalt M、Michishita E、Hung T、Carney D、Pena P、Lan F等。ING2 PHD结构域将组蛋白H3赖氨酸4甲基化与活性基因阻遏联系起来。 自然。 2006; 442:96–99. doi:10.1038/nature04835。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
50 Shi X、Kachirskaia I、Walter KL、Kuo JH、Lake A、Davrazou F、Chan SM、Martin DG、Fingerman IM等。酿酒酵母蛋白质组全分析确定了几个PHD指是在赖氨酸4或赖氨酸36甲基化的组蛋白H3的新的直接和选择性结合模块。 生物学杂志。 化学。 2007; 282:2450–2455. doi:10.1074/jbc。 C600286200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
51 Wysocka J、Swigut T、Xiao H、Milne TA、Kwon SY、Landry J、Kauer M、Tackett AJ、Chait BT等。NURF对组蛋白H3赖氨酸4三甲基化和染色质重塑的PHD指。 自然。 2006; 442:86–90. doi:10.1038/nature04815。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
52 Thomas BJ,Rothstein R.提高转录活性DNA的重组率。 单元格。 1989; 56:619–630. doi:10.1016/0092-8674(89)90584-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
53 Deluen C、James N、Maillet L、Molinete M、Theiler G、Lemaire M、Paquet N、Collart MA。Ccr4-不复杂,yTAF1(yTaf(II)130p/yTaf。 分子细胞。 生物杂志,2002年; 22:6735–6749. doi:10.1128/MCB.22.19.6735-6749.2002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]