介绍
癌症恶病质是一种复杂的多因素综合征,与不同类型癌症的发病有关(Fearon等人,2011年). 其进展使患者虚弱,降低身体功能和对化疗的耐受性,损害生活质量并缩短生存期。癌症患者的预后和生存受到恶病质的影响,多达30%的癌症死亡是恶病质造成的(Fearon等人,2012年). 据估计,高达80%的晚期癌症患者将发展为高度衰弱的肌肉骨骼功能障碍(von Haehling和Anker,2014年;Sun等人,2015年)据报道,这些并发症在癌症缓解后持续数月甚至数年(Hayes等人,2005年;Meeske等人,2007年). 尽管恶病质产生了影响,但它仍然是一个有待研究的领域,在美国还没有得到批准的治疗方法。恶病质表型最明显的特征是体重逐渐减轻,伴有骨骼肌和脂肪组织的消瘦(Fearon等人,2011年). 特别是,肌肉萎缩是该综合征最令人担忧的方面之一,尤其是因为肌肉质量的丧失降低了对化疗药物的耐受性并导致停止治疗(Dewys等人,1980年)有助于新陈代谢的改变(Collins等人,2002年;桑德斯和蒂斯代尔,2004年;Busquets等人,2005年)导致身体虚弱,严重降低日常活动表现(Hayes等人,2005年;Luctkar-Flude等人,2009年). 癌症背景下肌肉萎缩的发病机制是一个复杂的现象,其中包括蛋白酶体依赖性蛋白水解酶系统的过度激活导致蛋白质分解增加(Baracos等人,1995年)和溶酶体自噬系统(Penna等人,2013年;Aversa等人,2016年)蛋白质合成代谢降低或不降低(Kim等人,2021年). 一些迹象表明,在癌症恶病质期间,骨骼肌的肌肉再生程序也会发生改变(Penna等人,2010年;He等人,2013年). 此外,线粒体结构、生物发生、周转和新陈代谢的损伤经常被检测到,并可能导致该综合征的能量低效率特征(VanderVeen等人,2017年).
沿着这条线,在Lewis肺癌(LLC)和结肠癌26(C26)宿主的骨骼肌中描述了线粒体超微结构改变的证据(Shum等人,2012年;Pin等人,2015年). 我们和其他人在肿瘤宿主骨骼肌中报告的线粒体内稳态改变可以解释这种结构变化(Ballaro等人,2019年;霍特等人,2020b). 此外,在恶病质骨骼肌中,线粒体吞噬(调节线粒体周转的过程)增加(Penna等人,2019年). 这些结构改变通常与氧化能力的降低有关,正如调节TCA循环的两种重要酶琥珀酸脱氢酶(SDH)和丙酮酸脱氢酶(PDH)活性的变化以及丙酮酸脱氢酶激酶(PDK)-4的调节所表明的那样,参与细胞能量代谢的控制(Pin等人,2015年;Pin等人,2019a;Pin等人,2019b). 总之,这些变化有助于恶病质肿瘤宿主肌肉纤维成分的氧化-糖酵解转变与。健康对照(Pin等人,2015年;霍特等人,2020a),并参与肌脂肪变性的发病(即,肌内脂肪的积累)在恶病质小鼠中(霍特等人,2020a). 此外,据报道,线粒体功能障碍会增加氧化应激水平和活性氧的产生,从而进一步促进线粒体损伤和退化(Penna等人,2020年),这是癌症肌肉萎缩的先兆和原因(Brown等人,2017年). 总之,这些数据强调了保护和维持线粒体稳态的重要性,以及在癌症中保护骨骼肌的功能,并表明以线粒体为靶点可能是对抗恶病质的一种有希望的治疗干预措施。
已经测试了几种药物来改善线粒体功能和能量代谢(Penna等人,2018年). 其中一些化合物在线粒体水平上特异性地发挥作用,并作为具有抗氧化特性的线粒体靶向剂。特别是,MitoQ和SkQ1是与亲脂性阳离子结合的抗氧化剂,由于膜电位的差异,能够在线粒体膜中积累,而SS-31肽通过与心磷脂结合在线粒体内积累(布鲁姆等人,2018年). 有趣的是,最近的一项研究表明,服用SS-31可以改善患有C26肿瘤或接触化疗药物的动物的恶病质表型(Ballaro等人,2021年),而Guigni等。据报道,易于获得的MitoQ能够防止肌管培养物中肌球蛋白的损失,从而表明它可能是一种很有前途的策略,可以在癌症环境中对抗恶病质(Guigni等人,2018年).
在本研究中,我们验证了MitoQ是一种防止C26荷瘤小鼠线粒体改变和改善恶病质表型的工具。我们的数据表明,长期服用MitoQ可以部分预防肿瘤发生后体重减轻、肌肉萎缩和虚弱。骨骼肌氧化代谢的改善进一步证实了这些观察结果。
方法
细胞培养
小鼠C26结肠腺癌细胞由Donna McCarthy(俄亥俄州立大学,俄亥俄州哥伦布,美国)提供,并在含有10%胎牛血清、1%谷氨酰胺、1%丙酮酸钠、1%青霉素和链霉素的高糖(4.5 g/L)DMEM中培养。细胞保持在5%的CO中2,37°C增湿培养箱。小鼠C2C12骨骼肌成肌细胞(ATCC、Manassas、VA)在添加10%FBS、100 U/ml青霉素、100 mg/ml链霉素、100 mg/ml丙酮酸钠、2 mM L-谷氨酰胺的高糖DMEM中生长,并在37°C的5%CO中保持生长2将成肌细胞暴露于含有2%马血清的DMEM中生成肌管(即分化培养基,DM),每隔一天更换培养基5天。为了确定对依赖于MitoQ的肌管大小的影响(MitoQ Limited,新西兰奥克兰),肌管暴露于20%的C26条件培养基(CM)和75µM MitoQ(C26+MitoQ)或三苯基膦阳离子(TPP,用作非特异性非活性化合物;C26+TPP)中长达48小时。对照肌管暴露在相同百分比的无条件培养基(UM)中。
动物
所有动物研究均由印第安纳大学医学院动物护理和使用委员会批准,并符合国家卫生研究院《实验动物使用和护理指南》以及1964年《赫尔辛基宣言》及其后来的修正案。所有动物都保持有规律的暗-光循环(从早上8点到晚上8点),在整个实验期间都可以免费获得食物和水。在实验中,使用CD2F1雄性小鼠(印第安纳州印第安纳波利斯市Envigo),并将其安置在印第安纳大学实验动物资源中心的无病设施中(每个笼子最多4只)。当小鼠11周龄时,1×106C26细胞接种于无菌盐水中的皮下。小鼠被随机分为四组:接受TPP(TPP)的小鼠;n个=4),用MitoQ(MitoQ;n个=4),接受TPP(C26+TPP)的C26荷瘤小鼠;n个=6)和用MitoQ(C26+MitoQ;n个= 7). 在整个研究期间,从接种肿瘤前2周开始,在饮用水中以200μM的浓度给药MitoQ(即,在9周龄时)。记住,每只动物通常每天饮用约5毫升溶液(数据未显示),此剂量约等于25毫克/千克剂量,与之前的报告一致(Ghosh等人,2010年). 在整个实验期间,对小鼠进行监测。肿瘤注射后13天,在光麻醉下(氧气中的5%异氟醚)处死小鼠。收集、称重、在液氮中速冻并储存在−80°C下,以进行进一步分析。胫骨前肌在液氮冷却异戊烷中冷冻,安装在OCT中并保存以进行形态学分析。
握力
如前所述,对小鼠全身力量进行评估(Bonetto等人,2015年). 通过握力计(俄亥俄州哥伦布市哥伦布仪器公司)记录绝对握力(峰值力,单位为克)。完成了五次测量,前三次测量包括在分析中。为了避免习惯化,在基线(第0天)和牺牲时(第13天)测试动物的握力。研究人员在测试期间没有失明。
肌肉横截面积评估
为了评估骨骼肌萎缩,在中腹取10μm厚的胫骨前肌冰冻切片进行免疫染色,如前所述(霍特等人,2020b). 简言之,将切片在室温下封闭1小时,并在4°C下用肌营养不良蛋白一级抗体[1:50,#MANDRA1(7A10),发育研究杂交瘤银行,爱荷华州爱荷华市]孵育过夜,然后用一种二级抗体(AlexaFluor 555,1:1000,A21127,Thermo Fisher Scientific)孵育1小时在室温下培养。使用Lionheart LX自动显微镜(BioTek仪器)分析整个肌营养不良蛋白染色切片的CSA。
肌管大小评估
C2C12细胞层固定在冰镇丙酮甲醇中,并与抗肌球蛋白重链抗体(MF-20,稀释1:200;发育研究杂交瘤银行,爱荷华州爱荷华市)和AlexaFluor 488标记的二级抗体(纽约州格兰德岛Invitrogen)孵育。通过使用ImageJ 1.43软件测量校准图像上避开聚集核区域的长多核纤维的最小直径来分析肌管大小。每个实验条件使用三个生物复制品。然后对每个重复的结果进行平均,以获得最终的肌管尺寸。
西方印迹法
通过在放射免疫沉淀分析(RIPA)缓冲液中溶解细胞层或均质100 mg腓肠肌组织获得总蛋白提取物[150 mM NaCl、1.0%NP-40、0.5%脱氧胆酸钠、0.1%十二烷基硫酸钠(SDS)和50 mM Tris,pH 8.0],并加入蛋白酶(美国印第安纳波利斯州罗氏)和磷酸酶(Thermo Scientific,Rockford,IL,United States)抑制剂鸡尾酒。通过离心(15分钟,14000 g)去除细胞碎片,收集上清液并储存在−80°C下。蛋白质浓度是使用比钦酸(BCA)蛋白质分析方法(Thermo Scientific)测定的。然后在4–15%梯度SDS标准TGX预制凝胶(Bio-Rad,Hercules,CA,美国)中电泳蛋白质提取物(30μg)。将凝胶转移到硝化纤维素膜(Bio-Rad)上。在室温下用SEA BLOCK封闭试剂(Thermo Scientific)封闭膜1小时,然后用稀释抗体在4°C下含0.2%吐温-20的SEA BLOCK缓冲液中孵育过夜,轻轻摇晃。用含有0.2%吐温-20的PBS清洗后,在室温下用抗兔IgG(h+L)DyLight 800或抗鼠IgG。然后用奥德赛红外成像系统(LI-COR Biosciences,Lincoln,NE,United States)对斑点进行可视化。使用Gel-Pro分析仪软件进行光学密度测量。使用的抗体包括:来自细胞信号技术的p-Akt-S473(#4060)、Akt(#9272)、p-mTOR(#5536S)、mTOR(7C10)、p-4E-BP1(#236B4)、4E-BPl(#53H11)、OPA1(#80471),PDK4(#ab214938)、p-PDH(#ab177461)、PDH(#ab168379)、来自Abcam的PGC1α(#ab3242)和来自发育研究杂交瘤银行(爱荷华市,IA,美国)。
实时定量聚合酶链反应
按照制造商提供的方案,使用miRNeasy Mini试剂盒(美国加利福尼亚州巴伦西亚的齐亚根)分离腓肠肌RNA。使用Synergy H1分光光度计(美国弗吉尼亚州Winooski Biotek)对RNA进行定量。使用Verso cDNA试剂盒(Thermo Fisher Scientific,Waltham,MA,美国)将总RNA反向转录到cDNA。利用TaqMan基因表达分析系统(加利福尼亚州卡尔斯巴德生命科技公司),通过实时PCR(Light Cycler 96,美国印第安纳波利斯罗氏)测量转录水平。Atrogin-1(Mm00499523_m1)、Murf-1(Mm01185221_m1)、Fis1(Mm0081580)、Mfn(Mm00500120)、PDK4(Mm01166879)、Pink1(Mm0550827)、Parkin(Mm00450187)、Opa1(Mm01349707)、Pgc1α(Mm01208835)、CytB(Mm04225271_g1)、Lipe(Mm200495359)、Pnpla2(Mm0075040)、Fasn(Mm 00662319)、Sr的表达水平ebf1(Mm00550338),Srebf2(Mm01306292),检测到Plin1(Mm00558672_m1)、Cpt1b(Mm.PT.6753512a1)、Acaa1a(Mm.PT.18700004a1)和Hadha(Mm.PT.33859811a1)。使用标准2将基因表达标准化为TBP(Mm01277042_m1)水平-ΔCT方法。在所有实验组中,TBP的表达没有显著改变。
骨骼肌低密度脂蛋白受体的定量
根据制造商方案,通过使用特异性ELISA试剂盒(#MLDLR0;Bio-Techne Corporation,Minneapolis,MN,United States)测量来自所有组的腓肠肌骨骼肌匀浆中LDL受体的水平。
油红O染色
为了进行ORO染色,将胫骨前肌切片(10μm),并立即固定在冰冷的甲醛(3.7%;Thermo Fisher Scientific)中1小时。切片在Milli-Q水(MilliporeSigma)中连续清洗,并在按照前面所述制备的ORO工作溶液中染色(霍特等人,2020a);ORO染色后,切片再次在Milli-Q水中连续洗涤,然后在自来水中漂洗10分钟。切片安装在PBS中50%的甘油中,并使用Axio Observer拍照。Z1电动显微镜(蔡司)。使用ImageJ软件分析整个ORO染色切片的信号强度和阳性染色面积。
酶活性
根据制造商的说明,使用Sigma-Aldrich的比色分析试剂盒(分别为#MAK091、MAK183和#MAK197)测量腓肠肌匀浆中己糖激酶(HK)、丙酮酸脱氢酶(PDH)和琥珀酸脱氢酶的酶活。简单地说,将10 mg骨骼肌组织均匀地放入100μL冰镇分析缓冲液中,然后离心,并将10μL匀浆添加到96个平板中。将适当的反应混合物添加到每个微孔和酶反应产物中,从而得到与酶活性成比例的比色产物(SDH为600 nm,HK和PDH为450 nm)。通过在37°C下孵育平板记录吸光度,每5分钟测量一次(600或450 nm),持续30分钟。
统计分析
进行双向方差分析(ANOVA)检验以确定实验组之间的差异。后hoc完成了比较通过一项Tukey检验,其统计显著性先验设定为第页≤ 0.05. 使用GraphPad Prism 8.4.1进行所有统计。数据表示为平均值±标准偏差。
结果
MitoQ改善肌管萎缩和体外新陈代谢
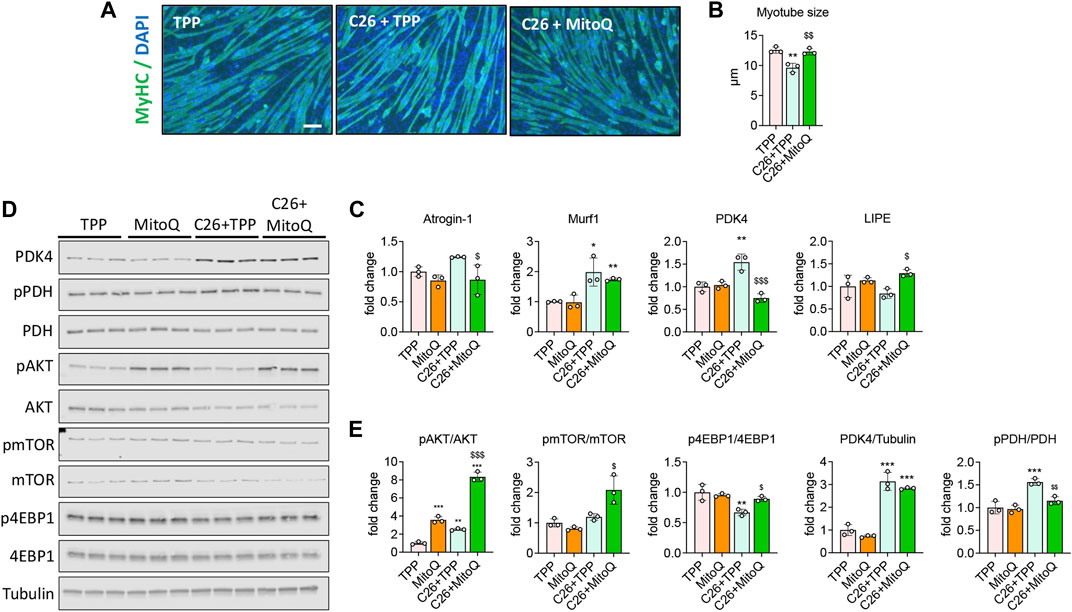
为了澄清体外将C2C12肌管培养物暴露于肿瘤衍生条件培养基(CM)中,给予20%C26 CM,并用MitoQ 75μM,C26+MitoQ治疗48小时,观察MitoQ对C2C12肌管培养物的影响。与我们之前的观察结果一致(Pin等人,2019b)与TPP治疗的对照组相比,用C26细胞与TPP联合产生的CM孵育的肌管尺寸减小(-23%,第页< 0.01;图1A). 有趣的是,MitoQ保护肌管免受肿瘤衍生因子引起的萎缩(图1A、B). 肌特异性泛素连接酶穆尔1暴露于C26 CM后增加(+98%,第页< 0.001;图1C)虽然这种治疗只能防止阿托金-1(−30%,第页< 0.001,图1C). 然后我们检查了参与丙酮酸脱氢酶复合物(PDH)调节的PDK4的表达,以及能量代谢中的一种关键酶,我们发现该酶在恶病质小鼠的肌肉中上调(Pin等人,2019b). 暴露于C26的肌管显示PDK4在mRNA和蛋白质水平上均增加(+54%第页<0.01和+213%,第页分别<0.001;图1C-E)与PDH磷酸化增加一致(+56%,第页<0.01,图1D、E). 给予MitoQ降低了PDK4基因表达水平以及PDH的磷酸化(分别为−51%和−26%,第页分别<0.01;图1C-E)在C26 CM处理的肌管中。由于肌内脂质代谢在恶病质期间可能受到损害,我们研究了脂肪酶E激素敏感性(LIPE)的表达,已知其参与肌内脂质积累(Haemmerle等人,2002年).利佩在C26+TPP处理的肌管中没有变化,虽然MitoQ给药增强了其表达(+53%,第页< 0.05与。C26+TPP;图1C). 为了验证合成代谢信号是否同样受到治疗的影响,我们评估了AKT的磷酸化,发现服用MitoQ后AKT磷酸化显著增加(MitoQ:+2.5倍,第页< 0.001; C26+MitoQ:+7倍,第页< 0.001与。火力发电厂;图1D、E). 同样,p-4EBP1下调支持合成代谢信号的减少(-33%,第页< 0.01与。TPP)被MitoQ纠正(+33%,第页< 0.05与。C26+TPP;图1D、E).
MitoQ改善C26主机的体重、肌肉质量和虚弱程度
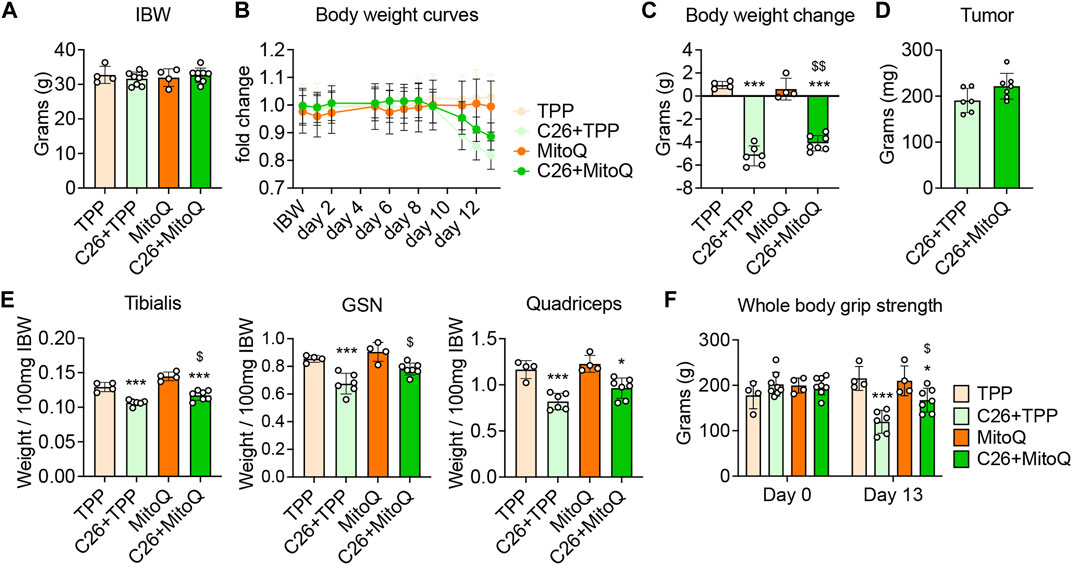
为了确定MitoQ是否足以改善癌症恶病质,CD2F1雄性小鼠在接种C26肿瘤细胞前2周开始接受MitoQ治疗,直至死亡之日。如所示图1A,注射肿瘤时的体重(即11周龄)在所有实验组中具有可比性。C26+TPP宿主在肿瘤植入后9天开始体重显著下降(图2B)而服用MitoQ能够在不影响肿瘤生长的情况下部分纠正身体消瘦(图2B-D). C26+TPP宿主失去了骨骼肌质量,正如胫骨前肌减少(-17%,第页<0.001),腓肠肌(-21%,第页<0.001)和股四头肌(-29%,第页<0.001)肌肉质量(图2E,补充图S1A)随着肌肉力量的降低(−45%,第页< 0.001;图2F,补充图S1B)和肌肉横截面积(−9%,第页< 0.05;补充图S1C). 值得注意的是,C26+MitoQ组受到了胫骨增大(+8%,第页<0.05)和腓肠肌(+12%,第页<0.05)肌肉(图2E,补充图S1A). 同样,通过使用MitoQ(+40%,第页< 0.05;图2F,补充图S1B). 此外,不受治疗影响的C26携带者脾脏质量严重增加(+120%,第页< 0.001与。TPP和+162%,第页< 0.001与。MitoQ),而心脏和肝脏没有变化(补充图S1D). 有趣的是,C26+TPP宿主的白色脂肪组织(WAT)严重耗竭(-58%,第页< 0.001;补充图S1D)而在接受MitoQ治疗的荷瘤小鼠中,尽管没有显著性增加,但增加了50%(第页=0.0675;补充图S1D). 因此,我们决定研究线粒体解偶联蛋白-2(UCP2)的表达,这是WAT中最丰富的UCP亚型,参与能量稳态的调节(Pinkney等人,2000年). 我们发现MitoQ能够减少UCP2型在荷瘤小鼠的WAT中(−59%,第页< 0.05;补充图S1E).
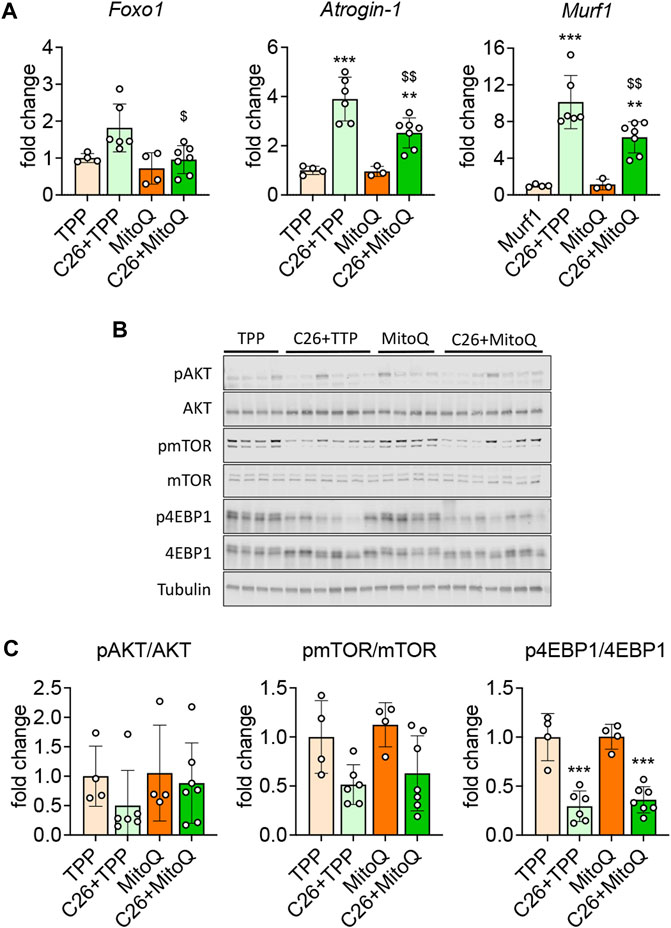
如前所述(霍特等人,2020a)并且与骨骼肌质量的减少一致,蛋白质分解代谢标志物的mRNA表达,例如阿托金-1和MuRF-1型在C26肿瘤宿主的肌肉中显著增加(+289%,第页< 0.001; +912%,第页分别<0.001;图3A)与。火力发电厂。有趣的是,服用MitoQ能够部分恢复C26携带者肌肉中的高分解状态,这表现在C26携带者的mRNA表达减少阿托金-1(−64%,第页< 0.01),MuRF-1型(−62%,第页<0.01),以及福克斯1(−53%,第页< 0.05;图3A). 由于蛋白质降解和合成之间的不平衡会导致骨骼肌萎缩(Bonaldo和Sandri,2013年),我们研究了以前在癌症恶病质中发现改变的合成代谢信号标志物的表达(Huot等人,2020a). 如所示图3B、C所有组的p-AKT/AKT和p-mTOR/mTOR比率没有变化,而恶病质肌肉中的p-4EBP1/4EBP1比率降低(-70%,第页<0.001)。这些数据表明,与我们的体外数据(图1)在AKT、mTOR或4EBP1磷酸化水平不变的情况下,MitoQ治疗无法改善合成代谢信号(图3B、C).
MitoQ改善线粒体平衡和代谢
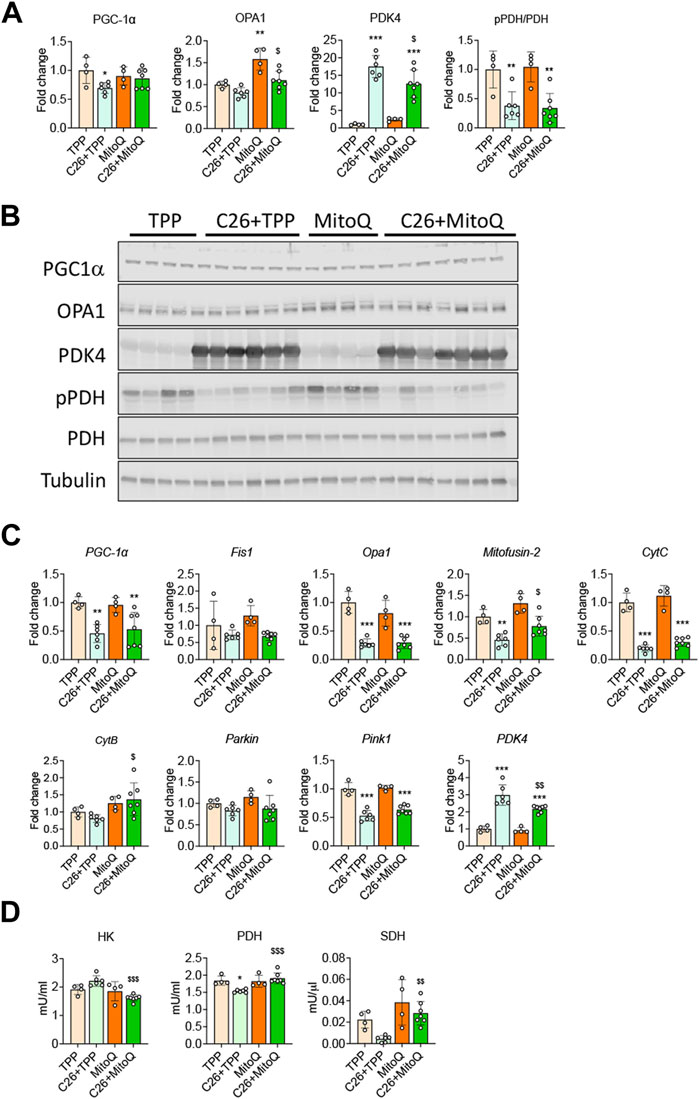
由于MitoQ直接作用于线粒体,我们研究了线粒体生物发生、周转和功能的标记。与我们之前的发现一致(Pin等人,2019b;霍特等人,2020a)C26携带者肌肉中PGC1α的蛋白和基因表达降低,PGC1α是线粒体生物发生的主要调节因子之一(−30%,第页<0.05和-54%,第页分别<0.01;图4A–C). 与TPP处理的宿主相比,服用MitoQ有助于保持C26宿主中PGC1α蛋白的表达(−47%第页<0.05和图4A、B). 关于线粒体动力学和有丝分裂的标记物财务报表1和帕金所有组均保持不变(图4C)而线粒体融合和分裂的调节器OPA1(作战行动1),丝裂霉素-2和粉红色1在C26+TPP宿主的肌肉中被下调。有趣的是,只有丝裂霉素-2治疗后显著改善(+70%,第页< 0.05;图4C). 如所示图4A、B,OPA1蛋白水平不受C26肿瘤生长的显著影响,而MitoQ能够上调健康和荷瘤小鼠肌肉中OPA1的表达(图4A、B). 为了阐明线粒体靶向药物是否改善了氧化功能,我们分析了线粒体特异性酶细胞色素C(CytC)和细胞色素B(CytB)的基因表达,发现只有前者在荷瘤小鼠的肌肉中显著降低,而MitoQ没有提供任何保护作用(图4C). 符合我们的体外数据显示,PDK4在肿瘤宿主的基因和蛋白质水平上均增加,而MitoQ部分阻止了PDK4的过度表达(图4A–C). 此外,在C26模型中PDH磷酸化没有增加,MitoQ治疗在任何组中都没有效果(图4A、B). 为了评估在分子水平上观察到的变化是否也伴随着能量代谢的调节,我们评估了关键酶的活性,包括HK、PDH和SDH。如所示图4DC26+TPP小鼠肌肉中HK和SDH酶活性没有变化,而MitoQ治疗可降低HK(-27%,第页<0.001),SDH增加(+80%,第页< 0.01;图4D)存在C26肿瘤。最后,与PDK4的表达一致,PDH的活性在恶病质肌肉中显著降低(-17%,第页<0.05),并通过服用MitoQ(+24%,第页< 0.001;图4D).
MitoQ治疗可减少肌肉脂肪变性并改善β-氧化
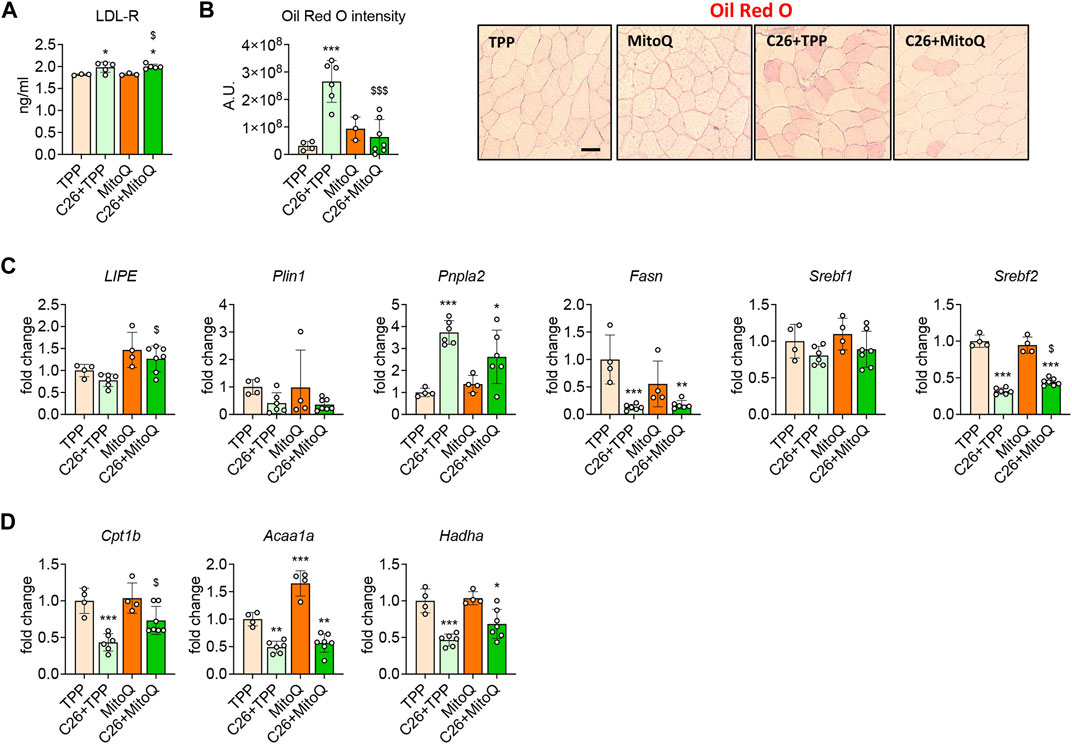
高脂血症提示脂质代谢异常,LDL-R水平升高(Pin等人,2019a)和肌脂肪增多(霍特等人,2020a)表征C26模型,并能反映脂肪作为能量底物的利用变化。因此,我们研究了使用MitoQ是否可以改善这些改变。与我们之前的研究类似(Pin等人,2019a),恶病质宿主肌肉中LDL-R水平升高(+10%,第页< 0.05;图5A)与C26荷瘤小鼠胫骨前横切面油红-O测定的肌内脂肪堆积增加相一致(图5B). 有趣的是,MitoQ治疗并没有调节LDL-R的表达(图5A)虽然它能够减少骨骼肌中的脂肪堆积(图5B). 为了研究导致脂肪积累变化的分子机制,我们评估了对照和肿瘤宿主骨骼肌中脂肪生成和脂解标志物的表达。的级别利佩,脂肪分解的调节器,以及Plin1和斯雷布1参与脂质代谢控制,在肿瘤宿主中没有改变(图5C). 相反,脂肪生成的调节器Fasn公司和Srebf2系列显著降低(−87%和−68%,第页分别<0.001)和Pnpla2型增加了(+273%,第页< 0.001;图5C). MitoQ执政后,利佩和Srebf2系列发现在C26承载者的骨骼肌中显著增加(+63%和+40%,第页分别<0.05;图5C). 由于肌内脂肪积累的变化可能与脂肪作为能量底物的利用改变有关,因此还测定了β-氧化标记物。基因表达Cpt1b型,阿卡亚和哈达在恶病质肌肉中减少(−57%、−45%和−53%,第页分别<0.01;图5D),而仅Cpt1b型受治疗积极调节(+64%,第页< 0.05;图5D).
讨论
癌症恶病质是一种复杂的多因素综合征,其特征是影响多个组织和器官的功能和代谢缺陷。在美国,目前还没有批准的治疗恶病质的方法。我们和其他人强调,癌症引起的恶病质会促进几个器官的代谢紊乱(Pin等人,2019a)这些甚至可能出现在体重明显减轻之前(O'Connell等人,2021年). 特别是,能量状态的变化似乎在推动癌症患者常见的功能损伤方面发挥着关键作用。在这方面,负能量平衡似乎与线粒体改变的出现紧密相关(Fearon等人,2011年). 以前有报道称线粒体代谢改变与骨骼肌萎缩直接相关(Pin等人,2019b),也支持了几项旨在研究线粒体靶向策略治疗恶病质的潜力的研究。在这里,我们研究了使用MitoQ是否能够改善C26肿瘤诱导的恶病质表型,这是一种用于癌症恶病质研究的特征鲜明的临床前模型。
MitoQ是一种以线粒体为靶点的抗氧化剂和膳食补充剂,可以口服,在人类和动物的长期使用中耐受性良好(墨菲,2008;斯诺等人,2010年;Shill等人,2016年). 它由抗氧化剂部分泛喹啉和TPP组成,泛喹啉在泛醌中被氧化,并被复合物II迅速还原以恢复抗氧化能力+阳离子部分,反过来允许其在线粒体内膜内积聚(布鲁姆等人,2018年). 在MitoQ的作用机制中,预防脂质过氧化以及过氧腈、超氧物和蛋白质氧化是最具特点的(墨菲,2008;Zinovkin和Zamyatnin,2019年).
使用MitoQ进行的几项临床前和临床研究揭示了其改善不同病理状态的潜力。例如,研究表明,MitoQ可以改善健康老年人的内皮功能并减少氧化应激(Rossman等人,2018年)而其给药有助于减少小鼠酒精性肝脂肪变性(Chacko等人,2011年)以及减少人类慢性HCV感染引起的肝损伤(Gane等人,2010年). MitoQ治疗还改善了压力超负荷大鼠模型和内毒素诱导心脏功能障碍啮齿动物模型的线粒体功能(Supinski等人,2009年;Ribeiro Junior等人,2018年). 相反,MitoQ并没有改善衰老小鼠模型中骨骼肌的丧失和功能以及氧化损伤(Sakellariou等人,2016年),在对帕金森氏病患者进行的人体临床研究中未发现任何有益影响(斯诺等人,2010年),尽管之前做出了承诺体外观察(Mao等人,2013年).
在这里,我们发现MitoQ治疗能够抵消暴露于肿瘤衍生因子的C2C12培养物中的肌管萎缩。我们的数据与之前的观察结果一致,支持该化合物能够防止暴露于化疗药物阿霉素和紫杉醇的C2C12肌管中肌球蛋白含量的损失(Guigni等人,2018年). 这些有益影响也在我们的体内实验。事实上,MitoQ治疗能够改善C26肿瘤生长诱导的恶病质表型。特别是,接受MitoQ的荷瘤小鼠的体重保持不变,这与之前在服用另一种线粒体靶向化合物SS-31的C26宿主中产生的数据一致(Ballaro等人,2021年),并在我们的模型中部分保留骨骼肌质量。有趣的是,与我们的数据相反,SS-31不能改善C26荷瘤小鼠的肌肉质量(Ballaro等人,2021年)尽管此前有报道称其可以防止肢体制动导致的肌纤维萎缩(Min等人,2011年). 为了保持肌肉质量,我们还发现在接受MitoQ治疗后,C26携带者的肌肉力量得到了改善,这与SS-31治疗足以提高接受化疗的肿瘤宿主的全身力量的证据相一致(Ballaro等人,2021年).
MitoQ保护骨骼肌质量的机制尚不清楚。癌症恶病质期间的肌肉萎缩通常是由蛋白质分解代谢过度激活引起的,主要是泛素蛋白酶体系统(UPS)过度激活所致(Bonaldo和Sandri,2013年;Rom和Reznick,2016年). 一些使用人类和啮齿动物样本的研究有助于确定肌肉特异性E3连接酶的增加表达作为UPS激活的标记(Rom和Reznick,2016年). 在我们的体外和体内研究表明,在服用MitoQ后,E3连接酶Atrogin-1和Murf1的表达得到了部分纠正,这可能是线粒体抗氧化剂保护癌症患者肌肉质量的作用机制之一。这些观察结果也与之前报道的C2C12肌管中E3连接酶负调控的结果相一致,该肌管暴露于原核团羰基氰化物间氯苯腙(CCCP)与MitoQ联合作用下(Lee等人,2020年).
据报道,蛋白质合成代谢的改变也参与了恶病质肌肉的负氮平衡(Tessitore等人,1993年;Kim等人,2021年)这种变化甚至可以在蛋白质降解激活之前检测到(Svaninger等人,1983年). 调节骨骼肌蛋白质合成代谢的主要途径之一是AKT-mTORC途径(Schiaffo等人,2021年). 在我们的体外研究表明,MitoQ治疗强烈增强了CM暴露的肌管中AKT-mTORC通路的激活体内实验表明,服用MitoQ后,肌肉合成代谢信号没有得到任何纠正,这可能是由于整个生物体内营养刺激的多样性所致。总的来说,这些数据表明,使用线粒体靶向药物可以纠正蛋白质分解代谢和合成代谢之间的不平衡,从而至少部分改善肌肉萎缩。未来对不同临床前癌症恶病质模型进行的研究需要验证这些观察结果。
脂肪组织丢失是恶病质的特征之一(Fouladiun等人,2005年;Das等人,2011年). 在我们的体内实验中,我们发现接受MitoQ治疗的肿瘤宿主表现出明显的WAT保留,尽管没有统计学意义,但这促使我们研究脂肪中的能量代谢是否也可以被调节。我们的数据没有揭示UCP1表达的变化,UCP1是WAT褐变的标志物,与癌症恶病质期间的热量浪费有关(Bing等人,2000年)而UCP2水平通过MitoQ治疗恢复。值得注意的是,UCP2的表达与肥胖呈负相关(Oberkofler等人,1998年;Pinkney等人,2000年)发现在高活性氧条件下升高(Patterson等人,2012年)可能起到抗氧化损伤的保护机制(克劳斯等人,2003年). 总之,这些观察结果似乎证实了MitoQ主要通过其抗氧化特性来保护C26携带者的肥胖这一观点。
我们已经描述了在几种临床前小鼠癌症模型中,骨骼肌中与线粒体生物发生、转换和功能相关的几个因素被下调(Pin等人,2018年;霍特等人,2020a;霍特等人,2020b)因此,线粒体环境可能是恶病质治疗干预的关键靶点。尽管本研究中研究的大多数线粒体因子在C26宿主的骨骼肌中被异常调节,但只有MitoQ治疗增加了Mitofusin-2和CytB的表达。最近的数据证实了MitoQ增加C2C12细胞中Mitousin-2表达的能力,从而证实了我们的观察结果(Lee等人,2020年)以及心力衰竭时的心肌(Kim等人,2020年). 有趣的是,MitoQ也能够纠正PDK4的过度表达,尽管它在体内设置。正如我们在最近的一项研究中所显示的那样,这种激酶是PDH和TCA循环的重要负调节因子,其过度表达足以导致肌肉萎缩(Pin等人,2019b). 与这些发现一致,暴露于MitoQ的萎缩C2C12肌管中PDH的磷酸化降低,这很好地反映了由PDH和SDH活性调节支持的线粒体代谢的改善体内同样在这种情况下,我们的数据与显示SS-31在携带C26肿瘤的小鼠的肌肉中增加SDH活性和ATP产生的能力的证据一致(Ballaro等人,2021年). 总之,这些数据突出了MitoQ调节肿瘤宿主氧化代谢的能力。
我们之前在C26模型中显示了系统性葡萄糖需求增加的证据,这与纤维类型的氧化-糖酵解转变和HK活性增加相关(Pin等人,2019a;霍特等人,2020a). 相反,在C26宿主的系统水平上发现β-氧化显著降低(Pin等人,2019a). 临床前动物模型和临床研究结果表明,恶病质期间血浆中甘油、游离脂肪酸、甘油三酯和低密度脂蛋白颗粒水平较高(Gercel-Taylor等人,1996年;Pin等人,2019a;Riccardi等人,2020年)可能是脂肪组织消耗所致(Dalal,2019年). 在这种情况下,LDL-R水平不变,肌内脂肪积累减少,表明MitoQ在一定程度上能够改善脂质作为主要能量来源的利用利佩和Cpt1b型在MitoQ给药小鼠的肌肉中,表明该治疗增强了脂解和β-氧化。
总之,我们的研究表明,MitoQ治疗可以部分纠正C26大肠肿瘤诱导的恶病质表型。我们的宏观观察表明,肌肉质量和力量的改善与服用米托Q后肌肉能量代谢正常化的证据相关,与HK活性降低和TCA循环改善一致,总的来说,这表明氧化-糖酵解代谢转变发生了逆转,而这种转变通常是恶病质肌肉的特征。此外,我们的数据表明,MitoQ可以提高骨骼肌内积累的脂质的利用率,从而有助于重新平衡能量代谢。
尽管有这些有希望的观察结果,但我们意识到我们研究的一些局限性。例如,我们在癌症恶病质临床前模型中进行的实验方法包括在接种肿瘤之前用MitoQ进行2周的预处理,因此很难与临床设置相类似。为了验证MitoQ作为一种抗恶病质治疗策略的有效性,需要进一步的研究来确定其对抗啮齿动物肌肉萎缩的能力,因为啮齿动物已经有证据表明存在恶病质。重要的是,之前在长期临床前和临床研究中,MitoQ被作为膳食补充剂进行了研究,发现其具有较高的安全性和有限的毒性。因此,未来的研究将针对健康受试者和长期服用该药物的癌症患者测试MitoQ有益的抗恶病质特性(墨菲,2008;斯诺等人,2010年;Shill等人,2016年). 最后,在我们的研究中,我们没有报告肿瘤宿主骨骼肌中MitoQ的抗氧化特性。记住我们之前的观察结果,化疗与癌症类似,也会促进线粒体异常和活性氧水平升高,而这反过来又会导致恶病质患者骨骼肌功能障碍的发展(Barreto等人,2016a;Barreto等人,2016年b;Brown等人,2017年;Ballaro等人,2021年;Beltra等人,2021年)未来的研究还需要验证MitoQ与常规使用的抗癌药物联合使用的抗恶病质特性。
数据可用性声明
支持本文结论的原始数据将由作者提供,没有任何不当保留。
道德声明
该动物研究由印第安纳大学医学院动物护理和使用委员会审查和批准。
作者贡献
FP和AB构思并设计了实验;FP和JH执行了体外和体内恶病质的实验和分子表征;FP和AB撰写并编辑了论文。
基金
本研究得到了印第安纳大学外科和耳鼻咽喉头颈外科的支持,并获得了V癌症研究基金会(V2017-021)、美国癌症协会(研究学者基金会132013-RSG-18-010-01-CCG)的资助国家关节炎、肌肉骨骼和皮肤病研究所(R01AR079379)向AB.JH提供了NIH T32机构培训拨款(AR065971)。#12G10抗Tubulin单克隆抗体(由Frankel J和Nelsen EM在爱荷华州大学开发)、#MF-20抗肌球蛋白重链单克隆抗体,由Fischman DA在康奈尔大学开发)和#MANDRA1(7A10)抗肌萎缩蛋白单抗(由Morris GE在NE Wales Institute开发)从NIH NICHD创建的发育研究杂交瘤银行获得,该银行位于爱荷华州爱荷华市爱荷华大学生物系。MitoQ是MitoQ Limited(新西兰奥克兰)的一份礼物。
利益冲突
作者声明,该研究是在没有任何可能被解释为潜在利益冲突的商业或金融关系的情况下进行的。
出版商备注
本文中表达的所有声明仅为作者的声明,不一定代表其附属组织的声明,也不一定代表出版商、编辑和审稿人的声明。任何可能在本文中进行评估的产品,或制造商可能提出的索赔,都不受出版商的保证或认可。
补充材料
本文的补充材料可以在以下网站上找到:https://www.frontiersin.org/articles/10.3389/fcell.2022.861622/full#补充-材料
工具书类
Aversa,Z.、Pin,F.、Lucia,S.、Penna,F.和Verzaro,R.、Fazi,M.等人(2016)。恶病质癌症患者骨骼肌中诱导自噬。科学。代表。6, 30340. doi:10.1038/srep30340
PubMed摘要|CrossRef全文|谷歌学者
Ballaró,R.、Beltrá,M.、De Lucia,S.、Pin,F.、Ranjbar,K.、Hulmi,J.J.等人(2019年)。小鼠适度运动可改善癌症加化疗引起的肌肉消耗和线粒体改变。财务会计准则委员会j。33, 5482–5494. doi:10.1096/fj.201801862r
PubMed摘要|CrossRef全文|谷歌学者
Ballaro,R.、Lopalco,P.、Audrito,V.、Beltra,M.、Pin,F.、Angelini,R.等人(2021年)。SS-31靶向线粒体可改善癌症和化疗所致恶病质患者的全身能量状态。癌症(巴塞尔)13850年。doi:10.3390/癌症13040850
PubMed摘要|CrossRef全文|谷歌学者
Baracos,V.E.、Devivo,C.、Hoyle,D.H.和Goldberg,A.L.(1995年)。肝癌恶病质大鼠骨骼肌ATP-泛素蛋白酶体途径的激活。美国生理学杂志-内分泌。Metab公司。268,E996–E1006。doi:10.1152/ajpendo.1995.268.5.e996
CrossRef全文|谷歌学者
Barreto,R.、Mandili,G.、Witzmann,F.A.、Novelli,F.、Zimmers,T.A.和Bonetto,A.(2016a)。癌症和化疗通过激活共同的信号通路导致肌肉丧失。前面。生理学。7, 472. doi:10.3389/fphys.2016.00472
PubMed摘要|CrossRef全文|谷歌学者
Barreto,R.、Waning,D.L.、Gao,H.、Liu,Y.、Zimmers,T.A.和Bonetto,A.(2016b)。化疗相关恶病质与线粒体耗竭和ERK1/2和P38 MAPK的激活有关。Oncotarget公司7, 43442–43460. doi:10.18632/目标9779
PubMed摘要|CrossRef全文|谷歌学者
Beltra,M.、Pin,F.、Ballaro,R.、Costelli,P.和Penna,F.(2021)。癌症恶病质中的线粒体功能障碍:对肌肉健康和再生的影响。细胞10, 3150. doi:10.3390/cells1013150
PubMed摘要|CrossRef全文|谷歌学者
Bing,C.、Brown,M.、King,P.、Collins,P.,Tisdale,M.J.和Williams,G.(2000)。MAC16诱导的癌症恶病质中棕色脂肪解偶联蛋白(UCP)1、骨骼肌UCP2和UCP3的基因表达增加。癌症研究。60, 2405–2410.
PubMed摘要|谷歌学者
Bonaldo,P.和Sandri,M.(2013年)。肌肉萎缩的细胞和分子机制。数字化信息系统。模型。机械。6, 25–39. doi:10.1242/dmm.010389
PubMed摘要|CrossRef全文|谷歌学者
Bonetto,A.、Andersson,D.C.和Waning,D.L.(2015)。小鼠肌肉质量和力量的评估。Bonekey代表。4, 732. doi:10.1038/bonekey.2015.101
PubMed摘要|CrossRef全文|谷歌学者
Broome,S.C.、Woodhead,J.S.T.和Merry,T.L.(2018年)。线粒体靶向抗氧化剂与骨骼肌功能。抗氧化剂(巴塞尔)7, 107. doi:10.3390/antiox7080107
PubMed摘要|CrossRef全文|谷歌学者
Brown,J.L.、Rosa-Caldwell,M.E.、Lee,D.E.、Blackwell,T.A.、Brown,L.A.、Perry,R.A.等人(2017年)。荷瘤小鼠肿瘤恶病质进展中,线粒体退化先于肌肉萎缩的发展。J.肌肉恶病质8926–938之间。doi:10.1002/jcsm.12232
CrossRef全文|谷歌学者
Busquets,S.、Almendro,V.、Barrero,E.、Figueras,M.、Argiles,J.M.和López-Soriano,F.J.(2005)。骨骼肌中UCP基因表达的激活可能与循环脂肪酸和食物摄入无关。活性氧在小鼠癌症恶病质模型中的作用。FEBS信函。579, 717–722. doi:10.1016/j.febslet.2004.12.050
PubMed摘要|CrossRef全文|谷歌学者
Chacko,B.K.、Srivastava,A.、Johnson,M.S.、Benavides,G.A.、Chang,M.J.、Ye,Y.等人(2011年)。线粒体靶向泛醌(MitoQ)降低乙醇依赖性微小和巨大肝脂肪变性。肝病学54, 153–163. doi:10.1002/hep.24377
PubMed摘要|CrossRef全文|谷歌学者
Collins,P.、Bing,C.、Mcculloch,P.和Williams,G.(2002年)。肌肉UCP-3 mRNA水平在与人类胃肠道腺癌相关的体重减轻中升高。英国癌症杂志86, 372–375. doi:10.1038/sj.bjc.6600074
CrossRef全文|谷歌学者
Das,S.K.、Eder,S.、Schauer,S、Diwoky,C.、Temmel,H.、Guertl,B.等人(2011年)。脂肪甘油三酯脂肪酶与癌症相关恶病质的关系。科学333, 233–238. doi:10.1126/科学.1198973
PubMed摘要|CrossRef全文|谷歌学者
Dewys,W.D.,Begg,C.,Lavin,P.T.,Band,P.R.,Bennett,J.M.,Bertino,J.R.等人(1980年)。癌症患者化疗前体重减轻对预后的影响。东方合作肿瘤小组。美国医学杂志。69, 491–497. doi:10.1016/s0149-2918(05)80001-3
CrossRef全文|谷歌学者
Fearon,K.、Strasser,F.、Anker,S.D.、Bosaeus,I.、Bruera,E.、Fainsinger,R.L.等人(2011年)。癌症恶病质的定义和分类:国际共识。柳叶刀Oncol。12, 489–495. doi:10.1016/s1470-2045(10)70218-7
PubMed摘要|CrossRef全文|谷歌学者
Fearon,K.C.H.、Glass,D.J.和Guttridge,D.C.(2012年)。癌症恶病质:介体、信号传递和代谢途径。Cel Metab公司。16, 153–166. doi:10.1016/j.cmet.2012.06.011
CrossRef全文|谷歌学者
Fouladiun,M.、Körner,U.、Bosaeus,I.、Daneryd,P.、Hyltander,A.和Lundholm,K.G.(2005)。非选择性癌症患者在姑息治疗中脂肪和瘦组织区域分布的身体成分和时间进程变化与食物摄入量、代谢、运动能力和激素相关。癌症103, 2189–2198. doi:10.1002/cncr.21013
PubMed摘要|CrossRef全文|谷歌学者
Gane,E.J.、Weilert,F.、Orr,D.W.、Keogh,G.F.、Gibson,M.、Lockhart,M.M.等人(2010年)。针对丙型肝炎患者的II期研究显示,线粒体靶向抗氧化剂米托醌可减轻肝损伤。肝脏Int。30, 1019–1026. doi:10.1111/j.1478-3231.2010.02250.x
PubMed摘要|CrossRef全文|谷歌学者
Gercel-Taylor,C.、Doering,D.L.、Kraemer,F.B.和Taylor,D.D.(1996)。卵巢癌患者的正常系统脂质代谢异常。妇科。昂科尔。60, 35–41. doi:10.1006/gyno.1996.008
PubMed摘要|CrossRef全文|谷歌学者
Ghosh,A.、Chandran,K.、Kalivendi,S.V.、Joseph,J.、Antholine,W.E.、Hillard,C.J.等人(2010年)。帕金森病模型中线粒体靶向药物的神经保护作用。自由基。生物医学。49, 1674–1684. doi:10.1016/j.freeradbiomed.2010.08.028
PubMed摘要|CrossRef全文|谷歌学者
Guigni,B.A.、Callahan,D.M.、Tourville,T.W.、Miller,M.S.、Fiske,B.、Voigt,T.等人(2018年)。乳腺癌患者骨骼肌萎缩和功能障碍:化疗衍生氧化应激的作用。美国生理学杂志-细胞生理学。315,C744–C756。doi:10.1152/ajpcell.00002.2018
CrossRef全文|谷歌学者
Haemmerle,G.、Zimmermann,R.、Hayn,M.、Theussl,C.、Waeg,G.和Wagner,E.等人(2002年)。小鼠激素敏感性脂肪酶缺乏导致脂肪组织、肌肉和睾丸中的甘油三酯积累。生物学杂志。化学。277, 4806–4815. doi:10.1074/jbc.m110355200
CrossRef全文|谷歌学者
Hayes,S.、Battistutta,D.和Newman,B.(2005年)。乳腺癌诊断六个月后的客观和主观上半身功能。乳腺癌研究治疗。94, 1–10. doi:10.1007/s10549-005-5991-z
PubMed摘要|CrossRef全文|谷歌学者
He,W.A.、Berardi,E.、Cardillo,V.M.、Achariya,S.、Aulino,P.、Thomas Ahner,J.等人(2013年)。NF-kappaB介导的肌肉微环境中Pax7失调促进癌症恶病质。临床杂志。投资。123, 4821–4835. doi:10.11172/jci68523
CrossRef全文|谷歌学者
霍特,J.R.、诺辛格,L.J.、宾,F.、纳拉西姆汉,A.、齐默尔斯,T.A.、奥康奈尔,T.M.等人(2020a)。结直肠肝转移瘤的形成导致肌肉骨骼和代谢异常,与恶病质加重一致。JCI洞察力5,e136687。doi:10.1172/jci.insight.136687
CrossRef全文|谷歌学者
Huot,J.R.、Pin,F.、Narasimhan,A.、Novinger,L.J.、Keith,A.S.、Zimmers,T.A.等人(2020b)。ACVR2B拮抗剂作为转移性结直肠癌恶病质多器官扰动的对策。J.肌肉恶病质11, 1779–1798. doi:10.1002/jcsm.12642
CrossRef全文|谷歌学者
Kim,S.,Song,J.,Ernst,P.,Latimer,M.N.,Ha,C.-M.,Goh,K.Y.等人(2020年)。MitoQ调节氧化还原相关的非编码RNA,以在压力超负荷心力衰竭中保持线粒体网络的完整性。美国生理学杂志。心脏循环。生理学。318,H682–H695。doi:10.1152/ajpheart.00617.2019
CrossRef全文|谷歌学者
Kim,H.G.、Huot,J.R.、Pin,F.、Guo,B.、Bonetto,A.和Nader,G.A.(2021年)。癌症恶病质中rDNA转录降低降低骨骼肌核糖体容量和蛋白质合成。FASEB J。35,第21335页。doi:10.1096/fj.202002257R
PubMed摘要|CrossRef全文|谷歌学者
Krauss,S.、Zhang,C.-Y.、Scorrano,L.、Dalgaard,L.T.、St-Pierre,J.、Grey,S.T.等人(2003年)。超氧化物介导的解偶联蛋白2激活导致胰腺β细胞功能障碍。临床杂志。投资。112, 1831–1842. doi:10.1172/jci200319774
CrossRef全文|谷歌学者
Lee,Y.J.、Kim,G.H.、Park,S.I.和Lim,J.H.(2020年)。线粒体i‐AAA蛋白酶Yme1L的下调通过FoxO3a和肌抑制素激活诱导肌肉萎缩。J.细胞。分子医学。24, 899–909. doi:10.1111/jcmm.14799
PubMed摘要|CrossRef全文|谷歌学者
Luctkar-Flude,M.、Groll,D.、Woodend,K.和Tranmer,J.(2009年)。老年癌症患者的疲劳和体力活动:一项为期六个月的随访研究。昂科尔。努斯。论坛36, 194–202. doi:194-202年10月188/09日
PubMed摘要|CrossRef全文|谷歌学者
Mao,P.、Manczak,M.、Shirendeb,U.P.和Reddy,P.H.(2013)。MitoQ是一种线粒体靶向抗氧化剂,在实验性自身免疫性脑脊髓炎小鼠多发性硬化模型中延缓疾病进展并减轻发病机制。生物化学。生物物理学。Acta(Bba)-摩尔基础差。1832, 2322–2331. doi:10.1016/j.bbadis.2013.09.005
CrossRef全文|谷歌学者
Meeske,K.、Smith,A.W.、Alfano,C.M.、Mcgregor,B.A.、Mctiernan,A.、Baumgartner,K.B.等人(2007年)。乳腺癌幸存者诊断后2至5年的疲劳:HEAL研究报告。资格。生命资源。16, 947–960. doi:10.1007/s11136-007-9215-3
PubMed摘要|CrossRef全文|谷歌学者
Min,K.、Smuder,A.J.、Kwon,O.-s.、Kavazis,A.N.、Szeto,H.H.和Powers,s.K.(2011)。线粒体靶向抗氧化剂保护骨骼肌免受固定化诱导的肌肉萎缩。J.应用。生理学。(1985)111, 1459–1466. doi:10.1152/japplphysical.00591.2011
CrossRef全文|谷歌学者
Murphy,M.P.(2008)。靶向线粒体的亲脂阳离子。生物化学。生物物理学。Acta(Bba)-生物能源。1777, 1028–1031. doi:10.1016/j.bbabio.2008.03.029
CrossRef全文|谷歌学者
Oberkofler,H.、Liu,Y.M.、Esterbauer,H.,Hell,E.、Krempler,F.和Patsch,W.(1998)。解偶联蛋白-2基因:肥胖者腹膜内脂肪组织中mRNA表达降低。糖尿病学41, 940–946. doi:10.1007/s001250051011
PubMed摘要|CrossRef全文|谷歌学者
O'Connell,T.M.、Golzarri-Arroyo,L.、Pin,F.、Barreto,R.、Dickinson,S.L.、Couch,M.E.等人(2021年)。癌症恶病质早期检测的代谢生物标志物。前Cel。开发生物。9, 720096. doi:10.3389/fcell.2021.720096
CrossRef全文|谷歌学者
Patterson,A.D.、Shah,Y.M.、Matsubara,T.、Krausz,K.W.和Gonzalez,F.J.(2012)。过氧化物酶体增殖物激活受体α诱导解偶联蛋白2保护对乙酰氨基酚诱导的肝毒性。肝病学56, 281–290. doi:10.1002/hep.25645
PubMed摘要|CrossRef全文|谷歌学者
Penna,F.、Costamagna,D.、Fanzani,A.、Bonelli,G.、Baccino,F.M.和Costelli,P.(2010年)。ERK抑制可预防荷瘤小鼠的肌肉消耗和肌生成受损。公共科学图书馆一号5,e13604。doi:10.1371/journal.pone.0013604
PubMed摘要|CrossRef全文|谷歌学者
Penna,F.、Costamagna,D.、Pin,F.,Camperi,A.、Fanzani,A.、Chiarpotto,E.M.等人(2013年)。自噬降解导致癌症恶病质中的肌肉消耗。美国病理学杂志。182, 1367–1378. doi:10.1016/j.ajpath.2012.12.023
CrossRef全文|谷歌学者
Penna,F.、Ballaró,R.、Beltraá,M.、De Lucia,S.和Costelli,P.(2018年)。调节新陈代谢以改善癌症引起的肌肉消耗。氧化物。医学委员会。朗格夫。2018, 7153610. doi:10.1155/2018/7153610
PubMed摘要|CrossRef全文|谷歌学者
Penna,F.、Ballaró,R.、Martinez-Cristobal,P.、Sala,D.、Sebastian,D.、Busquets,S.等人(2019年)。自噬加剧癌症恶病质中的肌肉消耗并损害线粒体功能。分子生物学杂志。431, 2674–2686. doi:10.1016/j.jmb.2019.05.032
PubMed摘要|CrossRef全文|谷歌学者
Penna,F.、Ballaró,R.和Costelli,P.(2020年)。氧化还原平衡:癌症恶病质肌肉消耗干预的目标?抗氧化剂。氧化还原信号。33, 542–558. doi:10.1089/ars.2020.8041
PubMed摘要|CrossRef全文|谷歌学者
Pin,F.、Busquets,S.、Toledo,M.、Camperi,A.、Lopez-Soriano,F.J.、Costelli,P.等人(2015)。运动训练和促红细胞生成素联合预防癌症引起的肌肉改变。Oncotarget公司43202年至43215年。doi:10.18632/目标6439
PubMed摘要|CrossRef全文|谷歌学者
Pin,F.、Barreto,R.、Kitase,Y.、Mitra,S.、Erne,C.E.、Novinger,L.J.等人(2018年)。卵巢癌异种移植物生长导致肌肉和骨量减少:癌症恶病质研究的新模型。J.肌肉恶病质9, 685–700. doi:10.1002/jcsm.12311
CrossRef全文|谷歌学者
Pin,F.、Barreto,R.、Couch,M.E.、Bonetto,A.和O'connell,T.M.(2019a)。癌症和化疗引起的恶病质对能量代谢产生明显干扰。J.肌肉恶病质10, 140–154. doi:10.1002/jcsm.12360
CrossRef全文|谷歌学者
Pin,F.、Novinger,L.J.、Huot,J.R.、Harris,R.A.、Couch,M.E.、O'connell,T.M.等人(2019b)。PDK4导致癌症恶病质的代谢改变和肌肉萎缩。FASEB j。33, 7778–7790. doi:10.1096/fj.201802799r
PubMed摘要|CrossRef全文|谷歌学者
Pinkney,J.H.、Boss,O.、Bray,G.A.、Bulmer,K.、Coppack,S.W.和Mohamed-Ali,V.(2000)。人脂肪组织解偶联蛋白-2基因表达的生理关系在体内1临床杂志。内分泌。Metab公司。85, 2312–2317. doi:10.1210/jcem.85.66622
CrossRef全文|谷歌学者
Ribeiro Junior,R.F.、Dabkowski,E.R.、Shekar,K.C.、O´Connell,K.A.、Hecker,P.A.和Murphy,M.P.(2018年)。MitoQ改善压力负荷所致心力衰竭患者的线粒体功能障碍。自由基。生物医学。117, 18–29. doi:10.1016/j.freeradbiomed.2018.012
PubMed摘要|CrossRef全文|谷歌学者
Riccardi,D.M.D.R.,Das Neves,R.X.,De Matos-Neto,E.M.,Camargo,R.G.,Lima,J.D.C.,Radloff,K.等人(2020年)。癌症恶病质患者的血脂谱和全身炎症。前面。螺母。7, 4. 数字对象标识代码:10.3389/fnut.2020.00004
PubMed摘要|CrossRef全文|谷歌学者
Rom,O.和Reznick,A.Z.(2016)。E3泛素连接酶MuRF-1和MAFbx在骨骼肌质量损失中的作用。自由基。生物医学。98, 218–230. doi:10.1016/j.freeradbiomed.2015年12月31日
PubMed摘要|CrossRef全文|谷歌学者
Rossman,M.J.、Santos-Parker,J.R.、Steward,C.A.C.、Bispham,N.Z.、Cuevas,L.M.、Rosenberg,H.L.等人(2018年)。长期补充线粒体抗氧化剂(MitoQ)可改善健康老年人的血管功能。高血压71, 1056–1063. doi:10.1161/高血压.117.10787
PubMed摘要|CrossRef全文|谷歌学者
Sakellariou,G.K.,Pearson,T.,Lightfoot,A.P.,Nye,G.A.,Wells,N.,Giakoumaki等人(2016)。长期服用线粒体靶向抗氧化剂甲磺酸线粒体醌不能减轻与年龄相关的氧化损伤或挽救与骨骼肌衰老相关的肌肉质量和功能损失。FASEB j。30, 3771–3785. doi:10.1096/fj.201600450r
PubMed摘要|CrossRef全文|谷歌学者
Sanders,P.M.和Tisdale,M.J.(2004)。锌-α2-糖蛋白(ZAG)对骨骼肌和脂肪组织解偶联蛋白表达的影响。癌症快报。212, 71–81. doi:10.1016/j.canlet.2004.03.021
PubMed摘要|CrossRef全文|谷歌学者
Schiaffo,S.、Reggiani,C.、Akimoto,T.和Blaauw,B.(2021年)。骨骼肌肥大的分子机制。第Jnd号8, 169–183. doi:10.3233/jnd-200568
PubMed摘要|CrossRef全文|谷歌学者
Shill,D.D.、Southern,W.M.、Willingham,T.B.、Lansford,K.A.、Mccully,K.K.和Jenkins,N.T.(2016)。线粒体特异性抗氧化剂补充不会影响耐力运动训练诱导的循环血管生成细胞适应、骨骼肌氧化能力或最大摄氧量。《生理学杂志》。594,7005–7014。doi:10.1113/jp272491
CrossRef全文|谷歌学者
Shum,A.M.Y.、Mahendradatta,T.、Taylor,R.J.、Painter,A.B.、Moore,M.M.、Tsoli,M.等人(2012年)。肿瘤诱导骨骼肌耗损中MEF2C信号传导的中断以及肿瘤和线粒体完整性的丧失。老化4, 133–143. doi:10.18632/页.100436
PubMed摘要|CrossRef全文|谷歌学者
Snow,B.J.、Rolfe,F.L.、Lockhart,M.M.、Frampton,C.M.、O'sullivan,J.D.、Fung,V.等人(2010年)。一项评估线粒体靶向抗氧化剂MitoQ作为帕金森病疾病改善治疗的双盲、安慰剂对照研究。压敏电阻。迪索德。25, 1670–1674. doi:10.1002/mds.23148
PubMed摘要|CrossRef全文|谷歌学者
Sun,L.,Quan,X.-Q.和Yu,S.(2015)。晚期癌症恶病质流行病学调查及诊治现状分析。螺母。癌症67, 1056–1062. doi:10.1080/01635581.2015.1073753
PubMed摘要|CrossRef全文|谷歌学者
Supinski,G.S.、Murphy,M.P.和Callahan,L.A.(2009年)。MitoQ管理可预防内毒素引起的心脏功能障碍。美国生理学杂志-雷古尔。集成。公司。生理学。297,R1095–R1102。doi:10.1152/ajpregu.90902.2008年
CrossRef全文|谷歌学者
Svaninger,G.、Bennegard,K.、Ekman,L.、Ternell,M.和Lundholm,K.(1983年)。缺乏证据表明减肥荷瘤小鼠骨骼肌分解率升高。J.国家。癌症研究所。71, 341–346.
谷歌学者
Tessitore,L.、Costelli,P.、Bonetti,G.和Baccino,F.M.(1993年)。实验动物的癌症恶病质、营养不良和组织蛋白周转。架构(architecture)。生物化学。生物物理学。306, 52–58. doi:10.1006/abbi.1993.1479
PubMed摘要|CrossRef全文|谷歌学者
VanderVeen,B.N.、Fix,D.K.和Carson,J.A.(2017年)。癌症恶病质期间骨骼肌线粒体动力学、线粒体吞噬和生物发生的破坏:炎症的作用。氧化物。医学委员会。朗格夫。2017, 3292087. doi:10.1155/2017/3292087
PubMed摘要|CrossRef全文|谷歌学者
von Haehling,S.和Anker,S.D.(2014)。恶病质的患病率、发病率和临床影响:事实和数字——2014年更新。J.肌肉恶病质5, 261–263. doi:10.1007/s13539-014-0164-8
CrossRef全文|谷歌学者
Zinovkin,R.A.和Zamyatnin,A.A.(2019年)。线粒体靶向药物。Cmp公司12, 202–214. doi:10.2174/1874467212666181127151059
PubMed摘要|CrossRef全文|谷歌学者