血管内皮生长因子A(VEGFA)亚型治疗已被证明可以改变精原干细胞的稳态。因此,我们生成了pDmrt1-Cre;素食主义者−/−(敲除,KO)小鼠pDmrt1-核心用鞭子抽打老鼠素食主义者小鼠试验支持细胞和生殖细胞中所有VEGFA亚型的丢失是否会损害精子发生。第一次交配时,KO雄性花了14天的时间让对照雌性怀孕(P(P)<.02),并且在随后的所有分娩间隔(9天;P(P)< .07). 杂合子雄性每窝繁殖的幼崽较少(P(P)<.03),第1胎产仔后的时间延长了10天(P(P)<.05)使雌性受孕,这表明生育能力的丧失更为渐进。收集了6个月龄雄性小鼠的生殖器官。附睾体中每个小管的精子较少(P(P)<.001)和较少ZBTB16染色的未分化精原细胞(P(P)<.003)。睾丸信使核糖核酸丰度密件抄送2(P(P)< .02),Bcl2:钡(P(P)< .02),神经元3(P(P)<.007),以及Ret公司更大(P(P)=0.0005),倾向于Sin3a公司总体上趋于减少福克斯1(P(P)<.07)。CD31和VE-Cadherin的免疫荧光在睾丸血管中无差异;然而,CD31-阳性染色仅在KO睾丸的未分化精原细胞中可见。因此,支持细胞和生殖细胞中VEGFA亚型的丢失改变了长期维持未分化精原细胞所必需的基因,最终减少精子数量并导致生育能力低下。
男性相关因素,如精子数低和精子发生异常,是造成美国210万对夫妇50%不育的原因。男性不育病例的发病率有所增加,导致了新的排卵障碍综合征(1). 因为睾丸发育不全综合征可能涉及一系列轻微到异常的精子发生(2)精原干细胞(SSC)内环境平衡失调可能是一个原因。对SSC发展的相关因素知之甚少;然而,我们确实知道SSC与称为生殖细胞的原始生殖细胞不同,在睾丸发育过程中,生殖细胞必须从睾丸索(小管)中心迁移到外围,并且它们也会进行增殖(自我更新)。这一过程发生在啮齿类动物出生后第3-5天,在胚胎第17天左右开始有丝分裂阻滞(三–5). 如果没有发生生殖细胞迁移,这些细胞会发生凋亡,SSC不会形成。因此,影响SSC形成的因素也可能影响SSC的扩张,而抑制这些因素可能会导致凋亡和SSC池减少。SSC自我更新和分化之间的平衡是维持精子发生和男性生育能力所必需的。
血管内皮生长因子A(VEGFA)是一种负责血管发育和内皮细胞迁移的旁分泌生长因子。虽然VEGFA亚型最初被认为是血管生长和维持的调节因子,但其生物活性远远超出了血管生物学。我们已经证明,体内睾丸中VEGFA亚型活性的改变会导致SSC自我更新和定植生精小管的能力发生显著变化(6). 此外,正常睾丸、前列腺、精囊和精液中VEGFA的表达表明VEGFA可能参与男性生育(7,8).
这个素食主义者该基因由八个外显子组成,这些外显子可以选择性剪接以产生不同的促血管生成和抗血管生成亚型。一般来说,促血管生成亚型促进血管系统的发育,而抗血管生成亚型则抑制血管的发育(9,10). 研究表明,在E14、E16、E19、出生后第5天和第5天,特定生殖细胞周围和一些生殖细胞细胞质中VEGFA阳性染色(11). 在小鼠生殖细胞向SSC转化时,VEGFA_164在P3-P5的生殖细胞中表达,此后表达降低。此外,抗血管生成VEGFA亚型存在于E14和E16的一些生殖细胞、P0的支持细胞和生殖细胞中的间质和微弱间质、P5后的未分化精原细胞以及P20的初级精母细胞和圆形精子细胞中(6,12). 我们实验室的最新数据表明,VEGFA亚型可以通过SSC移植到受体中来影响SSC的更新和增殖。抗血管生成亚型VEGFA_165B抑制SSC定植,表明它们抑制SSC自我更新或刺激SSC分化。促血管生成同种型VEGFA_164的抗体也抑制受体中菌落的形成,表明VEGFA_164对SSC的更新是必要的(6). 总之,这些数据表明,VEGFA亚型的平衡对于调节SSC库和雄性生殖寿命是必要的。
在目前的研究中,我们提出VEGFA在SSC的更新和分化中发挥着重要作用。为了研究VEGFA在体内的作用,我们用一种新的抗血管生成和促血管生成的方法,制备了Sertoli细菌细胞特异性VEGFA亚型null转基因小鼠pDmrt1-核心本研究的目的是确定支持性生殖细胞特异性VEGFA缺失对男性生殖表型的体内影响,包括参与调节未分化精原细胞、精子发生和睾丸形态发生的基因。
材料和方法
动物
使用Cre-lox方法获得Sertoli和细菌细胞VEGFA敲除(KO)小鼠,使用素食主义者漂浮的老鼠(13)与猪双性恋和mab-3相关转录因子1交配(图纸-1-1) 发起人(pDmrt-1型)-Cre小鼠(14). 纯合子素食主义者将漂浮的小鼠与抗体阳性的小鼠交配pDmrt-1-Cre公司等位基因。得到的F1杂合小鼠首先与纯合小鼠交配素食主义者用鞭子抽签创始人以产生F2群体,然后收集用于研究(参见补充图1,发表于内分泌学会期刊在线网站http://endo.endojournals.org). 对照组和纯合KO小鼠来自F2代。我们使用了Cre-negative素食主义者−/−或素食主义者+/负极小鼠作为对照组和C阳性素食主义者−/−小鼠作为KO(pDmrt1-Cre;素食主义者−/−)或C阳性素食主义者+/负极作为杂合子(Het)。图纸1在E10.5的中性小鼠性腺前体细胞中表达,前体细胞在雄性中分化为支持细胞,在雌性中分化为颗粒细胞。老鼠图纸1在E12.5时在睾丸内的支持细胞和生殖细胞以及卵巢内的体细胞和生殖电池中表达。通过E13.5,在卵巢体细胞中不再检测到表达。的表达式图纸1睾丸中从E13.5增加到E15.5。生殖细胞表达图纸1成熟前精原细胞中可检测到mRNA(15),并且在所有阶段小管的支持细胞中检测到表达,直到第一次生精波(16,17). 这个pDmrt1型该基因的表达与小鼠相似图纸1(14). 在我们的pDmrt1-Cre;素食主义者−/−小鼠,Cre重组酶活性由pDmrt1启动子和切除素食主义者基因。外显子3存在于促血管生成和抗血管生成亚型中;因此,所有素食主义者异型体在细胞中受到影响图纸1表示为。对6个月龄雄性小鼠(n=9个对照组,n=8 KO)的体重和器官重量进行评估,并在处死时收集睾丸、附睾、前列腺、精囊、肾脏和肾上腺进行分析。
所有动物方案均由内布拉斯加州大学动物护理和使用研究所委员会根据《国家卫生研究院实验动物护理与使用指南》批准。所有动物模型都是通过口头或书面MTA协议从合作研究人员处获得的。因此,通讯作者无权自由分发这些鼠标行。
基因分型
用蛋白酶K消化法从尾部样品中提取基因组DNA,然后用6 M NaCl提取和乙醇沉淀法通过常规PCR进行基因分型。在54°C的退火温度下,DNA扩增30个周期,以检测絮状物素食主义者.的表达式pDmrt1-核心从55°C退火的DNA中检测到,并用正向引物扩增34个周期pDmrt1和一个相反的Cre公司.
从睾丸提取RNA并转化为cDNA后,RT-PCR也用于测定性腺Cre公司在每个收集的器官中表达。所有没有Cre公司在睾丸内表达或Cre公司在其他器官中表达的基因从分析中删除。PCR中使用的引物序列可以在补充表1.
激素分析
安乐死时采集躯干血,并将其放入装有20μL EDTA钾溶液(0.01 M EDTA在PBT中稀释30%;Fisher Scientific)的试管中。血液样本在1250℃立即离心克持续10分钟。然后将分离的血浆收集到一个新的试管中,并在−80°C下储存。睾酮浓度由睾酮ELISA试剂盒(目录号1880;Alpha Diagnostics International Inc)测定(18). 使用0纳克/毫升、0.5纳克/毫克、1纳克/毫升、2.5纳克/毫升、10纳克/微升和20纳克/mL样品建立标准曲线。测定灵敏度为0.125 ng/mL,组内系数为4.29%。
固定、包埋、染色和免疫组织化学
将代表性组织固定在Bouin溶液中,并根据标准程序进行石蜡包埋(19). 组织切片(5μm),如前所述进行免疫组织化学(IHC)(19). VEGFA抗体是针对与人类VEGFA(目录号sc-507;Santa Cruz Biotechnology)的1-140氨基酸相对应的肽而产生的兔多克隆IgG。它作为促血管生成和抗血管生成亚型的泛抗体,用于确定KO和对照小鼠睾丸内的支持细胞和生殖细胞中是否存在VEGFA亚型。初级抗体在10%正常山羊血清(NGS)中以1:100稀释。作为阴性对照,连续切片处理时不含初级抗体。生物素化山羊抗兔二级抗体在10%NGS中稀释1:300,并与本研究中的每种一级抗体一起使用(目录号BA-1000;Vector Laboratories)。使用氨乙基咔唑铬试剂底物溶液(Invitrogen)检测二级抗体。其他初级抗体也采用了类似的免疫组织化学方法。将含有16(ZBTB16,也称为PLZF)一级抗体(目录号sc-22839;Santa Cruz Biotechnology)的锌指和BTB结构域在10%NGS中稀释为1:500。将磷酸化叉头盒O1(FOXO1;Ser 256)在10%NGS(目录号ab131339;Abcam)中稀释1:300。
生育试验
雄性和雌性小鼠在大约2-4个月大时配对,一直配对到6-8个月大。对照组、Het和KO雄性小鼠均与已证实生育能力的对照雌性小鼠配对。从雄性和雌性被放在笼子里到分娩的时间以天为单位进行测量。我们还确定了每窝幼崽的数量。我们以12对为对照×对照、Het×对照和KO×对照进行了育性研究。然而,在生育率研究后,PCR分析Cre公司在睾丸中进行,如果Cre公司也在其他器官中表达,将动物从分析中删除。这不合适Cre公司表达导致用于分析的Het×对照和KO×对照对数量减少。
免疫荧光
除添加了含有0.05%吐温20(产品目录号BP337-100;Fisher Scientific)的PBS外,检测结果的免疫荧光处理与上述IHC类似。使用了两种主要抗体:CD31的兔抗体(PECAM;目录号ab28364;Abcam)和VE-CADHERIN的山羊抗体(目录号sc-6458;Santa Cruz Biotechnology)。两者均在PBS-Tween中的3%BSA(目录号A3311;Sigma-Aldrich)中以1:50稀释。添加抗兔FITC二级抗体(Alexa Fluor 488;目录号4412S;细胞信号技术)以结合CD31一级抗体。为了检测VE-CADHERIN的表达,我们使用了一种抗血清德克萨斯红二级抗体(Alexa Fluor 594;目录号A-21223;Invitrogen/Life Technologies)。每个次级抗体在PBS-Tween的3%BSA中以1:400稀释。一旦用相应的二级抗体优化了每个一级抗体,用两种一级抗体的混合物以及两种二级抗体的混合物对睾丸进行双重标记。在添加荧光二级抗体之前,染色被转移到一个黑暗的房间。在PBS-Tween中孵育和洗涤三次后,用含4′,6-二氨基-2-苯基吲哚(DAPI;目录号H-1500;Vector Laboratories)的VECTASHIELD HardSet安装介质安装载玻片并盖上盖子。使用SlideBook 4.2软件(智能成像创新)和IX71奥林巴斯倒置亮场和荧光显微镜(Hitschfel Instruments)在暗室中对幻灯片进行成像。除了添加了所有抗体的片段外,载玻片还有两个单独的片段:一个没有任何抗体,另一个只添加了次级抗体。这些阴性对照证实了背景荧光的多少。在×100和×400处拍摄两张图像,在×200处拍摄三张图像,分别为对照(n=5)和KO(n=4)睾丸。
未分化精原细胞和精子数的测定
使用Olympus BX51显微镜(美国奥林巴斯)在×200倍放大下检查用于ZBTB16免疫组织化学的睾丸切片,并使用cellSens数字成像软件(美国奥林巴斯)采集图像。在每个显微镜视野中,每个小管的未分化精原细胞的数量被鉴定为ZBTB16染色阳性,并且是从每个动物的每个睾丸的中心部分随机选择的四个不重叠的视野中确定的。平均每个睾丸的阳性染色精原细胞数量,并将KO(n=7)和对照(n=6)之间的平均值进行比较。苏木精和伊红染色的附睾切片在×400下使用相同的相机和软件进行检查。从每只动物每只附睾的五个随机选择的区域中,测定每个显微镜视野下附睾体中每个小管内的精子数量。这五个显微区域的精子数量是每个小管的平均数,并在KO(n=5)和对照(n=4)小鼠之间进行了比较。对于相同的动物和图像,我们使用ImageJ软件(美国国立卫生研究院)测量附睾体中的小管面积。
定量RT-PCR(qPCR)
根据之前的协议,从每只动物中采集一个睾丸进行RNA提取、RT-cDNA和qPCR分析(19). RNA样品在−80°C下保存,直到使用SuperScript III逆转录酶(Invitrogen)进行RT。实时PCR检测残余基因组DNA。样品在−20°C下保存,直到用于qPCR。将等量的cDNA添加到主混合物中进行qPCR。使用了TaqMan通用PCR和Power SYBR绿色母体混合物(应用生物系统)。根据验证结果,反应使用150或300纳米引物,TaqMan反应需要2微米探针。引物使用Primer Express 3.0软件(Applied Biosystems)进行设计,并在Integrated DNA Technologies进行合成,除非另有说明。需要SYBR Green测量定量的基因也绘制在解离曲线上,以确保未检测到引物二聚体。qPCR是根据以前的方案进行的(19). TaqMan基因表达测定用于检测四个基因的表达:胶质细胞源性神经营养因子(Gdnf公司),ret原癌基因(Ret公司),新加坡3A(Sin3a公司)和神经生长素3(神经元3)(目录号4331182;Applied Biosystems)。探针是在我们的实验室设计并购买的两个基因:BCL2相关X蛋白(Bax公司)和B细胞白血病/淋巴瘤2(Bcl2公司)(应用生物系统)。每个基因的引物和探针序列列于补充表1mRNA丰度标准化为看家基因甘油醛-3-磷酸脱氢酶的表达(Gapdh公司),表示为相对于平均控制值的折叠变化(设置为值1)。的表达式Gapdh公司使用VIC探针和引物试剂盒(目录号4308313;Taqman啮齿动物GapDH控制试剂;Applied Biosystems)进行测定。数值表示为平均值±SEM。
末端脱氧核苷酸转移酶dUTP缺口末端标记法(TUNEL)
对照和KO睾丸的中段根据先前设计的方案(目录号G3250;Promega)测定细胞凋亡。使用带有DAPI(Vector Laboratories)的VectaStain支架安装载玻片。使用SlideBook 4.2 Software(智能成像创新)和IX71 Olympus倒置亮场和荧光显微镜(Hitschfel Instruments)在黑暗的房间中对测试进行成像。TUNEL阳性细胞发出亮绿色荧光(FITC滤光片,488 nm),而细胞核由于DAPI(360–460 nm)发出亮蓝色。由于放大×100倍时KO和对照组的细胞凋亡没有明显差异,我们没有进行进一步的分析。
统计分析
使用单因素方差分析和Dunnett检验对数据进行分析,以比较KO和对照(JMP软件;SAS Institute)。数据差异在以下情况下被视为具有统计学意义:P(P)< .05. 用JMP软件(SAS Institute)对生育数据进行单因素方差分析,并与Student进行比较t吨测试。差异被认为在P(P)< .05. 如果.05>,则考虑显著性趋势P(P)< .1. 所有处理均与对照组进行比较。
结果
pDmrt1-Cre的有效性;素食主义者−/−KO表型
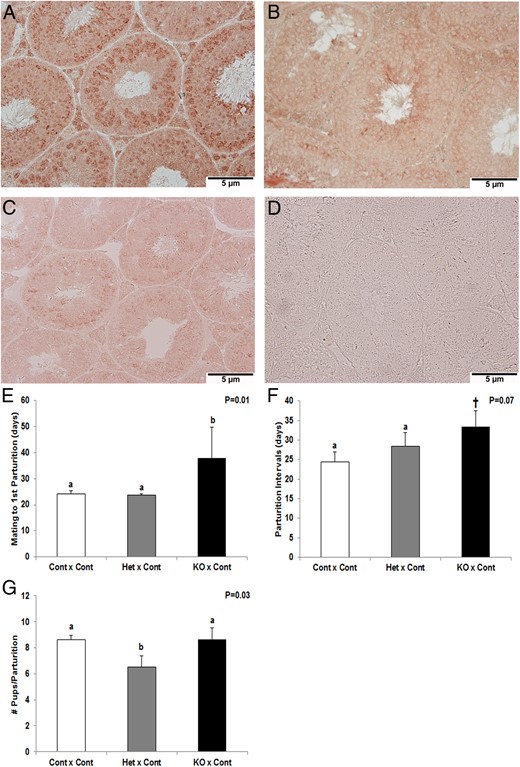
用检测血管生成和抗血管生成亚型的pan-VEGFA抗体进行免疫组织化学,以确定素食主义者支持细胞和生殖细胞中的亚型影响这些细胞类型中VEGFA亚型的蛋白表达。Het中VEGFA亚型减少(图1B) 和KO试验(图1C) vs控件(图1A) 尤其是在生精小管内的支持细胞中。为了确定生精小管中VEGFA表达的整体减少,我们在我们的IHC中使用嗜铬细胞测定来检测所有VEGFA亚型的蛋白表达,包括促血管生成和抗血管生成。KO小鼠睾丸支持细胞中VEGFA亚型的表达降低,因此,为检测睾丸中VEGFA表达降低提供了一个有效的模型。未经初级抗体处理的切片缺乏阳性染色,用作阴性对照(图1D) ●●●●。
图1。
在对照睾丸(a)、杂合睾丸(Het)和KO睾丸(C)中用panVEGFA抗体进行免疫组织化学。阴性对照睾丸在没有一级抗体(D)的情况下进行处理。以雄性作为每对(对照组、Het组、KO组)中第一个出现的雄性进行的生育试验的结果被分为从交配到第一次分娩的天数(E)、每个分娩间隔的平均天数(F)和每胎平均出生的幼崽数(G)。对于(E)中的Control×Control、Het×Control和KO×Control对,n分别为12、5和4。对于(F)和(G)中的Control×Control、Het×Control和KO×Control对,n分别为16、8和6。当P(P)< .05; †, 数据趋于显著(.05<P(P)<.1)。
pDmrt1-Cre的育性;素食主义者−/−和杂合子雄性小鼠
小鼠要么交配:1)雄性对照对雌性对照(对照×对照;n=12);2) 雄性KO对雌性对照(KO×对照;n=4);或3)雄性Het对雌性对照(Het×对照;n=5)。雄性KO×对照雌性交配时,从雌雄初次交配到第一次分娩的天数延长了14天(38.0±11.8 d;P(P)<0.01)与对照组(24.1±1.4 d;图1E) ●●●●。此外,当分析所有分娩间隔时,与对照交配相比,KO雄性×对照雌性交配的女性怀孕时间往往延长9天(33.5±4.07 vs 24.5±2.49天;P(P)< .07;图1F) ●●●●。然而,第一次分娩时Het×对照组的交配没有差异。有趣的是,当我们继续评估Het×对照交配时,对照雌性与Het雄性交配后,从第一次分娩到第二次分娩的时间比对照交配长10天(36.3±2.7 vs 25.8±3.4 d;P(P)< .05). 令人惊讶的是,我们还观察到Het×Control交配中每窝幼崽数的差异,与对照交配相比,两次交配减少了(6.50±0.65 vs 8.67±0.75;P(P)< .03;图1G) ●●●●。然而,KO×对照组和对照×对照组交配的幼崽数量没有差异。
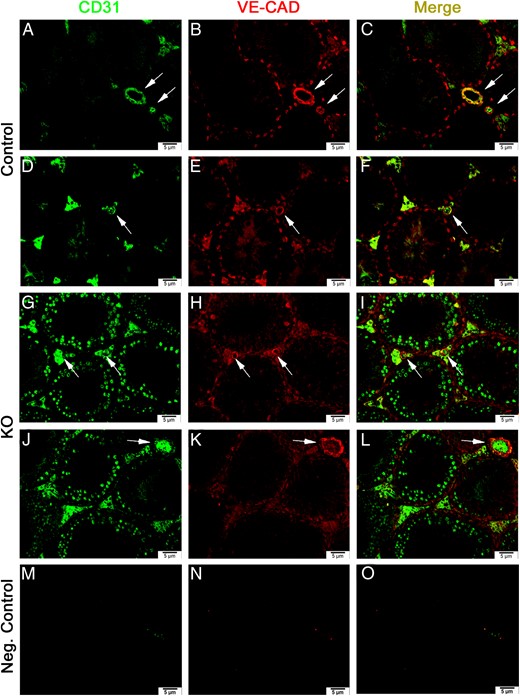
KO雄性大鼠睾丸间质的血管结构没有改变,但有丝分裂生殖细胞的增加有所不同
未分化精原细胞的存在已被证明在靠近间质的生精小管部分增加,尤其是在血管附近(20). 因此,我们对两种已知的内皮细胞标记物-血小板粘附分子(PECAM-1或CD31)和血管内皮细胞钙粘蛋白(VE-CAD)进行免疫荧光双重标记。虽然我们的研究结果显示KO小鼠睾丸血管系统没有明显差异(图2,J–L)与对照组睾丸比较(图2在KO雄性睾丸的生殖细胞中,CD31阳性染色(绿色)更加明显(图2,D–F)在任何控制中都不明显(图2,A–C)。未经初级抗体处理的连续切片用作阴性对照(图2,M–O)。
图2。
小鼠睾丸×200的荧光图像,聚焦于对照小鼠(A-F)和基因敲除小鼠(G-L)的小管和血管。CD31阳性染色呈绿色(A、D、G、J)。VE-CAD阳性染色为红色(B、E、H、K)。在共存(C,F,I,L)的地方,两者的合并显示为黄色。阴性对照组在没有初级抗体的情况下进行处理。图中是用FITC滤镜(M)、德州红滤镜(N)以及最终与背景融合(O)观看的阴性对照图像。
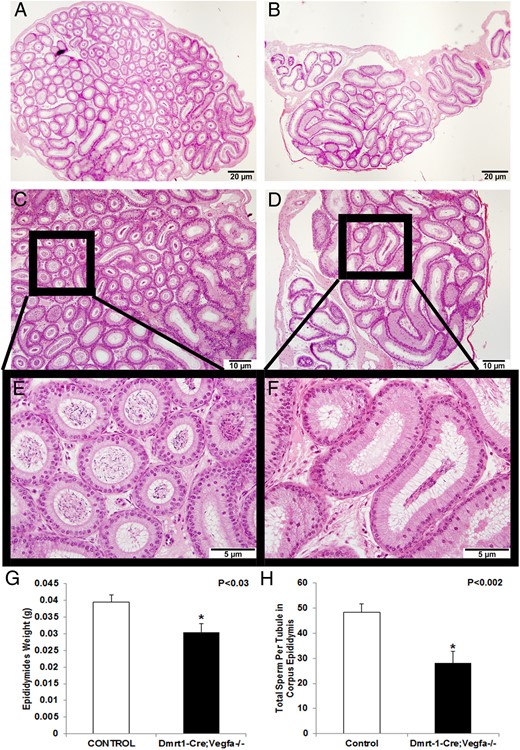
pDmrt1-Cre影响附睾形态;素食主义者−/−每小管附睾精子数量减少的小鼠
附睾内有形态学改变。附睾很重要,因为它是精子细胞成熟和获能所必需的。形态学上,KO小鼠的附睾似乎比对照附睾具有更少的小管和更少的盘绕(图3,A–F),器官不同部分之间的分割更大。KO小鼠的附睾比对照组小23%(0.030±0.0026 vs 0.039±0.0022 g,P(P)< .05;图3G) ●●●●。除小管数量和附睾重量减少外,KO小鼠附睾体(28.07±4.62;P(P)<.002)与对照组(48.45±3.38;图3H) ●●●●。有趣的是,KO雄性大鼠附睾体中的小管面积显著增大(113 9491±18 498像素;P(P)<.03)与对照组相比(106 3001±28 039像素;数据未显示)。此外,尽管KO雄性和对照雄性之间的小管数量没有差异,但KO雄性的精子数量在没有每个小管代表的情况下仍然减少(189.8±30.8;P(P)=0.0003)与对照雄性相比(357.2±28.4;数据未显示)。
图3。
对照组(A,C)和KOs(B,D)附睾在×40和×100时的苏木精-伊红染色。对照组(E)和KO(F)附睾的插图为×400。表示对照组(n=20)和KO雄性(n=23)附睾体中每个小管的精子数量(G)。*,当P(P)< .05.
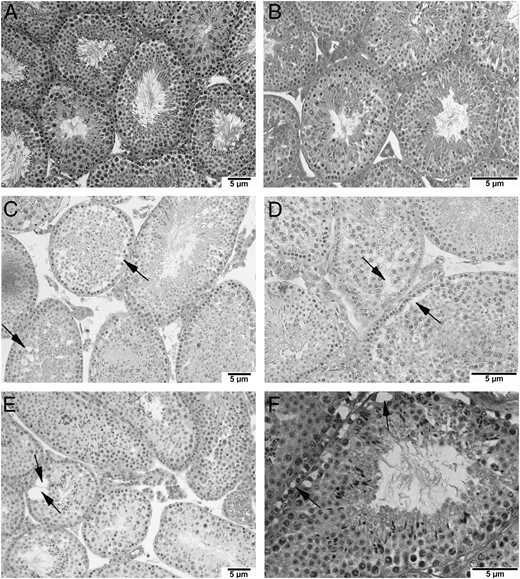
与对照组相比,KO和Het小鼠睾丸形态发生的变化
尽管睾丸重量没有显著差异,但睾丸生精上皮组织结构紊乱,有大液泡,在KO和Het小鼠中生殖细胞通常位于这些液泡中(图4,A–F)。在某些情况下,某些阶段的生殖细胞似乎位于小管内的异常位置。与KO小鼠睾丸相比,我们在Het小鼠体内观察到更多的形态学改变和生精障碍。
图4。
×200对照组(A)、×400对照组(B)、×200杂合子(Het)(C)、×400Het(D)、×200KO(E)和×400KO(F)睾丸黑白切片苏木精-伊红染色。箭头表示生精上皮破裂。
ZBTB16蛋白的睾丸表达
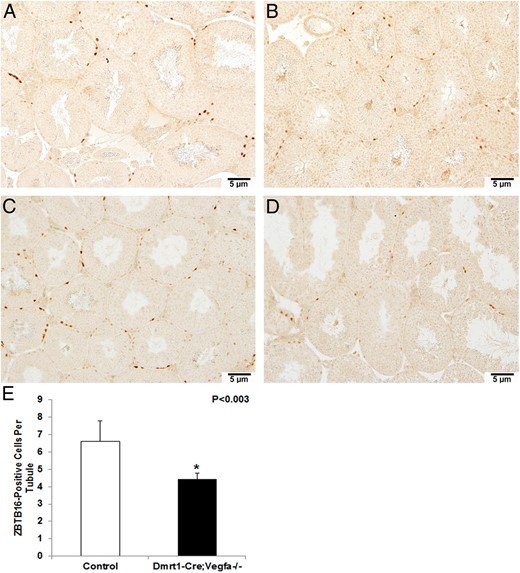
为了确定VEGFA缺失对精原细胞群体的影响,我们对未分化精原细胞标记物ZBTB16(也称为PLZF)进行了免疫组化。ZBTB16被认为对未分化精原细胞的自我更新很重要(21). KO睾丸中每个小管ZBTB16阳性未分化精原细胞数量减少(4.38±0.29;P(P)< .003;图5B) 与对照组相比(6.60±0.67);图5A) 显示6个月大的KO小鼠未分化精原细胞丢失。在没有初级抗体的情况下处理的连续切片用作阴性对照(未显示)。
图5。
对照组(A和C)和KO(B和D)睾丸横切面放大200倍后ZBTB16阳性染色。ZBTB16染色阳性的未分化精原细胞用红棕色染色表示。此外,还显示了对照组(n=24)和KO组(n/27)睾丸(E)之间每个小管中ZBTB16阳性未分化精原细胞的计数。*,当P(P)< .05.
KO小鼠睾丸中SSC生态位建立和维持的关键基因发生改变,未分化精原细胞减少
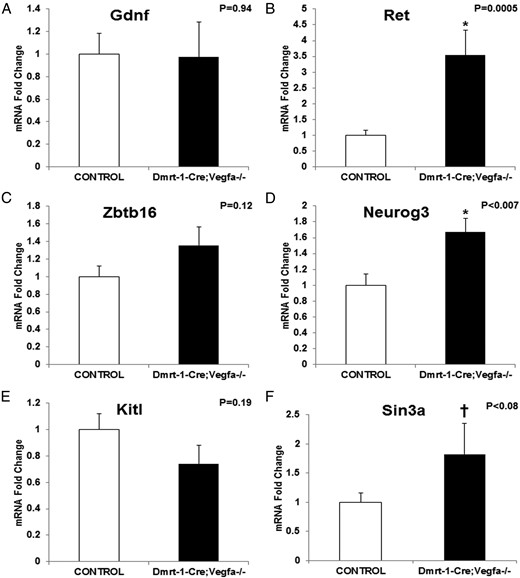
在未分化精原细胞的发育群体中,有几个基因对未分化精母细胞(可能还有SSC)的维持很重要。其中一个因子RET是睾丸中由支持细胞分泌的生长因子GDNF的受体。GDNF介导的RET信号对未分化精原细胞的发育很重要(22,23). 相对数量Ret公司KO小鼠睾丸mRNA表达量较大(3.53±0.81;P(P)=0.0005)比对照组(1±0.16;图6B) ●●●●。然而Gdnf公司KO睾丸中的mRNA与对照组无差异(图6A) ●●●●。NEUROG3是一种转录因子,在未分化精原细胞和那些分化并最终导致精子发生的精原细胞中表达(24). 相对数量神经元3KO睾丸mRNA显著升高(1.67±0.17;P(P)<.007)比对照组(1±0.14;图6D) ●●●●。在Zbtb16号机组KO和对照睾丸间的mRNA(图6C) ●●●●。
图6。
调节未分化精原细胞基因的整个睾丸mRNA丰度:Gdnf公司(A) ,Ret公司(B) ,Zbtb16号机组(C) ,神经元3(D) ,基特尔(E) ,以及辛3a(F) 。平均KO值(n=8–17)表示为与对照(n=5–9)平均值(设置为1)相比的折叠变化±SEM。*,当P(P)< .05; †, 数据趋于显著(.05<P(P)< .1).
SIN3A是一种支持细胞产物,它影响精子细胞的伸长,支持细胞需要它为未分化精原细胞建立一个生态位,因为它似乎有助于精原细胞向基底膜迁移(22). 相对数量Sin3a公司KO睾丸中的mRNA有升高趋势(1.82±0.53;P(P)<.08)比对照组(1±0.15;图6F) ●●●●。据报道,睾丸生殖细胞和精原细胞的存活和增殖需要Kit配体(KITL)(25). 然而,KO和对照试验在基特尔mRNA丰度(图6E) ●●●●。
KO小鼠睾丸中调节细胞凋亡的关键基因发生改变
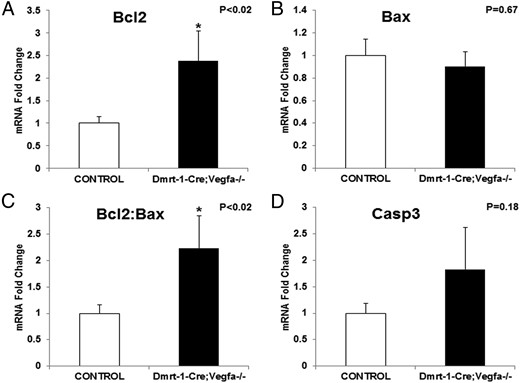
因为VEGFA促血管生成亚型治疗已被证明可以增加BCL2级相对于行李牛睾丸(26),我们评估Bcl2公司和Bax公司条件KO与对照睾丸的mRNA表达。的级别Bcl2公司KO睾丸mRNA表达水平较高(2.38±0.66;P(P)<.02)比对照组(1±0.14;图7A) ●●●●。然而,mRNA丰度在Bax公司KO试验中与对照组的比较(图7B) ●●●●。此外Bcl2公司到Bax公司Sertoli细菌特异性VEGFA缺失小鼠的mRNA水平升高(2.24±0.61;P(P)<.02)与对照组相比(1±0.16;图7C) ●●●●。此外,Caspase 3的mRNA(案例3)是一种促进细胞凋亡的因子,在KO和对照睾丸之间没有差异(图7D) ●●●●。
图7。
调节细胞凋亡和存活的基因的整个睾丸mRNA丰度:Bcl2公司(A) ,Bax公司(B) ,Bcl2:钡(C) 、和案例3(D) ●●●●。平均KO值(n=11-17)表示为与对照(n=5-9)平均值(设为1)相比的折叠变化±SEM。*,当P(P)< .05.
磷酸化FOXO1免疫组化在KO小鼠睾丸中更多为细胞质
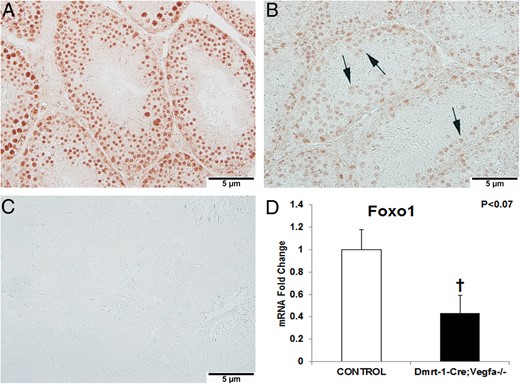
FOXO1是一种转录因子,被认为对未分化精原细胞的自我更新或分化很重要,这取决于它是否被磷酸化(27). KO睾丸中磷酸化FOXO1阳性染色强度较低,细胞质较多(图8B) 与控件相比(图8A) ●●●●。未经初级抗体处理的切片缺乏阳性染色,用作阴性对照(图8C) ●●●●。此外,总的mRNA丰度福克斯1KO小鼠睾丸呈下降趋势(57%)(0.43±0.16);P(P)<.07)与对照小鼠相比(1±0.18;图8D) ●●●●。
图8。
对照雄性(A)和KO雄性(B)睾丸中磷酸化FOXO1的免疫组织化学显示为×400。处理阴性对照睾丸,不含初级抗体(C)。箭头指向KO睾丸中的细胞质磷酸化FOXO1染色(B)。总计福克斯1测量并比较对照组(n=11)和KO组(n=5)雄性(D)睾丸中的mRNA丰度。†,结果在0.05时显著<P(P)< .1.
KO小鼠体重减轻
KO小鼠的体重(28.52±0.48 vs 32.52±1.20 g,P(P)< .02;补充图2F) 与对照组小鼠相比减少了12.3%。此外,前列腺趋向于缩小55%(0.01±0.0031克vs 0.022±0.0045克;P(P)<.07;补充图2B) ●●●●。尽管与对照组相比,观察到体重减轻,但睾丸、精囊、肾脏和肾上腺重量没有差异(补充图2、A和C–F)。与对照组小鼠相比,血浆睾酮浓度也没有差异(补充图2G) 6个月龄时收集小鼠。
讨论
在本研究中,我们提供了新的数据,即支持细胞和生殖细胞分泌的VEGFA亚型对于维持未分化精原细胞、精子数量和正常男性生育能力是必要的。再一次pDmrt-1-Cre公司在小鼠支持细胞和一些生殖细胞中检测到转基因;然而,内源性小鼠DMRT-1似乎在生殖细胞中没有翻译(17). 所有VEGFA亚型的消除都会导致生育能力低下,女性怀孕或生育后代的间隔更长,即使有一个等位基因被条件性敲除也会发生这种情况。此外,这些数据支持我们实验室和合作者最近发表的一篇文章,即促血管生成或抗血管生成VEGFA亚型治疗可能通过改变基因更新或分化的能力来影响调节SSC生态位的基因(6).
在KO睾丸中,被认为调节未分化精原细胞更新或分化的基因表达发生改变。未分化精原细胞中表达的基因(Ret公司)在未分化和早期分化中(神经元3)和支持细胞(Sin3a公司)与对照组相比,具有更大的mRNA丰度(或倾向于)。如果不是所有的未分化精原细胞和所有导致精子发生的精原细胞中都表达NEUROG3(24). RET和SIN3A的缺失导致小鼠SSC耗竭(22,23)以及通过RET抑制GDNF信号转导显著损害SSC更新(28).
此外,总计福克斯1KO雄性睾丸中的mRNA趋于减少,磷酸化FOXO1的表达似乎更多是细胞质的,表达更少。FOXO1属于转录因子家族,因其在调节细胞过程(包括细胞命运决定)中的作用而闻名(29,30). FOXO1的磷酸化导致从细胞核到细胞质的移位(31). 一项涉及小鼠的研究福克斯1在生殖细胞中被条件性敲除表明FOXO1在SSC内稳态中的新作用(27). 它的核移位与分化的开始(表达c-套件)而细胞质磷酸化表达与自我更新有关。已确定FOXO1可能通过其与RET的积极关系调节SSC更新(27). 此外,VEGFA_164已被证明上调小鼠肾脏中GDNF的表达并磷酸化RET(32).
尽管SIN3A由支持细胞表达,并且已被确定对SSC生态位的建立很重要(22),它也被证明在生殖细胞中被敲除时会导致不育(33). SIN3A作为转录辅助因子发挥作用,其靶点之一是ZBTB16(34). 尽管mRNA丰度Sin3a公司在本研究中,KO雄性睾丸中ZBTB16的阳性染色减少。此外,SIN3A似乎对间接调节生殖细胞分化很重要。当Zbtb16号机组生殖细胞中的基因被敲除,细胞在围产期恢复静止时发生凋亡(33). ZBTB16阳性精原细胞的减少表明VEGFA亚型的丢失可能会耗尽SSC库。这支持了先前的研究,即与对照组相比,注射具有促血管生成亚型VEGFA_164抗体或抗血管生成亚类VEGFA_ 165B治疗的围产期小鼠(P3–5),然后在P8和P21进行精原细胞移植,可以减少睾丸中SSC的定植。结合本研究的数据,VEGFA_164促血管生成亚型可能对维持SSC生态位所必需的持续SSC更新、增殖或存活至关重要,而抗血管生成亚型别VEGFA_ 165B可能通过凋亡促进生殖细胞分化或死亡(6).
在KO小鼠的睾丸内,促进生存的基因表达也存在差异:增加Bcl2公司和Bcl2:钡mRNA丰度。在其他研究中,与对照组相比,重组小鼠VEGFA_164处理增加了培养牛睾丸外植体中生殖细胞的数量。此外,体外阻断VEGFA活性可减少VEGFA处理睾丸组织中的生殖细胞数量(26). 这表明促血管生成VEGFA亚型是生殖细胞的生存因子,可能存在代偿机制来增强前生存基因,如Bcl2公司.
由于VEGFA亚型的缺失,睾丸似乎试图增加因子的转录以维持SSC生态位(Sin3a公司),可能通过增强GDNF信号转导进行更新(Ret公司)和细胞存活(Bcl2公司和Bcl2:钡). 由于NEUROG3至少在大多数未分化精原细胞中表达,其mRNA丰度增加也可能表明试图维持生态位。总mRNA丰度福克斯1KO雄性睾丸中磷酸化FOXO1的阳性染色强度降低;然而,染色也出现了更多的细胞质。这也暗示了试图补偿VEGFA亚型缺失。此外,案例3mRNA丰度没有差异,TUNEL染色在KO和对照睾丸之间也没有差异(数据未显示),这进一步表明维持生殖细胞存活的保护机制。因为以前的数据表明抗血管生成VEGFA亚型促进分化(6),他们的缺席可能也推动了补偿机制(增加神经元3). 存活因子的增加可能是为了将生殖细胞维持在多个阶段,因为附睾中既有成熟精子,也有睾丸中未分化的精原细胞。补偿机制能够在短期内维持生育能力,但VEGFA亚型的缺失似乎会导致生育能力的逐渐降低,正如杂合子男性所证明的那样。
除了调节未分化精原细胞和存活的因素发生改变外,体重减轻了12%。在目前的研究中,体重下降的原因尚不清楚;然而,睾丸内因素的改变可能影响了身体生长,也可能导致前列腺形态和大小的差异。此外,睾丸产生的因子不仅可以增加体重和生长,还可以影响附睾的形态发生和潜在的功能维持(35).
尽管睾丸重量没有差异,但与对照组相比,Het和KO睾丸中生殖细胞应该存在的空泡是可见的。以前,VEGFA_121的组成性表达受黏蛋白1的控制(慕尼黑1)启动子导致小鼠生育能力低下。其中一些小鼠的生精小管紊乱,精子发生似乎受阻(7). 在另一项研究中,在小鼠乳腺肿瘤病毒启动子的控制下,人VEGFA_165在睾丸和附睾中的过度表达通过生精阻滞和内皮细胞增生导致不育(36).
支持细胞和生殖细胞都分泌VEGFA,并参与纤溶酶(尿激酶纤溶酶原激活剂或uPA和组织纤溶酶酶原激活物或tPA)和纤溶酶抑制剂(纤溶酶激活物抑制剂-1或PAI-1)的产生,这可能会改变细胞粘附和生殖细胞通过血液测试屏障从管腔室迁移到管腔室的能力(37–40). VEGFA亚型的丢失可能导致运动调节的减少以及上皮组织的紊乱,类似于VEGFA_121在两种情况下都得到控制时的情况慕尼黑1或小鼠乳腺肿瘤病毒启动子(7,36). 此外,未分化精原细胞的丢失可能会损害支持细胞和生殖细胞之间的通讯,使支持细胞与生殖细胞之间已经断开的通讯变得复杂。
为了阐明本研究中VEGFA消除的影响是否是由于血管对生态位的改变以及之前提到的支持细菌-细胞粘附减弱所致,我们检测了CD31(PECAM-1)和VE-CAD的表达。这两种蛋白的睾丸血管系统都具有双重荧光标记,并且在任何KO睾丸和对照睾丸之间没有显著差异。虽然两种内皮细胞标记物似乎都有利于间质室和血管系统,但在KO睾丸染色的生殖细胞中可以看到CD31阳性染色,而在对照组中则没有。CD31已被证明是人类精子上的一个重要受体,可能启动获能(41,42). 此外,CD31也被证明可以标记迁移的男性特异性内皮细胞(43). 最后,虽然CD31已被证明对粘附很重要,但迁移生殖细胞中的CD31阳性染色表明,它是睾丸中支持细胞粘附所必需的(42). KO组和对照组睾丸VE-CAD表达无差异;然而,它可以在间质以及支持细胞和可能的一些生殖细胞之间的粘附连接中看到。
去除Sertoli和生殖细胞亚群中的VEGFA亚型会导致小体、附睾和前列腺重量,调节细胞凋亡的睾丸基因表达改变,精原细胞未分化,生殖细胞中CD31表达增加。此外,KO小鼠睾丸中未分化精原细胞数量和附睾体中精子数量减少,这将导致男性生育能力降低。因此,无论是直接还是间接影响,本研究的总体结果表明,VEGFA是维持未分化精原细胞、精子生成和男性生育能力所必需的基因的调节器。
致谢
我们感谢Jennifer Wood博士和Renee McFee博士在提交之前仔细阅读和修改了这篇文章。我们还感谢Renata Spuri Gomes在测量附睾小管面积方面的帮助。
这项工作得到了美国国家卫生研究院/美国国家儿童健康与人类发展研究所HD051979的支持,以及内布拉斯加州卫生与公共服务部2009年、2012年的部分支持,这是内布拉斯加林肯市内布拉斯卡大学农业研究部的贡献。
披露摘要:作者无需披露任何信息。
缩写
DAPI公司
E类
FOXO1系列
GDNF公司
赫特
国际水文委员会
击倒对手
NGS公司
P(P)
定量PCR
安全控制系统
隧道
VE-CAD公司
VEGFA(血管内皮生长因子)
工具书类
1斯卡克贝克
无
,约根森
N个
.
睾丸发育不全与生育
.男科动物
.2005
;37
(6
):217
–218
. 2费兰
A类
,维南齐
C类
,塞丽斯
R(右)
,加罗拉
A类
,弗里戈
自动控制
,福雷斯塔
C类
.
男性不育的药物遗传学研究:卵泡刺激激素β亚基启动子多态性
.生育和不育
.2011
;96
(6
):1344
–1349.2秒
. 三。麦吉尼斯
MP公司
,奥尔思
吉咪
.
雄性大鼠出生后生殖细胞恢复迁移活动
.Eur J细胞生物学
.1992
;59
(1
):196
–210
. 4麦吉尼斯
MP公司
,奥尔思
吉咪
.
体内外新生大鼠睾丸中生殖细胞有丝分裂的再激活及向基底膜的迁移
.Anat Rec公司
.1992
;233
(4
):527
–537
. 5奥尔思
吉咪
,杰斯特
WF公司
,锂
左心室
,拉斯利特
铝
.
新生啮齿动物睾丸发育过程中性腺细胞和输精管细胞的相互作用
.当前最高开发生物
.2000
;50
:103
–124
. 6凯雷斯
KC公司
,德阿维拉
吉咪
,杯
AS公司
,麦克莱恩
流行音乐播音员
.
VEGFA家族亚型调节体内精原干细胞稳态
.内分泌学
.2012
;153
(2
):887
–900
. 7Huminiecki公司
L(左)
,陈
HY公司
,路易斯
秒
等.
血管内皮生长因子转基因小鼠表现出降低雄性生育能力和胎盘排斥反应
.摩尔哼声再现
.2001
;7
(三
):255
–264
. 8奥伯梅尔
A类
,奥布鲁卡
A类
,波尔
M(M)
等.
男性生育中的血管内皮生长因子及其受体
.生育和不育
.1999
;72
(2
):269
–275
. 9哈珀
SJ公司
,贝茨
执行
.
VEGF-A剪接:抗血管生成治疗的关键?
Nat Rev癌症
.2008
;8
(11
):880
–887
. 10阿尔塔克
无线电高度表
,麦克菲
马来西亚令吉
,史密斯
无线电高度表
,巴尔特斯-布雷特维奇
MM(毫米)
,克洛普顿
DT公司
,杯
AS公司
.
中和血管内皮生长因子抗血管生成亚型在刺激围生期大鼠卵巢血管发育和卵泡发育方面比使用促血管生成亚型别治疗更有效
.生殖生物学
.2009
;81
(5
):978
–988
. 11博特
钢筋混凝土
,麦克菲
马来西亚令吉
,克洛普顿
DT公司
,图姆斯
C类
,杯
AS公司
.
血管内皮生长因子和激酶域受体参与大鼠睾丸形态发生过程中生精索的形成和血管的发育
.生殖生物学
.2006
;75
(1
):56
–67
. 12巴尔特斯-布雷特维奇
MM(毫米)
,阿尔塔克
无线电高度表
,博特
钢筋混凝土
等.
血管内皮生长因子抗血管生成亚型的中和或促血管生成异构体的给药刺激大鼠睾丸血管发育
.繁殖
.2010
;140
(2
):319
–329
. 13格伯
惠普
,希尔兰
科威特
,赖安
调幅
等.
新生小鼠的生长和生存需要VEGF
.开发
.1999
;126
(6
):1149
–1159
. 14博伊尔
A类
,多尔南
秒
,达诺
我
,卢西耶
J型
,Silversides公司
数据仓库
.
DMRT1调控序列在哺乳动物性别分化中的功能保护
.起源
.2002
;34
(4
):236
–243
. 15雷
N个
,霍恩巴克
KI公司
,大米
陆军部
,卡尔波娃
T型
,阿格博尔
弗吉尼亚州
,赫克特
陆上通信线
.
小鼠DMRT1表达的性别特异性差异在性腺发育过程中取决于细胞类型和阶段
.生殖生物学
.2007
;77
(三
):466
–475
. 16雷蒙德
反恐精英
,凯特尔韦尔
年少者
,赫希
B类
,巴德韦尔
VJ公司
,扎尔科夫
D类
.
小鼠和鸡胚生殖嵴中Dmrt1的表达提示脊椎动物的性发育
.求文献一篇
.1999
;215
(2
):208
–220
. 17雷蒙德
反恐精英
,墨菲
兆瓦
,奥沙利文
MG公司
,巴德威尔
VJ公司
,扎尔科夫
D类
.
Dmrt1是与昆虫和苍蝇性调节因子相关的基因,是哺乳动物睾丸分化所必需的
.基因开发
.2000
;14
(20
):2587
–2595
. 18巴特
GK公司
,海洋
TL公司
,奥拉廷沃
卫生官员
等.
瘦素缺乏对小鼠睾丸形态、生殖细胞凋亡和凋亡相关基因表达水平的影响
.J安德洛
.2006
;27
(2
):302
–310
. 19麦克菲
马来西亚令吉
,阿尔塔克
无线电高度表
,麦克菲
马来西亚令吉
等.
血管内皮生长因子受体信号转导的抑制会阻止卵泡发育,但不一定会破坏围产期大鼠卵巢的血管发育
.生殖生物学
.2009
;81
(5
):966
–977
. 20吉田
秒
,佑野
M(M)
,纳贝希玛
Y(Y)
.
小鼠睾丸未分化精原细胞的血管相关生态位
.科学类
.2007
;317
(5845
):1722
–1726
. 21布亚斯
FW公司
,科什
铝
,沙尔马
M(M)
等.
Plzf在成年男性生殖细胞中是干细胞自我更新所必需的
.自然基因
.2004
;36
(6
):647
–652
. 22佩恩
希杰
,加拉赫
SJ公司
,工头
O(运行)
,丹纳伯格
金华
,德皮尼奥
无线电高度表
,布劳恩
重新
.
支持细胞需要Sin3a为未分化精原细胞、生殖细胞肿瘤和精子细胞伸长建立一个生态位
.干细胞
.2010
;28
(8
):1424
–1434
. 23诺顿
CK公司
,耆那教
秒
,斯特里克兰
调幅
,古普塔
A类
,米尔布兰特
J型
.
胶质细胞源性神经营养因子介导的RET信号调节精原干细胞命运
.生殖生物学
.2006
;74
(2
):314
–321
. 24吉田
秒
,高椋
A类
,奥博
K(K)
等.
神经生长素3描绘了小鼠睾丸精子发生的最早阶段
.求文献一篇
.2004
;269
(2
):447
–458
. 25塞特
C类
,多尔奇
秒
,杰雷米亚
R(右)
,罗西
P(P)
.
干细胞因子和替代c-kit基因产物在生殖细胞建立、维持和功能中的作用
.国际开发生物学杂志
.2000
;44
(6
):599
–608
. 26凯雷斯
KC公司
,德阿维拉
J型
,麦克莱恩
流行音乐播音员
.
血管内皮生长因子在牛睾丸精子发生建立过程中调节生殖细胞存活
.繁殖
.2009
;138
(4
):667
–677
. 27戈兹
美赞臣
,吴
Z轴
,加拉多
技术总监
,哈姆拉
FK公司
,卡斯特里隆
DH(决断高度)
.
小鼠精原干细胞需要Foxo1来维持和启动精子发生
.临床研究杂志
.2011
;121
(9
):3456
–3466
. 28吉吉瓦
M(M)
,卡瓦伊
K(K)
,吹原
J型
等.
GDNF通过RET酪氨酸1062介导的信号传导对精原干细胞的维持至关重要
.基因细胞
.2008
;13
(4
):365
–374
. 29汉堡包
BM公司
,千磅
吉吉
.
细胞周期和死亡控制:长寿叉头
.生物化学科学趋势
.2002
;27
(7
):352
–360
. 30汉堡包
BM公司
,梅德马
右侧
.
生死攸关的决定:PKB/Akt下班时FOXO Forkhead转录因子起主导作用
.J白细胞生物学
.2003
;73
(6
):689
–701
. 31沃格特
PK(主键)
,江
H(H)
,青木
M(M)
.
三层控制:FOXO蛋白的磷酸化、乙酰化和泛素化
.细胞周期
.2005
;4
(7
):908
–913
. 32Tufro公司
A类
,泰克曼
J型
,巴努
N个
,维莱加斯
G公司
.
VEGF-A/VEGFR2和GDNF/RET信号通路之间的串扰
.生物化学-生物物理研究委员会
.2007
;358
(2
):410
–416
. 33佩莱格里诺
J型
,卡斯特里隆
DH(决断高度)
,大卫
G公司
.
染色质相关的Sin3A对小鼠雄性生殖细胞谱系至关重要
.求文献一篇
.2012
;369
(2
):349
–355
. 34大卫
G公司
,阿兰
L(左)
,商行
上海
,Wong(王)
顺时针
,德皮尼奥
无线电高度表
,德让
A类
.
与mSin3A相关的组蛋白去乙酰化酶介导急性早幼粒细胞白血病相关PLZF蛋白的抑制
.癌基因
.1998
;16
(19
):2549
–2556
. 35 罗德里格斯
厘米
,柯比
JL公司
,辛顿
英国电信
附睾的发育。在:罗拜尔
B类
,辛顿
英国电信
,编辑。
附睾:从分子到临床实践
.纽约
:Kluwer学术出版社/Plenum出版社
;2002
:251
–267
. 36科尔佩莱宁
工程安装
,卡卡宁
美赞臣
,滕胡宁
A类
等.
睾丸和附睾中VEGF的过度表达导致转基因小鼠不育:VEGF非内皮靶点的证据
.J细胞生物学
.1998
;143
(6
):1705
–1712
. 37拉克鲁瓦
M(M)
,史密斯
FE公司
,弗里茨
IB公司
.
支持细胞富集培养物分泌纤溶酶原激活物
.分子细胞内分泌
.1977
;9
(2
):227
–236
. 38张
T型
,周
HM公司
,线路接口单元
YX公司
.
猕猴睾丸纤溶酶原激活剂和抑制剂、尿激酶受体和抑制素亚基的表达
.Mol Hum再现
.1997
;三
(三
):223
–231
. 39格里斯沃尔德
医学博士
.
睾丸生殖细胞与支持细胞的相互作用
.生殖生物学
.1995
;52
(2
):211
–216
. 40线路接口单元
YX公司
,线路接口单元
K(K)
,周
HM公司
,杜
问
,胡
ZY公司
,邹
RJ公司
.
培养猴支持细胞中组织型纤溶酶原激活剂和纤溶酶酶原激活物抑制剂-1的激素调节
.人类生殖
.1995
;10
(三
):719
–727
. 41尼克松
B类
,保罗
JW公司
,Spiller公司
厘米
,阿特维尔-海普
AG公司
,阿什曼
LK语言
,艾特肯
RJ公司
.
PECAM-1参与调节人类精子电容相关酪氨酸磷酸化的受体介导信号转导途径的证据
.细胞科学杂志
.2005
;118
(第20部分
):4865
–4877
. 42和歌山
T型
,滨田
K(K)
,山本
M(M)
,苏达
T型
,石井
秒
.
血小板内皮细胞粘附分子-1在小鼠原始生殖细胞迁移和早期性腺形成过程中的表达
.组织化学细胞生物学
.2003
;119
(5
):355
–362
. 43史密斯
加利福尼亚州
,麦克利夫
PJ公司
,哈德逊
问
,辛克莱
AH(AH)
.
雄性特异性细胞迁移到发育中的性腺是一个涉及PDGF信号的保守过程
.求文献一篇
.2005
;284
(2
):337
–350
.
内分泌学会版权所有©2013