PubMed摘要:
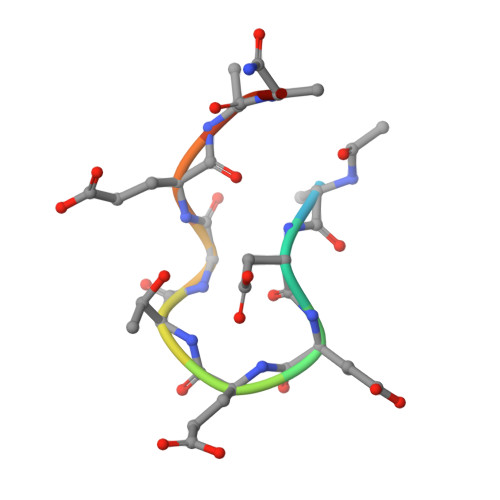
大环,包括大环肽,在靶向具有挑战性的蛋白-蛋白质相互作用(PPI)方面表现出了良好的前景。其中一个引起高度关注的PPI是Kelch-like ECH-Associated Protein-1(KEAP1)和Nuclear Factor(Eythroid-derived 2)-like 2(Nrf2)之间的PPI。在X射线晶体学、核磁共振、建模和机器学习的指导下,我们发现Nrf2对KEAP1的全部20nM结合亲和力可以在一个环状7-肽c中重演[(D类)-β-homoAla-DPETGE]。该化合物由Nrf2衍生的线性肽GDEETGE鉴定(K(K) D类=4.3μM),仅通过优化环状化合物的构象,而不改变任何KEAP1相互作用残基。测定了与KEAP1结合的每个线性和环状肽变体的X射线晶体结构。尽管亲和力变化很大,但在肽结合残基的构象或它们与KEAP1的相互作用方面没有观察到明显差异。然而,通过机器学习对X射线结构的分析表明,结合配体中的应变位置可以通过观察到的未变形线性肽的几何形状的子脉畸变模式来确定。我们表明,优化环肽亲和力部分是通过与78位脯氨酸取代相关的构象预组织和非相互作用残基Asp77的几何结构驱动的,部分是通过减少ETGE基序本身的张力驱动的。这种方法可能有助于分析其他配体-受体系统中构象预组织和张力之间的权衡。我们还鉴定了位于核心DxETGE基序两侧的一对保守的疏水残基,它们在促进Nrf2与KEAP1的高亲和力结合中起构象作用。