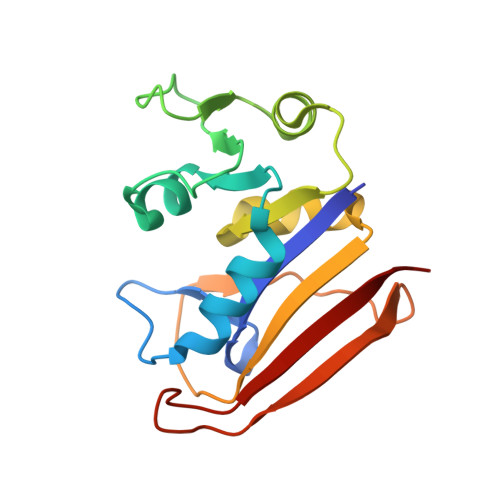
大肠杆菌二氢叶酸还原酶与叶酸和NADP复合物的高压蛋白晶体结构分析。
公共医学 : 30198899 内政部: https://doi.org/10.107/S2059798318009397 相关结构的主要引文: 4X5F型 , 4X5G型 , 4X5H型 , 4X5I型 , 4x5英寸 , 5Z6F型 , 5Z6J型 , 5Z6K型 , 5Z6L型 , 5Z6M型 PubMed摘要: 对大肠杆菌二氢叶酸还原酶(ecDHFR)与叶酸和NADP的络合物进行了高压晶体学研究 + 在高达800 MPa的高压条件下,晶体形式包含M20回路的开放和闭合构象。 在270至500 MPa的压力下,含有开放构象的晶体形态从P2发生相变 1 至C2。 在高压下观察到ecDHFR的几个结构变化,同时伴随着NADP的结构变化 + 辅因子和水合结构。 在闭合构象的晶体形式中,M20环随着压力的变化而移动,伴随着活性位点周围的构象变化,包括NADP + 和叶酸。 这些运动与所建议的假设一致,即M20环的运动是ecDHFR催化反应所必需的。 NADP的烟酰胺环以开放构象的晶体形式存在 + 尽管辅酶处于结晶状态,但作为反应的中间步骤,它会经历一次大的翻转。 此外,对Arg57和叶酸之间的水分子的观察阐明了底物结合途径的早期步骤。 这些结果证明了使用高压蛋白质晶体学作为捕获与蛋白质反应循环相关的高能亚态或瞬态结构的方法的可能性。