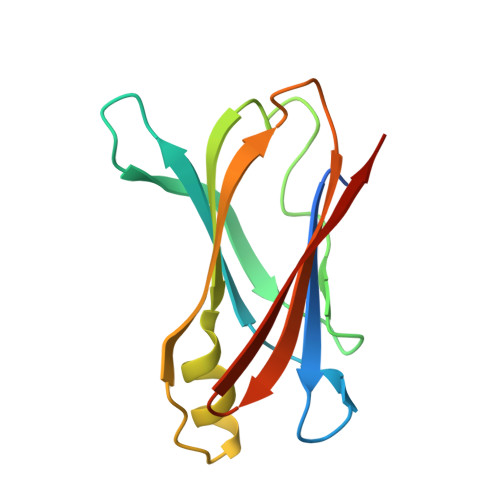
不对称配体与转甲状腺素结合的结构证据。
公共医学 : 26249340 内政部: https://doi.org/10.107/S1399004715010585 相关结构的主要引文: 4WNJ型 , 4英寸 , 4WO0型 PubMed摘要: 人转甲状腺素(TTR)是淀粉样蛋白的一个显著例子,几种能够稳定其天然状态的化合物已被认为是治疗TTR淀粉样变性的有效药物。 TTR四聚体中的两个甲状腺素(T4)结合位点显示负结合协同性。 在这里,已经确定了TTR与三种天然多酚(蝶啶、槲皮素和芹菜素)复合物的结构,其中这种不对称表现为存在一个具有明确配体占据率和相关电子密度的主结合位点和一个配体占据度低得多的第二个次要位点。 对两个结合位点之间的结构差异的分析结果与这种结合不对称性一致。 TTR配体饱和四聚体蛋白两个T4结合位点的能力不同,这可能是因为配体对较弱结合位点的亲和力不同。 相比之下,在相同实验条件下共结晶的高亲和力配体tafamidis能够完全饱和两个T4结合位点。 这种不对称性的特征是两个结合位点的空腔构象存在微小但显著的差异。 分子动力学模拟表明,溶液中存在更大的差异。 在溶液中进行的竞争结合分析表明,多酚类翼手龙和槲皮素在TTR中存在一个优先结合位点,与T4的优先结合位点不同。 通过使用两种药物的混合物,可以利用TTR结合不对称性来治疗TTR淀粉样变,每种药物对不同的结合位点都表现出优先结合,从而有利于四聚体蛋白的饱和,从而使其稳定。