背景:RUNX1转录因子基因在散发性髓系和淋巴细胞白血病中经常通过易位、点突变或扩增发生突变。它还与易患急性髓细胞白血病(FPD-AML)的家族性血小板疾病有关。RUNX1控制的大部分未知生物通路的破坏可能是白血病发生的原因。我们使用了多种微阵列平台和生物信息技术来帮助识别这些生物途径,以帮助理解RUNX1突变导致白血病的原因。
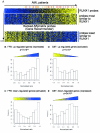
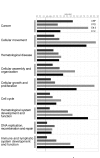
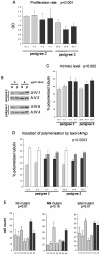
结果:在这里,我们报告了由RUNX1直接或间接调节的基因,这些基因是基于对3种不同人类和小鼠平台产生的基因表达谱的研究。使用的平台是对以下各项的全球基因表达谱分析:1)FPD-AML患者RUNX1突变的细胞系,2)RUNX1和CBFbeta的过度表达,以及3)使用cDNA或Affymetrix微阵列的RUNX1敲除小鼠胚胎。我们观察到,我们的数据集(差异表达基因列表)与已发表的来自RUNX1或其辅因子CBFbeta突变的散发性AML患者的微阵列数据显著相关。在差异表达基因中发现了许多生物学过程,功能检测表明,FPD-AML患者的杂合RUNX1点突变损害细胞增殖、微管动力学和可能的遗传稳定性。此外,对差异表达基因的调控区的分析首次系统地鉴定了许多潜在的新RUNX1靶基因。
结论:这项工作是首次尝试识别由RUNX1调节的遗传网络的大规模研究,RUNX1是造血系统和白血病发展的主调节器。RUNX1控制的生物途径和靶基因在家族性和散发性白血病的疾病进展以及治疗意义中具有重要意义。