结果和讨论
ALFY定位于细胞突起
ALFY包含几个C末端结构域,包括一个功能未知的PH-BEACH-domain、五个WD重复序列、一个与GABARAP蛋白结合的LC3-相互作用区域(LIR)和一个PtdIns(3)P-结合FYVE-domains(Simonsen等人,2004年;Lystad等人,2014年) (图1A) ●●●●。ALFY的大尺寸(3526个氨基酸,68个外显子)使得克隆和表达全长蛋白变得困难,因此以前的研究是基于用抗ALFY抗体对固定细胞进行免疫染色或表达缺失突变体(Clausen等人,2010年;Simonsen等人,2004年). 我们现在已经成功地在HeLa和U2OS T-Rex Flp-in细胞中克隆并表达了全长ALFY,该ALFY用增强型绿色荧光蛋白(EGFP)或串联二聚体NeonGreen(tdNG)标记(图S1A、B).两种细胞系的活细胞成像显示ALFY定位于分布在细胞质中的动态小泡状结构,细胞突起丰富,靠近基底质膜(图1B类;图S1C). 有趣的是,ALFY阳性结构被积极地重新分配到迁移细胞的前进前缘和后退后缘(图1C) ,指示ALFY在细胞迁移期间的作用。
图1。
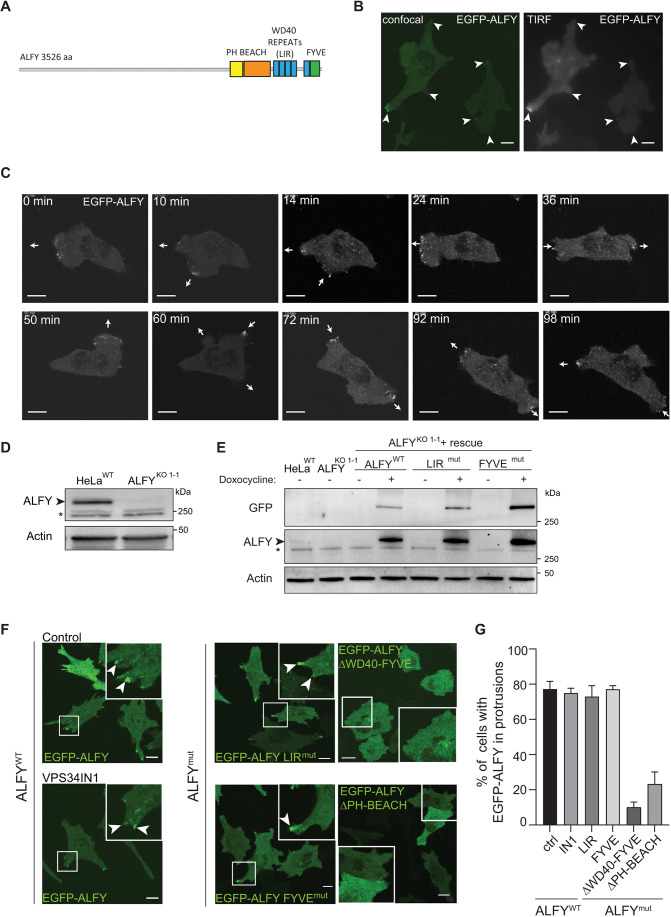
ALFY定位于细胞突起。(A) ALFY的域结构。ALFY包含一个长的N末端,随后是一个带有PH-BEACH-domain的保守C末端,五个WD重复序列,包括一个LC3-相互作用区域(LIR)和一个PtdIns(3)P-结合FYVE-domain。(B) 用四环素处理诱导表达EGFP–ALFY的HeLa细胞24小时 h和使用旋转圆盘共焦(左)或TIRF(右)成像模式实时成像。箭头突出细胞突起中积累的荧光信号。比例尺:10 微米。(C) 希拉牌手表KO1-1公司用3×Flag–EGFP–ALFY稳定转染的细胞被实时成像100 最小值箭头表示电池前端和后端的移动方向。比例尺:10 微米。(D) HeLa T-Rex FlpIN的蛋白质印迹重量和ALFYKO1-1公司CRISPR-Cas9生成的细胞株*表示非特定蛋白质带。(E) HeLa T-Rex FlpIN的蛋白质印迹重量、ALFYKO1-1公司和ALFYKO1-1公司用强力霉素处理或不处理拯救细胞以诱导EGFP-ALFY、LIR的表达多用途终端和FYVE多用途终端.*表示非特定带。B-E中的图像代表了三个实验。(F) ALFY公司KO1-1公司用强力霉素处理救援细胞系24小时 h诱导EGFP–ALFY、EGFP-ALFY LIR的表达多用途终端、EGFP–ALFY FYVE公司多用途终端、EGFP–ALFYΔWD40-FYVE和EGFP-ALFY△PH-BEACH,然后进行活细胞成像。EGFP-ALFY公司重量细胞是否用VPS34IN1处理2次 h(左图)。箭头突出细胞突起中积累的荧光信号。比例尺:10 微米。(G) 量化F图像中突起中含有EGFP–ALFY的细胞百分比(%)(每个细胞系35–100个细胞的平均值±标准偏差)。
为了进一步研究野生型(WT)和突变型ALFY蛋白的定位和功能,在HeLa T-Rex Flp-in细胞(HeLa ALFY)中耗尽ALFY击倒对手)使用两种不同的引导RNA(图S1D)经western blotting证实(图1D类;图S1E)用几种抗ALFY抗体进行免疫沉淀(图S1F). 选择了几个KO克隆进行进一步研究(ALFYKO1-1公司、ALFYKO2-6型,阿尔菲KO2-9型和ALFYKO2-11型)以及用于生成可诱导表达EGFP–ALFY WT、LIR或FYVE域突变体的救援细胞系(图1E和4B) ●●●●。与EGFP–ALFY、EGFP-ALFY LIR类似多用途终端和FYVE多用途终端局限于细胞内结构和细胞突起(图1F、 G),表明ALFY对突起的定位独立于其与GABARAP蛋白和PtdIn(3)P的结合(Simonsen等人,2004年;Lystad等人,2014年). 同样,在用VPS34抑制剂(VPS34IN1)处理的细胞中,EGFP–ALFY在突起处的定位不受影响(图1F、 G)。相反,缺乏WD40-FYVE结构域(EGFP–ALFYΔWD40-FYVE)或PH-BEACH结构域的ALFY突变体在细胞突起中没有表现出富集(图1F、 G),提示其C末端部分在靶向细胞突起中的作用。
图4。
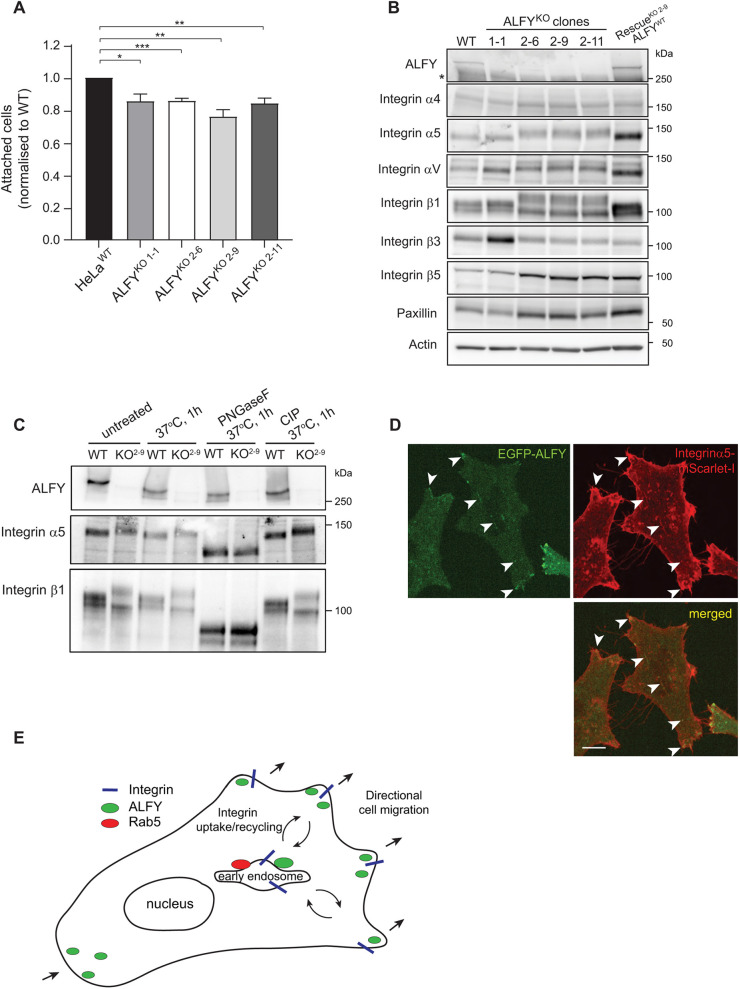
ALFY调节细胞粘附和整合素贩运。(A) 附加HeLa比例的量化重量和ALFYKO1-1公司、ALFYKO2-6型、ALFYKO2-9型和ALFYKO2-11型相对于野生型的细胞(用CellMask染色)(平均值±s.e.m。,n个=4). *对<0.05; **对<0.01; ***对<0.001(非配对双尾学生t吨-测试)。(B) HeLa整合素蛋白水平的分析重量和ALFYKO1-1公司、ALFYKO2-6型、ALFYKO2-9型和ALFYKO2-11型细胞以及ALFYKO2-9型EGFP–ALFY救援小组。这些斑点是三个独立实验的代表。(C) 希拉牌手表重量和ALFYKO2-9型是否用PNGaseF或CIP处理1次 37°C下放置h,然后使用所示抗体进行western blot分析。(D) ALFY的代表性活细胞图像KO2-9型EGFP–ALFY救援细胞,与整合素-α5–mScarlet-I共同表达。箭头表示两种结构均为阳性。比例尺:10 微米。C、D中的图像代表了三个实验。(E) ALFY在细胞迁移中的作用模型。ALFY定位于迁移细胞前缘和后缘的细胞突起,以及早期内体。通过存在于这些结构上,ALFY调节粘附蛋白(如整合素)的正确分类和双向运输,从而控制定向细胞迁移。
ALFY以PtdIns(3)P依赖性方式定位于早期内体
通过不同细胞质标记物的联合免疫染色分析EGFP–ALFY阳性结构的性质。令人惊讶的是,EGFP–ALFY与早期内体标记物EEA1和RAB5广泛共定位(图2A、 B类;电影1)而晚期内体标记RAB7或再循环内体标记LAB11检测到动态的“接吻和奔跑”相互作用(图S1G、H,电影2,三). 我们在活细胞成像过程中注意到,EGFP–ALFY的亚细胞定位对温度高度敏感,因为它对细胞突起的定位在用冷PBS洗涤细胞10分钟后丢失 室温下的最小值(图S1I). 考虑到许多细胞内事件,包括内吞和分泌,在低温下受到抑制(Saraste等人,1986年;Tomoda等人,1989年)以及ALFY-FYVE结构域与PtdIns(3)含磷膜的弱结合(Reinhart等人,2021年),ALFY向早期内体的募集可能依赖于活性。
图2。
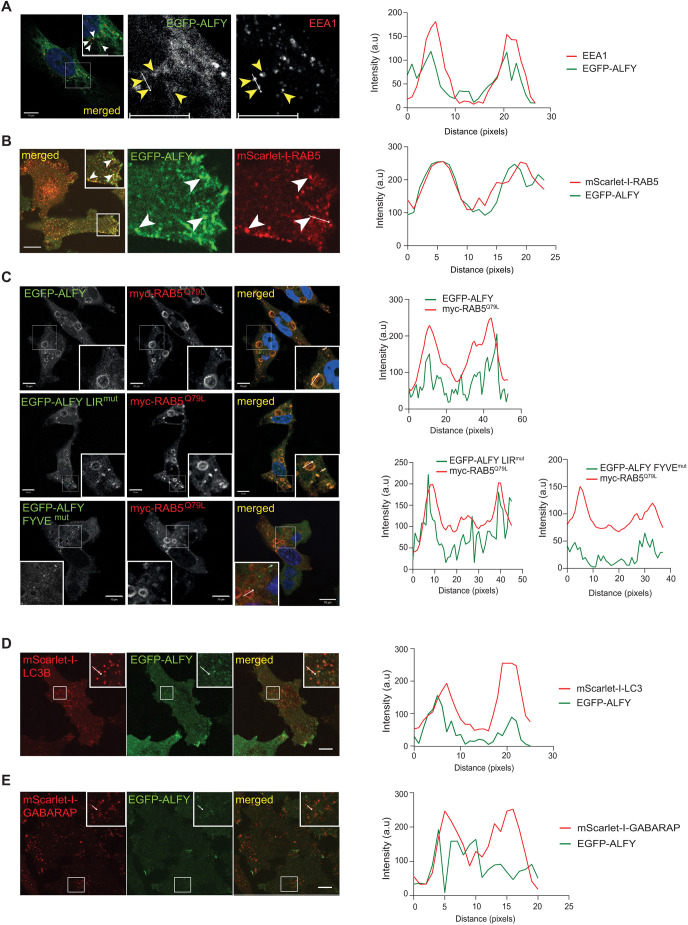
ALFY以PtdIns(3)P依赖性方式定位于早期内体。(A) ALFY公司KO1-1公司EGFP–ALFY救援细胞被固定,并针对EEA1进行免疫染色,并通过共焦显微镜进行分析。黄色(插图中为白色)箭头突出显示EGFP–ALFY结构,EEA1为正。共定位直方图来自标记线中的两个囊泡。(B) ALFY公司KO1-1公司稳定表达mScarlet-I–RAB5的EGFP–ALFY细胞用四环素处理过夜,并用肝细胞成像进行分析。mScarlet-I–RAB5-和EGFP–ALFY-阳性点用箭头表示,标记线的柱状图中显示了同位化。(C) 赫拉·阿尔菲KO1-1公司使用EGFP–ALFY、EGFP-ALFY LIR抢救的细胞多用途终端或EGFP–ALFY FYVE多用途终端瞬时转染Myc–RAB5Q79升,固定为18 转染后h,针对Myc进行免疫染色,以显示RAB5Q79升共焦显微镜分析前的结构。指示Myc–RAB5的结肠化直方图Q79升结构如图所示。(D) ALFY公司KO1-1公司稳定表达mScarlet-I标记的LC3B的EGFP-ALFY细胞用四环素治疗并进行活体成像。从指示的结构中测量Colocalization。(E) ALFY公司KO1-1公司用四环素处理具有稳定表达mScarlet-I标记的GABARAP的EGFP–ALFY细胞,并对其进行活体成像。从指示的结构中测量Colocalization。图像是三个实验的代表。比例尺:10 微米。
因为ALFY的LIR和FYVE域对其突起定位都不是必需的(图1F、 G),我们询问这些基序是否是ALFY向早期内体募集所必需的。海拉阿飞KO1-1公司表达EGFP–ALFY、EGFP-ALFY LIR的细胞多用途终端或EGFP–ALFY FYVE多用途终端转染了组成性活性GTPase缺陷RAB5突变体(Myc–RAB5Q79升)产生扩大的早期内体。EGFP–ALFY和EGFP-ALFY LIR多用途终端被有效招募到Myc–RAB5第79季度囊泡,同时补充EGFP–ALFY FYVE多用途终端大大减少了(图2C) 表明ALFY向早期内体的募集需要其FYVE结构域,但与GABARAP的结合无关。EGFP–ALFY FYVE多用途终端然而,是否局限于小型RAB5阴性结构(图2C类;图S2B)与VPS34IN1处理的细胞中存在EGFP–ALFY阳性结构一致(图1F) ●●●●。
如前所述(Simonsen等人,2004年;Lystad等人,2014年),我们观察到EGFP–ALFY与自噬标记mScarlet-I–LC3B(LC3B也称为MAP1LC3B)的一些共定位(图2D) 和mCarlet-I–GABARAP(图2E) 而全长ALFY在基础条件下未能与自噬受体mScarlet-I–SQSTM1共定位(图S2A).
为了阐明ALFY的可能内体功能,我们分析了转铁蛋白(Tfn)的循环和Tfn受体(TfR)的降解,以及WT和ALFY中表皮生长因子(EGF)受体(EGFR)和罗丹明EGF的降解KO1-1公司细胞。而在ALFY中,Tfn再循环和TfR降解不受影响KO1-1公司单元格(图S2C-E)在ALFY中,EGFR和罗丹明–EGF水平降低KO1-1公司细胞与WT细胞的比较(图S2F–J),表明ALFY调节EGFR从早期内体到溶酶体的货物分选。
总之,我们表明EGFP–ALFY以PtdIns(3)P依赖的方式定位于早期内体,但它也独立于PtdIns(3)P被招募到细胞质结构。
定向细胞迁移需要ALFY
ALFY定位于迁移细胞的前缘和后缘,以及它在大脑皮层神经发生过程中的神经迁移作用,促使我们研究ALFY在细胞迁移中的作用。28例伤口愈合分析 h透露ALFY击倒对手细胞显示伤口闭合减少(图3A、 B),但与HeLa相比增殖相似重量单元格(图S3A),表示ALFY击倒对手细胞迁移能力减弱。通过手动跟踪单个细胞,我们发现ALFY击倒对手细胞迁移速度比HeLa快重量细胞,但缺乏方向性,因此无法迁移到伤口中(年-方向,FMLY)(图3C、 D类;图S3B). 这让人想起在ALFY KO小鼠中观察到的轴突寻路缺陷,即轴突对趋化性线索没有反应(Dragich等人,2016年).
图3。
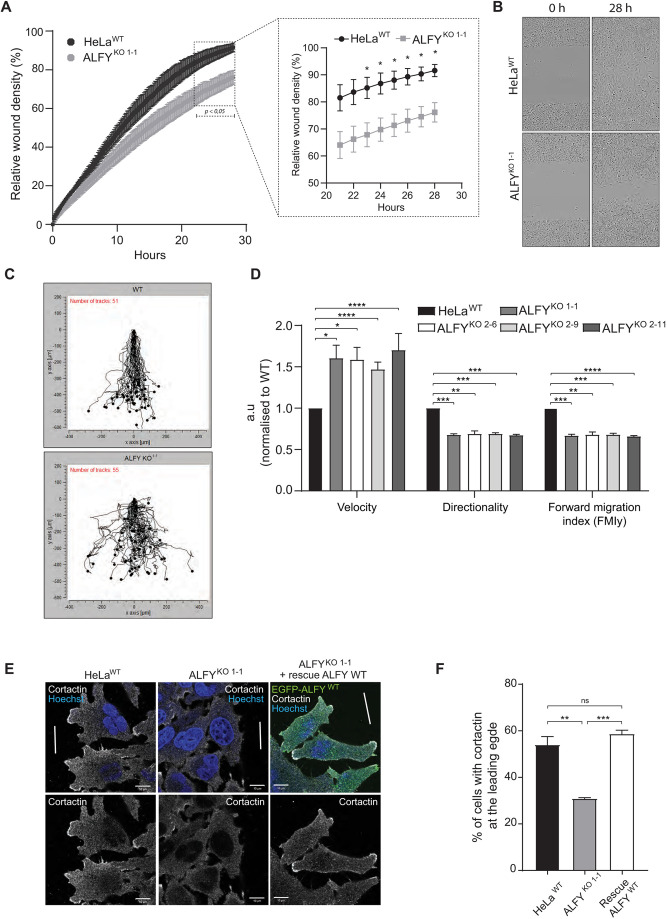
定向细胞迁移需要ALFY。(A) HeLa创面愈合分析重量和ALFYKO1-1公司使用孵化器的细胞®活细胞成像系统。从三个独立实验的三个重复中量化平均相对伤口密度。左侧面板中用虚线方框标记的时间点显示为右侧的放大图(平均值±s.e.m。,n个=3). *对<0.05,通过多重非配对双尾t吨-测试。(B) A中显示HeLa伤口密度的典型实验图像重量和ALFYKO1-1公司在0和28 h.图像显示1460×1970 微米。(C) 代表希拉运动的图形重量和ALFYKO1-1公司通过使用趋化和迁移工具(Ibidi)跟踪来自实验的图像中的单个细胞而获得的细胞,如在A中。(D) 手动跟踪HeLa伤口愈合分析的图像重量、ALFYKO1-1公司、ALFYKO2-6型、ALFYKO2-9型和ALFYKO2-11型,显示了沿年-轴(平均值±s.e.m。,n个=3). *对<0.05, **对<0.01; ***对<0.001****对<0.0001(未配对双尾学生t吨-测试)。(E) HeLa前缘形成分析重量单元格,ALFYKO1-1公司单元格和ALFYKO1-1公司多西环素诱导EGFP–ALFY表达的救援细胞,针对皮质素进行免疫染色以标记前沿。白线表示引入的伤口。(F) 在前缘有皮质素的E细胞百分比(%)的量化。(平均值±标准误差。,n个=3). **对<0.01; ***对<0.001;ns,不显著(非配对双尾学生t吨-测试)。
此外,皮质素的补充,这是一种促进肌动蛋白分支的蛋白质,在细胞迁移过程中补充到细胞的前沿(Ammer and Weed,2008年),在ALFY中被显著废除KO1-1公司细胞与HeLa的比较重量细胞,但通过EGFP–ALFY的表达解救(图3E、 F),表明ALFY在细胞定向迁移过程中促进前缘的形成,与前缘细胞突起的富集相一致(图1C) ALFY的方向性降低击倒对手单元格(图3C、 D类;图S3B).
ALFY调节细胞粘附和整合素糖基化
由于ALFY定位于细胞突起并调节细胞迁移,我们询问ALFY是否可能调节FA的周转,这对细胞在迁移过程中的粘附和分离非常重要。事实上,ALFY的附件显著减少击倒对手细胞与HeLa的比较重量单元格(图4A) ●●●●。为了确定这是否由FA蛋白的变化引起,我们检测了ALFY中整合素蛋白的表达水平击倒对手和救援小组。有趣的是,ALFY中整合素-α5、整合素-A V和整合素β1蛋白带的迁移减少KO2型克隆,在EGFP–ALFY的重新表达后得到了拯救(图4B) ●●●●。此外,在ALFY中检测到整合素αV和整合素β3的蛋白水平增加,以及帕西林的水平降低KO1-1公司细胞系(图4B) ●●●●。尚不清楚为什么这两个ALFY击倒对手克隆影响不同的整合素,但由于ALFY是一种具有多个转录物的非常大的蛋白质,我们不能排除两个导向(g)RNA(靶向不同的外显子)导致ALFY的一部分可能具有显性负功能的表达,尽管可用抗体没有观察到截短蛋白(图S1E、F). 然而,在ALFY耗竭时观察到的整合素变化可以通过全长ALFY的表达来挽救,这表明ALFY调节整合素的贩运以及可能的翻译后修饰。为了解决后者,WT和ALFY击倒对手用PNGaseF酶处理细胞以裂解N-聚糖或小牛肠磷酸酶(CIP)以去除磷酸盐。整合素α5和整合素β1在ALFY中迁移率的差异击倒对手用PNGaseF处理的细胞中细胞完全丢失,而CIP处理没有影响(图4C) ,证明ALFY调节整合素的N-糖基化。整合素α5和整合素β1都含有几个潜在的N-连接糖基化位点,它们的糖基化可以影响异二聚体和结合特性、细胞迁移和粘附(Isaji等人,2009年,2006;Marsico等人,2018年;Hang等人,2017年). ALFY如何调节整合素糖基化的机制尚不清楚,但在细胞突起和细胞内结构中与整合素-α5–mScarlet-I共定位(图4D) 以及RAB5A和EEA1(图2A、 B类;电影1)提示它可能调节整合素从质膜的内吞作用及其向再循环室的转运。我们观察到ALFY与再循环内体标记RAB11A和晚期内体标记LAB7A紧密并置和短期共定位(图S1G、H,电影2,三)支持这一假设。RAB11阳性再循环内体中整合素的糖基化(Kitano等人,2021年)和跨高尔基网络或核周再循环隔间,其中整合素在长循环再循环过程中是横向的(De Franceschi等人,2015年),可以解释ALFY中整合素-α5β1的不同糖基化模式击倒对手细胞。有趣的是,据报道整合素-α5的N-糖基化可调节EGFR的激活(Hang等人,2015年)这可能解释了ALFY的作用击倒对手EGFR营业额(图S2F–J).
活细胞成像显示,ALFY在与帕罗西林降解脂肪酸密切相关的高流动性结构中富集,表明它们可以传递或去除脂肪酸成分(图S3C). 已经确定,迁移细胞必须去除细胞后部聚集的黏附物,并在细胞前缘将其重新导入以向前迁移(Bretscher,1989年,1992). 正如我们在细胞前缘和后缘观察到的EGFP–ALFY阳性结构(图1C) 我们推测ALFY参与了早期内体的双向运输(图4E) ●●●●。然而,还需要进一步的实验来确定ALFY介导的贩运的性质及其在整合素糖基化中的作用。
在本研究中,我们首次报道了活细胞中全长ALFY的细胞内定位和动力学。我们发现ALFY定位于细胞突起和早期内体,从那里它似乎调节整合素的正确分类,从而控制细胞的定向迁移和附着(图4E) 。因此,我们的结果为在缺乏Alfy的小鼠中观察到的缺陷神经元迁移和寻路表型提供了解释(Dragich等人,2016年).
材料和方法
细胞系、培养基和抑制剂
HeLa T-Rex Flp-In细胞系(Tighe等人,2008年)作为礼物从英国曼彻斯特大学的安东尼·蒂奇和斯蒂芬·泰勒以及U2OS T-Rex Flp-In细胞系获得(Malecki等人,2006年)是美国哈佛医学院Stephen C.Blacklow的一份礼物。细胞保存在Dubecco改良的Eagle’s培养基(DMEM;Gibco)中,补充10%胎牛血清(FBS),5 U/ml青霉素和50 µg/ml链霉素,以及5 µg/ml速溶素(Invitrogen)和100 μg/ml zeocin(Invitrogen)维持TET阻遏物和Flp-In位点。在Flp-in位点有稳定整合基因的细胞系保存在5个 µg/ml速溶素和100 µg/ml潮霉素B(VWR)和17-24诱导的基因表达 用1进行h处理 µg/ml强力霉素(Clonetech/AH)或四环素(Sigma,T7660)。在2 µg/ml用于选择转染CRISPR质粒的细胞。VPS34IN1(Selleckchem)用于5 2μg/ml h.在100℃下使用Bafilomycin A1(BafA1;Enzo,BML-CM110-0100) nM用于抑制溶酶体降解。对所有细胞系进行常规污染检测。
抗体
以下主要抗体用于免疫荧光和/或免疫印迹:兔抗ALFY(1:1000;Novus Biologicals,NBP1-03332,Bethyl Laboratories,A301-869A,Abcam,ab84888,LSBio,Cat.No LS-C483076和Simonsen等人,2004年)抗EEA1(1:250,BD Biosciences,610457),抗Myc(1:500,Abcam,ab9132),抗rtactin(1:200,Millipore upstate,05-180),抗paxillin(1:1000,Abcan,ab32084),抗β-actin(1:1000;Cell Signaling Technology,#3700),反标志(1:1000、Sigma,F1804),抗GFP(1:1000),克隆泰克,#632381),抗整合素-α4(1:1000,细胞信号技术,8440T),抗整合酶-α5,抗整合素-β5(1:1000,细胞信号技术,3629T),抗EGFR(1:5000,Fitzgerald,20-ES04),抗转铁蛋白受体(1:5000,Zymed,13-6890),抗小鼠IgG(Starbright 700,BioRad,12004158),抗兔IgG(DyLight 800,赛默飞世尔科学公司,SA5-10044),抗绵羊IgG(DyLight 594,赛默飞世尔科学公司,SA510056),抗兔IgG(HRP,Jackson,ImmunoResearch 111-035-144)、抗鼠IgG、抗兔(DyLight 649、Jackson、ImmunoResearch 711-495-152)、抗小鼠IgG和抗山羊IgG。用Hoechst 33342(Invitrogen,H1399)进行DNA染色。
质粒和克隆
ALFY通过PCR从人类cDNA文库中扩增出四个片段(碱基对1–3028、2256–5425、5123–7570和7355–10581),并克隆到PCR blund II TOPO载体(Invitrogen)中。为了产生LIR和FYVE域突变体,使用QuikChange Lightning Multi-Site-Directed突变试剂盒(Agilent)对含有目标ALFY序列的构建物进行突变。带有或不带有LIR或FYVE突变的ALFY片段通过pENTR1A(Invitrogen)中的Gibson组装连接,生成全长ALFY。通过测序验证得到的全长ALFY插入物。缺乏PH-BEACH或WD40-FYVE结构域的ALFY构建物是通过从全长pENTR-ALFY中克隆限制性内切酶而生成的。使用来自pENTR1A-ALFY WT、LIR或FYVE突变体或ΔPH-BEACH-或ΔWD40-FYVE突变的网关重组克隆(Invitrogen)生成pDest-FlpIn-tdNGFlag-ALFY和pDest-FlpIn-EGFP-ALFY。通过将相应的cDNA亚克隆到pLVX puro慢病毒骨架中的限制性内切酶产生用于稳定转染mScarlet-I–RAB5A、mScarlet-I–RAB7A、mScarlet-I–Rab11A、mScarlet-I–LC3B、mScarlet-I–GABARAP和mScarlet-I–SQSTM1的载体(Takara Bio)。为了生成表达串联二聚体NeonGreen的Gateway目的载体(pDestFlpIn-tdNGFlag),合成了编码两个NeonGreen3×Flag标签拷贝的cDNA作为连接子序列从头开始(ThermoFisher GeneArt基因合成)并将其克隆到pDestFlpInHA载体中,而不是HA标签。pLVX-paxillin-mScarlet-I和pLVX-整合素α5-mScarlet-I由Gibson组装产生。所有结构均通过Sanger测序进行验证。pCMV-VSV-G为Addgene质粒#8454(保藏人Bob Weinberg),psPAX2为Addgene质粒#12260(由Didier Trono存放)。pcDNA3-myc-RAB5-WT和-Q79L质粒是挪威奥斯陆大学医院癌症研究所的Harald Stenmark教授赠送的礼物。
病毒的产生和转导
106HEK-FT细胞在10 cm培养皿,第二天转染1.6 μg pCMV-VSV-g、psPAX2和转移质粒。24天后更换培养基 收集含h和慢病毒的培养基,并通过Acrodisc 0.45进行过滤 48和72处的µm超膜注射器过滤器 转染后h。对于细胞感染,105HeLa或U2OS细胞被镀在六孔板的孔中,第二天将细胞培养基更换为2 ml新鲜培养基,含0.5 ml含慢病毒培养基和8 µg/ml聚brene(圣克鲁斯生物技术公司)。介质已更改24 含2的新鲜培养基感染后h μg/ml嘌呤霉素。将嘌呤霉素选择的细胞池用于实验。
稳定转染细胞系的产生
海拉霸王龙FlpIN重量、ALFY击倒对手用pOG44 Flp重组酶表达载体(Invitrogen)和pDEST-FlpIN-EGFP-ALFY、LIR联合转染U2OS细胞多用途终端、FYVE多用途终端、ΔPH-BEACH或ΔWD40-FYVE(用于HeLa细胞)或pDest-FlpIN-tdNGFlag-ALFY(用于U2OS细胞),比例为10:1,使用X-tremeGene9 DNA转染试剂(Roche,XTG9-RO)。24点 转染后h,细胞分裂为4个10 容量为200厘米的盘子和培养基 添加µg/ml Hygromycin B(VWR)以选择含有稳定整合到基因组中的感兴趣基因的细胞。选择单个克隆2 选择后数周,通过蛋白质印迹和共聚焦成像检测EGFP–ALFY的表达。mScarlet-I–RAB5A、mScarlet-I–RAB7A、mScaret-I–RAB11A、mScar let-I-LC3B、mScartlet-I—GABARAP、mScarmet-I–SQSTM1和paxillin–mCarlet-I是通过感染慢病毒颗粒产生的,如病毒产生和转导部分所述。Lipofectamine 2000(Invitrogen,11668019)用于瞬时转染。
CRISPR/Cas9诱导ALFY KO细胞系的建立
为了产生ALFY KO细胞系,按照Zhang lab克隆方案制作了CRISPR质粒(Ran等人,2013年). 使用crispr.mit.edu crispr设计工具设计了两个独立的单导向RNA(#1,5′-GATCGGGAGCTTTAGAGG-3′;#2,5′-GCAGAGTGAAGCAGTAG-3′),并从Sigma(图S1D). 将导向物克隆到hSpCas9-2A-Puro V2.0(px459)质粒(Addgene#62988)并根据制造商的协议,使用X-tremeGene9转染试剂(Roche)转染HeLa TRex FlpIN细胞。24小时后,用含有2.0 μg/ml嘌呤霉素。3之后 第天,用连续稀释法将耐嘌呤霉素细胞以每孔单细胞密度接种在96周的平板中。对几个克隆进行了测试,并通过western blotting对敲除的克隆进行了确认。
细胞裂解和western印迹
对于western blot分析,在裂解缓冲液(150 mM NaCl,1%Triton®声波风廓线仪X-100,1 mM EDTA和50 mM Tris-HCl pH 7.4),补充完整的蛋白酶抑制剂鸡尾酒(罗氏,05056489001)10 冰块上的最小值。裂解产物在15000下离心克用于10 用BCA蛋白测定法(Pierce,23225)测量上清液的蛋白浓度,以确保SDS-PAGE上的装载量相等。SDS-PAGE后,使用一级抗体和荧光团或HRP偶联的二级抗体进行蛋白质印迹,用Chemidoc™MP成像系统(BioRad)进行检测和分析。检测前,将含有HRP-结合抗体的膜与Supersignal™West Dura Extended duration底物(Thermo Fisher Scientific,34075)孵育5 最小值。
对于EGFR的蛋白印迹,细胞被血清饥饿2 用50 ng/ml EGF(Santa Cruz Biotechnology,sc-4552)用于指定时间点。随后裂解细胞并制备用于如上所述的蛋白质印迹。
用于PNGaseF和小牛肠磷酸酶(CIP)治疗,3×105HeLa WT或ALFY KO2-9细胞被镀在六孔板的孔中,并在100个孔中溶解 50µl/孔 mM Tris-HCl pH值7.5150 mM NaCl,次日1%Triton X-100。细胞裂解物在12000℃离心分离 克用于5 最小值用于PNGaseF治疗,9 将微升细胞裂解液与1 微升糖蛋白变性缓冲液(NEB,B1704S),加热至100°C 10 分钟,然后在冰上冷却,补充2 µl的10×GlycoBuffer2(NEB,B3704S),2 微升10%NP40,1 µl PNGaseF(NEB,P0709S)和5 微升水,孵育1小时 37°C时为h。用于CIP治疗,9 µl细胞裂解液补充1.1 µl 10×NEBuffer2和1 微升CIP(NEB,M0290S)并孵育1 37°C时为h。
免疫沉淀
为了进行免疫沉淀,细胞在含有150 mM NaCl,1%Triton®声波风廓线仪X-100和50 mM Tris-HCl pH 8.0,添加完整蛋白酶抑制剂鸡尾酒(罗氏,05056489001)(500 微升/10 cm盘子)。将裂解产物在4°C下旋转培养30 min。在16000℃下离心裂解产物克用于10 4°C下培养min,上清液与5 µl抗ALFY抗体在4°C下旋转过夜。通过添加20 µl蛋白G动态珠(Invitrogen,10003D)至裂解物中1 h在4°C下旋转。使用DynaMag磁铁(12321D)收集结合蛋白,并在裂解缓冲液中洗涤三次。用PBS清洗珠子两次,并在50分钟内重新悬浮 µl PBS,然后进行质谱分析或western blot分析。
转铁蛋白回收和流式细胞术分析
为了测量Tfn循环,首先将WT和ALFY KO电池置于冰上10 分钟,用10进行治疗前 µg/ml Alexa Fluor 555结合Tfn(Invitrogen,T35352电话)用于15 min。然后用PBS清洗细胞,并在37°C的细胞培养条件下追踪指定的时间段。追逐后,将细胞胰蛋白酶化,用4%多聚甲醛(PFA)固定,离心3 500时最小值克以使细胞沉淀。细胞在PBS中清洗,并通过与5 ml试管(猎鹰,352235)。使用Acea Biosciences的NovoCyte流式细胞仪通过流式细胞术分析细胞。
罗丹明–EGF降解分析
用50 ng/ml罗丹明–EGF(Invitrogen,E348)15 37°C时最小值,然后是60、30或0 用4%PFA(Polysciences,18814-10)固定15分钟 冰块上的最小值。将1×PBS添加到每个孔中,并使用Andor Dragonfly 505旋转圆盘共焦显微镜和NIKON Apo TIRF 60×/1.49 NA油浸物镜获取罗丹明–EGF图像。通过获取一系列具有0.3的z堆栈来成像整个细胞体积 µm轴向距离。对于罗丹明-EGF的图像分析,z(z)-用叠加最大强度投影法分割细胞中的罗丹明–EGF囊泡。使用CellProfiler定量罗丹明–EGF阳性囊泡的平均计数和大小(面积)(v.4.1.3)(Carpenter等人,2006年).
免疫荧光、共焦显微镜和共定位分析
细胞生长在玻璃盖片上或玻璃底部的8孔室中,并按照所述进行处理,然后在4%多聚甲醛(PFA;Polysciences,18814-10)中固定15 室温下的最小值。PFA在0.05时淬火 M NH公司4Cl代表10 min,然后渗透5 在含有0.05%皂苷的PBS中的min。通过将固定细胞与指定的初级和相应的次级抗体孵育在含有0.05%皂苷的PBS中进行免疫染色。随后对细胞进行10次染色 最小值为1 g/ml Hoechst 33342在PBS中稀释。盖玻片安装在Prolong Diamond Antifade Mountant中(Invitrogen,第36965页)。使用蔡司LSM 710共聚焦显微镜和63×物镜对细胞进行分析。
使用ImageJ(斐济)生成彩色化直方图,方法是在感兴趣的结构中画一条线,并使用曲线图函数获得每个像素的灰度值(强度)。为了生成图形,绘制了两个重叠通道的强度。
活细胞成像
在装有Okolab细胞培养箱的Andor Dragonfly 505高速共焦平台上,在FluoreBrite DMEM培养基(Gibco)中对八孔Lab-Tek II室盖玻璃中生长的细胞进行实时成像,该培养基配备有温度、CO2和湿度控制,使用NIKON Apo TIRF 60×/1.49 NA油浸物镜。旋转圆盘共焦模式用于所有图形,除了图1B、 右侧面板,其中TIRF模式为100 采用nm穿透深度。
伤口愈合分析和定向分析
将细胞接种在96孔ImageLock™平板(Essen Bioscience)中。当细胞成为融合的单层时,使用创伤制造工具(Essen Bioscience)进行创伤。为了清除细胞碎片,更换培养基,然后将培养板置于培养箱中®S3用于成像的活细胞显微镜(Sartorius)。每10口井采集一张图像 28分钟 h监测细胞向伤口的迁移。使用孵化器量化相对伤口密度®软件S3(Sartorius),测量每个时间点伤口区域内的空间细胞密度相对于伤口区域外的空间细胞浓度。使用三个独立实验的三个重复孔的平均值,将数据表示为平均相对伤口密度。
使用ImageJ软件和Manual tracking插件以及Chemotaxis and Migration工具(ibidi GmbH)对伤口愈合分析中的细胞进行手动跟踪。通过将欧氏距离除以由ibidi趋化和迁移工具获得的累积距离,计算细胞的持久性。
为了使用免疫荧光对细胞进行定向分析,细胞生长在带有500 µm电池自由间隙(ibidi)。移除插入物,并将细胞在新鲜培养基中培养4-5 h、 在固定和染色之前,如前所述标记前缘。为了通过共焦成像进行分析,从三个独立的实验中采集了5-10张图像。为了进行量化,手动计数前缘为皮质素阳性的细胞,并将其与每个视野中的细胞总数进行比较,同时对每个条件下的60-100个细胞进行计数。
细胞增殖试验
根据制造商的说明,使用细胞增殖和细胞毒性试剂盒(Boster,AR1156),使用3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化铵(MTT)分析法测量细胞增殖。细胞以不同细胞密度分三次接种在96周的平板中。24点 播种后h,将MTT加入培养基中,静置4小时 h用于活的、增殖的细胞形成紫色不溶性的formazan晶体。将晶体溶解过夜,并通过测量560的光密度来测定所得有色溶液的浓度 纳米。
细胞附着试验
将不同的细胞系用胰蛋白酶消化并用CellMask™深红质膜染色剂(Invitrogen,10046元)然后在96周的培养皿中播种(每个细胞系重复6次)。细胞孵育30 在PBS中进行三次清洗以去除未附着的细胞之前,使细胞附着在井底。使用Odyssey CLx Imager使用700激光扫描96孔板,并使用Image Studio™软件量化每个孔的总强度,作为剩余细胞的测量。
统计分析
使用GraphPad Prism 8.0.1和对-值来自于双尾t吨-未配对样本的测试,在对≤0.05(详见图例)。






