摘要 简单摘要 癌症治疗成本高,副作用和复发率高。 因此,新的(最好是天然的)、经济的和更安全的治疗和预防措施一直是人们的需求,并已成为优先研究的主题。 早些时候,我们已经证明了Ashwagandha树叶和蜂胶提取物的抗癌活性。 Wi-A(Ashwagandha提取物中的活性抗癌成分)和CAPE(蜂胶中的活性抗肿瘤成分)的组合早些时候被证明具有更高的癌细胞选择性细胞毒性。 在本研究中,我们报告了低剂量Wi-A和CAPE联合使用的抗转移活性及其作用机制,并建议将其用于癌症转移治疗。
摘要 维他福林A(Wi-A)和咖啡酸苯乙酯(CAPE)是Ashwagandha的生物活性成分( 桑尼氏威萨尼亚 )和蜂胶。 这两种天然化合物都已被证明具有抗癌活性。 在本研究中,我们招募了低剂量的每种化合物,并开发出一种具有显著抗迁移和抗血管生成活性的组合。 广泛的分子分析包括cDNA阵列和特定基因靶点的表达分析表明,这些活性是通过其对细胞粘附/紧密连接蛋白(Claudins、E-cadherin)、, 典型Wnt/β-catenin信号通路的抑制以及随后EMT信号蛋白(波形蛋白、MMPs、VEGF和VEGFR)的下调在癌症转移中起关键作用。 数据支持这种新型Wi-A和CAPE组合(Wi-ACAPE,包含0.5µM Wi-A与10µM CAPE)可能用于治疗转移性和侵袭性癌症,因此,需要通过招募各种实验和临床转移模型进行进一步评估。
关键词: ashwagandha、含aferin A(Wi-A)、蜂胶、咖啡酸苯乙酯(CAPE)、Wi-ACAPE组合、抑制、转移、血管生成、癌症治疗
1.简介 癌症是一种高度异质性疾病,涉及多种机制,这些机制与肿瘤的增殖、迁移和干细胞特性有关。 尽管在癌症研究和治疗方面取得了巨大进展,但由于其三个主要特征(i)转移,即癌细胞从体内的初级部位转移到次级部位的现象,(ii)耐药性和(iii)癌细胞干[ 1 , 2 , 三 ]. 这三种蛋白中的每一种都以多种方式涉及多种蛋白质的相互作用,以及影响癌症特征的功能网络,因此需要有针对性的治疗。 导致癌症进展和转移的一些主要蛋白和信号通路包括异常p53、PI3K/AKT/mTOR、EGFR、VEGF和Wnt/β-catenin信号[ 4 , 5 , 6 , 7 , 8 , 9 ]. 此外,各种癌症表型已被证明受组织微环境、microRNA和表观遗传机制的调控[ 10 , 11 , 12 ].
上皮细胞向间充质细胞转化(EMT)是肿瘤转移的关键步骤。 它允许癌细胞获得迁移和侵袭特性,由参与蛋白信号级联的多种EMT诱导转录因子(Twist、Snail、Slug和Zeb)调节,如p53、Akt、STAT3、MAPK、Wnt和β-catenin。 EMT主要表现为E-钙粘蛋白的下调和各种转移蛋白的上调,包括N-钙粘蛋白、波形蛋白、莫他林、基质金属蛋白酶(MMPs)和CARF[ 13 , 14 , 15 , 16 , 17 , 18 ]. E-cadherin是细胞间粘附的关键调节因子。 它形成粘附连接的重要组成部分,与β-连环蛋白结合并将其作为E-cadherin:β-连环素复合物固定在细胞膜中,从而阻止β-连锁素介导的EMT信号[ 19 , 20 ]. 在几种癌症中,E-cadherin的丢失被证明可以增强β-catenin的核移位,从而激活Wnt/β-catening信号,促进细胞迁移和侵袭[ 21 , 22 , 23 , 24 ]. 紧密连接和粘附连接由跨膜蛋白(Occludin和Claudin)组成,它们调节粘附细胞之间离子和溶质的运动,并阻止膜蛋白在顶膜和基底膜之间的混合。 激活的EMT通常以(i)紧密连接的丢失和E-到N-钙粘蛋白的转换为特征,后者定义了间充质细胞的特征[ 17 , 25 , 26 ]-和(ii)活性Wnt/β-catenin信号通路,转移信号的关键参与者。 β-catenin具有双重功能; 规范Wnt信号通路的细胞间粘附和转录激活的调节。 β-catenin的结构和信号传递特性的不平衡已在几种癌症中得到证实[ 27 , 28 , 29 , 30 ]. 然而,对潜在分子机制的理解仍然不完整。 β-连环蛋白在细胞质和细胞核中的稳定和积累是Wnt信号激活的重要标志。 在Wnt配体存在下,累积的β-连环蛋白转位到细胞核,并与T细胞因子(TCF)(一种转录因子)建立复合物,导致其下游靶基因活化,导致不受控制的细胞增殖和致癌。 肿瘤转移受基质金属蛋白酶的影响,基质金属蛋白酶在细胞外环境中发挥作用,导致基质和非基质蛋白降解。 它们在大多数癌症中富集,受一系列致癌因素的调节[ 17 ]. 同样,VEGF在血管和淋巴管的形成以及肿瘤血管生成中起着关键作用,在大多数癌症中被发现上调,并受缺氧信号和肿瘤微环境相关蛋白的调节[ 31 , 32 , 33 ]. 鉴于这些前提,Wnt/β-catenin、MMP和VEGF信号被认为是癌症治疗的靶点[ 9 , 17 , 34 ].
通过放射治疗、手术切除和/或化疗根除肿瘤是癌症治疗的传统方案,其目的是减轻癌症负担。 然而,由于治疗成本高、副作用多和耐药性研究,用于癌症治疗的天然化合物的开发已经启动。 早些时候,我们曾报道过蜂胶和Ashwagandha叶提取物中的抗癌活性( 桑尼氏威萨尼亚 ). 抗癌活性成分分别定义为咖啡酸苯乙酯(CAPE)和维他福林A(Wi-A)。 这两种药物都被证明具有多种抗癌活性[ 35 ]. 此外,我们开发了一种Wi-a和CAPE的组合,与单独使用这两种化合物相比,它们在人类卵巢癌和宫颈癌细胞中表现出更好的抗癌潜力[ 36 ]. 结果表明,该组合可激活p53并使PARP1(聚ADP-核糖聚合酶1)失活,从而导致癌细胞生长停滞或凋亡。 一些研究报告了Wi-A和CAPE在不同癌症模型中的抗转移活性,包括乳腺癌、胃肠道癌、黑色素瘤、非小细胞肺癌和卵巢癌[ 37 , 38 , 39 , 40 , 41 , 42 , 43 ]. 鉴于这些报道,我们研究了低剂量Wi-a和CAPE的联合是否可以提供抗转移活性。 以人宫颈癌(HeLa)和乳腺癌(MCF-7,Mortalin-OE(Mot-OE)MCF-7和MDA-MB-231)细胞为模型,分别或联合研究了化合物的抗迁移、抗侵袭和抗血管生成活性。 我们证明,Wi-a和CAPE的组合(称为Wi-ACAPE)在低剂量下具有抗转移活性及其分子作用机制。 基于其抗EMT、抗MMP和抗VEGF活性,Wi-ACAPE被认为是一种天然、经济和安全的混合物,用于抑制和治疗癌症转移。
2.材料和方法 2.1. 细胞培养与药物治疗 人宫颈癌细胞(HeLa)、乳腺癌细胞(MCF-7、Mortalin过度表达MCF-7(Mot-OE MCF-7)和MDA-MB-231)、正常肺成纤维细胞(MRC5和TIG-3)和脐静脉内皮细胞(HUVEC),取自日本研究生物资源细胞库(日本东京JCRB细胞库), 在37°C、5%CO的气氛下,在Dulbecco’s Modified Eagle’s Medium(DMEM)(Invitrogen,Carlsbad,CA,USA)中培养,补充5-10%胎牛血清(日本大阪富士薄膜WAKO纯化学公司)和1%青霉素-链霉素 2 制备Wi-A和CAPE的二甲基亚砜(DMSO)(日本大阪富士薄膜WAKO纯化学公司)中的5 mM储备溶液,并将其储存在−20°C下。 将化合物在细胞培养基中稀释至工作浓度0.5μM(Wi-A)、10μM(CAPE)或其组合Wi-ACAPE(0.5μM+10μM)。 细胞在约70%的汇合处用化合物处理48小时。
2.2. 细胞活性测定 使用MTT[3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化]分析法(Sigma-Aldrich,日本东京)通过定量细胞活性分析测定Wi-A、CAPE及其组合的细胞毒性。 细胞以5×10的密度接种在96-well板(TPP®,Trasadingen,Switzerland)中 三 细胞/孔,并在37°C的CO中培养24小时 2 孵化器。 用Wi-A、CAPE或它们的组合(如 图S1 和 图1 )48小时,然后添加MTT溶液(0.5 mg/mL;100μL/孔),在37°C下培养3-4小时,然后再添加100μL二甲基亚砜。 将平板摇晃10分钟,以适当溶解形成的甲霜晶体。 使用Infinite M200 Pro微孔板阅读器(瑞士梅内多夫帝肯集团有限公司)在570 nm处测量吸光度。
图1。
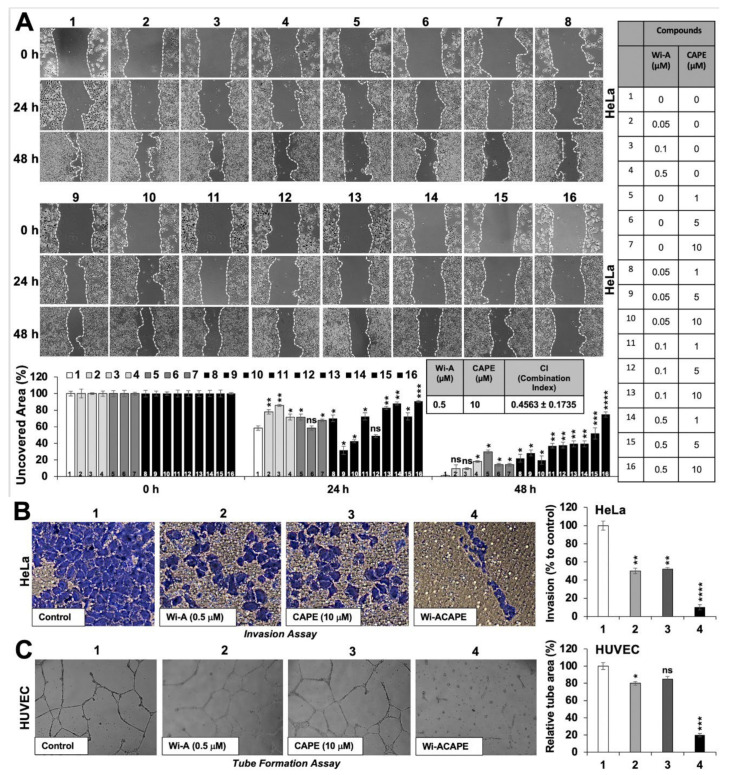
Wi-ACAPE具有抗转移潜能。 维他福林a(Wi-a)和咖啡酸苯乙酯(CAPE)联合治疗48小时可抑制体外细胞迁移、侵袭和血管生成。 更强的HeLa细胞迁移延迟效应( A类 ),入侵( B类 )和HUVEC细胞管形成( C类 )与单独使用Wi-A或CAPE相比,观察到Wi-ACAPE对治疗(48小时)的反应。 数据对照对照进行标准化,并绘制成百分比差异。 每个数据集表示至少三个独立实验的平均SD。 统计显著性定义为 第页 >0.05(纳秒), 第页 ≤0.05(*)时, 第页 ≤ 0.01 (**), 第页 ≤0.001(***)和 第页 ≤0.0001(****),分别表示不显著、显著、非常显著、高度显著和极显著。
2.3。 形态学观察 电池(15×10 4 /well)接种在6孔板中(TPP,Trasadengen,瑞士),放置过夜,然后与化合物孵育48小时。观察细胞形态,并使用尼康TS100-F相差显微镜(日本东京尼康)拍摄图像。
2.4. 体外划痕/伤口愈合试验 HeLa、MCF-7、Mot-OE MCF-7和MDA-MB-231细胞(1×10 5 细胞/孔)被镀在6孔板中(瑞士特拉萨丁根TPP),并允许在37°C的CO中通过过夜培养形成单层 2 孵化器。 用p200吸管尖端手动刮除细胞单层,形成线性伤口。 用PBS洗涤细胞三次,然后在对照培养基或试验化合物补充培养基(Wi-A、CAPE及其组合,如 图1 A) ●●●●。 使用尼康TS100-F显微镜(日本东京尼康)在0、24和48小时观察并捕获细胞向划痕区域的移动。
2.5. 体外细胞侵袭试验 使用康宁BioCoat Matrigel侵入室试剂盒(354480;康宁Labware公司,美国马萨诸塞州Two Oak Park)进行体外细胞侵入试验。 将悬浮在0.5 mL无血清Dulbecco改良Eagle’s培养基(DMEM)中的HeLa细胞接种到侵袭插入物的顶部。 将0.75 mL添加了10%胎牛血清的DMEM作为化学引诱剂添加到24孔板的孔中。 培养48小时后,将插入物转移到新板上并用PBS清洗。使用甲醇:丙酮(1:1)固定悬浮在每个插入物底部Matrigel基底膜基质中的细胞。 然后,用0.5%结晶紫对细胞进行过夜染色。 过多的污渍用蒸馏水冲洗去除。 插入物经空气干燥、可视化并在显微镜下拍照(日本东京尼康TS100-F)。 DMSO被用作车辆控制。
2.6. 试管形成分析 通过在基底膜基质上形成人脐静脉内皮细胞(HUVECs)管状结构来评估Wi-A、CAPE及其组合Wi-ACAPE的抗血管生成活性 组织培养板涂有250μL BD Matrigel生长因子还原溶液(BD Biosciences,Franklin Lakes,NJ,USA),并在37°C下培养30分钟,直到Matrigel变为固体。 HUVEC以1.5×10的密度接种在Matrigel涂层板中 5 细胞/孔,在M199培养基(对照)或试验化合物补充的M199培养液中培养。 捕获管状结构的图像; 通过Image-Pro Plus 6.0软件(美国马里兰州银泉市媒体控制论)测量管网覆盖面积。
2.7. cDNA阵列技术 按照制造商的方案,使用RNeasy迷你试剂盒(美国加利福尼亚州斯坦福巴伦西亚市齐根)从对照和处理的HeLa细胞中分离出总RNA。 分别使用NanoDropTM(Nanodrop ND-1000分光光度计)(Nanodrop Technologies,Inc.,Wilmington,DE,USA)和琼脂糖凝胶电泳测定RNA的数量和质量。 用Cy3或Cy5标记等量的总RNA样品(1µg),并使用cDNA微阵列(Cell Innovator Inc.,日本福冈)。 扩增cDNA,使用低输入快速扩增标记试剂盒(安捷伦,#5190-2305,Santa Clara,CA,USA)进行标记,并根据制造商的说明与60K安捷伦60-mer寡聚微阵列(SurePrint G3人类基因表达微阵列8×60K v3)杂交。 所有杂交微阵列载玻片均由安捷伦扫描仪扫描。 使用安捷伦特征提取软件(v9.5.1.1)计算相对杂交强度和背景杂交值。
每个样品获得的信号值用于计算治疗后不同基因相对于对照组的表达变化。 首先,计算Wi-A、CAPE和Wi-ACAPE联合处理细胞相对于未处理对照细胞的对数倍变化值。 log2倍数变化大于1或小于−1的基因分别被认为是上调和下调的。 然后,使用注释、可视化和集成发现数据库(DAVID)v6.8,在不同路径中富集这些失调基因( https://david.ncifcrf.gov网址/ (于2021年8月18日访问)。
2.8. 流式细胞术分析 按照制造商的说明,使用细胞表面染色流动分析试剂盒(Novus Biologicals,LLC,Englewood,CO,USA)检测对照和处理的HeLa细胞中VEGFR1和VEGFR2的细胞表面表达。 按照制造商的方案,使用Guava PCA流式细胞仪(Millipore,Billerica,MA,USA)进行表达分析。
2.9. Western Blot分析 48小时后采集对照和处理过的细胞,使用RIPA裂解缓冲液(美国马萨诸塞州沃尔瑟姆的赛默飞世尔科学公司)进行裂解,并辅以cOmplete TM公司 ,迷你蛋白酶抑制剂鸡尾酒(罗氏应用科学,德国曼海姆)。 然后,将总细胞裂解液在冷室(4°C)中涡流30分钟。将裂解液以15000 rpm离心15分钟。上清液进行BCA蛋白质分析(美国马萨诸塞州沃尔瑟姆的赛默飞世尔科学公司),以确定每个样品的蛋白质浓度。 在6–12%的SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)中分离等量的总蛋白(10–20µg),然后使用半干转移吸墨纸(日本东京ATTO公司)转移到聚偏二氟乙烯(PVDF)膜(Millipore,Billerica,MA,USA)上 或使用Mini-PROTEAN Tetra Cell(BIO-RAD,Hercules,CA,USA)进行湿法转移。 在室温下使用3%的牛血清白蛋白组分V(日本大阪富士薄膜WAKO纯化学公司)封闭膜60–120分钟。在4°C下用靶蛋白特异性一级抗体隔夜探测封闭膜。 主要抗体为:E-cadherin(24E10)、β-catenin(D13A1)、phospo-p38 MAPK(D3F9)、phospo-Akt(D9E)、Akt(C67E7)、phopho-c-Raf(56A6)、p44/42 MAPK(Erk½)(137F5)、FAK(D5O7U)、PI3激酶p110α(C73F8)、hnRNP-K(R332)和MMP9(G657)(Cell Signaling Technology,Danvers,MA,USA); Claudin 1(A-9)、Wnt-1(E-10)、Cyclin D1(DSC-6)、N-cadherin(D4R1H)、VEGFR2(A-3)、MMP1(3B6)、MMP2(2C1)、MMP3/10(F-10)、MMP7(FL-267)、纤维结合蛋白(568)和Vimentin(V-9),(美国加利福尼亚州帕索·罗伯斯圣克鲁斯生物技术公司); c-Myc(ab32072)、VEGFA(ab46154)和VEGFR1(ab32152)(英国剑桥Abcam); 摩塔林(37-6)[ 44 ]和CARF(A-10)[ 45 ]抗体是在我们实验室产生的。 在TBS-T中清洗三次后,用辣根过氧化物酶(HRP)结合二级抗体(抗兔IgG和抗鼠IgG(美国加利福尼亚州圣克鲁斯生物技术公司)培养印迹,并使用增强化学发光系统(英国白金汉郡GE Healthcare)进行开发。 抗β-肌动蛋白抗体(英国剑桥Abcam)用作内部负荷控制。 蛋白质带图像通过ImageJ 1.46软件(美国马里兰州贝塞斯达国立卫生研究院)进行分析。
2.10. 免疫荧光 HeLa细胞(4×10 4 电池/孔)被镀在放置在12孔板中的18-mm玻璃盖玻片上,并放置一夜。 24小时后,用Wi-A、CAPE或它们的组合处理细胞48小时,然后用PBS洗涤两次,并在4°C的甲醇:丙酮(1:1)溶液中固定5–10分钟。然后使用PBS洗涤细胞。使用含有0.1%Triton X-100(PBS-T)的PBS进行细胞渗透10分钟, 然后在室温下用2%的牛血清白蛋白组分V在PBS-T中封闭1小时。用一级抗体培养固定细胞(如上文所列,在Western blotting分析部分)。 通过用与德克萨斯红(英国白金汉郡Amersham Biosciences)或异硫氰酸荧光素(FITC)、Alexa-488和Alexa-594(美国俄勒冈州尤金市分子探针)结合的二级抗体染色(孵育1–2小时)来观察免疫染色。 使用Hoechst 33342(Invitrogen,Molecular Probes,Eugene,OR,USA)对细胞核进行反染色。 盖玻片安装在玻璃载玻片上,并在配备AxioVision 4.6软件的蔡司Axiover 200 M显微镜下(日本东京卡尔蔡司)和共焦激光扫描显微镜(日本东京卡尔蔡司LSM510)进行检查。 使用ImageJ 1.46软件(美国马里兰州贝塞斯达国立卫生研究院)量化荧光信号代表的蛋白质表达。
2.11. 免疫沉淀 对照组、Wi-A、CAPE和Wi-ACAPE处理的细胞被采集并使用非离子型NP-40缓冲液进行溶解。 使用BCA分析法测定全细胞裂解物的蛋白质浓度(美国伊利诺伊州罗克福德市赛默飞世尔科学公司)。 将含有300–500μg总蛋白的细胞裂解物与对照IgG(sc-2025)(Cell Signaling Technology,Danvers,MA,USA)或抗E-cadherin抗体(67A4)(Cel Signaling-Technology,丹弗斯,MA,US)和VEGFA(ab46154)(Abcam,Cambridge,UK)孵育(4℃,缓慢旋转过夜) 过夜,然后加入A/G PLUS琼脂珠(sc-2003)(Santa Cruz Biotechnology,Paso Robles,CA,USA)。 将混合物在4℃下缓慢旋转培养4 h,然后在4℃、2500 rpm下离心5 min以收集免疫沉淀剂。 清除上清液。 用NP-40缓冲液洗涤含有珠子和免疫沉淀剂的颗粒三次。 然后,将颗粒与SDS缓冲液混合,并在96°C下煮沸10分钟。免疫沉淀剂在SDS-PAGE上溶解,然后转移到PVDF膜上。 如先前在蛋白质印迹部分中所述检测感兴趣的蛋白质。
2.12. 血管内皮生长因子酶联免疫吸附试验 VEGFA抗体(ab46154)(Abcam,Cambridge,UK)在ELISA涂层缓冲液(421701)(BioLegend Inc.,BioLenged Way,San Diego,CA,USA)中稀释至最终浓度4–8μg/mL,并在ELISA平板(Corning,Labware,Inc.,Two Oak Park,MA,USA。 然后用含有200µL 0.05%吐温20(PBS-T)的PBS将微孔冲洗三次,并用5%牛血清白蛋白在室温下封闭1h。HeLa细胞(15×10 4 /well)接种在6孔板中,让其沉淀过夜,然后用Wi-A、CAPE或Wi-ACAPE处理。 用PBS清洗细胞,通过胰蛋白酶法收集,并在1500 rpm(4°C)下离心10 min。提取缓冲液(100 mM Tris,pH 7.4,150 mM NaCl,1 mM EGTA,1 mM-EDTA,1%,Triton X-100,0.5%脱氧胆酸钠)中含有cOmplete TM公司 使用迷你蛋白酶抑制剂鸡尾酒(瑞士巴塞尔罗氏公司)进行细胞裂解(在4°C下培养1小时)。 细胞裂解物(100µL中75–100µg)和标准物在室温下在96 well VEGFA涂层ELISA板中培养4 h。 然后用PBS-T清洗微孔三次,并在100µL稀释液缓冲液(1.7 mM Na)中重新加载抗VEGFA抗体(100 ng/mL 2 一氧化碳 三 ,3.3 mM NaHCO 三 在室温下,在pH 9.6的蒸馏水中培养1小时,然后进行三次PBS-T洗涤,最后,在室温下用二级抗兔辣根过氧化物酶(HRP)结合抗体(Thermo Fisher Scientific,Waltham,MA,USA)培养30分钟。用PBS-T将板洗涤三次,用100µL 3,3′培养, 5,5′-四甲基联苯胺(TMB)底物(421101)(BioLegend Inc.,BioLenged Way,San Diego,CA,USA)保持30分钟,然后添加100µL停止溶液(423001。 使用Infinite M200 Pro微孔板阅读器(瑞士曼尼多夫帝肯集团有限公司)在450 nm处测量光密度。 然后使用Microsoft™Office将450 nm波长下的VEGFA吸光度差异表示为100%,并以百分比绘制。
2.13. 细胞凋亡检测 HeLa细胞接种在6孔板中。 48小时后,通过在4°C下以3000 rpm离心5分钟收集对照和Wi-A/CAPE/Wi-ACAPE处理的细胞。用100μL新鲜培养基重新悬浮细胞颗粒,并用Guava Nexin试剂(EMD Millipore Corporation,Berlington,MA,USA)染色。 细胞凋亡分析由Guava PCA-96系统(Luminex Corporation,Austin,TX,USA)完成。 通过FlowJo软件(v7.6,Flow Jo,LLC,阿什兰,OR,美国)检测并量化凋亡细胞。
2.14. 组合指数(CI)分析 使用CompuSyn软件的Chou–Talalay组合指数(CI)方法,新泽西州Paramus(2005)[ 46 ]分析Wi-A和CAPE的最佳组合比。 CI评分表示药物联合的协同作用(CI<1)、拮抗作用(CI>1)和加性效应(CI=1)的定量测定。
2.15. RNA提取和实时定量聚合酶链反应(RT-qPCR) 按照制造商描述的方案,使用RNeasy迷你试剂盒(美国加利福尼亚州斯坦福巴伦西亚市齐根)从对照和处理的HeLa细胞中提取总RNA。 按照制造商描述的方案,使用QuantiTect逆转录试剂盒(日本东京齐根)将样品中等量的总RNA(1µg)逆转录成cDNA。 使用SYBR Select Master mix(美国加利福尼亚州福斯特市生命技术应用生物系统公司)通过实时定量PCR(RT-qPCR)进行基因表达定量。 基因特异性引物RT-qPCR的条件( 表S1 ),在50℃下放置2分钟,然后在95℃下放置10分钟,然后进行40次变性(95℃,15秒)、退火(60℃,1分钟)和拉伸(72℃,15 s)循环。 靶基因的相对表达水平与作为内部对照的18S基因进行了标准化。 RT-qPCR分析所用引物的详细信息见 表S1 。
2.16条。 统计分析 来自三个或更多独立实验的统计数据表示为平均值±标准偏差。 一个未配对的学生 吨 -进行测试(GraphPad Prism,GraphPad-software,San Diego,CA,USA),以确定对照样品和实验样品之间的统计显著性。 的值 第页 >0.05(纳秒), 第页 ≤0.05(*)时, 第页 ≤ 0.01 (**), 第页 ≤0.001(***)和 第页 ≤0.0001(****)分别被视为无显著性、统计显著性、非常显著性、高度显著性和极显著性。
3.结果 3.1、。 低剂量Wi-A和CAPE联合抑制癌细胞迁移、侵袭和血管生成 我们以前曾报道过Wi-A和CAPE的组合剂量(分别为1μM和20μM)通过激活DNA损伤和凋亡信号对癌细胞产生选择性毒性[ 36 ]. 联合用药的效果明显优于单独用药。 与其他癌细胞系相比,Wi-A和CAPE(分别为1μM和20μM)联合使用对人宫颈癌(HeLa)细胞的作用更强[ 36 ]. 自从HeLa细胞被广泛用作转移性宫颈癌细胞系的模型以来[ 47 , 48 , 49 , 50 ],我们在本研究中继续使用HeLa细胞。 还比较了HeLa对高转移性乳腺癌细胞株(MCF-7、Mot-OE MCF-7和MDA-MB-231)的影响[ 14 , 51 , 52 , 53 , 54 ]. 为了检测该组合的抗转移活性,我们招募了每种不产生细胞毒性的低剂量化合物,并研究了它们对癌细胞迁移、侵袭和血管生成(癌转移的三种关键表型)的影响。 通过MTT法测定Wi-A(0.05、0.1和0.5μM)、CAPE(1、5和10μM)及其组合在HeLa、MDA-MB-231、MCF-7和Mot-OE MCF-7细胞中的剂量依赖性细胞毒性,确定低无毒剂量。 还使用人类正常成纤维细胞(MRC5和TIG-3)进行比较。 如所示 图S1A、B ,所选剂量的化合物单独或联合对任何检测的细胞系均无细胞毒性。 在显微镜下直接观察处理后的细胞未发现任何应激表型,如脱落、凝结或起泡等。因此,我们选择了Wi-a(0.5μM)和CAPE(10μM)的组合,并通过流式细胞术和分子分析确定其对凋亡和生长阻滞的影响。 如所示 图S2A 对细胞生长和凋亡无影响。 此外,参与生长停滞/凋亡的蛋白(p53、PARP-1和Bcl-2)的表达没有变化( 图S2B ). 根据这些数据,Wi-A(0.5μM)、CAPE(10μM)及其组合被认为处于低无毒范围,并用于进一步实验。 值得注意的是,Wi-A(0.5μM)、CAPE(10μM)或其联合处理的正常成纤维细胞在参与转移的MMP3和波形蛋白的表达方面没有任何变化( 图S2C ).
接下来,我们通过划痕/伤口愈合试验检查了对照和处理细胞的迁移能力。
如所示 图1 A、 用Wi-A或CAPE处理的HeLa细胞向受伤区域迁移较慢,表明这两种化合物都会抑制细胞迁移。 值得注意的是,Wi-A和CAPE联合处理的细胞显示出显著更高的抗迁移潜能; 组合(0.5μM Wi-A+10μM CAPE;以下称为Wi-ACAPE)显示出最高的抗迁移作用,因此用于进一步分析。 我们使用Chou–Talalay分析方法量化Wi-ACAPE的药效学相互作用[ 46 , 55 ]. 结果表明,Wi-ACAPE与Wi-A表现出协同的体外药效学相互作用,其组合指数(CI)值为0.4563(小于1)( 图1 A) ●●●●。 这些数据表明,Wi-ACAPE具有协同抗迁移潜力。 为了排除这种效应不是细胞系特异性的,我们还使用了其他转移细胞系(MCF-7、Mot-OE MCF-7和MDA-MB-231细胞)。 如所示 图S3A、C、E Wi-ACAPE对所有三种细胞系的细胞迁移均有较强的抑制作用。
接下来,我们分别通过Boyden Chamber和试管形成实验检测了Wi-ACAPE的抗侵袭和抗血管生成潜能。 HUVEC细胞被广泛认为是研究血管生成的良好体外模型,我们招募其进行试管形成试验[ 56 , 57 , 58 , 59 ]. 如所示 图1 B、 与未处理的对照细胞相比,用Wi-A(0.5μM)或CAPE(10μM)处理的细胞对细胞侵袭表现出抑制作用。 Wi-ACAPE处理的细胞显示出显著的细胞侵袭减少。 与这些数据一致,HUVEC细胞试管形成试验也显示Wi-a或CAPE处理细胞的试管形成减少。 值得注意的是,Wi-ACAPE处理的细胞显示完全没有管形成( 图1 C) ●●●●。 综上所述,这些数据表明,Wi-a和CAPE的低剂量组合(Wi-ACAPE)具有显著的抗转移和抗血管生成活性。
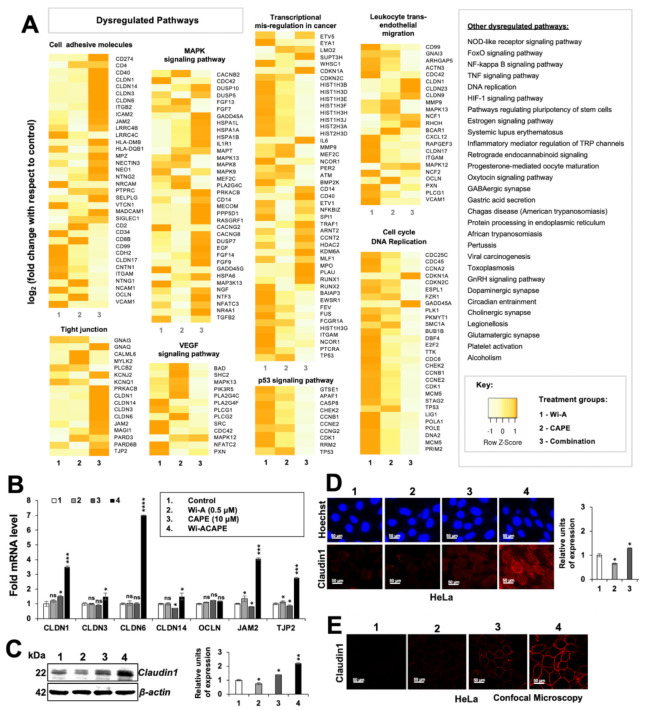
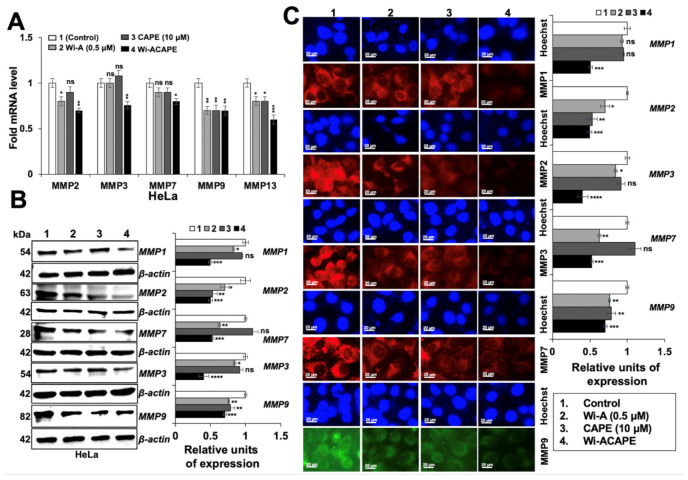
3.2. Wi-ACAPE处理的细胞显示转移信号通路失活 接下来我们研究了Wi-ACAPE抗转移活性的分子机制。 对照组和处理组(Wi-A 0.5μM;CAPE 10μM和Wi-ACAPE)HeLa细胞接受cDNA阵列。 尽管在一般情况下,±4的折叠变化对应于对数 2 ±2的(折叠变化)被用作解释失调基因的阈值,我们选择了±2的折叠变化阈值或对数 2 (折叠变化)为±1,以确保更广泛的分析。 然后使用DAVID服务器对上调或下调的基因进行功能注释/基因富集分析。 DAVID的功能注释聚类算法集成了Kappa统计技术来度量两个注释之间的公共基因的程度,以及模糊启发式聚类技术来根据Kappa值对相似注释组进行分类。 因此,注释共享的共同基因越多,它们组合在一起的可能性就越高。 这个 第页 -软件使用改进的Fisher Exact检验(称为EASE Score)计算每个簇内每个注释项的相关值。 对阵列数据的分析显示,致癌、细胞粘附、迁移和侵袭等过程中涉及的几种通路发生了失调。 这些基因包括参与细胞周期和DNA复制、跨内皮细胞迁移、MAPK、VEGF、p53、NF-Kβ、TNF-α和HIF-1α信号的基因( 图2 A) ●●●●。 值得注意的是,虽然参与细胞周期和DNA复制的基因显示下调,但与对照、Wi-A或CAPE处理的细胞相比,许多参与细胞粘附的基因在Wi-ACAPE处理细胞中显示上调。 许多调节紧密连接和MAPK信号的基因在Wi-ACAPE处理的细胞中也显示出显著上调。 另一方面,大多数参与跨胚层迁移的基因表现出强烈的下调。 参与VEGF和p53信号传导的基因在Wi-ACAPE处理的细胞中也显示出显著的下调。 在考虑这些数据时,我们假设Wi-ACAPE诱导的细胞迁移抑制可能通过其对细胞粘附紧密连接信号通路的影响而起作用,因此,通过对几个基因和其他基因(血管内皮生长因子-VEGF及其受体)的表达分析进行验证 在血管生成和转移中起关键作用,如下一节所述。
图2。
Wi-A/CAPE/Wi-ACAPE处理细胞的cDNA阵列分析。 如cDNA阵列结果所示,Wi-A/CAPE/Wi-ACAPE导致细胞粘附分子(CAMs)的失调、紧密连接蛋白的激活、血管内皮生长因子(VEGF)和其他参与肿瘤转移的信号通路的下调( A类 ). Wi-ACAPE处理48 h后,HeLa细胞中克劳丁家族成员、连接粘附分子2(JAM2)和紧密连接蛋白(TJP2)的mRNA表达增加( B类 ). Western blotting显示,Wi-ACAPE导致Claudin 1表达显著增加( C类 ),免疫染色( D类 )和共焦显微镜( E类 ). 将数据与对照数据进行标准化,并绘制为折叠差异。 每个数据集表示至少三个独立实验的平均SD。 统计显著性定义为 第页 >0.05(纳秒), 第页 ≤ 0.05 (*), 第页 ≤ 0.01 (**), 第页 ≤0.001(***)和 第页 ≤0.0001(****),分别表示不显著、显著、非常显著、高度显著和极显著。 未裁剪的斑点如所示 图S5 。
3.3. Wi-ACAPE失调紧密连接(TJ)基因 基于cDNA阵列结果,我们接下来研究了Wi-A、CAPE及其组合对几个紧密连接(TJ)基因表达的影响,这些基因在细胞间粘附、组织完整性和转移中起重要作用[ 60 , 61 ].
如所示 图2 B、 与未经处理的对照细胞相比,CAPE处理和Wi-ACAPE处理的HeLa细胞的CLDN1基因表达增加。 CLDN3和CLDN6基因的表达仅在Wi-ACAPE处理的细胞中增加。 尽管Wi-A处理的HeLa细胞在CLDN14基因的表达方面没有明显变化,但与未处理的对照组相比,CAPE处理的细胞中CLDN14的表达有所减少,Wi-ACAPE处理细胞中的CLDN14表达显著增加。 此外,JAM2和TJP2基因的表达在Wi-a-或CAPE处理的细胞中显示出轻微的增加; Wi-ACAPE处理的细胞数量显著增加。 另一方面,OCLN基因表达在两个治疗组中保持不变( 图2 B) 。 由于Claudin 1蛋白是紧密连接复合物的一个确定的关键成分[ 62 , 63 ],我们扩展了分析,以确定其在对照细胞和处理细胞中的水平。 如所示 图2 C和 图S3B、D、F 与未经处理、Wi-a或CAPE处理的HeLa、MCF-7、Mot-OE MCF-7和MDA-MB-231细胞相比,Wi-ACAPE处理细胞中Claudin 1的表达显著增加。 免疫细胞化学也证实了这些发现,其中我们通过共焦显微镜观察到膜定位的Claudin 1蛋白增加( 图2 D、 E)。 相反,高剂量Wi-a和CAPE联合处理的细胞(1μM Wi-a+20μM CAPE)显示出细胞毒性。 而对照细胞和处理细胞的表达分析显示E-cadherin中的a减少; Claudin 1、MMP3和Vimentin未显示任何显著变化( 图S4A、B ).
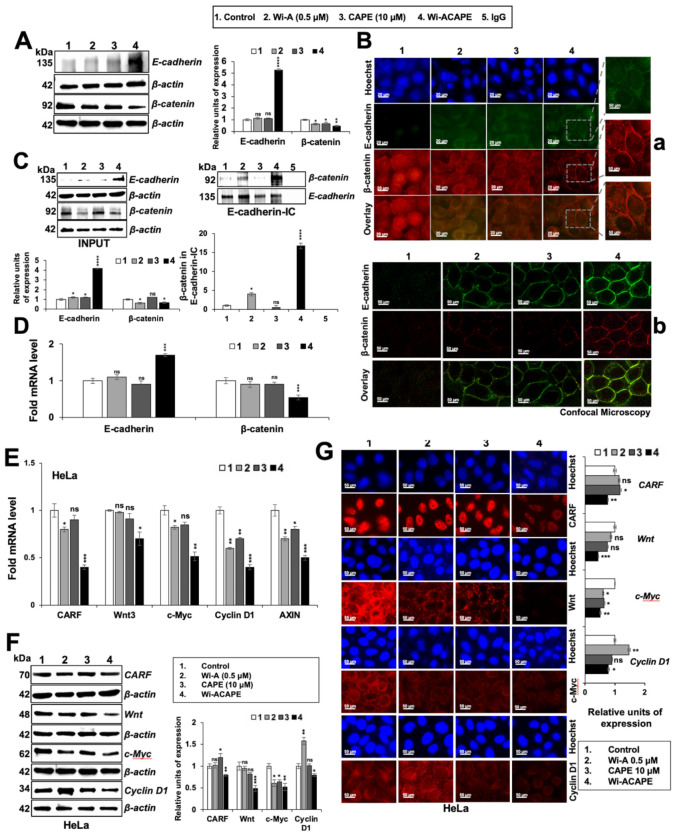
3.4. Wi-ACAPE处理的细胞显示E-Cacherin上调和β-Catenin下调 上皮-间充质转化(EMT)是肿瘤转移的第一步。 其标志是E-cadherin表达缺失或其在细胞-细胞接触处的去定位[ 22 ]. 根据上述cDNA阵列数据和一些基因的验证,我们接下来研究了E-cadherin的表达(转录和蛋白质水平)。 如所示 图3 A、 与未经处理的对照组相比,B、Wi-A和CAPE处理的HeLa细胞在E-cadherin表达方面没有显著变化。 另一方面,经Wi-ACAPE处理的细胞数量显著增加。 Wi-ACAPE处理的MCF-7/Mot-OE MCF-7/MDA-MB-231细胞也显示,与单独使用Wi-a或CAPE处理相比,E-cadherin表达显著增加( 图S3B、D、F ). E-cadherin通过与β-catenin的相互作用/结合介导细胞间粘附。 在正常生理条件下,E-cadherin/β-catenin复合物中的E-cadherin将β-catentin隔离在细胞膜上,阻止EMT进展。 E-cadherin的丢失促进了β-catenin从膜复合物中的释放,导致其核移位和激活Wnt/β-catening信号,从而导致细胞迁移增加和癌细胞的侵袭性特征[ 22 , 23 , 24 , 64 ]. 因此,我们检测了β-catenin的表达和亚细胞定位。 如所示 图3 A和 图S3B、D、F 与未经处理的对照细胞相比,Wi-A和CAPE处理的HeLa/MCF-7/Mot-OE MCF-7/MDA-MB-231细胞均显示β-catenin表达降低,Wi-ACAPE处理细胞显示β-catanin表达显著降低。 接下来,我们用免疫细胞化学方法检测了E-cadherin和β-catenin在对照细胞和处理细胞中的亚细胞定位。 如所示 图3 B(a),β-catenin主要见于对照组未处理细胞的细胞核中。 Wi-A和CAPE处理的细胞显示核β-连环蛋白染色减少; Wi-ACAPE处理的细胞显示出明显的非核染色及其在细胞膜中的浓度。 我们通过共焦显微镜证实了这些结果( 图3 B(B)),显示处理细胞中E-cadherin增加; 与Western blotting数据一致,Wi-ACAPE处理的细胞显著增加。 在细胞膜中观察到E-钙粘蛋白和β-连环蛋白共定位。 此外,Wi-ACAPE处理的细胞在膜上显示出明显的β-连环蛋白隔离,表明这些细胞中E-cadherin:β-连环素复合物增加。 接下来,我们通过免疫共沉淀法研究了对照细胞和处理细胞中的此类复合物。 使用抗E-钙粘蛋白特异性抗体从对照和处理的细胞裂解物中免疫沉淀E-钙粘蛋白复合物。 用抗β-连环蛋白抗体检测E-cadherin复合体中β-连环素的存在。 如所示 图3 C、 与未处理的对照、Wi-a或CAPE处理的细胞相比,在Wi-ACAPE处理的细胞中检测到E-钙粘蛋白复合物中的β-连环蛋白显著增加。 我们还通过RT-qPCR检测了对照细胞和处理细胞中E-cadherin和β-catenin的mRNA表达。 如所示 图3 D、 Wi-ACAPE处理的细胞E-cadherin表达增加了4倍; 用Wi-A或CAPE处理的细胞未显示任何显著变化。 同样,在Wi-ACAPE-处理的细胞中观察到β-catenin减少,但在Wi-a/CAPE-处理细胞中未观察到。 综上所述,这些数据表明Wi-ACAPE在蛋白质和mRNA水平上具有多模式活性。 E-cadherin的增加在转录水平上调,导致β-catenin在细胞膜中的隔离,并抑制其转录激活功能和转移信号。
图3。
Wi-ACAPE导致EMT信号的逆转和Wnt/β-catenin的失活。 Wi-ACAPE调节E-cadherin和β-catenin的表达,从而抑制Wnt/β-catentin介导的EMT信号。 Western blotting检测到经Wi-ACAPE处理(48 h)的HeLa细胞E-cadherin表达增加,β-catenin表达减少( A类 )、免疫细胞化学( B类 )和共焦显微镜( B类 ). 使用抗E-钙粘蛋白特异性抗体进行的协同免疫沉淀分析表明,从Wi-ACAPE处理的(48小时)HeLa细胞中免疫沉淀的E-钙黏蛋白复合物中的β-连环蛋白部分增加( C类 ). 用Wi-ACAPE治疗48小时后,观察到E-cadherin增加,β-catenin mRNA水平降低( D类 ). Wi-ACAPE处理(48 h)的HeLa细胞在mRNA处显示CARF、Wnt、c-Myc、Cyclin D1和AXIN的下调( E类 )和蛋白质( F类 , G公司 )级别。 将数据与对照数据进行标准化,并绘制为折叠差异。 每个数据集表示至少三个独立实验的平均SD。 统计显著性定义为 第页 >0.05(纳秒), 第页 ≤ 0.05 (*), 第页 ≤ 0.01 (**), 第页 ≤0.001(***)和 第页 ≤0.0001(****),分别表示不显著、显著、非常显著、高度显著和极显著。 未裁剪的斑点如所示 图S5和S6 。
3.5. Wi-ACAPE导致Wnt/β-连环蛋白介导的EMT信号下调 考虑到上述数据,即Wi-ACAPE介导的E-cadherin上调导致β-catenin在细胞膜中积聚并抑制转录激活功能,我们接下来检查了β-catentin下游效应器的表达。 与E-cadherin的上调一致,与Wi-A或CAPE处理的细胞相比,其下游负调控效应器和Wnt蛋白在Wi-ACAPE中表现出更高的下调。 由于Wnt/β-catenin途径也受c-Myc、cyclin D1、AXIN、CD44和VEGF的调节[ 34 , 65 ]接下来,我们检查了这些蛋白质在对照细胞和处理细胞中的状态。 如所示 图3 E、 Wi-A/CAPE/Wi-ACAPE处理的细胞显示Cyclin D1和AXIN mRNA减少。c-Myc mRNA在Wi-A/Wi-ACAPE-处理的细胞中显示减少。 另一方面,Wnt3mRNA仅在Wi-ACAPE中出现下降( 图3 E) 。 此外,CARF(p14的合作者)的表达 农业研究基金 )/CDKN2AIP mRNA已被证明调节癌细胞中Wnt/β-catenin介导的EMT[ 18 ]在Wi-ACAPE处理的细胞中显示出显著的减少。 值得注意的是,虽然Wi-A导致CARF下调,但CAPE无效。 蛋白质表达分析(蛋白质印迹和免疫染色)显示了类似的数据。 与单用Wi-A或CAPE相比,Wi-ACAPE处理的细胞显示出强烈的CARF、Wnt、c-Myc和Cyclin D1下调( 图3 F) ●●●●。 与对照细胞和Wi-a/CAPE处理细胞相比,Wi-ACAPE处理细胞的c-Myc、Cyclin D1表达显著降低。 免疫细胞化学证实了这些数据( 图3 G) ●●●●。
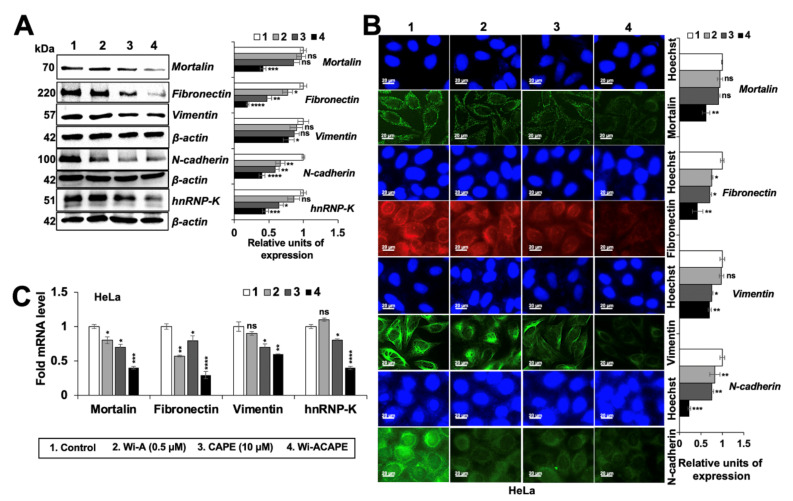
3.6条。 Wi-ACAPE处理的细胞显示EMT信号逆转 基于上述显示Wi-ACAPE处理细胞中上皮蛋白增加的结果,我们接下来检查了间充质(纤维连接蛋白、N-钙粘蛋白、波形蛋白和基质金属蛋白酶-MMP)蛋白的表达水平。 与EMT信号的逆转一致,与Wi-A或CAPE处理的细胞相比,Wi-ACAPE处理细胞中间充质蛋白(纤维结合蛋白、波形蛋白、N-钙粘蛋白)的表达显著降低( 图4 A、, 图S3B、D、F ).
图4。
Wi-ACAPE导致EMT信号的逆转和间充质蛋白的下调。 蛋白质印迹( A类 )、免疫细胞化学( B类 )和RT-qPCR( C类 )分析表明,Wi-ACAPE治疗48小时后,纤维结合蛋白、波形蛋白、N-钙粘蛋白、hnRNP-K和Mortalin表达下调。数据与对照组进行标准化,并绘制成倍差。 每个数据集表示至少三个独立实验的平均SD。 统计显著性定义为 第页 >0.05(纳秒), 第页 ≤ 0.05 (*), 第页 ≤ 0.01 (**), 第页 ≤0.001(***)和 第页 ≤0.0001(****),分别表示不显著、显著、非常显著、高度显著和极显著。 未裁剪的斑点如所示 图S7 。
此外,莫他林和hnRNP-K在癌细胞中富集,在致癌和转移中发挥关键作用[ 14 , 66 ]显示Wi-ACAPE处理的细胞显著减少。 免疫细胞化学分析也证实了这些发现( 图4 B) 。 对照细胞和处理细胞中这些蛋白的mRNA分析显示出类似的结果,支持这些变化发生在转录水平( 图4 C) ●●●●。 鉴于这些数据,我们接下来研究了基质金属蛋白酶(MMPs)的表达,它们在细胞迁移、侵袭和血管生成中起着关键作用。 如所示 图5 A、 Wi-ACAPE引起MMP2、MMP3、MMP7和MMP13 mRNA的强烈下调,这与单独使用这两种化合物相比。 与单个化合物相比,MMP9 mRNA未显示Wi-ACAPE的任何增强作用。 蛋白质印迹和免疫染色分析显示,Wi-ACAPE对MMP1、MMP2、MMP3、MMP7和MMP9蛋白的增强作用与Wi-a/CAPE相似( 图5 B、 C和 图S3B、D、F )表明Wi-ACAPE导致EMT信号的逆转。
图5。
Wi-ACAPE引起基质金属蛋白酶(MMPs)的下调。 RT-qPCR( A类 )、蛋白质印迹( B类 )和免疫细胞化学( C类 )分析显示,Wi-ACAPE处理(48小时)HeLa细胞中MMP-1、-2、-3、-7和-9下调。 将数据与对照进行标准化,并绘制为倍数差。 每个数据集表示至少三个独立实验的平均SD。 统计显著性定义为 第页 >0.05(纳秒), 第页 ≤ 0.05 (*), 第页 ≤ 0.01 (**), 第页 ≤0.001(***)和 第页 ≤0.0001(****),分别表示不显著、显著、非常显著、高度显著和极显著。 未裁剪的斑点如所示 图S8 。
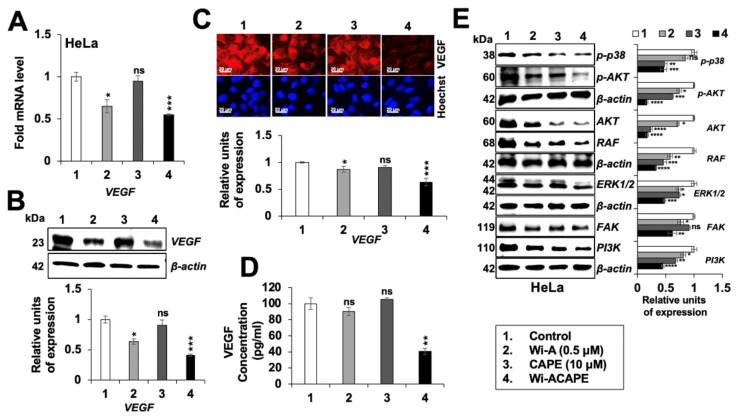
3.7. Wi-ACAPE处理的细胞显示VEGF信号失活 VEGF在肿瘤细胞转移和血管生成中起关键作用; 鉴于cDNA阵列数据和上述分析,我们接下来研究了Wi-A/CAPE/Wi-ACAPE对VEGF信号的影响。 如所示 图6 A、 在Wi-A/Wi-ACAPE处理的细胞中,VEGF mRNA显著下调; 单独CAPE并不影响VEGF mRNA。与这些数据一致,VEGF蛋白在Wi-a/Wi-ACAPE治疗反应中显著降低( 图6 B、 C、和 图S3B、D、F ). VEGF ELISA试验证实了这些数据,表明Wi-ACAPE处理的细胞显著减少( 图6 D) ●●●●。 此外,一些VEGF驱动的效应蛋白如p-p38MAPK(磷酸化p38丝裂原活化蛋白激酶)、p-AKT(磷酸蛋白激酶B)、FAK(黏着斑激酶)、ERK½(细胞外信号调节激酶)、PI3K(磷脂酰肌醇-3-激酶)和RAF在转移和血管生成中均表现出显著下调( 图6 E) 。 这些结果也与cDNA阵列结果和RT-qPCR结果一致( 图S3G ). 在每种情况下,与Wi-A或CAPE处理的细胞相比,Wi-ACAPE处理细胞表现出更强的下调作用( 图6 )支持其更高的抗转移活性。
图6。
Wi-ACAPE导致VEGF噬菌体失活。 Wi-ACAPE处理(48小时)的HeLa细胞显示VEGF mRNA下调( A类 )和蛋白质(( B类 – D类 )分别通过Western blotting、免疫染色和ELISA分析检测)。 一些与转移和血管生成有关的VEGF驱动效应蛋白也显示Wi-ACAPE处理的细胞减少( E类 ). 将数据与对照数据进行标准化,并绘制为折叠差异。 每个数据集表示至少三个独立实验的平均SD。 统计显著性定义为 第页 >0.05(纳秒), 第页 ≤ 0.05 (*), 第页 ≤0.01(**), 第页 ≤0.001(***)和 第页 ≤0.0001(****),分别表示不显著、显著、非常显著、高度显著和极显著。 未切割的斑点如所示 图S9和S10 。
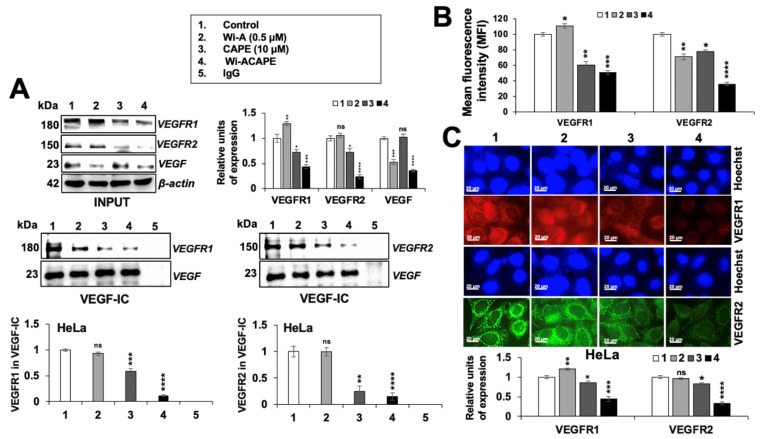
由于VEGF信号传导依赖于VEGF与VEGF受体(VEGFR1/VEGFR2)的相互作用[ 67 ]接下来,我们通过联合免疫沉淀分析确定Wi-A/CAPE/Wi-ACAPE对VEGF-VEGFR复合物的影响。 用抗VEGF小鼠单克隆抗体从对照和处理过的细胞裂解物中免疫沉淀VEGF-VEGFR复合物。 用抗VEGFR1和抗VEGFR2抗体对复合物进行Western blotting检测复合物中的VEGFR含量。 如所示 图7 A、 来自Wi-ACAPE处理细胞的复合物显示VEGF-VEGFR1和VEGF-VEGFR2复合物显著减少。 另一方面,Wi-A对VEGFR1或VEGFR2的VEGF复合物没有引起任何变化,而CAPE使两者都减少。 值得注意的是,Wi-ACAPE处理的HeLa细胞显示VEGF、VEGFR1和VEGFR2水平下降( 图7 A、 输入车道和7B)。 我们还通过流式细胞术(FACS)研究了对照和处理细胞中VEGFR1和VEGFR2的细胞表面表达。 如所示 图7 C、 与Wi-a/CAPE-处理的细胞相比,Wi-ACAPE-处理细胞中VEGFR1水平和VEGFR2表达急剧下降( 图7 C) ●●●●。
图7。
Wi-ACAPE阻断了VEGF与其受体的相互作用。 Wi-ACAPE处理(48小时)的HeLa细胞显示VEGF-VEGFR1/R2相互作用受到抑制。 VEGF免疫沉淀显示对照细胞中VEGFR1和VEGFR2的免疫共沉淀,Wi-a、CAPE和Wi-ACAPE处理的细胞中VEGFR1和VEGFR2免疫共沉淀减少。 后者的下降幅度最大( A类 ). 流式细胞术检测到Wi-ACAPE处理的HeLa细胞中VEGFR1和VEGFR2的细胞表面表达下调( B类 ). 免疫细胞化学显示VEGFR1和VEGFR2减少( C类 )分析。 将数据与对照数据进行标准化,并绘制为折叠差异。 每个数据集表示至少三个独立实验的平均SD。 统计显著性定义为 第页 >0.05(纳秒), 第页 ≤ 0.05 (*), 第页 ≤ 0.01 (**), 第页 ≤0.001(***)和 第页 ≤0.0001(****),分别表示不显著、显著、非常显著、高度显著和极显著。 未裁剪的斑点如所示 图S11 。
4.讨论 我们早些时候开发了一种Wi-a和CAPE的组合,在体内外均显示出较高的抗癌潜力[ 36 ]. 值得注意的是,癌症相关死亡的最常见原因与获得迁移和侵袭能力所支持的癌症转移以及新血管网络(血管生成)的发展有关,而血管生成对于体内初级和次级部位肿瘤的形成至关重要[ 14 , 68 ]. 鉴于癌症治疗和预防复发,低无毒剂量的抗癌化合物被认为是重要的。 在这方面,验证反迁移和反入侵活动极为重要[ 69 , 70 ]. 细胞黏附分子、Wnt/β-catenin信号和血管内皮生长因子(VEGF)已被确定为通过上皮-间充质转化(EMT)调节肿瘤转移和血管生成的主要信号通路[ 60 , 71 , 72 , 73 ]. 通过天然化合物干扰这些信号分子和通路已被证明在体内外水平抑制转移、血管生成和癌症干细胞[ 74 ]. Wi-A是Ashwagandha的活性抗癌化合物,已被证明具有抗炎、抗增殖、抗转移和抗血管生成的特性,表明其作为抗癌药物的潜力[ 37 , 41 , 75 , 76 , 77 , 78 , 79 ]. Wi-A及其与Withanone(Wi-N)的结合[ 78 , 80 ],顺铂[ 81 ]和紫杉醇[ 37 ]在抑制肿瘤、抗转移、克服耐药性和防止肿瘤复发方面显示出优越的效果。 类似地,Wi-N和葫芦素B的组合被证明可以选择性地诱导癌细胞衰老[ 74 ]. 咖啡酸苯乙酯(CAPE)是一种从蜜蜂蜂胶中提取的抗癌成分,通过其多种作用方式显示出抗转移和抗血管生成活性[ 82 , 83 , 84 , 85 , 86 ]. 使用人类卵巢癌和宫颈癌细胞,我们之前报道,与单独使用这两种化合物相比,Wi-a和CAPE的组合(1µM和20µM)显示出更好的抗癌潜力[ 36 ]. 这些研究证实,联合治疗癌症可能是一种更安全、更有效的选择。 在本研究中,我们研究了Wi-A、CAPE及其组合:Wi-ACAPE(0.5µM、10µM或0.5µM+10µM)在抑制转移和血管生成方面的可能分子作用。 我们使用HeLa细胞作为细胞和分子检测的体外模型。 首先,我们发现Wi-ACAPE通过几种信号通路(细胞粘附分子、紧密连接、MAPK和VEGF信号通路)的失调增强了对迁移、侵袭和血管生成的抑制,这些信号通路与这些表型密切相关。 Wi-ACAPE显示E-cadherin/β-catenin信号调节异常,如E-cadherin表达增加和β-catentin表达减少所示( 图3 ).
E-cadherin是一种120-kDa跨膜糖蛋白,通过EMT过程与癌症侵袭和转移密切相关。 恢复E-cadherin表达的想法被认为是可行的,可以抑制其下游致癌EMT信号[ 87 ]. 据报道,几种天然化合物通过上调E-cadherin在体外抑制细胞迁移、侵袭和血管生成[ 24 , 88 , 89 , 90 , 91 , 92 ]. 我们报告称,Wi-a和CAPE的独特组合(Wi-ACAPE)可强烈刺激E-cadherin的表达,并通过抑制Wnt/β-catenin、MMP和VEGF信号通路逆转EMT。 值得注意的是,Wi-ACAPE处理的细胞中核β-连环蛋白的减少与Wnt/β-连环素调节基因的减少相关( c-Myc,细胞周期蛋白D1 和 AXIN公司 )与癌症转移密切相关( 图3 ). 与这些数据一致,Wi-ACAPE处理的细胞显示间充质蛋白(纤维连接蛋白、波形蛋白、N-钙粘蛋白和基质金属蛋白酶)显著减少( 图4 和 图5 ).
据报道,应激蛋白mothalin/mthsp70和CARF(ARF的合作者)调节癌细胞的EMT。 这两种蛋白在癌细胞中富集,并已被证明有助于细胞迁移和EMT信号通路(PI3K-Akt、JAK-STAT和局灶粘附信号)[ 14 , 15 , 18 , 30 , 93 , 94 , 95 , 96 , 97 , 98 ]. Wi-ACAPE导致莫他林和CARF的下调( 图3 和 图4 ),支持Wi-ACAPE的多模式操作。 此外,血管内皮生长因子信号——血管生成的关键驱动因素——被认为是大多数癌症类型的治疗靶点。 由于其活性是通过与具有酪氨酸激酶活性的受体(VEGFR1和VEGFR2)结合来调节的,因此有几种方法包括VEGF阻断、VEGF-trap和酪氨酸激酶抑制剂[ 2 , 31 ]已在实验室和临床研究中得到验证。 FDA批准的VEGF靶向药物贝伐单抗已被证明下调VEGF并抑制其与VEGFR的相互作用[ 99 ]. 然而,与贝伐单抗相关的不良事件仍然令人担忧[ 100 ]保证开发一类新的更安全的药物。 在本研究中,Wi-ACAPE通过下调VEGF mRNA和蛋白及其受体来抑制HeLa细胞的迁移、侵袭和血管生成潜能。 此外,VEGF与其受体的结合也被阻断。 通过p38MAPK、AKT、FAK、ERK、PI3K和RAF蛋白的减少证实了VEGF下调导致Wi-ACAPE处理的细胞,表明转移和血管生成信号的有效抑制( 图6 ). 结合我们早期的研究结果,Wi-a和CAPE通过调节p53-mortalin和PARP1信号在癌细胞中引起选择性细胞毒性[ 36 ]我们报告称,Wi-a和CAPE的低剂量组合(Wi-ACAPE)具有显著的抗转移和抗血管生成潜力,值得进一步的实验和临床试验。
5.结论 我们证明,低剂量Wi-a和CAPE(Wi-ACAPE)通过上调E-cadherin和Claudin1导致EMT逆转,从而抑制Wnt/β-catenin、Vimentin、MMPs、VEGF和VEGFR信号通路。 数据表明,Wi-ACAPE具有治疗转移性癌症的潜力,因此,需要进一步研究其在体内和临床试验中的疗效验证。
补充资料 以下支持信息可从以下网址下载: https://www.mdpi.com/article/10.3390/cancers14030787/s1 ,图S1:Wi-A/CAPE/Wi-ACAPE(在指定剂量下)对人类宫颈癌/乳腺癌细胞和正常肺成纤维细胞都没有细胞毒性。 图S2:低剂量Wi-A/CAPE/Wi-ACAPE没有引起凋亡信号的激活。 图S3:Wi-ACAPE在体外显示了乳腺癌的抗转移潜力。 图S4:Withaferin A和CAPE(Wi-ACAPE(高))联合对转移蛋白标志物的影响。 图S5:从E-钙粘蛋白免疫复合物和从Wi-A/CAPE/Wi-ACAPE处理和对照HeLa细胞裂解物检测到的输入物中检测到的感兴趣蛋白质(Claudin1、E-cadherin和β-catenin)的完整非剪切Western blots( 图2 C和 图3 A、 C)。 图S6:从Wi-A/CAPE/Wi-ACAPE处理和对照HeLa细胞裂解物中检测到的感兴趣蛋白质(CARF、Wnt、c-Myc和细胞周期蛋白D1)的完全未切割的蛋白质印迹( 图3 F) ●●●●。 图S7:从经Wi-A/CAPE/Wi-ACAPE处理和对照的HeLa细胞裂解物中检测到的感兴趣蛋白质(Mortalin、Fibronectin、Vimentin、N-cadherin和hnRNP-K)的完整非剪切Western blot( 图4 A) ●●●●。 图S8:从Wi-A/CAPE/Wi-ACAPE处理和对照HeLa细胞裂解物中检测到的感兴趣蛋白质(MMP1、MMP2、MMP7、MMP3和MMP9)的完整非剪切Western blot( 图5 B) 。 图S9:从经Wi-A/CAPE/Wi-ACAPE处理和对照的HeLa细胞裂解物中检测到的感兴趣蛋白(VEGF)的完整非剪切Western blot( 图6 B) 。 图S10:从Wi-A/CAPE/Wi-ACAPE处理和对照HeLa细胞裂解物中检测到的感兴趣蛋白质(p-p38、p-AKT、AKT、RAF、ERK1/2、FAK、PI3K)的完整非剪切Western blot( 图6 E) 。 图S11:从VEGF免疫复合物和输入经Wi-A/CAPE/Wi-ACAPE处理和对照的HeLa细胞裂解物中检测到的感兴趣蛋白(VEGFR1和VEGFR2)的完整非剪切Western blot( 图7 A) ●●●●。 图S12:分别从经Wi-A/CAPE/Wi-ACAPE处理和对照的HeLa和TIG-3细胞裂解液中检测到的感兴趣蛋白质(p53、PARP-1、Bcl-2)和(MMP3、vimentin)的完整非剪切Western blot。 β-actin作为内负荷对照。 图S13:从经Wi-A/CAPE/Wi-ACAPE处理和对照的MCF-7细胞裂解液中检测到的感兴趣蛋白质(Claudin-1、MMP3、E-cadherin、β-catenin、Vimentin、VEGF)的完整非剪切Western blot。 β-actin作为内负荷对照。 图S14:从Wi-A/CAPE/Wi-ACAPE处理的和对照的Mot-OE MCF-7细胞裂解液中检测到的感兴趣蛋白质(Claudin-1、MMP3、E-cadherin、β-catenin、Vimentin、VEGF)的完整非剪切Western blot。 β-actin作为内负荷对照。 图S15:从经Wi-A/CAPE/Wi-ACAPE处理和对照的MDA-MB-231细胞裂解液中检测到的感兴趣蛋白质(Claudin-1、MMP3、E-cadherin、β-catenin、Vimentin、VEGF)的完整非剪切Western blot。 β-actin作为内负荷对照。 图S16:从Wi-A/CAPE/Wi-ACAPE处理和对照HeLa细胞裂解物中检测到的感兴趣蛋白质(Claudin1、E-cadherin、MMP3、Vimentin)的完整非剪切Western blot。 β-actin作为内负荷对照。 表S1:用于实时定量聚合酶链反应(RT-qPCR)的引物序列。
作者贡献 概念化、S.C.K.和R.W。; 方法论,A.N.S.、J.K.D.、A.E.、V.K.和H.Z。; 软件、A.N.S.、J.K.D.、V.K.和R.W。; 验证、A.N.S.、J.K.D.、A.E.、V.K.、H.N.M.和H.Z。; 形式分析,A.N.S.、J.K.D.、A.E.、D.S.、S.C.K.和R.W。; 调查、A.N.S.、J.K.D.、A.E.和V.K。; 资源、Y.I.、K.T.、D.S.、S.C.K.和R.W。; Data Curation,A.N.S.、J.K.D.和V.K; 书面原稿编制,A.N.S。; Writing-Review and Editing,A.N.S.、J.K.D.、A.E.、V.K.、H.N.M.、H.Z.、Y.I.、K.T.、D.S.、S.C.K.和R.W。; 可视化、A.N.S.、A.E.、J.K.D.和V.K。; 监管,R.W。; 项目管理、D.S.、S.C.K.和R.W。; Funding Acquisition、D.S.、S.C.K.和R.W.所有作者均已阅读并同意手稿的出版版本。
基金 这项研究得到了AIST(日本)和DBT(印度政府)拨款的支持,拨款编号为BT/BI/14/042/2017。 Anissa Nofita Sari和Huayue Zhang是日本科技厅(JST)-SPRING奖学金的获得者,赠款编号JPMJSP2124。
数据可用性声明 当前研究中使用和/或分析的所有数据集都包含在手稿中 补充信息文件 。
脚注 出版商备注: MDPI在公布的地图和机构隶属关系中对管辖权主张保持中立。
工具书类
1 Chang J.C.癌症干细胞:在肿瘤生长、复发、转移和治疗抵抗中的作用。 医学。 2016; 95:S20–S25。 doi:10.1097/MD.0000000004766。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
2 Zirlik K.,Duyster J.《抗血管生成学:现状和未来展望》。 昂科尔。 Res.治疗。 2018; 41:166–171. doi:10.1159/000488087。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Houthuijzen J.M.、Daenen L.G.、Roodhart J.M.和Voest E.E.间充质干细胞在抗癌药物耐药性和肿瘤进展中的作用。 英国癌症杂志。 2012; 106:1901–1906. doi:10.1038/bjc.2012.201。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
4 Powell E.,Piwnica-Worms D.,Piwnica-Worms H.p53对转移的贡献。 癌症发现。 2014; 4:405–414. doi:10.1158/2159-8290.CD-13-0136。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
5 Harakandi C.,Nininahazwe L.,Xu H.,Liu B.,He C.,Zheng Y.C.,Zhang H.肿瘤治疗中靶向USP7-MDM2-p53的干预位点的最新进展。 生物有机化学。 2021; 116:105273. doi:10.1016/j.bioorg.2021.105273。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
6 Ciruelos Gil E.M.针对雌激素受体阳性乳腺癌中的PI3K/AKT/mTOR通路。 癌症治疗。 2014年版; 40:862–871. doi:10.1016/j.ctrv.2014.03.004。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
7 杨磊,石鹏,赵刚,徐杰,彭伟,张杰,张刚,王欣,董梓,陈峰,等。肿瘤治疗中靶向肿瘤干细胞途径。 信号。 输水管。 目标。 疗法。 2020; 5:8. doi:10.1038/s41392-020-0110-5。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
8 Holmes K.、Roberts O.L.、Thomas A.M.、Cross M.J.血管内皮生长因子受体-2:结构、功能、细胞内信号和治疗抑制。 单元格。 信号。 2007; 19:2003–2012. doi:10.1016/j.cellsig.2007.05.013。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9 王Z.,赵涛,张S.,王J.,陈毅,赵海,杨毅,石S.,陈奇,刘K.肿瘤发生中的Wnt信号通路,肿瘤治疗的药理靶点和药物开发。 生物标记研究2021; 9:68. doi:10.1186/s40364-021-00323-7。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
10 Liu W.,Vivian C.J.,Brinker A.E.,Hampton K.R.,Lianidou E.,Welch D.R.转移细胞过程中微环境对转移抑制因子表达和功能的影响。 癌症微环境。 2014; 7:117–131. doi:10.1007/s12307-014-0148-4。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Liu Q.L.,Zhang Z.,Wei X.,Zhou Z.G.非编码RNA与肿瘤转移:分子和临床前景。 单元格。 分子生命科学。 2021; 78:6823–6850。 doi:10.1007/s00018-021-03929-0。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Johnson C.,Warmoes M.O.,Shen X.,Locasale J.W.表观遗传学和癌症代谢。 癌症快报。 2015; 356:309–314. doi:10.1016/j.canlet.2013.09.043。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
13 Wadhwa R.、Takano S.、Kaur K.、Deocaris C.C.、Pereira-Smith O.M.、Reddel R.R.、Kaul S.C.mortalin/mthsp70/Grp75的上调有助于人类致癌。 国际癌症杂志。 2006; 118:2973–2980. doi:10.1002/ijc.21773。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
14 Na Y.、Koul S.C.、Ryu J.、Lee J.S.、Ahn H.M.、Kaul Z.、Kalra R.S.、Li L.、Widodo N.、Yun C.O.等。应激伴侣-凡士林有助于上皮-间质转化和癌症转移。 2016年癌症研究; 76:2754–2765. doi:10.1158/0008-5472.CAN-15-2704。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
15 Yun C.O.、Bhargava P.、Na Y.、Lee J.S.、Ryu J.、Kaul S.C.、Wadhwa R.凡士林与癌细胞干细胞和癌症治疗的相关性。 科学。 2017年报告; 7:42016. doi:10.1038/srep42016。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
16 Yoo J.Y.、Ryu J.、Gao R.、Yaguchi T.、Kaul S.C.、Wadhwa R.、Yun C.O.通过靶向性腺病毒的凋亡和抗血管生成作用抑制肿瘤。 《基因医学杂志》,2010年; 12:586–595。 doi:10.1002/jgm.1471。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
17 Tania M.、Khan M.A.、Fu J.上皮-间充质转化诱导转录因子和转移癌。 肿瘤生物学。 2014; 35:7335–7342. doi:10.1007/s13277-014-2163-y。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
18 Kalra R.S.、Chaudhary A.、Yoon A.R.、Bhargava P.、Omar A.、Garg S.、Yun C.O.、Kaul S.C.、Wadhwa R.CARF富集通过Wnt/beta-catenin信号传导促进上皮-间质转化:其临床相关性和作为治疗靶点的潜力。 肿瘤发生。 2018; 7:39. doi:10.1038/s41389-018-0048-4。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
19 Kim W.K.、Kwon Y.、Jang M.、Park M.、Kim J.、Cho S.、Jang D.G.、Lee W.B.、Jung S.H.、Choi H.J.等。Beta-catenin激活下调细胞-细胞连接相关基因并诱导结直肠癌上皮-间质转化。 科学。 2019年报告; 9:18440. doi:10.1038/s41598-019-54890-9。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
20 Kyuno D.、Takasawa A.、Kikuchi S.、Takemasa I.、Osanai M.、Kojima T.紧密连接在癌细胞上皮-间充质转化中的作用。 生物化学。 生物物理学。 生物学家学报。 2021; 1863:183503. doi:10.1016/j.bbamem.2020.183503。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
21 杨N.,陈海,黄勇,宋霞,杨萍,张S.,闫伟,李娜,冯姿。Wnt5a在子宫内膜样腺癌上皮-间质转化调控中的作用和意义。 癌症管理。 2021年决议; 13:6527–6535. doi:10.2147/CMAR。 S319346中。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
22 田欣,刘振华,牛斌,张杰,谭T.K.,李S.R.,赵勇,哈里斯D.C.,郑G.E-cadherin/beta-catenin复合物和上皮屏障。 J.生物识别。 生物技术。 2011; 2011年5月567305日。 doi:10.1155/2011/567305。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
23 Mendonsa A.M.、Na T.Y.、Gumbiner B.M.E-cadherin在接触抑制和癌症中的作用。 致癌物。 2018; 37:4769–4780. doi:10.1038/s41388-018-0304-2。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
24 朱国杰、宋鹏鹏、周华、沈晓华、王建国、马晓峰、顾玉杰、刘德东、冯安南、钱晓云等。上皮-间质过渡标记物E-cadherin、N-cadherin,beta-catenin和ZEB2在喉鳞状细胞癌中的作用。 昂科尔。 莱特。 2018; 15:3472–3481. doi:10.3892/ol.2018.7751。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
25 周小梅,张宏,韩霞。上皮-间充质转换蛋白在妇科癌症中的作用:病理学和治疗学的观点。 肿瘤生物学。 2014; 35:9523–9530. doi:10.1007/s13277-014-2537-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
26 张娜,邵芳,贾伟。肝细胞癌中微纤维相关蛋白2的上调与肿瘤血管生成和预后不良密切相关。 昂科尔。 莱特。 2021; 22:739. doi:10.3892/ol.2021.13000。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
27 王斌,李昕,刘磊,王敏贝塔-连环蛋白:宫颈癌的致癌作用和治疗靶点。 生物研究2020; 53:33. doi:10.1186/s40659-020-00301-7。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
28 Perez-Plasencia C.、Duenas-Gonzalez A.、Alatorre-Tavera B.宫颈癌发生过程中的第二次打击:wnt/β-catenin途径的参与。 国际建筑。 2008年医学会; 1:10. doi:10.1186/1755-7682-1-10。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
29 Zhang Y.,Wang X.针对癌症中的Wnt/beta-catenin信号通路。 《血液学杂志》。 昂科尔。 2020; 13:165. doi:10.1186/s13045-020-00990-3。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
30 Wei B.,Cao J.,Tian J.H.,Yu C.Y.,Huang Q.,Yu J.J.,Ma R.,Wang J.,Xu F.,Wang-LB.Mortalin通过激活Wnt/GSK3beta/beta-catenin信号通路维持乳腺癌干细胞干细胞干化。 美国癌症研究杂志2021; 11:2696–2716. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
31 Chuai Y.、Rizzuto I.、Zhang X.、Li Y.、Dai G.、Otter S.J.、Bharathan R.、Stewart A.、Wang A.血管内皮生长因子(VEGF)靶向治疗持续性、复发性或转移性宫颈癌。 Cochrane数据库系统。 2021年修订; 3:CD013348。 doi:10.1002/14651858.CD013348.pub2。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 Lu Y.,Zhao H.,Liu Y.,Zoo Y.,Xu Q.,Liu L.,Li X.,Zhu H.,Zhang Y.,张S.,等。慢性应激激活血管内皮细胞中的丛蛋白A1/VEGFR2-JAK2-STAT3以促进血管生成。 正面。 肿瘤。 2021; 11:709057. doi:10.3389/fonc.2021.709057。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
33 郭杰、王斌、付梓、魏杰、陆伟。缺氧微环境诱导EMT并提升胃癌细胞的干细胞特性。 Technol公司。 癌症研究治疗。 2016; 15:60–68. doi:10.1177/1533034614566413。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
34 Ramachandran I.、Thavathiru E.、Ramalingam S.、Natarajan G.、Mills W.、Benbrook D.、Zuna R.、Lightfoot S.、Reis A.、Anant S.Wnt抑制因子1在体内诱导凋亡并抑制宫颈癌生长、侵袭和血管生成。 致癌物。 2012; 31:2725–2737. doi:10.1038/onc.2011.455。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35 Widodo N.,Kaur K.,Shrestha B.G.,Takagi Y.,Ishii T.,Wadhwa R.,Kaul S.C.Ashwagandha叶提取物对癌细胞的选择性杀伤:肿瘤抑制因子的鉴定及其作用的首次分子见解。 临床。 癌症研究2007; 13:2298–2306. doi:10.1158/1078-0432.CCR-06-0948。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
36 Sari A.N.、Bhargava P.、Dhanjal J.K.、Putri J.F.、Radhakrishnan N.、Shefrin S.、Ishida Y.、Terao K.、Sundar D.、Kaul S.C.等。与阿非林-A和CAPE的结合提供了卓越的抗癌效力:生物信息学和实验证据证明了它们的分子靶点和作用机制。 癌症。 2020; 12:1160. doi:10.3390/cancers12051160。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
37 Kyakulaga A.H.、Aqil F.、Munagala R.、Gupta R.C.Withaferin A抑制非小细胞肺癌细胞的上皮细胞向间充质细胞转化。 科学。 2018年代表; 8:15737. doi:10.1038/s41598-018-34018-1。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
38 Kakar S.S.、Parte S.、Kelsey Carter I.G.J.、Worth C.、Rameshwar P.、Ratajczak M.Z.Withaferin A(WFA)通过靶向卵巢癌干细胞抑制肿瘤生长和转移。 Oncotarget公司。 2017; 8:74494–74505. doi:10.18632/目标20170。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
39 Nagy Z.、Cheung B.B.、Tsang W.、Tan O.、Herath M.、Ciampa O.C.、Shadma F.、Carter D.R.、Marshall G.M.Withaferin A激活TRIM16,使其在黑色素瘤中具有抗癌活性。 科学。 2020年报告; 10:19724. doi:10.1038/s41598-020-76722-x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
40 Ting L.-L.,Chou A.S.-B.,Xieh C.-H.,Hsiung S.-C.,Pang S.-T.,Liao S.-K.Withaferin A靶向UP-LN1癌细胞模型中的癌干细胞和转移癌干细胞。 《癌症转移治疗杂志》。 2016; 2:29–40. [ 谷歌学者 ]
41 Thaiparambil J.T.、Bender L.、Ganesh T.、Kline E.、Patel P.、Liu Y.、Tighiouart M.、Vertino P.M.、Harvey R.D.、Garcia A.等人。威瑟芬A通过诱导波形蛋白分解和丝氨酸56磷酸化,以亚细胞毒性剂量抑制乳腺癌的侵袭和转移。 国际癌症杂志。 2011; 129:2744–2755. doi:10.1002/ijc.25938。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
42 彭C.Y.,杨华伟,朱玉华,张玉华,谢敏杰,周敏英,叶克泰,林玉梅,杨S.F.,林春伟.咖啡酸苯乙酯通过调节基质金属蛋白酶-2和丝裂原活化蛋白激酶途径抑制口腔癌细胞转移。 伊维德。 基于补充。 Alternat公司。 2012年医学; 2012年:732578。 doi:10.1155/2012/732578。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
43 Liang Y.,Feng G.,Wu L.,Zhong S.,Gao X.,Tong Y.,Cui W.,Qin Y.,Xu W.,Xiao X.等。咖啡酸苯乙酯通过失活NF-κB途径抑制鼻咽癌细胞的生长和转移。 药物设计。 开发和治疗。 2019; 13:1335–1345. doi:10.2147/DDDT。 S199182。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
44 Kaul Z.、Yaguchi T.、Harada J.I.、Ikeda Y.、Hirano T.、Chiura H.X.、Kaul S.C.、Wadhwa R.一种适合细胞长期实时成像的抗体结合内化量子点。 生物化学。 细胞生物学。 2007; 85:133–140. doi:10.1139/o06-205。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
45 Wadhwa R.、Sugihara T.、Hasan M.K.、Duncan E.L.、Taira K.、Kaul S.C.p19ARF的新型假定合作者。 老年病学扩展。 2003; 38:245–252. doi:10.1016/S0531-5565(02)00180-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
46 Chou T.C.,Talalay P.剂量-效应关系的定量分析:多种药物或酶抑制剂的联合作用。 高级酶调节。 1984; 22:27–55. doi:10.1016/0065-2571(84)90007-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
47 Nath B.、Raza A.、Sethi V.、Dalal A.、Ghosh S.S.、Biswas G.通过收缩微通道了解宫颈癌(HeLa)细胞的流动动力学、生存能力和转移潜能。 科学。 2018年代表; 8:17357. doi:10.1038/s41598-018-35646-3。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
48 李萍,茅姿,彭姿,周磊,陈毅,黄培华,特鲁伊卡·C.I.,德拉比克·J.J.,埃尔·戴里·W·S·S·,道·M·循环肿瘤细胞的声学分离。 程序。 国家。 阿卡德。 科学。 美国2015年; 112:4970–4975. doi:10.1073/pnas.1504484112。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
49 Paterlini-Brechot P.,Benali N.L.循环肿瘤细胞(CTC)检测:临床影响和未来方向。 癌症快报。 2007; 253:180–204. doi:10.1016/j.canlet.2006.12.014。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
50 赵勇,姚荣,欧阳立,丁宏,张涛,张凯,程旭,孙伟。子宫颈肿瘤体外模型Hela细胞的三维打印。 生物制造。 2014; 6:35001. doi:10.1088/1758-5082/6/3/035001。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
51 Tu Y.F.、Kaipparettu B.A.、Ma Y.、Wong L.J.高转移性乳腺癌细胞系MDA-MB-231的线粒体表现出更强的自噬特性。 生物化学。 生物物理学。 《学报》。 2011; 1807:1125–1132. doi:10.1016/j.bbabio.2011.04.015。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
52 Zhang X.,Chan T.,Mak M.MDA-MB-231单细胞和双细胞在受限微环境中侵袭的形态动力学特征。 科学。 代表2021年; 11:6529. doi:10.1038/s41598-021-85640-5。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
53 Liu Y.-L.、Chou C.-K.、Kim M.、Vasisht R.、Kuo Y.-A.、Ang P.、Liu C.、Perillo E.P.、Chen Y.-A、Blocher K.基于EGFR动力学评估乳腺癌细胞的转移潜能。 科学。 众议员2019; 9:3395. doi:10.1038/s41598-018-37625-0。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
54 左X.-X.,杨Y.,张Y.,张Z.-G.,王X.-F.,石Y.-G.血小板通过直接相互作用促进乳腺癌细胞MCF-7转移:表面整合素α2β1-接触介导Wnt-β-catenin通路的激活。 细胞通讯。 信号。 2019; 17:142. doi:10.1186/s12964-019-0464-x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
55 Elwakel A.、Soudan H.、Eldoksh A.、Shalaby M.、Eldemellawy M.,Ghareb D.、Abouseif M.、Fayad A.、Hassan M.、Saeed H.采用Chou-Talalay方法研究二元和三元药物组合对MDA-MB-231三阴性乳腺癌细胞的体外药效学相互作用。 协同2019; 8:100047. doi:10.1016/j.synres.2019.100047。 [ 内政部 ] [ 谷歌学者 ]
56 Qadir A.,Wahid M.,Asif M.,Roome T.贝伐单抗和塞来昔布在使用人脐静脉内皮细胞体外对血管生成的协同作用。 国际临床杂志。 药理学。 疗法。 2020; 58:696–702. doi:10.5414/CP203757。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
57 Yukawa H.、Suzuki K.、Aoki K.,Arimoto T.、Yasui T.、Kaji N.、Ishikawa T.、Ochiya T.和Baba Y.通过摄取肝细胞癌细胞分泌的外泌体,对人脐静脉内皮细胞的血管生成进行成像。 科学。 2018年代表; 8:6765. doi:10.1038/s41598-018-24563-0。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
58 Huang B.,Huang M.,Li Q.癌相关成纤维细胞通过VEGF介导的EZH2/VASH1通路促进肝细胞癌血管生成。 Technol公司。 癌症研究治疗。 2019; 18:1533033819879905. doi:10.1177/1533033819879905。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
59 Chen Z.,Htay A.,Dos Santos W.,Gillies G.T.,Fillmore H.L.,Sholley M.M.,Broaddus W.C.通过与胶质母细胞瘤细胞的三维共培养诱导人脐静脉内皮细胞(HUVEC)的体外血管生成。 神经瘤杂志。 2009; 92:121–128. doi:10.1007/s11060-008-9742-y。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
60 Martin T.A.紧密连接在癌症转移中的作用。 塞明。 细胞发育生物学。 2014; 36:224–231. doi:10.1016/j.semcdb2014.09.008。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
61 Bhat A.A.、Uppada S.、Achkar I.W.、Hashem S.、Yadav S.K.、Shanmugakonar M.、Al-Naemi H.A.、Haris M.、Uddin S.癌症和炎症中的紧密连接蛋白和信号通路:功能性串扰。 正面。 生理学。 2018; 9:1942. doi:10.3389/fphys.2018.01942。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
62 Chao Y.C.、Pan S.H.、Yang S.C.、Yu S.L.、Che T.F.、Lin C.W.、Tsai M.S.、Chang G.C.、Wu C.H.、Wu Y.Y.等。Claudin-1是一种转移抑制因子,与肺腺癌的临床结果相关。 美国J.Respir。 克里特。 2009年护理医学; 179:123–133. doi:10.1164/rccm.200803-456OC。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
63 Bhat A.A.、Syed N.、Therachiil L.、Nisar S.、Hashem S.、Macha M.A.、Yadav S.K.、Krishnankutty R.、Muralitharan S.、Al-Naemi H.等人,Claudin-1,癌症的双刃剑。 国际分子科学杂志。 2020; 21:569. doi:10.3390/ijms21020569。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
64 Heuberger J.、Birchmeier W.钙粘蛋白介导的细胞粘附与典型Wnt信号的相互作用。 冷泉港。 透视。 生物.2010; 2:a002915。 doi:10.1101/cshperspect.a002915。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
65 Delmas A.L.、Riggs B.M.、Pardo C.E.、Dyer L.M.、Darst R.P.、Izumchenko E.G.、Monroe M.、Hakam A.、Kladde M.P.、Siegel E.M.WIF1是子宫颈鳞状细胞癌表观遗传沉默的常见靶点。 致癌。 2011; 32:1625–1633. doi:10.1093/carcin/bgr193。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
66 Gao R.,Yu Y.,Inoue A.,Widodo N.,Kaul S.C.,Wadhwa R.异质核核糖核蛋白K(hnRNP-K)通过诱导参与细胞外基质、细胞运动和血管生成的基因促进肿瘤转移。 生物学杂志。 化学。 2013; 288:15046–15056. doi:10.1074/jbc。 M113.466136。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
67 Lohela M.、Bry M.、Tammela T.、Alitalo K.血管生成与淋巴管生成相关的VEGFs和受体。 货币。 操作。 细胞生物学。 2009; 21:154–165. doi:10.1016/j.ceb.2008.12.012。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
68 Bielenberg D.R.、Zetter B.R.《血管生成对转移过程的贡献》。 《癌症杂志》2015; 21:267–273. doi:10.1097/PPO.0000000000138。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
69 Gandalovicova A.、Rosel D.、Fernandes M.、Vesely P.、Heneberg P.、Cermak V.、Petruzelka L.、Kumar S.、Sanz-Moreno V.、Brabek J.Migrastatics-抗代谢和抗侵袭药物:前景与挑战。 癌症趋势。 2017; 3:391–406. doi:10.1016/j.trecan.2017.04.008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
70 Steeg P.S.靶向转移。 Nat.Rev.癌症。 2016; 16:201–218. doi:10.1038/nrc.2016.25。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
71 Howard S.,Deroo T.,Fujita Y.,Itasaki N.上皮-间质转化期间钙粘蛋白在Wnt/beta-catenin信号传递中的积极作用。 《公共科学图书馆·综合》。 2011; 6:e23899。 doi:10.1371/journal.pone.0023899。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
72 Fantozzi A.、Gruber D.C.、Pisarsky L.、Heck C.、Kunita A.、Yilmaz M.、Meyer Schaller N.、Cornelle K.、Hopfer U.、Bentires Alj M.等。VEGF介导的血管生成将EMT诱导的癌症干性与肿瘤起始联系起来。 2014年癌症研究; 74:1566–1575. doi:10.1158/008-5472.CAN-13-1641。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
73 张平,刘海,夏峰,张庆伟,张玉英,赵琦,赵志海,蒋志伟,蒋C.C.上皮-间质转化是获得顺铂耐药性和增加鼻咽癌细胞转移潜能所必需的。 《国际分子医学杂志》,2014年; 33:151–159. doi:10.3892/ijmm.2013.1538。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
74 Garg S.、Huifu H.、Kumari A.、Sundar D.、Kaul S.C.、Wadhwa R.葫芦素B和丙酮的新组合诱导癌细胞衰老:分子机制和治疗潜力。 杰伦托尔。 生物科学。 医学科学。 2020; 75:1031–1041. doi:10.1093/gerona/glz077。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
75 Oh E.,Garg S.,Liu Y.,Afzal S.,Gao R.,Yun C.O.,Kaul S.C.,Wadhwa R.三甘醇衍生物抗转移和抗血管生成活性的鉴定和功能表征。 正面。 昂科尔。 2018; 8:552. doi:10.3389/fonc.2018.00552。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
76 Yang H.,Wang Y.,Cheryan V.T.,Wu W.,Cui C.Q.,Polin L.A.,Pass H.I.,Dou Q.P.,Rishi A.K.,Wali A.Withaferin A在体内外抑制间皮瘤中的蛋白酶体活性。 《公共科学图书馆·综合》。 2012; 7:e41214。 doi:10.1371/journal.pone.0041214。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
77 Lee J.、Sehrawat A.、Singh S.V.Withaferin A可激活人类乳腺癌细胞中的Notch2和Notch4。 乳腺癌研究治疗。 2012; 136:45–56. doi:10.1007/s10549-012-2239-6。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
78 Gao R.、Shah N.、Lee J.S.、Katiyar S.P.、Li L.、Oh E.、Sundar D.、Yun C.O.、Wadhwa R.、Kaul S.C.富含Ashwagandha和醇的混合物通过hnRNP-K.Mol.Cancer Ther限制转移和血管生成。 2014; 13:2930–2940. doi:10.1158/1535-7163.MCT-14-0324。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
79 Chaudhary A.、Kalra R.S.、Malik V.、Katiyar S.P.、Sundar D.、Kaul S.C.、Wadhwa R.2、3-二氢-3beta-methoxy with aferin-A缺乏抗转移效力:生物信息学和实验证据。 科学。 2019年报告; 9:17344. doi:10.1038/s41598-019-53568-6。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
80 Widodo N.、Priyandoko D.、Shah N.、Wadhwa R.、Kaul S.C.Ashwagandha叶提取物及其成分内酯酮对癌细胞的选择性杀伤涉及ROS信号传导。 《公共科学图书馆·综合》。 2010; 5:e13536。 doi:10.1371/journal.pone.0013536。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
81 Kakar S.S.、Ratajczak M.Z.、Powell K.S.、Moghadamfalahi M.、Miller D.M.、Batra S.K.、Singh S.K.Withaferin a单独或联合顺铂通过靶向假定的肿瘤干细胞抑制卵巢癌的生长和转移。 公共科学图书馆一号。 2014; 9:e107596。 doi:10.1371/journal.pone.0107596。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
82 Wadhwa R.、Nigam N.、Bhargava P.、Dhanjal J.K.、Goyal S.、Grover A.、Sundar D.、Ishida Y.、Terao K.、Kaul S.C.《γ-环糊精对咖啡酸苯乙酯抗癌活性的分子表征和增强》,《癌症杂志》。 2016; 7:1755–1771. doi:10.7150/jca.15170。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
83 Wang J.、Bhargava P.、Yu Y.、Sari A.N.、Zhang H.、Ishii N.、Yan K.、Zhang Z.、Ishida Y.、Terao K.等。新型咖啡酸苯乙酯-mortalin抗体纳米颗粒对癌细胞具有增强的选择性细胞毒性。 癌症。 2020; 12:2370. doi:10.3390/cancers12092370。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
84 Ishida Y.、Gao R.、Shah N.、Bhargava P.、Furune T.、Kaul S.C.、Terao K.、Wadhwa R.蜜蜂蜂胶中的抗癌活性:咖啡酸苯乙酯及其与γ-环糊精复合物作用的功能见解。 癌症治疗。 2018; 17:867–873。 doi:10.1177/1534735417753545。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
85 曾J.C.,林C.Y.,苏L.C.,傅H.H.,杨S.D.,Chuu C.P.CAPE通过激活非规范Wnt信号抑制前列腺癌细胞的迁移和侵袭。 Oncotarget公司。 2016; 7:38010–38024. doi:10.18632/noctarget.9380。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
86 Lee Y.Y.,Kao C.L.,Tsai P.H.,Tasai T.H.,Chiou S.H.,Wu W.F.,Ku H.H.,Wong T.T.咖啡酸苯乙酯优先增强髓母细胞瘤细胞系中的放射增敏和氧化应激。 儿童神经。 系统。 2008; 24:987–994. doi:10.1007/s00381-008-0636-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
87 Gheldof A.、Berx G.Cadherins和上皮-间充质转化。 掠夺。 分子生物学。 Transl.公司。 科学。 2013; 116:317–336. doi:10.1016/B978-0-12-394311-8.00014-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
88 宋瑜,叶明,周杰,王志伟,朱霞。用天然化合物恢复E-cadherin的表达,用于生殖器癌和泌尿系癌的抗癌治疗。 摩尔-热。 Oncolytics公司。 2019; 14:130–138. doi:10.1016/j.omto.2019.04.005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
89 Chu S.C.、Yu C.C.、Hsu L.S.、Chen K.S.、Su M.Y.、Chen P.N.小檗碱逆转人宫颈癌细胞的上皮-间充质转化并抑制转移和肿瘤诱导的血管生成。 摩尔药理学。 2014; 86:609–623. doi:10.1124/mol.114.094037。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
90 Tyszka-Czochara M.、Lasota M.、Majka M.咖啡酸和二甲双胍通过作用于不同的分子靶点,抑制TGF-beta1诱导的C-4I和HTB-35/SiHa人宫颈鳞癌细胞的侵袭性表型。 国际分子科学杂志。 2018; 19:266. doi:10.3390/ijms19010266。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
91 Han S.T.、Kim J.S.、Lee J.Y.、Kim M.K.、Yoo J.S.,Han B.G.、Choi S.O.、Yang J.W.磷酸二酯酶5抑制剂通过肾脏klotho表达抑制上皮-间充质转化的机制。 临床。 实验药理学。 生理学。 2018; 45:269–277. doi:10.1111/1440-1681.12872。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
92 李斌,潘世通,邱建霞。白花蛇毒素对人舌鳞癌细胞上皮-间充质转化的影响及其机制。 中华口强一学杂志。 2017; 52:421–426. doi:10.3760/cma.j.issn.1002-0098.2017.07.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
93 Chen K.S.,Shi M.D.,Chien C.S.,Shih Y.W.Pinocembrin通过失活α-β整合素/FAK/p38alpha信号通路抑制TGF-beta1诱导的人Y-79视网膜母细胞瘤细胞的上皮-间质转化和转移。 细胞生物学。 2014; 4:41. doi:10.186/2045-3701-4-41。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
94 Meng Z.,Zhang R.,Wu X.,Zang M.,Zhang S.,Jin T.,凡士林的预后价值与肺腺癌中上皮-间质转化和血管生成的作用相关。 致癌。 2021:bgab081。 doi:10.1093/carcin/bgab081。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
95 Hasan M.K.、Yaguchi T.、Sugihara T.、Kumar P.K.、Taira K.、Reddel R.R.、Kaul S.C.、Wadhwa R.CARF是一种新型蛋白,可与小鼠p19ARF(人p14ARF)协同激活p53。 生物学杂志。 化学。 2002; 277:37765–37770. doi:10.1074/jbc。 m20417.72万元。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
96 Hasan M.K.、Yaguchi T.、Minoda Y.、Hirano T.、Taira K.、Wadhwa R.、Kaul S.C.CARF(ARF的合作者)的替代阅读框蛋白(ARF)独立功能涉及其与p53的相互作用:新p53激活途径及其负反馈控制的证据。 生物化学。 J.2004年; 380:605–610. doi:10.1042/bj20040337。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
97 Hasan M.K.、Yaguchi T.、Harada J.I.、Hirano T.、Wadhwa R.、Kaul S.C.CARF(ARF的合作者)与HDM2相互作用:CARF-p53-HDM2-p21WAF1通路的新型调控反馈调节的证据。 国际期刊Oncol。 2008; 32:663–671. doi:10.3892/ijo.32.3.663。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
98 Cheung C.T.,Singh R.,Yoon A.R.,Hasan M.K.,Yaguchi T.,Kaul S.C.,Yun C.O.,Wadhwa R.CARF沉默诱导人类癌细胞凋亡的分子特征。 细胞死亡不同。 2011; 18:589–601. doi:10.1038/cdd.2010.129。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
99 Eskander R.N.,Tewari K.S.针对晚期宫颈癌的血管生成。 疗法。 高级医学Oncol。 2014; 6:280–292. doi:10.1177/1758834014543794。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
100 Lee N.、Kim S.I.、Lee M.、Kik H.S.、Kin J.W.、Park N.H.、Song Y.S.Bevacizumab对持续性和转移性宫颈癌的疗效和复发模式。 在体内。 2019; 33:863–868. doi:10.21873/invivo.11551。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。
数据可用性声明 当前研究中使用和/或分析的所有数据集都包含在手稿中 补充信息文件 。
Cances的文章由以下机构提供 多学科数字出版研究所(MDPI)