介绍 小鼠乳腺的导管系统在产后前3周从乳头延伸出一个发育不全的导管,在产后发育( 鲍尔,1998年 ; Silberstein,2001年 ). 小鼠在4-5周龄开始进入青春期前,乳腺对生殖激素产生反应,生殖激素启动生长期,末端芽(TEB)结构驱动导管形态发生。 TEB是生长导管尖端的棒状结构,由两种细胞类型组成:一种是产生管腔乳腺上皮细胞的体细胞内层,另一种是发育成肌上皮层的未分化帽细胞单层( 莫里斯和斯坦,2017年 ; 威廉姆斯和丹尼尔,1983年 ). 到9周大时,TEB侵入基质会产生一棵乳腺树,填充乳腺脂肪垫,形成成熟处女动物特有的乳腺。
成人组织干细胞的典型特征是未分化的多能干细胞,能够通过细胞分裂再生器官或组织的结构( 波斯特和克利夫斯,2019年 ). 乳腺干细胞(MaSCs)的存在首先通过显示成年乳腺组织在移植到3周龄同基因小鼠的清除脂肪垫中时可以繁殖乳腺来证明( Deome等人。, 1959 ). 在移植试验中,由乳腺再生单位(MRU)定义的MaSC的频率估计约为基底细胞(BCs)的2%( Fu等人。, 2019 ; Shackleton等人。, 2006 ; Stingl等人。, 2006 ). 小鼠MaSC群体具有Lin的表达谱 − CD24型 + CD29型 高的 CD49f型 高的 表达细胞角蛋白5和14(由 Krt5(Krt5) 和 Krt14号机组 基因)。 与多能干细胞存在于基底层的假设相一致,BC-衍生类有机物能够形成由内部立方腔细胞组成的结构,这些细胞能够产奶,周围环绕着形态细长的肌上皮层,而腔细胞衍生类有机质缺乏肌上皮层( Jamieson等人。, 2017 ).
乳腺发育程序的特点是由几个转录因子协调的转录组的变化( Pal等人。, 2017 ; Wuidart等人。, 2018 ). AP-2转录因子家族是神经嵴衍生物、表皮和泌尿生殖组织正常胚胎发生和胚胎发育所必需的( Hilger-Eversheim等人。, 2000 ; Winger等人。, 2006 ). AP-2因子在调节乳腺发育中也起着重要作用。 在小鼠乳腺中,AP-2α和AP-2γ在7周龄时在基底和管腔乳腺上皮细胞的细胞核中表达,并且这两种因子都在TEB的体细胞和帽细胞中表达( Jager等人。, 2010 ; Zhang等人。, 2003 ). 研究已经检测了使用MMTV启动子的转基因驱动的AP-2α过度表达的影响( Zhang等人。, 2003 ). 乳腺发育的初始阶段是正常的,成熟的处女8周龄小鼠表达转基因,显示出正常的乳腺树结构; 然而,在6个月龄时,表达转基因的小鼠表现出较稀疏的导管网络,肺泡芽减少。 在妊娠期间,表达转基因的小鼠的小叶肺泡组织的增殖减少,细胞凋亡增加。 在过度表达AP-2γ的小鼠中进行的平行研究表明,Ki-67表达增加、溴脱氧尿苷掺入增加以及细胞凋亡增加导致了过度增殖,总体效果导致妊娠期间肺泡上皮发育不良( Jager等人。, 2003 ).
的基因敲除(KO) Tfap2c型 胚胎外膜AP-2γ表达缺失导致早期胚胎死亡( Auman等人。, 2002 ). 的条件淘汰(CKO) Tfap2c型 使用 Sox2系统 促进者驱动 Cre公司 重组酶显示AP-2γ的缺失在青春期前损害了乳腺的分支( Jager等人。, 2010 ). AP-2γ缺失导致分支点数量和最大导管长度减少,但不影响TEB的生成。 到8个月时,处女的乳腺导管已经完全填满了脂肪垫 Tfap2c型 CKO小鼠; 然而,分枝程度降低,表明AP-2γ控制着导管伸长的速度以及第三级分枝和侧芽的发育。 在另一项研究中,CKO Tfap2c型 使用MMTV启动程序驱动 Cre公司 导致仅在管腔上皮细胞中AP-2γ表达缺失( Cyr等人。, 2015 ). 年乳腺分支延迟 Tfap2c型 与管腔细胞相比,CKO小鼠的分支点减少,BCs的相对比例增加。
以前的实验模型对AP-2γ在基础和MaSC人群中的作用得出结论的能力有限,并且无法确定乳腺发育所必需的AP-2γ靶基因。 为了进一步理解AP-2γ在乳腺发育中的作用,我们使用了一种转基因,该转基因使用 Krt5(Krt5) 启动子驱动他莫昔芬诱导物的表达 Cre-ER公司 ,允许控制 Tfap2c型 KO并将AP-2γ的损失导向包括MaSC在内的BC人群。
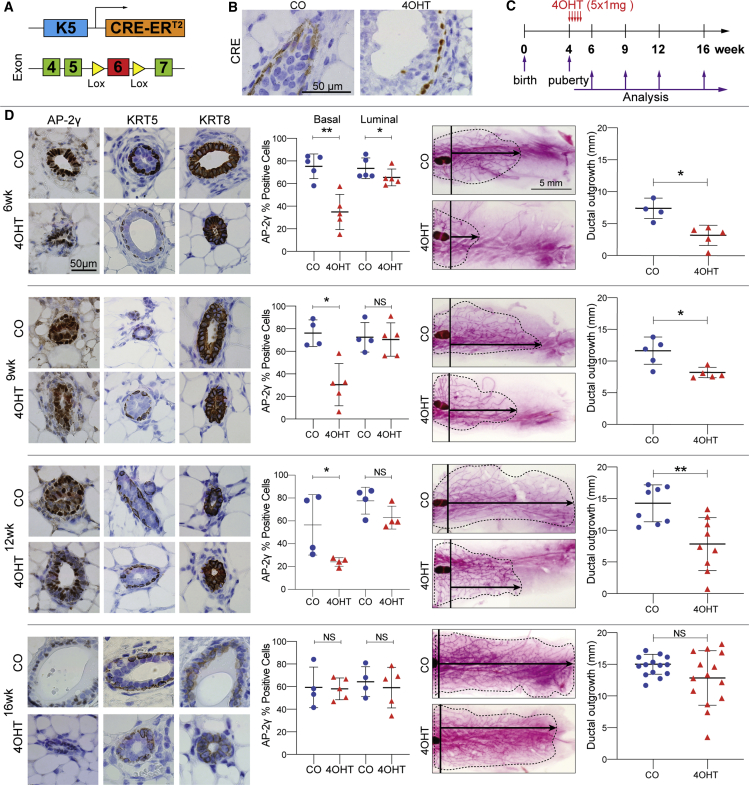
结果 AP-2γ受损乳腺导管生长不良的缺失 控制 Tfap2c型 在小鼠MaSC的KO中,我们利用表达三苯氧胺诱导的FVB小鼠 Cre公司 重组酶与雌激素受体融合并在牛角蛋白5启动子驱动下表达( Indra等人。, 1999 ) ( 图1 A) ●●●●。 我们证实,CRE的定位仅限于基底层的细胞质,核定位是由暴露于4-羟基-三苯氧胺(4OHT)引起的( 图1 B) ●●●●。 被鞭打的 Tfap2c型 等位基因被设计为删除第6外显子,该外显子干扰功能性AP-2γ蛋白的表达。 自由现金流/ Tfap2c型 飞行/飞行 /Krt5 Cre急诊室 T2段 用玉米油(CO)或4OHT对小鼠进行脉冲处理,剂量先前表明不会干扰形态发生( Scheele等人。, 2017 ). 从4周大的青春期早期开始,对基因完全相同的同窝雌鼠进行为期5天的治疗,并用免疫组织化学方法分析AP-2γ的表达,在6周、9周、12周和16周时用整只羊评估乳腺分支( 图1 C和1D)。 在6周、9周和12周时,BCs中AP-2γ的表达显著降低,仅在6周时管腔细胞中的表达略有降低。 16周后,AP-2γ表达差异消失。 第6外显子缺失 Tfap2c型 4OHT治疗1周内,在基底乳腺上皮细胞(MMEC)中检测到mRNA,但在管腔细胞中未检测到( 图S1 A) ●●●●。 CKO显示乳腺导管延长延迟 Tfap2c型 第6、9和12周。 然而,与4OHT和CO处理的小鼠相比,在16周时未发现乳腺导管结构的显著差异。 在FVB中进行了一组并行实验/ Krt5-Cre-ER公司 T2段 小鼠证明使用相同方案的三苯氧胺治疗对乳腺导管形态发生没有影响( 图S1 B和S1C)。 研究结果表明,CKO Tfap2c型 要么是镶嵌的,要么未能靶向前体细胞群体,因此野生型细胞可以胜过突变细胞,并导致导管生长的最终恢复。 总之,研究结果表明AP-2γ在乳腺导管伸长中起着关键作用。
图1。
AP-2γ缺失抑制乳腺导管生长
(A) Krt5(Krt5) 启动子用于驱动 Cre公司 重组酶通过Lox位点消除AP-2γ的表达 Tfap2c型 基因。
(B) 自由现金流/ Tfap2c型 飞行/飞行 /Krt5-Cre-ER公司 T2段 用玉米油(CO)或4-羟基-三苯氧胺(4OHT)和 Cre公司 免疫组化检测其表达; 用4OHT处理诱导核CRE表达。
(C) 显示从4周龄开始连续5天用CO或4OHT治疗小鼠的示意图; 在6周、9周、12周和16周时进行分析。
(D) 蛋白质表达和总量分析。 免疫组织化学(左侧)检测CKO的MMEC中AP-2γ蛋白的丢失 Tfap2c型 KRT5和KRT8的表达分别显示基底和管腔MMEC。 在6周、9周和12周时,(BC)室中的AP-2γ表达显著降低。 在6周时,发现肠壁细胞的AP-2γ表达显著降低,但在9周和12周时,这种降低并未持续。 对每只动物至少三个具有代表性的显微镜视野(40倍放大)进行量化。 通过比较染色细胞和总上皮细胞来计算百分比。 结果表示为平均值±SEM ; CO/4OHT的数量:n=5/5(6周),n=4/5(9周),n=4/4(12周),n-4/5(16周)。 ∗ p<0.05, ** p<0.01; n.s.,不重要; Mann-Whitney U检验的统计显著性。 6周、9周、12周和16周龄小鼠的代表性完整乳腺(右侧); 黑色箭头表示测量的距离。 相应的图表显示了从淋巴结到最远处乳腺分支测量的乳腺树的生长情况,表明CKO使乳腺树的增长显著减少 Tfap2c型 ,在16周内解决。 结果表示为平均值±SEM; CO/4OHT小鼠数量:n=4/5(6周),n=5/5(9周),n=8/9(12周),n=14/14(16周); ∗ p<0.05, ** p<0.01; 不显著; Mann-Whitney U检验的统计显著性。
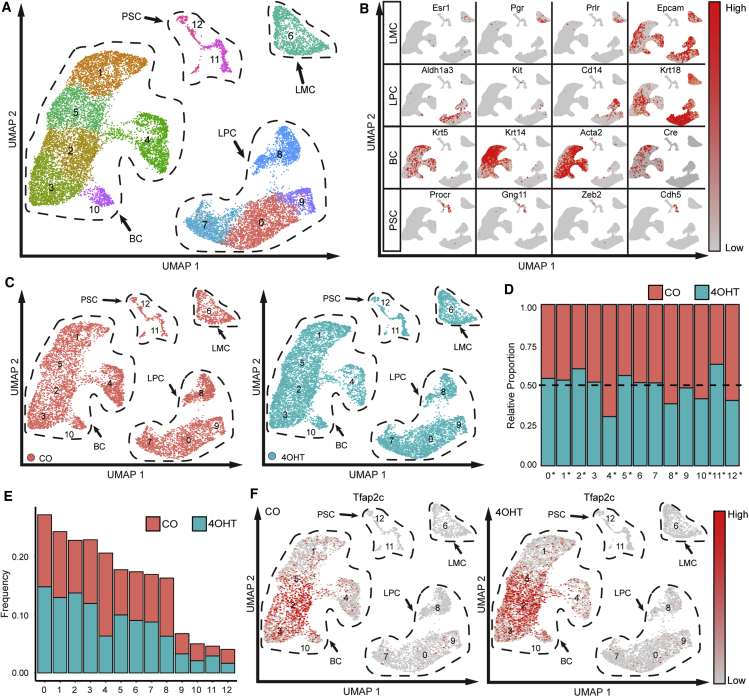
的CKO Tfap2c型 改变MMEC聚类和基因表达模式 单细胞RNA测序(scRNA-seq)用于检测AP-2γ缺失的MMEC转录组的变化。 四周FVB/ Tfap2c型 飞行/飞行 /Krt5-Cre-ER公司 T2段 用4OHT或CO对小鼠进行类似的脉冲处理,并在9周龄时采集乳腺( 图S1 D) ●●●●。 生成单个细胞并对其进行流分类,以丰富内腔和基底乳腺上皮细胞群,这些细胞按1:1组合,并用scRNA-seq进行分析( 图2 ). 值得注意的是,与CO和4OHT处理的FVB相比,我们没有发现收获的基底细胞和管腔细胞总数有统计学上的显著差异/ Tfap2c型 飞行/飞行 /Krt5-Cre-ER公司 T2段 动物。 使用统一流形近似和投影(UMAP)分析了来自CO处理动物的7866个MMEC和来自4OHT处理动物的10350个MMEC组合群体的RNA-seq数据,其中确定了13个不同的MMEC簇,称为簇0-12( 图2 A) ●●●●。 表达模式用于识别主要MMEC组,即管腔成熟细胞、管腔前体细胞(LPC)、BCs和蛋白C受体(PROCR) + )干细胞(PSC)( Wang等人。, 2015 ; Sun等人。, 2018 ) ( 图2 B和 S2系列 A) ●●●●。 PSC簇的基因表达模式与 Procr公司 + 报告的多能干细胞数量 Wang等人。 (2015) ( 图S2 B) ●●●●。 的CKO Tfap2c型 显著降低了分别属于基底和管腔簇的簇4和簇8内细胞的相对比例( 图2 C–2E)。 在其他几个集群中,包括集群10(BC集群)和集群12(PSC集群),降幅较小。 此外,属于PSC亚组的第11簇细胞的相对比例显著增加( 图2 D和2E)。 这个 Tfap2c型 该基因在基底隔室中表达最高 Tfap2c型 -簇2中的表达细胞( 图2 F) ●●●●。 LPC簇0、7、8和9中分散的细胞也被证明具有相对较高的 Tfap2c型 表达式。 尽管CKO消除了基底层AP-2γ蛋白的表达( 图1 ),第6外显子缺失的mRNA表达如预期( 图2 F) ●●●●。
图2。
scRNA序列分析
(A) 实验在两个独立的重复中进行,在每个实验中,两个CO和两个4OHT处理的小鼠用于乳腺收获,每个条件下总共有4只小鼠。 UMAP聚类分析鉴定出13个乳腺细胞簇; 转录组定义了密切相关的簇,包括BC、管腔前体簇(LPC)、成熟管腔簇(LMC)和 Procr公司 + 干细胞簇(PSC)。
(B) 用于分类乳腺细胞簇主要组的基因表达示例。
(C) 分别显示CO处理(橙色)和4OHT处理(茶色)动物的UMAP簇。
(D) CO和4OHT处理的动物每簇中乳腺细胞的相对比例,其中0.50表示细胞的相对数量没有变化; ∗ p<0.05。
(E) CO和4OHT处理小鼠的细胞频率由集群中细胞的相对数量显示。
(F) 的表达式模式 Tfap2c型 CO和4OHT处理的小鼠。
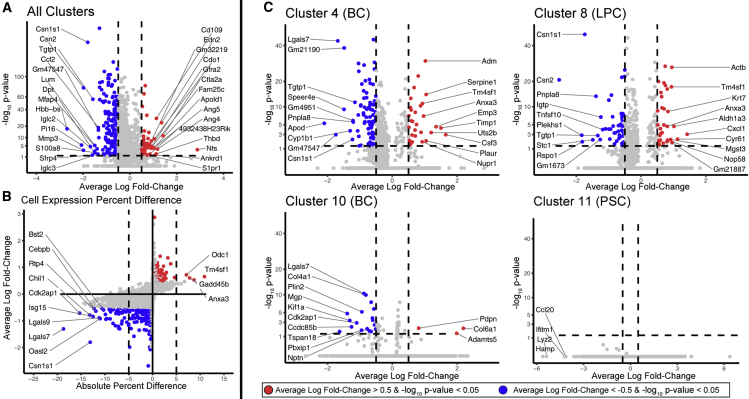
对数据进行分析,以确定AP-2γ缺失时表达发生显著变化的基因,然后对该基因列表进行Ingenuity Pathway Analysis(IPA)分析。 IPA表明许多因AP-2γ缺失而改变的基因参与了细胞周期、迁移和分化( 表S1 ). 共有644个基因在CKO的表达中表现出显著变化 Tfap2c型 ( 表S2 ). 使用基于±0.5的对数变化和p<0.05的显著性的差异,与CKO诱导的基因相比,受抑制的基因数量更多 Tfap2c型 ( 图3 A) ●●●●。 当局限于绝对百分比差异为集群中5%细胞的基因时,有30个基因被抑制,4个基因被AP-2γ缺失诱导( 图3 B和 第3章 ). 当按聚类分析时,除聚类11外,每个聚类中都发现了基因表达的变化( 图3 C和 S4系列 ). 当考虑在四个或更多簇中表现出显著变化的基因时, Cdk2ap1型 , 增强子结合蛋白 , 通信1 , Hspa1a , Krt15 , Lgals7号机组 , 普林2 , 血小板8 ,以及 Sp140型 被压抑和 安克萨3 , 加德4 5b中, Krt18(Krt18) , Nfkbia公司 , 奥迪c1 ,以及 Tm4sf1型 由CKO诱导 Tfap2c型 ( 表S2 ). 对于所有这些基因,表达的变化总是包括基础簇(1、2、3、4、5和10),而对于 Lgals7号机组 和 克15 ,表达的变化仅限于基底簇。 对5周龄时分离的大腔和基底MMEC的选定基因的表达分析证实了AP-2γ的调节作用( 图S5 ).
图3。
CKO引起的基因表达变化 Tfap2c型
(A) 垂直轴显示−log的火山图 10 随着AP-2γ的损失,所有MMEC中改变的基因的p值和横轴平均对数倍变化; 彩色点代表p<0.05和平均对数变化>±0.5的基因; 蓝色用于抑制基因,红色用于KO诱导的基因 Tfap2c型 .
(B) 如(A)所示的相同数据绘制了平均对数倍变化与显示基因表达的细胞百分比差异。 标记的基因具有调整后的p值<0.05和±5%的差异。
(C) 第4、8、10和11簇基因表达变化的火山图如(A)所示。
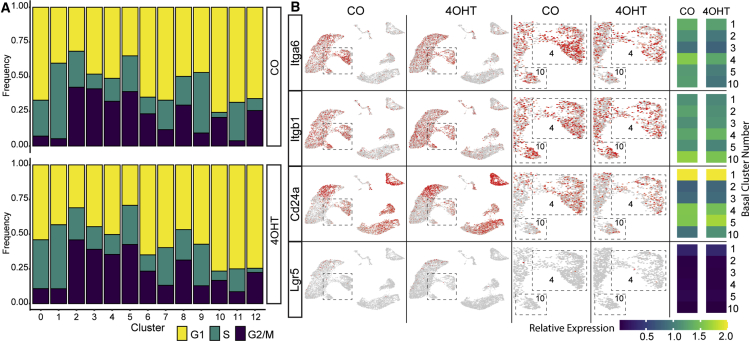
的CKO Tfap2c型 MaSCs的抑制多能性 以前的研究( Fu等人。, 2019 ; 维斯瓦德和斯廷格尔,2014年 )通过表达标记Lin来定义MaSC − 韩元5 + ,CD49 高的 ,CD29 高的 和CD24 + LGR5已被报道为另一个潜在的MaSC标记,但研究显示LGR5的重新填充活性并不一致 + 和LGR5 − 子集( 维斯瓦德和斯廷格尔,2014年 ). 使用scRNA-seq对小鼠乳腺进行的检查没有发现代表MaSC的单个独特簇,这与以前的报告一致,即功能性MaSC状态可能由具有不同转录特征的细胞生成( Giraddi等人。, 2018 ). 目前使用scRNA-seq对乳腺转录组的分析没有明确定义MaSC簇( 图2 和 4 ); 然而,根据MaSC标记的表达模式,簇4和簇10中的一小部分细胞可能代表MaSC群体。 在基础簇中,簇10的G细胞百分比最高 1 /G公司 0 S期细胞百分比最低( 图4 A) ●●●●。 的CKO Tfap2c型 减少了基底簇4和10内的细胞数量( 图2 D和2E),表达模式与具有MaSC表型的细胞群体一致; 注意到簇4和簇10中的细胞 伊特加6 /CD49f型 + , Itgb1号机组 /CD29型 高 , Cd24a公司 /CD24型 + ,以及 Lgr5级 低 ( 图4 B) ●●●●。 具有MaSC标记表达的细胞随着KO Tfap2c型 AP-2γ缺乏对MaSC特征和乳腺导管生长的影响表明CKO Tfap2c型 可能降低MaSC的频率和/或功能。
图4。
随着AP-2γ的丢失MaSCs的变化
(A) 细胞周期显示为G中细胞的比例 1 、S和G 2 /CO和4OHT处理小鼠的乳腺细胞簇M。
(B) 的表达式模式 伊特加6 , Itgb1号机组 , Cd24a公司 ,以及 Lgr5级 来自CO和4OHT处理小鼠的基因。 中间面板:放大框状区域的视图,聚焦于基底簇4和10; 右侧面板:显示相对表达式的热图 伊特加6 , Itgb1号机组 , Cd24a公司 ,以及 Lgr5级 在CO和4OHT处理的小鼠的基础MMEC簇中。
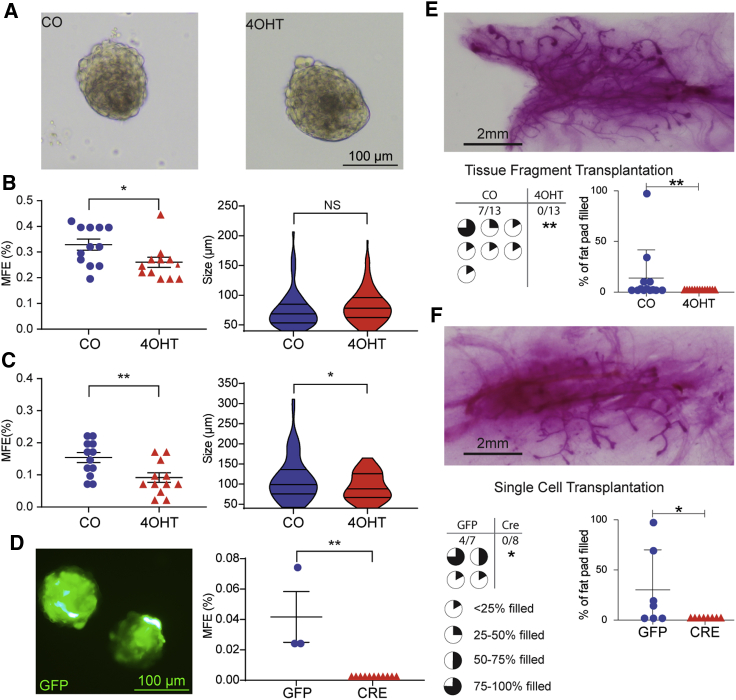
为了检查从FVB中分离出来的MMEC和MaSCs功能特性的变化/ Tfap2c型 飞行/飞行 /Krt5-Cre-ER公司 T2段 用一氧化碳和4OHT处理的小鼠进行了乳房球形成能力的检测。 与CO处理小鼠相比,从4OHT处理小鼠中分离出的MMEC表现出形成乳房球的能力显著降低,这是通过乳房球形成效率来衡量的( 图5 A和5B)。 二次乳房球的形成被认为是评估MaSC活动自我更新的更可靠方法( Shaw等人。, 2012 ). 从4OHT处理的动物和CO处理的动物中回收的初级乳房球生成次级乳房球; 4OHT处理过的小鼠的初级乳房球显示其形成次级乳房球的能力降低( 图5 C) ●●●●。 从CKO为 Tfap2c型 与对照组相比,它们也较小。 为了避免4OHT的潜在混淆效应,FVB的基础MMEC/ Tfap2c型 飞行/飞行 用表达绿色荧光蛋白(Ad-GFP)或GFP和Cre重组酶(Ad-Cre)的腺病毒载体转导小鼠,进行荧光激活细胞分选(FACS)以回收GFP + 用于形成乳房球的细胞; 而Ad-GFP转导的细胞形成了乳房球,而Ad-Cre-Transfered细胞未能形成乳房球( 图5 D) 与KO Tfap2c型 导致乳腺球形成能力的丧失。
图5。
AP-2γ缺失减少哺乳动物球和乳腺重建
从9周龄FVB收获的MMEC形成的哺乳动物球/ Tfap2c型 飞行/飞行 /Krt5-Cre-ER公司 T2段 从4周开始用CO和4OHT治疗的小鼠。
(A) 培养14天后的原始乳房样本。
(B) 乳腺球形成效率(MFE)和乳腺球大小的数据; n=每种条件下重复12次4000个细胞的电镀; ∗ p<0.05; n.s.,不显著,学生t检验。
(C) 由(A和B)中所述的初级乳房球形成的次级乳房球,以及MFE和尺寸数据; n=每种条件下重复12次4000个细胞的电镀 ∗ p<0.05, ** p<0.01,学生t检验。
(D) GFP示例 + Ad5CMVeGFP转导MMEC中的乳房球培养14天,MFE转导Ad5CMVeGFP和Ad5CMVCre-eGFP; ** p<0.01,学生t检验。
(E) 顶部面板显示了CO处理动物再造乳腺分支的示例; 数据表明,移植来自经CO处理但未经4OHT处理的小鼠的乳腺组织,发现乳腺树重建,7/13与0/13,p<0.01,Fisher精确检验; 填充百分比结果图为平均值±SEM, ∗ p<0.05,Mann-Whitney U检验。
(F) 顶部面板显示了Ad-GFP转导细胞的再造乳腺分支示例; 数据显示,经Ad-GFP转导但未经Ad-Cre转导的细胞重建乳腺树,4/7对0/8,p<0.05,Fisher精确检验; 填充率结果图为平均值±SEM; ∗ p<0.05,Mann-Whitney U检验。
乳腺移植被用于进一步证明CKO对 Tfap2c型 功能性MaSC。 从9周龄小鼠中分离出乳腺组织,这些小鼠从4周龄开始用CO或4OHT处理5天。 从CO处理的动物中分离出的乳腺组织,当移植到3周龄同系FVB小鼠的清除脂肪垫中时,能够重建乳腺,而从4OHT处理的动物身上提取的乳腺组织不能在清除脂肪垫内再生乳腺结构( 图5 E) ●●●●。 为了进一步研究AP-2γ对乳腺再生能力的影响,从FVB中采集MMEC BCs/ Tfap2c型 飞行/飞行 小鼠,并用Ad-Cre或Ad-GFP转导。 用Ad-GFP转导的基底MMEC显示出再生乳腺树的能力; 然而,用Ad-Cre转导的细胞未能证明其再生乳腺结构的能力( 图5 F) ●●●●。 这些数据表明AP-2γ在维持多潜能、功能性MaSC中起着关键作用。
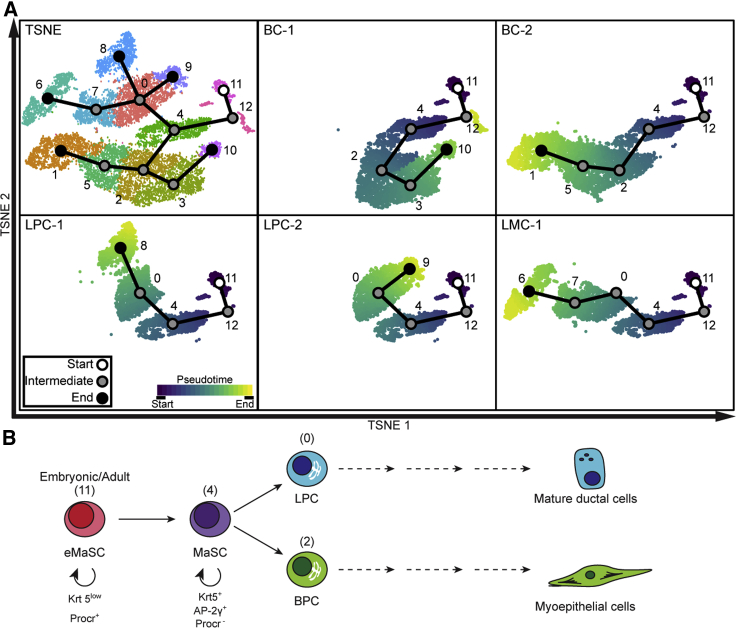
伪时间分析 scRNA-seq数据的伪时间分析用于在 Tfap2c型 表达式( 图6 ). 最早的MMEC前驱体由Procr代表 + 细胞簇(11和12)。 Procr中的基因表达 + 细胞包括已知MaSC标记的表达,包括 Zeb2公司 , 促性腺激素11 , 等电位5 ,以及 加拿大存托凭证5 ,但基础谱系标记低表达 Krt5(Krt5) ( 图2 )与早期研究一致,研究表明 + 细胞群是一个多能干细胞胚胎群( Wang等人。, 2015 ). 我们的数据表明 Krt5(Krt5) 低的 /Procr公司 + 胚胎MaSC在青春期持续存在于成人乳腺,但不受 Tfap2c型 CKO公司( 图3 C) ●●●●。 从Procr开始的伪时间轨迹 + 集群11/12与集群4不同,并为包含KRT5的集群提供了额外证据 + MaSC( 图6 ). 从簇4开始,分化途径分化为管腔和基底谱系,终止于成熟管腔或成熟BC种群。 使用p-Creode进行的无监督伪时间轨迹分析进一步支持了干细胞在PSC簇中的作用以及与簇4中细胞的密切发育关系( 图S6 ).
图6。
乳腺细胞发育的假时间和模型分析
(A) scRNA-seq的伪时间分析 弹弓 ; 第一个面板显示伪时间覆盖tSNE图,与前面的图具有相同的聚类,其余面板显示从中推断出的每个个体谱系 弹弓 .
(B) CKO结果支持的乳腺发育模型 Tfap2c型 ; 括号中的数字表示集群编号。
讨论 这项研究为AP-2γ在乳腺发育的青春期前阶段的作用提供了重要的见解。 的CKO Tfap2c型 在KRT5内 + BC室抑制乳腺导管的生长,抑制乳腺上皮细胞形成乳房球和再生乳腺结构的能力。 在可以进行比较的地方,目前的研究结果与以前研究AP-2γ在小鼠乳腺中作用的报告一致( Cyr等人。, 2015 ; Jager等人。, 2010 ). 如前所述, 免疫球蛋白5 被鉴定为乳腺中的AP-2γ靶基因( Jager等人。, 2003 )我们注意到 Igfbp5型 基底簇4和管腔簇7的表达( 表S2 ). 目前的研究结果通过阐明AP-2γ在基底/MaSC室中的作用以及确定调节乳腺发育的AP-2γ靶基因,扩展了先前的报道。
关于多能KRT5的潜在作用,存在相当大的争议 + 乳腺基底室中的MaSC在青春期生长( Lee等人。, 2019 ). 线性追踪实验使用 Krt5-CreER公司 /4周龄时用三苯氧胺治疗的Rosa-YFP小鼠表现出仅标记基底室( Van Keymeulen等人。, 2011 ). 类似地,设计用于标记KRT14的谱系追踪实验 + 基底干细胞对青春期后小鼠单能性骨髓基质干细胞的支持作用( Wuidart等人。, 2016 ). 其他研究提供了证据,证明乳腺胚胎的大部分生长来自胚胎第15.5天之后的受谱系限制的单能细胞( Lilja等人。, 2018 ). 另一方面,移植实验表明CD29 高的 CD24型 + BCs能够产生正常的乳腺结构。 线性追踪实验报告人 Rios等人。 (2014年) 使用高分辨率3D成像,显示了导管树管腔和基底部的标记 Krt5(Krt5) 启动子,支持多能KRT5模型 + MaSC在青春期乳腺发育期间产生成熟的基底细胞和管腔细胞。 结果中的关键差异可能受到用于处理组织的技术以及使用3D与2D成像可视化标记细胞的影响( Rios等人。, 2016 ).
发现某些管腔细胞转录组改变的一种可能性是 Tfap2c型 单位:KRT5 + 在AP-2γ蛋白丢失之前,MaSC产生管腔细胞; 然而,一旦AP-2γ蛋白功能丧失 Tfap2c型 基因失去了它们的多能能力。 先前对管腔型乳腺癌的研究表明 TFAP2C型 抑制管腔基因表达和诱导基础基因表达诱导上皮-间质转化( Bogachek等人。, 2016 ; Cyr等人。, 2015 ). 一个可能的假设是AP-2γ是多能干细胞生成管腔祖细胞所必需的,这可以解释乳腺发育和管腔乳腺癌模型中的发现( 图6 B) ●●●●。 如果的CKO Tfap2c型 在MaSC中,阻止其产生管腔前体细胞的能力,那么所有随后的管腔上皮细胞都必须来源于完整的MaSC Tfap2c型 这将解释为什么在以后的时间点没有检测到AP-2γ表达降低( 图1 ). 或者,AP-2γ的缺失可能会降低基底细胞的生存能力,这可能是对乳腺增生形成和乳腺导管重建的影响。 此外,组织分离和AP-2γ丢失可能会降低BCs的活性或增殖,这可能是实验结果的原因。 基础簇4和10相对减少,但KRT5相对增加 + 基生簇1、2、3和5; 因此,对BC活性的影响可能是集群4和集群10中细胞特有的,其中可能包括MaSC群体。 关于AP-2γ的丢失是否会导致BC的增殖停滞、侵袭细胞外基质的能力降低、影响BC特性的基因表达的改变或基底细胞和激素反应性管腔细胞之间的信号缺陷,还有更多的问题。 AP-2γ的缺失是否会影响MaSC的活性或改变其转录组从而导致功能或特性的改变,这是一个复杂的问题,尚不容易确定。
集群11,由PROCR组成 + 韩元5 − 细胞是唯一一个CKO基因表达模式没有显著变化的细胞簇 Tfap2c型 ,表明集群11代表处于发育层次顶部的多能干细胞胚胎群体; 我们还证实了PROCR中的表达模式 + 细胞簇与下面描述的特征曲线相匹配 Wang等人。 (2015) ( 图S2 ). 簇11中AP-2γ靶基因的表达缺乏变化与PROCR的假设一致 + 簇11中的细胞先于 Krt5(Krt5) 因此有一个完整的 Tfap2c型 基因。 其他研究人员已确定PROCR + 乳腺上皮细胞群,尽管他们没有得出结论,该人群代表MRU( Bach等人。, 2017 ). 伪时间分析表明,PROCR + 细胞导致集群4,其中可能包括KRT5 + MaSC( 图6 和 第9部分 ). 数据表明,在4OHT脉冲后,PROCR + 细胞产生KRT5 + 完整的MaSC Tfap2c型 该基因具有多潜能,可在16周内实现正常的乳腺形态发生。
一些已知的调节乳腺发育的基因被CKO改变 Tfap2c型 .小鼠缺乏 增强子结合蛋白 显示乳腺形态发生中断,导管生长减少,二次分支减少,妊娠期间分泌细胞丢失( Robinson等人。, 1998 ; Seagroves等人。, 1998 ). C/EBPβ缺陷小鼠也缺乏β-酪蛋白的表达,此外 增强子结合蛋白 在几个集群中受到压制 Csn2型 管腔簇0、7和8中编码β-酪蛋白的基因(CKO为 Tfap2c型 ( 表S2 ). IκBα由 Nfkbia公司 该基因是核因子κB(NF-κB)转录因子的主要抑制剂( Henkel等人。, 1993 ). 当移植到同基因动物体内时,缺乏IκBα的乳腺上皮细胞会增加导管外侧分支和导管内增生( Brantley等人。, 2001 ). 的CKO Tfap2c型 增加的表达 Nfkbia公司 在几个基础簇中,这与AP-2γ的缺失通过抑制NF-κB抑制导管生长一致。 损失 Rspo1号机组 表达导致妊娠期间乳腺无侧支和肺泡发育缺失( Chadi等人。, 2009 )和的CKO Tfap2c型 导致镇压 Rspo1号机组 在几个管腔上皮细胞簇中的表达。 综上所述,我们的研究结果表明,AP-2γ的缺失导致乳腺分支和正常肺泡发育受到抑制,至少部分是通过调节 增强子结合蛋白 , Nfkbia公司 ,以及 Rspo1号机组 .
总之,AP-2γ在青春期前乳腺导管的生长中起着重要作用。 我们假设AP-2γ的缺失减少了功能性MaSC的数量,并显著抑制了MaSC再生乳腺结构的能力。 AP-2γ调节乳腺发育所必需的几个基因的表达,包括 增强子结合蛋白 , Nfkbia公司 ,以及 Rspo1号机组 所述模型系统将进一步检查AP-2γ在乳腺发育和哺乳的其他阶段的影响。
实验程序 老鼠 所有动物研究均符合机构动物护理和使用委员会(IACUC)办公室制定的指南,并经IACUC批准进行。 FVB/NJ和KRT5-Cre-ER T2段 (FVB.Cg-Tg)( Krt5-cre/ER公司 T2段 )2Ipc/JeldJ)小鼠购自Jackson实验室(库存编号001800和018394)。 这个 Tfap2c型 飞行/飞行 我 小鼠菌株如前所述( Auman等人。, 2002 )在FVB/NJ背景下回交15代以上,以限制遗传变异。 敲除小鼠是通过杂交产生的 Tfap2c型 飞行/飞行 具有 Krt5-Cre-ER公司 T2段 小鼠,后代与 Tfap2c型 飞行/飞行 生成FVB/ Tfap2c型 飞行/飞行 /Krt5-Cre-ER公司 T2段 。从4周龄开始,以30 mg/kg/天的剂量腹腔注射4OHT,持续5天。 所有实验分析均在雌性小鼠中进行。 基因型分析采用Transnetyx(Cordova,TN)对尾部DNA进行qPCR分析。
乳腺细胞制备、标记和流式细胞术 经一氧化碳(媒剂)治疗和4OHT治疗的8至9周龄处女胎仔雌性FVB的乳腺/ Tfap2c型 飞行/飞行 /Krt5-Cre-ER公司 T2段 在37°C下,将小鼠在温和胶原酶/透明质酸酶(STEMCELL,cat.no.07919)与5%胎牛血清(FBS)的混合物中,在完全EpiCult-B(STEMCELL,cat.no.05611)培养基中消化15 h。 红细胞在NH中溶解 4 Cl.细胞悬液在0.25%胰蛋白酶-EDTA中进一步消化1分钟,然后5 U/mL dispase(STEMCELL,cat.no.07913)加上0.1 mg/mL DNase I(STEMCELL,cat.no.07900),消化1分钟后通过40μm细胞过滤器过滤。 在Hank平衡盐溶液中洗涤后,通过台盼蓝评估细胞活力。 如前所述执行单细胞隔离程序( Borcherding等人。, 2015 ). FACS使用FACS Aria(Becton Dickinson)进行。 林先生 – 人口被定义为TER119 – ,CD31 − 和CD45 – 使用FlowJo软件(v.10.1r7,Tree Star)分析FACS数据。 使用了以下抗体:CD31-Biotin(BioLegend,102404,1:250)、TER-119-Boitin(bioLegeng,116204,1:250。
乳腺分支的整体分析 如前所述,收集乳腺,并在第4对乳腺上进行整体坐骑( Plante等人。, 2011 ). 为了分析分支的形态发生,在灯箱上拍摄了全乳腺图像,并测量了从淋巴结到最远TEB的分支距离。 在乳腺移植实验中,测量了分支区域。 所有图像均通过ImageJ进行量化。
免疫组织化学 对来自第四乳腺的福尔马林固定石蜡包埋样本进行免疫组织化学分析。 使用以下抗体进行分析:抗AP-2γ,1:100(圣克鲁斯生物技术公司,编号sc-12762); 抗CRE,1:50(细胞信号技术,编号15036); 抗CK5,1:100(Abcam,ab5235); 和抗CK8/18,1:500(Abcam,ab53280)。 遵循标准方案,使用Vector ABC试剂盒进行扩增。 在奥林巴斯BX-51显微镜上采集了亮场图像。
定量实时RNA分析 使用RNeasy Mini Kit(QIAGEN,目录号74104)从流式细胞术回收的基底细胞和管腔细胞中分离RNA。 使用随机六聚体方法(Thermo Fisher Scientific),通过实时定量PCR将mRNA转化为cDNA。 第2/3外显子的相对表达 Tfap2c型 (TFS,分类号4351372;ID:Mm00493470_g1),第6外显子 Tfap2c型 (TFS,目录号4351372;ID:Mm00493474_m1), 增强子结合蛋白 (TFS,Mm00843434_s1), Lgals7号机组 (TFS,Mm00456135_m1), Rspo1号机组 (TFS,Mm00507077_m1),以及 通讯录2 使用TaqMan引物和ΔΔ C类 t吨 qPCR方法,并使用CO-与4OHT处理的小鼠进行比较。 放大 Gapdh公司 (TFS,目录号4331182;ID:Mm99999915_g1)用作内源性对照。
用于测序的单细胞捕获和文库准备 按照与上述相同的流式细胞术方案,以1:1的比例提交新分选的基底和管腔上皮细胞,以使用制造商推荐的铬(10×基因组学)和Illumina技术进行测序。 将同窝出生的对照乳腺上皮细胞的两个单独提交给10×基因组学。 在两份提交的材料中,将两个经CO处理的MMEC和两个经4OHT处理的小鼠MMEC合并,然后分别提交进行测序。 这导致共有四只经CO处理和四只经4OHT处理的9周龄小鼠用于下游分析。 扩增的cDNA被构建到3′表达文库中,并汇集在150-bp、配对的化学流细胞的不同通道中。 Illumina HiSeq 4000与安捷伦生物分析仪一起使用,平均文库大小在329到432 bp之间。 库的适配器序列长度为124个碱基。 爱荷华大学基因组学部使用Illumina bcl2fastq软件将基本调用转换为FASTQ文件。 每个样本估计捕获3546至5545个细胞,提交测序,每个细胞的平均读数在63842至94776之间。
scRNA-Seq数据处理和质量控制 使用Cell Ranger v.3.0.1和mm10参考基因组(GRCm38.91)绘制转录本。 使用R导入过滤后的基因计数矩阵,并使用Seurat R软件包v.3.1提出的标准工作流程在下游分析之前完成所有样本的质量控制( Butler等人。, 2018 ; Stuart等人。, 2019 ). 所有RNA特征计数<200或线粒体DNA百分比>5%的细胞均被清除。
scRNA-Seq聚类和可视化 使用Seurat完成scRNA-seq数据归一化,以说明每个细胞中相对于总表达值的特征表达测量值,并使用1×10的对数转换数据 4 因子( Butler等人。, 2018 ; Stuart等人。, 2019 ). 在数据集中确定了显示高细胞间变异性的特征子集。 如前所述,使用相互最近邻方法将四个单独的样本组合成一个单一的“集成”修拉对象( Stuart等人。, 2019 ),允许进一步分析,以识别数据集之间的常见单元格类型,并控制样本之间的批处理效应。 进行了线性缩放,并完成了主成分分析计算。 UMAP是使用 RunUmap(运行Umap) 默认设置和主元件输入设置为20的功能( Becht等人。, 2018 ). 这个 查找群集 Seurat函数使用默认的Louvain算法,分辨率为0.5个聚类单元,识别出13个聚类。 的顺序 Cre公司 将转基因连接到mm10参考基因组中,并通过Cell Ranger重新运行所有四个样本。 提取转基因的单细胞表达数据,并将其添加到之前的数据中,以便于可视化,同时保持聚类与公认的mm10参考基因组一致。 使用Wilcoxon秩和检验计算差异基因表达,假计数为0.01,无对数变化阈值或细胞百分比。 使用Bonferroni方法对差异基因表达的p值进行调整,以进行多个假设的比较。
路径分析 使用IPA(德国希尔登QIAGEN)分析来自scRNA-seq量化的差异基因表达结果。 对每个簇分别进行分析,以检查其高度显著上调或下调的基因在CO和4OHT之间的关系。 完成分析时,调整后的p<0.05,对数变化≥和≤0.5,以隔离各簇中KO改变的顶层网络 Tfap2c型 .
细胞周期分析 利用scRNA-seq数据计算CO和4OHT处理小鼠在先前生成的整合物体上的细胞周期阶段。 根据之前发布的标记确定分数( Nestorowa等人。, 2016 ). 利用 细胞周期评分 Seurat中关于四个样本的集成元数据的函数,S和G2/M分数被存储在对象元数据中,以及基于先前发布的标记将每个细胞分类为G2M、S和G1期。 通过使用ggplot2 R包v.3.2.1创建频率表和图形,可以可视化基于集群的细胞周期分布。
哺乳动物试验 从CO和4OHT处理的FVB中新分类的基础MMEC/ Tfap2c型 飞行/飞行 / Krt5-CreER公司 T2段 以4000个细胞/孔、8000个活细胞/毫升的密度将母鼠对照小鼠培养在低附着板上,置于补充有EpiCult-B增殖补充剂、10 ng/mL表皮生长因子、10 ng/毫升成纤维细胞生长因子β、4μg/mL、10%FBS、, 和50μg/mL庆大霉素在37°C的低氧培养箱中培养14天( Dong等人。, 2013 ; Shaw等人。, 2012 ). 上述分拣一式三份。 在这两种情况下,每种情况下大约有48000个BC被分类,这使得总共有12个井被电镀。 第21天,通过引入胰蛋白酶和通过20G注射针轻轻抽吸机械破坏初级乳房,生成次级乳房。 同样,每种条件下采集48000个细胞,将每种条件的12个重复细胞接种在低粘附性平板上。 二次乳房球在37°C的低氧培养箱中培养14天。 对乳房进行盲法分析和数据收集,以治疗乳房。 所有用于对比分析的图像均在第14天拍摄。 通过ImageJ软件,利用最小直径40μm和3D结构证据来评估乳房球总数,以区分单个基底细胞、细胞聚集物和其他碎片。乳房球形成效率由每层基底上皮细胞形成的乳房球百分比决定。 在乳腺腺病毒检测中,从 Tfap2c型 飞行/飞行 对MMEC进行初步分类后,立即用腺病毒转导。 第二天,所有的BCs被重新接种,在过滤单个细胞后,通过FACS对腺病毒-GFP和GFP标记的Cre重组酶进行筛选,以检测GFP阳性。 如前所述,将这些细胞放置在非粘附板中,并在14天时评估其是否形成乳房球。
腺病毒转导 增强型腺病毒-GFP(Ad5CMVeGFP)和增强型GFP标记的CRE重组酶腺病毒(Ad5CMVCre-eGFP)均购自爱荷华大学病毒载体核心(爱荷华州爱荷华市),病毒滴度为5×10 10 每毫升斑块形成单位。Ad5CMVeGFP通过CMV启动子表达增强的GFP,Ad5CMVCre-eGFP在IRES序列的下游具有GFP。 所有转导均在无血清Opti-MEM中以200的感染倍数进行1小时。所有下游腺病毒实验均以一式三份的方式进行,其中MMEC是从细胞分选中获得的,如前所述。
小鼠乳腺移植 对3周龄的FVB/NJ受体雌性处女进行麻醉,将右第四乳腺的脂肪垫清除至淋巴结,组织学证实乳腺完全切除。 在一组实验中,1-mm 三 乳腺切片取自9周龄FVB/ Tfap2c型 飞行/飞行 / Krt5-Cre-ER公司 T2段 之前用4OHT或CO治疗4至5周后有条件地敲除的小鼠 Tfap2c型 ,然后按照上述相同的清除方法移植到清除的脂肪垫中。 在另一个一致的实验中,从FVB中获得新鲜的FACS分类MMEC/ Tfap2c型 飞行/飞行 小鼠乳腺,用Ad5CMVeGFP或Ad5CMVCre eGFP和9000–10000 GFP转导 + 将MMEC移植到受体小鼠新清除的脂肪垫中。 8周后,由盲法研究者收集移植乳腺进行整体染色和分析。
伪时间分析 Slingshot用于推断和验证细胞谱系( Street等人。, 2018 ). Slingshot对象是使用先前生成的集成scRNA对象生成的。 伪时间推断的tSNE图是使用dims=20、max_iter=2000、seed.use=2和其余默认设置生成的。 集群按照之前的Seurat集群标记进行标记,以确保一致性,Slingshot使用的tSNE标识符运行 缩小尺寸 ,start.clus设置为集群11,最大迭代次数设置为20。 使用 Sling伪时间 功能。 使用p-Creode对先前生成的Seurat综合目标进行无监督轨迹分析( Herring等人。, 2018 ). 根据程序建议使用默认参数,并显示n=200次运行的典型轨迹。 为了一致性,从p-Creode推断轨迹的节点根据之前指定的Seurat簇颜色进行着色。
统计分析 对于分支和免疫组化数据的整体分析,对于非正态分布的小样本,使用非参数Mann-Whitney U检验评估统计显著性。 对于乳腺移植实验,进行了Mann-Whitney U检验和Fisher精确检验。 p值小于0.05被认为是显著的。 由于哺乳动物数量和大小是连续的未配对数据,因此使用Student t检验进行分析。 由于每个集群中的细胞计数在CO或4OHT处理下都是可分类的,因此使用裂方检验来确定Seurat的scRNA-seq集群细胞点之间的显著性。 所有scRNA-seq统计分析均在R版本3.6.0中进行。 所有剩余的统计分析均在GraphPad Prism v.8.0.1中进行。
作者贡献 概念化、V.W.G.、E.C.、T.W.、W.Z.和R.J.W。; 方法论、V.W.G.、E.C.、D.T.T.、T.W.、W.Z.和R.J.W。; 软件、E.C.、D.T.T.、N.B.和M.V.K。; 验证、V.W.G.、E.C.、D.T.T.、V.C.C.、N.B.、K.E.K.、V.T.W.、A.W.L.、D.M.V.D.H.、J.R.W.和M.V.K。; 形式分析、V.W.G.、E.C.、D.T.T.、V.C.C.、N.B.、V.T.W.、A.W.L.和M.V.K。; 调查,V.W.G.、E.C.、D.T.T.、V.C.C.、K.E.K.、V.T.W.、A.W.L.、D.M.V.D.H.和J.R.W。; 资源、V.W.G.、E.C.、D.T.T.和K.E.K。; 数据处理、E.C.、D.T.T.、N.B.和M.V.K。; 写作——原稿,V.W.G.和R.J.W。; 写作——评论与编辑、V.W.G.、E.C.、D.T.T.、V.C.C.、N.B.、K.E.K.、V.T.W.、A.W.L.、D.M.V.D.H.、J.R.W.、M.V.K.、T.W.,W.Z.和R.J.W。; 可视化、V.W.G.、E.C.、D.T.T.和K.E.K。; 监督、V.W.G.、W.Z.和R.J.W。; 项目管理,W.Z.和R.J.W。; 资金收购,T.W.、W.Z.和R.J.W。
致谢 这项工作得到了NIH拨款R01CA183702(PI:R.J.W.)、CA200673(PI:W.Z.)、CA 203834(PI:W-Z.)T32CA14862(P.I.:R.J.W)、DOD/CDMRP拨款BC180227(PI:W/Z.)以及克里斯汀·奥利文乳汁乳腺癌研究基金会(给R.J.W.Kristen Olewine Milke Breast Cancer Research Fund)、J.D.和吉尔·托雷森(给R.JW.)以及博士和夫人的慷慨捐赠。 詹姆斯·罗伯特·斯宾塞家族癌症研究基金(W.Z)。 国家卫生研究院拨款T32CA148062支持E.C.、D.T.T.、K.E.K.、V.T.W.、A.W.L.和D.M.V.D.H。 N.B.得到了F30奖学金CA206255的支持。
参与者信息 Weizhou Zhang,电子邮件: zhangw@ufl.edu。
Ronald J.Weigel,电子邮件: ronald-weigel@uiowa.edu。
工具书类
Auman H.J.、Nottoli T.、Lakiza O.、Winger Q.、Donaldson S.、Williams T.转录因子AP-2gamma在胚胎外谱系中对早期植入后发育至关重要。 发展。 2002; 129:2733–2747. doi:10.1242/dev.129.11.2733。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Bach K.、Pensa S.、Grzelak M.、Hadfield J.、Adams D.J.、Marioni J.C.、Khaled W.T.通过单细胞RNA测序揭示的乳腺上皮细胞分化动力学。 国家公社。 2017; 8:2128. doi:10.1038/s41467-017-02001-5。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Ball S.M.青春期前小鼠乳腺中末端芽的发育。 阿纳特。 1998年记录; 250:459–464. doi:10.1002/(SICI)1097-0185(199804)250:4<459::AID-AR9>3.0.CO; 2-S型。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Becht E.、McInnes L.、Healy J.、Dutertre C.A.、Kwok I.W.H.、Ng L.G.、Ginhoux F.、Newell E.W.使用UMAP可视化单细胞数据的降维。 自然生物技术。 2018; 3网址:10.1038/nbt.4314。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Bogachek M.V、Park J.M.、De Andrade J.P.、Lorenzen A.W.、Kulak M.V.、White J.R.、Gu V.W.、Wu V.T.、Weigel R.J.抑制SUMO途径抑制乳腺癌和结直肠癌中的癌干细胞群。 干细胞报告。 2016; 7:1140–1151. doi:10.1016/j.stemcr.2016.11.001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Borcherding N.,Bormann N.、Kusner D.、Kolb R.、Zhang W.ErbB2驱动的乳腺癌中基底和管腔肿瘤起始细胞的转录组分析。 基因组数据。 2015; 4:119–122。 doi:10.1016/j.gdata.2015.04.008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Brantley D.M.、Chen C.L.、Muraoka R.S.、Bushdide P.B.、Bradberry J.L.、Kittrell F.、Medina D.、Matrisian L.M.、Kerr L.D.、Yull F.E.核因子-κB(NF-kappaB)调节小鼠乳腺上皮的增殖和分支。 分子生物学。 单元格。 2001; 12:1445–1455. doi:10.1091/mbc.12.5.1445。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Butler A.、Hoffman P.、Smibert P.、Papalexi E.、Satija R.整合不同条件、技术和物种的单细胞转录组数据。 自然生物技术。 2018; 36:411–420. doi:10.1038/nbt.4096。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Chadi S.、Buscara L.、Pechoux C.、Costa J.、Laubier J.、Chaboissier M.C.、Pailhoux E.、Vilotte J.L.、Chanat E.、Le Provost F.R-Spondin1是乳腺发育期间正常上皮形态发生所必需的。 生物化学。 生物物理学。 Res.Commun公司。 2009; 390:1040–1043. doi:10.1016/j.bbrc.2009.10.104。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Cyr A.R.、Kulak M.V.、Park J.M.、Bogachek M.V、Spanheimer P.M.、Woodfield G.W.、White-Baer L.S.、O'Malley Y.Q.、Sugg S.L.、Olivier A.K.TFAP2C控制着乳腺发育和致癌过程中的腔上皮表型。 致癌物。 2015; 34:436–444. doi:10.1038/onc.2013.569。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Deome K.B.、Faulkin L.J.、Jr.、Bern H.A.、Blair P.B.将增生性肺泡结节移植到雌性C3H小鼠的无腺体乳腺脂肪垫中形成乳腺肿瘤。 1959年癌症研究; 19:515–520. [ 公共医学 ] [ 谷歌学者 ]
Dong Q.,Wang D.,Bandyopadhyay A.,Gao H.,Gorena K.M.,Hildreth K.,Rebel V.I.,Walter C.A.,Huang C.,Sun L.Z.来自小鼠乳腺干细胞丰富的基底细胞的哺乳动物:克隆特征和重新繁殖潜力。 2013年干细胞研究; 10:396–404. doi:10.1016/j.scr.2013.01.007。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Fu N.、Nolan E.、Lindeman G.J.、Visvader J.E.干细胞与乳腺发育中的分化层次。 生理学。 2019年修订版; 100:489–523. doi:10.1152/physrev.00040.2018。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Giraddi R.R.、Chung C.Y.、Heinz R.E.、Balcioglu O.、Novotny M.、Trejo C.L.、Dravis C.、Hagos B.M.、Mehrabad E.M.、Rodewald L.W.单细胞转录体区分乳腺早期发育中的干细胞状态变化和谱系规范程序。 细胞代表2018; 24:1653–1666 e1657。 doi:10.1016/j.celrep.2018.07.025。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Henkel T.、Machleidt T.、Alkalay I.、Kronke M.、Ben-Neriah Y.、Baeuerle P.A.IκB-α的快速蛋白水解是激活转录因子NF-κB的必要条件。自然。 1993; 365:182–185. doi:10.1038/365182a0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Herring C.A.、Banerjee A.、McKinley E.T.、Simmons A.J.、Ping J.、Roland J.T.、Franklin J.L.、Liu Q.、Gerdes M.J.、Coffey R.J.对单细胞RNA-seq和成像数据的非监督轨迹分析揭示了肠道中的替代簇状细胞起源。 细胞系统。 2018; 6:37–51 e39。 doi:10.1016/j.cels.2017.10.012。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Hilger-Eversheim K.、Moser M.、Schorle H.和Buettner R.。AP-2转录因子在脊椎动物发育、凋亡和细胞周期控制中的调节作用。 基因。 2000; 260:1–12. doi:10.1016/s0378-1119(00)00454-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Indra A.K.、Warot X.、Brocard J.、Bornert J.M.、Xiao J.H.、Chambon P.、Metzger D.表皮基底层的时间控制定点突变:三苯氧胺诱导的Cre-ER(T)和Cre-ER。 1999年《核酸研究》; 27:4324–4327. doi:10.1093/nar/27.22.4324。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Jager R.、Schafer S.、Hau-Liersch M.、Schorle H.转录因子AP-2gamma/TFAP2C缺失会损害小鼠乳腺的分支形态发生。 开发动态。 2010; 239:1027–1033. doi:10.1002/dvdy.22239。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Jager R.、Werling U.、Rimpf S.、Jacob A.、Schorle H.转录因子AP-2gamma在转基因模型中刺激增殖和凋亡并损害分化。 2003年Mol.Cancer Res.2003; 1:921–929. [ 公共医学 ] [ 谷歌学者 ]
Jamieson P.R.、Dekkers J.F.、Rios A.C.、Fu N.Y.、Lindeman G.J.、Visvader J.E.研究组织动力学的健壮小鼠乳腺类器官系统的衍生。 发展。 2017; 144:1065–1071. doi:10.1242/dev.145045。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Lee E.、Piranlioglu R.、Wicha M.S.、Korkaya H.乳腺发育过程中乳腺干细胞亚群的可塑性和效力。 国际分子科学杂志。 2019; 20:2357. doi:10.3390/ijms20092357。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Lilja A.M.、Rodilla V.、Huyghe M.、Hannezo E.、Landragin C.、Renaud O.、Leroy O.、Rulands S.、Simons B.D.、Fre S.对Notch1表达细胞的克隆分析揭示了胚胎乳腺中存在保持长期可塑性的单能干细胞。 国家委员会。 生物年鉴2018; 20:677–687. doi:10.1038/s41556-018-0108-1。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Morris J.S.,Stein T.青春期导管形态发生:末端芽的分离和转录组分析。 方法分子生物学。 2017; 1501:131–148. doi:10.1007/978-14939-6475-8_5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Nestorowa S.、Hamey F.K.、Pijuan Sala B.、Diamanti E.、Shepherd M.、Laurenti E.、Wilson N.K.、Kent D.G.、Gottgens B.小鼠造血干细胞和祖细胞分化的单细胞分辨率图。 鲜血。 2016; 128:e20–e31。 doi:10.1182/bloud-2016-05-716480。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Pal B.,Chen Y.,Vaillant F.,Jamieson P.,Gordon L.,Rios A.C.,Wilcox S.,Fu N.,Liu K.H.,Jackling F.C.通过单细胞RNA图谱构建小鼠乳腺发育谱系关系。 国家公社。 2017; 8:1627. doi:10.1038/s41467-017-01560-x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Plante I.,Stewart M.K.,Laird D.W.小鼠模型中乳腺发育和功能的评估。 视觉杂志。 2011年到期; 21:2828. doi:10.3791/2828。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Post Y.,Clevers H.最简单地定义成人干细胞功能:通过有丝分裂替换丢失细胞的能力。 细胞干细胞。 2019; 25:174–183. doi:10.1016/j.tem.2019.07.002。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Rios A.C.、Fu N.Y.、Cursons J.、Lindeman G.J.、Visvader J.E.乳腺血统追踪的复杂性和注意事项。 2016年乳腺癌研究; 18:116. doi:10.1186/s13058-016-0774-5。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Rios A.C.、Fu N.Y.、Lindeman G.J.、Visvader J.E.乳腺中双功能干细胞的原位鉴定。 自然。 2014; 506:322–327. doi:10.1038/nature12948。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Robinson G.W.、Johnson P.F.、Hennighausen L.、Sterneck E.。C/EBPbeta转录因子调节乳腺上皮细胞增殖和分化。 基因开发1998; 12:1907–1916. doi:10.1101/gad.12.12.1907。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Scheele C.L.、Hannezo E.、Muraro M.J.、Zomer A.、Langedijk N.S.、van Oudenaarden A.、Simons B.D.、van Rheenen J.分支形态发生期间乳腺干细胞的特性和动力学。 自然。 2017; 542:313–317. doi:10.1038/nature21046。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Seagroves T.N.、Krnacik S.、Raught B.、Gay J.、Burgess-Beusse B.、Darlington G.J.、Rosen J.M.C/EBPbeta,但不是C/EBPalpha,对小鼠乳腺导管形态发生、小叶肺泡增殖和功能分化至关重要。 基因开发1998; 12:1917–1928. doi:10.1101/gad.12.12.1917。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Shackleton M.、Vaillant F.、Simpson K.J.、Stingl J.、Smyth G.K.、Asselin-Labat M.L.、Wu L.、Lindeman G.J.、Visvader J.E.从单个干细胞生成功能性乳腺。 自然。 2006; 439:84–88. doi:10.1038/nature04372。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Shaw F.L.、Harrison H.、Spence K.、Ablett M.P.、Simoes B.M.、Farnie G.、Clarke R.B.乳腺干细胞活性定量的详细乳腺检测协议。 《乳腺生物学杂志》。 肿瘤。 2012; 17:111–117. doi:10.1007/s10911-012-9255-3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Silberstein G.B.产后乳腺形态发生。 微型计算机。 Res.Tech.2001; 52:155–162. doi:10.1002/1097-0029(20010115)52:2<155::AID-JEMT1001>3.0.CO; 2页。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Stingl J.、Eirew P.、Ricketson I.、Shackleton M.、Vaillant F.、Choi D.、Li H.I.、Eaves C.J.乳腺上皮干细胞的纯化和独特特性。 自然。 2006; 439:993–997. doi:10.1038/nature04496。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Street K.、Risso D.、Fletcher R.B.、Das D.、Ngai J.、Yosef N.、Purdom E.、Dudoit S.Slingshot:单细胞转录组学的细胞谱系和假时间推断。 BMC基因组学。 2018; 19:477. doi:10.1186/s12864-018-4772-0。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Stuart T.、Butler A.、Hoffman P.、Hafemeister C.、Papalexi E.、Mauck W.M.、3rd、Hao Y.、Stoeckius M.、Smibert P.、Satija R.单细胞数据的综合集成。 单元格。 2019; 177:1888–1902 e1821。 doi:10.1016/j.cell.2019.05.031。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Sun H.、Miao Z.、Zhang X.、Chan U.I.、Su S.M.、Guo S.、Wong C.K.H.、Xu X.、Deng C.X.单细胞RNA-seq揭示了小鼠乳腺上皮细胞的异质性和层次性。 生物学杂志。 化学。 2018; 293:8315–8329. doi:10.1074/jbc。 RA118.002297。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Van Keymeulen A.、Rocha A.S.、Ousset M.、Beck B.、Bouvencourt G.、Rock J.、Sharma N.、Dekoninck S.、Blanpain C.不同的干细胞有助于乳腺的发育和维持。 自然。 2011; 479:189–193. doi:10.1038/nature10573。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Visvader J.E.、Stingl J.乳腺干细胞和分化层次:现状和展望。 基因开发2014; 28:1143–1158. doi:10.1101/gad.242511.114。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
王丹、蔡C.、董欣、于庆春、张晓欧、杨磊、曾玉安。通过蛋白C受体表达鉴定多能干细胞。 自然。 2015; 517:81–84. doi:10.1038/nature13851。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Williams J.M.、Daniel C.W.《乳腺导管延伸:分支形态发生期间肌上皮和基底膜的分化》。 开发生物学。 1983; 97:274–290. doi:10.1016/0012-1606(83)90086-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Winger Q.,Huang J.,Auman H.J.,Lewandoski M.,Williams T.小鼠植入前发育期间转录因子AP-2表达和功能的分析。 生物再现。 2006; 75:324–333. doi:10.1095/biolreprod.106.052407。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Wuidart A.、Ousset M.、Rulands S.、Simons B.D.、Van Keymeulen A.、Blanpain C.解决组织特异性干细胞多向分化的定量谱系追踪策略。 基因开发2016; 30:1261–1277。 doi:10.1101/gad.280057.116。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Wuidart A.、Sifrim A.、Fioramonti M.、Matsumura S.、Brisebarre A.、Brown D.、Centonze A.、Dannau A.、Dubois C.、Van Keymeulen A.多能胚胎乳腺祖细胞的早期谱系分离。 国家委员会。 生物年鉴2018; 20:666–676。 doi:10.1038/s41556-018-0095-2。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Zhang J.,Brewer S.,Huang J.,Williams T.转录因子AP-2alpha的过度表达抑制乳腺生长和形态发生。 开发生物。 2003; 256:127–145. doi:10.1016/s0012-1606(02)00119-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。