摘要 极度还原的氧气(O 2 )该水平不利于肌源性分化和多核肌管的形成,长期暴露于高原缺氧已被报道为骨骼肌萎缩的重要因素。 然而,慢性缺氧如何导致肌肉功能障碍尚不清楚。 在本研究中,我们发现严重缺氧(1%O 2 )显著抑制C2C12细胞(来自成肌细胞系)的功能。 重要的是,即使在常氧条件下培养几代,这种损伤也会持续出现。 从机制上讲,我们揭示了组蛋白脱乙酰化酶9(HDAC9),组蛋白脱乙酸酶家族的一员,在缺氧条件下,在C2C12细胞中显著增加,从而通过直接结合到启动子区域抑制细胞内自噬水平 附件7 , 贝克林1 、和 生命周期3 这种现象导致GSK3β的顺序去磷酸化和典型Wnt通路的失活,损害C2C12细胞的功能。 综上所述,我们的结果表明,低氧诱导的成肌细胞功能障碍是由于自噬的表观遗传调控异常所致,我们的实验证据揭示了慢性缺氧引起的一些肌肉疾病的可能分子发病机制,并提示了潜在的治疗选择。
介绍 慢性高原缺氧可导致缺氧微环境相关疾病患者的肌肉萎缩,如慢性阻塞性肺病(COPD)和动脉硬化闭塞症 1 一些研究报告称,低氧对肌肉再生的抑制作用是一个暂时且可逆的过程 2 ,这似乎延缓了肌源性分化。 相比之下,一些研究表明,慢性缺氧下受损的再生具有长期影响,可能无法充分逆转,并导致肌肉质量下降 三 , 4 ; 然而,其潜在机制尚不清楚。
肌肉发生是肌肉再生的关键步骤。 此外,成肌细胞是这一过程所必需的,因为它们通过相互成功分化和融合,再生出特征性的多核肌纤维; 它们在维持肌肉结构和质量方面也起着重要作用 5 一些研究表明,1%O 2 抑制C2C12(来自成肌细胞系)的肌源性分化 2 , 6 ,而3-6%O 2 水平可以促进肌生成 7 先前的研究报道,严重缺氧通过抑制成肌细胞中的MyoD或Myogenin,以依赖于 三 或独立于 6 , 8 低氧诱导因子(HIF1α),对低氧信号反应的主要贡献者。 一些研究指出,成肌细胞分化是由缺氧引起的可逆性损伤,因为成肌细胞在恢复正常氧气水平时保持其增殖或分化能力 2 相比之下,其他研究人员认为,慢性缺氧对肌肉的影响是长期的 三 , 4 此外,我们的实验室先前证实,微环境诱导的功能损伤可以通过表观遗传调控的方式传递给子细胞 9 然而,慢性低氧对成肌细胞功能改变的影响及其影响的内在机制在很大程度上尚未探索。
组蛋白上赖氨酸残基的乙酰化是DNA转录表观遗传调控的关键过程 10 组蛋白上赖氨酸残基的乙酰化水平由赖氨酸乙酰转移酶(KATs)/组蛋白乙酰转移酶类(HATs)和组蛋白脱乙酰化酶(HDAC)控制。 在过去的几年里,一些研究表明HDAC对长期低氧诱导的基因转录调控有反应 11 、脂肪细胞功能障碍 12 和疾病发展 13 , 14 重要的是,已经证明组蛋白去乙酰化酶参与肌肉特异性基因和肌肉分化的调节 15 , 16 因此,我们假设缺氧可能通过表观遗传学调节诱导成肌细胞的持续变化,从而导致随后的肌肉功能障碍。
在这项研究中,我们证明了高空缺氧微环境以表观遗传调控的方式损害了C2C12的功能。 从机制上讲,我们揭示了由于缺氧,C2C12中HDAC9显著增加,从而通过直接结合到启动子区域抑制细胞内自噬 附件7 , 贝克林1 、和 LC3型 自噬减少导致GSK3β去磷酸化,随后经典Wnt通路失活,损害C2C12的肌生成。
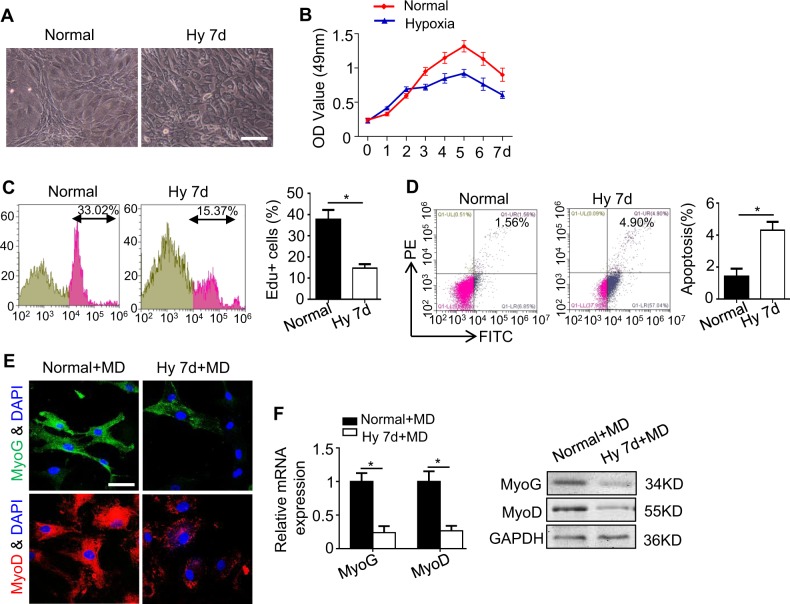
结果 缺氧抑制C2C12细胞的特性 为了研究C2C12的特性,进行了肌发生诱导。 C2C12成功形成肌管,并显示MyoG和MyoD的表达升高(补充图。 1 )如qRT-PCR和western blotting所示。 为了研究缺氧对成肌细胞功能的影响,将C2C12细胞暴露于缺氧(1%O 2 )或保持在标准条件下(21%O 2 ). 缺氧微环境下C2C12的形态基本不变; 然而,细胞质中颗粒数量增加,细胞核明显可见(图。 1a个 ). MTT和Edu分析显示,与对照组相比,缺氧组C2C12的活性和增殖显著降低(图。 1b、c )这表明,尽管缺氧最初促进了C2C12的活性,但在缺氧暴露7天后,其增殖能力最终降低。 此外,流式细胞术检测到缺氧组中凋亡的C2C12数量增加(图。 1天 ).
图1。 缺氧时C2C12细胞的特性显著降低。
C2C12细胞在常压或缺氧微环境下培养7天。 一 使用倒置显微镜观察在这两种条件下生长的C2C12细胞的形态。 比例尺:50μm。 b , c(c) 用MTT法测定两种处理下C2C12细胞的活性和增殖( b )和Edu( c(c) )分析。 d日 流式细胞术检测两个C2C12细胞的凋亡。 e(电子) C2C12细胞在肌源性分化培养基(MD)中在常氧或缺氧微环境下培养7天,并用免疫荧光染色检测MyoG(绿色)/MoD(红色)/细胞核(蓝色)。 比例尺:50μm。 (f) 用qRT-PCR和western blotting检测C2C12细胞的肌源性基因。 数据以代表性实验中一式三份样品的平均值±标准差表示* P(P) < 0.05. c(c) , d日 未配对双尾学生的 吨 -测试。 b , (f) 单因素方差分析
接下来,我们研究了C2C12在常氧和缺氧条件下的肌生成。 缺氧条件下培养7天的C2C12表现出严重的肌生成抑制,如免疫染色减少和MyoG和MyoD表达减少所示(图。 1e、f ),这一发现与以前的报告一致 2 , 17 总的来说,我们的结果表明极低的O 2 水平抑制C2C12的增殖和分化能力,但促进凋亡。
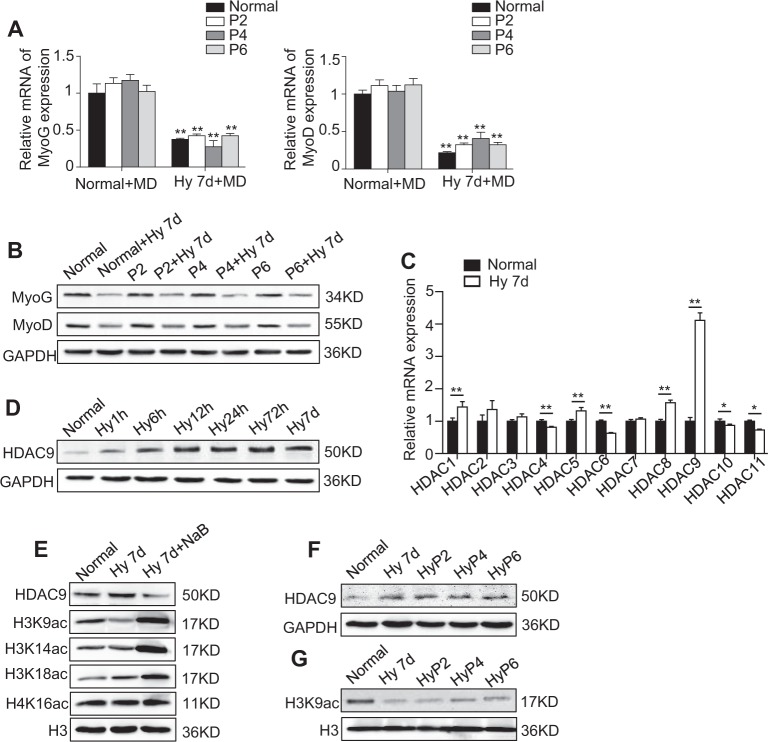
缺氧通过HDAC9抑制C2C12细胞的肌生成 先前的研究已经证实,低氧介导的肌源性分化抑制是可逆的 2 然而,我们观察到缺氧条件下第2、4和6代的C2C12中MyoG和MyoD的表达水平低于常氧条件下C2C12的相同代(C2C12在缺氧和常压条件下培养3天用作第1代;图。 2a个 ). MyoG和MyoD的表达水平与传代时几乎相同,并且低于正常细胞(图。 2亿 ),表明即使当细胞在常氧条件下培养数代时,缺氧介导的对C2C12中肌生成的抑制也是一致的。
图2。 缺氧对C2C12细胞功能受损的影响以表观遗传依赖性的方式发生。
一 , b C2C12细胞分别在正常(P1)和缺氧(Hy)条件下在MD中培养7天,然后在常氧条件下连续传代6次。 通过qRT-PCR分析C2C12细胞第2、4和6代中MyoG和MyoD的表达( 一 )和蛋白质印迹( b ). c(c) C2C12细胞在常氧或缺氧条件下培养7天,组蛋白脱乙酰酶家族的表达( HDAC1-11型 )用qRT-PCR检测。 d日 western blotting检测缺氧刺激后不同时间点C2C12细胞中HDAC9的表达水平。 e(电子) 显示了C2C12细胞中HDAC9和众所周知的组蛋白靶点在常氧或缺氧条件下的表达水平,包括NaB治疗或不治疗(NaB剂量为200μM)。 (f) , 克 western blotting检测C2C12细胞不同传代(正常、Hy7d、HyP2、HyP4和HyP6)中HDAC9和H3K9ac的表达水平。 数据表示为代表性实验中三份样品的平均值±标准差* P(P) < 0.05, ** P(P) < 0.01. 单向方差分析(ANOVA)
越来越多的证据表明,微环境通过乙酰化改变组蛋白的转录后修饰 18 – 20 从而影响细胞的功能 12 因此,我们比较了在常氧条件下培养的C2C12和在低氧条件下培育的C2C12HDAC家族的表达模式。 结果表明,缺氧1h、24h和7d后,HDAC1、2、8和9的表达水平持续升高。 尤其是,与正常对照细胞相比,缺氧暴露的C2C12中HDAC9的表达增加了近5倍(图。 2厘米 ,补充图。 2 ). 接下来,我们重点研究了HDAC9,并检测了缺氧条件下不同时间点HDAC9的表达水平。 Western blotting分析表明,低氧条件下HDAC9水平显著升高,并且这种影响在不同的传代中也很明显(图。 二维,f ). 由于缺氧通常通过缺氧诱导因子(HIF)影响细胞特性 三 , 21 ,我们还检测了缺氧条件下不同时间点细胞中HIF1α和HIF2α的表达水平。 Western blotting分析表明,缺氧1h后HIF1α略有增加,缺氧72h后持续下降,几乎消失,HIF2α的表达模式与缺氧的不同时间点无关(补充图。 三 ). 这些结果表明,C2C12中HDAC9的增加与HIF没有密切关系; 因此,我们没有在其他实验中研究这些因素。
已发现HDAC9更喜欢组蛋白H3的赖氨酸9、赖氨酸14和赖氨酸18 22 乙酰化以调节基因功能; 因此,我们在阻断HDAC9的表达后检测组蛋白3和4的乙酰化位点。 结果表明,与曲古抑菌素A(TSA)相比,丁酸钠(NaB)在同时抑制HDAC9表达和促进H3K9乙酰化方面有很强的作用(补充图。 4 ). 赖氨酸残基H3K9的表达模式与上调的HDAC9相反。 此外,H3K9在低氧-C2C12的不同代次中也被低乙酰化(超过2倍),尽管HDAC9水平增强(图。 2e–克 ),表明低氧诱导的HDAC9升高导致组蛋白H3赖氨酸残基9处的组蛋白去乙酰化。
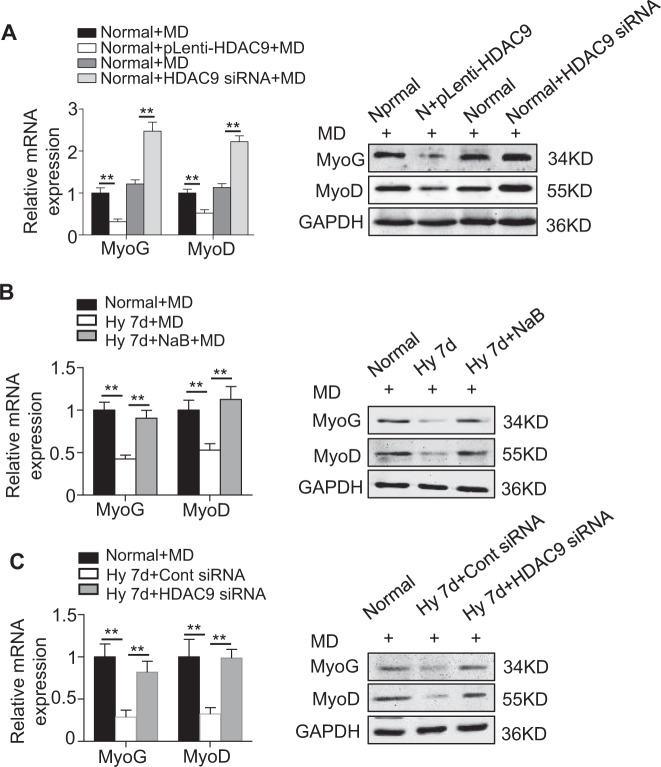
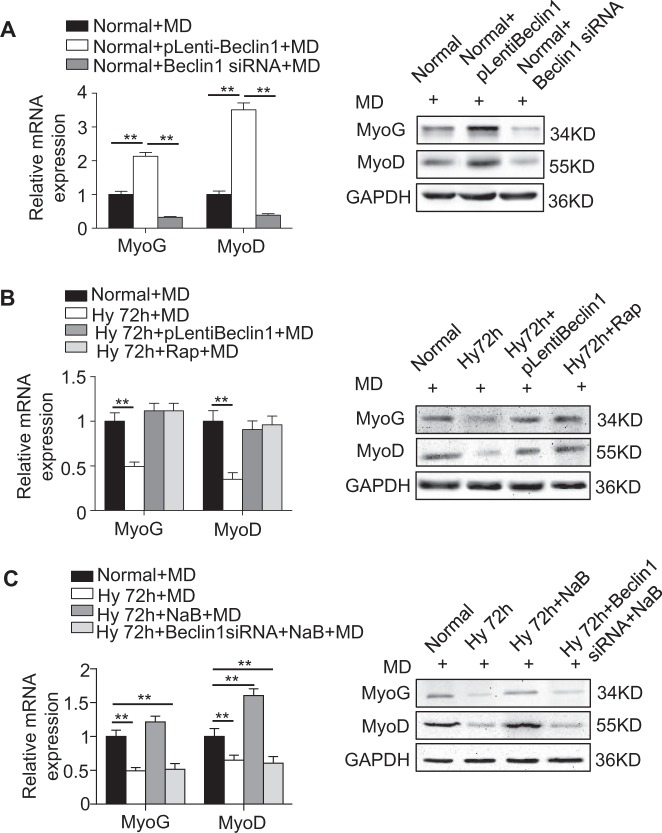
HDAC9的抑制可挽救缺氧诱导的肌生成障碍 在正常氧条件下培养的C2C12中HDAC9的过度表达显著损害了其肌发生。 相反,如MyoG和MyoD表达所证实的,在正常氧条件下培养的C2C12中HDAC9表达的抑制部分增强了其肌发生(补充图。 5 ,图。 3a年 ). 这些数据表明,HDAC9调节C2C12的肌发生。 接下来,我们研究了下调HDAC9对缺氧培养的C2C12功能恢复的治疗作用。 我们观察到,NaB成功地挽救了缺氧诱导的MyoG和MyoD表达水平的降低,这表明治疗效果可能是由缺氧诱导的HDAC家族表达受到抑制引起的(图。 3亿 ).
图3。
抑制剂或siRNA下调HDAC9的表达可以缓解缺氧对C2C12细胞肌生成的抑制作用。 一 描述了通过慢病毒载体在C2C12细胞中调节HDAC9表达。 肌原性诱导后第7天用qRT-PCR和western blotting检测MyoG和MyoD的表达。 b , c(c) 为了观察HDAC9对C2C12细胞肌生成的影响,用HDAC抑制剂丁酸钠(NaB)处理C2C12的细胞( b )或使用HDAC9 siRNA( c(c) ). 肌原性诱导7天后,用qRT-PCR和western blotting检测C2C12细胞中MyoG和MyoD的表达水平。 数据表示为代表性实验中三份样品的平均值±标准差* P(P) < 0.05, ** P(P) < 0.01. 单向方差分析(ANOVA)
鉴于HDAC9直接调节C2C12的肌生成,NaB是一种广谱HDAC抑制剂,我们接下来专门下调缺氧培养C2C12中的HDAC9水平。 正如预期的那样,在特异性下调HDAC9后,低氧诱导的MyoG和MyoD表达水平的降低也得到了缓解(图。 3厘米 ). 总之,这些数据表明,缺氧诱导的C2C12肌发生抑制可能是由于HDAC9水平升高,而HDAC9的下调成功地挽救了缺氧损伤的C2C12。
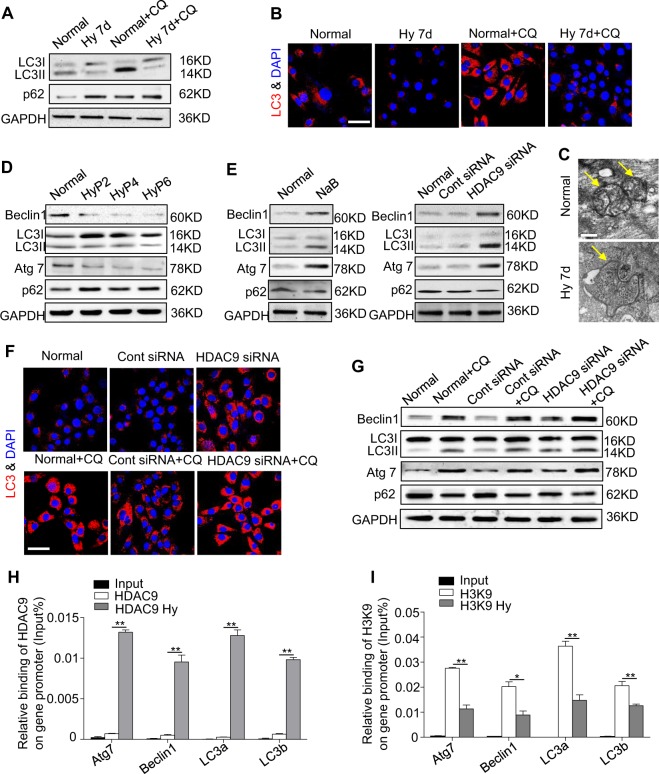
HDAC9通过自噬的表观遗传调控抑制肌生成 在缺氧条件下,自噬是维持细胞功能和体内平衡所必需的 23 – 25 ,我们接下来研究了缺氧对C2C12自噬的影响。 LC3II在正常细胞中表达,缺氧7天后表达降低。 相反,与对照组相比,在上述缺氧条件下,作为自噬降解的特定货物的p62的表达明显增加(图。 4a类 ). 接下来我们应用了自噬抑制剂氯喹(CQ),它可以防止溶酶体降解,从而在自噬活跃时显著增加LC3II的表达 26 CQ实验表明,与常氧培养的细胞相比,缺氧培养的细胞缺乏进一步形成自噬体的能力,如western blotting和免疫染色所示(图。 4a、b ). 此外,正如透射电镜所示,我们在缺氧细胞组中发现的自噬体少于正常氧细胞组(图。 4c类 ). 这些结果表明,细胞长期缺氧后,自噬活性受到抑制。 此外,自噬活性的下降从P2持续到P6,表明HDAC9的作用相反。 因此,缺乏自噬导致缺氧培养的第2代细胞中p62的积累,但在P2和P6之间保持不变(图。 第4天 ,补充图。 6 ). 重要的是,正常C2C12中的自噬被显著激活,并导致在有或无CQ的情况下下调HDAC9的NaB治疗后p62积累减少(图。 4e–克 )如western印迹和免疫染色分析所示。 这些结果表明HDAC9与细胞内自噬可能有密切关系。
图4。 HDAC9表观遗传调节C2C12细胞的自噬水平。
一 采用western blotting方法检测缺氧7天(含或不含氯喹(CQ))后自噬相关蛋白Beclin1、LC3I/II和特异性货物p62的表达水平。 b 将C2C12细胞在常氧或缺氧微环境中培养7天,加入或不加入CQ。用免疫荧光染色法分析C2C12中的LC3(红色)/细胞核(蓝色)。 比例尺:50μm。 c(c) 为了观察自噬体,C2C12细胞在常压或缺氧条件下培养7天,然后用电子显微镜观察。 比例尺:2μm。 d日 western blotting检测C2C12细胞Hyp 2、Hyp 4和Hyp 6中自噬相关蛋白的表达水平。 e(电子) 用NaB和HDAC9 siRNA处理后,通过蛋白质印迹检测自噬相关蛋白的表达水平。 (f) , 克 显示有或无CQ的正常毒性C2C12细胞中HDAC9的下调。 免疫荧光染色分析C2C12细胞的LC3(红色)/细胞核(蓝色),western blotting分析自噬相关基因。 比例尺:50μm。 小时 , 我 从暴露于或未暴露于缺氧的C2C12细胞中分离出染色质,并使用乙酰化组蛋白H3K9(Ac-H3K9)和HDAC9抗体进行染色质免疫沉淀分析。 IgG抗体作为对照。 数据表示为代表性实验中三份样品的平均值±标准差* P(P) < 0.05, ** P(P) < 0.01. 单向方差分析(ANOVA)
为了检测HDAC9是否直接调节自噬相关基因的表达,我们进行了染色质免疫沉淀(ChIP)分析。 结果表明,HDAC9在 附件7 , 贝克林1 , 生命周期3a 、和 LC3b公司 在C2C12中(图。 4小时 )表明HDAC9直接与这些自噬相关基因的启动子结合。 因此,在C2C12中自噬相关基因的启动子处,H3K9也高度富集(图。 第4页 )表明HDAC9表观遗传学调控C2C12的细胞内自噬。
接下来,我们测试了NaB或HDAC9 siRNA的治疗效果是否可以通过调节自噬直接拯救缺氧受损的C2C12。 Beclin1下调后,自噬水平显著降低,然后抑制C2C12的肌源性分化,而Beclin2的过度表达增强了自噬和肌发生,如qRT-PCR和western blotting所示(补充图。 7 ,图。 5a级 ). 然后,我们观察到,通过上调Beclin1或雷帕霉素激活C2C12中的自噬可以挽救缺氧引起的受损肌肉发生(图。 5亿 ,补充图。 8 ). 更重要的是,NaB可以在缺氧后挽救C2C12的肌生成,但这种作用可以被Beclin1的下调所阻断(图。 5厘米 ). 总之,这些结果表明,缺氧主要通过HDAC9介导的表观遗传抑制自噬来减少C2C12的肌生成。 接下来我们评估了自噬调节肌肉发生的机制。
图5。 HDAC9可能通过自噬调节C2C12细胞的肌源性分化。
一 描述了通过慢病毒载体和siRNA对C2C12细胞中Beclin1表达的调节。 用qRT-PCR和western blotting检测肌生成相关基因MyoG和MyoD。 b 通过过度表达Beclin1或Rapamycin(Rap)激活缺氧C2C12细胞的自噬后,通过qRT-PCR和western blotting检测肌生成相关基因MyoG和MyoD。 c(c) C2C12细胞在MD中培养,并在缺氧条件下用NaB或Beclin1 siRNA处理72h。通过qRT-PCR和western blotting检测C2C12电池中的肌生成相关基因MyoG和MyoD。 对照组为常氧C2C12细胞。 数据表示为代表性实验中三份样品的平均值±标准差* P(P) < 0.05, ** P(P) < 0.01. 单向方差分析(ANOVA)
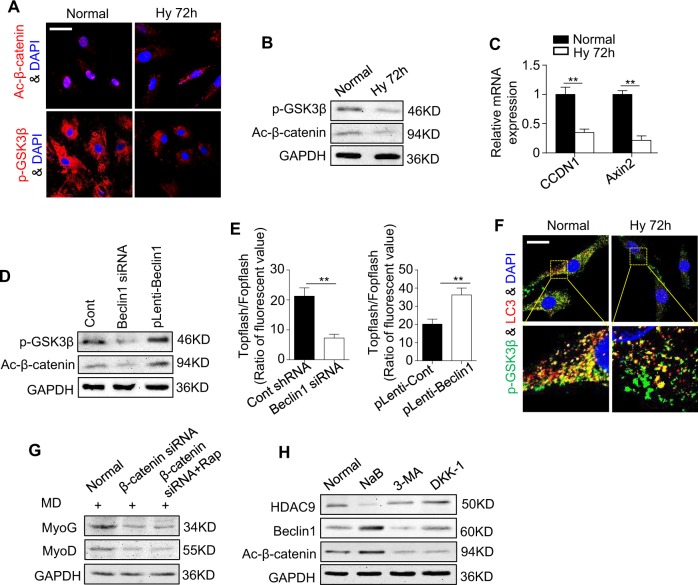
自噬通过激活Wnt/β-catenin通路调节C2C12细胞的肌生成 Wnts代表一类分泌信号蛋白,在各种胚胎和成年组织中调节细胞命运决定、细胞增殖和干细胞活性。 许多强有力的研究报告称,典型Wnt信号传导对调节成肌细胞的肌肉再生和肌生成非常重要 27 , 28 我们还观察到,如免疫染色和western blotting所示,缺氧后磷酸化GSK3β(p-GSK3?)和活化β-连环蛋白(ac-?连环蛋白)的表达水平均降低。 此外 CCND1号机组 和 轴2 mRNA是Wnt/β-catenin途径的下游中间产物,在缺氧C2C12中含量低得多(图。 6a–c类 )表明Wnt/β-catenin通路在缺氧时失活。 更令人信服的是,我们观察到Wnt3a对典型Wnt通路的激活有效地挽救了由缺氧引起的C2C12肌发生受损(补充图。 9 ). 这些数据表明Wnt/β-catenin通路的失活可能有助于缺氧导致C2C12功能受损。
图6。 自噬通过调节典型Wnt通路调节C2C12细胞的肌源性分化。
一 – c(c) 免疫荧光染色检测p-GSK3β和活性-β-catenin的表达水平( 一 )和蛋白质印迹( b )细胞在常氧或缺氧条件下培养72小时后,用qRT-PCR分析典型Wnt通路的下游基因( c(c) ). 比例尺:50μm。 d日 Beclin1下调后,用western blotting检测C2C12细胞中p-GSK3β和活性-β-catenin的表达水平。 e(电子) 转染48小时后通过荧光素酶分析检测典型Wnt通路的激活。 (f) 免疫染色显示,常压缺氧培养72h的C2C12细胞中LC3(红色)和p-GSK3β(绿色)重叠。比例尺:25μm。 克 C2C12细胞在MD中培养并转染对照siRNA或β-catenin siRNA,并使用雷帕霉素激活自噬。 治疗72小时后,用western blotting检测肌生成相关基因。 小时 用NaB、3-MA和DKK-1处理C2C12细胞。 western blotting检测HDAC9、Beclin1和ac-β-catenin的表达水平。 数据表示为代表性实验中三份样品的平均值±标准差* P(P) < 0.05, ** P(P) < 0.01. c(c) 单因素方差分析(ANOVA)。 e(电子) 未配对双尾学生的 吨 -测试
鉴于新出现的研究表明自噬可能有助于调节典型Wnt通路 29 ,我们首先检测慢病毒调节自噬后p-GSK3β和ac-β-catenin的表达。 下调 贝克林1 在常氧C2C12中损害Wnt途径,模仿缺氧C2C12的表型。 相反,恢复 贝克林1 如western blotting和TOPflash分析所证实的,缺氧细胞中的表达重新激活了Wnt途径(图。 第6天,第5天 ). 这些结果表明Wnt通路被激活或失活取决于自噬水平。 更重要的是,我们在常氧和缺氧条件下培养C2C12 72小时,并通过共焦激光扫描显微镜观察p-GSK3β和LC3。 结果表明,LC3在常氧和缺氧条件下均能与p-GSK3β共定位。 值得注意的是,合并后的图像显示,由于p-GSK3β和LC3的表达水平降低,缺氧细胞组中p-GSK3-β和LC3-的共定位降低(图。 第6页 ). 总之,这些结果表明,自噬可能通过磷酸化GSK3β直接调节经典Wnt途径。
然后我们研究了自噬是否通过Wnt/β-catenin途径调节肌源性分化。 结果表明,β-catenin表达下调降低了C2C12的肌生成。 重要的是,β-catenin下调后,雷帕霉素不能恢复被抑制的肌生成(补充图。 10 ,图。 6克 ). 最后,为了确认组蛋白去乙酰化酶、自噬和典型Wnt通路的调控网络,C2C12被NaB、3-MA和DKK-1处理。 值得注意的是,NaB抑制HDAC9的表达并促进其余下游基因的表达,而自噬抑制剂3-MA抑制Beclin1和ac-β-catenin的表达。 此外,典型Wnt途径抑制剂DKK-1仅阻断ac-β-catenin的表达(图。 6小时 ). 总之,这些结果表明,典型的Wnt途径受到HDAC9介导的自噬的下游调控。
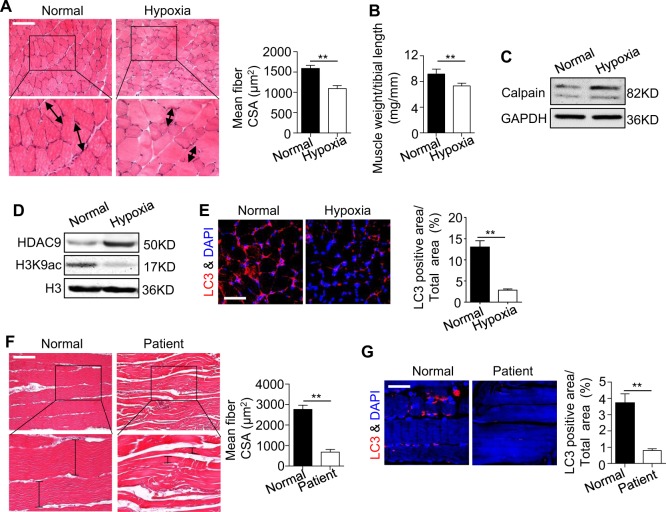
HDAC9表观基因调控的自噬在缺血性肌肉萎缩中也被观察到 为了进一步验证我们在体外进行的研究,我们首先建立了小鼠缺血性肌肉萎缩模型。 对小鼠腓肠肌切片进行组织学检查,以评估慢性缺血缺氧对组织完整性的影响。 结果表明,正常生长的肌纤维大小和形状均匀,细胞核位于外周(图。 第7页 ). 暴露于缺血缺氧21天的小鼠肌肉组织显示肌纤维严重萎缩,纤维大小不规则,纤维之间的间隙更大。 然而,在任何显微照片中均未观察到坏死纤维或细胞分裂(图。 第7页 ). 此外,随着缺血缺氧暴露时间的延长,大鼠腓肠肌重量/胫骨长度的比率显著下降,在缺氧暴露21天期间下降了22%(图。 第7页 ). Calpains是Ca的成员 2+ -活化半胱氨酸蛋白酶在细胞运动、细胞增殖和凋亡中发挥重要作用 30 一些研究表明,钙蛋白酶在萎缩过程中被激活 31 , 32 在我们的研究中,我们观察到缺氧21天后钙蛋白酶的表达水平明显增加(图。 第7页c )表明肌肉在慢性缺血缺氧后萎缩。
图7。 在股动脉结扎模型和动脉硬化闭塞症患者中也观察到HDAC9表观遗传调控的自噬。
我们构建了小鼠单FA结扎模型,并在第21天从对照组和手术组采集样本。 一 苏木精-伊红染色(h&e)用于观察FA结扎模型小鼠腓肠肌组织。 肌肉纤维的定量分析结果如右图所示。 比例尺:200μm。 b , c(c) 肌肉重量/胫骨长度之比( b )和钙蛋白酶表达( c(c) )对照组和结扎组进行分析。 d日 western blotting检测两组HDAC9和H3K9的表达水平。 e(电子) 使用抗LC3(红色)和核染色(蓝色,DAPI)对肌肉样本进行免疫染色,以显示自噬水平。 LC3定量分析结果 + 单元格显示在右侧面板中。 比例尺:100μm。 (f) 显示正常对照组和动脉硬化闭塞症患者的肌肉H&E染色。 量化分析的结果显示在右侧面板中。 比例尺:200μm。 克 免疫组化分析显示LC3(红色)和DAPI(蓝色)在腓肠肌远端的表达。 LC3的量化 + 单元格显示在右侧面板中。 比例尺:100μm。 n个 = 8表示鼠标模型和 n个 = 2个用于患者。 数据表示为代表性实验中三份样品的平均值±标准差* P(P) < 0.05, ** P(P) < 0.01. 未配对双尾学生 吨 -测试
鉴于缺氧暴露后C2C12中HDAC9表达增加,随后通过调节自噬影响细胞功能,我们接下来测试HDAC9是否调节缺血缺氧小鼠模型中的自噬水平。 如western blotting所示,缺血缺氧组HDAC9的表达增加,但H3K9ac的水平降低(图。 7天 ). 正如预期的那样,低氧小鼠模型中的自噬功能显著丧失,LC3水平降低(图。 第7页 )如缺氧培养的C2C12。 更重要的是,在动脉硬化闭塞症引起的慢性肌肉萎缩患者中,我们也观察到同样的肌肉萎缩和自噬水平降低(图。 7f,克 ). 总之,我们的结果表明,缺氧可能通过HDAC9表观遗传调控的自噬抑制肌肉再生(图。 8 ).
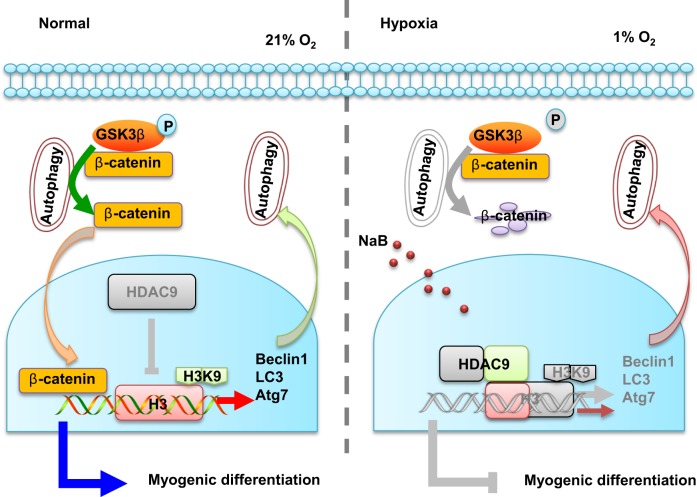
图8。 示意图描述了缺氧如何调节C2C12细胞的肌源性分化和表观遗传学指导的治疗方法。
在有正常氧气的情况下,细胞内自噬控制GSK3β的磷酸化,然后促进β-catenin从细胞质转移到细胞核,从而激活肌生成相关基因的表达。 低氧条件下,缺氧微环境导致HDAC9表达增加,HDAC9脱乙酰化自噬相关基因H3K9并抑制自噬体形成。 自噬不足随后导致GSK3β去磷酸化和典型Wnt通路失活,最终阻止肌源性分化。 NaB治疗可部分缓解缺氧引起的C2C12细胞肌源性分化受损
讨论 低氧对肌生成过程的影响已被广泛研究。 几项研究提供了可靠的数据,表明小于1%的O 2 在体外水平抑制原代成肌细胞和C2C12的增殖和肌生成 2 , 6 , 33 这就提出了一个问题,即长期低氧微环境是否会永久损害肌生成过程。 一些研究表明,成肌细胞分化被缺氧可逆地抑制 2 ,因为当正常的氧气水平恢复时,成肌细胞会恢复成肌能力。 相反,我们的结果表明,当恢复正常氧气时,C2C12在六次传代后对缺氧引起的肌生成的抑制作用持续存在。 我们认为先前研究结果与我们研究结果之间的差异可能是由于培养条件和观察方法不同。 我们之前曾报道,微环境通过表观遗传调控对细胞功能产生长期影响 5 先前的一份报告表明,低氧诱导的胚胎干细胞肌源性分化是通过调节HDAC6介导的 34 另一项研究也表明,缺氧条件下的肌生成与与myoD启动子相关的组蛋白去乙酰化相关 33 , 35 – 37 因此,我们首先筛选了11个HDAC。 结果表明,HDAC9在缺氧反应中显著上调。 应用HDAC9 siRNA或HDACs抑制剂NaB下调HDAC9可恢复缺氧对C2C12肌生成的抑制作用。 因此,我们发现,长期暴露于严重缺氧诱导的肌肉功能障碍或质量损失可能是通过表观遗传学调控引起的,类似于在缺氧诱导的阿尔茨海默病中观察到的 38 , 39 ,肺动脉高压 40 和心脏组织纤维化 41 值得注意的是,我们观察到C2C12的自噬在低氧暴露后首先增强,然后在低氧培养6小时后下降。 然而,暴露于缺氧后,HDAC9的表达持续增加。 因此,我们推断HDAC9可能在长期低氧暴露期间调节自噬。
自噬 24 , 42 是在营养素缺乏期间以及对缺氧、内质网应激和其他应激作出反应时回收细胞物质的主要生存途径,对维持组织内环境稳定至关重要。 重要的是,在肌病和肌营养不良的发病机制中观察到了失调的自噬 43 , 44 最近的一项研究表明,对于短期间歇性低氧诱导的骨骼肌萎缩,自噬显著增强 45 在该研究中,间歇性低氧暴露4天后,肢体肌肉中的LC3II蛋白增加(2.4倍)。 然而,低氧诱导的自噬对成肌细胞分化的影响尚不清楚。 在目前的研究中,我们发现长期暴露于低氧环境会降低C2C12的自噬水平,并且自噬随着细胞传代而受到抑制。 然而,我们注意到,在短期(<6小时)缺氧刺激下,C2C12的自噬水平显著增加,然后随着缺氧时间的延长而逐渐下降(数据未显示)。 这一发现与先前的报告一致,即急性缺氧会增加自噬标记物的表达 45 , 46 有趣的是,我们注意到Beclin1 siRNA对自噬的抑制阻断了NaB在缺氧时拯救C2C12功能的作用。 重要的是,我们确认HDAC9直接与 附件7 , 贝克林1 , 生命周期3a 、和 LC3b公司 在C2C12中。 上述结果表明,自噬是由HDAC9表观遗传调控的,在慢性缺氧微环境中维持C2C12的功能需要自噬。
一些研究表明,Wnt/β-catenin信号传导对肌肉发育和成肌细胞肌源性分化的调节至关重要 47 – 49 如Pax7-阳性肌祖细胞染色所示,小鼠β-catenin的条件性缺失导致肌肉质量减少和肌纤维减少 50 以前的报告已经证明Wnt/β-catenin信号传导对肌肉发生的多个步骤至关重要 28 , 48 , 51 , 52 ,但很少有报道表明肌肉再生过程中不需要Wnt/β-catenin信号 53 在本研究中,我们发现自噬通过调节GSK3β的磷酸化来维持成肌细胞系的功能,GSK3是调节缺氧时β-catenin核转位的重要调节因子。 尽管许多研究人员已经证明GSK3β决定了不同细胞学过程中自噬的激活 54 – 56 ,自噬调节GSK3β磷酸化的研究很少。 最近,一些研究表明,Beclin1 siRNA抑制肾细胞中GSK3β的磷酸化 57 结合我们的研究结果,我们认为自噬直接调节GSK3β的磷酸化,从而激活Wnt/β-连环蛋白通路,这对维持C2C12的肌生成至关重要。
我们的数据表明,表观遗传调控对持续低氧诱导的成肌细胞肌发生抑制作用至关重要,自噬激活是挽救成肌细胞肌性分化的关键步骤,这可能为治疗慢性缺氧引起的肌病提供一种前瞻性策略。 需要进一步的研究来探索自噬如何降解磷酸化的GSK3β。
材料和方法 C2C12细胞系培养及细胞缺氧模型 从中国科学院细胞库(中国上海)获得的永生小鼠C2C12成肌细胞,最初来源于C3H小鼠腿部肌肉,在37°C和5%CO的无涂层6孔板上培养 2 在补充有10%胎牛血清(FBS,GIBCO-BRL)的高糖生长培养基(4.5 g/l d-glucose)DMEM(GIBCO-BREL,马里兰州盖瑟斯堡,美国)中,2 mM 我 -谷氨酰胺(美国马里兰州罗克维尔生命技术公司)和1%青霉素-链霉素(GIBCO-BRL)。 到达汇合处后,在分化培养基(补充2%马血清的DMEM,1 mM)中诱导C2C12成肌细胞 我 -谷氨酰胺、1%青霉素-链霉素)治疗2-3天。
为了建立缺氧培养条件,将C2C12成肌细胞置于缺氧(1%O 2 ,5%一氧化碳 2 ,37°C)培养箱(Galaxy氧气控制培养箱,英国欧文RS Biotech)1、3、6、12、24、72小时和7天。 对照细胞(正常组)在常氧条件下培养同等时间框架(21%O 2 ,5%一氧化碳 2 ,37°C)。
MTT分析 根据制造商的方案(Sigma-Aldrich),使用为期8天的3-(4,5-二甲基噻唑-2yl)-2,5-二苯基四唑溴化铵(MTT)测定在常氧或缺氧条件下培养的C2C12成肌细胞的活性。 使用微孔板阅读器在490 nm处测定吸光度(Bio-Tek Instruments,Winooski,VT,USA)。 实验一式三份。
5-乙炔基-2′-脱氧尿苷分析 根据制造商的说明,使用5-乙炔基-2′-脱氧尿苷(EdU)DNA体外增殖检测试剂盒(RiboBio,中国广州)测定在常氧或缺氧条件下培养的C2C12成肌细胞的增殖。 流式细胞术对这些先前标记有EdU的细胞进行。
细胞凋亡分析 根据制造商的说明,使用凋亡检测试剂盒(BD Pharmingen)测定在常氧或缺氧条件下培养的C2C12成肌细胞的凋亡。 通过检测Annexin-V和碘化丙啶(PI)染色,并将百分比与对照组测定的数字进行比较,流式细胞术分析细胞凋亡,区分存活细胞、死亡细胞、早期凋亡细胞和晚期凋亡细胞。
免疫荧光染色 C2C12细胞在常氧或缺氧条件下培养,直到汇合,然后在分化培养基中维持3天,以促进成肌细胞融合。 然后用4%多聚甲醛在4°C下固定15分钟,用0.2%Triton X-100在PBS中渗透10分钟,用5%正常山羊血清封闭30分钟 对于免疫荧光染色,C2C12细胞与肌球蛋白(R&D系统,1:100,明尼阿波利斯,明尼苏达州,美国,MAB4470)或LC3I/II(细胞信号,1:100和12741)一级抗体在4°C下孵育过夜。 随后,根据制造商的说明,在室温下将其与Cy3-/FITC二级抗体孵育1小时。
qRT-PCR分析 根据制造商的说明,使用TRIzol(Invitrogen,Carlsbad,CA,USA)从C2C12细胞中分离出的总mRNA被反转录为cDNA。 使用Primescript进行实时PCR检测 TM(TM) RT主混合液(Takara Bio Inc.,日本Otsu)、SYBR Premix Ex TaqTMII(Takar Bio Inc.)和CFX96商标实时PCR检测系统(Bio-Rad,加利福尼亚州,美国)。 的表达式级别 肌细胞生成素 , MyoD公司 , HDAC1-11型 , 生命周期3 , 贝克林1 , 附件7 , 轴2 、和 CCND1号机组 使用补充表中列出的引物(Sangon Biotech,中国)进行检测 1 . GAPDH公司 作为一种家政基因。 实验一式三份。
蛋白质印迹分析 C2C12细胞在RIPA裂解缓冲液中采集(中国上海贝尤泰姆生物技术研究所)。 使用BCA分析对全细胞蛋白提取物进行定量,用SDS-PAGE 8–12%分离,然后转移到PVDF膜(Millipore,Billerica,MA,USA)。 抗体包括Myogenin(Abcam,1:1000,ab124800,Cambridge,MA,USA)、MyoD(Santa Cruz,1:200,sc-377460)、HDAC9(Abcam1:1000,ab59718)、HIF1α(Abcam-1:1000,ab 179483)、HIF2α(Abcam,1:1000;ab179825)、H3K9(Abcam,1:11000,ab32129)、H3C14、H3K18、H4K16(Cell Signaling,1:1000)、LC3I/II(Cell信号,1:1000、12741)、, Beclin1(Cell Signal,1:1000,3738)、Atg5(Cell信号,1:1000、12994)、Atg 7(Cell Signal,1-1000,8558)、Atg12(Cell Signal,1/1000,4180)、p62(Cell信令,1:1000和23214)、p-GSK3βSer9(Cell Sygnal,1:000,9323)、GSK3?(Cell Senal,1:100012456)和活性-β-catenin(Millipore,1:800,05–665)。 用GAPDH(Abcam,1:4000,ab181602)对剥离膜进行重复处理,作为负荷控制。 在与抗兔或抗小鼠IgG二级抗体(CoWin Bioscience Co.,Beijing,China)孵育后,使用ECL试剂盒(Beyotime Institute of Biotechnology)进行信号检测。 实验一式三份。
转染试验 使用siPORTNeoFX将抗小鼠HDAC9(Gene-Pharma Co,中国上海)、β-catenin(Gene-Pharma Co,上海)、Beclin1(Gene-Partra Co)或阴性对照(Gene-Patrma Co)的siRNA双链寡核苷酸转染到最终浓度为50 nM的常氧和缺氧C2C12成肌细胞中。 8小时后更换培养基。 实验一式三份。
小分子给药 为了研究丁酸钠(NaB)对C2C12细胞肌发生的影响,在缺氧条件下用或不用NaB(200μM,sigma,156-54-7)培养C2C12电池。 为了检测NaB和曲古抑菌素A(TSA)对C2C12细胞自噬的影响,在常氧条件下用NaB(200μM)和TSA(100 nM,Sigma,58880-19-6)培养C2C12电池。 将雷帕霉素(100 nM,Sigma,53123-88-9)、NaB(200μM)、3-MA(5 mM,Simma,5142-23-4)和重组小鼠DKK-1(100 ng/ml,BioLegend,San Diego,CA,USA,759604)添加到在常氧或缺氧条件下培养的C2C12细胞中,以检查自噬与信号通路之间的关系。 所有用于qRT-PCR和western印迹的细胞样本均按照制造商的说明收集。
透射电子显微镜(TEM)分析 用胰蛋白酶收集C2C12细胞,用无血清PBS洗涤,主要固定在4%戊二醛和4%多聚甲醛(Sigma,pH 7.2)中过夜。 用PBS清洗后,细胞在一系列乙醇溶液(50、70、95和100%)中逐渐脱水,然后原位嵌入LX-812树脂中(美国拉德研究工业公司)。 随后,用1%醋酸铀酰(30分钟)和柠檬酸铅(10分钟)对超薄切片(60 nm)进行染色。 然后使用加速电压为100 kV的FEI Tecnai G12 Spirit BioTwin透射电子显微镜(美国FEI公司)观察细胞的超微结构。使用Veleta CCD相机(德国奥林巴斯SIS)拍摄数字图像。
染色质免疫沉淀 我们使用染色质免疫沉淀(ChIP)检测试剂盒(Merck Millipore,Billerica,MA,USA,17–371)根据制造商的方案确认蛋白质和基因启动子之间的结合。 使用抗HDAC9抗体(Abcam,ab59718)和多克隆抗组蛋白H3抗体(乙酰基K9)(Abcam,ab10812)作为检测抗体,使用正常兔IgG(Merck Millipore)作为阴性对照。 用qRT-PCR分析所有沉淀DNA样品,并将结果归一化为输入值。 跨H3K9-/HDAC9-结合位点的引物 附件7,Beclin1,LC3a 、和 LC3b公司 发起人(中国Sangon biotech)列于补充表 2 .
后肢缺血模型 雄性4月龄小鼠购自中国西安第四军医大学动物中心。 16只小鼠被随机、均匀地分为两组(每组8只),接受假手术或股动脉结扎手术。 简单地说,在腹股沟韧带下方的近端区域和股骨深支上方的远端区域结扎股动脉。 然后在结扎部位之间切开。 所有涉及动物的程序均经第四军医大学动物使用和护理委员会批准(许可证号:SYXK 2012-0023)。
人类受试者 第四军医大学附属医院因动脉硬化闭塞症对两名动脉硬化闭塞患者(男性)进行了检查,年龄分别为48岁和53岁。 从两名46岁和50岁的车祸致骨折患者(男性)身上采集健康人体肌肉样本。
该临床研究得到了第四军医大学附属医院伦理委员会的批准,并在样本采集前获得了所有参与者的书面知情同意。
统计 数据表示为平均值±标准差未配对双尾学生 吨 -两组间的比较采用检验,多重比较采用单因素方差分析(ANOVA)和Bonferroni后验。 所有实验重复了三次以上,并显示了具有代表性的实验。 P(P) 值<0.05被认为是显著的* P(P) < 0.05, ** P(P) < 0.01. 使用SPSS17.0软件进行分析测试。
致谢 这项工作得到了国家自然科学基金(31571532)、陕西省重点研发计划项目(2017ZDXM-SF-038)和国家自然科学项目(81271176和31601099)的资助。
作者贡献 Z.Z.收集并整理数据。 L.Z和Y.Z写的手稿最多,并帮助分析数据。 L.L.帮助进行了统计设计和ChIP分析。 J.Z.和Q.W.对C2C12细胞培养和鉴定做出了贡献。 Z.J.设计了实验并分析了数据。 W.L.开发了这个概念,监督了这个项目,构思了实验并修改了手稿。
脚注
出版商备注: Springer Nature在公布的地图和机构关联中的管辖权主张方面保持中立。
参与者信息 Zuolin Jin,电话:+86-29-84776471,电子邮件: zuolinj@163.com。
刘文佳,电话:+86-29-84776138,电子邮件: wenjia@xiterm.com ,电子邮件: wenjialiu23@163.com。
补充信息 补充信息 本文附于(10.1038/s41419-019-1763-2)。
工具书类
1 Slot IG、Schols AM、De Theije CC、Snepvangers FJ、Gosker HR。常压缺氧3周小鼠骨骼肌氧化表型的改变。 《细胞生理学杂志》。 2016; 231:377–392. doi:10.1002/jcp.25083。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Di Carlo A等。缺氧通过加速MyoD降解抑制肌源性分化。 生物学杂志。 化学。 2004; 279:16332–16338. doi:10.1074/jbc。 M313931200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Jash S,Adhya S。短暂缺氧与长期缺氧对体内卫星细胞增殖和分化的影响。 干细胞国际2015; 2015:961307. doi:10.1155/2015/961307。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
4 Turan N等。一种系统生物学方法确定了定义慢性阻塞性肺病骨骼肌异常的分子网络。 公共科学图书馆计算。 生物杂志2011; 7:e1002129。 doi:10.1371/journal.pcbi.1002129。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
5 Demonbreun AR,McNally EM。发育和修复中的肌肉细胞通讯。 货币。 操作。 药理学。 2017; 34:7–14. doi:10.1016/j.coph.2017.03.008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
6 Wang C等。缺氧通过p53蛋白依赖性诱导Bhlhe40蛋白抑制肌源性分化。 生物学杂志。 化学。 2015; 290:29707–29716. doi:10.1074/jbc。 M115.688771。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
7 Hidalgo M等。氧气在L6成肌细胞早期分化过程中调节谷胱甘肽过氧化物酶活性。 细胞生理学。 生物化学。 2014; 33:67–77. doi:10.1159/000356650。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
8 Majmundar AJ等(2)通过磷脂酰肌醇3-激酶/AKT信号调节骨骼肌祖细胞分化。 分子细胞生物学。 2012; 32:36–49. doi:10.1128/MCB.05857-11。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
9 Li B等。GCN5通过DKK1乙酰化在炎症微环境中调节牙周膜干细胞的成骨分化。 科学。 2016年代表; 6:26542. doi:10.1038/srep26542。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
10 Dawson MA,Kouzarides T.癌症表观遗传学:从机制到治疗。 单元格。 2012; 150:12–27. doi:10.1016/j.cell.2012.06.013。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
11 Safronova OS、Nakahama K、Morita I。急性缺氧通过HDAC3和HEXIM1依赖机制影响P-TEFb,以促进基因特异性转录抑制。 核能。 2014年《酸类研究》; 42:8954–8969. doi:10.1093/nar/gku611。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Bricurvt J等。组蛋白脱乙酰酶5和6的表达受损模拟了肥胖和缺氧对脂肪细胞功能的影响。 摩尔金属。 2016; 5:1200–1207. doi:10.1016/j.molmet.2016.09.011。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
13. Koyuncuoglu T等。尿苷通过降低新生大鼠的组蛋白脱乙酰酶活性来预防缺氧缺血性脑损伤。 恢复。 神经醇。 神经科学。 2015; 33:777–784. doi:10.3233/RNN-150549。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
14 致M等。组蛋白脱乙酰酶7减少导致COPD患者缺氧适应缺陷。 胸部。 2012; 141:1233–1242. doi:10.1378/箱.11-1536。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
15. Blondelle J等人。HACD1是膜组成和流动性的调节器,促进成肌细胞融合和骨骼肌生长。 分子细胞生物学杂志。 2015; 7:429–440. doi:10.1093/jmcb/mjv049。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
16 Micheli L等。PC4/Tis7/IFRD1刺激骨骼肌再生,并作为MyoD和NF-kappa B.J.Biol的调节器参与成肌细胞分化。 化学。 2011; 286:5691–5707. doi:10.1074/jbc。 M110.162842。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
17 Ren HX,Accili D,Duan CM。缺氧通过不同调节多种信号通路将胰岛素样生长因子的促肌作用转化为促有丝分裂作用。 程序。 美国国家科学院。 科学。 美国2010年; 107:5857–5862. doi:10.1073/pnas.0909570107。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
18 De Meireles LC等。在大鼠衰老过程中,跑步机运动诱导海马组蛋白乙酰化发生选择性变化。 神经科学。 莱特。 2016; 634:19–24. doi:10.1016/j.neulet.2016.10.008。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 Villagra A、Sotomayor EM、Seto E.组蛋白脱乙酰酶和免疫网络:在癌症和炎症中的意义。 致癌物。 2010; 29:157–173. doi:10.1038/onc.2009.334。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
20 张华,等。组蛋白去乙酰化酶表达水平和活性在慢性乙型肝炎患者炎症反应中的作用。分子医学报告2017; 15:2744–2752. doi:10.3892/mmr.2017.6290。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
21 Palazon A、Goldrath AW、Nizet V、Johnson RS.HIF转录因子、炎症和免疫。 免疫。 2014; 41:518–528. doi:10.1016/j.immuni.2014.09.008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
22. Yan KL,等。组蛋白脱乙酰酶9缺乏可对抗效应T细胞介导的系统性自身免疫。 生物学杂志。 化学。 2011; 286:28833–28843. doi:10.1074/jbc。 M111.233932。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
23 Glick D、Barth S、Macleod KF。 自噬:细胞和分子机制。 《病理学杂志》。 2010; 221:3–12. doi:10.1002/path.2697。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
24 Beau I、Mehrpour M、Codogno P.自噬体与人类疾病。 国际生物化学杂志。 细胞生物学。 2011; 43:460–464. doi:10.1016/j.biocel.2011.01.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
25 水岛N、莱文B、克尔沃AM、克林斯基DJ。自噬通过细胞自我控制与疾病作斗争。 自然。 2008; 451:1069–1075. doi:10.1038/nature06639。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
26 Garcia-Prat L等人。自噬通过防止衰老来维持茎。 自然。 2016; 529:37–42. doi:10.1038/nature16187。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
27. Jones AE等。Wnt/beta-catenin控制卵泡抑素信号传导,以调节卫星细胞肌生成潜能。 骨骼肌。 2015; 5:14. doi:10.1186/s13395-015-0038-6。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
28 铃木A、Pelikan RC、岩手J.WNT/β-catenin信号通过调节步骤特异性靶点调节肌肉发生的多个步骤。 摩尔细胞生物学。 2015; 35:1763–1776. doi:10.1128/MCB.01180-14。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
29 Kadir R等。ALFY控制的DVL3自噬调节Wnt信号,决定人脑大小。 公共科学图书馆-遗传学。 2016; 12:e1005919。 doi:10.1371/journal.pgen.1005919。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
30 Goll DE、Thompson VF、Li H、Wei W、Cong J.钙蛋白酶系统。 生理学。 2003年版; 83:731–801. doi:10.1152/physrev.00029.2002。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
31 Min K等。阿霉素诱导的心肌和骨骼肌肌病需要增加线粒体活性氧释放和钙蛋白酶激活。 生理学杂志。 2015; 593:2017–2036. doi:10.1113/jphysiol.2014.286518。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 Smith IJ、Lecker SH、Hasselgren PO。 脓毒症中钙蛋白酶活性和肌肉萎缩。 美国生理学杂志。 内分泌。 Metab公司。 2008; 295:E762–E771。 doi:10.1152/ajpendo.90226.2008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
33 Yun Z、Lin Q、Giaccia AJ。 缺氧条件下的适应性肌生成。 分子细胞。 生物学2005; 25:3040–3055. doi:10.1128/MCB.25.8.3040-3055.2005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
34 Lee SW等。低氧靶点HDAC6在胚胎干细胞肌源性分化中诱导的MicroRNA-26a。 核酸研究2015; 43:2057–2073. doi:10.1093/nar/gkv088。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
35 麦肯锡TA、Zhang CL、Lu J、Olson EN。 组蛋白去乙酰化酶的信号依赖性核输出调节肌肉分化。 自然。 2000; 408:106–111. doi:10.1038/35040593。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
36 Mozzetta C等人。成纤维祖细胞介导HDAC抑制剂促进年轻而非老年Mdx小鼠营养不良肌肉再生的能力。 EMBO Mol.Med.2013; 5:626–639. doi:10.1002/emmm.201202096。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
37 Saccone V等。HDAC调节的肌瘤受体控制BAF60变异体交换,并指导营养不良肌肉中纤维脂肪生成祖细胞的功能表型。 基因开发2014; 28:841–857. doi:10.1101/gad.234468.113。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
38 刘华,邱华,杨杰,倪杰,乐伟。慢性缺氧通过下调DNA甲基转移酶3b,使γ-分泌酶去甲基化,从而促进阿尔茨海默病。 老年痴呆症。 2016; 12:130–143. doi:10.1016/j.jalz.2015.05.019。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
39 Liu H,Le W.阿尔茨海默病慢性低氧介导的神经退行性变的表观遗传修饰。 翻译。 神经衰减器。 2014; 3:7. doi:10.1186/2047-9158-3-7。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
40 Yang Q、Sun M、Ramchandran R、Raj JU。 IGF-1信号在新生儿缺氧诱导的肺动脉高压中的作用:表观遗传学调控。 血管。 药理学。 2015; 73:20–31. doi:10.1016/j.vph.2015.04.005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
41 Watson CJ等。低氧诱导的表观遗传修饰与心脏组织纤维化和肌纤维母细胞样表型的发展有关。 嗯,分子遗传学。 2014; 23:2176–2188. doi:10.1093/hmg/ddt614。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
42 Ryter SW,Cloonan SM,Choi AM。自噬:细胞代谢和体内平衡的关键调节器。 分子细胞。 2013; 36:7–16. doi:10.1007/s10059-013-0140-8。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
43 Bernardi P、Bonaldo P、线粒体功能障碍和自噬缺陷在VI型胶原肌营养不良发病机制中的作用。 冷泉港。 透视。 生物.2013; 5:a011387。 doi:10.1101/cshperspect.a011387。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
44 Sandri M、Coletto L、Grumati P、Bonaldo P。肌病和肌营养不良患者自噬和蛋白质降解系统的失调。 细胞科学杂志。 2013; 126:5325–5333. doi:10.1242/jcs.114041。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
45. Giordano C,Lemaire C,Li T,Kimoff RJ,Petrof BJ。短期间歇性缺氧后小鼠膈肌自噬相关萎缩和代谢重塑。 《公共科学图书馆·综合》。 2015; 10:e0131068。 doi:10.1371/journal.pone.0131068。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
46. Masschelein E等。急性环境缺氧以基因型依赖的方式诱导LC3脂质氧化。 FASEB J.2014; 28:1022–1034. doi:10.1096/fj.13-239863。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
47 Rudnicki MA,Williams BO.骨和肌肉中的Wnt信号。 骨头。 2015; 80:60–66. doi:10.1016/j.bone.2015.02.009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
48 Huraskin D等。通过Axin2的Wnt/beta-catenin信号传导是肌发生所必需的,与YAP/Taz和Tead1一起在IIa/IIx肌纤维中活跃。 发展。 2016; 143:3128–3142. doi:10.1242/dev.139907。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
49. Abraham ST。Wnt3a/β-catenin信号通路在C2C12细胞肌源性程序中的作用。 体外细胞发育生物学。 阿尼姆。 2016; 52:935–941. doi:10.1007/s11626-016-0058-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
50 Hutcheson DA、Zhao J、Merrell A、Haldar M、Kardon G。胚胎和胎儿肢体肌源性细胞来源于发育不同的祖细胞,对β-catenin有不同的需求。 基因开发2009; 23:997–1013. doi:10.1101/gad.1769009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
51 Tanaka S、Terada K、Nohno T。典型Wnt信号参与小鼠成肌细胞从细胞增殖到肌源性分化的转换。 J.摩尔信号。 2011; 6:12. doi:10.186/1750-2187-6-12。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
52. 铃木A,Scruggs A,岩田J。WNT/β-catenin信号在肌肉发生过程中的时间特异性作用。 《自然科学杂志》。 2015; 1:e143。 [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
53 Murphy MM等人。肌肉再生过程中,不需要瞬时激活Wnt/beta-catenin信号,但必须沉默干细胞功能。 干细胞报告2014; 3:475–488. doi:10.1016/j.stemcr.2014.06.019。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
54 翟P,Sadoshima J.糖原合成酶激酶-3beta控制心肌缺血和再灌注期间的自噬。 自噬。 2012; 8:138–139. doi:10.4161/auto.8.1.18314。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
55 Park CH、Lee BH、Ahn SG、Yoon JH、Oh SH。GSK-3beta的丝氨酸9和酪氨酸216磷酸化对获得性镉抗性中的自噬进行差异调节。 毒物科学。 2013; 135:380–389. doi:10.1093/toxsci/kft158。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
56 Gavilán E、Sánchez-Aguayo I、Daza P、Ruano D。GSK-3beta信号通过蛋白酶体抑制,决定乳腺癌细胞系MCF7中的自噬激活和非肿瘤细胞系MCF10A中的包涵体形成。 细胞死亡。 数字化信息系统。 2013; 4:e572。 doi:10.1038/cddis.2013.95。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
57 Long Q,Li X,He H,He D。自噬激活可能通过调节Akt/GSK-3beta途径保护冲击波诱导的肾小管上皮细胞凋亡。 国际生物学杂志。 科学。 2016; 12:1461–1471. doi:10.7150/ijbs.16864。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。