摘要
血脑屏障(BBB)破坏与多种神经疾病有关。脑微血管内皮细胞(BMEC)是血脑屏障的关键组成部分。基质金属蛋白酶-2/9(MMP-2/9)和toll样受体-2(TLR2)在BMEC中共表达,并已被证明在血脑屏障破坏中发挥重要作用。目前尚不清楚TLR2是否能调节BMEC中的MMP-2/9。在本研究中,使用Pam3CSK4激活TLR2,并通过定量实时PCR和蛋白质印迹测量血脑屏障中MMP-2/9和紧密连接(TJs)的表达。用蛋白质印迹法测定磷蛋白。使用丝裂原活化蛋白激酶(MAPKs)和NF-κB抑制剂来确定TLR2调节BMEC中MMP-2/9表达的信号通路。本研究表明,Pam3CSK4上调了BMEC中MMP-9的mRNA和蛋白表达,同时下调了MMP-2和TJ的表达。Pam3CSK4还诱导了BMEC中MAPK和NF-κB信号通路的磷酸化。经ERK1/2和JNK抑制剂预处理后,MMP-9表达降低,但p38未降低。然而,添加NF-κB抑制剂后,MMP-2和MMP-9的mRNA和蛋白表达增加。我们的结果表明,Pam3CSK4能够通过ERK1/2和JNK信号通路上调MMP-9的表达,但NF-κB信号通路负调控TLR2对BMEC中MMP-2和MMP-9表达的影响。该发现为MMP-2/9在BMEC中表达的分子机制提供了新的见解。
关键词:Toll样受体-2、基质金属蛋白酶、Pam3CSK4、丝裂原活化蛋白激酶、脑微血管内皮细胞
介绍
Toll样受体(TLR)是跨膜模式识别受体(PRR),不仅参与全身细菌感染,也参与脑损伤[1]. TLR在哺乳动物天然免疫细胞和非免疫细胞中表达,如上皮细胞和内皮细胞[1]. 中枢神经系统(CNS)中几乎所有类型的细胞,包括小胶质细胞、神经元、星形胶质细胞[2],和内皮细胞[三],表示TLR。目前已知13个鼠TLR和10个人TLR[4,5]. TLR2是一种在细胞表面表达的TLR[2]. 先前的一项研究表明,在小鼠脑缺血模型中TLR2的mRNA表达上调[6]. 与野生型小鼠相比,TLR2缺乏小鼠脑缺血损伤后梗死面积减小[6].
血–脑屏障(BBB)在维持中枢神经系统微环境的稳态中起着关键作用。BBB由脑微血管内皮细胞(BMEC)形成,由紧密连接(TJ)和粘附连接(AJ)连接[7]. 内皮细胞之间的TJ和AJ维持BBB的完整性[三]. 血脑屏障破坏与一系列中枢神经系统疾病有关,如多发性硬化症[7]缺氧和缺血[8].
基质金属蛋白酶(MMPs)是一个锌依赖酶家族,通过降解内皮细胞的TJ破坏BBB完整性[9]. MMP-2/9降解脑血管周围基底层的主要成分,包括IV型胶原、层粘连蛋白和纤维连接蛋白[9]. 最近的报告表明,MMP-2/9和TLR2[三]以BMEC表示。TLR2可激活丝裂原活化蛋白激酶(MAPK)通路[三]. 其他研究表明MMPs受MAPK信号通路调节[10]. 然而,其分子机制此前尚未进行研究。我们推测TLR2激活可能通过MAPK和NF-κB信号通路诱导BMEC中MMP-2/9的表达,从而导致BBB的破坏。因此,我们使用TLR2合成类似配体Pam三胱氨酸-丝氨酸-赖氨酸4(Pam3CSK4)激活TLR2,并探讨Pam3CSK4是否以及如何调节BMEC中MMP-2/9的表达。
材料和方法
试剂
TLR2激动剂Pam3CSK4购自InvivoGen(美国加利福尼亚州圣地亚哥)。U0126(ERK1/2抑制剂)购自Cell Signaling Technology(美国马萨诸塞州贝弗利)。SB203580(p38 MAPK抑制剂)、SP600125(JNK抑制剂)和BAY11-7082(NF-κB抑制剂)购自Calbiochem(加利福尼亚州圣地亚哥,美国)。
对于western blot分析,抗TLR2(目录ab108998;1:1000)、抗MMP-9(目录ab76003;1:1000。Anti-claudin 5(目录号ABT45;1:1000)和anticolagen IV(目录号ab6586;1:2000)分别从默克Millipore(美国马萨诸塞州Billerica)和Abcam(中国上海)购买。Anti-ZO-1(目录61-7300;1:4000)从Invitrogen(美国加利福尼亚州卡尔斯巴德)购买。β-actin来自Proteintech(美国伊利诺伊州罗斯蒙特)。抗磷酸化ERK1/2(目录号4377)、pJNK(目录号4668)、pP38 MAPK(目录编号4511)和pNF-κB p65(目录号3033)的抗体购自Cell Signaling Technology。
原代脑微血管内皮细胞(BMEC)培养
所有实验均按照美国国立卫生研究院《实验动物护理和使用指南》进行,并经中国昆明理工大学动物护理委员会批准。BMEC培养自先前发表的Sprague–Dawley新生大鼠大脑皮层[11]. 内皮细胞在含有20%胎牛血清(FBS)的DMEM/高糖中培养24 h,并用4µg/mL嘌呤霉素进行筛选(美国俄亥俄州Amresco)。用von Willebrand因子(vWF,1:50,Proteintech,Rosemont,IL,USA)免疫荧光染色鉴定BMEC。
定量实时聚合酶链反应
使用Eastep™Total RNA Extraction Kit(中国上海Promega)从BMEC中分离出总RNA。通过NanoDrop2000(Thermo Fisher Scientific,Waltham,MA,USA)测量分离RNA的质量和数量。根据制造商的方案,使用GoScript™逆转录系统(Promega)合成第一链cDNA。使用SYBR®Premix Ex TaqTM II(TliRNaseH Plus,Takara,Dalian,China)在Roche LightCycler 480上对1 uL cDNA产物进行定量实时聚合酶链反应(qRT-PCR)。
底漆β-肌动蛋白、MMP-2和MMP-9大鼠引物的设计如下:
β-肌动蛋白(正向:5′-GGAGATTACTGCCTGGCTCCTA-3′,反向:5′-GACTCATCGTACTGCTTGCTG-3′);
MMP-2(正向:5′-ACCTTGACCAGACACACACATCGAG-3′,反向:5′-CAGGGTCCAGTGTGTA-3′);
MMP-9(正向:5′-CATGCGCTGGGCTTTAGATCA-3′,反向:5′-GAGGCCTGGGTCAGGTTAGAG-3′)。PCR条件为:一个周期的初始变性(95℃30 s)、40个周期的扩增(40个周期95℃5 s、55℃30 s、72℃30s)和一个周期扩增曲线分析(95℃5s、60℃60s、95℃)。每个反应重复三次。比较mRNA表达水平表示为2-ΔΔCt.
Western Blot分析
用含有蛋白酶抑制剂鸡尾酒(Calbiochem,加州圣地亚哥,美国)和PhosSTOP(Roche Applied Science,伊利诺伊州罗克福德,美国)的RIPA裂解缓冲液(Beyotime Biotechnology,中国上海)收集细胞裂解产物。上清液中的蛋白质浓度通过双钦尼克酸(BCA)分析(Beyotime Biotechnology)进行检测。蛋白质通过western blot分离,然后转移到聚偏二氟乙烯膜(Merck Millipore),然后用含有0.1%吐温20和5%(w/v)脱脂奶的Tris缓冲盐水(TBS;Sangon Biotech,中国上海)封闭。将膜与一级抗体在4°C下孵育过夜,然后在室温下与辣根过氧化物酶(HRP)结合的二级抗体(1:5000,Proteintech)孵育2小时。抗体稀释率为:TLR2抗体(1:1000)、MMP-9抗体(1:100)、MMP2抗体(1:11000)、闭塞素抗体(1:12000)、克劳丁5抗体(1:10000)、IV型胶原抗体(1:2000)、ZO-1抗体(1:4000)、β-肌动蛋白抗体(1:5000)、p-ERK1/2、p-JNK、p-p38和p-NF-κB p65抗体(1:1000。使用增强化学发光(Proteintech)对带状物进行可视化,并使用膜成像系统(Bio-Rad,Hercules,CA,USA)进行拍照。使用ImageJ软件(美国马里兰州贝塞斯达NIH)半定量测量带强度。
统计分析
结果表示为平均值±标准误差(SE)。采用单因素方差分析(ANOVA)进行统计分析,然后进行最小显著性差异检验。第页 ≤ 0.05被认为具有统计学意义。
结果
Pam3CSK4上调BMEC中MMP-9的表达但下调MMP-2的表达
据报道,BMEC可以表达两种MMPs[12]和TLR2[三]. 为了研究TLR2激活对BMEC中MMP-2/9的影响,我们用1µg/mL Pam3CSK4处理细胞1、2、3、6和24小时。MMP-9的mRNA和蛋白表达分别在3和6小时增加(第页 < 0.05,图1b、 d)。MMP-2 mRNA水平在第1、2和3小时显著降低(第页 < 0.05,图1a) ●●●●。然而,MMP-2蛋白水平在2小时后下降(第页 < 0.05,图1c) ●●●●。
图1。
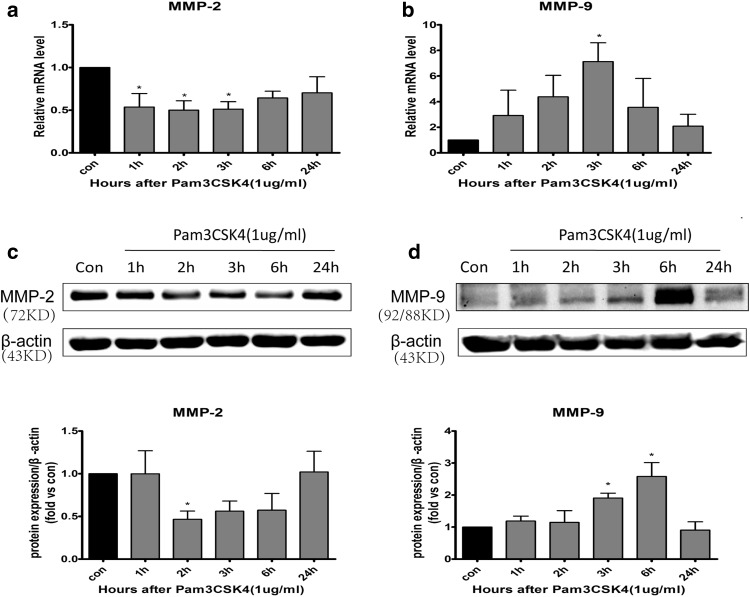
Pam3CSK4刺激的BMEC中MMP-2和MMP-9的mRNA和蛋白表达水平。用Pam3CSK4(1µg/mL)刺激BMEC 1、2、3、6和24小时。MMP-2的mRNA表达水平(一),基质金属蛋白酶-9(b条)用qRT-PCR分析β-actin。收集细胞检测MMP-2(c(c))和MMP-9(d日)蛋白质表达采用western blot,蛋白质水平采用ImageJ软件定量,并用β-肌动蛋白水平进行标准化*第页 < 0.05, **第页 < 与用PBS处理细胞的对照组相比,0.001
Pam3CSK4下调BMEC中TJ的表达
基质金属蛋白酶降解BMEC中的TJ蛋白(如克劳丁5和闭塞素)和基底膜蛋白(如层粘连蛋白和胶原),导致BBB的破坏[13,14]. 为了观察TLR2刺激是否能破坏BMEC中的TJ,加入TLR2激动剂Pam3CSK4后,用western blot法测定克劳丁5、闭塞素、ZO-1和IV型胶原蛋白水平。发现克劳丁5(图2a) 和IV型胶原蛋白(图2c) 2小时后,ZO-1水平下降(图2d) 经Pam3CSK4治疗后,BMEC在3小时时下降(全部第页 < 0.05). 然而,闭塞素水平没有改变(图2b) ●●●●。
图2。
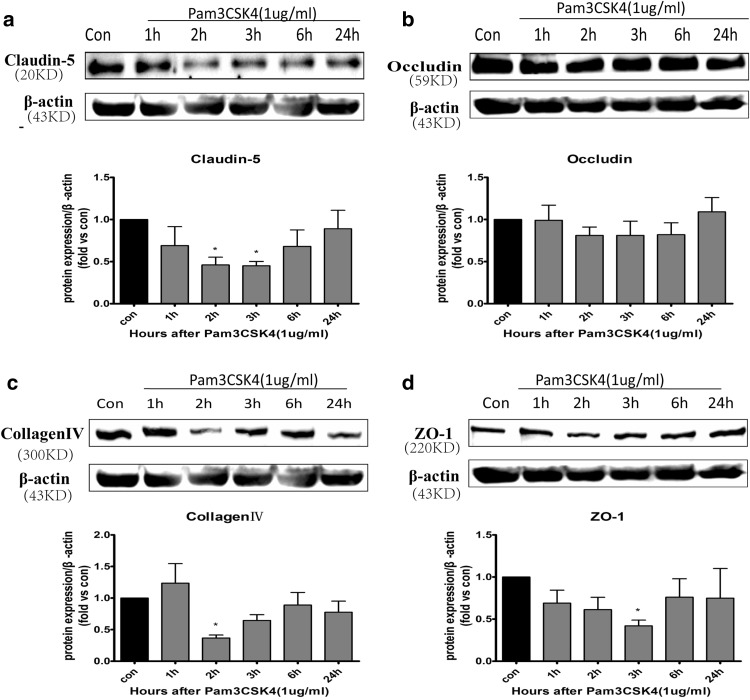
Pam3CSK4刺激的BMEC中TJ的蛋白表达水平。用Pam3CSK4(1µg/mL)刺激BMEC 1、2、3、6和24小时。收集细胞检测克劳丁5(一),咬合蛋白(b条),IV型胶原蛋白(c(c))和ZO-1(d日)蛋白质表达采用western blot,蛋白质水平采用ImageJ软件定量,并用β-肌动蛋白水平进行标准化*第页 < 0.05, **第页 < 与用PBS处理细胞的对照组相比,0.001
Pam3CSK4诱导BMEC中MAPK和NF-κB磷酸化
在用1μg/mL Pam3CSK4处理BMEC 1、2、3、6和24小时后,我们通过蛋白质印迹检测MAPK和NF-κB的磷酸化。ERK1/2的磷酸化(图三a) ,JNK(图三c) 和第38页(图三b) 1小时检测到MAPK(第页 < 0.05). ERK1/2和JNK的磷酸化倾向于持续3小时,尽管在2小时和3小时没有统计学意义(第页 > 0.05,图三a、 c)。在3和6小时诱导NF-κB磷酸化(第页 < 0.05,图三d) ●●●●。
图3。
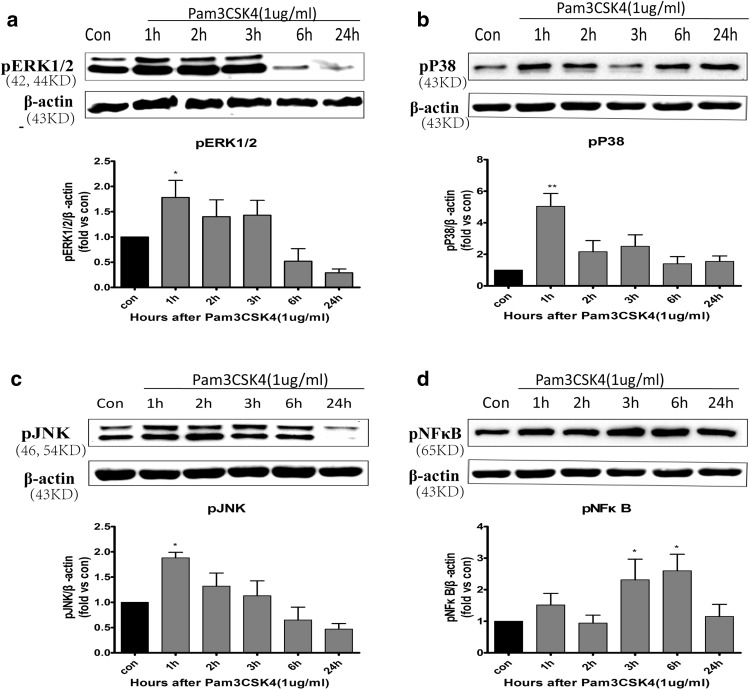
Pam3CSK4诱导BMEC中ERK、JNK、p38和NF-κB磷酸化。用1µg/mL的Pam3CSK4处理细胞不同时间后,磷酸化ERK的表达(一),第38页(b条)、JNK(c(c))和NF-κB(d日)western-blot分析并用β-actin蛋白水平进行归一化*第页 < 0.05, **第页 < 与用PBS处理细胞的对照组相比,0.001
Pam3CSK4通过ERK1/2、JNK和NF-κB途径调节MMP-2/9的表达
为了研究TLR2调节BMEC中MMP-2/9表达的信号通路,用ERK1/2抑制剂(20µM U0126)、p38 MAPK抑制剂(20μM SB203580)、JNK抑制剂(20µM SP600125)和NF-κB抑制剂(10µM BAY11-7082)或DMSO(0.1%溶媒对照)预处理细胞1小时,然后用1µg/mL Pam3CSK4处理6小时。用qRT-PCR和western blotting检测MMP-2和MMP-9的表达。如图所示4b、 d、U0126和SP600125显著抑制MMP-9的表达,而Pam3CSK4上调了MMP-9表达(所有第页 < 0.05). 与载体+Pam3CSK4组相比,SB203580和BAY11-7082未抑制MMP-9的上调(图4b、 d)。然而,BAY11-7082预处理细胞后,MMP-2的mRNA和蛋白表达(第页 < 0.001,图4a、 c)和MMP-9的mRNA分别与载体对照组和载体+Pam3CSK4组相比增加(第页 < 0.001,图4b) ●●●●。
图4。
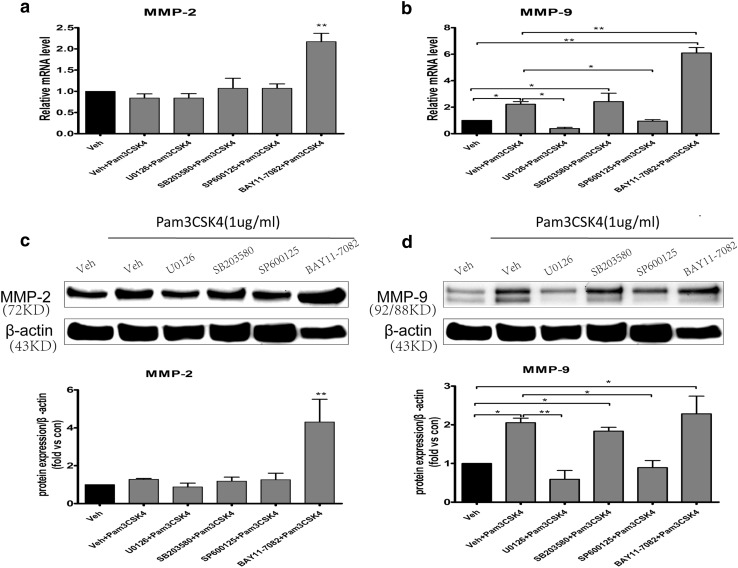
Pam3CSK4通过MAPK/NF-κB信号通路影响BMEC中MMP-2和MMP-9的表达水平。用ERK1/2抑制剂(U0126)、p38 MAPK抑制剂(SB203580)、JNK抑制剂(SP600125)和NF-κB抑制剂(BAY11-7082)或DMSO预处理BMEC 1 h,然后用1µg/mL Pam3CSK4处理6 h。MMP-2的mRNA表达水平(一),基质金属蛋白酶-9(b条)用qRT-PCR分析β-actin。收集细胞检测MMP-2(c(c))和MMP-9(d日)蛋白质表达采用western blot,蛋白质水平采用ImageJ软件定量,并用β-肌动蛋白水平进行标准化*第页 < 0.05, **第页 < 0.001,与用PBS处理细胞的载体对照组相比
讨论
中枢神经系统中血液和大脑之间有三个主要屏障:血脑屏障、血脑脊髓液屏障和蛛网膜屏障[15]. BBB功能障碍与几种神经疾病的病理生理学相关[15]例如中风、多发性硬化症(MS)和阿尔茨海默病(AD)。BBB分解也与细胞因子、趋化因子和其他物质有关,包括基质金属蛋白酶[16].
MMPs家族包括20多种蛋白水解酶[17]. 它们通常分为四类:胶原酶、明胶酶(MMP-2和MMP-9)、基质溶素、基质溶酶和膜型MMPs[18]. MMPs家族参与组织重塑、癌症转移、慢性炎症和神经疾病[19]. 基质金属蛋白酶还能够降解几种蛋白酶、生长因子、细胞表面受体和细胞-细胞粘附分子[20]. 在受损的脑组织中,各种细胞表达MMPs,包括常驻细胞(内皮细胞、星形胶质细胞和神经元)和浸润性炎症细胞[9]. MMP在成人大脑中的表达通常很低,但许多研究表明,缺血性卒中后几种MMP被激活,并且其水平增加[21,22]. MMP活性在四个不同水平上受到严格调节:转录水平的基因表达;分区;前酶激活;和抑制蛋白水解[23].
当激动剂配体与TLR结合时,配体分子将激活TLR信号通路。TLR信号通路有两种类型:髓系分化因子88(MyD88)依赖性通路和TIR-域适配器诱导干扰素-β(TRIF)依赖性(MyD88-independent)通路[2]. TLR2激活MAPK[三]和转录因子(NF-κB)通过MyD88依赖性信号通路,导致促炎细胞因子的表达,如白细胞介素(IL)-1、IL-6和肿瘤坏死因子(TNF)-α以及基质金属蛋白酶的产生。MAPKs包括三个主要成员:细胞外信号相关激酶(ERKs)、c-Jun N-末端激酶(JNKs)/应激激活蛋白激酶和p38[24].
最近的研究表明,MMP-2/9与中枢神经系统疾病密切相关。先前的研究人员揭示了MMP-9在不同细胞类型中的表达受MAPKs的调节[25–27]. 此外,转录因子NF-κB参与调节几种细胞类型中MMPs的表达。几种TLR激动剂可以激活NF-κB并调节MMP的表达[26]. 然而,BBB的BMEC的分子机制尚未阐明。我们的研究表明,TLR2配体Pam3CSK4可以显著上调BMEC中MMP-9的表达,下调MMP-2的表达。同时,TLR2的刺激导致克劳丁-5、IV型胶原和ZO-1的下调,这与人类大脑内皮细胞系hCMEC/d3的研究一致[三]. MMP-2/9是炎症反应的关键介质,可能导致BMEC中的TJ降解和中枢神经系统疾病中BBB完整性的缺乏。先前的研究表明,MMP-9可以损伤TJ蛋白[28]. 据报道,活性MMP-9诱导ZO-1表达降低[29]MMP-9基因敲除小鼠缺血后ZO-1的降解减弱[30]. 可以合理地得出结论,TLR2激活可能通过增加BMEC中MMP-9蛋白水平来降解ZO-1。然而,MMP-9蛋白诱导的时间为3-6小时,而本研究中仅在治疗2小时后观察到克劳丁-5或IV型胶原的减少。我们只通过western blot和qRT-PCR检测细胞中MMP-9的含量。因此,推测上清液或其他物质中分泌的MMP-9会导致治疗2小时后克劳丁-5和胶原蛋白IV的减少。
Pam3CSK4是TLR2的特异配体[31]在本研究中,Pam3CSK4在1小时诱导了BMEC中ERK、JNK和p38 MAPK的磷酸化,在3和6小时诱导了NF-κB的磷酸化。此外,为了研究Pam3CSK4影响MMP-2/9表达的信号通路,我们用抑制剂预处理BMEC 1小时,然后用Pam3CSK4处理细胞6小时。ERK1/2抑制剂(U0126)和JNK抑制剂(SP600125)显著阻断Pam3CSK4诱导的MMP-9表达。与溶媒对照组相比,p38 MAPK抑制剂(SB203580)不抑制MMP-9的上调。结论:TLR2可能通过ERK1/2和JNK信号通路调节BMEC中MMP-9的表达。相反,在用NF-κB抑制剂(BAY11-7082)预处理细胞后,MMP-2/9的mRNA和蛋白表达与载体对照组相比明显增加,但只有MMP-9 mRNA表达与载体+Pam3CSK4组相比显著增加。结果表明,TLR2通过NF-κB信号通路负调控BMEC中MMP-2和MMP-9的表达。先前的研究表明TLR2激活了两条下游通路,包括IKK复合物和MAPK家族,然后激活NF-κB和激活蛋白-1(AP-1),导致促炎细胞因子的表达[32]. 然而,一项研究报道磷脂酰肌醇3-激酶(PI3K)负调控TLR2信号[33]. 因此,推测Pam3CSK4对MMP-2表达的调节涉及NF-κB信号通路和其他信号通路(如PI3K通路)之间的平衡。然而,这个实验有局限性。选择Pam3CSK4刺激BMEC 6 h以研究TLR2调节MMP-2表达的信号通路是不合适的,因为刺激Pam3CSK4 6 h后,BMEC中MMP-2的mRNA和蛋白水平没有变化(图1a、 b)。
总之,TLR2通过ERK1/2和JNK信号通路调节MMP-9的表达,通过NF-κB信号通路负调控MMP-2/-9的表达。该发现可能为MMP-2/-9在BMEC中表达的分子机制提供新的见解。
致谢
本研究得到国家自然科学基金资助(81460188);云南省应用基础研究项目(No.2011FB148);云南省科技厅与昆明医科大学应用基础联合专项(No.2013FB201);云南省中青年学术技术带头人和后备人才(No.2012HB028);云南省卫生系统领导(No.D-201235);王龙德院士工作站。
工具书类
-
1.Gooshe M、Abdolghaffari AH、Gambuzza ME、Rezaei N。Toll样受体在多发性硬化症中的作用以及可能的治疗靶向性。《神经科学评论》。2014;25:713–739. doi:10.1515/revenuro-2014-0026。[内政部] [公共医学] [谷歌学者]
-
2Hamanaka J,Hara H.Toll样受体参与缺血诱导的神经元损伤。中枢神经系统药物药物化学。2011;11:107–113. doi:10.2174/187152411796011312。[内政部] [公共医学] [谷歌学者]
-
三。Nagyõszi P,Wilhelm I,Farkas AE等。脑内皮细胞中toll样受体的表达和调节。神经化学国际2010;57:556–564. doi:10.1016/j.neuint.2010.07.002。[内政部] [公共医学] [谷歌学者]
-
4Akira S、Uematsu S、Takeuchi O。病原体识别和先天免疫。单元格。2006;124:783–801. doi:10.1016/j.cell.2006.02.015。[内政部] [公共医学] [谷歌学者]
-
5Miggin SM,O'Neill LA。TLR信号调节的新见解。白血病生物学杂志。2006;80:220–226. doi:10.1189/jlb.1105672。[内政部] [公共医学] [谷歌学者]
-
6Ziegler G、Harhausen D、Schepers C等。TLR2在小鼠短暂性局灶性脑缺血中具有有害作用。生物化学与生物物理研究委员会。2007;359:574–579. doi:10.1016/j.bbrc.2007.05.157。[内政部] [公共医学] [谷歌学者]
-
7Ortiz GG、Pacheco-Moisés FP、Macías-Islas M等。血脑屏障在多发性硬化症中的作用。2014年《Arch Med Res.》;45:687–697. doi:10.1016/j.arcmed.2014.11.013。[内政部] [公共医学] [谷歌学者]
-
8Kaur C、Ling EA。缺氧缺血性条件下的血脑屏障。2008年《Curr Neurovasc Res.》;5:71–81. doi:10.2174/156720208783565645。[内政部] [公共医学] [谷歌学者]
-
9Lakhan SE、Kirchgessner A、Tepper D、Leonard A.急性缺血性卒中中基质金属蛋白酶和血脑屏障破坏。前神经病学。2013年doi:10.3389/fneur.2013.00032。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
10Piperi C,Papavassiliou AG.调节基质金属蛋白酶的分子机制。当前顶级药物化学。2012;12:1095–1112. doi:10.2174/1568026611208011095。[内政部] [公共医学] [谷歌学者]
-
11Burek M,Salvador E,Forster CY。作为体外血脑屏障模型的永生化鼠脑微血管内皮细胞系的生成。《2012年视觉实验杂志》doi:10.3791/4022。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
12Jin R,Yang G,Li G.缺血性卒中血脑屏障破坏的分子见解和治疗靶点:基质金属蛋白酶和组织型纤溶酶原激活剂的关键作用。神经生物学疾病。2010;38:376–385. doi:10.1016/j.nbd.2010.03.008。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
13.Adibhatla RM,Hatcher JF。组织纤溶酶原激活物(tPA)和基质金属蛋白酶在中风发病中的作用:治疗策略。中枢神经系统神经紊乱药物靶点。2008;7:243–253. doi:10.2174/187152708784936608。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
14坎宁安LA,韦泽尔M,罗森博格GA。MMPs和TIMPs在脑缺血中的多重作用。格利亚。2005;50:329–339. doi:10.1002/glia.20169。[内政部] [公共医学] [谷歌学者]
-
15Abbott NJ、Patabendige AA、Dolman DE、Yusof SR、Begley DJ。血脑屏障的结构和功能。神经生物学疾病。2010;37:13–25. doi:10.1016/j.nbd.2009.07.030。[内政部] [公共医学] [谷歌学者]
-
16血脑屏障:最新进展和临床相关性。神经病学。2012;78:1268–1276. doi:10.1212/WNL.0b013e318250d8bc。[内政部] [公共医学] [谷歌学者]
-
17罗林斯ND,巴雷特AJ,贝特曼A.MEROPS:肽酶数据库。核酸研究2010;38:D227–D233。doi:10.1093/nar/gkp971。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
18Nagase H,Visse R,Murphy G.基质金属蛋白酶和TIMP的结构和功能。2006年心血管研究;69:562–573. doi:10.1016/j.ccardires.2005.12.002。[内政部] [公共医学] [谷歌学者]
-
19Klein T,Bischoff R.基质金属蛋白酶的生理学和病理生理学。氨基酸。2011;41:271–290. doi:10.1007/s00726-010-0689-x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
20Khokha R、Murthy A、Weiss A.金属蛋白酶及其在炎症和免疫中的天然抑制剂。Nat Rev免疫学。2013;13:649–665. doi:10.1038/nri3499。[内政部] [公共医学] [谷歌学者]
-
21Lee CZ、Xue Z、Zhu Y、Yang GY、Young WL。基质金属蛋白酶-9抑制减弱血管内皮生长因子诱导的脑出血。(打、击等的)一下。2007;38:2563–2568. doi:10.1161/STROKEAHA.106.481515。[内政部] [公共医学] [谷歌学者]
-
22McColl BW,Rothwell NJ,Allan SM。小鼠实验性中风后,全身炎症改变了脑血管紧密连接破坏的动力学。神经科学杂志。2008;28:9451–9462. doi:10.1523/JNEUROSCI.2674-08.2008。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
23Loffek S、Schilling O、Franzke CW。基质金属蛋白酶的生物学作用:关键平衡。《欧洲复兴期刊》2011;38:191–208. doi:10.1183/09031936.00146510。[内政部] [公共医学] [谷歌学者]
-
24Vandooren J、Van den Steen PE、Opdenakker G.明胶酶B或基质金属蛋白酶-9(MMP-9)的生物化学和分子生物学:未来十年。生物化学与分子生物学评论。2013;48:222–272. doi:10.3109/10409238.2013.770819。[内政部] [公共医学] [谷歌学者]
-
25Ahmad R、Shihab PK、Jasem S、Behbehani K.FSL-1通过TLR-2和NF-kappaB/AP-1信号通路诱导单核细胞THP-1细胞产生MMP-9。细胞生理生化。2014;34:929–942. doi:10.1159/000366310。[内政部] [公共医学] [谷歌学者]
-
26蒋C,徐M,匡X,等。梅毒螺旋体鞭毛蛋白通过TLR5和MAPK/NF-kappaB信号通路刺激人表皮角质形成细胞中MMP-9和MMP-13的表达。Exp Cell Res.2017 doi:10.1016/j.yexcr.2017.09.040。[内政部] [公共医学] [谷歌学者]
-
27Shihab PK、Al-Roub A、Al-Ghanim M、Al-Mass A、Behbehani K、Ahmad R.TLR2和AP-1/NF-kappaB参与了人类单核细胞THP-1细胞中热杀李斯特菌诱导的MMP-9的调节。《国际火灾杂志》(伦敦)2015;12:32. doi:10.1186/s12950-015-0077-0。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
28Liu J,Jin X,Liu KJ,Liu W.基质金属蛋白酶-2介导的闭塞素降解和小窝蛋白-1介导的克劳丁-5再分布有助于缺血性卒中早期血脑屏障损伤。神经科学杂志。2012;32:3044–3057. doi:10.1523/JNEUROSCI.6409-11.2012。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
29Harkness KA,Adamson P,Sussman JD,Davies-Jones GA,Greenwood J,Woodroof MN。地塞米松对中枢神经系统血管内皮基质金属蛋白酶表达的调节。大脑。2000;123(第4部分):698–709。doi:10.1093/brain/123.4.698。[内政部] [公共医学] [谷歌学者]
-
30Asahi M,Wang X,Mori T,等。基质金属蛋白酶-9基因敲除对脑缺血后血脑屏障和白质成分蛋白水解的影响。神经科学杂志。2001;21:7724–7732. doi:10.1523/JNEUROSCI.21-19-07724.2001。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
31Jin MS,Kim SE,Heo JY,等。三酰化脂肽结合诱导的TLR1-TLR2异二聚体的晶体结构。单元格。2007;130:1071–1082. doi:10.1016/j.cell.2007.09.008。[内政部] [公共医学] [谷歌学者]
-
32Okun E、Griffoen KJ、Lathia JD、Tang S、Mattson MP、Arumugam TV。神经变性中的Toll样受体。脑研究评论2009;59:278–292. doi:10.1016/j.brainesrev.2008.09.001。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
33.Fukao T、Koyasu S.PI3K和TLR信号的负调控。趋势免疫。2003;24:358–363. doi:10.1016/S1471-4906(03)00139-X。[内政部] [公共医学] [谷歌学者]






