摘要 组蛋白去乙酰化酶(HDAC)抑制剂vorinostat作为一种用于治疗实体肿瘤的“表观”药物近年来受到了广泛关注。 然而,其作用机制尚不完全清楚,尤其是其与伴随肿瘤进展的三维核结构畸变的相互作用。 我们研究了vorinostat对来自正常、化生(癌前)和恶性组织的人类食管上皮细胞系的影响。 使用基于新型光学计算机断层扫描(CT)的定量3D吸收显微镜和传统共焦荧光显微镜的组合,我们表明恶性细胞优先接受伏立尼达治疗,从而改变其相对于非癌细胞的3D核结构。 固定单个细胞的光学CT(细胞CT)成像显示,药物治疗的癌细胞在核形态计量学方面表现出显著的变化。 共焦显微镜显示,伏立诺达引起H3K9ac标记的常染色质和H3K9标记的组成性异染色质分布的变化。 此外,3D免疫FISH显示,药物诱导的DNA修复基因MGMT的表达伴随着在化生细胞核中向细胞核中心的空间重新定位,但在非肿瘤细胞中没有。 我们的数据表明,vorinostat对正常和异常细胞三维核结构的差异调节可能在其抗癌作用中发挥功能作用。
组蛋白去乙酰化酶(HDAC)酶在许多上皮癌中的异常表达,包括肺癌、乳腺癌、胃肠道癌、前列腺癌和卵巢癌 1 , 2 , 三 , 4 ,激发了人们对HDAC抑制剂(HDACi)作为治疗药物的潜在用途的兴趣。 Vorinostat是美国食品和药物管理局(FDA)批准的首个治疗晚期皮肤T细胞淋巴瘤(CTCL)的HDAC抑制剂 5 , 6 众所周知,它可以抑制I类和II类HDAC酶的活性,并且是多个临床试验的焦点,作为实体肿瘤的潜在单药或联合药物治疗 7 大量研究表明伏立诺通过多种复杂的抗癌机制发挥作用。 除了引起组蛋白乙酰化导致基因表达的改变外,伏立诺抑制增殖,诱导分化,导致细胞周期阻滞,导致微摩尔浓度下的双链断裂,并触发癌细胞的凋亡和自噬 8 , 9 , 10 , 11 机制研究表明,许多非组蛋白,包括STAT和Bcl-2蛋白家族、HSP90、β-catenin和HIF1-α,是药物作用的关键因素。 然而,目前尚不清楚乙酰化诱导的染色质结构重排是如何促进伏利诺司他的作用机制的。
染色质被认为在空间上被组织成高阶结构,最终在细胞核内表现出非随机三维(3D)组织 12 3D基因组通过与核膜中的蛋白质结合来调节核形状 13 基因组的三维空间组织也在基因表达的表观遗传控制中发挥作用 14 , 15 , 16 , 17 , 18 荧光显微镜和图像分析的进步使得能够识别不同癌症的基因组区域组织中的特定模式 19 , 20 , 21 这些分析能力促进了细胞学尺度畸变(如核形状和大小)与高阶染色质组织之间的更密切联系。 固定细胞的单细胞光学计算机断层扫描技术的创新使三维定量各向同性吸收测量成为可能 22 这与临床相关,因为它将潜在的染色质重组与病理学家传统上用于定性诊断恶性肿瘤的参数联系在一起,这些参数基于苏木精和伊红(H&E)等吸收染料的染色 23 .
对于伏立诺达如何影响从正常到癌前再到癌症的细胞三维核结构,以及核结构中与恶性肿瘤相关的变化是否或如何调节药物的癌症特异性药理作用,我们知之甚少。 一些先前的研究应用荧光显微镜方法报告了HDAC抑制剂曲古菌素A或丁酸钠治疗后上皮细胞中细胞学尺度的染色质去凝聚 24 , 25 , 26 , 27 .科尔滕霍斯特 等 .使用2D吸收模式显微镜显示,HDAC抑制剂丙戊酸治疗可导致前列腺癌细胞2D核结构的剂量依赖性改变 28 vorinostat引起的基因表达改变与乙酰化组蛋白的位点特异性积累相关 29 组蛋白修饰模式的改变通常被认为导致相应基因组位点的高阶结构重组。 然而,这并没有明确显示。 此外,还没有关于临床相关剂量伏立诺对癌上皮细胞相对于正常和癌前上皮细胞的三维核结构的影响的对比分析报告。 因此,染色质重组沿肿瘤进展谱的程度和模式尚不清楚。
我们结合了新颖和传统的定量显微镜方法来研究这些问题。 首先,我们使用高分辨率单细胞光学CT成像 30 固定细胞和自动形态分析,以准确量化与临床相关剂量的伏立诺对hTERT-永生鳞状细胞(以下简称“正常”)、癌前和恶性食管上皮细胞系的3D核结构的影响。 单细胞光学CT产生的图像具有亚微米各向同性分辨率(即沿所有三个轴具有相同的空间分辨率)。 细胞CT生成一个球形点扩散函数(PSF),该函数能够对所有三个空间维度的形态进行定向相关量化,这是传统成像模式无法实现的。 其次,我们应用基于共焦显微镜的定量3D免疫-FISH来评估恶性肿瘤是否以及如何影响药物诱导的3D核结构变化和基因表达之间的相互作用。 我们报告了接触相同剂量伏立诺达后,恶性和非恶性细胞的3D核结构模式之间的显著差异。 与癌前细胞和正常细胞相比,经Drug处理的癌细胞在重要的诊断形态学参数(如核大小(体积)、核-细胞质比和染色质团块)的大小和异质性方面表现出泛相间相减少。 此外,vorinostat诱导的DNA修复基因MGMT的表达伴随着其与H3K9ac标记的常染色质结构域在癌前细胞和恶性细胞(而非正常细胞)中共同定位的增加,以及癌前细胞中基因位点的向内空间重定位。 我们的结果强调了量化三维核结构在监测细胞对伏立诺达反应中的作用,并提供证据支持核结构在伏立诺塔抗癌机制中的功能作用。
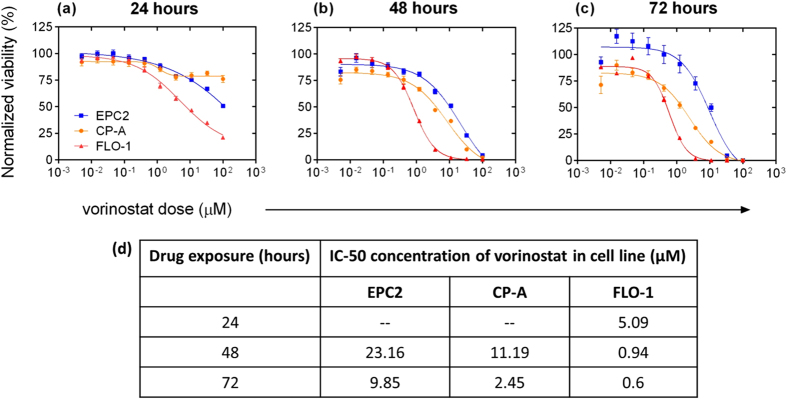
结果 Vorinostat降低食管腺癌细胞相对于化生和正常鳞状上皮细胞的活性 为了评估伏立诺对食管腺癌的抑制作用,我们测量了正常鳞状细胞(EPC2)、化生巴雷特(CP-A)和食管腺癌(FLO-1)细胞株在三个时间点(24、48和72小时)对伏立诺浓度增加(100 nM至1 mM)的敏感性。 所有三个时间点的药物剂量反应(DDR)曲线( 图1(a–c) )以及相应的IC50浓度( 图1(d) )发现与化生CP-A和正常鳞状EPC2细胞相比,FLO-1癌细胞对药物始终最敏感(即IC50浓度最低)。 我们为随后的实验选择了48小时的时间点,因为这是FLO-1产生乙状曲线的最短时间。 此时,FLO-1细胞所需的伏立诺达IC50浓度(0.94μM)比CP-A细胞(11.19μM)低11倍,是EPC2细胞(23.16μM)的24倍。
图1。 相对于化生CP-A和正常鳞状EPC2细胞,伏立诺达降低FLO-1食管腺癌细胞的活性。
以下情况后的药物剂量反应(DDR)曲线:( 一 ) 24, ( b条 )48和( c(c) )72小时伏立诺达暴露。 ( d日 )与CP-a和EPC2相比,FLO-1细胞的IC-50值明显较低。 EPC2和CP-A细胞在( d日 )表明此时这些细胞对药物的反应最小。 在将细胞生长归一化为单独细胞生长和使用载体对照DMSO后,使用Prism 6(Graphpad Software,San Diego,CA)中的剂量-反应-抑制可变斜率函数对所得数据(每个剂量n=6)进行分析。 误差条表示平均值的标准误差(SEM)。
Vorinostat治疗优先影响腺癌细胞相对于间期化生细胞和正常细胞的三维核结构 作为评估伏立诺达对正常和异常细胞三维间期核结构影响的第一步,我们应用单细胞光学计算机断层扫描(CT)成像和定制的三维自动图像分析方法,准确量化固定苏木精染色细胞的三维核结构, 并评估与载体对照(DMSO)相比,伏立尼撒处理细胞的形态异质性。 模拟临床相关的治疗方案,我们对非同步、间期EPC2、CP-a和FLO-1细胞进行了实验,这些细胞受到FLO-1癌细胞IC50药物浓度的影响。 此外,我们使用苏木精染色细胞,评估了以下与临床病理相关的诊断相关形态学参数:细胞核大小(体积以立方微米为单位)、核质比(NC)、核形状凸度(测量核形状的不规则性)、, 以及致密核内团块的数量(以反映染色质结构)。 体积光学CT图像中用于定量测量这些参数的公式定义为 补充表S1 .
对每种细胞类型每种情况下200个细胞的三维形态学分析揭示了几个有趣的趋势,表明药物治疗癌症(FLO-1)细胞相对于化生(CP-A)和正常鳞状细胞(EPC2)细胞的形态学变化更为显著。 我们的结果由具有代表性的体积渲染汇总而成( 图2 ),直方图( 图3 ),以及计算出的形态参数的统计( 表1 ).
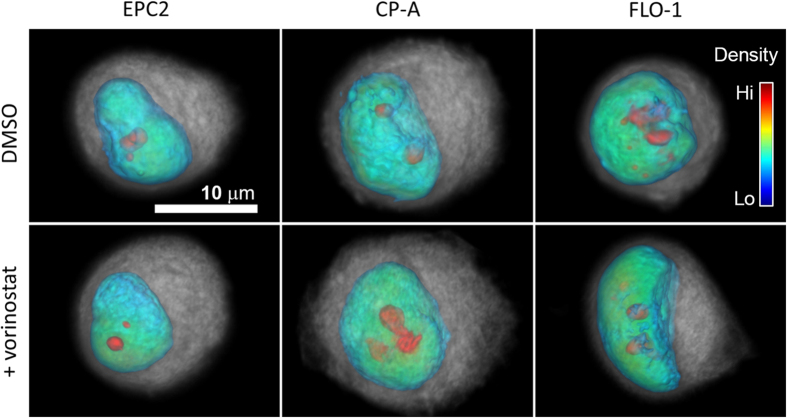
图2。 与化生和正常食管鳞状上皮细胞相比,伏立诺治疗优先降低FLO-1癌细胞的核大小和核内团块。
单细胞光学CT成像细胞的代表性体积渲染图显示了DMSO处理(顶行)和伏立尼撒处理(底行)EPC2(左列)、CP-A(中列)和FLO-1(右列)细胞的表面形态和核内部。 细胞质是灰色的,核膜是蓝色的,核密度增加的颜色由绿色变为红色,如颜色刻度条所示。
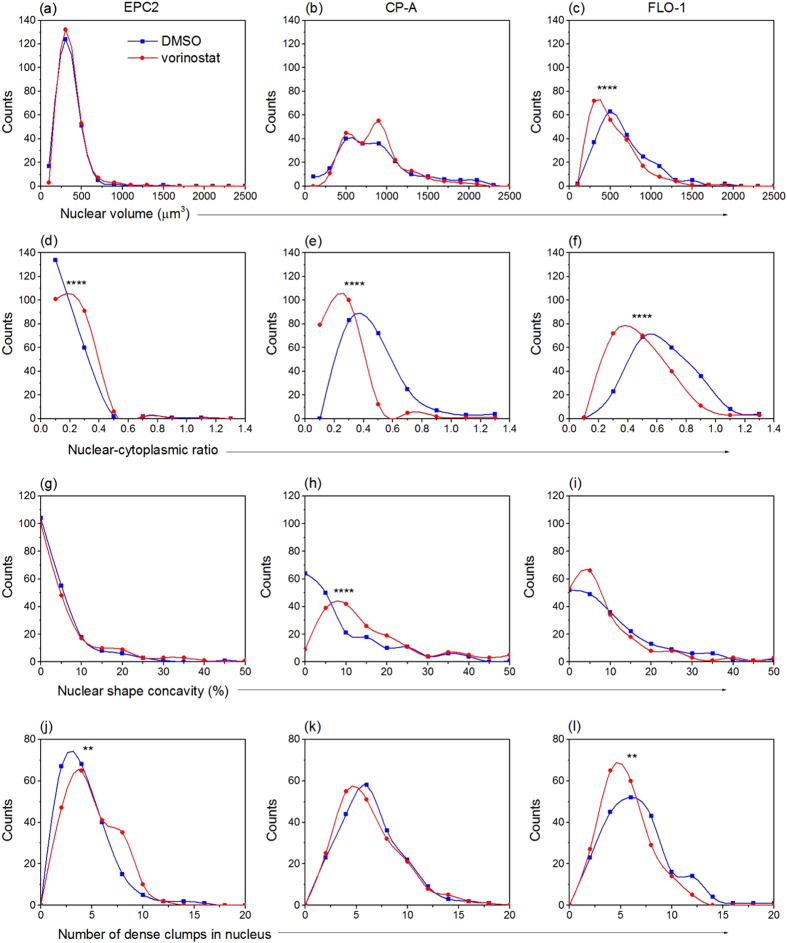
图3。 Vorinostat治疗可不同程度地改变正常鳞状细胞(EPC2)、化生Barrett’s(CP-A)和腺癌(FLO-1)食管上皮细胞的3D核结构和异质性。
直方图显示了0.94μM伏里诺施塔特(红色曲线)对以下方面的影响:( 一 – c(c) )核体积; ( d日 – (f) )核质比; ( 克 – 我 )核形状凹陷; ( j-l型 )与二甲基亚砜处理的细胞相比,细胞核内团块的数量和形态异质性(蓝色曲线)。 P值指标:**P<0.01,***P<0.0001。 治疗后,所有三种细胞类型的NC比率都出现了统计上显著的变化; 在EPC2细胞中NC比率增加,在CP-A和FLO-1细胞中降低。 经处理的FLO-1细胞还表现出核体积和核内团块减少。 药物暴露还导致CP-A细胞核明显变得更凹形,并导致EPC2细胞核内的核内团块增加。 每个条件下200个细胞生成直方图。 使用Mann-Whitney检验在Prism6中分析数据。
表1。 根据未同步hTERT转化的鳞状细胞(EPC2)、化生细胞(CP-A)和腺癌细胞(FLO-1)的3D光学CT图像得出的与诊断相关的形态计量学测量值的统计数据,食管上皮细胞经载体对照(DMSO)和伏立诺达(vstat)治疗。
形态描述符 处理情况 定量(平均值±平均值标准误差)
EPC2-hTERT(正常) CP-A(化生) FLO-1(癌症)
核体积(μm 三 ) 二甲基亚砜 356.8 ± 10.3 953.3 ± 46.8 672.7 ± 22.9
vstat公司 381.6 ± 10.4 896 ± 42.6 553.2 ± 20.5
核质比 二甲基亚砜 0.19 ± 0.01 0.52 ± 0.02 0.65±0.02
vstat公司 0.22 ± .01 0.26 ± 0.01 0.51 ± 0.01
核形状凹度(%) 二甲基亚砜 6.3 ± 1.1 12.7 ± 1.3 11 ± 0.8
vstat公司 8.2 ± 1.2 27.1 ± 2.4 9.5 ± 0.8
细胞核中致密团块的数量 二甲基亚砜 3.9 ± 0.18 6.1 ± 0.24 6.1 ± 0.23
vstat公司 4.5 ± 0.17 5.8 ± 0.22 5 ± 0.17
我们发现FLO-1细胞的核尺寸显著减小(从672.7±22.9μm 三 至553.2±20.5μm 三 ,p<0.0001),而该参数在EPC2和CP-A细胞中不受影响。 然而,所有三种细胞类型的NC比率都发生了统计上显著的变化(p<0.0001, 表1 )治疗后。 药物处理的FLO-1和CP-A细胞的NC比率降低,令人惊讶的是,在正常EPC2细胞中增加,表明后者的细胞体积显著减少。 用核形状凹度指数测量的三维核形状变化在药物治疗的正常细胞和癌细胞中没有明显变化,但在化生细胞中显著增加(从12.7±1.3%增加到27.1±2.4%,p<0.0001)。 暴露于该药物还导致三种细胞类型之间核内含量的核内团块(通过核内致密团块的数量测量)产生不同的反应。 结块减少(p=0.0017, 表1 )在治疗后的癌细胞中,化生细胞未受影响,而在正常鳞状细胞中增加(p=0.00063)。
我们比较了凝胶悬浮细胞的光学CT图像中vorinostat诱导的核重组的细胞学尺度观察结果,以及粘附的EPC2、CP-A和FLO-1细胞的常规共焦荧光显微镜成像,这些细胞免疫标记了与核形状和高阶染色质结构相关的蛋白。 具体来说,我们标记层粘连蛋白A/C来标记核层; 组蛋白标记H3K9ac、H3K9-me3和H3K27me3,分别显示常染色质、组成性异染色质和兼性异染质; 和原纤维蛋白来识别核仁区域。 我们仅在CP-a细胞亚群中观察到核形状凹陷和核表面起伏增加,而在EPC2或FLO-1细胞中没有观察到( 补充图S1 ). 同样,经药物处理的FLO-1细胞表现出H3K9ac的表达和扩散定位增加,H3K9 me3的外周定位突出,纤维蛋白阳性结构的数量和大小减少。 H3K27me3定位与溶媒对照相比没有明显变化,这表明它可能与细胞学尺度上观察到的笨拙变化无关。 CP-A和EPC2细胞核在这些染色质蛋白模式中表现出最小的变化。
为了评估这些蛋白的空间定位模式是否与药物治疗后其表达的变化相关,我们通过传统的基于细胞块的免疫印迹法测量了上述免疫标记蛋白靶点的总表达。 正如预期的那样,我们观察到活性组蛋白标记H3K9ac(p<0.0001)和H3K4me2(p<000001)的表达仅在药物处理的FLO-1细胞中增加,而在其他细胞类型中没有增加( 补充图S2 ). 有趣的是,H3K9me3和H3K27me3的表达水平在大细胞水平上没有明显变化(数据未显示)。 类似地,层粘连蛋白的免疫印迹显示,在药物治疗的FLO-1细胞中,层粘着蛋白A/C和层粘连B2的表达没有变化。 然而,我们观察到这些细胞中层粘连蛋白B1的表达减少(与CP-a或EPC2相比p<0.00001),这可能与细胞核大小的减少有关。 综上所述,这些结果表明,vorinostat诱导的基因组空间重组可能与基因组结构相关蛋白质表达水平的变化没有那么大的关系,因为它与改变的空间定位有关。
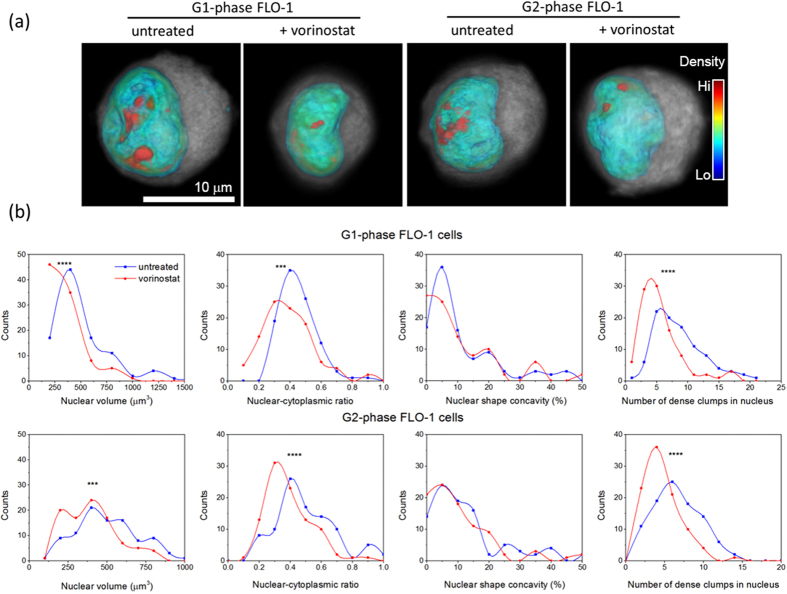
在细胞周期的G1期和G2期,腺癌细胞中涡旋诱导的3D核结构改变均保持不变 接下来,我们检查了伏立诺达对FLO-1癌细胞核结构的形态学影响是否是药物诱导的细胞周期改变的结果。 Hoechst染色的FLO-1细胞的荧光激活细胞分选(FACS)在处理后未发现任何明显的细胞周期阻滞或衰老诱导( 补充图S3 , 补充表S2 )与DMSO处理的细胞相比。 随后,我们重复了我们的单细胞光学CT成像和分析程序,以评估未经治疗和伏立诺治疗的FLO-1细胞群在细胞周期G1期和G2期的三维核结构。 对大约100个未经治疗和伏立诺治疗的FLO-1癌细胞进行的形态计量分析显示,在两个阶段,经药物治疗的癌细胞的核大小、NC比率和核内团块均有统计学意义上的显著减少( 图4 和 表2 ). 药物诱导的细胞核大小下降在G1期更为明显,而与G1期相比,G2期的NC比率下降幅度更大。 两个阶段的核内团块减少程度相同,而核形状的整体差异不显著。 这些结果表明,在FLO-1细胞的间期中,细胞核的大小和团块的减少持续存在。
图4。 FLO-1食管腺癌细胞在细胞周期的G1期和G2期均发生旋涡状态诱导的3D核结构改变。
( 一 )单细胞光学CT成像细胞的代表性假彩色容积渲染图显示,与细胞周期G1期和G2期的未经处理的FLO-1细胞相比,经vorinostat处理的FLO-1细胞的表面形态和核内部更光滑。 细胞质是灰色的,核膜是蓝色的,核密度增加的颜色由绿色变为红色,如色标条所示。 ( b条 )与未处理细胞相比,伏立康唑处理(红色曲线)的细胞核大小、核细胞质(NC)比率、核形状凹度和核内团块数量的形态异质性直方图(蓝色曲线)。 每个条件下100个细胞生成直方图。 P值用*表示:***P<0.001,****P<0.0001。 使用Mann-Whitney检验在Prism6中分析数据。
表2。 根据未经治疗和伏立诺达(vstat)治疗的腺癌(FLO-1)食管上皮细胞在细胞周期G1和G2期的3D光学CT图像得出的诊断相关形态测量数据的统计。
形态描述符 处理情况 定量(平均值±平均值的标准误差)
地面-1 G1 FLO-1 G2层
核体积(μm 三 ) 未经处理的 516.3 ± 28.1 503 ± 19.5
vstat公司 343 ± 17.5 407 ± 16.5
核质比 未经处理的 0.45 ± 0.01 0.51 ± 0.02
vstat公司 0.39 ± 0.02 0.39 ± 0.01
核形状凹度(%) 未经处理的 11.1 ± 1.2 15 ± 1.7
vstat公司 12.6 ± 1.7 13.6 ± 1.9
核内致密团块的数量 未经处理的 8.5 ± 0.5 6.1 ± 0.3
vstat公司 5.1 ± 0.3 4.2 ± 0.2
Vorinostat减少腺癌细胞的形态异质性 我们使用光学CT成像评估药物暴露对3D核形态异质性的影响。 图中所示三种细胞类型的测量形态参数直方图的比较 图3 以及相应的方法和标准误差 表1 发现药物治疗的FLO-1癌细胞受影响参数的异质性降低最为显著。 药物治疗后,化生CP-A细胞异质性下降最为显著,而正常鳞状细胞EPC2细胞异质性变化最小。
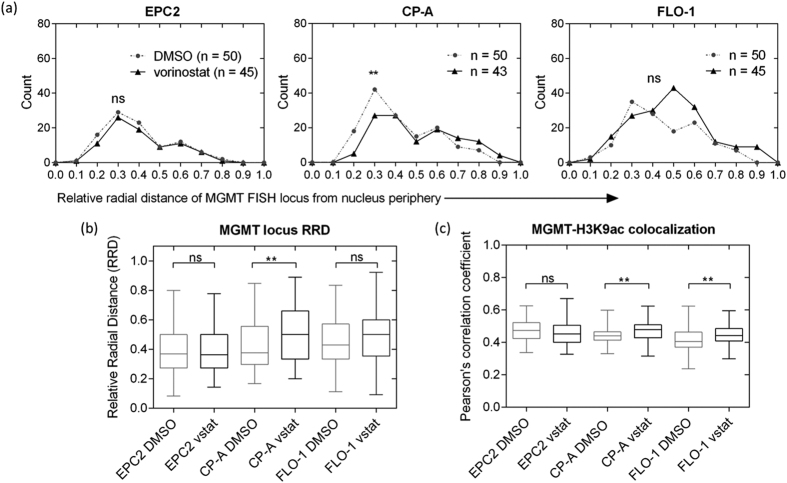
旋涡抑制诱导的DNA修复基因MGMT的表达伴随着该基因在正常和异常食管上皮细胞中的差异性重新定位 为了研究肿瘤进展中的核结构改变与伏诺司他诱导的基因表达之间的相互作用,我们通过3D免疫FISH和图像分析量化了正常EPC2、化生CP-A和恶性FLO-1食管上皮细胞中的基因位置。 我们选择了一组候选基因( 补充表S3 )基于他们在Barrett食管和食管腺癌中的异常表达。 伏立诺达治疗和DMSO对照正常化后,通过RT-qPCR对该候选列表的基因表达进行评估,结果显示所有细胞系中都诱导了MGMT的表达,与CP-a和EPC2中观察到的约2倍和5倍的表达相比,FLO-1的表达增加了12倍( 补充图S4 ). 与CP-A或EPC2的反应相比,伏诺司他治疗后FLO-1中MGMT表达的增加是显著的(两种比较均<0.0001)。 在Barrett食管和食管腺癌中,MGMT被甲基化异常沉默 31 然后,我们使用免疫-FISH标记所有三种细胞类型中的MGMT位点和H3K9ac标记的常染色质域,通过共焦显微镜对细胞成像, 并在共聚焦z堆栈上进行定量图像分析,以测量MGMT基因位点的核重定位程度及其与H3K9ac标记的常染色质结构域的共定位。 我们观察到正常和异常细胞之间MGMT的核重定位以及H3K9ac共定位的差异趋势。 药物暴露后,MGMT基因位点在CP-A细胞核中靠近几何核中心,但在EPC2细胞中没有移动( 图5a ). 在FLO-1细胞中,观察到伏利诺司他暴露后有向细胞核中心移动的趋势,但这种变化不符合我们的统计显著性标准(p=0.06)。 有趣的是,虽然载体和药物处理的相对径向距离(RRD)的CP-A分布都是明显的非高斯分布(分别为A=2.4188,p值=3.794e-06和A=1.7438,p值=0.000172),但在用伏诺司他治疗后,RRD在FLO-1中的分布变为高斯分布。 二甲基亚砜处理的FLO-1中MGMT基因的位置明显非高斯(A=0.94,p=0.01679),而伏立诺达处理的细胞具有正态分布的RRD(A=0.59,p=0.1198),总体上人口的位置趋于中位( 图5a ). 在3种细胞类型中,药物处理的FLO-1细胞核在基因重新定位方面表现出最大的异质性( 图5b ). FLO-1细胞观察到的趋势可能归因于其在该位点的固有非整倍性(即该基因存在n>2个等位基因)。 没有理由预设 先验的 任何给定细胞中的所有等位基因都会转录激活,因此会重新定位。 共刻度分析( 图5c )在药物治疗的CP-a和FLO-1细胞中,MGMT与H3K9ac的空间相关性在统计学上显著增加(p<0.01),而EPC2细胞没有变化。 正常细胞和异常细胞之间的这些差异趋势共同表明,3D核结构中与恶性肿瘤相关的变化可能会影响vorinostat诱导的基因表达增加。
图5。 伏立诺达暴露后MGMT表达增加伴随着基因位点的差异性重新定位以及正常和异常食管上皮细胞之间的H3K9ac协同定位。
( 一 )直方图显示了在DMSO(点灰色)和vorinostat(黑色)处理的正常EPC2、化生CP-A和恶性FLO-1细胞中MGMT位点的核定位趋势。 核位置使用相对径向距离(RRD)度量计算(0=外围,1=中心)。 伏立诺达暴露后,MGMT位点向CP-A的核内部移动,但在EPC2或FLO-1细胞中没有移动。 P值用*表示:ns=不显著(P>0.05),**P<0.01。 在FLO-1中接触伏立诺司他改变了RRD的分布,使其成为正态分布(A=0.5933,p值=0.1198)。 在CP-A中没有看到类似的结果( b条 )盒形图反映了伏立诺达治疗前后每种细胞类型中MGMT位点核位置的异质性程度。 与CP-A和EPC2细胞相比,经处理的FLO-1细胞核在MGMT的核位置上表现出最大的异质性。 ( c(c) )方框图显示,在药物处理的CP-a和FLO-1细胞中,MGMT与H3K9ac标记的常染色质结构域的共定位显著更高(p<0.01),而EPC2细胞中没有变化。 通过MGMT FISH和H3K9ac染色的像素强度的Pearson相关性评估Co-localization。 使用Kolmogorov-Smirnoff(KS)非参数检验分析频率分布。
讨论 过去十年来的技术进步使人们能够更好地理解基因组的三维空间结构、其与恶性肿瘤的变化及其在调节基因表达中的作用。 然而,这些方面只是在众多的机制研究中被稀疏地考虑在内,这些研究是为了破译伏立诺达的肿瘤特异性作用。 因此,我们试图研究HDAC抑制剂药物vorinostat与食管上皮细胞3D间期核结构改变之间的相互作用,这些改变沿着从正常鳞状细胞到Barrett食管和食管腺癌的进展谱发生。 在这项研究中,我们定量地证明了临床相关剂量的伏诺司他对正常、癌前(化生)和恶性食管上皮细胞系的细胞学规模、3D间期核结构及其异质性有不同的影响。 暴露于IC50浓度的药物后,恶性细胞优先表现出与癌前细胞和正常细胞相关的诊断相关形态学参数(如核体积、核质比和核内染色质团块)的大小和异质性显著降低。 共焦显微镜显示,vorinostat介导了H3K9ac标记的常染色质在恶性细胞相对于非恶性细胞中更广泛的空间定位,以及H3K9 me3标记的组成性异染色质在恶性肿瘤中的外围定位略有增加。 暴露后的这些差异性变化构成了由药物引起的细胞学水平的癌细胞特异性基因组重组。 在细胞周期的G1期和G2期富集的恶性细胞中观察到的核结构变化趋势的一致性表明,这些现象与潜在的药物诱导的细胞周期阻滞或衰老无关。 此外,我们发现MGMT基因的药物诱导表达与其与H3K9ac标记的常染色质结构域在癌前和恶性细胞中的共定位增加有关,但在正常细胞中没有。 此外,该基因在化生细胞中优先向内核重定位。 在癌细胞中,基因定位没有显著变化,但这些细胞中存在基因位置的重新分布。 这些结果表明三维核结构在vorinostat对食管上皮细胞的肿瘤选择性作用中具有功能性作用。 它们还首次证明了三维核形态计量学作为定量读数的实用性,以评估腺癌患者对伏立诺治疗的细胞反应。
本研究中使用的基于光学CT的3D成像和形态计量学方法使得病理学家在临床上常用的基于苏木精染色的细胞核形态学观察与研究团体的荧光显微镜观察之间具有密切的相关性。 使用光学CT以亚微米、各向同性空间分辨率对固定苏木精染色细胞进行体积成像,可以快速准确地评估细胞学尺度上的三维核结构及其异质性。 该技术固有的空间分辨率各向同性排除了图像插值程序的需要,该程序可以人工合成具有各向同性体素尺寸的三维共焦显微镜图像。 在处理前后生成准确、定量的3D核形态计量学的能力允许生成健壮的形态特征。 该方法有望用于监测或预测伏立诺达或其他药物治疗的疗效。 沃利诺司他作为敏化剂在联合治疗中的临床应用部分是由于其引起的核结构的可观察变化。 通过追踪患者,通过连续活检或循环肿瘤细胞,并分析细胞群的核结构,我们不仅可以确定有多少细胞对vorinostat有反应,还可以确定这些细胞是否代表肿瘤的恶性、增生或正常成分。 这种单细胞分析在检测感兴趣细胞的能力因大量正常或非目标细胞的存在而受到干扰的情况下特别有用。 本研究中通过定量3D免疫-FISH测量药物诱导的高阶基因组结构变化也可能是评估治疗反应的有用工具。
我们的研究表明伏立诺作为单一治疗剂治疗Barrett食管和食管腺癌可能有效。 尽管沃利诺司他已被证明对血液系统恶性肿瘤有效,并在许多协同治疗干预试验中得到证实,但关于沃利诺司他对食管腺癌(EA)的影响尚不清楚。 恶性食管上皮细胞的亚微摩尔IC50药物浓度以及相对于化生和正常鳞状细胞的大IC50差异表明vorinostat对这种癌症类型的转化细胞具有特异性。 化生鳞状细胞和正常鳞状细胞之间IC50值的两倍差异表明,该药物可能对Barrett食管病患者有益。 评估voristat治疗是否可以通过使Barrett食管细胞正常化来阻止癌前阶段食管腺癌的进展,这将是一件有趣的事情。 我们的研究还证实了伏立诺达的时间和剂量依赖性抑制活性。 FDA批准的其他HDAC抑制剂(如帕纳比诺司特)也有类似的趋势 32 .
我们从这一肿瘤进展模型系统中获得的结果通过证明该药物在上皮细胞从正常状态向恶性状态发展过程中对其高阶3D基因组结构的状态特异性影响,为vorinostat的作用机制提供了新的见解。 vorinostat治疗的恶性细胞中的3D核结构变化与其相对于治疗的癌前细胞和正常细胞的生存能力降低之间的相关性增加了恶性细胞可能实际上需要异常基因组结构才能生存和功能的可能性。 虽然组蛋白乙酰化通常被认为是“开放”染色质的标志,因此用vorinostat抑制HDAC有望通过染色质失活增加核体积,但我们的结果表明,情况更为微妙。 我们假设,伏立诺达暴露后,我们看到的核体积的减少是由于多个赖氨酸处的组蛋白乙酰化动力学以及DNA结合蛋白的破坏,导致化生细胞和癌细胞的核体积更加正常。 由于这些细胞开始时核体积明显较大,染色质结构的这些改变导致核体积减少,导致细胞核与正常细胞的大小更为相似。 为了更好地了解3D核结构的变化,未来一项有用的研究将是定期对伏立尼达治疗后的细胞进行成像,并注释其核形态。 这样的研究将提供潜在的有用信息 补充信息 在48小时时观察到的变化。
MGMT基因位置的正常和异常细胞之间的差异及其与常染色质结构域的共定位表明基因调控、核位置和癌症相关的3D核结构之间存在联系。 异常细胞中vorinostat引起的3D核结构的表观遗传破坏可能是该药物肿瘤选择性作用机制的生物物理基础。 我们对伏立诺达作用机制的研究结果和观点与正常细胞和恶性细胞固有染色质结构差异是HDAC抑制剂癌症特异性的基础这一观点一致 33 然而,这并不排除其他机制的可能性,例如不同的DNA损伤修复能力 11 或抑制中和活性氧的分子 34 其他可能的机制与我们关于不同核重组的结果一致,可能是药物治疗癌症细胞中ATP水平和pH缓冲能力的破坏。 麦克布莱恩 等 . 35 已经假设药物治疗的癌细胞可能由于染色质过乙酰化而遭受细胞内pH的失调。 我们推测,这种失调可能会扩展到细胞外pH值和细胞内ATP水平,因为众所周知,食管腺癌细胞位于低pH值环境中,与正常鳞状细胞相比,耗氧量较少 36 传感器技术可用于在未来的实验中验证这些假设 37 .
我们报告的药物处理的正常和异常细胞在核定位和MGMT H3K9ac协同定位方面的差异趋势的数据提出了关于核定位的功能意义的有趣问题。 在药物治疗的异常细胞中,该基因位点与H3K9ac标记的常染色质结构域共定位的一致性表明,基因周围的局部染色质环境比其核位置对其表达水平的影响更大。 因此,该结果重申了先前关于局部染色质环境在表观遗传学调控其表达方面可能优先于基因在细胞核内的空间位置的报道 38 对其他基因进行免疫-FISH或活细胞实验,以确定这一发现是否具有普遍性,这将是有价值的。
我们认识到,我们的一些结果与之前公布的结果形成了对比。 我们报告的经伏立康唑治疗的恶性食管上皮细胞中,随着染色质失活的增加,细胞核体积减少,这与先前报道的对曲古菌素A的反应在肺癌和结肠癌细胞中呈相反趋势的研究相矛盾 24 这可能是一种药物特异性或细胞系依赖性现象,药物处理的FLO-1细胞中可能缺乏细胞周期阻滞。 值得进一步研究的其他观察结果包括,在经药物治疗的间期正常鳞状细胞中,核-细胞质比率和核内团块的增加。 层粘连蛋白B1表达的减少,而非层粘连蛋白质B2和层粘连A/C的减少,也需要进一步分析。 最近的研究报告了DNA损伤后衰老细胞层粘连B1水平的降低 39 虽然这一方面似乎与我们的研究没有直接关系,但ChIP-seq实验可以深入了解层粘连B1缺失对癌细胞3D基因组结构的功能影响。 未来研究的另一个有益方向是评估停药后正常和异常细胞三维核结构的时间变化。 这项研究将为研究表观遗传药物作用的可逆性在多大程度上通过基因组结构的长度尺度渗透提供见解。 最后,我们认识到使用2D条件下培养的永生化细胞系来模拟Barrett食管的肿瘤进展所带来的局限性。 在3D基质中培养的细胞或从自发重演食管腺癌正常进展的小鼠模型中提取的细胞将提供更大的翻译相关性,并有助于研究微环境对基因组结构的生物物理影响。 然而,我们的研究强调需要将高阶染色质结构的时空行为及其与恶性肿瘤相关的改变纳入研究,以了解伏立诺治疗实体肿瘤的效用。
方法 细胞培养和试剂 我们之所以选择细胞系,是因为它们表现出从正常鳞状细胞到食管腺癌(EA)的肿瘤发展经过一个称为Barrett食管(BE)的化生阶段。 HDAC 1和2的异常表达在BE和EA中已有报道 40 , 41 hTERT转化的“正常”鳞状细胞(EPC2)、化生Barrett食管(CP-A)和食管腺癌(FLO-1)细胞系按照ATCC-描述的方案在37°C和5%CO的T-25烧瓶中作为单层培养 2 在给药实验之前,细胞生长到大约85%的汇合处。 在−20°C下储存之前,将伏立诺(亚苄基苯胺羟肟酸)以100 mM储备溶液的形式溶解在二甲基亚砜中。
伏诺司他治疗 EPC2、CP-A和FLO-1细胞以3000个细胞/孔的速度接种在96周板中。 24小时后,将10点、3倍的连续稀释液从100μM开始添加到平板中。 使用CellTiter Glo分析(威斯康星州麦迪逊市普罗米加)测量细胞活力。 将活性数据归一化为单独的细胞,然后是单独使用载体处理的细胞。 通过使用Prism 6(Graphpad Software,San Diego,CA)中的剂量-反应-抑制、可变斜率函数分析所得数据(每个剂量n=6),并测定50%细胞活力对应的浓度(IC50)。 该程序符合S形方程Y=底部+(顶部-底部)/(1+10^((LogIC50-X)*山坡))。 对于所有其他实验,细胞在处理前24小时用0.94μM伏立诺唑播种48小时,并在处理后立即收获用于分析。 DMSO被用作车辆控制。
细胞周期分析 用10μL/mL Hoechst 33342活细胞DNA染料对每种条件下的细胞(未处理、DMSO处理和vorinostat处理)进行染色,孵育10分钟,然后在PBS中重新悬浮。通过荧光激活细胞分选(FACS)将染色细胞分为G1和G2期。
逆转录定量PCR(RT-qPCR) 根据制造商的方案,使用Qiagen RNeasy迷你试剂盒(加利福尼亚州巴伦西亚市Qiangen)从细胞中提取总RNA。 使用iScript逆转录超级混合物(Bio-Rad,Hercules,CA)合成cDNA。 靶基因(MLH1、MGMT、CDKN2A(p16)、CDKN1A(p21)、CDH1、CDX1、CDX2、TFF3、AKAP12和EZH2)的引物购自Qiagen,正常化控制基因β-actin是定制的(支持表3)。 RT-qPCR使用SYBR-Green Master Mix(纽约格兰德岛生命科技公司)在Step One Plus平台(加利福尼亚州福斯特市应用生物系统公司)上进行。 反应按如下方式进行:在95°C下进行1个循环2分钟,然后按顺序进行40个循环:95°C(15秒)、60°C(1分钟)和72°C(30秒)。 使用Pfaffl方法分析采集的数据 42 获得靶基因相对于对照基因的表达水平。
免疫印迹法 使用含有1%原钒酸钠和蛋白酶抑制剂的RIPA缓冲液溶解细胞,转移到2 mL Eppendorf试管中,在4°C下旋转培养30分钟,然后离心。 使用Pierce BCA蛋白质检测试剂盒(马萨诸塞州沃尔瑟姆赛默费希尔23225)定量蛋白质浓度。 将提取的蛋白质装入30μL孔的4–15%固定化蛋白质凝胶(446–1083,Bio-Rad,Hercules,CA)中,电泳后转移到固定化PVDF膜。 在Licor阻断缓冲液(927–40000,LI-COR,Lincoln,NE)中封闭膜一小时,用适当的一级抗体在4°C下培养过夜,用0.1%吐温20在PBS(PBST)中洗涤四次,最后用适当的二级抗体(Licor IRDye 680/800)培养一小时。 以下蛋白质在每种条件下进行了三次实验:H3K9ac(Millipore,#06–942)、H3K9 me3(Abcam,Cambridge,MA,ab8898)、H3 K27me3(Millipore,#07–449)、层粘连蛋白A/C(Cell Signaling Technology,Danvers,MA),#2032)、层黏蛋白B1(Abcan,ab16048)和层粘连蛋白质B2(Abcam,ab8983)。 β-肌动蛋白(Sigma-Aldrich,A2103)用作负荷对照。 使用Odyssey平台和软件(LI-COR)对斑点进行成像和量化。
免疫荧光 细胞培养在1.5厚的矩形覆盖玻璃上。 在免疫标记之前,用新制备的2%甲醛固定细胞5分钟,用Karsenti's缓冲液(0.5%Triton X-100,80 mM PIPES,1.0 mM MgSO4,5.0 mM EGTA,pH 7.0)渗透2分钟,再用2%甲醛固定2分钟 分钟,用PBST冲洗3次,然后用1%牛血清白蛋白(BSA)和5%正常山羊血清在PBST中封闭30分钟。 随后在室温下或4°C下过夜,用1%BSA稀释在PBST中的初级抗体孵育2小时,然后孵育1-2小时,对细胞进行免疫标记 在含有1%BSA的PBST中稀释的适当AlexaFluor™结合二级抗体(Life Technologies)中放置小时。免疫标记细胞核最终在室温下用10μg/mL DAPI反染20分钟。 每个标记步骤后,细胞在PBST中漂洗3次,最后一步后在PBS中再漂洗2次。 最后,将盖玻片安装在磷酸盐缓冲的90%甘油中的玻璃载玻片上,并用透明指甲油密封。 评估以下蛋白质的空间定位:层粘连蛋白A/C(Santa Cruz,sc-7292)、纤维蛋白(Abcam,ab4566)、H3K9ac(Millipore,#06–942)、H3 K9me3(Abcam,ab8898和Novus Biologicals,NBP1-30141)和H3K27me3(阿布cam,ab6002和Millipore,#07–449)。 染色细胞用60×1.2NA水浸透镜通过激光共聚焦扫描成像。 所有实验均一式三份。 图像采集设置在细胞系和治疗中保持一致。 使用尼康NIS Elements软件包对图像进行后处理。
单细胞光学CT成像和三维核形态测量 Cell-CT™平台(VisionGate,Phoenix,AZ)用于执行快速单细胞光学CT成像。 这种基于吸收的成像方式可以以各向同性亚微米空间分辨率生成固定和染色的单个细胞的3D图像 30 与传统的通过堆叠2D图像生成体积图像的方法(例如,宽视野或共焦显微镜)不同,光学CT中的3D图像是通过500个角度伪投影的层析重建生成的,这些伪投影是在旋转玻璃毛细管内的固定染色单细胞。 补充图S5 演示了共焦显微镜由于沿光轴的空间分辨率较低而导致的形态畸变,以及光学细胞CT成像固有的各向同性分辨率是如何克服这一问题的。 样品制备和图像采集协议已在前面描述 43 简单地说,用Cytyc(马萨诸塞州马尔堡市Cystyc)将胰蛋白酶化细胞固定1小时。 固定细胞用6.25%w/w苏木精染色,嵌入光学凝胶(Smartgel,Nye,Fairhaven,MA)中,并装入100μL玻璃注射器中。 使用Cell CT™对相间细胞进行断层成像,并使用Matlab(2011a版,Mathworks,Natick,MA)对重建的3D图像进行自动形态学分析,以量化细胞特征(定义见 补充表1 ). 对每种情况下(对照组、车用治疗组和药物治疗组)的200个细胞进行非同步化EPC2、CP-A和FLO-1细胞的分析。 此外,100个对照和药物处理的FLO-1细胞在FACS分类后进行成像,以在细胞周期的G1和G2期富集。
3D荧光 现场 杂交(FISH)和图像分析 TAMARA标记的FISH探针(RP11-809J17和RP11-779G23)购自Empire Genomics(纽约州罗斯维尔公园)。 细胞生长在隔间盖玻片中,并接受3D免疫荧光 44 同时标记目标基因的核位置,并评估其与组蛋白标记H3K9ac表示的常染色域的共定位。 粘附细胞在室温下在4%甲醛中固定10分钟,用PBS洗涤3次,用0.5%Triton X-100在PBS中渗透15分钟,用4%BSA在PBS室温下封闭10分钟,在37°C与一抗孵育1小时,洗涤2次(5 分钟),与AlexaFluor 488结合的山羊抗兔IgG二级抗体(A-11034,Life Technologies)孵育1小时,并用PBST洗涤两次。为了准备FISH,然后将细胞在1%甲醛中固定10分钟,并在0.5%Triton X-100中再次渗透5分钟。 然后在室温下将载玻片在0.1M HCl中培养7至10分钟,用2X盐柠檬酸钠(SSC)洗涤两次(每次5分钟),用RNase(SSC中100μg/mL)在37°C下处理1小时,并在50%甲酰胺/2X SSC中平衡至少2小时。 平衡后,用杂交混合物(2μL FISH探针、8μL杂交缓冲液和0.5μL Cot1 DNA)在85°C下变性玻片3分钟,并在37°C的加湿容器中培养过夜。 第二天,细胞在37°C的2X SSC中清洗三次,每次清洗5分钟。然后,在60°C的0.1X SSC下清洗三次载玻片,每次清洗五分钟。 细胞在安装前用DAPI染色。
使用60×1.4NA油浸透镜和激光扫描共聚焦成像,以0.25μm的轴向步长获取标记细胞的三维图像堆栈。 图像采集设置在实验中保持一致。 使用Matlab软件对获取的三维图像数据中的基因定位进行量化。 相对径向距离(RRD)度量(改编自 45 )用于确定FISH信号相对于核外围的位置(0表示位于外围,1表示位于核中心)。 计算皮尔逊系数以测量H3K9ac与FISH信号的共定位程度。
统计分析 使用Prism 6软件(Graphpad软件,加利福尼亚州圣地亚哥)进行统计分析。 由于数据的非高斯性质,Mann-Whitney评估了处理细胞系和DMSO对照之间的差异。 此外,还应用Kolmogorov-Smirnoff(KS)比较了参数的分布,并报告了调整后的p值。 低于0.05的P值被认为是显著的。 通过Anderson-Darling正态性检验(使用R中nortest包的ad.test)评估正态性。
其他信息 如何引用这篇文章 :南达库马,V。 等 旋涡仪对癌细胞和非癌食管细胞的3D核结构有不同的改变。 科学。 代表 . 6 , 30593; doi:10.1038/srep30593(2016)。
鸣谢 这项研究得到了国家癌症研究所物理科学与癌症生物学融合中心的支持,批准号为U54CA143862。 (P.Davies,P.I.)作者感谢与Thai Tran博士进行的富有成果的科学讨论,并感谢Miranda Slaydon、Atma Thompson和Beatriz Rodolpho在样品制备和图像采集方面提供的帮助。
脚注
D.Meldrum和R.Johnson在VisionGate拥有财务利益。 亚利桑那州凤凰城有限公司。
作者贡献 V.N.设计并进行了细胞-CT实验,并编写了正文。 N.H.、J.H.H.、S.H.、K.H.和P.S.为数据收集做出了贡献。 H.L.G.进行了共聚焦实验。 K.J.B.进行了鱼类实验和数据分析。 R.H.J.和D.R.M.指导了这项工作。H.L.G.、K.J.B.、R.H.J和D.R.M编辑了手稿。
工具书类
Glozak M.和Seto E。 组蛋白脱乙酰酶与癌症。 癌基因 26, 5420–5432 (2007). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Ropero S.和Esteller M。 组蛋白脱乙酰酶(HDAC)在人类癌症中的作用。 分子肿瘤学 1, 19–25 (2007). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Weichert W。 人类恶性肿瘤中HDAC的表达与临床预后。 癌症信件 280, 168–176 (2009). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Witt O.、Deubzer H.E.、Milde T.和Oehme I。 HDAC家族:与癌症相关的靶点是什么? 癌症信件 277, 8–21 (2009). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Grant S.、Easley C.和Kirkpatrick P。 Vorinostat公司。 自然评论药物发现 6, 21–22 (2007). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Mann B.S.、Johnson J.R.、Cohen M.H.、Justice R.和Pazdur R。 FDA批准摘要:伏立诺治疗晚期原发性皮肤T细胞淋巴瘤。 肿瘤学家 12, 1247–1252 (2007). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
临床试验。 临床试验。 政府< www.clinicaltrials.gov > (2014).
里根五世。 癌症生物学:新型组蛋白去乙酰化酶抑制剂伏立诺达(亚甲酰苯胺羟肟酸)的抗肿瘤作用机制。 英国癌症杂志 95,S2–S6(2006)。 [ 谷歌学者 ]
Richon V.M.、Garcia Vargas J.和Hardwick J.S。 伏立诺治疗的发展:癌症治疗的当前应用和未来前景。 癌症信件 280, 201–210 (2009). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Marks P.A.和Breslow R。 二甲基亚砜合成伏立诺达:这种组蛋白去乙酰化酶抑制剂作为抗癌药物的开发。 自然生物技术 25, 84–90 (2007). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Lee J.-H.、Choy M.、Ngo L.、Foster S.&Marks P.A。 组蛋白脱乙酰酶抑制剂诱导DNA损伤,正常但未转化的细胞可以修复这种损伤。 美国国家科学院院刊 107, 14639–14644 (2010). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
米斯特利T。 核建筑概念。 生物论文 27, 477–487 (2005). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
D'Angelo M.和Hetzer M。 核膜在细胞组织中的作用。 细胞和分子生命科学CMLS 63, 316–332 (2006). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Bickmore W.A.和van Steensel B。 基因组结构:间期染色体的结构域组织。 单元格 1521270–1284,doi:10.1016/j.cell.2013.02.001(2013)。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
克里默T。 等。染色体区域——功能性核景观。 细胞生物学的当前观点 18, 307–316 (2006). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Misteli T.和Soutoglou E。 核结构在DNA修复和基因组维护中的新兴作用。 《自然》杂志评论分子细胞生物学 10, 243–254 (2009). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Geyer P.K.、Vitalini M.W.和Wallrath L。 核组织:对基因表达采取立场。 Curr Opin细胞生物学 23、354–359,doi:10.1016/j.ceb.2011.03.002(2011)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Reddy K.L.、Zullo J.M.、Bertolino E.和Singh H。 通过将基因重新定位到核膜介导的转录抑制。 自然 452243–247,doi:10.1038/nature06727(2008)。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
克里默·M。 等。正常和肿瘤细胞核中与基因密度相关的高阶染色质排列的遗传。 细胞生物学杂志 162809-820,doi:10.1083/jcb.200304096(2003)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Meaburn K.J.、Gudla P.R.、Khan S.、Lockett S.J.和Misteli T。 乳腺癌中疾病特异性基因的重新定位。 细胞生物学杂志 187801-812,doi:10.1083/jcb.200909127(2009)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Danescu A.、Herrero Gonzalez S.、Cristofano A.、Mai S.和Hombach‐Klonisch S。 子宫内膜癌发生过程中的三维核端粒结构变化。 基因、染色体与癌症 52, 716–732 (2013). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
迈耶·M·。 等。二维和三维细胞自动分析:比较研究。 模式识别 42141-146,doi:10.1016/j.patcog.2008.06.018(2009)。 [ 内政部 ] [ 谷歌学者 ]
Zink D.、Fischer A.和Nickerson J。 癌细胞的核结构。 《自然》杂志评论癌症 4, 677–687 (2004). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
BártováE。 等。组蛋白H3修饰和组蛋白去乙酰化酶抑制后HP1蛋白的核水平和模式。 细胞科学杂志 118, 5035–5046 (2005). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Llères D.、James J.、Swift S.、Norman D.G.和Lamond A.I。 使用FLIM–FRET定量分析活细胞中的染色质致密。 细胞生物学杂志 187, 481–496 (2009). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Taddei A.、Maison C.、Roche D.和Almouzni G。 通过抑制脱乙酰酶可逆破坏着丝粒周围异染色质和着丝粒功能。 自然细胞生物学 3, 114–120 (2001). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
总K.F。 等。曲古菌素A诱导的组蛋白乙酰化导致间期染色质去凝聚。 细胞科学杂志 1174277–4287,doi:10.1242/Jcs.012963(2004)。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Kortenhorst M.S.Q公司。 等。丙戊酸引起前列腺癌细胞核结构的剂量和时间依赖性变化 在体外 和 体内 .分子癌症治疗 8, 802 (2009). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Marks P.和Xu W.S。 组蛋白脱乙酰酶抑制剂:在癌症治疗中的潜力。 细胞生物化学杂志 107, 600–608 (2009). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
福弗·M·。 等。使用光学投影断层扫描术对单个孤立细胞核进行三维成像。 光学快车 13, 4210–4223 (2005). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
库斯特D。 等。Barrett食管化生-异型增生-癌序列中启动子高甲基化沉默MGMT表达。 癌症信件 275, 117–126 (2009). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
威尔逊P.M。 组蛋白脱乙酰酶抑制剂panobinostat和vorinostat在结直肠癌模型中的抗肿瘤活性需要持续抑制脱乙酰酶。 新药 31, 845–857 (2013). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
承运人F。 组蛋白脱乙酰酶抑制剂对染色质的调节:对细胞电离辐射敏感性的影响。 分子和细胞药理学 5, 51 (2013). [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
巴特勒·L·M。 等。组蛋白脱乙酰酶抑制剂SAHA阻止癌细胞生长,上调硫氧还蛋白结合蛋白-2,下调硫氧还毒素。 美国国家科学院院刊 99, 11700–11705 (2002). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
麦克布莱恩医学硕士。 等。组蛋白乙酰化调节细胞内pH值。分子细胞 49, 310–321 (2013). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
凯尔鲍斯卡。 等。非相互作用和相互作用细胞中单细胞水平的生理表型表征方法。 生物光学期刊 17,doi:10.1117/1.JBO.17.3.037008(2012)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
卢H。 等。用于测量蓝藻光合活性的新型比例光学氧和pH双传感器,具有三种发射颜色。材料化学杂志 19293年至19301年,doi:10.1039/c1jm13754a(2011)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Easwaran H.P.公司。 等。CpG超甲基化导致癌相关基因的异常沉默独立于其在细胞核中的空间组织。 癌症研究 70, 8015–8024 (2010). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Freund A.、Laberge R.-M.、Demaria M.和Campisi J。 层粘连蛋白B1缺失是一种衰老相关的生物标志物。 细胞的分子生物学 23, 2066–2075 (2012). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
兰格·R。 等。食管腺癌中I类组蛋白脱乙酰化酶(HDAC1和HDAC2)的表达:一项免疫组织化学研究。 临床病理杂志 jcp公司。 2010.080952 (2010). [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Miyashita T。 等。组蛋白脱乙酰酶1和转移相关基因1表达在食管癌发生中的影响。 肿瘤信件 8, 758–764 (2014). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Pfaffl M.W.公司。 实时RT-PCR相对定量的新数学模型。 核酸研究 29,e45–e45(2001)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Nandakumar V.、Kelbauskas L.、Johnson R.和Meldrum D。 使用单细胞计算机断层扫描和三维核型测定对癌前进展进行定量表征。 细胞测定法A部分 79A,25-34(2011年)。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Zinner R.、Teller K.、Versteeg R.、Cremer T.和Cremer M。 生物化学符合核结构:多色免疫荧光原位杂交用于染色体片段和不同组蛋白甲基化差异表达基因位点的共定位分析。 酶调节研究进展 47223-241,doi:10.1016/j.advenzreg.2007.01.05(2007)。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Meaburn K.J.和Misteli T。 早期肿瘤发生过程中的位点特异性和活性无关的基因重新定位。 细胞生物学杂志 180, 39–50 (2008). [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。