线粒体在脂质代谢中发挥关键作用,并促进细胞膜主要成分的合成,如磷脂酰乙醇胺(PE)。 在这里,Aaltonen等人证明了两种途径介导PE合成:Ups2–Mdm35依赖的脂质转移和MICOS依赖的膜并置。
摘要 线粒体在细胞脂质代谢中发挥关键作用,并促进细胞膜主要成分的合成,如磷脂酰乙醇胺(PE)和磷脂酰胆碱。 在此,我们证明位于线粒体内膜的磷脂酰丝氨酸脱羧酶Psd1通过两条途径促进线粒体PE合成。 首先,Ups2–Mdm35复合物(人类中的SLMO2–TRIAP1)在线粒体膜间空间中作为磷脂酰丝氨酸(PS)特异性脂质转移蛋白,允许Psd1在内膜中形成PE。 其次,Psd1在反式中使外膜中的PS脱羧,与Ups2–Mdm35的PS转移无关。 后一种途径需要线粒体膜与线粒体接触部位和嵴组织系统(MICOS)紧密结合。 在MICOS缺乏的细胞中,Ups2–Mdm35限制PS转移,减少线粒体PE积累,从而保护线粒体呼吸和嵴形成。 这些结果将线粒体PE代谢与MICOS联系起来,结合蛋白质和脂质稳态功能,以保持线粒体结构和功能。
结果和讨论 Ups2–Mdm35作为PS转移蛋白复合物发挥作用 为了对Ups2–Mdm35进行功能表征,我们使用纯化的蛋白质复合物建立了一个体外检测系统。 为了促进异源表达,我们设计了一种Ups2变异体(Ups2*),该变异体缺乏半胱氨酸残基,但仍保持功能活性,并修复了由Ups2缺失引起的生长缺陷 酿酒酵母 ( 图S1 A ). 他标记的Ups2*和Mdm35在 大肠杆菌 ,并将杂寡聚物纯化至均匀(图S1 B)。
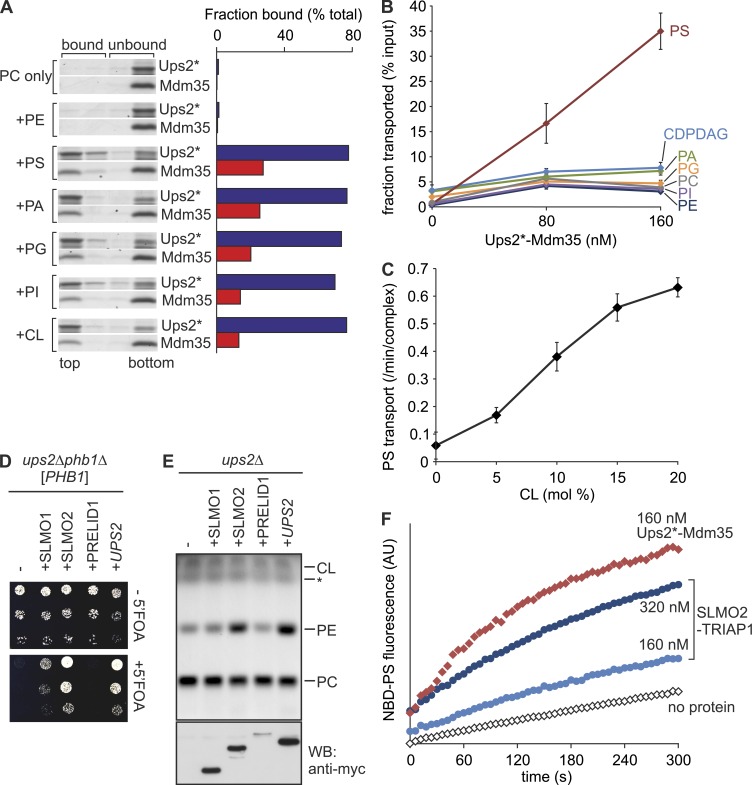
我们首先评估Ups2*–Mdm35是否结合磷脂,并使用脂质体进行浮选实验( 图1 A ). Ups2*与带负电荷的磷脂(包括PS和CL)结合,但不与中性磷脂(PC或PE; 图1 A ). 如上文对Ups1–Mdm35所述,大部分Mdm35在与膜结合时与Ups2*分离( Connerth等人,2012年 ; Watanabe等人,2015年 ). 为了研究可能的磷脂转移活性,Ups2*–Mdm35与含有所有主要类别磷脂的供体脂质体和不含这些磷脂的受体脂质体孵育( 图1 B ). 孵育后,用密度梯度离心法分离受体脂质体,并用定量质谱(qMS)进行分析。 我们通过Ups2*–Mdm35观察到PS向受体脂质体的选择性和浓度依赖性转移( 图1 B ). 其他磷脂(如PA或二磷酸胞苷(CDP)-DAG)未被转运或效率极低( 图1 B ). 使用基于荧光的去淬灭试验显示,由于膜中存在CL或其他带负电荷的磷脂(PI或PG),Ups2*–Mdm35的PS转移加快( 图1 C 图S1、C和D)。 因此,Ups2*–Mdm35促进了PS的选择性转移,这是一种脂质特异性,与Ups1–Mdm35%显著不同,后者对PA具有选择性( Connerth等人,2012年 ).
图1。
Ups2–Mdm35是一种PS转移蛋白复合物。 (A) 磷脂结合。 历史标记的Ups2 C96S/C101S/C142S/C153S (Ups2*)–将Mdm35(5µM)与由双油酸-PC(DOPC)和20 mol%指示的双油酸-磷脂(总脂质浓度2 mM)组成的脂质体在20°C下孵育10分钟。 浮选后,收集四个馏分,并用SDS-PAGE进行分析。 对蛋白质条带进行密度分析,并将所有四条通道中的条带强度之和设置为100%。 前两部分代表结合材料。 (B) 磷脂转运。 Ups2*–Mdm35与供体脂质体(0.25 mM;DOPC/四油酰基-CL/Lac-PE/17:0 PC/17:0 PE/DOPA/DOPS/DOPI/DOPG/DO-CDPDAG/DOPE/NBD-PE=35/15/10/5/5/5/5/5/5/5/5/4.5/0.5 mol%,填充12.5%蔗糖)和受体脂质体(1 mM,DOPC/DOPE/四油酰基-CL/Lac-PE/罗丹明-PE=50/24.95/10/0.05 mol%)孵育5分钟。 通过浮选分离受体脂质体后,提取脂质并用qMS定量。 误差条代表SEM。 n个 = 4. (C) Ups2*–Mdm35对PS转移活性的CL依赖性。 通过荧光去猝灭监测PS转移( 图S1 C ). 误差条代表SEM。 n个 = 3. (D) 人类SLMO2的表达抑制了 向上2 Δ 电话1 Δ单元。 连续稀释 向上2 Δ 电话1 Δ ( PHB1级 )将表达C-末端myc标记的SLMO1、SLMO2或PRELID1的细胞点在含有或不含有5-氟乳清酸(5′FOA)的含葡萄糖培养基上。 (E) SLMO2表达恢复Δ中的PE水平 向上2 线粒体。线粒体脂质的TLC。*, 未确认的脂质种类。 使用抗myc抗体(WB)对相同样本进行SDS-PAGE和免疫印迹分析。 (F) SLMO2–TRIAP1复合物促进NBD-PS的膜间转移。NBD-PS转移通过荧光去猝灭进行监测。 AU,任意单位。
人类线粒体含有三种Ups/PRELI家族蛋白,称为SLMO1、SLMO2和PRELID1( Dee和Moffat,2005年 ). 而PRELID1–TRIAP1调解PA传输( Potting等人,2013年 )SLMO1和SLMO2的功能仍然是个谜。 为了鉴定Ups2的功能同源序列,我们在缺乏Ups2基因的酵母细胞中表达了人类Ups/PRELI家族成员。 删除 通用产品2 在缺乏禁止性膜支架亚单位Phb1的酵母细胞中是致命的( Osman等人,2009年 ). SLMO2和SLMO1的表达在较小程度上允许生长 向上2 Δ 电话1 Δ细胞( 图1D ). 我们观察到在 向上2 Δ线粒体携带SLMO2,而SLMO1或PRELID1的表达对线粒体PE没有显著影响( 图1 E ). 与这些体内结果一致,纯化的SLMO2–TRIAP1促进了NBD-PS的膜间转移,而非NBD-PA( 图1 F 和S1 E)。 我们从这些实验中得出结论,Ups2–Mdm35和SLMO2–TRIAP1是保守的PS转移蛋白。
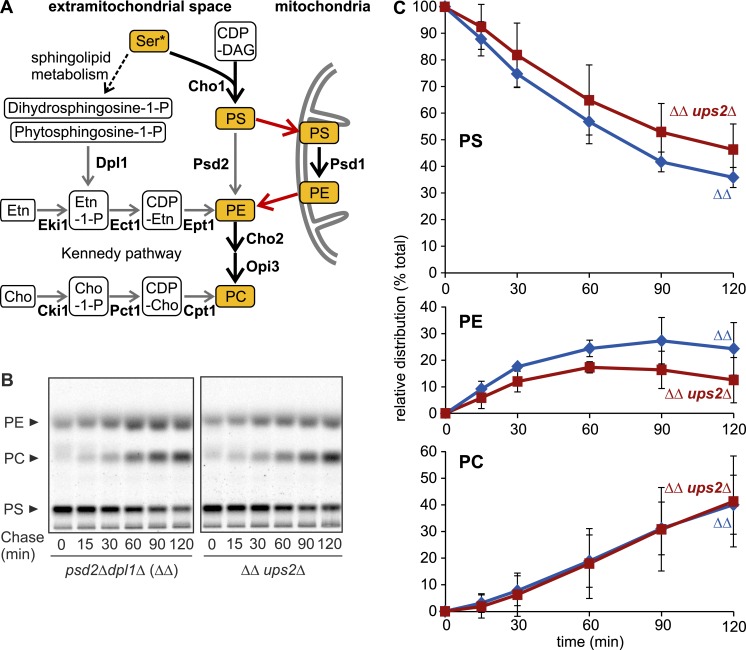
线粒体PE合成可以独立于体内Ups2进行 我们的体外数据表明,Ups2–Mdm35通过IMS运输PS,以进行依赖于Psd1的PE合成。 因此,我们使用[ 14 C] 丝氨酸被并入PS。PE可以通过不同的细胞代谢途径合成( Birner等人,2001年 ; 图2 A ). 因此,我们使用了缺乏Psd2和Dpl1的酵母细胞( psd2型 Δ dpl1型 Δ),非线粒体PE合成中的关键酶。 PE的形成完全依赖于Psd1 psd2型 Δ dpl1型 无乙醇胺时的Δ细胞( Birner等人,2001年 ; 图2 A ). 我们监测了放射性标记PS到PE的Psd1依赖性脱羧反应,以及随后通过ER中的PE甲基化酶转化为PC( 图2 B ). Ups2英寸的损耗 psd2型 Δ dpl1型 Δ细胞(图中称为ΔΔ)适度损害PE的积累,但不影响其转化为PC( 图2、B和C ). 这些结果与 向上2 Δ线粒体( Osman等人,2009年 ; Tamura等人,2009年 )以及Ups2–Mdm35作为体内脂质转运蛋白复合物的功能。 然而,这些观察结果表明,依赖于Psd1的PE合成可以独立于Ups2–Mdm35体内的PS转移。
图2。
PE生物发生可以在没有Ups2的情况下进行。 (A) PE/PC生物成因 酿酒酵母 .粗箭头表示B和 图4 A ,其中非线粒体PE/PC合成因删除 DPL1(DPL1) 和 PSD2型 培养基中缺乏乙醇胺(Etn)或胆碱(Cho)。 红色箭头表示脂质交换。 (B) 体内PE/PC合成评估。 脉冲标记后[ 14 C] 丝氨酸,在含有未标记丝氨酸(chase)的培养基中进一步培养,提取脂质并通过TLC和放射自显影术进行分析。 ΔΔ, dpl1型 Δ psd2型 Δ. (C) PS、PE和PC水平被量化,并显示为总脂质的一部分。 误差条代表SD。 n个 = 3.
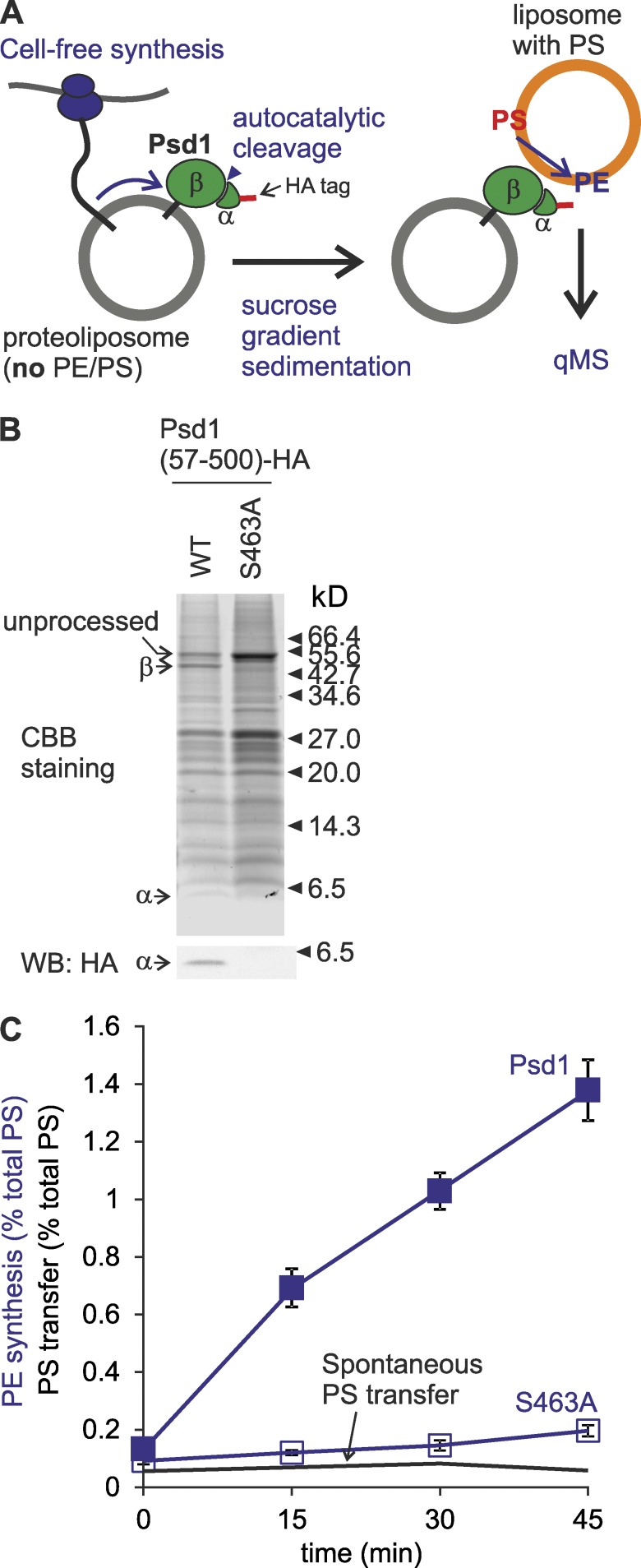
Psd1可以在并列膜中转换PS 体内Psd1产生的Ups2依赖性PE合成表明,PS可以通过不涉及Ups2–Mdm35跨IMS传递PS的替代途径到达内膜中的Psd1。 脂转运蛋白Ups/PRELI家族的其他成员可能至少部分替代Ups2的丢失并保留PS转运。 然而, psd2型 Δ dpl1型 缺乏所有Ups样蛋白(Ups1–3)的Δ细胞不是乙醇胺营养缺陷型细胞,这表明在缺乏这些脂质转移蛋白的情况下可以发生依赖于Psd1的PE合成( 图S2 A ). 另一种情况是,Psd1的IMS催化域( Choi等人,2005年 ; Horvath等人,2012年 )能够使外膜(OM)中的PS脱羧,也就是说,不依赖于PS转移到IM。 为了测试这种可能性,我们在体外合成了Psd1,并将其重组为缺乏PS和PE的脂质体( 图3 A ). Psd1的脱羧酶活性取决于其自催化过程,而自催化过程在催化活性S463突变后被取消( Horvath等人,2012年 ; Onguka等人,2015年 ). 我们观察到重组Psd1中有相当一部分的自催化裂解,但Psd1没有 463A型 表明脂质体结合的Psd1达到功能状态( 图3 B ). 携带Psd1或Psd1的蛋白脂质体 463A型 与含有PS的脂质体孵育,并通过qMS评估PE的形成( 图3 C ). Psd1但不是Psd1 463A型 促进PS脱羧和反式脂肪酸脂质体中PE的形成( 图3 C ). 值得注意的是,PE的合成依赖于Psd1,不涉及脂质体之间的PS转移,因为没有发生显著的自发PS转移( 图3 C ). 此外,未检测到脂质体融合(图S2 B)。 我们的结论是,Psd1可以在并列膜中催化PS脱羧并转化为PE,这为在体内不存在Ups2-Mdm35转移PS的情况下Psd1依赖的PE合成提供了可能的理论基础。
图3。
在反式中,Psd1能够在并列膜上将PS转化为PE。 (A) 通过重组Psd1监测反式脱羧反应。 (B) 重组Psd1的自催化处理。 使用HA特异性抗体对浮选后的含有Psd1的级分进行SDS-PAGE和免疫印迹分析。 CBB,考马斯亮蓝。 (C) Psd1在并列膜上将PS脱羧为PE。 S463A、Psd1 463A型 绘制了相同条件下的自发PS转移图以进行比较。 给定时间点产生的PE或传输的PS显示为总PS输入的百分比。 误差条代表SEM。 n个 = 3.
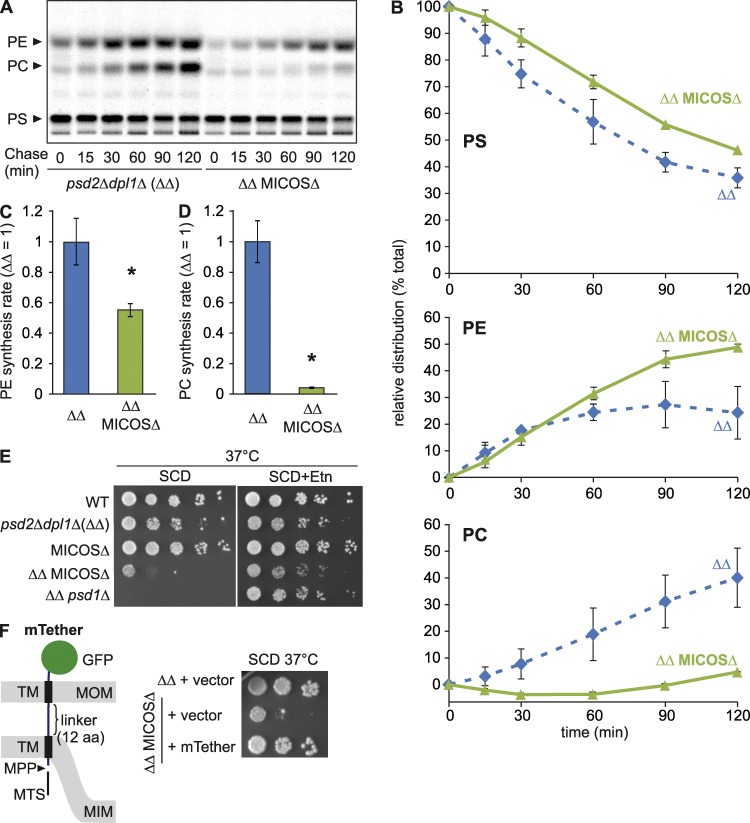
MICOS协调线粒体PE代谢 这些结果表明线粒体PE合成可能受OM和IM相对位置的调节。 线粒体接触位点和嵴组织系统(MICOS)已被确定为线粒体形状和组织的主要调节器( Harner等人,2011年 ; Hoppins等人,2011年 ; von der Malsburg等人,2011年 ; Alkhaja等人,2012年 ). IM中的异寡聚MICOS复合物与线粒体嵴的维持和形成以及与OM的膜接触有关,这支持跨线粒体膜的协调蛋白质易位( Friedman等人,2015年 ; Horvath等人,2015年 ). 有趣的是,MICOS亚基与心磷脂合成途径表现出强烈的负遗传相互作用( Hoppins等人,2011年 )让人想起PE代谢中的成分( Gohil等人,2005年 ). 因此,我们寻求MICOS可以确保Psd1有效合成PE的可能性。 我们删除了 PSD2型 和 DPL1(DPL1) 在缺乏所有六种MICOS亚基的酵母细胞中(MICOSΔ; Friedman等人,2015年 )废除非线粒体PE合成( 图2 A )并使用[ 14 C] 体内丝氨酸。 MICOS的缺失显著降低了依赖于Psd1的PE合成速率,更严重地影响了PE甲基化为PC的速率( 图4,A–D ). 通过测定累积PE和PC相对于总PS、PC和PE的比例,发现MICOS缺乏细胞中PC合成急剧减少,而PE的相对比例增加( 图4 B ). 这与 向上2 Δ电池( 图2 C )尽管MICOS复合物或Ups2的丢失导致细胞内PE累积绝对量的类似减少(图S2 C)。
图4。
MICOS协助PE的线粒体合成及其在ER中转化为PC。 (A) 标记细胞中PS、PE和PC的合成[ 14 C] 丝氨酸。 ΔΔ, dpl1型 Δ psd2型 Δ. (B) PS、PE或PC波段中放射性的相对分布表示为 图2 C 。错误条表示SD。 n个 = 3. (C和D)Psd1-PE和PC的形成依赖于[ 14 C] PS。显示了缺乏MICOS的细胞中PE(C)和PC(D)的合成速率。 通过绘制PE和PC(C)或PC(D)之和的带强度的动力学变化,并确定拟合曲线的斜率(介于 t吨 =15分钟 t吨 =90分钟)。 ΔΔ的平均值设置为1。 误差条代表SEM。 n个 = 3. *, P<0.05。 (E) 非线粒体PE合成的缺失会损害MICOSΔ细胞的生长。 在37°C下,在补充有乙醇胺(Etn;10 mM)的含葡萄糖SC培养基(SCD)上评估细胞生长。 WT,野生型。 (F) 在两个线粒体膜(mTether)之间表达人工系链可抑制缺乏MICOS和非线粒体PE合成的细胞的乙醇胺营养不良。 左侧,mTether的示意图; 右图,37°C时SCD上的细胞生长。
与MICOS复合物在线粒体PE代谢中的作用一致,抑制非线粒体PE合成会损害MICOS缺陷细胞在可发酵碳源葡萄糖上的生长( 图4 E ). 同样,在缺乏Psd2和Dpl1的细胞中,Psd1表现出负的遗传相互作用( 图4 E ). 在这两种情况下,通过补充乙醇胺的培养基来支持生长,乙醇胺可以恢复非线粒体PE的合成,这表明PE生物合成的缺乏会导致观察到的生长缺陷( 图4 E ). Psd1活性不受MICOS亚单位损失的影响(图S2 D),这表明PS传递到Psd1是这些细胞线粒体PE合成的速率限制。 总之,我们的数据表明,MICOS复合物调节线粒体PE合成,并促进线粒体衍生PE在内质网中形成PC。因此,我们认为MICOS确保两个线粒体膜紧密并置,从而允许Psd1使OM中的PS脱羧。
为了评估MICOS是否通过外膜和内膜的系留在线粒体PE合成中发挥作用,我们生成了一个嵌合蛋白,该嵌合蛋白包含IM蛋白Yme2(aa 279–308)的线粒体靶向信号和跨膜结构域,以及OM蛋白Tom70(aa 10–30)的跨膜结构区融合到GFP( 图4 F ). 通过12 aa的连接子连接跨膜结构域。我们在缺乏Psd2和Dpl1的MICOS缺陷细胞中表达着丝粒质粒的嵌合蛋白,这些细胞的生长严格依赖于Psd1的线粒体PE合成或外源乙醇胺的补充( 图4 E ). 人工系链蛋白以成熟形式积聚在线粒体中,并将GFP结构域暴露在外(图S2、E和F)。 栓系蛋白的表达允许MICOS缺陷细胞在没有乙醇胺的情况下生长( 图4 F ). 因此,在PE代谢中,人工系链至少可以部分替代MICOS,这符合Psd1在PE合成中线粒体膜紧密并置的要求。 然而[ 14 C] 丝氨酸标记实验显示,这些细胞中PE合成仅适度增加,表达系链蛋白的MICOS缺陷细胞的呼吸生长未恢复(图S2 G,未描绘),表明人工膜系链仅替代MICOS作为膜组织复合体的某些功能。
删除 通用产品2 在缺乏MICOS亚单位的情况下保持呼吸生长和嵴形态 PE或CL合成障碍损害了各种生物的嵴形态发生( Signorell等人,2009年 ; Connerth等人,2012年 )强调磷脂环境对线粒体超微结构的重要性。 当抑制CL合成时,嵴形态会受到干扰,但当Ups1–Mdm35将PA转移到IM时会恢复( Connerth等人,2012年 ),表明脂质组成的适度改变可以对嵴的形态发生产生显著影响。 因此,我们研究了线粒体PE代谢的改变是否有助于MICOS缺陷细胞的嵴形态或超微结构缺陷。
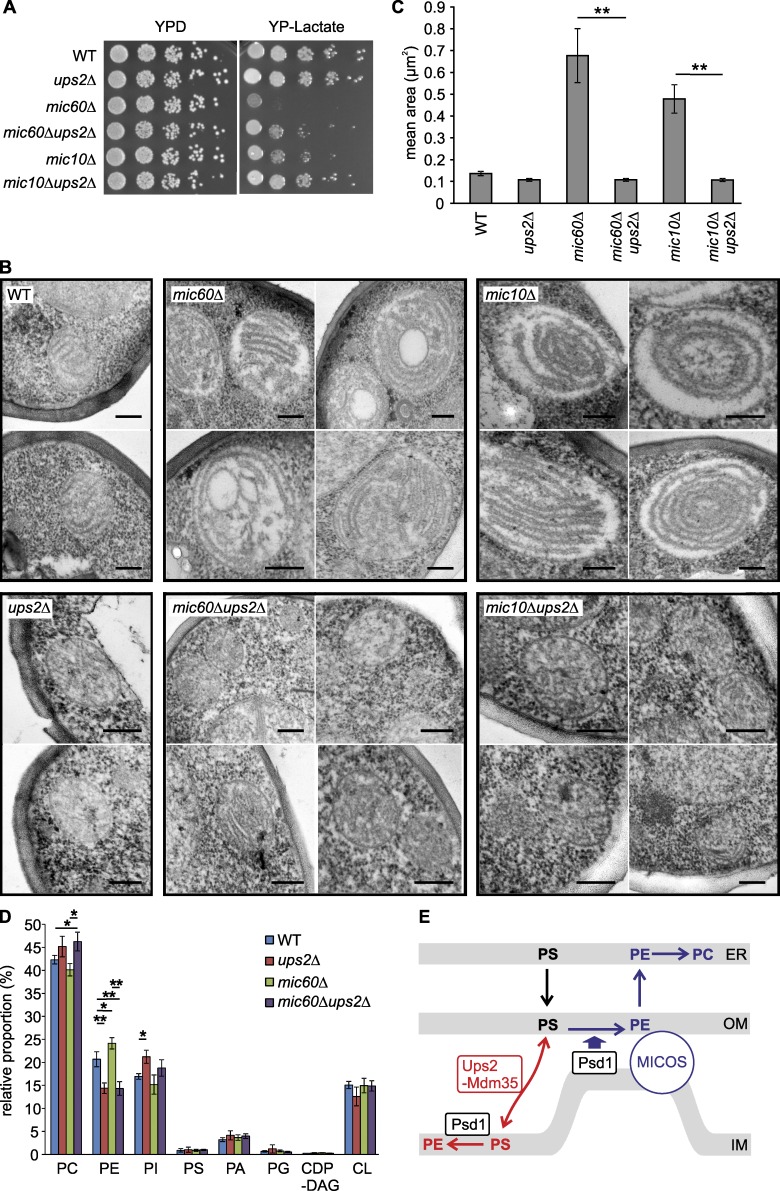
我们删除了 通用产品2 在缺乏核心MICOS亚单位Mic10或Mic60的细胞中,评估细胞生长( 图5 A ). 的增长 云母10 Δ和 麦克风60 在没有Ups2的情况下,非发酵碳源上的Δ细胞显著改善( 图5 A ). 类似地,删除 通用产品2 促进MICOSΔ细胞的呼吸生长( 图S3 A )以及 云母10 Δ或 麦克风60 Δ细胞缺乏线粒体外PE合成(图S3 B)。 缺乏MICOS亚单位的细胞的电子显微镜显示线粒体增大,有堆积的多层嵴( Rabl等人,2009年 ; Harner等人,2011年 ; Hoppins等人,2011年 ; von der Malsburg等人,2011年 ; Alkhaja等人,2012年 ; Friedman等人,2015年 )而Ups2的缺失并不影响线粒体的整体结构( 图5 B ). 删除 通用产品2 大体恢复了线粒体和嵴的平均大小 麦克风60 Δ或 云母10 Δ电池( 图5、B和C )而荧光显微镜显示管状线粒体在 麦克风60 Δ电池(图S3 C)。 这些结果表明,通过抑制Ups2介导的PS向内膜的转移,MICOS缺陷细胞的嵴形态和呼吸缺陷至少可以部分绕过。
图5。
删除 通用产品2 在缺乏MICOS的细胞中恢复呼吸生长和线粒体结构。 (A) 细胞在可发酵和不可发酵碳源上生长。 在30°C的YPD或YP-乳酸平板上分析指示菌株的系列稀释液。 WT,野生型。 (B) 对缺乏Ups2、Mic60和/或Mic10的细胞进行EM分析。 显示了在YP-乳酸上生长的细胞的典型显微照片。 棒材,200 nm。 (C) 指示菌株电子显微照片中线粒体的平均面积。 误差条代表SEM。 n个 > 15. **, P<0.01。 (D) 在乳酸培养基中生长的细胞中线粒体磷脂组的qMS。 误差条代表SEM。 n个 = 3. *, P<0.05;**, P<0.01。 (E) Psd1相关PE合成中Ups2-Mdm35和MICOS作用的模型。
为了证实这些发现,我们测定了 麦克风60 Δ, 向上2 Δ,以及 麦克风60 Δ 向上2 Δ细胞(qMS)( 图5 D 和S3 D)。 Mic60缺失损害线粒体结构( 图5 B )但对线粒体膜中的磷脂组成或各种PE物种中的酰基链分布没有显著影响( 图5 D 和S3 D)。 删除 通用产品2 导致线粒体PE水平下降( Osman等人,2009年 ; Tamura等人,2009年 )在缺乏Mic60或所有MICOS亚单位的情况下也很明显( 图5D 和S3 E)。 我们观察到PE的酰基链组成在 向上2 Δ和 向上2 Δ 麦克风60 Δ线粒体(图S3 D)。 因此,Ups2的缺失会导致大鼠线粒体膜PE水平的显著改变 麦克风60 Δ细胞并大体恢复线粒体超微结构。 通过删除 PSD1型 (图S3 F)。 删除 PSD1型 野生型细胞中PE在线粒体中的积累显著减少,呼吸系统发育受损( Birner等人,2001年 ). 然而,MICOS缺陷细胞中Psd1的丢失显著改善了呼吸生长(图S3 F)。 因此,我们得出结论,通过减少PS向IM的转移,可以维持MICOS缺乏细胞的嵴形态发生和线粒体呼吸,从而限制PE的积累,这表明膜脂环境与线粒体结构和功能密切相关。
总之,我们的结果表明Ups2–Mdm35脂质转移蛋白与MICOS在线粒体PE合成中密切合作,突出了膜接触对线粒体磷脂稳态的重要性。 我们认为PE是沿着两条Psd1依赖性途径在线粒体内合成的( 图5 E )首先,Ups2–Mdm35依赖性PS转移到IM导致Psd1脱羧,PE在IM中积累; 第二,MICOS确保线粒体膜紧密并置,允许Psd1依赖但Ups2–Mdm35独立的PE在OM中形成。PE池可以从线粒体释放出来,并在ER中转化为PC。
一些证据表明,OM和IM之间的脂质交换发生在接触部位( Simbeni等人,1990年 ). CL结合可将Ups2–Mdm35招募到这些位点,这些位点富含CL( Simbeni等人,1991年 ; Connerth等人,2012年 ). MICOS可能促进Ups2–Mdm35在这些部位的线粒体内PS转移,支持紧密的膜并置。 然而,我们的结果揭示了MICOS在PE代谢中的另一个功能:两个线粒体膜的紧密空间邻近允许Psd1在OM中脱羧PS。因此,在没有Ups2–Mdm35的情况下,PE的Psd1依赖性合成及其在PC中的转化可以维持。 研究MICOS是否也能使其他IM蛋白作用于OM中的底物,如 我 -切割酵母线粒体OM中Atg32的AAA蛋白酶Yme1( Wang等人,2013年 ). 此外,我们的研究让人想起了在PC合成中,质膜-ER接触位点的栓系络合物的作用( Tavassoli等人,2013年 ). 因此,促进脂质修饰酶的反式活性成为膜接触如何促进细胞脂质稳态的一般原理。
细胞膜间的某些栓系复合物具有脂质转移活性( Reinisch和De Camilli,2015年 ). 因此,MICOS可能直接介导线粒体内脂质转移,例如促进PE从IM中输出。 这可能解释了为什么在缺乏乙醇胺的情况下,在MICOS的细胞中表达人工膜系链可以恢复生长,但不能恢复与MICOS丢失相关的其他表型。 MICOS缺陷细胞的呼吸生长在膜系带表达后不会恢复,这与MICOS作为嵴形态发生、蛋白质移位和呼吸链组装的一般膜组织系统的附加功能一致( Harner等人,2011年 ; Hoppins等人,2011年 ; von der Malsburg等人,2011年 ; Friedman等人,2015年 ; Horvath等人,2015年 ). 然而,这些功能似乎与线粒体PE代谢密切相关,因为在缺乏MICOS的情况下,限制Ups2–Mdm35依赖性PS向IM的转运可促进呼吸生长和嵴形态发生。 因此,IM中磷脂组成的适度改变,如PE水平的增加,对线粒体超微结构有着深远的影响。 这种抑制作用的确切机制还有待确定。 与Ups2类似,呼吸复合物III和IV以及ATP合成酶需要在MICOS缺乏细胞中生成异常嵴( Hoppins等人,2011年 ; Friedman等人,2015年 ). 因此,MICOS很可能通过微调线粒体膜特性和磷脂与其他蛋白质膜组织者的活动的动态平衡来确保线粒体的结构和功能。
材料和方法 酵母菌株和生长条件 本研究中使用的酵母菌株列于 表S1 .通过PCR-靶向同源重组删除基因( Wach等人,1994年 ). 酵母细胞在添加2%葡萄糖、2%半乳糖或2%乳酸的YP或合成完全(SC)培养基或乳酸培养基中培养。 为了评估乙醇胺营养不良,SC培养基中添加了10 mM乙醇胺。
Ups2-Mdm35和SLMO2-TRIAP1复合物的克隆、表达和纯化 将编码带有N末端六组氨酸标签和Mdm35的Ups2的DNA片段克隆到pET-Duet-1载体中。 编码半胱氨酸的所有四个密码子 通用产品2 被编码丝氨酸的密码子取代,通过PCR-介导的定点突变。 蛋白质表达于 大肠杆菌 Rosetta-gami 2(DE3;Promega)或Suffle T7(新英格兰生物实验室公司)细胞。 在37°C培养2 h后,将培养物转移到18°C培养1 h,并通过添加IPTG(0.2 mM)表达Ups2和Mdm35 14 h。根据Ups1–Mdm35复合物的纯化方案纯化Ups2–Mdm35复合物,并进行一些修改( Connerth等人,2012年 ). 简言之,细胞在缓冲液B(50 mM Tris/HCl,pH 8,250 mM NaCl,1×完全EDTA-无蛋白酶抑制剂混合物[Roche],1 mM PMSF和20 mM咪唑)中溶解。 裂解液在30000转 克 持续20分钟,使用HisTrap和HiLoad 16/60 Superdex-75 pg柱对上清液进行柱层析(GE Healthcare)。 在洗脱组分中测定NBD-PS转移活性。 将含有最高PS转移活性的组分合并、浓缩、透析至缓冲液C(10 mM Tris/HCl、pH 7.4和150 mM NaCl),并储存在−80°C下。
从cDNA中扩增出编码人类SLMO2的N末端六组氨酸标签和TRIAP1的DNA片段,并克隆到pET-Duet-1载体中。 如前所述,SLMO2和TRIAP1在无细胞裂解液中表达( Schwarz等人,2007年 )在没有洗涤剂和还原剂的情况下。 裂解液在16100转 克 持续20分钟,将上清液(60µl)与540µl缓冲液B和20µl 50%Ni-Sepharose HP珠浆混合(GE Healthcare)。 在4°C下培养1.5 h后,用含有咪唑(40 mM)的缓冲液B清洗珠子,用含有300 mM咪唑(100µl)的缓冲溶液B洗脱结合蛋白复合物。
体内PE/PC合成的评估 酵母细胞在补充有2%半乳糖的YP培养基中孵育。 隔夜培养物在不含肌醇的SC培养基中稀释,补充2%半乳糖(SC-gal),OD 0.4,并在30°C下培养至OD 1-2。 对数生长的细胞被脉冲标记为[ 14 C] 丝氨酸(5µCi/ml)在缺乏肌醇和丝氨酸的SC-gal培养基中在30°C下保持15分钟。 收集、清洗细胞,并将其重新悬浮在含有未标记丝氨酸的培养基中。 在30°C下进一步培养后,使用氯仿/甲醇(2:1[vol/vol])对样品进行脂质提取,并通过TLC分析脂质(氯仿/醇/25%氨,65:35:5[vol/vol/vol]。 对TLC板的自显影进行量化。
Psd1的重组 用PCR扩增了一个编码Psd1(氨基酸位置57–500)的DNA片段,该片段包含一个N端七噻啶肽,然后是一个TEV裂解位点和C端HA-肽,并克隆到pET16b中。 Psd1变异体在细菌无细胞裂解液中表达,基本上如所述( Schwarz等人,2007年 )在5 mM脂质体P(69.25%1,2-二油酰基)存在下- 锡 -甘油-3-磷酸胆碱[DOPC]、20%四油酰基-CL、10%二油酰基-PG、0.25%NBD-PE和0.5%罗丹明-PE,在缓冲液LP(5 mM Tris-HCl,pH 8.5和10 mM醋酸钾)中重组,但不含洗涤剂和蛋白酶抑制剂。 16100离心后 克 将含有聚集体和蛋白质脂质体的颗粒部分重新悬浮在含有40%蔗糖的缓冲液FB(5 mM Hepes-NaOH,pH 7.4和25 mM NaCl)中20 min,并转移到超离心管中。 覆盖1.5 ml 30%蔗糖(FB中)、500µl 10%蔗糖(FB中)和175µl FB,并在200000 g下旋转管1.5 h。蛋白质脂质体在30/10%和10/0%界面积累。 收集顶部部分(1 ml),并通过SDS-PAGE分析对成熟Psd1进行定量。 为了评估PS脱羧酶活性,在26°C的缓冲液M(20 mM Hepes-NaOH,pH 7.4,92 mM NaCl和2 mM MgCl)中,将含有Psd1(107 nM,脂质浓度设置为20µM)的蛋白质脂质体与脂质体K(180µM;40%DOPC,20%四油酰基CL,40%二油酰基PS,在缓冲液FB中重组)孵育 2 ). 将反应体积设置为60µl,并在每个时间点对10µl样品进行脂质提取和qMS。 为了评估PS的自发转移,在相同条件下将脂质体P与脂质体K(含2.5%17:0PC,填充20%蔗糖)孵育,提取分离的脂质体P中的脂质并用qMS定量。 用17:0PC和1,2-二油酰基评估脂质体的污染和回收率- 锡 -甘油-3-磷酸甘油,用于标准化数值。 在相同条件下,通过监测NBD荧光的失活来评估脂质体融合。
人工膜栓系蛋白的构建 通过同源重组将人工系链克隆到载体YCplac22ADH中。 编码线粒体靶向序列的基因 粗糙脉孢菌 扩增了Atp9(氨基酸位置1-69)、Yme2跨膜序列(氨基酸位置279-308)、Tom70跨膜顺序(氨基酸位置10-30)和yeGFP蛋白,片段间同源性为20 bp。 引物中引入了编码Yme2和Tom70序列之间连接区(例如AAAENLYFQGGG)的DNA。 酵母细胞通过扩增片段和线性化质粒转化。 从SC-TRP板上生长的细胞中分离出质粒,并通过测序进行验证。 为了评估人工系绳对MICOS的功能互补性, dpl1型 Δ psd2型 将YCplac22ADH-mTether构建物转化的ΔMICOSΔ细胞在35°C的SCD平板上生长1d,将平板上的细胞系列稀释液新鲜地放置在SCD平板中,并在37°C孵育2d后监测细胞的生长。
统计分析 误差条表示图图例中所示的SD或SEM。 Student’s对两组之间的差异进行了统计分析 t吨 测试。
细胞分离和线粒体分离 根据标准程序对酵母细胞中的线粒体进行细胞分离和分离( Tatsuta和Langer,2007年 ). 为了进一步纯化,对粗线粒体进行清洗,将其重新悬浮在缓冲液A中(0.6 M山梨醇和5 mM MES,pH 6.0),并以连续蔗糖梯度(缓冲液A内20–50%[wt/vol])装载。 蔗糖梯度-在100000离心后,从梯度的下三分之一处收集纯化线粒体 克 1小时,并在冷SEM缓冲液中清洗(10 mM MOPS/KOH,pH 7.2,1 mM EDTA,0.25 M蔗糖)。 通过SDS-PAGE和Western blotting评估细胞器的分离和线粒体的纯度。
磷脂的qMS 质谱分析基本上按照所述进行( Connerth等人,2012年 ; Velázquez等人,2016年 ). 在存在主要磷脂(PC 17:0-14:1、PE 17:0-14:、PI 17:0-14、PS 17:0-14:0、PG 17:0-14:00和PA 17:0-14:3;均来自Avanti极性脂质)和CL(CL混合物I,LM-6003;Avanti Polar Lipids)的内标物的情况下,从分离的纯线粒体或整个酵母细胞中提取脂质。 根据Bligh和Dyer的要求进行提取,并进行了修改( Velázquez等人,2016年 ). 在以下设置下,将脂质溶解在甲醇中的10 mM醋酸铵中,并在配备纳米融合散斑装置(TriVersa NanoMate;Advion)的QTRAP 6500三重四极质谱仪(Sciex)上进行分析:CUR,20; CAD,中等; IHT,90°C; EP,10; 模式:高质量; 步长,0.1 D; 凝结时间,0 ms; 扫描速度,200 D/s; 暂停5ms; CEM,2300; 同步,LC同步; 和扫描模式,Profile(用于QT 6500); 样品输注量,12µl; 样品后抽吸的空气体积,1µl; 芯片前气隙,启用; 吸气延迟,0s; 预穿孔,带芯轴; 喷雾感应,启用; 温度,12°C; 气压,0.4 psi; 电离电压,1.15 kV; 极性,正极; 通风顶部空间,启用; 预湿,1×; 交付后体积,0.5µl; 触点闭合延迟,1s; 音量定时延迟,0 s; 吸入深度,1mm; 预穿孔深度,9mm; 和输出触点闭合,Rel 1/2.5 s持续时间(对于NanoMate)。 四极子Q1和Q3以单位分辨率运行。 在正离子模式下通过扫描前体进行PC分析 米 / z(z) 184在50 eV的碰撞能量(CE)下。PE、PI、PS、PG、PA和CDP-DAG测量在正离子模式下进行,扫描25、30、20、30、25和40 eV的CE处的中性损耗分别为141、277、185、189、115和403 D。 通过扫描质量的前体,以正离子模式识别CL物种( 米 / z(z) 465.4、467.4、491.4、493.4、495.4、505.5、519.5、521.5、523.5、535.5、547.5、549.5、551.5、573.5、575.5、577.5、579.5、601.5、605.5、607.5、631.5、715.5和771.5 D)对应的DAG-H 2 O片段作为40–50 eV CE处的单电荷离子。质谱由LipidView软件1.2版(Sciex)处理,用于脂质的识别和定量。 根据内标物和内源性脂质之间的反应差异,对脂质量(pmol)进行校正。 CL物种同位素重叠的校正根据 Scherer等人(2010年) .
体外脂质结合和转移检测 如前所述,通过脂质体浮选和脂质转移试验进行磷脂结合( Connerth等人,2012年 ; Miliara等人,2015年 ). 为了评估脂质结合,将Ups2–Mdm35复合物(5µM)与脂质体(2 mM总脂质,在1µM过滤器上挤压)在20°C的50µl缓冲液F(MES/NaOH,pH 5.5,100 mM NaCl和2 mM EDTA)中孵育10分钟。孵育后,将样品与100µl 60%蔗糖在缓冲液FB中混合,放入超离心管中, 并覆盖1.35 ml缓冲液F30(F中30%蔗糖)、1 ml缓冲液F10(F中10%蔗糖)和250µl缓冲液F。在200000℃下离心试管 克 在1.5h内,从顶部收集四个700µl的组分,用TCA沉淀组分中的蛋白质,用Tris-Tricine SDS-PAGE分析,并用胶体考马斯亮蓝染色。 在标准分析中,在25°C下,在120µl缓冲液TA(20 mM Tris/HCl,pH 7.4,100 mM NaCl和1 mM EDTA)中存在Ups2–Mdm35复合物(80 nM)、供体脂质体(12.5µM总脂质)和受体脂质体(50µM总脂)时监测脂质转移。
分离线粒体中Psd1酶活性的评估 将线粒体重新悬浮在缓冲液B中(0.1 M Tris-HCl,pH 7.4,10 mM EDTA,和2µM 16:0-06:0 NBD PS[Avanti Polar Lipids,Inc.]),使最终浓度达到5 mg/ml,并在25°C下培养。 在每个时间点采集一部分样品(相当于200µg线粒体),并进行脂质提取。 通过TLC(展开溶剂:氯仿/甲醇/H)分析脂质 2 O/三乙胺30:35:7:35[体积/体积/体积])。 通过荧光成像(Typhoon Trio;GE Healthcare)检测并量化NBD信号。
超微结构研究中的冷冻和冷冻替代 酵母细胞的电子显微镜分析如前所述( Lefebvre-Legendre等人,2005年 ). 简而言之,将酵母细胞颗粒放置在涂有formvar的铜EM格栅(400目)表面。 每个回路很快浸没在预冷的液态丙烷中,并用液氮保持在-180°C。 然后将环转移到干燥丙酮中4%四氧化锇的预冷溶液中,在-82°C的1.8-ml聚丙烯小瓶中放置48小时(替代固定),逐渐加热至室温,并在干燥丙酮中洗涤三次。 样品在4°C的丙酮中用1%醋酸铀酰在黑色房间中染色1小时。 在用干丙酮再次冲洗后,用araldite(环氧树脂,Fluka;Sigma-Aldrich)逐步渗透环。 超薄切片与柠檬酸铅进行对比。
在线补充材料 图S1显示了Ups2变体在体内的功能,它们从 大肠杆菌 以及使用Ups2–Mdm35和SLMO2–TRIAP1进行的体外脂质转运分析,证明了PS转运对负电荷脂质的依赖性。 图S2显示了缺乏Ups/Preli家族脂质转移蛋白和非线粒体PE合成的细胞的乙醇胺原营养物,在Psd1活性测定期间排除脂质体融合的对照实验,PE和Psd1活性在MICOS缺陷细胞中的积累, 人工膜系链表达后这些细胞的呼吸生长,以及评估该系链的细胞定位的实验。 图S3显示了缺乏线粒体外PE合成的MICOS亚基和/或Ups2的细胞的呼吸生长,缺乏Ups2和/或MICOS亚基的线粒体中PE的磷脂剖面和酰基链分布,以及缺乏MICOS和/或Psd1的细胞的呼吸道生长。 表S1列出了本研究中使用的酵母菌株。 在线补充材料可在 http://www.jcb.org/cgi/content/full/jcb.201602007/DC1 .
致谢 我们感谢古德伦·齐默(Gudrun Zimmer)提供的卓越技术支持,以及菲利普·兰普(Philipp Lampe)在无细胞合成方面的支持。
这项工作得到了德国联邦科学院对T.Tatsuta和T.Langer的拨款(LA 918/14-1和TA 1132/2-1)以及欧洲研究委员会对T.Lange的拨款(第233078号公告)的支持。
作者声明没有竞争性的经济利益。
脚注
本文中使用的缩写:
CDP公司 二磷酸胞苷
总工程师 碰撞能量
氯 心磷脂
DOPC公司 1,2-二油酰- 锡 -甘油-3-磷酸胆碱
感应电动机 内膜
智能弹药系统 膜间间隙
MICOS公司 线粒体接触位点与嵴组织系统
运行维护 外层膜
巴基斯坦 磷脂酸
个人计算机 磷脂酰胆碱
体育课 磷脂酰乙醇胺
PS(聚苯乙烯) 磷脂酰丝氨酸
质量管理体系 定量质谱法
联合国安全理事会 合成全套
工具书类
Alkhaja A.K.、Jans D.C.、Nikolov M.、Vukotic M.、Lytovchenko O.、Ludewig F.、Schliebs W.、Riedel D.、Urlaub H.、Jakobs S.和Deckers M。。 2012 MINOS1是丝裂原复合物的一个保守成分,对线粒体功能和嵴组织是必需的。 分子生物学。 单元格。 23:247–257. 10.1091/桶。 E11-09-0774号 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Birner R.、Bürgermeister M.、Schneiter R.和Daum G。。 2001 磷脂酰乙醇胺及其几种生物合成途径在 酿酒酵母 .分子生物学。 单元格。 12:997–1007. 10.1091/mbc.12.4.4.997年 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Choi J.Y.、Wu W.I.和Voelker D.R。。 2005 磷脂酰丝氨酸脱羧酶作为研究磷脂运输的遗传和生物化学工具。 分析。 生物化学。 347:165–175. 10.1016/j.ab.2005.03.017 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Connerth M.、Tatsuta T.、Haag M.、Klecker T.、Westermann B.和Langer T。。 2012 脂质转运蛋白在酵母中的磷脂酸线粒体内转运。 科学。 338:815–818. 10.1126/科学.1225625 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Dee C.T.和Moffat K.G。。 2005 线粒体蛋白的一个新家族由 果蝇属 基因slmo、preli-like和real-time。 Dev.基因进化。 215:248–254. 2007年10月7日/00427-005-0470-4 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Friedman J.R.、Mourier A.、Yamada J.、McCaffery J.M.和Nunnari J。。 2015 MICOS与呼吸复合物和脂质协调,建立线粒体内膜结构。 电子生活。 4 10.7554/eLife.07739 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Gohil V.M.、Thompson M.N.和Greenberg M.L。。 2005 线粒体磷脂酰乙醇胺和心磷脂生物合成途径的合成致死相互作用 酿酒酵母 《生物学杂志》。 化学。 280:35410–35416. 10.1074/jbc。 M505478200型 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Harner M.、Körner C.、Walther D.、Mokranjac D.、Kaesmacher J.、Welsch U.、Griffith J.、Mann M.、Reggiori F.和Neupert W。。 2011 线粒体接触位点复合体,是线粒体结构的决定因素。 EMBO J。 30:4356–4370. 10.1038/emboj.2011.379 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Hoppins S.、Collins S.R.、Cassidy-Stone A.、Hummel E.、Devay R.M.、Lackner L.L.、Westermann B.、Schuldiner M.、Weissman J.S.和Nunnari J。。 2011 以线粒体为中心的遗传相互作用图揭示了线粒体内膜组织所需的支架样复合体。细胞生物学杂志。 195:323–340. 10.1083/jcb.201107053 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Horvath S.E.、Böttinger L.、Vögtle F.N.、Wiedemann N.、Meisinger C.、Becker T.和Daum G。。 2012 酵母线粒体磷脂酰丝氨酸脱羧酶1的加工和拓扑结构。 生物学杂志。 化学。 287:36744–36755. 10.1074/jbc。 M112.398107号 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Horvath S.E.、Rampelt H.、Oeljeklaus S.、Warscheid B.、van der Laan M.和Pfanner N。。 2015 膜接触位点在蛋白质导入线粒体中的作用。蛋白质科学。 24:277–297. 10.1002/pro.2625 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Lefebvre-Legendre L.、Salin B.、Schaöffer J.、Brèthes D.、Dautant A.、Ackerman S.H.和di Rago J.P。。 2005 未能组装ATP合成酶的α3β3亚复合物导致α和β亚单位在包涵体内积聚,线粒体嵴丢失 酿酒酵母 《生物学杂志》。 化学。 280:18386–18392. 10.1074/jbc。 M410789200美元 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
列夫·S。 2010 脂质转运蛋白及其以外的非囊性脂质转运。 自然修订版分子细胞生物学。 11:739–750. 10.1038/nrm2971 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Miliara X.、Garnett J.A.、Tatsuta T.、Abid Ali F.、Baldie H.、Pérez-Dorado I.、Simpson P.、Yague E.、Langer T.和Matthews S。。 2015 线粒体磷脂转移复合物TRIAP1/PRELI样结构域家族的结构洞察。 EMBO代表。 16:824–835. 10.15252/emb.201540229 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Onguka O.、Calzada E.、Ogunnea O.B.和Claypool S.M。。 2015 磷脂酰丝氨酸脱羧酶1的自动催化和功能不需要线粒体特异性因子。 生物学杂志。 化学。 290:12744–12752. 10.1074/jbc。 M115.641118号 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
奥斯曼·C.、哈格·M.、波特·C.、罗德恩费尔斯·J.、迪普·P.V.、维兰德·F.T.、布吕格尔·B.、韦斯特曼·B.和兰格·T。。 2009 禁令的遗传相互作用组:线粒体中保守调节物对心磷脂和磷脂酰乙醇胺的协调控制。细胞生物学杂志。 184:583–596. 10.1083/jcb.200810189 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Potting C.、Tatsuta T.、König T.、Haag M.、Wai T.、Aaltonen M.J.和Langer T。。 2013 TRIAP1/PRELI复合物通过介导磷脂酸的线粒体内转运来防止细胞凋亡。 单元格元数据。 18:287–295. 2016年10月10日/j.cmet.2013.07.008 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Rabl R.、Soubannier V.、Scholz R.、Vogel F.、Mendl N.、Vasiljev-Neumeyer A.、Körner C.、Jagasia R.、Keil T.、Baumeister W.等人。 2009 线粒体嵴和嵴连接的形成取决于Fcj1和Su e.g.J.Cell Biol之间的拮抗作用。 185:1047–1063. 10.1083/jcb.200811099 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Reinisch K.M.和De Camilli P。。 2015 膜接触位点的SMP域蛋白:结构和功能。 生物化学。 生物物理学。 学报: S1388-1981(15)00225-5号 2016年10月10日/j.bbalip2015.12.003 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Scherer M.、Schmitz G.和Liebisch G。。 2010 通过亲水相互作用LC-MS/MS同时定量心磷脂、双(单酰甘油)磷酸及其前体,包括同位素重叠校正。 分析。 化学。 82:8794–8799. 10.1021/ac1021826 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Schwarz D.、Junge F.、Durst F.、Frölich N.、Schneider B.、Reckel S.、Sobhanifar S.、Dötsch V.和Bernhard F。。 2007 膜蛋白的制备规模表达 大肠杆菌 -基于连续交换的无细胞系统。 《国家协议》。 2:2945–2957. 10.1038/nprot.2007.426 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Signorell A.、Gluenz E.、Rettig J.、Schneider A.、Shaw M.K.、Gull K.和Bütikofer P。。 2009 磷脂酰乙醇胺合成的扰动影响线粒体形态和细胞周期进程 布氏锥虫 .摩尔微生物。 72:1068–1079. 10.1111/j.1365-2958.2009.06713.x号 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Simbeni R.、Paltauf F.和Daum G。。 1990 酵母中磷脂的线粒体内转移, 酿酒酵母。 生物学杂志。 化学。 265:281–285. [ 公共医学 ] [ 谷歌学者 ]
Simbeni R.、Pon L.、Zinser E.、Paltauf F.和Daum G。。 1991 酵母的线粒体膜接触位点。 脂质成分的特征和磷脂线粒体内易位的可能参与。 生物学杂志。 化学。 266:10047–10049. [ 公共医学 ] [ 谷歌学者 ]
Tamura Y.、Endo T.、Iijima M.和Sesaki H。。 2009 Ups1p和Ups2p拮抗调节线粒体中的心磷脂代谢。细胞生物学杂志。 185:1029–1045. 10.1083/jcb.200812018 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Tamura Y.、Onguka O.、Hobbs A.E.、Jensen R.E.、Iijima M.、Claypool S.M.和Sesaki H。。 2012年a 两种保守的膜间隙蛋白Ups1p和Ups2p在线粒体内磷脂运输中的作用[已更正]。 生物学杂志。 化学。 287:15205–15218. 10.1074/jbc。 M111.338665号 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Tamura Y.、Onguka O.、Itoh K.、Endo T.、Iijima M.、Claypool S.M.和Sesaki H。。 2012年b 线粒体中磷脂酰乙醇胺的生物合成:磷脂酰丝氨酸(PS)的运输独立于PS脱羧酶和膜间空间蛋白UPS1P和UPS2P。 生物学杂志。 化学。 287:43961–43971. 10.1074/jbc。 M112.390997号 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Tatsuta T.和Langer T。。 2007 研究线粒体内的蛋白质分解。方法分子生物学。 372:343–360. 10.1007/978-1-59745-365-3_25 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Tatsuta T.、Scharwey M.和Langer T。。 2014 线粒体脂质贩运。 趋势细胞生物学。 24:44–52. 2016年10月10日/j.tcb.2013.07.011 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Tavassoli S.、Chao J.T.、Young B.P.、Cox R.C.、Prinz W.A.、de Kroon A.I.和Loewen C.J。。 2013 质膜-内质网接触位点调节磷脂酰胆碱的合成。 EMBO代表。 14:434–440. 2038年10月10日/2013.36年12月10日 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
van Meer G.、Voelker D.R.和Feigenson G.W。。 2008 膜脂:它们的位置和行为。 自然修订版分子细胞生物学。 9:112–124. 10.1038/编号2330 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Velázquez A.P.、Tatsuta T.、Ghillebert R.、Drescher I.和Graef M。。 2016 脂滴介导的内质网稳态调节饥饿期间的自噬和细胞存活。 《细胞生物学杂志》。 212:621–631. 10.1083/jcb.201508102 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
von der Malsburg K.、Müller J.M.、Bohnert M.、Oeljeklaus S.、Kwiatkowska P.、Becker T.、Loniewska-Lwowska A.、Wiese S.、Rao S.、Milenkovic D.等人。 2011 丝裂原在线粒体膜组织和蛋白质生物生成中的双重作用。 开发单元。 21:694–707. 2016年10月10日/j.devcel.2011.08.026 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Wach A.、Brachat A.、Pöhlmann R.和Philippsen P。。 1994 用于经典或基于PCR的基因中断的新异源模块 酿酒酵母 酵母。 10:1793–1808. 10.1002/年320101310 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
王凯(Wang K.)、金姆(Jin M.)、刘欣(Liu X.)和克林斯基(Klinsky D.J.)。。 2013 线粒体i-AAA蛋白酶Yme1对Atg32的蛋白水解处理调节有丝分裂。 自噬。 9:1828–1836. 10.4161/自动26281 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Watanabe Y.、Tamura Y.、Kawano S.和Endo T。。 2015 线粒体中Ups1-Mdm35磷脂转移的结构和机制研究。 6:7922 10.1038/ncomms8922 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
于峰、何峰、姚海、王三、王杰、李杰、祁霞、薛海、丁杰、张平。。 2015 Ups1-Mdm35复合物介导的线粒体内磷脂酸转运的结构基础。 EMBO代表。 16:813–823. 10.15252/emb.201540137 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。