摘要
神经系统功能的一个中心主题是平衡:突触的强弱,神经元的放电频率上下调节,神经回路平衡兴奋与抑制。这种推/拉调节主题一直延续到兴奋性突触的分子水平,其中蛋白质功能通过激酶和磷酸酶的磷酸化和去磷酸化来控制。然而,这些相反的酶活性只是方程的一部分,因为支架相互作用和多蛋白复合物的组装进一步需要有效的局部突触信号。本文将重点介绍突触可塑性过程中支架蛋白对突触后丝氨酸/苏氨酸激酶和磷酸酶信号的协调作用。
关键词:激酶锚定蛋白(AKAP)、钙/钙调蛋白依赖性蛋白激酶II(CaMKII)、钙调神经磷酸酶、钙通道、兴奋-转录偶联、谷氨酸受体、磷酸蛋白磷酸酶1(PP1)、蛋白激酶A(PKA)、支架蛋白、突触可塑性
通过平衡磷酸化/去磷酸化控制突触强度
哺乳动物大脑的一个决定性方面是它具有丰富的经验依赖性可塑性能力,这种可塑性可以改变神经元之间特定突触连接的强度。长期增强(LTP)是兴奋性突触可塑性的两种截然不同的研究形式2和长期抑郁(LTD),分别加强和削弱突触。LTP和LTD在一个叫做海马体的大脑区域进行了最深入的研究,它们支持空间和陈述性学习和记忆。钙诱导LTP和LTD2+通过突触后NMDA-型离子型谷氨酸受体(NMDAR)的内流,分别通过调节兴奋性突触传递的AMPA-型离子性谷氨酸受体功能的长期增加或减少来表达(1,2).
NMDAR是异源四聚体组装体,最常见的是包含两个GluN1和两个GluN2A-2D亚基,并且对Na具有渗透性+,K+和Ca2+在海马突触,NMDAR由GluN1、GluN2A和GluN2B亚单位组装而成。AMPAR是GluA1–GluA4亚基的异源四聚体组装体,大多数仅对Na具有渗透性+和K+由于含有防止Ca的GluA2亚单位2+流入,流入(三). 然而,海马神经元也能表达少量钙2+-缺乏GluA2亚单位的可渗透性AMPAR(即GluA1同源体),主要位于突触外和细胞内位置,但在可塑性和神经元损伤后可被突触吸收(4). 有趣的是,LTP和LTD表面上的拮抗过程背后的分子机制有很多共同点;两者都需要相关的突触前和突触后活动,从而产生NMDAR Ca2+并由重叠的酶组介导。然而,这是突触检测钙的细微差异的能力2+和其他第二信使,并有效地将这些信号转导到离散的下游信号通路,从而允许完全相反的结果产生于极为相似的突触刺激。
最终,兴奋性突触可塑性必须增加、删除或修改AMPAR以改变突触强度。尽管本系列其他地方深入讨论了可塑性期间的AMPAR调节(参见Roche和同事(101)),这里值得一提。简短、强大的NMDAR Ca2+内流可以激活一系列激酶,通过磷酸化两个AMPAR来增加LTP期间的AMPAR活性(2,5–7)和其他调节蛋白(5,8,9). 特别是AMPAR-GluA1亚基在几个C末端尾部残基上被磷酸化,以改变通道的生物物理特性和突触定位。例如,Ca2+-钙调素依赖性蛋白激酶II(CaMKII)和PKC磷酸化Ser-831和Ser-818上的GluA1(仅PKC),以增加LTP期间的单通道电导和突触结合。GluA1在Ser-845上也被cAMP-依赖性蛋白激酶(PKA)磷酸化,这增加了通道开放概率,并刺激循环胞吐来启动AMPAR,以便在LTP期间进行突触插入(参考文献。5–7). 因此,尽管CaMKII可能是NMDAR Ca最重要的直接转换器2+LTP期间的信号传导,多个突触后激酶共同促进增强(图1).
图1。
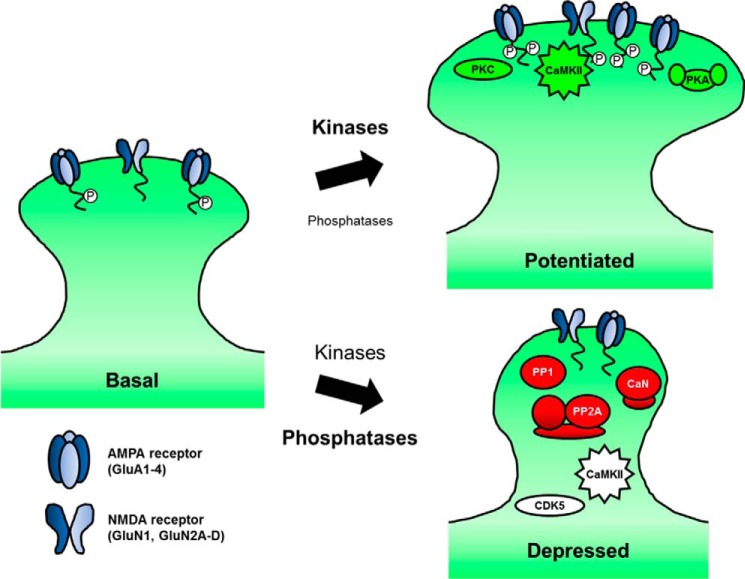
突触可塑性过程中的突触后磷酸化/去磷酸化信号传导。在突触增强过程中,短暂而强烈的细胞溶质钙2+主要激活激酶,如CaMKII、PKC和PKA。AMPA(GluA1–4亚单位)和NMDA型(GluN1和GluN2A-2D亚单位)谷氨酸受体是磷酸化的许多突触靶点之一,促进更强的突触传递。相反,在钙的适度长时间流入期间2+这引发了突触抑制,磷酸酶的活性通常大于激酶的活性;CaN、PP1和PP2A去磷酸化受体、支架和其他突触蛋白,导致树突棘变小,突触强度降低。然而,激酶也在突触抑制中发挥作用。
相反,弱但持续的NMDAR Ca可诱发LTD2+流入。在这些条件下,蛋白磷酸酶1(PP1)、2A(PP2A)和钙调神经磷酸酶(CaN;也称为PP2B)被激活(10–12) (图1). 因此,在LTD期间,AMPAR和其他突触后靶点的去磷酸化通常受到青睐。特别是,GluA1 Ser-845去磷酸化通过促进内吞和防止再循环以利于受体降解,对LTD期间AMPAR的去除至关重要(参考文献。5–7). 因为它被钙直接活化2+CaM、CaN可能是NMDAR Ca最重要、最直接的传感器2+LTD期间的信号传导,但其他磷酸酶和激酶,包括CaMKII(下文讨论),也在LTD期间发挥重要作用(图1). 因此,本综述中讨论的一个首要问题是,无处不在的第二信使系统(cAMP和Ca2+)以及具有广泛底物特异性(PKA、CaMKII、PP1和CaN)的信号酶在突触处组织,以协调LTP和LTD期间非常特定的局部信号事件?
AKAP79/150对突触后PKA、PKC和钙调神经磷酸酶信号的协调调节
上述问题的重要答案可以在突触后密度(PSD)中的支架相互作用网络中找到,PSD是一种位于突触前末端对面树突棘尖端的结构(另见Spence和Soderling(102)本期更多关于树突棘结构)。PSD网络中的支架蛋白定位信号酶,对第二信使作出反应,并对突触底物产生快速影响。由A激酶锚定蛋白(AKAP)79/150(人类79/150;也称为AKAP5)组装的PKA-PKC-CaN复合体是突触后支架组织信号复合体的典型例子(图2) (13).
图2。
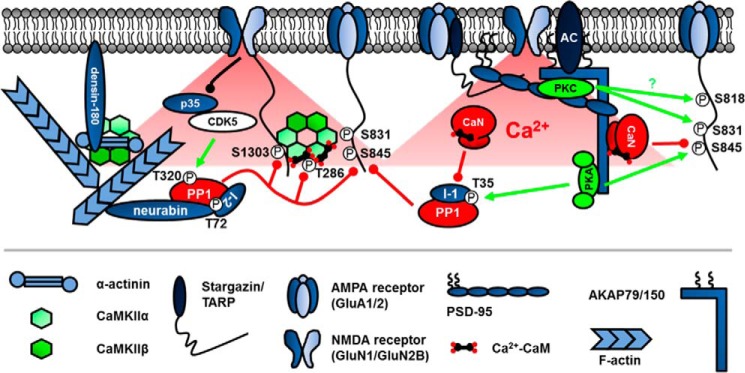
激酶和磷酸酶支架对可塑性过程中的突触后信号传导至关重要。酶以钙为靶点2+cAMP通过与突触支架(如AKAP79/150和PSD-95)以及肌动蛋白结合蛋白(如神经氨酸酶和α-肌动蛋白)结合而来源于重要底物。CaMKII的独特之处在于它是一种酶、自支架和肌动蛋白组织者。带圆圈P代表磷酸化。绿线代表磷酸化,以及红线代表去磷酸化。这个黑线代表失活CDK5激酶活性的p35降解。所描述的特异性AMPAR和NMDAR是GluA1/2和GluN1/2B。TARP是跨膜AMPA受体调节蛋白的缩写。
第一个特征是通过其C端两亲性α-螺旋结构域结合PKA(14),AKAP79/150随后被证明能结合CaN(15)通过P的变体X(X)我X(X)其他CaN结合蛋白中发现的IT基序(16–18)和PKC通过其N-末端膜靶向结构域(19). AKAP79/150也作为一个结构脚手架枢纽,因为它结合F-actin(20)、质膜脂质磷脂酰肌醇-4,5-二磷酸(21),突触粘附分子(22)和连接NMDAR和AMPAR的PSD-95家族支架蛋白(23). 鉴于AKAP79/150收集锚定酶并与谷氨酸受体相连,因此它在突触可塑性中起着不可或缺的作用也就不足为奇了。事实上,使用AKAP150基因敲除小鼠的实验证明了这种支架在海马LTD和空间学习中的作用(24). 对缺乏PKA锚定位点的AKAP150 C末端截断敲除小鼠的进一步分析表明,AKAP-PKA信号传导促进GluA1 Ser-845磷酸化并支持LTP,LTD和逆转学习(25–27). 此外,利用RNAi进行突变替换的研究(28,29)和一只缺乏P的AKAP150敲入小鼠X(X)我X(X)IT-like CaN对接图案(30)揭示锚定CaN介导GluA1 Ser-845去磷酸化和AMPAR内吞促进LTD和抑制LTP。此外,AKAP-CaN或-PKA锚定的基因破坏改变了空间和情境恐惧学习和记忆。三最后,尽管AKAP79/150锚定的PKC可以磷酸化异种细胞和培养神经元中的GluA1 Ser-831,但AKAP-PKC锚定在突触可塑性和认知中的作用尚未得到解决(31). 总之,这些研究说明了支架在局部平衡磷酸化和去磷酸化以控制突触可塑性方面发挥的关键作用。
除了定位激酶和磷酸酶外,AKAP还可以结合cAMP信号通路的其他关键成分,包括G蛋白偶联受体、腺苷酸环化酶(AC)和磷酸二酯酶。AKAP79/150与β结合2-肾上腺素能受体(β2AR)(32)和多种AC亚型(33,34). β2AR与AC-cAMP-PKA信号耦合,通过GluA1磷酸化增强LTP和学习记忆(35,36). 在一系列优雅的实验中,比较AKAP150敲除小鼠和AKAP150-PKA结合缺陷小鼠,AKAP敲除小鼠在β2AR增强GluA1 Ser-845磷酸化和LTP(37). PKA结合缺陷小鼠较不严重的表型归因于与AC保持相互作用,导致β2AR-刺激的cAMP生产可能通过其他PKA池发出信号,尽管效果较差。值得注意的是,AKAP250/Gravin(也称为AKAP12)也可以与β2AR促进LTP监管(38). 因此,这两种AKAP-PKA复合物在突触后LTP调节中可能存在相互作用。有趣的是,在上述许多研究中,发现AKAP79/150锚定的PKA和CaN通过优先控制GluA1 Ca影响LTP/LTD2+-可能是因为这些GluA1同源单体可以在四个Ser-845位点磷酸化,而GluA1/2异构体中只有两个位点磷酸化(26,30,37).
由于其微米大小,树突棘本身是用于分隔信号的微域,但很明显,AKAP79/150和其他PSD支架蛋白形成了在分子/纳米尺度上起作用的突触后信号复合物。这种脊髓内纳米域信号可能发生在PSD的受体附近、脊椎质膜的突触外区域或脊椎放大的内体中。AKAP79/150也是突触后纳米靶向的一个很好的例子,因为其自身的定位是通过棕榈酰酰基转移酶DHHC2对其N-末端靶向结构域的可逆棕榈酰化来微调的(39,40). AKAP79/150棕榈酰化对于一般靶向质膜来说不是必需的,但对于质膜脂筏(与PSD相关)的特异定位和再循环内体来说是必需的(40,41). 重要的是,在化学LTP诱导期间,内体中的AKAP79/150棕榈酰化是刺激循环胞吐和AKAP和GluA1传递到突触所必需的(39,40). 然而,总的来说,我们对AKAP79/150和其他突触后支架的贩运的理解落后于我们对它们控制的AMPAR贩运的理解。我们确实知道,在化学LTD诱导过程中,AKAP79/150可以与PSD-95支架解偶联,并通过去棕榈酰化的组合抑制其N-末端靶向相互作用,从突触后膜和内体中去除(39)磷脂酰肌醇-4,5-二磷酸的磷脂酶C裂解,以及依赖CaN的F-actin重组。重要的是,在LTD过程中对AKAP79/150膜靶向的这种抑制可能会阻止PKA介导的GluA1的再磷酸化,这将促进循环并逆转LTD(参考文献。13). 有趣的是,AKAP79/150突触定位、PKA和CaN信号以及GluA1 Ser-845磷酸化的变化最近也被牵涉到调节GluA1突触定位,动态平衡形式的突触可塑性,可在所有输入中上调或下调突触强度,以响应整体神经元活动的慢性增加或减少(42,43).
突触后CaMKII信号的调节
CaMKII是由α、β、γ和δ亚型组装而成的十二元全酶。在大多数神经元中,CaMKII含有α>βγ/δ亚型。由于其在突触处的富集和钙的机制2+调节,CaMKII(尤其是α)在突触可塑性领域引起了广泛关注(44–46). 对钙的反应2+海拔,Ca2+-与CaMKII结合的CaM取代了自身抑制域,以允许外源底物和相邻Ca自身抑制域中Thr-286(β,γ,δ上的Thr-287)的活性位点进入2+-CaM-结合亚单位。Thr-286的自磷酸化以两种方式修饰CaMKII功能:它增强Ca2+-CaM结合亲和力(即所谓的CaM陷阱)并阻止自身抑制结构域完全占据活性位点,产生所谓的CaMKII“自主性”,其中激酶在CaM解离后保持部分活性。重要的是,CaMKII自主性作为过去Ca的“分子记忆”的一种形式发挥作用2+在LTP诱导和学习记忆中起着至关重要的作用(47,48). CaMKII Thr-286可以被PP1或PP2A去磷酸化,但PP1似乎在PSD中CaMKIL的去磷酸化中起着更显著的作用(49). 在强烈的突触刺激后,更多的CaMKII也迅速被招募到PSD(50–53),其中不仅磷酸化AMPAR及其辅助亚单位(8,9)也包括小型GTPase调节器(54,55)和粘附分子(56). 有这么多重要的靶点,CaMKII突触后信号是如何控制的?因为有很多关于这个主题的综合评论(44–46),这里我们将主要关注控制CaMKII信号的特定突触后支架相互作用(图2).
CaMKII全酶结构允许CaMKIα和β亚基通过共同和不同的相互作用蛋白相互作为支架。F-actin结合是一种明显受β控制的相互作用与α亚单位。CaMKII可以通过适配器蛋白α-肌动蛋白间接与F-肌动蛋白结合(57)但也可以通过其β亚型直接结合F-actin(58–61). 钙激活后2+-CaM,CaMKIIβ从F-actin中解离,使激酶重新分布并建立新的相互作用。特别是,CaMKII活化促进与PSD支架密度-180的结合;然而,由于致密蛋白-180也与α-肌动蛋白结合,因此产生了一种三元复合物,它仍然可以与F-肌动蛋白连接,但也可以通过CaMKII与Glu22B亚基的结合进一步与NMDARs结合(57,62,63). 然而,更为复杂的是,CaMKII与GluN1亚单位之间存在二次相互作用,而α-肌动蛋白结合GluN1反而抑制了这种相互作用(64). 重要的是,CaMKII和F-actin相互作用;CaMKII是通过与F-肌动蛋白的相互作用来定位的,但反过来可以通过其β亚型在Ca中直接捆绑和稳定肌动蛋白纤维2+-CaM调节方式(59–61). 的确,CaMKIIβ对肌动蛋白细胞骨架的完整性很重要,其丢失会破坏脊椎的稳定性(61). 有趣的是,CaMKIIβ缺失对脊柱的这种影响可以用激酶失活突变体来挽救,这突出了CaMKII作为结构支架的功能。通过比较CaMKIIβ基因敲除小鼠和表达激酶敏感性CaMKIβ基因的小鼠的表型,进一步证实了这种激酶依赖性作用的重要性(65). 尽管CaMKIIβ基因敲除会损害CaMKI突触定位、LTP和学习,但这些功能都不会被激酶活性突变所破坏。
如上所述,另一个关键的CaMKII突触后相互作用是与NMDAR GluN2B亚单位的相互作用,该亚单位在CaMKIII磷酸化位点Ser-1303附近的C末端尾部包含一个结合位点(66–69). 激活的CaMKII在Ca后迅速向GluN2B募集2+刺激,但像Thr-286磷酸化一样,持续Ca2+信号,从而允许突触后CaMKII参与另一种形式的“分子记忆”。事实上,CaMKI与GluN2B的结合与LTP维持和记忆巩固有关。在一项研究中,发现高剂量的抑制肽(tatCN21)与GluN2B竞争CaMKII结合,会严重破坏GluN2B-CaMKIII结合和LTP维持(70). 在第二项研究中,CaMKII结合缺陷的GluN2B敲除小鼠表现出GluA1 Ser-831磷酸化、LTP和记忆巩固的降低(71). 总之,这些发现支持了一个模型,在该模型中,CaMKII的酶和非酶功能可以协同工作,在兴奋性突触处处理和存储信息。
大量证据表明CaMKII在LTP中的作用,但越来越多的证据表明它也参与LTD(72). 有趣的是,GluA1中一个新表征的Ser-567磷酸化位点导致AMPAR突触排斥(73),最近被证明在NMDAR LTD条件下被自主CaMKII磷酸化(72). 此外,与LTP中涉及的典型CaMKII底物相比,GluA1 Ser-567表现出明显的特征(即Ser-831)在该Ca中2+-CaM刺激不会使Ser-567磷酸化水平高于自主CaMKII获得的水平。因此,一个有趣的新假设是,有两类CaMKII底物受刺激物的差异调节与自主激酶活性分别有利于LTP或LTD。这些最近的发现也为过于简化的规则提供了一个明显的例外,即激酶介导突触增强,磷脂酶介导突触素抑制。
突触后PP1信号的调节
理解可塑性的另一个挑战是,突触的变化往往是通过多种平行和重叠的信号通路来控制的,如CaN、PP1和PP2A磷酸酶,它们都参与LTD(10–12). 与AKAP79/150对CaN信号的控制一样,PP1和PP2A信号也严重依赖于结合伙伴来调节活性和亚细胞靶向性,但由于对LTD期间PP2A的信号调节知之甚少,因此我们将仅讨论PP1。在突触后PP1调节蛋白中最突出的是相关的F-肌动蛋白结合蛋白neurabin-1(图2)和嗜棘蛋白(也称为神经纤维蛋白-2),通过具有松散一致序列(K/R)(V/I)的模块化结合基序来锚定PP1X(X)(F/W),通常缩写为RVX(X)F类(74). 重要的是,使用竞争性RV破坏PP1和神经氨酸酶/嗜酸性粒细胞蛋白之间的相互作用X(X)F结合基序肽能阻断LTD(75). 此外,通过突变对neurabin-PP1关联的特异性干扰抑制LTD,而野生型neurabin-1的过度表达增强LTD并促进GluA1 Ser-845和Ser-831的去磷酸化(76,77). 总的来说,这些发现支持了一个模型,即neurabin-1在LTD期间招募PP1到突触以促进AMPAR去磷酸化。
因此,另一个关键问题是,当PP1酶活性与神经氨酸等支架复合时,突触活性是如何调节的?历史上,海马LTD期间PP1的NMDAR激活模型暗示了CaN介导的PP1抑制性PKA底物抑制剂-1(I-1)的去磷酸化(10). 此外,神经氨酸酶1的PKA磷酸化可以抑制其PP1结合,这是一种可能有利于LTP的机制(76,78). 然而,最近NMDAR信号中的几个其他PP1调节机制受到了关注,包括PP1与抑制剂-2(I-2)的结合,可能在与神经大麻素-1的三元复合物中,以及Thr-320上的PP1抑制性磷酸化。特别是,最近的工作确定了细胞周期素依赖性激酶5(CDK5)是PP1 Thr-320的激酶,并证明当CDK5通过其p35亚单位的蛋白酶体降解被突触NMDAR激活所抑制时,PP1自身磷酸化物变得活跃(79). 这项研究还揭示了PP1与I-2结合的需求,I-2 Thr-72去磷酸化增加了PP1的结合,以促进NMDAR LTD期间的PP1信号传导;该机制与PP1通过Thr-35去磷酸化与I-1结合的逆转形成对比。总之,这些研究表明一个激酶(CDK5)和多个PP1结合蛋白共同调节突触后PP1的活性(图2). 有趣的是,最近的另一项研究发现,PP1也是稳态突触降尺度所必需的,但在这种情况下,PP1通过肌球蛋白轻链激酶的Ser-43磷酸化从I-2抑制中释放出来而被激活(80).
协同激酶和磷酸酶信号在突触后兴奋-转录偶联中的作用
持续数小时、数天、数月甚至数年的持久可塑性形式,如LTP晚期,不仅需要LTP早期AMPAR突触定位的初始变化,还需要随后的基因转录(81)和蛋白质合成(由Alvarez-Castelao和Schuman报道(103)本期)。将神经元活性的急性变化与基因转录的持续变化联系起来的几种途径依赖于局部钙2+通过电压门控L型钙通道(LTCC)流入,触发转录因子的磷酸化或去磷酸化,如钙2+/cAMP反应元件结合蛋白(CREB)、CREB调节的转录辅活化因子(CRTC1)和活化T细胞核因子(NFAT)(82–84). 特别是LTCC Ca的特权角色2+在与LTP/LTD和长期记忆相关的神经元兴奋-转录(E-T)耦合中向CREB发出信号已经被认识了近25年(85–88).
CREB自身的转录激活功能可以通过多种激酶(包括PKA、CaMKs和ERK)对Ser-133进行磷酸化来控制(81). 然而,E-T偶联的研究揭示了激酶和磷酸酶在激活CREB依赖性转录中的重要作用。在多种类型的神经元中,LTCC激活CaN和CaMKII,它们在调节CREB介导的转录中可能起到相反或合作的作用(83,89,90). 然而,最近对交感和皮层神经元的研究发现,LTCC Ca2+内流将CaMKIIβ招募到CaMKIγ自身抑制区的反磷酸化Thr-287通道中,并促进Ca2+-CaM捕获,而CaN的伴随激活在CaMKIIγ的核定位序列中使Ser-334去磷酸化。随后的CaMKIIγ易位和CaM穿梭到细胞核,然后激活CaMK激酶(CaMKK)和CaMKIV磷酸化CREB(91). 有趣的是,CaMKIIγ的一个激酶活性突变体能够向CREB发出信号,从而为CaM穿梭提供额外的支持,而不是CaMKIIIγ的酶作用。因此,CaMKIIγ在两个关键位点的磷酸化调节使其能够将CaM穿梭到细胞核并诱导基因转录。然而,CaMKIIγ磷酸化状态和CaM结合的变化是如何被精确调节到仅在通道处加载CaM,然后在细胞核中释放CaM的分子细节有待进一步研究。此外,根据这种机制,只有完全由γ亚型组成的CaMKII全酶才能进入细胞核(图3); 否则,很难排除与CaMKIIγ联合进入细胞核的酶活性CaMKIβ产生的额外信号。
图3。
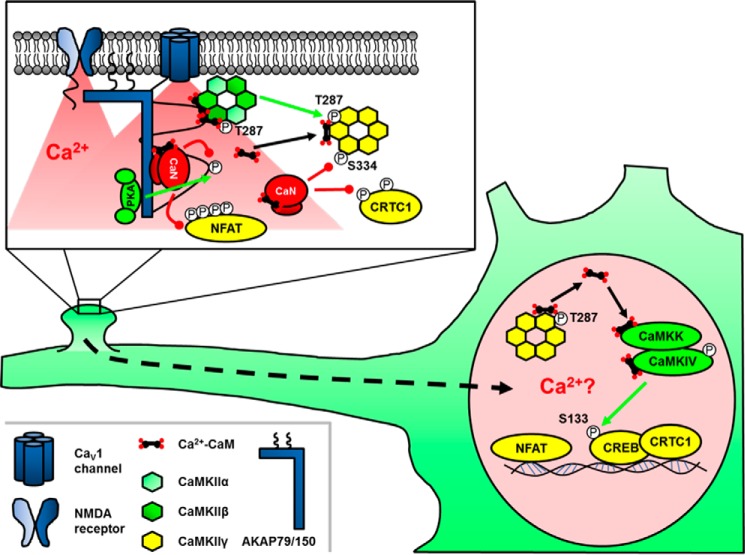
突触后兴奋-转录耦合中激酶和磷酸酶的信号传递。锚定激酶和磷酸酶微调钙2+通过LTCC流入。钙激活的磷酸酶CaN使转录因子NFAT和CRTC1上的核定位序列去磷酸化,从而允许它们转移到细胞核。LTCC-钙内流还激活CaMKIIα/β,该α/β可以磷酸化并“锁定”CaMKIIIγ,形成与Ca紧密结合的构象2+-卡姆。随后CaN介导的CaMKIIγ核定位序列的去磷酸化驱动核移位和钙的传递2+-CaM到CaMKIV,磷酸化并激活CREB。绿线代表磷酸化,以及红线代表去磷酸化。
上述CaMKII-CaMKIV信号机制也可能仅对兴奋后CREB激活的初始快速阶段(秒至分钟)起作用,其中Ca2+不仅在LTCC附近增加,而且在全球范围内增加,以保持Ca2+-将CaM一直结合到细胞核。相比之下,局部LTP诱导和钙限制导致CREB激活时间延长(分钟到小时)2+树突内流被认为是由ERK通路的局部突触后CaMKII激活介导的,随后是ERK信号从树突到细胞核的较慢、较长距离的易位,以磷酸化CREB(87,92,93). 此外,CREB共激活物CRTC1被CaN去磷酸化,以响应LTCC Ca2+突触输入到树突触发的内流,然后缓慢地向远端转移到细胞核,在那里CREB依赖的基因表达是恐惧记忆的基础(83,94). 因此,尽管CREB E-T耦合中的许多关键因素已经确定,但未来的工作必须进一步探索细胞和突触组织的机制,以允许在这些不同的距离和时间尺度上向CREB发送信号。
在一个平行的E-T耦合系统中,关于突触后组织对核信号传递的贡献已经有了更多的研究,该系统是NFAT在短暂的局部LTCC Ca后转位到细胞核(超过几分钟到一小时)2+神经元大量涌入。过去十年的研究揭示了AKAP79/150有组织信号复合物在PKA/CaN双向调节神经元LTCC活性和NFAT介导的E-T偶联中的复杂性和重要性(图3) (18,95,96). AKAP79/150直接结合LTCC CaV(V)1.2通过C端亮氨酸拉链并通过P锚定CaNX(X)我X(X)与NFAT转录因子自身中发现的CaN对接序列非常相似的IT-like基序(17). 然而,尽管在本质上与NFAT竞争CaN结合并抑制PKA介导的LTCC活性增强,AKAP79/150-CaN锚定对LTCC Ca激活NFAT至关重要2+流入,流入(18,95). AKAP究竟是如何促进LTCC-CaN-NFAT信号传导的?在AKAP-CaN复合物晶体结构的指导下,PX(X)我X(X)令人惊讶的是,设计用于增加或减少CaN锚定亲和力的IT-like基序均被发现抑制NFAT激活。特别是,增加锚定亲和力将CaN固定在脊椎中,并阻止NFAT移位到细胞核(97). 因此,AKAP-CaN锚定必然是动态的,并通过平衡其上游激活物LTCC附近CaN的强烈补充与其有效释放以与其下游效应器NFAT通信来促进NFAT信号传递。
基于局部信号复合物的动态和平衡这一主题,其他研究发现,AKAP79/150-PKA锚定的破坏,通过急性过度表达和PKA锚定缺陷突变体的敲除,也可以阻止NFAT信号传导,这是一种可归因于基础LTCC磷酸化深度降低的缺陷,电流密度和去极化诱发Ca2+流入,流入(98,99). 因此,神经元LTCC-NFAT转录信号需要精确组织和平衡通道纳米环境中CaN的磷酸酶活性(NFAT激活所需)与PKA的相反激酶活性(防止CaN抑制通道功能所需)。重要的是,这些对AKAP79/150的研究提供了一些迄今为止最完整和详细的分子机制,解释了局部Ca2+LTCC信号在神经元E-T偶联中起着特殊的作用。
结论和未来方向
显然,突触后激酶/磷酸酶信号平衡是在多个时间尺度上调节突触可塑性的关键,通过控制局限于突触的局部信号转导以及与细胞核的远端通讯。在所有情况下,所需的高度信号特异性和效率都是由调节性结合伙伴/支架赋予的,在确定对突触功能的影响时,它们与激酶和磷酸酶本身的活动一样重要。事实上,不同甚至相反类型的可塑性可能涉及相同的激酶和磷酸酶参与者,但这些参与者的行动似乎是通过支架相互作用指向一种或另一种途径,以实现不同的结果。未来的研究应进一步阐明支架蛋白如何通过使用新的超分辨率显微镜方法在纳米尺度上询问信号复合物,在这种局部、突触后决策中发挥关键作用(100). 此外,进一步探索支架定向磷酸化如何通过其他可逆的翻译后修饰(如棕榈酰化和泛素化)与信号传导相互交叉也很重要(6)(另见阿尔瓦雷兹·卡斯特劳和舒曼(103)本期)。最后,鉴于许多神经精神和神经疾病的特点是突触可塑性的改变,更好地了解突触处激酶/磷酸酶信号通路的组织方式,有望找到治疗脑疾病的新药物靶点和疗法。与使用现有药理学全局抑制激酶和磷酸酶催化活性相比,精确靶向突触支架相互作用在提高疗效和特异性方面可能具有许多优势。
致谢
我们感谢Matthew Kennedy博士和Ulli Bayer博士批判性地阅读了这份手稿。尽管我们试图尽可能地做到包容性和全面性,并强调了该领域过去和最近的出版物,但对于本次小评论中遗漏的任何其他重要贡献和参考,我们深表歉意。由于篇幅限制,我们需要限制引文数量,并将重点放在文献中的特定主题和示例上。
*这项工作得到了美国国立卫生研究院NS040701和MH102338(对M.L.D.)的资助。这是专题迷你评论系列“突触可塑性的分子机制”中的第二篇文章。作者声明,他们与本文的内容没有利益冲突。内容完全由作者负责,不一定代表美国国立卫生研究院的官方观点。
2使用的缩写如下:
- 长期有形资产
长期增强作用
- 有限公司
长期抑郁症
- 自动控制
腺苷酸环化酶
- AKAP公司
A激酶锚定蛋白
- β2应收账
β2-肾上腺素能受体
- CaM公司
钙调素
- CaMK公司
钙2+-钙调素依赖性蛋白激酶
- 加拿大
钙调神经磷酸酶
- 川东北5
细胞周期素依赖性激酶5
- CREB公司
钙2+/cAMP反应元件结合蛋白
- 阴极射线管1
CREB-调节转录辅激活物
- E-T公司
激发-传递
- 识别1
抑制剂-1
- 识别码2
抑制剂-2
- 长期资本成本
L型钙通道
- 美国国家足球协会
活化T细胞的核因子
- PP1项目
蛋白磷酸酶1
- 第2a页
蛋白磷酸酶2A
- PP2B型
蛋白磷酸酶2B
- 屏蔽门
突触后密度
- NMDAR公司
NMDA型离子型谷氨酸受体
- AMPAR公司
AMPA型离子型谷氨酸受体。
工具书类
-
1.Malenka R.C.和Bear M.F.(2004)LTP and LTD:财富的尴尬。神经元44, 5–21[内政部] [公共医学] [谷歌学者]
-
2Huganir R.L.和Nicoll R.A.(2013)AMPAR和突触可塑性:过去25年。神经元80, 704–717[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
三。Dingledine R.、Borges K.、Bowie D.和Traynelis S.F.(1999)《谷氨酸受体离子通道》。药理学。版次51,7-61[公共医学] [谷歌学者]
-
4Liu S.J.和Zukin R.S.(2007),加利福尼亚州2+-渗透性AMPA受体在突触可塑性和神经元死亡中的作用。《神经科学趋势》。30, 126–134[内政部] [公共医学] [谷歌学者]
-
5Lee H.K.(2006)突触可塑性和磷酸化。药理学。疗法。112, 810–832[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
6Lu W.和Roche K.W.(2012)AMPA受体转运和功能的翻译后调控。货币。操作。神经生物学。22, 470–479[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
7Anggon V.和Huganir R.L.(2012)《AMPA受体贩运和突触可塑性的调节》。货币。操作。神经生物学。22, 461–469[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
8Tomita S.、Stein V.、Stocker T.J.、Nicoll R.A.和Bredt D.S.(2005)通过星形胶质瘤样TARP的磷酸化调节双向突触可塑性。神经元45, 269–277[内政部] [公共医学] [谷歌学者]
-
9Opazo P.、Labrecque S.、Tigaret C.M.、Frouin A.、Wiseman P.W.、De Koninck P.和Choquet D.(2010)CaMKII通过星形胶质瘤素的磷酸化触发表面AMPAR的扩散捕获。神经元67, 239–252[内政部] [公共医学] [谷歌学者]
-
10Mulkey R.M.、Endo S.、Shenolikar S.和Malenka R.C.(1994),钙调神经磷酸酶/抑制剂-1磷酸酶级联在海马长期抑郁中的参与。自然369, 486–488[内政部] [公共医学] [谷歌学者]
-
11Nicholls R.E.、Alarcon J.M.、Malleret G.、Carroll R.C.、Grody M.、Vronskaya S.和Kandel E.R.(2008)缺乏NMDAR依赖性LTD的转基因小鼠表现出行为灵活性不足。神经元58, 104–117[内政部] [公共医学] [谷歌学者]
-
12Beattie E.C.、Carroll R.C.、Yu X.、Morishita W.、Yasuda H.、von Zastrow M.和Malenka R.C.(2000)通过与LTD.Nat.Neurosci共享的信号机制调节AMPA受体内吞作用。3, 1291–1300[内政部] [公共医学] [谷歌学者]
-
13Sanderson J.L.和Dell’Acquia M.L.(2011)AKAP信号复合物在兴奋性突触可塑性调节中的作用。神经科学家17, 321–336[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
14Carr D.W.、Stofko-Hahn R.E.、Fraser I.D.、Cone R.D.和Scott J.D.(1992)通过A激酶锚定蛋白将cAMP依赖性蛋白激酶定位到突触后密度。AKAP 79的特性。生物学杂志。化学。267, 16816–16823[公共医学] [谷歌学者]
-
15Coghlan V.M.、Perrino B.A.、Howard M.,Langeberg L.K.、Hicks J.B.、Gallatin W.M.和Scott J.D.(1995)蛋白激酶A和蛋白磷酸酶2B与共同锚定蛋白的关联。科学类267, 108–111[内政部] [公共医学] [谷歌学者]
-
16Dell'Acqua M.L.、Dodge K.L.、Tavalin S.J.和Scott J.D.(2002)绘制AKAP79上的蛋白磷酸酶-2B锚定位点。磷酸酶活性的结合和抑制由残基315-360介导。生物学杂志。化学。277, 48796–48802[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
17Li H.、Rao A.和Hogan P.G.(2011)钙调神经磷酸酶与底物和靶向蛋白质的相互作用。趋势细胞生物学。21, 91–103[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
18Oliveria S.F.、Dell’Acqua M.L.和Sather W.A.(2007)AKAP79/150钙调神经磷酸酶锚定控制神经元L型钙2+通道活性和核信号传导。神经元55, 261–275[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
19Klauck T.M.、Faux M.C.、Labudda K.、Langeberg L.K.、Jaken S.和Scott J.D.(1996)哺乳动物支架蛋白AKAP79对三种信号酶的协调。科学类271, 1589–1592[内政部] [公共医学] [谷歌学者]
-
20Gomez L.L.、Alam S.、Smith K.E.、Horne E.和Dell'Acqua M.L.(2002)通过NMDA受体激活钙调神经磷酸酶和树突状肌动蛋白重塑调节A激酶锚定蛋白79/150-cAMP依赖性蛋白激酶突触后靶向。《神经科学杂志》。22, 7027–7044[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
21Dell'Acquia M.L.、Faux M.C.、Thorburn J.、Thorburn A.和Scott J.D.(1998)AKAP79上的膜靶向序列结合磷脂酰肌醇-4,5-二磷酸。EMBO期刊17,2246–2260[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
22.Gorski J.A.、Gomez L.L.、Scott J.D.和Dell’Acqua M.L.(2005)神经元和上皮细胞中A-激酶锚定蛋白信号支架与钙粘蛋白粘附分子的关联。分子生物学。单元格16, 3574–3590[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
23.Colledge M.、Dean R.A.、Scott G.K.、Langeberg L.K.,Huganir R.L.和Scott J.D.(2000)通过MAGUK-AKAP复合物将PKA靶向谷氨酸受体。神经元27, 107–119[内政部] [公共医学] [谷歌学者]
-
24Tunquist B.J.、Hoshi N.、Guire E.S.、Zhang F.、Mullendorff K.、Langeberg L.K.、Raber J.和Scott J.D.(2008)AKAP150缺失会干扰小鼠的不同神经元过程。程序。国家。阿卡德。科学。美国105、12557–12562[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
25Weisenhaus M.、Allen M.L.、Yang L.、Lu Y.、Nichols C.B.、Su T.、Hell J.W.和McKnight G.S.(2010)AKAP5突变破坏树突状信号复合物并导致小鼠的电生理和行为表型。公共科学图书馆5,e10325。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
26Lu Y.、Allen M.、Halt A.R.、Weisenhaus M.、Dallapiaza R.F.、Hall D.、Usachev Y.M.、McKnight G.S.和Hell J.W.(2007)LTP中AKAP150锚定的PKA和GluR2-标记的AMPA受体的年龄依赖性需求。EMBO期刊26,4879–4890[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
27Lu Y.、Zhang M.、Lim I.A.、Hall D.D.、Allen M.、Medvedeva Y.、McKnight G.S.、Usachev Y.M.和Hell J.W.(2008)AKAP150支持的PKA活动对LTD在其诱导阶段的发展至关重要。《生理学杂志》。586, 4155–4164[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
28Jurado S.、Biou V.和Malenka R.C.(2010)NMDA受体依赖性长期抑郁症需要钙调神经磷酸酶/AKAP复合物。自然神经科学。13, 1053–1055[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
29Bhattacharyya S.、Biou V.、Xu W.、Schlüter O.和Malenka R.C.(2009)PSD-95/AKAP相互作用在突触AMPA受体内吞中的关键作用。自然神经科学。12, 172–181[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
30Sanderson J.L.、Gorski J.A.、Gibson E.S.、Lam P.、Freund R.K.、Chick W.S.和Dell’Acqua M.L.(2012)AKAP150锚定的钙调神经磷酸酶通过限制钙的突触结合来调节突触可塑性2+-可渗透的AMPA受体。《神经科学杂志》。32, 15036–15052[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
31Tavalin S.J.(2008)AKAP79选择性增强Ca处GluR1的蛋白激酶C调节2+-钙调素依赖性蛋白激酶II/蛋白激酶C位点。生物学杂志。化学。283, 11445–11452[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
32Fraser I.D.、Cong M.、Kim J.、Rollins E.N.、Daaka Y.、Lefkowitz R.J.和Scott J.D.(2000)《AKAP/β的组装》2-肾上腺素受体信号传导复合体促进受体磷酸化和信号传导。货币。生物10,409–412[内政部] [公共医学] [谷歌学者]
-
33Efendiev R.、Samelson B.K.、Nguyen B.T.、Phatarpekar P.V.、Baameur F.、Scott J.D.和Dessauer C.W.(2010)AKAP79与多种腺苷酸环化酶(AC)亚型和支架AC5和-6与α-氨基-3-羟基-5-甲基-4-异恶唑丙酸(AMPA)受体相互作用。生物学杂志。化学。285, 14450–14458[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
34Bauman A.L.、Soughayer J.、Nguyen B.T.、Willoughby D.、Carnegie G.K.、Wong W.、Hoshi N.、Langeberg L.K.、Cooper D.M.、Dessauer C.W.和Scott J.D.(2006)通过锚定的PKA-腺苷酸环化酶V/VI复合物动态调节cAMP合成。分子电池23, 925–931[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
35Qian H.、Matt L.、Zhang M.、Nguyen M.、Patriarch T.、Koval O.M.、Anderson M.E.、He K.、Lee H.和Hell J.W.(2012)β2-肾上腺素能受体支持延长θ-破伤风诱导的LTP。《神经生理学杂志》。107, 2703–2712[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
36Hu H.、Real E.、Takamiya K.、Kang M.G.、Ledoux J.、Huganir R.L.和Malinow R.(2007)情绪通过去甲肾上腺素调节AMPA受体贩运来增强学习。单元格131, 160–173[内政部] [公共医学] [谷歌学者]
-
37Zhang M.、Patriarch T.、Stein I.S.、Qian H.、Matt L.、Nguyen M.、Xiang Y.K.和Hell J.W.(2013)激酶锚定蛋白AKAP5(AKAP79/150)的腺苷酸环化酶锚定对突触后β肾上腺素能信号传导很重要。生物学杂志。化学。288, 17918–17931[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
38Havekes R.、Canton D.A.、Park A.J.、Huang T.、Nie T.、Day J.P.、Guercio L.A.、Grimes Q.、Luczak V.、Gelman I.H.、Baillie G.S.、Scott J.D.和Abel T.(2012)Gravin策划蛋白激酶A和β2-肾上腺素能受体信号对突触可塑性和记忆至关重要。《神经科学杂志》。32, 18137–18149[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
39Keith D.J.、Sanderson J.L.、Gibson E.S.、Woolfrey K.M.、Robertson H.R.、Olszewski K.、Kang R.、El-Husseni A.和Dell'Acquia M.L.(2012)A激酶锚定蛋白79/150的棕榈酰化调节树突内体靶向和突触可塑性机制。《神经科学杂志》。32, 7119–7136[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
40Woolfrey K.M.、Sanderson J.L.和Dell’Acqua M.L.(2015)棕榈酰酰基转移酶DHHC2通过AKAP79/150的棕榈酰化调节再循环内体胞吐和突触增强。《神经科学杂志》。35, 442–456[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
41Delint-Ramirez I.、Willoughby D.、Hammond G.R.V.、Ayling L.J.和Cooper D.M.(2011)棕榈酰化将AKAP79蛋白靶向脂筏,并促进其对钙敏感腺苷酸环化酶8型的调节。生物学杂志。化学。286, 32962–32975[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
42Diering G.H.、Gustina A.S.和Huganir R.L.(2014)通过AKAP5偶联PKA-GluA1控制双向稳态可塑性过程中AMPA受体磷酸化和细胞表面靶向。神经元84, 790–805[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
43Kim S.和Ziff E.B.(2014)钙调神经磷酸酶通过钙的突触运输调节突触缩放2+-可渗透的AMPA受体。《公共科学图书馆·生物》。12,e1001900。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
44Lisman J.、Yasuda R.和Raghavachari S.(2012)CaMKII长期增强作用的机制。国家神经科学评论。13, 169–182[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
45Coultrap S.J.和Bayer K.U.(2012)《信息处理和存储中的CaMKII法规》。《神经科学趋势》。35, 607–618[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
46Hell J.W.(2014)CaMKII:声称突触后功能和组织处于中心阶段。神经元81, 249–265[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
47Buard I.、Coultrap S.J.、Freund R.K.、Lee Y.S.、Dell’Acqua M.L.、Silva A.J.和Bayer K.U.(2010)启动而非维持神经元长期信息存储需要CaMKII“自主性”。神经科学杂志。30, 8214–8220[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
48Giese K.P.、Fedorov N.B.、Filipkowski R.K.和Silva A.J.(1998)《Thr的自磷酸化》286α钙-钙调蛋白激酶II在LTP和学习中的作用。科学类279, 870–873[内政部] [公共医学] [谷歌学者]
-
49Strack S.、Barban M.A.、Wadzinski B.E.和Colbran R.J.(1997)突触后密度相关和可溶性钙的差异失活2+/蛋白磷酸酶1和2A的钙调素依赖性蛋白激酶II。神经化学杂志。68, 2119–2128[内政部] [公共医学] [谷歌学者]
-
50Strack S.,Choi S.、Lovinger D.M.和Colbran R.J.(1997)将自磷酸化钙/钙调蛋白依赖性蛋白激酶II转移到突触后密度。生物学杂志。化学。272, 13467–13470[内政部] [公共医学] [谷歌学者]
-
51Shen K.和Meyer T.(1999)通过NMDA受体刺激对海马神经元中CaMKII移位和定位的动态控制。科学类284, 162–166[内政部] [公共医学] [谷歌学者]
-
52Shen K.、Teruel M.N.、Connor J.H.、Shenolikar S.和Meyer T.(2000)通过钙/钙调蛋白依赖性蛋白激酶II的可逆易位实现分子记忆。自然神经科学。3, 881–886[内政部] [公共医学] [谷歌学者]
-
53Otmakhov N.、Tao-Cheng J.H.、Carpenter S.、Asrican B.、Dosemeci A.、Reese T.S.和Lisman J.(2004)诱导NMDA受体依赖性化学长期增强后,树突棘中钙/钙调蛋白依赖性蛋白激酶II的持续积累。《神经科学杂志》。24, 9324–9331[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
54Xie Z.、Srivastava D.P.、Photowala H.、Kai L.、Cahill M.E.、Woolfrey K.M.、Shum C.Y.、Surmeier D.J.和Penzes P.(2007)Kalirin-7控制树突棘的活性依赖性结构和功能可塑性。神经元56, 640–656[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
55Araki Y.、Zeng M.、Zhang M.和Huganir R.L.(2015)在LTP期间,SynGAP从突触棘的快速扩散会触发AMPA受体插入和脊椎扩大。神经元85, 173–189[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
56Bemben M.A.、Shipman S.L.、Hirai T.、Herring B.E.、Li Y.、Badger J.D.2nd、Nicoll R.A.、Diamond J.S.和Roche K.W.(2014)神经原-1的CaMKII磷酸化调节兴奋性突触。自然神经科学。17, 56–64[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
57Walikonis R.S.、Oguni A.、Khorosheva E.M.、Jeng C.J.、Asuncion F.J.和Kennedy M.B.(2001)Densin-180与钙的α亚基形成三元复合物2+/钙调素依赖性蛋白激酶II和α-肌动蛋白。《神经科学杂志》。21, 423–433[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
58Shen K.、Teruel M.N.、Subramanian K.和Meyer T.(1998)CaMKIIβ作为F-actin靶向模块发挥作用,将CaMKIα/β杂低聚物定位于树突棘。神经元21, 593–606[内政部] [公共医学] [谷歌学者]
-
59O'Leary H.、Lasda E.和Bayer K.U.(2006)CaMKIIβ与肌动蛋白细胞骨架的关联受选择性剪接调控。分子生物学。单元格17, 4656–4665[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
60Lin Y.C.和Redmond L.(2008)CaMKIIβ与体内稳定的F-肌动蛋白结合调节F-肌动蛋白丝的稳定性。程序。国家。阿卡德。科学。美国105、15791–15796[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
61Okamoto K.、Narayanan R.、Lee S.H.、Murata K.和Hayashi Y.(2007)CaMKII作为一种对维持树突棘结构至关重要的F-肌动蛋白结合蛋白的作用。程序。国家。阿卡德。科学。美国104、6418–6423[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
62Robinson A.J.、Bass M.A.、Jiao Y.、MacMillan L.B.、Carmody L.C.、Bartlett R.K.和Colbran R.J.(2005)钙/钙调蛋白依赖性蛋白激酶II与突触后密度蛋白NR2B、密度蛋白-180和α-肌动蛋白-2的多价相互作用。生物学杂志。化学。280, 35329–35336[内政部] [公共医学] [谷歌学者]
-
63Strack S.、Robinson A.J.、Bass M.A.和Colbran R.J.(2000)钙/钙调蛋白依赖性激酶II与突触后密度蛋白密度-180的发育调节剪接变异体的关联。生物学杂志。化学。275, 25061–25064[内政部] [公共医学] [谷歌学者]
-
64Leonard A.S.、Bayer K.U.、Merrill M.A.、Lim I.A.、Shea M.A.、Schulman H.和Hell J.W.(2002)钙/钙调蛋白依赖性蛋白激酶II对接调控N个-钙/钙调素和α-肌动蛋白的甲基-d-天冬氨酸受体。生物学杂志。化学。277, 48441–48448[内政部] [公共医学] [谷歌学者]
-
65.Borgesius N.Z.、van Woerden G.M.、Buitendijk G.H.、Keijzer N.、Jaarsma D.、Hoogenraad C.和Elgersma Y.(2011)βCaMKII通过将αCaMKI靶向突触,在海马突触可塑性和学习中发挥非酶作用。《神经科学杂志》。31, 10141–10148[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
66Strack S.、McNeill R.B.和Colbran R.J.(2000)钙/钙调蛋白依赖性蛋白激酶II靶向细胞NR2B亚基的机制和调节N个-甲基-d-天冬氨酸受体。生物学杂志。化学。275, 23798–23806[内政部] [公共医学] [谷歌学者]
-
67Leonard A.S.、Lim I.A.、Hemsworth D.E.、Horne M.C.和Hell J.W.(1999)钙/钙调蛋白依赖性蛋白激酶II与N个-甲基-d-天冬氨酸受体。程序。国家。阿卡德。科学。美国96、3239–3244[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
68Bayer K.U.、De Koninck P.、Leonard A.S.、Hell J.W.和Schulman H.(2001)与NMDA受体的相互作用将CaMKII锁定在活性构象中。自然411, 801–805[内政部] [公共医学] [谷歌学者]
-
69O'Leary H.、Liu W.H.、Rorabaugh J.M.、Coultrap S.J.和Bayer K.U.(2011)核苷酸和磷酸化双向调节钙2+/钙调素依赖性蛋白激酶II(CaMKII)与N个-甲基-d-天冬氨酸(NMDA)受体亚单位GluN2B。生物学杂志。化学。286, 31272–31281[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
70Sanhueza M.、Fernandez-Villalobos G.、Stein I.S.、Kasumova G.、Zhang P.、Bayer K.U.、Otmakhov N.、Hell J.W.和Lisman J.(2011)CaMKII/NMDA受体复合体在维持突触强度中的作用。《神经科学杂志》。31, 9170–9178[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
71Halt A.R.、Dallapiaza R.F.、Zhou Y.、Stein I.S.、Qian H.、Juntti S.、Wojcik S.、Brose N.、Silva A.J.和Hell J.W.(2012)CaMKII绑定到GluN2B在内存整合期间至关重要。EMBO期刊31,1203–1216[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
72Coultrap S.J.、Freund R.K.、O’Leary H.、Sanderson J.L.、Roche K.W.、Dell’Acqua M.L.和Bayer K.U.(2014)Autonomous CaMKII使用差异底物位置选择机制介导LTP和LTD。细胞代表6,431–437[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
73Lu W.、Isozaki K.、Roche K.W.和Nicoll R.A.(2010)AMPA受体的突触靶向受GluA1第一细胞内环路中CaMKII位点的调控。程序。国家。阿卡德。科学。美国107、22266–22271[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
74Peti W.、Nairn A.C.和Page R.(2013)蛋白质磷酸酶1调节和特异性的结构基础。FEBS期刊280、596–611[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
75.Morishita W.、Connor J.H.、Xia H.、Quinlan E.M.、Shenolikar S.和Malenka R.C.(2001)蛋白质磷酸酶1对突触强度的调节。神经元32, 1133–1148[内政部] [公共医学] [谷歌学者]
-
76Hu X.D.、Huang Q.、Roadcap D.W.、Shenolikar S.S.和Xia H.(2006)肌动蛋白相关神经氨酸酶蛋白磷酸酶-1复合物调节海马可塑性。神经化学杂志。98, 1841–1851[内政部] [公共医学] [谷歌学者]
-
77Hu X.D.,Huang Q.,Yang X.和Xia H.(2007)神经氨酸酶靶向突触蛋白磷酸酶-1在海马突触传递和长期抑郁中对AMPA受体运输的差异调节。《神经科学杂志》。27, 4674–4686[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
78McAvoy T.、Allen P.B.、Obaishi H.、Nakanishi H.、Takai Y.、Greengard P.、Nairn A.C.和Hemmings H.C.Jr.(1999)通过磷酸化调节神经氨酸酶I与蛋白磷酸酶1的相互作用。生物化学38, 12943–12949[内政部] [公共医学] [谷歌学者]
-
79Hou H.、Sun L.、Siddoway B.A.、Petralia R.S.、Yang H.、Gu H.、Nairn A.C.和Xia H.(2013)突触NMDA受体刺激通过抑制Cdk5的磷酸化激活PP1。《细胞生物学杂志》。203, 521–535[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
80Siddoway B.A.、Altimimi H.F.、Hou H.、Petralia R.S.、Xu B.、Stellwagen D.和Xia H.(2013)在突触标度中蛋白磷酸酶-1的抑制剂-2调节中的重要作用。《神经科学杂志》。33, 11206–11211[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
81Greer P.L.和Greenberg M.E.(2008)《从突触到细胞核:控制突触发育和功能的钙依赖性基因转录》。神经元59, 846–860[内政部] [公共医学] [谷歌学者]
-
82Bading H.、Ginty D.D.和Greenberg M.E.(1993)通过不同的钙信号通路调节海马神经元的基因表达。科学类260, 181–186[内政部] [公共医学] [谷歌学者]
-
83.Ch’ng T.H.、Uzgil B.、Lin P.、Avliyakulov N.K.、O’Dell T.J.和Martin K.C.(2012)转录辅活化因子CRTC1从突触到细胞核的活性依赖性运输。单元格150, 207–221[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
84Graef I.A.、Mermelstein P.G.、Stankunas K.、Neilson J.R.、Deisserth K.、Tsien R.W.和Crabtree G.R.(1999)L型钙通道和GSK-3调节海马神经元中NF-ATc4的活性。自然401, 703–708[内政部] [公共医学] [谷歌学者]
-
85Murphy T.H.、Worley P.F.和Baraban J.M.(1991)L型电压敏感性钙通道介导即刻早期基因的突触激活。神经元7, 625–635[内政部] [公共医学] [谷歌学者]
-
86Deisserth K.、Bito H.和Tsien R.W.(1996)从突触到细胞核的信号传递:多种形式海马突触可塑性期间的突触后CREB磷酸化。神经元16, 89–101[内政部] [公共医学] [谷歌学者]
-
87Dolmetsch R.E.、Pajvani U.、Fife K.、Spotts J.M.和Greenberg M.E.(2001)通过MAP激酶途径通过L型钙通道钙调素复合物向细胞核发出信号。科学类294, 333–339[内政部] [公共医学] [谷歌学者]
-
88Moosmang S.、Haider N.、Klugbauer N.、Adelsberger H.、Langwieser N.,Muller J.、Stiess M.、Marais E.、Schulla V.、Lacinova L.、Goebbels S.、Nave K.A.、Storm D.R.、Hofmann F.和Kleppisch T.(2005)海马钙的作用v(v)1.2钙2+NMDA受体依赖性突触可塑性和空间记忆中的通道。《神经科学杂志》。25, 9883–9892[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
89Bito H.、Deisserth K.和Tsien R.W.(1996)CREB磷酸化和去磷酸化:钙2+-海马基因表达的刺激持续时间依赖性开关。单元格87, 1203–1214[内政部] [公共医学] [谷歌学者]
-
90Wheeler D.G.、Barrett C.F.、Groth R.D.、Safa P.和Tsien R.W.(2008)CaMKII局部编码L型通道活动,以在兴奋-传递耦合中向核CREB发出信号。《细胞生物学杂志》。183, 849–863[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
91Ma H.、Groth R.D.、Cohen S.M.、Emery J.F.、Li B.、Hoedt E.、Zhang G.、Neubert T.A.和Tsien R.W.(2014)γCaMKII航天飞机2+/CaM进入细胞核触发CREB磷酸化和基因表达。单元格159, 281–294[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
92Wiegert J.S.、Bengtson C.P.和Bading H.(2007)海马神经元中ERK1/2突触对核信号传递的基础和限制是扩散和非主动传递。生物学杂志。化学。282, 29621–29633[内政部] [公共医学] [谷歌学者]
-
93翟S.、Ark E.D.、Parra-Bueno P.和Yasuda R.(2013)通过激活一些树突棘触发的核ERK信号的长距离整合。科学类342, 1107–1111[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
94Nonaka M.、Kim R.、Fukushima H.、Sasaki K.、Suzuki K.、Okamura M.、Ishii Y.、Kawashima T.、Kamijo S.、Takemoto Kimura S.、Okuno H.、Kida S.和Bito H.(2014)CRTC1-CREB信号的区域特异性激活介导长期恐惧记忆。神经元84, 92–106[内政部] [公共医学] [谷歌学者]
-
95Zhang J.和Shapiro M.S.(2012)M型(Kv7)K的活性依赖性转录调控+AKAP79/150介导的NFAT行动。神经元76, 1133–1146[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
96Hall D.D.、Davare M.A.、Shi M.、Allen M.L.、Weisenhaus M.、McKnight G.S.和Hell J.W.(2007)cAMP依赖性蛋白激酶锚定到L型钙通道Ca的关键作用v(v)1.2通过神经元中的A激酶锚定蛋白150。生物化学46, 1635–1646[内政部] [公共医学] [谷歌学者]
-
97Li H.、Pink M.D.、Murphy J.G.、Stein A.、Dell’Acqua M.L.和Hogan P.G.(2012)钙调神经磷酸酶与AKAP79的平衡相互作用调节钙2+-钙调神经磷酸酶NFAT信号。自然结构。分子生物学。19, 337–345[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
98Murphy J.G.、Sanderson J.L.、Gorski J.A.、Scott J.D.、Catterall W.A.、Sather W.A.和Dell’Acquia M.L.(2014)AKAP支持的PKA维持神经元L型钙通道活性和NFAT转录信号。细胞代表7,1577–1588[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
99Dittmer P.J.、Dell’Acquia M.L.和Sather W.A.(2014),加利福尼亚州2+/神经元L型钙的钙调神经磷酸酶依赖性失活2+通道需要AKAP锚定蛋白激酶A启动。细胞报告7,1410–1416[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
100Toomre D.和Bewersdorf J.(2010)细胞成像的新浪潮。每年。Rev.细胞发育生物学。26, 285–314[内政部] [公共医学] [谷歌学者]
-
101.Lussier M.P.、Sanz-Clemente A.和Roche K.W.(2015)通过翻译后修饰对NMDA和AMPA受体的动态调节。生物学杂志。化学。48, 28596–28603[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
102.Spence E.F.和Soderling S.H.(2015)《肌动蛋白输出:突触细胞骨架的调节》。生物学杂志。化学。48, 28613–28622[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
103Alvarez-Castelao B.和Schuman E.R.(2015)《突触蛋白周转的调节》。生物学杂志。化学。48, 28623–28630[内政部] [PMC免费文章] [公共医学] [谷歌学者]





