摘要
适当的灌注对维持神经元稳态和脑功能至关重要。脑实质小动脉(PA)功能和结构的改变可能损害血流调节,增加患脑血管疾病的风险,包括痴呆和中风。高血压会改变大脑大动脉的结构和功能,但其对PA的影响尚不清楚。我们假设高血压会增加肌源性张力,并诱导PA的内向重塑;我们进一步提出抗高血压治疗或盐皮质激素受体(MR)阻断可逆转高血压的影响。从18周龄自发性高血压大鼠(SHRSP)中分离出PA并在压力肌电图中插管。在50 mmHg腔内压下,SHRSP的PA显示较高的肌源性张力(%张力:39.1±1.9 vs.28.7±2.5%,P(P)<0.01)和较小的静息管腔直径(34.7±1.9 vs.46.2±2.4μm,P(P)<0.01),通过一种似乎需要钙的机制2+通过L型电压门控钙的流入2+频道。SHRSP的PA表现出向内重塑(60mmHg时管腔直径:55.2±1.4 vs.75.7±5.1μm,P(P)<0.01),扩张性和顺应性增加。用抗高血压治疗SHRSP 6周,降低了PA的肌源性张力,增加了它们的静息管腔直径,并阻止了向内重塑。相反,用MR拮抗剂治疗SHRSP 6周并没有降低血压或肌源性张力,但阻止了内向重塑。因此,虽然PA的高血压重塑可能与MR有关,但肌源性张力似乎与MR活动无关。
关键词:高血压、脑实质小动脉、盐皮质激素受体、内向重塑、肌源性张力
大脑的适当灌注由于这些细胞储存能量和营养物质的能力有限,因此薄壁组织对神经元内环境稳定至关重要(9). 即使是脑灌注压力的微小变化也会对神经功能产生不利影响,从而导致长期后果,如小血管疾病和认知障碍(16). 实质小动脉(PA),也称为穿透小动脉,是脑循环的瓶颈(41)它们为离散的神经元群提供血液。PA是高阻力血管,因为它们比软脑膜动脉具有更高程度的肌张力(10). 重要的是,PA的功能障碍及其结构的改变先于白质损伤,并可能导致血管认知障碍的发展(35).
慢性高血压是脑血管疾病的主要危险因素,包括小血管疾病、中风(缺血性、出血性和腔隙性)和痴呆(37). 高血压导致颅内大动脉的功能和结构改变(46,48,49)如大脑中动脉(MCA)和较小的软脑膜动脉和小动脉(三,24,46). 这些变化包括肌原性张力增加(32),自动调节曲线右移(31),内皮依赖性舒张功能受损(62)以及结构和机械变化(46). 高血压增加血管加压素缺乏大鼠MCAs的固有肌源性张力(20)和自发性高血压大鼠(SHRSP)(54). 肌源性张力的增加可能与通过L型电压门控钙通道增加钙流入血管平滑肌细胞有关(14,34,55,58). 慢性高血压还会导致软脑膜大动脉的结构和机械变化,包括管腔直径减小(向内重塑)和壁厚增加(壁肥厚)(47–49,54). 尤其是结构的改变至少部分依赖于盐皮质激素受体(MR)的激活,因为这种受体的拮抗阻止了(54)和反转(53)SHRSP中MCA的重塑。
PA是脑血管树的一个重要分支,对神经功能至关重要,但高血压对这些小动脉的影响尚未研究。值得注意的是,PA和软脑膜动脉及小动脉在结构上有很大的不同。PA很少吻合(39)理论上,支点较少将减少PA中的湍流区域。PA和软脑膜动脉的神经支配也不同;软脑膜动脉接受来自外周神经系统的外源性神经支配(26). 在软脑膜动脉中,交感神经系统的活动至少在一定程度上是SHRSP中正常观察到的高血压相关壁肥厚的原因(4,27). 另一方面,PA周围环绕着星形细胞末端脚(12)星形胶质细胞是与PA相关的大多数神经的靶细胞(13). 神经递质受体的表达在血管树中也有所不同。例如,α1-去甲肾上腺素激活肾上腺素受体导致MCA收缩(18,30)但去甲肾上腺素通过激活β肾上腺素受体导致PA扩张(38). 由于这些原因,我们不能假设PA和软脑膜动脉在受到血压升高的挑战时会以类似的方式表现。
我们研究的目的是调查慢性高血压对PA的影响。我们假设,与血压正常的Wistar-Kyoto(WKY)大鼠相比,SHRSP的PA将表现出肌原性张力增加和向内肥厚性重塑。我们进一步假设,降低血压和阻断MR将降低高血压大鼠PA的肌源性张力并减轻其内向重塑。
方法
动物。
本研究使用了密歇根州立大学收容的12岁雄性SHRSP。年龄匹配的WKY大鼠购自印第安纳波利斯州哈兰·斯普拉格-道利。大鼠被维持在12:12小时的光暗循环中,饮用自来水并随意进食。18周龄时,用3%异氟醚麻醉大鼠,称重,并在失血后斩首处死,然后收集大脑。该实验方案得到了密歇根州立大学动物护理与使用委员会的批准,并符合美国国立卫生研究院“动物护理和使用指导原则”
降压治疗。
在饮用水中联合使用肼屈嗪(150 mg/l)+氢氯噻嗪(50 mg/l)+利血平(4 mg/l)治疗12岁男性SHRSP 6周[SHRSP+降压治疗(AhT)](36,42,59). 使用年龄匹配的载体处理(蒸馏水)SHRSP作为对照。
依普利酮治疗。
用依普利酮(EPL)(100 mg/kg)口服花生酱悬浮液治疗12岁雄性SHRSP,每日一次;我们实验室已将该治疗方案用于其他MR拮抗剂(53,54). 此剂量的EPL是从文献研究中选择的(21,63),我们实验室的初步研究表明,它能有效逆转SHSRP中的MCA重塑,其程度与螺内酯相似(53,54). 车辆处理的SHRSP每天接受花生酱,并作为本研究的对照。
动脉压测量。
如我们实验室之前所述,使用RTBP1001尾波血压系统(康涅狄格州托林顿肯特科学公司)通过尾波容积描记法测量血压(47).
PA隔离和插管。
取含有MCA的5×3mm脑组织切片,置于Ca2+-游离生理盐水溶液(PSS;以mM计:140 NaCl,5 KCl,1 MgCl2·7小时2O、 10 HEPES,10葡萄糖),添加1%牛血清白蛋白+10μM地尔硫卓+10μM硝普钠。将带有MCA的软脑膜轻轻地从组织中分离出来,并将从MCA分支出来的PA转移到定制的插管室(61). 然后用玻璃吸管将PA插管,在含有1.8 mM Ca的温暖(37°C)PSS中浸泡2+,并加压至50 mmHg,直至形成内在肌原性张力,其使用以下公式计算:肌原性色调%=[1−(主动管腔直径/被动管腔直径)]×100。使用MyoView 2.0软件(丹麦奥胡斯的丹麦Myo Technology公司)不断跟踪和记录PA外径和管腔直径。以下所述的所有反应性实验均在小动脉直径稳定至少10分钟后进行。
细胞外和细胞内钙的作用2+维持肌源性张力。
肌源性张力对钙的依赖性2+通过电压门控Ca进入2+钙的通道和释放2+首先用0.1μM硝苯地平孵育加压PA,以阻断L型电压门控钙离子,从而对来自商店的PAs进行评估2+通道,然后使用0 Ca2+-PSS+0.1μM硝苯地平,但不含螯合剂,用于评估去除细胞外钙后剩余肌生成张力的量2+.
PA对L型电压门控钙的反应性2+通道封锁。
PA对L型电压门控钙的敏感性2+通过在浴中增加硝苯地平(0.01 nM至1μM)浓度培养PA来评估通道抑制。将PA与每种浓度的硝苯地平孵育10分钟,并不断记录直径。数据显示为最大扩张的百分比,也显示为因治疗引起的结构改变而正常化的被动直径的百分比。
PA结构和机械性能。
在与0 Ca孵育后,分析了PA的结构和机械性能2+-补充2 mM EGTA和10μM硝普钠的PSS。腔内压力以20 mmHg的增量从3 mmHg增加到180 mmHg,小动脉在测量前平衡5 min,腔内压力增加。持续追踪和记录PA外径和管腔直径,并将壁厚计算为(外径-管腔直径)。如前所述计算壁腔比和周向壁应力(2),被动扩张性也是如此(6). 使用指数模型从应力/应变曲线计算弹性模量(β系数)(年=声发射βx个),其中年是周向应力,x个是周向应变,一是截距,β是指数拟合的斜率,与血管硬度直接相关。
化学品和试剂。
除非另有规定,否则所有化学品和试剂均购自西格玛阿尔德里奇(密苏里州圣路易斯)。
统计分析。
通过Student的t吨-测试或非参数替代。PA对硝苯地平的反应性和结构性质通过双向方差分析和Sidak校正进行多重比较。当P(P)< 0.05. 所有分析均使用GraphPad Prizm软件(6.0c版)进行。
结果
生理参数。
本研究中使用的SHRSP的最终体重和血压总结如下表1在高血压大鼠中,AhT显著降低血压,而EPL轻微升高血压。AhT治疗的大鼠体重明显低于对照组或EPL治疗的SHRSP。体重减轻可能是利血平治疗的结果。利血平会消耗单胺类神经递质、血清素和儿茶酚胺,并已被证明会导致大鼠体重减轻(25).
表1。
|
SHRSP公司 |
SHRSP+AhT |
SHRSP+EPL |
| 收缩压,mmHg |
214 ± 4 |
130 ± 6*
|
237 ± 3*
|
| 舒张压,mmHg |
170 ± 5 |
91 ± 6*
|
203 ± 3*
|
| 平均动脉压,mmHg |
181 ± 4 |
104 ± 6*
|
214 ± 3*
|
| 体重,g |
339 ± 8 |
298 ± 9†
|
343 ± 1 |
慢性高血压增加PA肌源性张力。
与WKY大鼠相比,SHRSP中PA的色调增加了约20%(图1A类). 因此,SHRSP大鼠的PA静息管腔直径在声调生成后显著小于WKY大鼠约40%(图1B类).
图1。
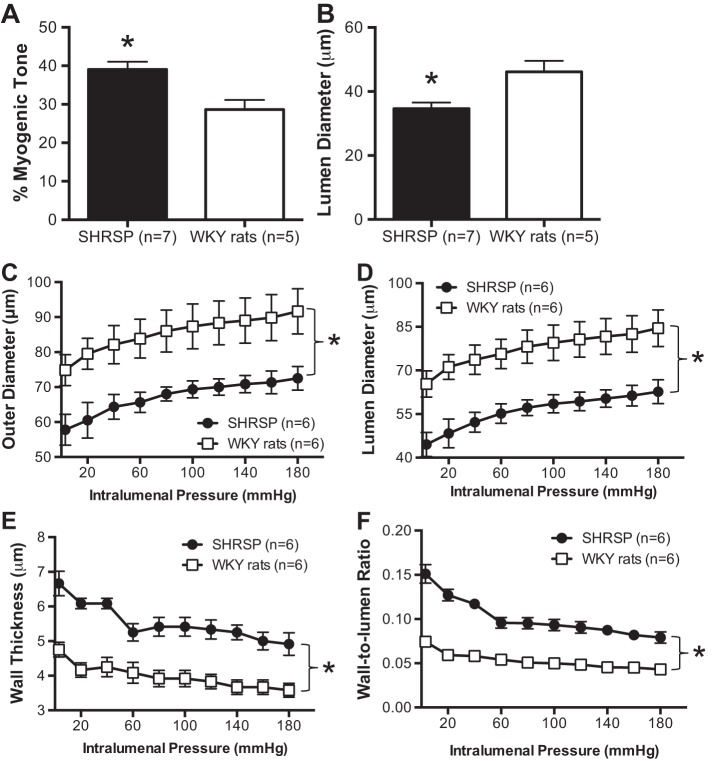
易患中风的自发性高血压大鼠(SHRSP)的慢性高血压会增加肌源性张力,并与实质小动脉(PA)的内向肥厚性重塑有关。A类:与年龄匹配的血压正常的Wistar-Kyoto(WKY)大鼠相比,18周龄SHRSP的加压PA肌源性张力增加。B类:SHRSP的PA静息管腔直径较小(肌源性张力生成后的管腔直径)。此外,SHRSP中的PA表现出典型的向内重塑过程,观察到两个外层的PA都显著减少(C类)和管腔直径(D类). 还观察到PA壁的富营养生长(E类)导致PA壁腔比增加(F类). 对于肌原性张力研究,PA在Ca中孵育2+生理盐水溶液(PSS)并加压至50 mmHg,然后允许产生自发肌张力。在PA与0 Ca孵育后评估被动结构2+补充100μmol/l硝普钠(SNP)+2 mmol/l EGTA的PSS。数值为平均值±SE;n个,大鼠数量*P(P)<0.05,SHRSP与WKY(学生t吨-测试)。
SHRSP的PA发生向内重塑。
从SHRSP对PA被动结构的评估显示出显著的向内重塑,其特征是外部结构减少(图1C类)和灯具(图1D类)直径。此外,壁厚增加(图1E类). 因此,与WKY大鼠的PA相比,SHRSP的PA的壁腔比降低(图1F类).
SHRSP中PA的硬度降低,柔顺性和膨胀性增加。
与WKY大鼠相比,SHRSP大鼠PA的壁应力较低(图2A类)膨胀性增加,尤其是在较高的腔内压力下(图2B类). 我们观察到由SHRSP中PA的β系数计算得出的刚度降低(图2C类)以及柔度的增加,表现为应力应变曲线右移(图2D类).
图2。
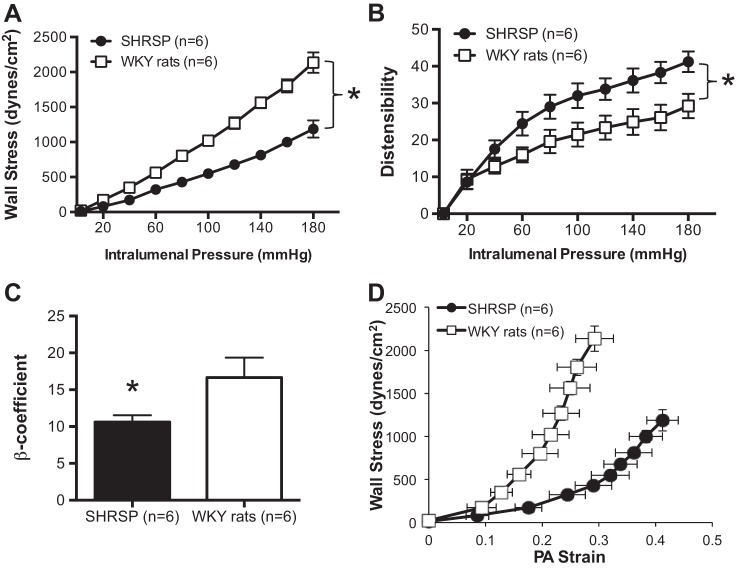
SHRSP中PA的机械性能。A类:在所研究的管腔内压力范围内,SHRSP产生的PA的壁应力比WKY正常大鼠产生的PA增加。SHRSP中的PA比WKY大鼠中的PA的扩张性增加(B类),通过β系数测量的刚度降低(C类)以及柔度增加,观察到应力-应变关系向左移动(D类). 用0 Ca孵育使平滑肌细胞失活后,在被动条件下评估力学性能2+补充100μmol/l SNP+2 mmol/l EGTA的PSS。数值为平均值±SE;n个,老鼠数量*P(P)<0.05,SHRSP与WKY(学生t吨-测试)。
AhT降低SHRSP患者PA肌原性张力。
为了验证慢性高血压与PA肌原性张力增加相关的假说,在高血压持续期用AhT治疗成人SHRSP。AhT显著降低SHRSP患者的血压(表1). 我们观察到,与安慰剂治疗的SHRSP相比,AhT后PA内在肌原性张力生成显著降低(图3A类). 此外,SHRSP+AhT治疗的PA的静息管腔直径明显大于安慰剂治疗的SHRSP(图3B类).
图3。
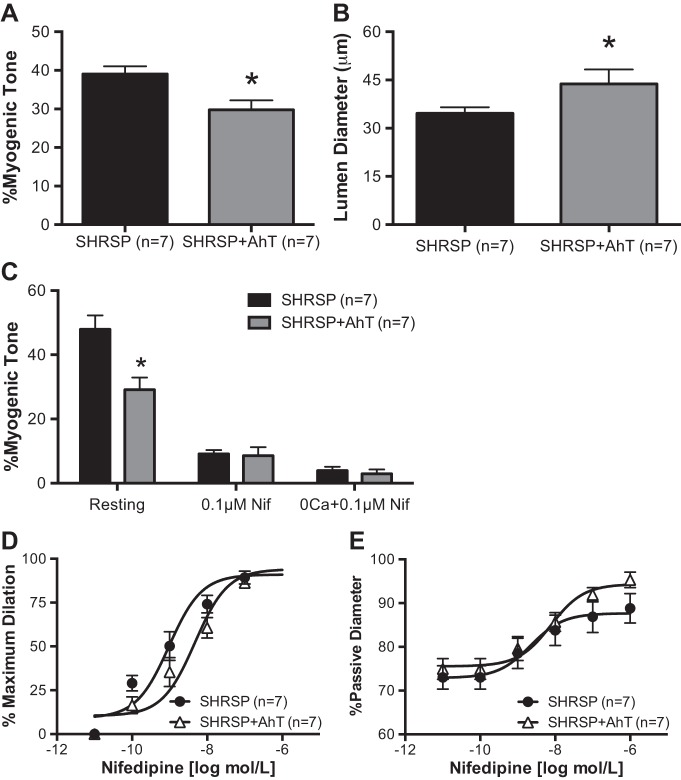
抗高血压治疗(AhT)降低PA肌源性张力和对L-型电压门控钙的反应性2+通道抑制剂。A类:与来自SHRSP的PA相比,来自SHRSP+AhT的PA中自发肌源性张力的生成减少。B类:此外,来自SHRSP+AhT的PA具有更大的静息管腔直径。C类:阻断L型电压门控钙2+含硝苯地平的通道显示,SHRSP+AhT产生的PA比SHRSP产生的PA具有更小的扩张作用,并且清除了细胞外Ca2+导致两组PA的扩张相似。此外,来自SHRSP+AhT的PA对L型电压门控钙浓度增加的敏感性降低2+离子通道抑制剂硝苯地平,浓度-反应曲线右移(D类)以及培养至硝苯地平浓度增加后,SHRSP+AhT中PA被动直径百分比增加的趋势(E类). 数值为平均值±SE;n个,大鼠数量*P(P)<0.05,SHRSP与WKY(学生t吨-测试)。
L型电压门控钙的参与2+维持PA肌源性张力的通道。
研究观察到的肌源性张力增加是否与L型电压门控钙相关2+通道,PA首先与EC孵育90硝苯地平和0钙的浓度2+PSS+硝苯地平。与来自SHRSP+AhT的PA相比,0.1μmol/l硝苯地平孵育导致SHRSP的PA中肌原性张力的损失更为显著,以至于在%肌原性色调中不再观察到差异(图3C类). 同样,用0 Ca培养2+PSS+0.1μmol/l硝苯地平引起SHRSP和SHRSP+AhT PA肌源性张力的类似损失(图3C类).
来自SHRSP+AhT的PA对L型电压门控钙的敏感性较低2+渠道封锁。
为了评估PA对钙通道阻滞剂的反应性,允许小动脉产生肌源性张力,然后与浓度增加的硝苯地平孵育。我们观察到在SHRSP+AhT中硝苯地平的最大反应曲线百分比向右偏移(图3D类)以及增长趋势(P(P)=0.058)通过PA被动直径标准化数据后(图3E类).
AhT逆转PA内向重塑,但不改变力学性能。
SHRSP患者血压降低导致向内动脉重塑过程减弱,表现为PA外径和管腔直径增加(图4,A类和B类)。在SHRSP行AhT后,壁厚也有适度减少,壁腔比也有显著降低(图4,C类和D类). 与安慰剂治疗的SHRSP相比,来自SHRSP+Aht的PA显示壁应力增加(图5A类). 然而,AhT并没有改变扩张性(图5B类),刚度(图5C类),或合规性(图5D类)SHRSP的PA。
图4。
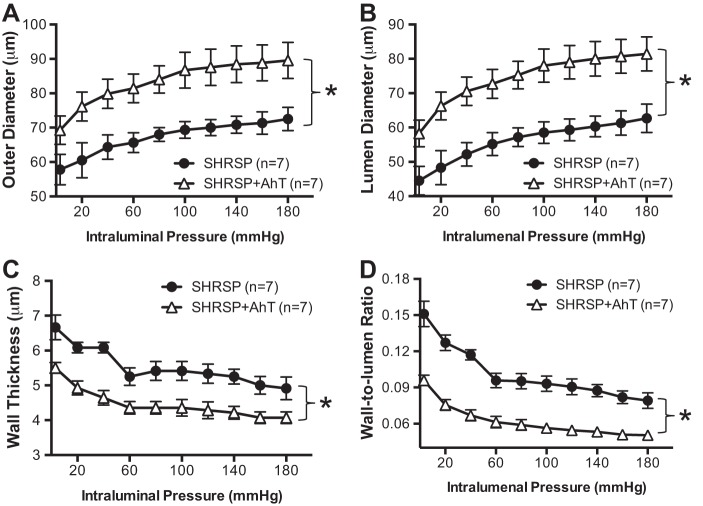
AhT可阻止SHRSP引起的PA向内肥厚性重塑(A类)和管腔直径(B类)这表明可以防止向内重塑过程。此外,壁厚有所下降(C类)和壁腔比(D类)表明AhT阻止了SHRSP血管壁的肥厚生长。在0 Ca孵育PA后评估被动结构2+补充100μmol/l SNP+2 mmol/l EGTA的PSS。数值为平均值±SE;n个,大鼠数量*P(P)<0.05,SHRSP与WKY(学生t吨-测试)。
图5。
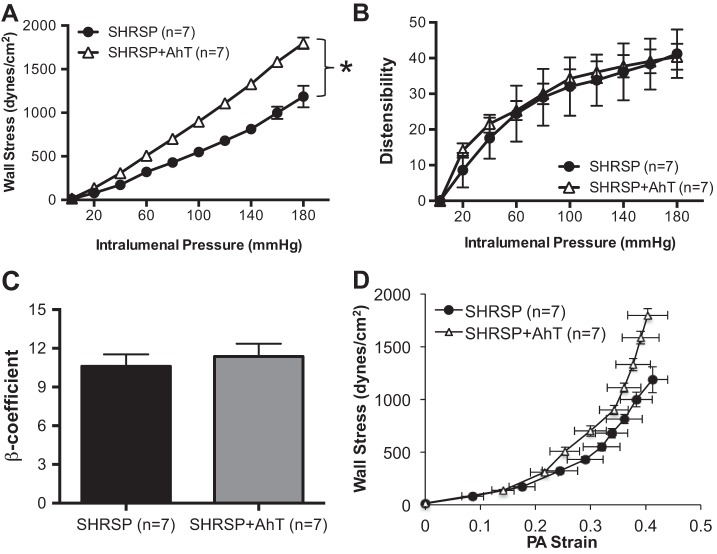
AhT对PA的力学性能没有影响。A类:SHRSP+AhT组PA的壁应力高于安慰剂治疗的SHRSP组。PA的膨胀性没有差异(B类),刚度,计算为β系数(C类),或在应力应变关系中(D类)组之间。PAs与0 Ca孵育后评估被动结构2+补充100μmol/l SNP+2 mmol/l EGTA的PSS。数值为平均值±SE;n个,大鼠数量*P(P)<0.05,SHRSP与WKY(学生t吨-测试)。
EPL没有降低PA肌源性张力。
在高血压持续期用EPL治疗SHRSP 6周并不能降低全身血压(表1). 因此,PA内在肌源性张力生成没有差异(图6A类)和静息管腔直径(图6B类).
图6。
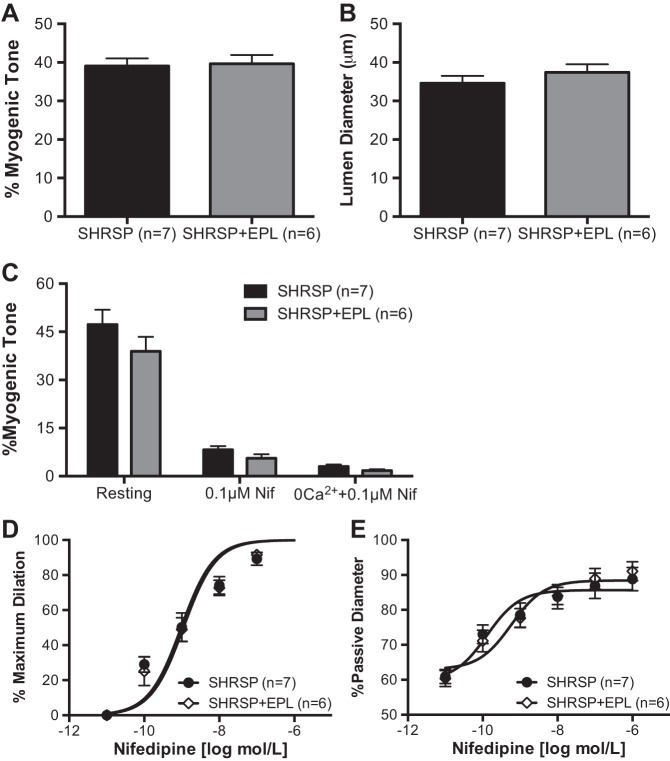
依普利酮(EPL)治疗并没有改变PA肌源性张力和对硝苯地平的反应性。经EPL治疗后,SHRSP加压PA的自发性肌源性张力没有改变(A类)SHRSP+EPL和车用SHRSP的PA静息直径无差异(B类).C类:阻断L型电压门控钙2+硝苯地平通道与细胞外钙的清除2+导致SHRSP和SHRSP+EPL的PA出现类似的扩张。PA对硝苯地平浓度增加的敏感性,如最大扩张百分比(D类)和%被动式直径(E类),经EPL治疗未发生变化。数值为平均值±SE;n个,大鼠数量。
细胞外钙的作用2+在维持肌源性张力时,EPL没有改变。
评估EPL治疗是否改变了L型电压门控钙的贡献2+PA肌源性张力发展中的通道,小动脉与硝苯地平和0钙孵育2+PSS,如上所述。硝苯地平治疗的肌源性张力丧失在EPL治疗和安慰剂治疗的SHRSP中相似(图6C类). 去除细胞外钙2+安慰剂和EPL治疗的SHRSP对PA的影响相似,并且各组间的肌原性张力没有差异(图6C类).
L型电压门控钙2+渠道封锁。
SHRSP+安慰剂和SHRSP+EPL的PA对硝苯地平的最大反应百分比没有差异(图6D类). 同样,通过被动直径对直径变化数据进行归一化,表明各组对硝苯地平的反应相似(图6E类).
EPL可减弱PA的内向重塑并改变其力学性能。
EPL治疗减轻了SHRSP患者PAs内动脉重塑过程(图7A类)和灯具(图7B类)研究了整个管腔内压力范围内的直径。此外,壁厚显著降低(图7C类)以及壁腔比(图7D类)显示SHRSP对PA向内重塑过程的衰减。管腔直径的增加和壁厚的减少导致SHRSP+EPL对PA壁应力的预期增加(图8A类). PA刚度增加(图8C类)和膨胀性(图8B类)合规性降低(图8D类).
图7。
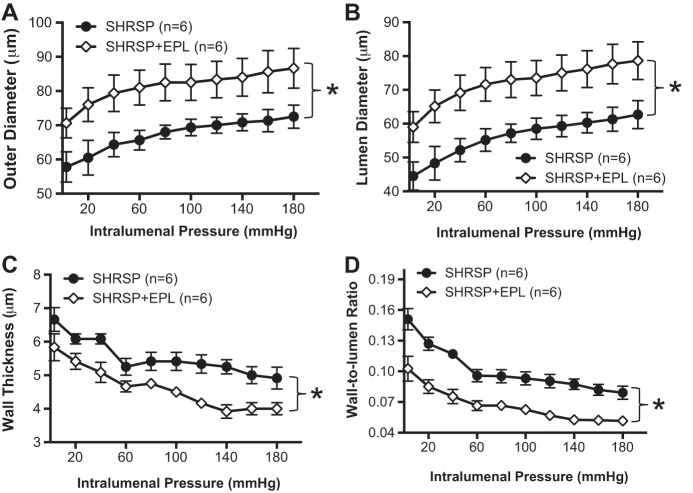
EPL治疗可防止PA向内肥厚性重塑。EPL治疗成人SHRSP引起外周血PA增加(A类)和管腔直径(B类). 壁厚(C类)和壁腔比(D类)与SHRSP+载体相比,SHRSP+EPL降低。综上所述,这些数据表明,EPL治疗可以阻止SHRSP中观察到的PA向内肥厚性重塑。将PAs与0 Ca孵育后评估被动结构2+补充100μmol/l SNP+2 mmol/l EGTA的PSS。数值为平均值±SE;n个,老鼠数量*P(P)<0.05,SHRSP与WKY(学生t吨-测试)。
图8。
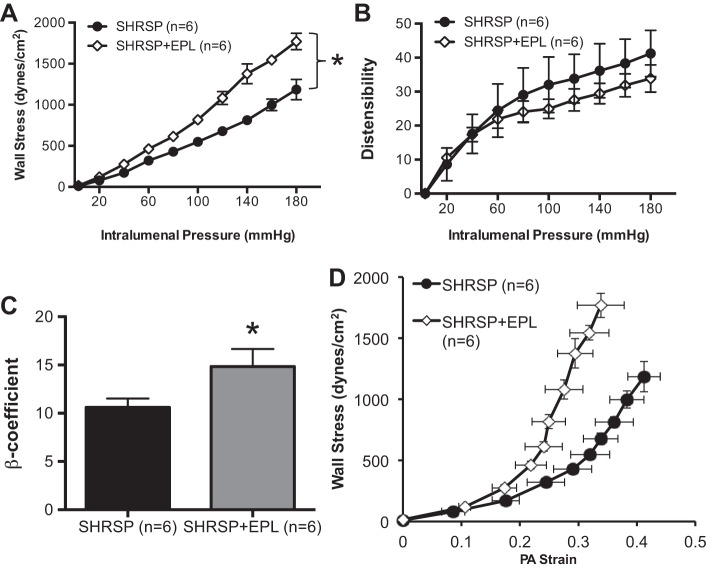
EPL改变了SHRSP中PA的刚度。A类:与溶媒处理的SHRSP相比,SHRSP+EPL处理的PA的壁应力增加。尽管膨胀性没有改变(B类),来自SHRSP+EPL的PA显示刚度增加,观察到β系数增加(C类)应力应变关系右移(D类). PAs与0 Ca孵育后评估被动结构2+补充100μmol/l SNP+2 mmol/l EGTA的PSS。数值为平均值±SE;n个,大鼠数量*P(P)<0.05,SHRSP与WKY(学生t吨-测试)。
讨论
这项研究有三个主要发现。首先,慢性高血压增加了PA的肌原性张力,并导致向内肥厚的动脉重塑。第二,用AhT使SHRSP的血压正常化,可以降低肌原性张力,防止向内肥厚性重塑,而不会影响PA的机械特性。最后,EPL治疗并没有降低血压或肌源性张力,但确实防止了向内肥厚性重塑。总之,这些数据表明,PA肌源性张力的调节可能与系统血压有关,而重塑过程更为复杂,涉及循环因素、MR激活和血压。据我们所知,这是首次研究高血压对脑实质微循环结构和功能的影响。值得注意的是,在这些研究中,允许高血压在用药前完全发展。我们提出,这种治疗模式评估了MR拮抗剂和AhT逆转高血压对脑血管系统影响的能力;这增加了研究的临床相关性。
PA连接软脑膜表面循环和大脑深层微循环。它们被认为是大脑循环的瓶颈(41),因为它们的分支很少。PA灌注大脑的离散区域,通过这一称为神经血管耦合的过程,流经这些区域的血液受到神经元和星形胶质细胞的严密调节(19). PA功能障碍或结构重塑可能对局部灌注产生不利影响,导致持续缺氧微环境和神经元死亡。事实上,最近的一项研究表明,单个PA的血栓闭塞导致圆柱形梗死,这与认知能力下降有关(57). 尽管PA在维持脑功能方面具有重要作用,但对其生理机制,尤其是在高血压等慢性病理状态下的生理机制知之甚少。正如引言中所讨论的,软脑膜循环和PA之间的重要差异阻止我们推断软脑膜动脉药物治疗对PA的影响。因此,我们的研究填补了我们对脑微循环认识的空白。
高血压对软脑膜动脉肌源性张力调节的影响存在争议。一些研究表明SHR大鼠和WKY大鼠大脑后动脉肌原性张力无差异(44). 相反,另一项研究表明,SHR大鼠的肌源性张力高于WKY大鼠(23,33). 本研究表明,与WKY大鼠相比,SHRSP的PA肌原性张力增加,因此,高血压大鼠的PA静息管腔直径较小。此外,与SHRSP+载体相比,在高血压持续期用AhT治疗6周的SHRSP的PA表现出肌源性张力降低。这些数据表明,系统血压可能是高血压大鼠PA肌张力增加的主要决定因素。女性SHR大鼠PA静息管腔直径小于WKY大鼠PA的管腔直径,这一发现支持了这一观点,可能是由于肌原性张力增加所致(7). EPL治疗并没有降低系统血压,也没有改变肌源性张力,这一事实加强了这一论点。目前尚不清楚高血压患者肌源性张力增加是否是大脑血管树中增加节段阻力的适应性反应。尽管这一想法是合理的,但仍有争议,因为之前的一项研究表明,包括软脑膜动脉和颅内大动脉在内的上游动脉的血管阻力增加,这可能使包括PA在内的下游小动脉的灌注压力正常化(22). 这一假设需要进一步调查。
肌源性张力的调节最终依赖于钙流入平滑肌细胞,并由收缩机制对钙的敏感性进行调节(15,29). PA比大的颅内动脉(如MCA)产生更多的肌源性张力,这可能依赖于电压依赖性钙的更高活性2+通道(11). 重要的是,Ca2+通过电压门控钙的流入2+高血压期间,经脉似乎增加,这可能进一步增强肌源性张力(14,34,58). 事实上,Ca2+SHR大鼠肠系膜动脉分离的血管平滑肌细胞电流大于WKY大鼠分离的血管肌细胞电流。这种差异与渠道开放概率增加有关(43). 这些数据表明高血压改变了L型钙的动力学2+而不是增加膜中的通道数。增加通道开放增加钙的全细胞振幅2+可能增加收缩力的电流,导致更高的肌源性张力。本研究通过显示L型钙的阻断作用,进一步说明了这一点2+含硝苯地平的通道在SHRSP+安慰剂和SHRSP+EPL的PA中引起更大的扩张,但在SHRSP+AhT中没有。这些数据表明,高血压患者肌源性张力增加可能依赖于钙2+通过L型钙的流入2+通道,尽管Ca发生变化2+敏感性也可能发挥作用,如下所述。我们研究中的一个警告是,我们没有研究L型钙的生物物理特性2+来自SHRSP的PA中的通道;因此,L型钙仍有可能增加2+渠道数量,以及活动的增加。此外,K的动力学变化+通道还可使心肌细胞静息膜电位进一步去极化,从而增加肌源性收缩。
钙的变化2+作为表型转换的结果,平滑肌细胞的敏感性也可能在慢性高血压期间肌源性张力增加中发挥作用。机械拉伸诱导平滑肌细胞中收缩蛋白的表达,即平滑肌肌球蛋白重链-1和-2(52). 这些蛋白质的增加可能会增加收缩力(51)因此,至少部分解释了SHRSP引起的PA肌原性张力增加。此外,收缩机制对钙的敏感性2+这种现象发生在高血压啮齿动物的动脉平滑肌细胞中(28,40). 尤其是Rho相关激酶的活性,这是一种重要调节平滑肌Ca的蛋白质2+灵敏度(56),因高血压而增加(8,60). 尚不确定SHRSP中的PA是否增强了Ca2+平滑肌细胞表型转换导致的敏感性。
高血压和大脑大动脉重塑之间的联系是众所周知的,很明显,腔内压力和循环因素参与了这一过程(46). 然而,高血压对PA的影响尚未得到广泛研究。SHRSP的PA显示出比正常血压WKY大鼠的PA更小的被动外径和管腔直径。壁厚和壁腔比也有所增加。有趣的是,壁厚增加与SHRSP中PA的刚度降低、膨胀性增加和顺应性增加有关。壁厚增加可能与内部弹性层的加厚有关,这可能是膨胀性增加的原因。事实上,SHRSP的软脑膜动脉壁弹性蛋白含量增加(5). 其他研究表明,高血压对大脑大动脉壁僵硬的影响类似(2,17).
降低血压可减弱SHRSP引起的肺动脉内向重塑。SHRSP+AhT的肺动脉外径和管腔直径较大,壁厚和壁腔比也降低。减弱内向重塑和降低内在肌原性张力可能共同作用于增加SHRSP+AhT中PA的静息管腔直径。这可能通过预防慢性轻度局部低灌注而在体内产生有益的效果,这种低灌注与小血管疾病和血管认知障碍的发展有关(64). 特别是,白质主要由PA灌注,组织学和体内研究表明,小血管疾病患者白质内的小动脉管腔变窄(1,45). 因此,AhT可以通过增加正常灌注来延缓高血压患者小血管疾病的发生,如果不能预防的话。
MR受体独立于血压参与颅内大动脉的重塑。我们之前的研究表明,经螺内酯治疗的SHRSP MCA的管腔直径大于对照SHRSP的MCA(53,54). 同样,本研究表明,用EPL治疗SHRSP可减轻向内PA重塑,表现为外径和管腔直径增加,壁厚和壁腔比减小。EPL还改变了PA的机械性能,导致微动脉硬度增加、膨胀性降低和顺应性降低。尽管EPL治疗的大鼠血压有小幅但显著的升高,但这些变化还是发生了。观察到的机械性能变化可能与年龄有关。在年轻SHRSP中,在高血压发展阶段(6-12周龄)用螺内酯阻断MR受体可增加MCA顺应性并降低僵硬(54). 然而,当12至18周龄的SHRSP接受螺内酯治疗时(与本研究中使用的治疗模式相同),僵硬和顺应性不变(53). 这些先前的发现和这里报道的发现之间的差异可能是正在研究的脑血管树不同部分的结果。此外,从SHRSP+EPL中观察到的PA壁厚减少可能是内部弹性层变薄的结果,这将增加刚度,降低柔顺性和膨胀性。
总之,本研究表明,慢性高血压增加了固有肌源性张力,并诱导PA向内肥厚性重塑。肌源性张力的增加依赖于维持高的全身血压和钙2+通过硝苯地平敏感通道内流增加或钙增加2+平滑肌细胞表型转换导致的敏感性。另一方面,重塑过程的衰减通过血压依赖和独立机制发生。
高血压是脑小血管疾病的一个主要可改变的危险因素,它加速血管认知功能障碍的发生,与阿尔茨海默病有关,并增加缺血性中风的风险(50). 小血管疾病患者的小动脉显示管腔变窄,提示PA的内向重塑可能是小血管疾病发展的主要因素(45). 因此,旨在减轻重塑的治疗,无论是否降低全身血压,都可能对有风险的患者有益。
赠款
这项工作由美国心脏协会(13GRNT1721000给A.M.Dorrance,12PRE8960019给P.W.Pires)和国家心脏、肺和血液研究所(PO1-HL-070687给W.F.Jackson)资助。
披露
作者未声明任何利益冲突,无论是财务还是其他方面。
作者贡献
作者贡献:P.W.P.、W.F.J.和A.M.D.的研究构思和设计;P.W.P.进行实验;P.W.P.分析数据;P.W.P.、W.F.J.和A.M.D.解释了实验结果;P.W.P.编制的数字;P.W.P.起草的手稿;P.W.P.、W.F.J.和A.M.D.编辑和修订手稿;P.W.P.、W.F.J.和A.M.D.批准了手稿的最终版本。
参考文献
-
1Auriel E、Csiba L、Berenyi E、Varkonyi I、Mehes G、Kardos L、Karni A、Bornstein NM。白质疏松症与动脉壁厚度相关:定量分析。神经病理学32: 227–233, 2012.[内政部] [公共医学] [谷歌学者]
-
2Baumbach GL,Hajdu马萨诸塞州。肾性和自发性高血压大鼠脑小动脉的力学和组成。高血压21: 816–826, 1993.[内政部] [公共医学] [谷歌学者]
-
三。Baumbach GL,地址:DD Heistad。慢性高血压患者的脑小动脉重塑。高血压13: 968–972, 1989.[内政部] [公共医学] [谷歌学者]
-
4Baumbach GL、Heistad DD、Siems JE。交感神经对大鼠脑小动脉成分和扩张性的影响。生理学杂志416: 123–140, 1989.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
5Baumbach GL、Walmsley JG、Hart MN。高血压大鼠脑小动脉的组成和力学。美国病理学杂志133: 464–471, 1988.[PMC免费文章] [公共医学] [谷歌学者]
-
6Chan SL、Chapman AC、Sweet JG、Gokina NI、Cipolla MJ。妊娠期PPARγ抑制对大脑后动脉功能和结构的影响。前生理学1: 130, 2010.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
7Chan SL、Sweet JG、Cipolla MJ。脑小血管疾病的治疗:高血压期间松弛素对脑实质小动脉功能和结构的影响。法国银行27: 3917–3927, 2013.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
8克里斯索波利斯S,索比CG。Rho激酶活性有助于体内脑血管张力并在慢性高血压期间增强的证据:与蛋白激酶C的比较88: 774–779, 2001.[内政部] [公共医学] [谷歌学者]
-
9乔丹·奇波拉。大脑循环。加州圣拉斐尔:摩根和克莱普尔生命科学,2009年。[公共医学] [谷歌学者]
-
10.Cipolla MJ、Li R、Vitullo L。穿透脑实质小动脉的血管周围神经支配。心血管药理学杂志44: 1–8, 2004.[内政部] [公共医学] [谷歌学者]
-
11Cipolla MJ、Sweet J、Chan SL、Tavares MJ、Gokina N、Brayden JE。大鼠脑实质小动脉与大脑中动脉压力诱导张力增加:离子通道和钙敏感性的作用。应用物理学杂志117: 53–59, 2014.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
12Cohen Z、Bonvento G、Lacombe P、Hamel E。血清素对脑微循环的调节。神经生物进展50: 335–362, 1996.[内政部] [公共医学] [谷歌学者]
-
13Cohen Z、Molinati G、Hamel E。大鼠大脑皮层去甲肾上腺素终末的星形胶质细胞和血管相互作用。大脑血流代谢杂志17: 894–904, 1997.[内政部] [公共医学] [谷歌学者]
-
14新泽西州Rusch Cox RH。接触高血压的动脉中电压门控离子通道的新表达谱。微循环9: 243–257, 2002.[内政部] [公共医学] [谷歌学者]
-
15Davis MJ,马萨诸塞州希尔。血管肌源性反应的信号机制。生理学评论79: 387–423, 1999.[内政部] [公共医学] [谷歌学者]
-
16德拉托雷JC。脑血流动力学和血管危险因素:为阿尔茨海默病奠定基础。阿尔茨海默病杂志32: 553–567, 2012.[内政部] [公共医学] [谷歌学者]
-
17Dorrance AM、Pollock DM、Romanko OP、Stepp DW。高钾饮食可减少高血压大鼠的梗死面积并改善血管结构。美国生理学杂志Regul Integr Comp Physiol292:R415–R4222007年。[内政部] [公共医学] [谷歌学者]
-
18Duckworth JW、Wellman GC、Walters CL、Bevan JA。死亡后立即获得人大脑中动脉对跨壁电场刺激和去甲肾上腺素的胺能组织荧光和收缩反应。循环研究65: 316–324, 1989.[内政部] [公共医学] [谷歌学者]
-
19Dunn KM,Nelson MT。大脑中的神经血管信号与高血压的病理后果。美国生理学杂志心脏循环生理学306:2014年1月1日至14日。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
20Dunn WR、Wallis SJ、Gardiner SM。从遗传性高血压Brattleboro大鼠分离的脑阻力动脉重塑和增强肌源性张力。血管研究杂志35: 18–26, 1998.[内政部] [公共医学] [谷歌学者]
-
21Endemann DH、Touyz RM、Iglarz M、Savoia C、Schiffrin EL。依普利酮预防自发性高血压大鼠盐诱导的血管重塑和心脏纤维化。高血压43: 1252–1257, 2004.[内政部] [公共医学] [谷歌学者]
-
22法拉奇FM,海斯塔德DD。大脑大动脉和脑微血管压力的调节。循环研究66: 8–17, 1990.[内政部] [公共医学] [谷歌学者]
-
23.Gonzalez JM、Somoza B、Conde MV、Fernandez-Alfonso MS、Gonzarez MC、Arribas SM。高血压增加自发性高血压大鼠大脑中动脉静息张力:强直性血管活性因子可用性的作用。临床科学(伦敦)114: 651–659, 2008.[内政部] [公共医学] [谷歌学者]
-
24Hajdu MA,Baumbach GL公司。慢性高血压大、小脑动脉力学。美国生理学杂志心脏循环生理学266:H1027–H10331994年。[内政部] [公共医学] [谷歌学者]
-
25.哈拉瑞斯AE,弗里德曼DX。体重减轻是利血平诱导的胺消耗的预测因素。欧洲药理学杂志32: 93–101, 1975.[内政部] [公共医学] [谷歌学者]
-
26哈默尔E。血管周围神经和脑血管张力的调节。应用物理学杂志100: 1059–1064, 2006.[内政部] [公共医学] [谷歌学者]
-
27Hart MN、Heistad DD、Brody MJ。慢性高血压和交感神经失神经对脑血管壁/管腔比率的影响。高血压2: 419–423, 1980.[内政部] [公共医学] [谷歌学者]
-
28Hilgers RH、Todd J Jr、Webb RC。血管紧张素II诱导的高血压大鼠肠系膜小动脉中PDZ-RhoGEF/RhoA/Rho激酶信号传导增加。J高血压25: 1687–1697, 2007.[内政部] [公共医学] [谷歌学者]
-
29Hill MA、Zou H、Potocnik SJ、Meininger GA、Davis MJ。受邀评论:小动脉平滑肌机械传导:钙2+肌源性反应的信号通路。应用物理学杂志91: 973–983, 2001.[内政部] [公共医学] [谷歌学者]
-
30Hograit ED,Andersson KE。大鼠脑动脉和肠系膜动脉连接后α肾上腺素受体的研究。《Auton药理学杂志》4: 161–173, 1984.[内政部] [公共医学] [谷歌学者]
-
31Iadecola C,戴维森RL。高血压和脑血管功能障碍。单元格元7: 476–484, 2008.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
32Ibrahim J、McGee A、Graham D、McGrath JC、Dominiczak AF。高血压和正常血压大鼠脑动脉肌源性张力的性别差异。美国生理学杂志心脏循环生理学290:H1081–H10892006年。[内政部] [公共医学] [谷歌学者]
-
33Izzard AS,Bund SJ,Heagerty AM。自发性高血压大鼠肠系膜动脉肌原性张力。美国生理学杂志心脏循环生理学270:1996年上半年至上半年。[内政部] [公共医学] [谷歌学者]
-
34Joseph BK、Thakali KM、Moore CL、Rhee SW。高血压期间血管平滑肌的离子通道重塑:新治疗方法的意义。药学研究70: 126–138, 2013.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
35Joutel A、Monet-Lepretre M、Gosele C、Baron-Menguy C、Hammes A、Schmidt S、Lemaire-Carrette B、Domenga V、Schedl A、Lacombe P、Hubner N。在脑缺血小血管病小鼠遗传模型中,脑血管功能障碍和微循环稀疏先于白质损伤。临床研究杂志120: 433–445, 2010.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
36Kang KT、Sullivan JC、Spradley FT、d'Uscio LV、Katusic ZS、Pollock JS。降压治疗增加了血管紧张素Ⅱ融合型高血压大鼠小动脉中四氢生物蝶呤水平和NO/cGMP信号。美国生理学杂志心脏循环生理学300:H718–H7242011年。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
37佐治亚州兰米。高血压脑小血管病与中风。大脑病理学12: 358–370, 2002.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
38林肯·J·。含有5-羟色胺和去甲肾上腺素的神经对脑动脉的神经支配。药物治疗学68: 473–501, 1995.[内政部] [公共医学] [谷歌学者]
-
39Moody DM、Bell MA、Challa VR。预测灌注或氧合不足易损性的脑血管模式特征:一项解剖学研究。AJNR Am J神经放射11: 431–439, 1990.[PMC免费文章] [公共医学] [谷歌学者]
-
40Mukai Y、Shimokawa H、Matoba T、Kandabashi T、Satoh S、Hiroki J、Kaibuchi K、Takeshita A。Rho激酶参与高血压血管疾病:一种新的高血压治疗靶点。法国银行15: 1062–1064, 2001.[内政部] [公共医学] [谷歌学者]
-
41Nishimura N、Schaffer CB、Friedman B、Lyden PD、Kleinfeld D。穿透小动脉是新皮质灌注的瓶颈。美国国家科学院程序104: 365–370, 2007.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
42.O'Brien RC、Cooper ME、Jerums G、Doyle AE。培哚普利和三联疗法在糖尿病肾病正常血压模型中的作用。糖尿病42: 604–609, 1993.[内政部] [公共医学] [谷歌学者]
-
43Ohya Y、Tsuchihashi T、Kagiyama S、Abe I、Fujishima M。自发性高血压大鼠阻力动脉平滑肌细胞中的单个L型钙通道。高血压31: 1125–1129, 1998.[内政部] [公共医学] [谷歌学者]
-
44.哈尔彭·W·奥索尔·G。正常血压和高血压大鼠脑血管的肌生成特性。美国生理学杂志心脏循环生理学249:H914–H9211985年。[内政部] [公共医学] [谷歌学者]
-
45Pantoni L,Garcia JH。大脑白质中的认知障碍和细胞/血管变化。Ann N Y科学院826: 92–102, 1997.[内政部] [公共医学] [谷歌学者]
-
46Pires PW、Dams Ramos CM、Matin N、Dorrance AM。高血压对大脑循环的影响。美国生理学杂志心脏循环生理学304:H1598–H16142013年。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
47Pires PW、Deutsch C、McClain JL、Rogers CT、Dorrance AM。Tempol是一种超氧化物歧化酶模拟物,可预防高血压大鼠的脑血管重塑。微血管研究80: 445–452, 2010.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
48Pires PW、Girgla SS、McClain JL、Kaminski NE、van Rooijen N、Dorrance AM。巨噬细胞耗竭后卒中-自发性高血压大鼠大脑中动脉结构和内皮功能的改善。微循环20: 650–661, 2013.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
49Pires PW、Rogers CT、McClain JL、Garver HS、Fink GD、Dorrance AM。多西环素是一种基质金属蛋白酶抑制剂,可减少中风自发性高血压大鼠脑缺血后的血管重塑和损伤。美国生理学杂志心脏循环生理学301:H87–H97,2011年。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
50邱C,Fratiglioni L。心血管负荷在与年龄相关的认知下降中的主要作用。Nat Rev Cardiol公司12: 267–277, 2015.[内政部] [公共医学] [谷歌学者]
-
51Rensen SS,Doevendans PA,van Eys GJ。血管平滑肌细胞表型多样性的调节和特征。Neth Heart J公司15: 100–108, 2007.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
52Reusch P、Wagdy H、Reusch R、Wilson E、Ives HE。机械应变增加了大鼠血管平滑肌细胞中的平滑肌,降低了非肌肌球蛋白的表达。循环研究79: 1046–1053, 1996.[内政部] [公共医学] [谷歌学者]
-
53Rigsby CS、Ergul A、Portik Dobos V、Pollock DM、Dorrance AM。螺内酯对持续性高血压大鼠脑血管结构的影响。Am J高血压24: 708–715, 2011.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
54Rigsby CS、Pollock DM、Dorrance AM。螺内酯可以改善雄性自发性高血压卒中大鼠脑血管的结构并增加其张力。微血管研究73: 198–205, 2007.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
55新泽西州Rusch,Hermsmeyer K。自发性高血压大鼠血管肌细胞膜钙电流改变。循环研究63: 997–1002, 1988.[内政部] [公共医学] [谷歌学者]
-
56舒伯特·R、利丁顿·D、博尔茨·SS。钙的新作用2+敏感性调节促进肌源性血管收缩。心血管研究77: 8–18, 2008.[内政部] [公共医学] [谷歌学者]
-
57Shih AY、Blinder P、Tsai PS、Friedman B、Stanley G、Lyden PD、Kleinfeld D。最小的中风:一条贯穿血管的闭塞会导致梗死和认知功能障碍。自然神经科学16: 55–63, 2013.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
58Sonkusare S、Palade PT、Marsh JD、Telemaque S、Pesic A、Rusch NJ。血管钙通道与高血压:病理生理学和治疗意义。血管药理学44: 131–142, 2006.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
59Velasquez MT、Striffler JS、Abraham AA、Michaelis OE Scalbert E、Thibault N。培哚普利改善SHR/N肥胖大鼠肾小球和肾小管间质损伤。高血压30: 1232–1237, 1997.[内政部] [公共医学] [谷歌学者]
-
60韦伯DS,韦伯RC。盐皮质激素性高血压大鼠肠系膜动脉对rho激酶抑制剂Y-27632的舒张增强。药理学63: 129–133, 2001.[内政部] [公共医学] [谷歌学者]
-
61Westcott EB,Jackson WF。ryanodine受体的异质功能,但不是IP三受体,在仓鼠提睾肌中供养动脉和小动脉。美国生理学杂志心脏循环生理学300:H1616–H1630,2011年。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
62Yang ST、Mayhan WG、Faraci FM、Heistad DD。慢性高血压期间脑血管的内皮依赖性反应。高血压17: 612–618, 1991.[内政部] [公共医学] [谷歌学者]
-
63.Zakrzeska A、Gromotowicz-Pollawska A、Szemraj J、Szoka P、Kisiel W、Purta T、Kasacka I、Chabielska E。依普利酮可减少糖尿病大鼠的动脉血栓形成。肾素血管紧张素醛固酮系统杂志。新闻界。[内政部] [公共医学] [谷歌学者]
-
64赵毅,龚CX。从慢性脑灌注不足到阿尔茨海默样脑病理和神经变性。细胞分子神经生物学35: 101–110, 2015.[内政部] [公共医学] [谷歌学者]










