摘要 激素受体(HR)阳性乳腺癌内分泌治疗的耐药性是相当多患者面临的一个重大临床问题。 调节癌细胞谷氨酰胺代谢的致癌转录因子c-MYC(以下简称MYC)与内分泌抵抗有关。 我们感兴趣的是,MYC介导的谷氨酰胺代谢是否也与芳香化酶抑制剂(AI)耐药乳腺癌相关。 我们研究了MYC在AI敏感和耐药乳腺癌细胞中的表达和调节以及抑制MYC表达的效果。 考虑到MYC在谷氨酰胺代谢中的作用,我们评估了谷氨酰胺对AI敏感和耐药细胞增殖的贡献,并进行了RNA测序,以研究MYC介导的谷氨酰胺利用在AI耐药中的机制。 我们发现谷氨酰胺代谢与雌激素无关,但在AI耐药乳腺癌细胞中仍需要ER。 的表达式 MYC公司 在AI耐药乳腺癌细胞中,雌激素受体(ER)和人表皮生长因子受体2(HER2)之间的相互作用使癌基因上调。 此外,谷氨酰胺转运蛋白溶质载体家族(SLC)1A5在AI耐药乳腺癌细胞中显著上调。 ER下调剂fulvestrant抑制AI耐药乳腺癌细胞中的MYC、SLC1A5、谷氨酰胺酶(GLS)和谷氨酰胺消耗。 抑制MYC、SLC1A5和GLS可降低AI耐药乳腺癌细胞的增殖。 我们的研究发现,在AI耐药的乳腺癌细胞中,MYC的表达受到ER和HER2之间的相互作用的上调。 MYC介导的谷氨酰胺代谢与乳腺癌的AI抵抗相关。
关键词: c-MYC、ER、HER2、谷氨酰胺、芳香化酶抑制剂抵抗、乳腺癌
1.简介 乳腺癌是全球女性中最常见的癌症,也是导致癌症死亡的第二大原因[ 1 ]. 激素受体(HRs)–雌激素受体(ER)和/或孕激素受体(PR)在大约70%的乳腺癌中表达。 此类患者乳腺癌细胞的生长依赖于雌激素和雌激素受体。雌激素介导的雌激素受体信号可以通过用芳香化酶抑制剂(AIs)(即来曲唑、阿那曲唑和依西美坦)阻断雌激素生物合成,用三苯氧胺拮抗雌激素与雌激素受体的结合, 并用fulvestrant下调ER。 内分泌疗法在绝经后女性HR阳性乳腺癌患者的治疗中发挥着重要作用[ 2 ]. 不幸的是,相当多的患者 从头开始 对内分泌治疗产生耐药性或最终产生后天性耐药性[ 2 ].
ER和人表皮生长因子受体2(HER2)信号通路之间的相互作用与内分泌治疗抵抗有关[ 三 - 5 ]. AIs治疗患者乳腺肿瘤中HER2信号上调[ 6 ]. HER2信号通路的上调,包括丝裂原活化蛋白激酶(MAPK)和磷脂酰肌醇3′-激酶(PI3K)/AKT,可以以配体依赖的方式磷酸化和激活ER[ 7 , 8 ]. 包括我们在内的许多研究小组已经表明,ER在内分泌抵抗的乳腺癌细胞中上调并组成性激活[ 9 - 11 ]. 这个 MYC公司 癌基因编码c-MYC(MYC)蛋白,是一种众所周知的ER调节基因[ 12 , 13 ]. MYC是一种转录因子,在细胞增殖、生长、存活、分化和凋亡中起关键作用[ 14 ]. 有趣的是,MYC与乳腺癌的内分泌抵抗有关[ 15 - 18 ].
谷氨酰胺是体内最丰富的氨基酸,在细胞增殖中起着重要作用。 它首先通过谷氨酰胺酶(GLS)转化为谷氨酸,然后分解为α-酮戊二酸,这是三羧酸(TCA)循环的中间产物[ 19 ]. 谷氨酰胺可以是合成脂质、蛋白质和核苷酸的碳和氮的来源[ 20 ]. 虽然大多数癌症的生长和生存依赖于高比率的有氧糖酵解,但一些癌细胞在缺乏外源性谷氨酰胺(称为“谷氨酰胺成瘾”)的情况下无法存活[ 20 ]. 雌激素刺激可增加ER阳性乳腺癌MCF7细胞中谷氨酰胺的消耗[ 21 ]表明谷氨酰胺代谢对雌激素依赖性细胞增殖至关重要。 MYC的致癌水平也与人类癌症中谷氨酰胺摄取和代谢的增加有关[ 22 , 23 ].
考虑到MYC与内分泌抵抗之间的联系[ 15 , 16 ]以及MYC对癌细胞谷氨酰胺代谢的调节[ 22 , 23 ],我们假设MYC介导的谷氨酰胺代谢也与AI抵抗相关。 我们研究了MYC在AI敏感和耐药乳腺癌细胞中的表达和调节以及抑制MYC表达的效果。 我们评估了谷氨酰胺对细胞增殖的作用,以及谷氨酰胺消耗量与乳腺癌细胞激素之间的关系。 最后,我们进行了RNA测序,并研究了MYC介导的谷氨酰胺代谢在AI抗性中的机制。
2.材料和方法 2.1. 细胞培养 人类乳腺癌细胞系MCF7衍生的细胞系MCV7aro和LTEDaro是在本实验室中生成的,并已在前面进行了表征和描述[ 9 , 24 ]. MCF7aro常规培养于添加10%胎牛血清(FBS)、2 mM L-谷氨酰胺、1 mM丙酮酸钠、100 U/mL青霉素-链霉素和0.1 mg/mL G418的最小Eagle's培养基(MEM)中。 LTEDaro保存在含有10%木炭/右旋糖酐处理过的FBS的无酚红MEM中,其补充剂与亲代MCF7aro细胞相同。 在睾酮治疗的实验中,MCF7aro细胞在治疗前在含有10%木炭/右旋糖酐处理的FBS的无酚红MEM培养基中培养72小时。 在缺乏谷氨酰胺或葡萄糖培养条件下,使用不含葡萄糖的无酚红Dulbecco改良Eagle培养基(DMEM)和含有10%木炭/右旋糖酐处理过的FBS的谷氨酰胺(GIBCO A14430-01)进行实验。
2.2. 抗体和试剂 抗人MYC(#5605)、p-MAPK(#9101)、MAPK(#9102)、p-AKT(Ser473)(#9271)、AKT(#9272)、p-ER(Ser167)(#5587)、GAPDH(#2118)抗体均来自细胞信号技术。 抗人HER2(#06-562)和p-ERα(Ser118)(ab32396)抗体来自Abcam Inc.。抗人ERα(HC-20)抗体(sc-543)来自Santa Cruz Biotechnology。 ER拮抗剂fulvestrant(#14409)和SLC1A5抑制剂L-谷氨酸γ-(对硝基苯胺)(GPNA)(G6133)均来自Sigma-Aldrich。 谷氨酰胺酶抑制剂化合物968(#352010)来自EMD Millipore。 AKT抑制剂MK-2206(S1078)来自Selleck Chemicals。 非靶向对照siRNA(sc-37007)和MYC siRNA(sc-29226)来自圣克鲁斯生物技术公司。 HER2 siRNA(L-003126-00)来自Dharmacon。 p44/42 MAPK siRNA(#6560)来自细胞信号技术。
2.3. 实时PCR 使用TRIzol试剂(Invitrogen)从细胞中提取总RNA,并使用纳米滴分光光度计进行定量。 用SuperScript VILO cDNA合成试剂盒(Invitrogen)从2.5μg总RNA进行反转录。用iQ5多色实时PCR检测系统(Bio-Rad)进行实时PCR。 人类 MYC公司 使用正向引物5′-GGCTCTCGGCAAAAGGTCA-3′和反向引物5′-CTGGTGTTGCTGATGT-3′扩增该基因(PrimerBank ID 239582723c1)[ 25 ]. 人类 SLC1A5型 使用正向引物5′-GAGCTTGCTTATCCCTTTC-3′和反向引物5’-GGGGCGTACACATATC-3′(PrimerBank ID 223468565c1)扩增基因[ 25 ]. 人类 GLS公司 使用正向引物5′-AGGTCTGTACCTAGCTGTGG-3′和反向引物5’-ACGTTGCAATCGTAGATTT-3′(PrimerBank ID 373251163c1)扩增基因[ 25 ]. 这个 ACTB公司 用正向引物5′-CACACACTGAGACAT-3′和反向引物5’-GCACAGCTCTGGAGACAC-3′扩增β-actin基因。 使用PerfeCTa SYBR Green SuperMix(Quanta Biosciences)建立实时PCR。 PCR结果以β-肌动蛋白作为内部对照进行标准化,然后与参考样品进行相对表达。 每项实验一式三份。 数据表示为平均值±SE。
2.4. 转染 根据制造商的方案,使用siPORT NeoFX转染剂(Ambion)对MCF7aro和LTEDaro进行对照siRNA或siRNA对MYC、HER2或MAPK的转染。 对于免疫印迹,在60-mm培养皿中进行转染。 对于MTT分析,使用96个平板。 简单地说,细胞被胰蛋白酶化并在培养基中稀释为1×10 5 分别在OPTI-MEM I培养基(Invitrogen)中稀释cells/ml.siPORT NeoFX转染剂和siRNA。 混合并培养10分钟后,将siRNA和转染剂的混合物分散到培养板或培养皿中。 细胞悬液(1×10 5 细胞/ml)覆盖在转染复合物上。 siRNA的最终浓度为30 nM。
2.5. 蛋白质印迹 如前所述进行蛋白质印迹[ 26 ]. 简而言之,细胞在冰上的RIPA缓冲液(细胞信号)中溶解5 min,然后超声60 s。蛋白质浓度由蛋白质检测试剂盒(Bio-Rad)测定,样品由10%SDS-聚丙烯酰胺凝胶电泳(PAGE)分离。 用一级抗体检测后,用辣根过氧化物酶偶联二级抗体孵育膜。 最后; 信号强度通过SuperSignal West Pico化学发光(Thermo Scientific)基底可视化测定。 蛋白质的相对表达按照内部对照GAPDH标准化。
2.6. 细胞增殖试验 细胞增殖通过3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴化物(MTT)分析测定。 在指定的时间,从细胞中取出96个平板的每个孔中的培养基,并用含有0.5 mg/mL MTT的0.1 mL新鲜无酚红培养基替换,然后在37°C下培养细胞1小时。丢弃培养基后, 将捕获在活细胞中的formazan染料溶解在0.1 mL二甲基亚砜中,并使用SpectraMax M5平板读取器(分子器件)在570 nm处测量吸光度。 每个实验至少使用五个重复进行。 数据表示为平均值±SE。
2.7. 谷氨酰胺和氨的测量 使用BioProfile 100 Plus分析仪(Nova Biomedical)测量谷氨酰胺和氨浓度。 简单地说,将细胞接种过夜,并按照充满培养基中的指示进行处理。 对照组用相同体积的无细胞培养基培养,培养方式与含细胞培养板相同。 立即收集培养基样品进行分析,或在−20°C下储存,直至进行分析。 测定每个样品的谷氨酰胺和氨浓度(以mmol/l为单位)。 通过从培养基对照浓度中减去样品浓度来计算谷氨酰胺消耗量。 通过从样品浓度中减去培养基对照浓度来计算氨产量。 数据表示为平均值±SE。
2.8. RNA测序和数据分析 将LTEDaro细胞接种过夜,然后在含有10%木炭/右旋糖酐处理过的不含谷氨酰胺的FBS、2mM L-谷氨酰胺或2mM L-谷酰胺+100nM fulvestrant的无酚无红DMEM培养基中培养24小时。每个治疗组一式三份。 使用TRIzol试剂(Invitrogen)从细胞中提取总RNA。 按照制造商的协议,使用Illumina HiSeq 2000系统在我们的综合基因组核心中制备转录组文库、选择大小、凝胶纯化并测序(Illuminia Inc.)。
使用TopHat将读数与人类基因组(构建hg19)对齐[ 27 ]. RPKM(每千字节读取数/百万映射读取数[ 28 ])为RefSeq计算[ 29 ]在Partek®Genomics SuiteTM(第6.6版,Partek,Inc.,St.Louis,MO)中使用期望最大化算法的基因,该算法基于Xing等人的方法[ 30 ]. 在添加0.1的比例因子之后,通过log2变换进一步归一化RPKM值[ 31 ]. 根据最小二乘平均值在线性尺度上计算折变值,使用归一化RPKM值计算单因素方差分析(ANOVA),使用Benjamini和Hochberg方法计算错误发现率(FDR)值[ 32 ]. 如果基因的fold-change|值大于1.5且FDR<0.05,则将其定义为差异表达。
2.9. 系统级分析 通过Fisher精确测试计算了Ingenuity pathway Analysis(IPA,Ingenuiity®Systems,www.Ingenuity.com)中路径富集的P值。 IPA用于构建网络和预测上游调节器活动。 根据已知下游靶点的折叠式变化值,预测上游调节器被激活或抑制:如果基因列表中的靶点显示激活z-score>2,则预测上游调控器被激活(如果激活z-store<-2,则预测被抑制)。
显示标准化基因表达值的热图。 使用欧几里得距离作为距离度量的平均链接进行层次聚类。 在Partek®Genomics SuiteTM(第6.6版,Partek公司,密苏里州圣路易斯)中进行聚类和可视化。
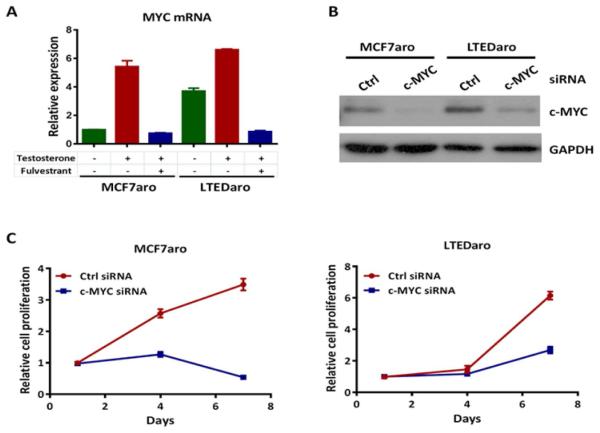
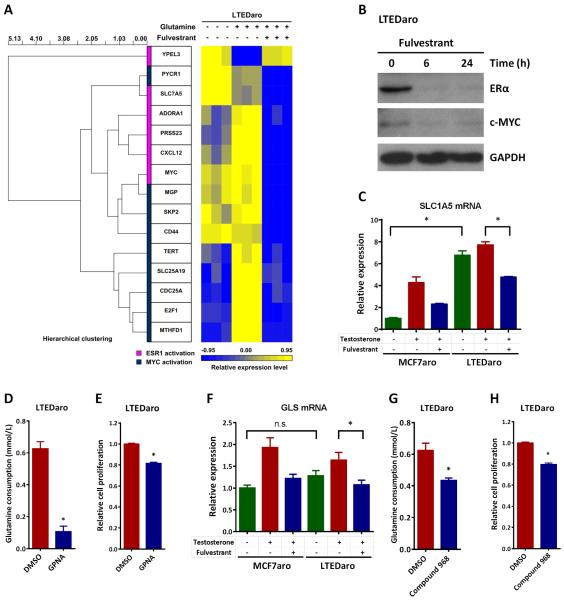
3.结果 3.1. 抗AI乳腺癌细胞中MYC的上调 这个 MYC公司 癌基因是一种雌激素依赖性基因,受雌激素受体转录调控[ 12 , 13 ]. ER在AI耐药乳腺癌细胞中上调并组成性激活[ 9 - 11 ]. 为了确定MYC的调节是否是通过ER在AI耐药乳腺癌细胞中进行的,我们检测了睾酮和富尔维斯坦治疗对 MYC公司 在MCF7aro(一种对AIs敏感的芳香化酶过表达乳腺癌细胞系)和LTEDaro(长期雌激素脱激活(LTED)后衍生的MCF7ari细胞系和AI抵抗模型中表达。 在MCF7aro细胞中,我们发现 MYC公司 睾酮经芳香化酶转化为雌二醇后,mRNA水平显著升高。 fulvestrant预处理完全阻断了 MYC公司 MCF7aro细胞中睾酮的mRNA( 图1A ),确认 MYC公司 是MCF7aro亲代细胞中的一个ER调节基因。 有趣的是 MYC公司 基线时,LTEDaro细胞中的mRNA远高于MCF7aro细胞,并且几乎与 MYC公司 睾酮处理诱导MCF7aro细胞的mRNA水平。 fulvestrant的预处理也完全阻断了 MYC公司 mRNA表达( 图1A ). 这些发现表明,在AI耐药乳腺癌细胞中,MYC通过组成性激活的ER上调。
图1。 AI耐药乳腺癌细胞中c-MYC的上调。
A.实时PCR分析 MYC公司 MCF7aro(激素去除72小时)和LTEDaro细胞在DMSO、睾酮(1nM)或睾酮(1 nM)加富尔维斯特(100nM)处理6小时后的表达。数值标准化为 ACTB公司 并绘制与DMSO处理的MCF7aro细胞的表达相关的曲线。 数据为平均值±SE(n=3)。
B.对转染非靶向对照(Ctrl)siRNA或靶向c-MYC的siRNA 72小时后的MCF7aro或LTEDaro细胞的全细胞裂解物中c-MYC表达进行Western blotting分析。
C.转染非靶向对照(Ctrl)siRNA或靶向C-MYC的siRNA的MCF7aro或LTEDaro细胞的细胞增殖。 在指定的时间点测量MTT。 数据为平均值±SE(n=5)。
MYC高表达是三苯氧胺治疗乳腺癌后不良预后的预测因子[ 15 , 17 ]. 因为我们发现MYC在AI耐药乳腺癌细胞中表达上调,所以我们试图确定短干扰RNA(siRNA)降低MYC表达是否会降低MCF7aro和LTEDaro细胞的细胞增殖。 我们通过Western blotting测试了MYC表达的敲除效率。 与 MYC公司 LTEDaro细胞MYC蛋白水平高于MCF7aro细胞。 我们发现siRNA转染后MYC蛋白水平显著降低,并且两种细胞系的敲除率相似( 图1B ). 然后,我们通过MTT法评估MYC敲低对细胞增殖的影响。 我们发现在MCF7aro和LTEDaro细胞中MYC敲除后,细胞增殖显著降低( 图1C )表明MYC在AI敏感和耐药乳腺癌细胞的增殖中起着重要作用。
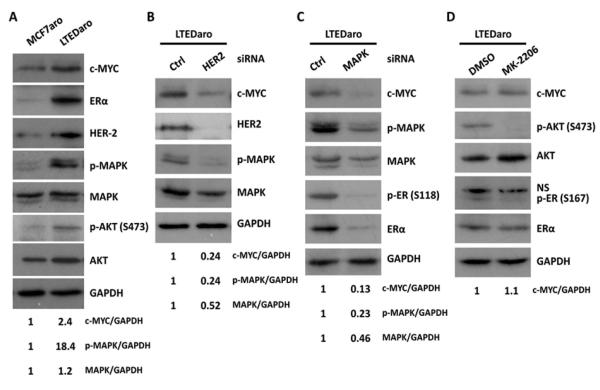
3.2. ER和HER2对AI耐药乳腺癌细胞MYC的上调 ER和HER2信号通路之间的相互作用与内分泌治疗抵抗有关[ 三 - 5 ]. 我们发现MYC在AI耐药乳腺癌细胞中上调,并且MYC上调与LTEDaro细胞中ERα和HER2的表达水平相关( 图2A ). 在同一组实验中,与MCF7aro细胞相比,LTEDaro细胞中MAPK和AKT的磷酸化显著增加( 图2A )证实HER2信号在AI耐药乳腺癌细胞中上调,与MYC表达增加有关。
图2。 ER和HER2之间的交叉作用上调AI耐药乳腺癌细胞中的c-MYC。
A.对正常培养基中培养的MCF7aro和LTEDaro细胞中c-MYC、ER和HER2的表达以及MAPK和AKT的磷酸化进行Western blotting分析。 c-MYC、p-MAPK、MAPK的定量标准化为负荷控制GAPDH,并计算与MCF7aro细胞表达相关的数值。
转染非靶向对照(Ctrl)siRNA或靶向HER2的siRNA 72小时后,LTEDaro细胞全细胞裂解物中的B.c-MYC蛋白水平。c-MYC、p-MAPK、MAPK的定量标准化为GAPDH,并计算与对照siRNA处理的LTEDaro细胞的表达相关的数值。
转染非靶向对照(Ctrl)siRNA或靶向MAPK的siRNA 72小时后,LTEDaro细胞全细胞裂解物中的C-MYC蛋白水平。C-MYC、p-MAPK和MAPK的定量标准化为GAPDH,并计算与对照siRNA处理的LTEDaro细胞的表达相关的值。
用二甲基亚砜或AKT抑制剂MK-2206(1μM)处理24小时的LTEDaro细胞全细胞裂解物中的D.c-MYC蛋白水平。c-MYC的定量标准化为GAPDH,并计算与用二甲基亚砜处理的LTEDaro细胞的表达相关的值。
为了测试HER2信号是否有助于MYC的上调,我们确定了siRNA减少HER2表达是否会降低MYC表达。 我们发现HER2的敲除显著降低了LTEDaro细胞中MYC的表达( 图2B )支持HER2上调AI耐药乳腺癌细胞的MYC。
HER2激活的两条主要细胞内途径是RAS-MAPK和PI3K-AKT途径[ 34 ]. 为了测试哪种途径负责上调MYC,我们用抗MAPK的siRNA和AKT抑制剂(MK-2206)处理LTEDaro细胞。 我们发现MAPK siRNA处理显著降低了MYC的表达以及ERα(Ser118)和总ERα的磷酸化( 图2C ). 相反,尽管AKT(Ser473)和ERα(Ser167)的磷酸化降低,AKT抑制剂(MK-2206)并没有降低MYC的表达( 图2D ). 这些发现表明HER2通过MAPK和ER的组成型激活来调节MYC的表达。
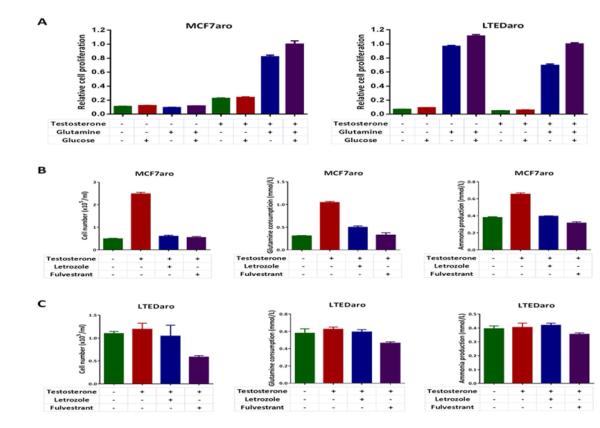
3.3. 谷氨酰胺的摄入与雌激素无关,但需要AI耐药乳腺癌细胞的ER 致癌转录因子MYC在乳腺癌内分泌抵抗中起作用[ 15 , 16 ]与人类癌症中的谷氨酰胺代谢有关[ 22 , 23 ]. 因为谷氨酰胺是氮的来源,也是为增殖细胞中TCA循环生物合成提供代谢物的关键来源[ 19 ],我们测定了MCF7aro或LTEDaro细胞在有无睾酮的情况下对谷氨酰胺和葡萄糖缺乏的细胞生长反应。 两种细胞系的生长均受到谷氨酰胺的刺激,但葡萄糖的刺激程度适中( 图3A )表明谷氨酰胺成瘾存在于AI敏感和耐药乳腺癌细胞中。 然而,在缺乏睾酮的情况下,MCF7aro细胞的生长完全减弱,而LTEDaro细胞则不受影响( 图3A )表明AI耐药乳腺癌细胞中雌激素依赖性谷氨酰胺代谢。
图3。 谷氨酰胺的摄入与雌激素无关,但需要AI耐药乳腺癌细胞的ER。
A.在存在或不存在睾酮的情况下,MCF7aro细胞(激素剥离72小时)对谷氨酰胺或葡萄糖剥夺的细胞生长反应。 在第6天测量MTT。 数据为平均值±SE(n=6)。
B.在存在或不存在睾酮的情况下,LTEDaro细胞对谷氨酰胺或葡萄糖缺乏的细胞生长反应。 在第6天测量MTT。 数据为平均值±SE(n=6)。
C.用二甲基亚砜、睾酮(1nM)、睾丸酮(1nM)加来曲唑(200nM)或睾酮(1 nM)加富尔维斯特(100nM)处理的MCF7aro细胞(激素去除72小时)的细胞生长、谷氨酰胺消耗和氨生成。 在第3天测量细胞数量、谷氨酰胺和氨浓度。 通过从培养基对照浓度中减去样品浓度来计算谷氨酰胺消耗量。 通过从样品浓度中减去培养基对照浓度来计算氨产量。 数据为平均值±SE。
D.用二甲基亚砜、睾酮(1nM)、睾酮和来曲唑(200nM)或睾酮和富尔维斯特(100nM)处理的LTEDaro细胞的细胞生长、谷氨酰胺消耗和氨生成。 在第3天测量细胞数量、谷氨酰胺和氨浓度。 通过从培养基对照浓度中减去样品浓度来计算谷氨酰胺消耗量。 通过从样品浓度中减去培养基对照浓度来计算氨产量。 数据为平均值±SE。
已发现雌激素刺激可增加MCF7乳腺癌细胞中谷氨酰胺的消耗[ 21 ]. 为了测试雌激素对乳腺癌细胞谷氨酰胺代谢的作用,我们测定了睾酮、来曲唑和富尔维斯特对MCF7aro和LTEDaro细胞谷氨酰胺消耗和氨生成的影响。 治疗72小时后,我们测量了细胞数量、谷氨酰胺和氨浓度。 我们发现,睾酮显著促进MCF7aro细胞生长并增加谷氨酰胺消耗,而来曲唑和富尔维斯特均阻断了睾酮治疗的效果( 图3B )表明雌激素通过雌激素受体刺激AI敏感性乳腺癌细胞中谷氨酰胺的消耗。 谷氨酰胺是细胞内产生氨的主要氮供体[ 35 ]. 与谷氨酰胺消耗量的变化一致,睾酮治疗后氨水平升高,而来曲唑阻断了MCF7aro细胞中氨的生成( 图3B ). 相反,睾酮和来曲唑对LTEDaro细胞的生长、谷氨酰胺的消耗或氨的产生没有影响,而富尔维斯坦治疗会降低细胞生长和谷氨酰胺的摄入( 图3C )这表明谷氨酰胺的摄入与雌激素无关,但仍需要AI耐药乳腺癌细胞中组成性激活的ER。
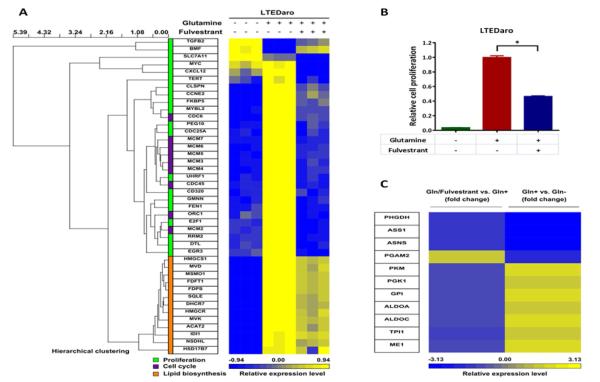
3.4. Fulvestrant抑制AI耐药乳腺癌细胞中谷氨酰胺介导的细胞增殖和脂糖代谢基因的表达 我们的结果表明,尽管AI耐药乳腺癌细胞中雌激素不依赖于雌激素,但ER在谷氨酰胺代谢中发挥作用,因此我们将LTEDaro细胞培养在不含谷氨酰胺(Gln−)、含谷氨酰胺的培养基(Gln+)或含谷氨酰胺和fulvestrant(Gln/fulvestrant)的培养基中24小时, 并进行RNA测序,以确定ER在LTEDaro细胞谷氨酰胺代谢中的作用。
我们使用Ingenuity软件分析了基因签名的分子和细胞功能。 五大分子和细胞功能列表 P(P) -值如所示 表1 在Gln+组和Gln−组之间的比较中,“脂质代谢”是变化最大的功能,在Gln+vs.Gln-组和Gln/Fulvestrant vs.Gln+的比较中“细胞生长和增殖”和“细胞死亡和存活”均位于变化功能的前五位列表中。
表1。 Ingenuity Pathway Analysis(IPA)确定的顶级分子和细胞功能
类别 P值 #分子
Gln+与Gln−
脂质代谢 2.49E-06-4.85E-02 57
小分子生物化学 2.49E-06-4.85E-02 119
维生素和矿物质代谢 2.49E-06-4.85E-02 23
细胞生长和增殖 1.37E-05-4.64E-02 213
细胞死亡和存活 2.56E-05-4.79E-02 206
Gln/Fulvestrant与Gln+
细胞周期 6.80E-11–2.73E-02 76
DNA复制、重组和修复 2.46E-09–2.73E-02 62
细胞生长和增殖 1.68E-05–2.73E-02 107
细胞死亡和存活 2.29E-05–2.73E-02 105
细胞组装和组织 3.53E-05–2.73E-02 22
Gln/Fulvestrant与Gln−
细胞生长和增殖 4.59E-07–2.98E-02 216
细胞组装和组织 2.69E-06–2.88E-02 31
DNA复制、重组和修复 2.69E-06–2.98E-02 26
氨基酸代谢 8.27E-06–2.75E-02 27
分子运输 2006年8月27日至2月2.98日 100
与Gln−组相比,我们观察到Gln+组中增殖和细胞周期的基因表达增加。 Gln/Fulvestrant组增殖和细胞周期的基因表达谱接近Gln−组( 图4A ). 这些结果表明,组成性激活的ER在谷氨酰胺介导的细胞增殖中起着重要作用。 我们通过MTT法证实了对细胞增殖的影响。 我们发现谷氨酰胺促进细胞增殖,而富尔维斯特兰降低谷氨酰胺介导的细胞增殖( 图4B ).
图4。 Fulvestrant抑制AI耐药乳腺癌细胞中谷氨酰胺介导的细胞增殖和脂糖代谢基因的表达。
A.树状图和热图显示了在不含谷氨酰胺、含谷氨酰胺或含谷氨酰胺和fulvestrant培养基中培养24小时的LTEDaro细胞基因表达数据的层次聚类分析。基因表达谱是从RNA测序数据中获得的。 分析了三组基因:细胞增殖、细胞周期和脂质生物合成。 列表示单个基因,行表示单个样本。 矩阵中的每个细胞代表单个样本中基因的表达水平。 比例尺指示表达式的级别; 红色表示高表达水平,蓝色表示低表达水平。
B.在不含谷氨酰胺、含谷氨酰胺或同时含有谷氨酰胺和富尔维斯坦的培养基中培养的LTEDaro细胞的细胞增殖。 在第7天测量MTT。 数据为平均值±SE(n=6)。 星号(*)表示 P(P) <0.05(t检验)。
C.热图显示了在不含谷氨酰胺(Gln−)、含谷氨酰胺(Gln+)或同时含谷氨酰胺和富维司琼(Gln/fulvestrant)的培养基中培养24小时的LTEDaro细胞的数据的基因表达分析。从RNA测序数据中获得基因表达谱。 列表示参与葡萄糖代谢的单个基因,行表示Gln/Fulvestrant与Gln+(左)或Gln+与Gln−(右)的倍数变化。 比例尺指示表达式的级别; 红色表示高表达水平,蓝色表示低表达水平。
谷氨酰胺可以作为碳和氮的来源,用于合成脂质、蛋白质和核苷酸[ 20 ]. 在RNA测序数据中,与Gln−组相比,我们在Gln+组中观察到一个强大的转录脂质生物合成基因特征。 Fulvestrant治疗对脂质生物合成中基因表达的影响较小( 图4A )这表明组成性激活的ER对谷氨酰胺促进的脂质生物合成可能不是必需的。
虽然谷氨酰胺刺激脂质生物合成的发现很重要,但我们对谷氨酰胺促进糖酵解感到特别兴奋( 表2 和 图4C ). 后一个观察结果支持我们的结果 图3 葡萄糖不足以驱动细胞增殖,细胞利用葡萄糖需要谷氨酰胺。 此外,通过比较Gln+组和Gln/Fuvestran组中这些基因的水平,发现葡萄糖的利用受到雌激素的调节( 图4C )以及Chen等人的审查[ 36 ].
表2。 通过摄入途径分析(IPA)鉴定谷氨酰胺介导的糖酵解酶表达(Gln+与Gln-−)
符号 Entrez基因名称 折叠更改
P(P) -价值
阿尔多阿 醛缩酶A,果糖二磷酸 1.504 2006年1月30日
阿尔多克 醛缩酶C,果糖二磷酸 2.087 3.62E-06型
ENO1公司 烯醇化酶1,(α) 1.553 4.54E-07号
性别均等指数 葡萄糖-6-磷酸异构酶 1.665 1.66E-08年
PFKP公司 磷酸果糖激酶,血小板 1.582 2.84E-07号机组
PGAM2型 磷酸甘油酸变位酶2(肌肉) -1.632 1.74E-03号机组
PGK1系列 磷酸甘油酸激酶1 1.607 2008年4月28日
PKM公司 丙酮酸激酶,肌肉 1.712 4.79E-07号
TPI1型 三磷酸异构酶1 1.568 3.86E-06型
3.5. Fulvestrant抑制AI耐药乳腺癌细胞中MYC介导的谷氨酰胺代谢 MYC是一个ER调节基因[ 12 , 13 ]. 如预期,ERα的表达式(由 ESR1系列 )靶基因,包括 MYC公司 ,在RNA测序数据中被fulvestrant阻断( 图5A ). 我们通过Western blotting检测富尔维斯特对ERα和MYC蛋白表达的影响。 我们发现,富尔维斯坦治疗后ERα和MYC的蛋白质水平显著降低( 图5B ).
图5。 Fulvestrant抑制AI耐药乳腺癌细胞中的c-Myc、SLC1A5和GLS。
A.树状图和热图显示了在不含谷氨酰胺、含谷氨酰胺或含谷氨酰胺和fulvestrant培养基中培养24小时的LTEDaro细胞基因表达数据的层次聚类分析。基因表达谱是从RNA测序数据中获得的。 分析了两组基因: ESR1系列 激活和 MYC公司 激活。 列表示单个基因,行表示单个样本。 矩阵中的每个细胞代表单个样本中基因的表达水平。 比例尺指示表达式的级别; 红色表示高表达水平,蓝色表示低表达水平。
B.Western blotting分析在指定时间点用fulvestrant(100nM)处理的LTEDaro细胞的全细胞裂解物中ERα和c-MYC的表达。
C.实时PCR分析 SLC1A5型 MCF7aro(激素去除72小时)和LTEDaro细胞在DMSO、睾酮(1nM)或睾酮(1 nM)加富尔维斯特(100nM)处理6小时后的表达。数值标准化为 ACTB公司 并绘制与DMSO处理的MCF7aro细胞的表达相关的曲线。 数据为平均值±SE(n=3)。
D.用二甲基亚砜或SLC1A5抑制剂GPNA(0.5mM)处理的LTEDaro细胞中谷氨酰胺的消耗。 在第3天测量谷氨酰胺浓度。 通过从培养基对照浓度中减去样品浓度来计算谷氨酰胺消耗量。 数据为平均值±SE。
E.用二甲基亚砜或SLC1A5抑制剂GPNA(0.5mM)处理的LTEDaro细胞的细胞增殖。 在第4天测量MTT。 数据为平均值±SE(n=6)。
F.实时PCR分析 GLS公司 MCF7aro(激素去除72小时)和LTEDaro细胞在DMSO、睾酮(1nM)或睾酮(1 nM)加富尔维斯特(100nM)处理6小时后的表达。数值标准化为 ACTB公司 并绘制与DMSO处理的MCF7aro细胞的表达相关的曲线。 数据为平均值±SE(n=3)。
G.用二甲基亚砜或GLS抑制剂化合物968(10μM)处理的LTEDaro细胞中谷氨酰胺的消耗。 在第3天测量谷氨酰胺浓度。 通过从培养基对照浓度中减去样品浓度来计算谷氨酰胺消耗量。 数据为平均值±SE。
H.用二甲基亚砜或GLS抑制剂化合物968(10μM)处理的LTEDaro细胞的细胞增殖。 在第4天测量MTT。 数据为平均值±SE(n=6)。 星号(*)表示 P(P) <0.05(t检验)。
MYC通过上调谷氨酰胺受体、溶质载体家族(SLC)1A5(也称为ASCT2),增强癌细胞胞外间隙对谷氨酰胺的摄取[ 20 ]. 为了确定SLC1A5在AI抗性乳腺癌细胞中是否上调,我们检测了 SLC1A5型 MCF7aro和LTEDaro细胞在基线检查时以及睾酮和Fulvestran治疗后。 在MCF7aro细胞中 SLC1A5型 睾酮治疗显著增加,fulvestrant预处理阻断了 SLC1A5型 睾酮治疗诱导的表达,表明 SLC1A5型 是AI敏感乳腺癌细胞中的雌激素诱导基因( 图5C ). 有趣的是 SLC1A5型 基线时,LTEDaro细胞中的mRNA远高于MCF7aro细胞,这与LTEDaro细胞中MYC的上调一致( 图5C 和 图1A)。 睾酮治疗并没有提高 SLC1A5型 LTEDaro细胞中的表达,表明谷氨酰胺转运蛋白SLC1A5在AI抗性乳腺癌细胞中不依赖于雌激素。 fulvestrant预处理显著减少 SLC1A5型 LTEDaro细胞中的表达( 图5C )表明SLC1A5在AI耐药乳腺癌中仍受ER调节。
由于SLC1A5在LTEDaro细胞中显著上调,我们想知道抑制SLC1A5-是否会减少谷氨酰胺消耗和细胞增殖。 我们测定了GPNA的作用,GPNA是一种抑制SLC1A5依赖性谷氨酰胺摄取的抑制剂[ 20 ]谷氨酰胺消耗和细胞增殖。 我们发现GPNA显著降低了LTEDaro细胞的谷氨酰胺消耗和细胞增殖( 图5D-E ).
谷氨酰胺一旦进入细胞,就可以通过谷氨酰胺水解进行代谢。 GLS是将谷氨酰胺转化为谷氨酸的酶,也可由MYC调节[ 20 ]. 因此,我们检测了 GLS公司 MCF7aro和LTEDaro细胞在基线检查时以及睾酮和Fulvestran治疗后。 在MCF7aro细胞中,睾酮治疗显著提高了 GLS公司 表达,而fulvestrant预处理显著阻断了睾酮治疗的效果( 图5F ). 与…对比 SLC1A5型 ,表达式 GLS公司 与基线时的MCF7aro细胞相比,LTEDaro细胞没有显著增加。 睾酮治疗并没有显著增加GLS的表达,但富尔维斯坦降低了LTEDaro细胞中GLS的表示( 图5F ).
为了测试抑制GLS是否影响AI耐药乳腺癌细胞中谷氨酰胺的消耗和细胞增殖,我们用GLS抑制剂化合物968处理LTEDaro细胞。 我们发现化合物968显著降低了LTEDaro细胞中的谷氨酰胺消耗和细胞增殖,表明GLS在治疗AI耐药乳腺癌中的作用( 图5G-H ).
综上所述,这些数据表明fulvestrant抑制AI耐药乳腺癌细胞中参与谷氨酰胺代谢的MYC、SLC1A5和GLS的表达。 我们的结果还表明,MYC和SLC1A5的表达增加是由组成性激活的ERα引起的,fulvestrant可以抑制ERα在AI耐药乳腺癌细胞中的表达。
4.讨论 HR阳性乳腺癌对内分泌治疗的耐药性是相当多患者面临的一个重大临床问题。 在本研究中,我们确定了MYC介导的谷氨酰胺代谢与AI耐药乳腺癌之间的关联。 我们发现,在AI耐药乳腺癌细胞中,通过ER和HER2之间的相互作用,致癌转录因子MYC上调。 谷氨酰胺代谢与雌激素无关,但在AI耐药乳腺癌中仍需要ER。 RNA测序显示,谷氨酰胺促进细胞增殖、脂质生物合成和糖酵解,而ER下调因子fulvestrant抑制AI耐药乳腺癌细胞中谷氨酰胺介导的细胞增殖和葡萄糖代谢。 此外,fulvestrant抑制了MYC、SLC1A5和GLS的表达,MYC,SLC1A5和GLS降低了AI耐药乳腺癌细胞的增殖。
癌基因的扩增和/或过度表达 MYC公司 在高级别乳腺癌中很常见[ 37 ]. MYC的上调与乳腺癌的内分泌抵抗有关[ 15 - 18 ]. 在我们的研究中,我们证明MYC在AI耐药乳腺癌细胞中上调。 越来越多的证据支持ER和HER2信号通路之间的密切相互作用与内分泌治疗抵抗有关[ 三 - 5 ]. 我们发现MYC的上调与AI耐药乳腺癌细胞中ER和HER2的表达水平相关。 此外,我们证明ER和HER2之间的串扰调节AI耐药乳腺癌细胞中MYC的表达。 这些发现表明,通过由ER和HER2通路调节的MYC的异常信号与乳腺癌的AI抵抗有关。
MYC的致癌水平调节人类癌症中的谷氨酰胺代谢[ 22 , 23 ]. 这使我们将谷氨酰胺代谢与AI抵抗联系起来。 我们发现,对人工智能敏感和耐药的乳腺癌细胞都对谷氨酰胺上瘾,但在对人工智能耐药的乳腺癌细胞中是以雌激素非依赖的方式,这表明谷氨酰胺代谢在人工智能耐药的乳腺癌中已经摆脱了雌激素依赖。 已发现雌激素刺激可增加MCF7乳腺癌细胞中谷氨酰胺的消耗[ 21 ]. 一直以来,我们在AI敏感的乳腺癌细胞中显示出类似的结果。 但是,AI耐药乳腺癌细胞中谷氨酰胺的消耗与雌激素无关。 然而,ER下调剂fulvestrant降低了AI耐药乳腺癌细胞中谷氨酰胺的消耗,这表明尽管雌激素不依赖,ER仍在谷氨酰胺消耗中发挥重要作用。 此外,我们的RNA-测序数据强烈表明,富尔维斯特兰可抑制AI耐药乳腺癌细胞中的谷氨酰胺代谢。 有趣的是,Shajahan-Haq等人最近发现,MYC和谷氨酰胺代谢与使用三苯氧胺和富尔维斯特耐药乳腺癌细胞系的抗雌激素抵抗相关[ 18 ]. 总之,MYC介导的谷氨酰胺代谢是乳腺癌内分泌治疗耐药的新机制。
MYC促进通过SLC1A5摄取谷氨酰胺,并促进谷氨酰胺代谢(例如,GLS是一种将谷氨酰胺转化为谷氨酸的酶)[ 20 ]. SLC1A5是谷氨酰胺依赖性mTORC1激活所需的转运体[ 22 , 38 ]. 有趣的是,我们发现SLC1A5在AI耐药乳腺癌细胞中显著上调。 睾酮治疗可显著诱导MCF7aro细胞中SLC1A5的表达,但LTEDaro细胞未诱导,这表明谷氨酰胺转运体独立于雌激素,并支持对AIs耐药的乳腺癌细胞在缺乏雌激素的情况下可以消耗谷氨酰胺。 此外,抑制MYC、SLC1A5和GLS显著降低AI耐药乳腺癌细胞的细胞增殖,表明靶向谷氨酰胺代谢是治疗AI耐药乳癌的潜在治疗策略。
总之,我们的研究表明,在AI耐药乳腺癌细胞中,MYC通过ER和HER2之间的串扰上调。 MYC介导的谷氨酰胺代谢与乳腺癌的AI抵抗相关。
亮点。
芳香化酶抑制剂(AI)耐药乳腺癌细胞对谷氨酰胺上瘾。
谷氨酰胺的摄入与雌激素无关,但仍需要AI耐药乳腺癌细胞的ER。
在AI耐药乳腺癌细胞中,c-MYC的表达通过ER和HER 2之间的相互作用上调。
靶向c-MYC介导的谷氨酰胺代谢抑制AI耐药乳腺癌细胞的增殖。
致谢 作者感谢希望之城综合基因组学中心的吴锡伟博士和王金辉博士对RNA测序的帮助。 该研究得到了国家卫生研究院(R01 ES08258 to SC)和熊猫慈善基金会(SC)的支持。
缩写
人工智能 芳香化酶抑制剂
DMEM公司 Dulbecco改良Eagle培养基
急诊室 雌激素受体
FBS公司 胎牛血清
格林 谷氨酰胺
GLS公司 谷氨酰胺酶
全球行动计划 L-谷氨酸γ-(对硝基苯胺)
HER2型 人表皮生长因子受体2
人力资源 激素受体
投资促进机构 创意路径分析
长期有效 长期雌激素剥夺
MAPK公司 丝裂原活化蛋白激酶
MEM公司 最小Eagle's介质
MTT公司 3-(4,5-二甲基噻唑-2-基)-2,5-二苯基四唑溴
PI3K系列 磷脂酰肌醇3'-激酶
小干扰RNA 短干扰RNA
SLC1A5型 溶质载体家族1A5
TCA公司 三羧酸
脚注
出版商免责声明: 这是一份未经编辑的手稿的PDF文件,已被接受出版。 作为对客户的服务,我们正在提供这份早期版本的手稿。 手稿在以最终可引用的形式出版之前,将经过编辑、排版和校对结果证明。请注意,在制作过程中可能会发现可能影响内容的错误,适用于该期刊的所有法律免责声明均适用。
利益声明
作者声明,没有任何利益冲突会影响所报告研究的公正性。
工具书类
[1]. Ferlay J、Shin HR、Bray F、Forman D、Mathers C、Parkin DM。2008年全球癌症负担估计:GLOBOCAN 2008。 国际癌症杂志。 2010; 127:2893–2917. doi:10.1002/ijc.25516。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[2]. Mauri D,Pavlidis N,Polyzos NP,Ioanidis JP。芳香化酶抑制剂和灭活剂与标准激素治疗在晚期乳腺癌中的生存率:荟萃分析。 2006年国家癌症研究所杂志; 98:1285–1291. doi:10.1093/jnci/djj357。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[3]. Martin LA、Farmer I、Johnston SR、Ali S、Marshall C、Dowsett M。增强的雌激素受体(ER)α、ERBB2和MAPK信号转导通路在MCF-7细胞适应长期雌激素剥夺的过程中起作用。 生物化学杂志。 2003; 278:30458–30468. doi:10.1074/jbc。 M305226200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[4]. Jelovac D、Sabnis G、Long BJ、Macedo L、Goloubeva OG、Brodie AM。长期使用芳香化酶抑制剂来曲唑治疗期间异种移植物和细胞中有丝分裂原活化蛋白激酶的激活。 《癌症研究》,2005年; 65:5380–5389. doi:10.1158/008-5472.CAN-04-4502。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[5]. Tokunaga E、Kimura Y、Mashino K、Oki E、Kataoka A、Ohno S、Morita M、Kakeji Y、Baba H、Maehara Y。乳腺癌中PI3K/Akt信号的激活和激素抵抗。 乳腺癌。 2006; 13:137–144. doi:10.2325/jbcs.13.137。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[6]. Flageng MH、Moi LL、Dixon JM、Geisler J、Lien EA、Miller WR、Lonning PE、Mellgren G。芳香化酶抑制剂新辅助治疗期间,乳腺癌患者的核受体共激活物和HER-2/neu上调。 英国癌症杂志。 2009; 101:1253–1260. doi:10.1038/sj.bjc.6605324。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[7]. Campbell RA、Bhat Nakshatri P、Patel NM、Constantinidou D、Ali S、Nakshatri H.磷脂酰肌醇3-激酶/AKT介导的雌激素受体α激活:一种抗雌激素耐药性的新模型。 生物化学杂志。 2001; 276:9817–9824. doi:10.1074/jbc。 M010840200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[8]. Kato S、Endoh H、Masuhiro Y、Kitamoto T、Uchiyama S、Sasaki H、Masushige S、Gotoh Y、Nishida E、Kawashima H、Metzger D、Chambon P。通过丝裂原活化蛋白激酶磷酸化激活雌激素受体。 科学。 1995; 270:1491–1494. doi:10.1126/science.270.5241.1491。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[9]. Masri S,Phung S,Wang X,Wu X,Yuan YC,Wagman L,Chen S。芳香化酶抑制剂耐药性、他莫昔芬耐药性和长期雌激素缺乏细胞的全基因组分析揭示了雌激素受体的作用。 癌症研究2008; 68:4910–4918. doi:10.1158/0008-5472.CAN-08-0303。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[10]. Martin LA,Farmer I,Johnston SR,Ali S,Dowsett M.长期雌激素缺乏期间ERK1/ERK2/雌激素受体相互作用增强雌激素介导的信号传导。 内分泌相关癌。 2005; 12(补充1):S75–84。 doi:10.1677/erc.1.01023。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[11]. Santen RJ、Song RX、Zhang Z、Kumar R、Jeng MH、Masamura A、Lawrence J,Jr.、Berstein L、Yue W.乳腺癌细胞长期雌激素缺乏可上调生长因子信号传导并增强雌激素敏感性。 内分泌相关癌。 2005; 12(补充1):S61–73。 doi:10.1677/erc.1.01018。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[12]. Shang Y,Hu X,DiRenzo J,Lazar MA,Brown M.雌激素受体调节转录的辅因子动力学和充分性。 单元格。 2000; 103:843–852. doi:10.1016/s0092-8674(00)00188-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[13]. Wang C、Mayer JA、Mazumdar A、Fertuck K、Kim H、Brown M、Brown PH。雌激素通过雌激素受体和AP-1转录因子激活的上游增强子诱导C-myc基因表达。 摩尔内分泌。 2011; 25:1527–1538. doi:10.1210/me.2011-1037。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[14]. Grandori C、Cowley SM、James LP、Eisenman RN。Myc/Max/Mad网络和细胞行为的转录控制。 细胞和发育生物学年鉴。 2000; 16:653–699. doi:10.1146/annurev.cellbio.16.1.653。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[15]. Miller TW、Balko JM、Ghazoui Z、Dunbier A、Anderson H、Dowsett M、Gonzalez-Angulo AM、Mills GB、Miller WR、Wu H、Shyr Y、Arteaga CL。获得性激素非依赖性人类乳腺癌细胞的基因表达特征表明MYC是抗雌激素抵抗的介体。 2011年临床癌症研究; 17:2024–2034. doi:10.1158/1078-0432.CCR-10-2567。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[16]. McNeil CM、Sergio CM、Anderson LR、Inman CK、Eggleton SA、Murphy NC、Millar EK、Crea P、Kench JG、Alles MC、Gardiner-Garden M、Ormandy CJ、Butt AJ、Henshall SM、Musgrove EA、Sutherland RL.c-Myc在乳腺癌中的过度表达和内分泌抵抗。 类固醇生物化学分子生物学杂志。 2006; 102:147–155. doi:10.1016/j.jsbmb.2006.09.028。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[17]. Al-azawi D、Ilroy MM、Kelly G、Redmond AM、Bane FT、Cocchiglia S、Hill AD、Young LS.Ets-2和p160蛋白协同调节内分泌抵抗型乳腺癌中的c-Myc。 致癌物。 2008; 27:3021–3031. doi:10.1038/sj.onc.1210964。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[18]. Shajahan-Haq AN、Cook KL、Schwartz-Roberts JL、Eltayeb AE、Demas DM、Warri AM、Facey CO、Hilakivi-Clarke LA、Clarke R.MYC调节内分泌抵抗型乳腺癌的未折叠蛋白反应以及葡萄糖和谷氨酰胺的摄取。 分子癌。 2014; 13:239. doi:10.1186/1476-4598-13-239。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[19]. DeBerardinis RJ、Lum JJ、Hatzivassiliou G、Thompson CB。 癌症生物学:代谢重组刺激细胞生长和增殖。 细胞代谢。 2008; 7:11–20. doi:10.1016/j.cmet.2007.10.002。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[20]. Wise DR,Thompson CB。 谷氨酰胺成瘾:癌症的新治疗靶点。 生物化学的发展趋势。 2010; 35:427–433. doi:10.1016/j.tibs.2010.05.003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[21]. 福布斯NS、梅多斯AL、克拉克DS、布兰奇HW。 雌二醇刺激乳腺癌细胞的生物合成途径:通过代谢通量分析检测。 代谢工程,2006年; 8:639–652. doi:10.1016/j.ymben.2006.06.005。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[22]. Wise DR、DeBerardinis RJ、Mancuso A、Sayed N、Zhang XY、Pfeiffer HK、Nissim I、Daikhin E、Yudkoff M、McMahon SB、Thompson CB。 Myc调节一个刺激线粒体谷氨酰胺分解并导致谷氨酰胺成瘾的转录程序。 美国国家科学院院刊2008; 105:18782–18787. doi:10.1073/pnas.0810199105。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[23]. Gao P、Tchernyshyov I、Chang TC、Lee YS、Kita K、Ochi T、Zeller KI、De Marzo AM、Van Eyk JE、Mendell JT、Dang CV.c-Myc对miR-23a/b的抑制增强了线粒体谷氨酰胺酶的表达和谷氨酰胺代谢。 自然。 2009; 458:762–765. doi:10.1038/nature07823。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[24]. 周德江,庞邦D,陈SA。人类芳香化酶互补DNA在哺乳动物细胞中的稳定表达:芳香化酶抑制剂筛选的有用系统。 1990年癌症研究; 50:6949–6954. [ 公共医学 ] [ 谷歌学者 ]
[25]. Spandidos A,Wang X,Wang H,Seed B.PrimerBank:用于基因表达检测和量化的人类和小鼠PCR引物对资源。 核酸研究2010; 38:D792–799。 doi:10.1093/nar/gkp1005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[26]. Chen Z,Wang O,Nie M,Elison K,Zhou D,Li M,Jiang Y,Xia W,Meng X,Chen S,Xing X.新型复合杂合CYP19A1突变导致中国成年男性芳香化酶缺乏症:雌激素替代治疗对骨、脂、肝和糖代谢的影响。 分子细胞内分泌。 2015; 399:32–42. doi:10.1016/j.mce.2014.09.016。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[27]. Trapnell C、Pachter L、Salzberg SL。TopHat:利用RNA-Seq发现剪接连接。 生物信息学。 2009; 25:1105–1111. doi:10.1093/bioinformatics/btp120。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[28]. Mortazavi A、Williams BA、McCue K、Schaeffer L、Wold B.通过RNA-Seq对哺乳动物转录体进行定位和量化。 Nat Meth公司。 2008; 5:621–628. doi:10.1038/nmeth.1226。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[29]. Pruitt KD、Tatusova T、Brown GR、Maglott DR.NCBI参考序列(RefSeq):现状、新特征和基因组注释政策。 核酸研究。 2012; 40:D130–D135。 doi:10.1093/nar/gkr1079。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[30]. Xing Y,Yu T,Wu YN,Roy M,Kim J,Lee C.从剪接图概率重建全长异构体的期望最大化算法。 核酸研究。 2006; 34:3150–3160. doi:10.1093/nar/gkl396。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[31]. CD典狱长,袁Y-C,吴霞。RNA-Seq折叠变化值的优化计算。 Int J Compute Bioinfo In Silico模型。 2013; 2:285–292. [ 谷歌学者 ]
[32]. Benjamini Y,Hochberg Y。控制错误发现率:一种实用且强大的多重测试方法。 英国皇家统计学会杂志。 B系列(方法学)1995; 57:289–300. [ 谷歌学者 ]
[33]. Ashburner M、Ball CA、Blake JA、Botstein D、Butler H、Cherry JM、Davis AP、Dolinski K、Dwight SS、Eppig JT、Harris MA、Hill DP、Issel-Tarver L、Kasarskis A、Lewis S、Matese JC、Richardson JE、Ringwald M、Rubin GM、Sherlock G.基因本体论:生物学统一的工具。 自然遗传学。 2000; 25:25–29. doi:10.1038/75556。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[34]. Yarden Y,Sliwkowski MX。《自然》杂志评论,解开ErbB信令网络。 分子细胞生物学。 2001; 2:127–137. doi:10.1038/35052073。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[35]. Shanware NP、Mullen AR、DeBerardinis RJ、Abraham RT。谷氨酰胺:在肿瘤生长和应激抵抗中的多效性作用。 分子医学杂志。 2011; 89:229–236. doi:10.1007/s00109-011-0731-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
[36]. Chen JQ,Brown TR,Russo J.雌激素和雌激素化学物质对能量代谢途径的调节,以及与内分泌干扰物暴露增加相关的肥胖的潜在影响。 Biochim生物物理学报。 2009; 1793:1128–1143. doi:10.1016/j.bbamcr.2009.03.009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[37]. 布兰卡托J、辛格B、刘A、廖DJ、迪克森RB。 高级乳腺癌中c-myc癌基因扩增和过度表达的相关性:FISH、原位杂交和免疫组织化学分析。 英国癌症杂志。 2004; 90:1612–1619. doi:10.1038/sj.bjc.6601703。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
[38]. Nicklin P、Bergman P、Zhang B、Triantafeallow E、Wang H、Nyfeler B、Yang H、Hild M、Kung C、Wilson C、Myer VE、MacKeigan JP、Porter JA、Wang YK、Cantley LC、Finan PM、Murphy LO。 氨基酸的双向转运调节mTOR和自噬。 单元格。 2009; 136:521–534. doi:10.1016/j.cell.2008.11.044。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]