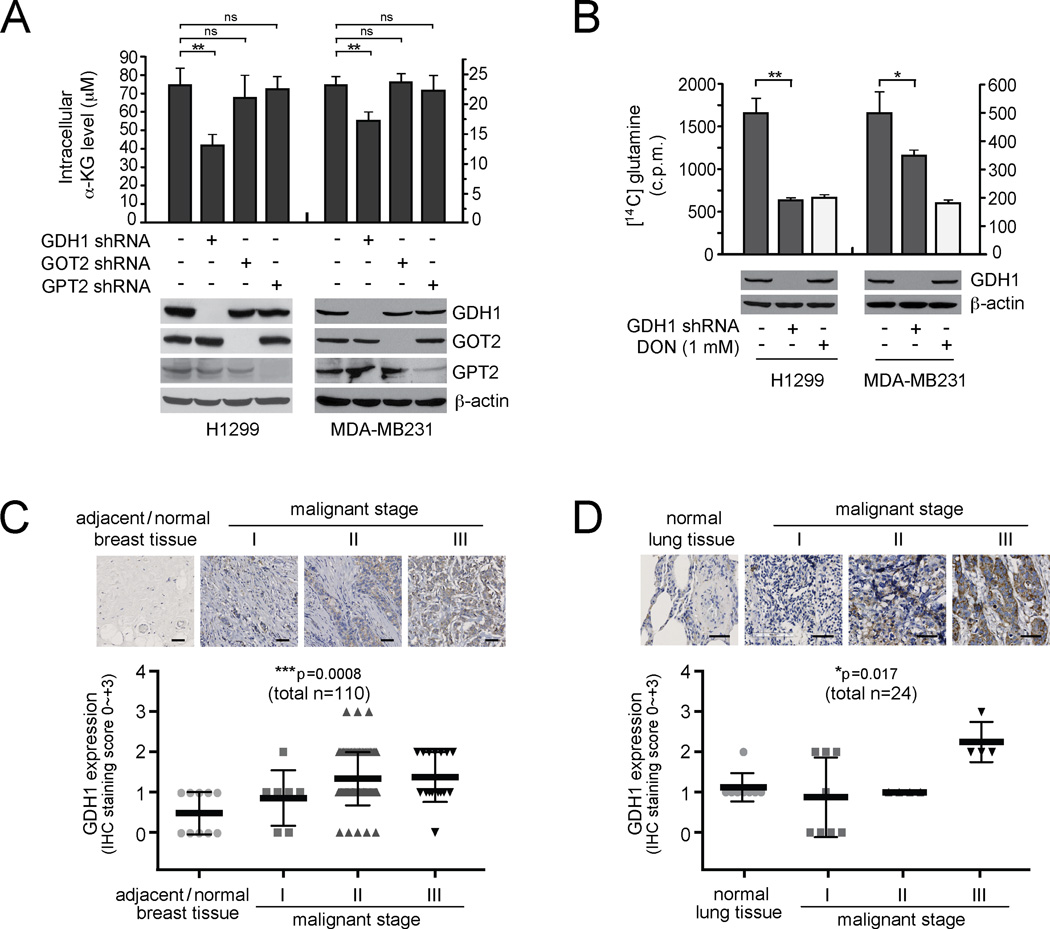
结果 GDH1主要调节癌细胞中α-KG的生成,在人类癌症中上调 为了更好地了解谷氨酰胺代谢在人类癌症中的作用,我们测试了阻断谷氨酸转化为α-KG的作用,这是谷氨酸水解的关键步骤,对癌细胞的影响。 在可能调节这一步骤的三种酶中,我们发现GDH1是主要负责将谷氨酸转化为α-KG的酶,而在肺癌H1299细胞和乳腺癌MDAMB231细胞中,与其他两种线粒体酶GOT2和GPT2相比( 图1A ). 此外,与携带空载体的对照细胞相比,shRNA介导的GDH1的稳定敲除导致谷氨酸分解率显著降低( 图1B )这表明GDH1在人类癌细胞的谷氨酰胺水解中起着关键作用。 此外,我们通过使用乳腺癌和肺癌患者的原代组织微阵列样本进行免疫组织化学染色(IHC),证明了GDH1的表达水平与乳腺癌和肺癌的进展阶段相关( 图1C和1D )。 晚期乳腺癌或肺癌患者的肿瘤样本中,GDH1的表达水平显著高于同一患者的相邻正常组织或无癌个体的正常组织。
图1。 GDH1主要调节癌细胞中α-KG的生成,在人类肺癌和乳腺癌中上调。
(A) 在稳定敲除GDH1、GOT2或GPT2的人肺癌H1299和乳腺癌MDA-MB231细胞中测定细胞内α-KG水平。 Western blot分析显示GDH1、GOT2和GPT2在H1299和MDA-MB231细胞中的表达。 β-actin作为负荷对照。 (B) 通过稳定击倒GDH1或携带空载体的对照细胞来测定H1299和MDA-MB231细胞中的谷氨酰胺降解率。 谷氨酰胺拮抗剂DON(6-重氮-5-氧代-I-去甲亮氨酸)作为阳性对照。 Western blotting显示GDH1表达。 数据为每个样本三个重复的平均值±SD,p值由双尾配对学生的 t吨 对面板1A和1B进行测试(ns:不显著;*:0.01<p<0.05;**:0.001<p<0.01)。 (C–D) GDH1在多组原始人类组织标本中表达的免疫组织化学分析。 乳腺导管癌(C)和肺癌(D)的组织微阵列来自美国biomex。 比例尺=50µm。 数据为平均值±标准差。通过方差分析得出p值。 (*:0.01<p<0.05;***:p<0.001)。
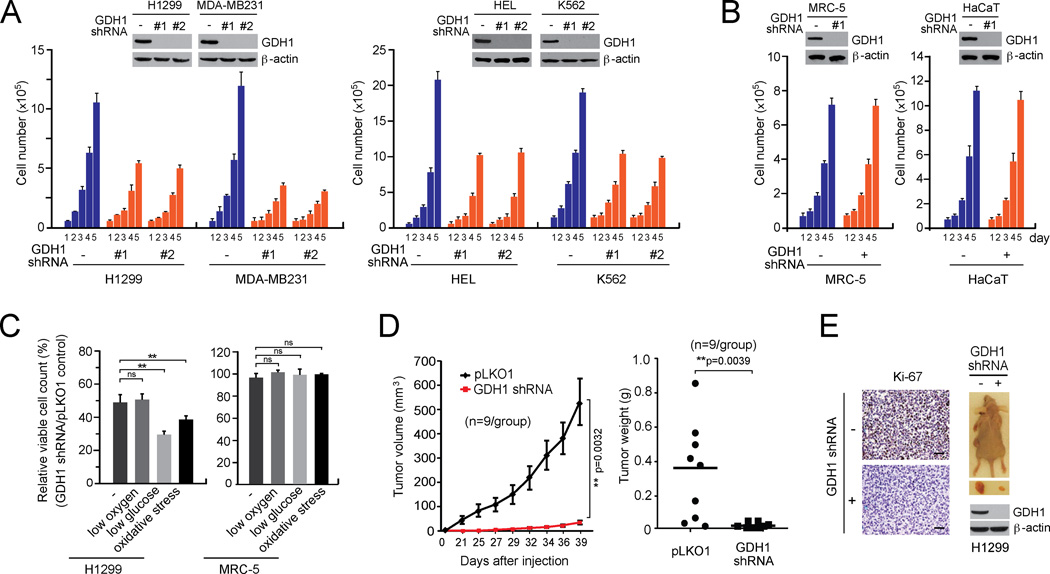
GDH1对癌细胞增殖和肿瘤生长很重要 为了确定GDH1在癌细胞增殖中的作用,我们建立了一组稳定敲除GDH1的人类癌细胞系。 这些包括H1299和MDA-MB231肿瘤细胞,以及人类白血病HEL和K562细胞。 对照组包括非肿瘤、增殖的人胎肺成纤维细胞MRC-5和人角质形成细胞HaCaT。 GDH1的稳定敲除导致所有测试的癌细胞株中的细胞数量减少( 图2A )但不在正常增殖细胞对照组( 图2B )表明GDH1在癌细胞增殖中起着关键作用。 集落形成试验也得到了类似的结果( 图S1A )和基于DNA的细胞增殖试验( 图S1B ). 氧化应激和低血糖培养条件(而非缺氧条件)进一步减弱H1299肺癌细胞GDH1敲除后的细胞增殖( 图2C ).
图2。 GDH1对癌细胞增殖和肿瘤生长具有重要作用。
(A–B) 通过对H1299和MDA-MB231肿瘤细胞(A; 左边 )HEL和K562白血病细胞(A; 正确的 )与表达空载体的对照细胞相比,MRC-5和HaCaT(B)稳定地敲除GDH1。 Western blot分析显示GDH1 shRNA克隆转导的细胞中GDH1的表达。 (C) 在包括低氧(1%O 2 )、低血糖(0.5 mM葡萄糖)和氧化应激(15µM H 2 O(运行) 2 ). (D) GDH1敲低对H1299细胞异种移植物小鼠肿瘤生长潜力的影响。 左侧: 每2–3天监测一次肿瘤大小,持续6周。 误差条代表SEM。 正确的: 在实验终点检查肿瘤重量。 (E) 左侧: IHC染色检测Ki-67在来自载体控制组或GDH1敲除组的肿瘤中表达的代表性图片。 比例尺=50µm。 正确的: 显示了典型的解剖肿瘤和肿瘤裂解物中GDH1的表达。 除面板D和E值由双尾学生的 t吨 面板C和双尾配对学生的测试 t吨 D组测试(ns:不显著;**:0.001<p<0.01)。 另请参见 图S1 .
此外,我们还进行了一项异种移植实验,在裸鼠皮下注射含有空载体的H1299细胞和分别生长在左右两侧的GDH1敲除的H1298细胞。 我们发现GDH1基因敲除导致大多数小鼠的肿瘤生长显著降低,与来自空白载体对照细胞的肿瘤相比,9只小鼠中有4只没有肿瘤( 图2D–2E ). 这些结果共同表明GDH1对癌细胞和肿瘤生长具有增殖优势。
GDH1对氧化还原调节至关重要,但对癌细胞中的生物能量学或合成代谢生物合成不重要 为了解释GDH1在癌症细胞的生物能量学、合成代谢生物合成和氧化还原稳态中的作用,我们使用肺癌H1299和乳腺癌MDA-MB231细胞进行了一组代谢分析,其中GDH1被敲除。 我们发现,与携带空载体的对照细胞相比,癌细胞中GDH1的减弱并不影响细胞内ATP水平( 图S2A ). GDH1敲除细胞与对照细胞相比,葡萄糖摄取、糖酵解速率和乳酸生成增加,但氧消耗速率不变( 图S2B-S2C ). 此外,与对照细胞相比,经糖酵解抑制剂、2-脱氧葡萄糖(2-DG)或葡萄糖剥夺治疗后,GDH1敲除细胞的胞内ATP水平显著降低,但经寡霉素(一种氧化磷酸化抑制剂)治疗后,细胞内ATP水平没有显著降低( 图S2D ). 这些数据共同表明,GDH1敲除导致的谷氨酰胺分解缺陷使细胞进一步依赖葡萄糖分解代谢来获得生物能量。 此外,GDH1敲除并不影响氧化戊糖磷酸途径(PPP)流量( 图S2E )或整个脂质或RNA生物合成( 图S2F和S2G ). 然而,GDH1的敲除显著降低了谷氨酰胺依赖性RNA的合成,而RNA合成的这种变化与葡萄糖衍生RNA的合成不可比( 图S2G ). 相比之下,GDH1基因敲除显著降低了细胞在低氧或低糖等应激条件下的细胞内ATP水平以及整体脂质和RNA合成水平( 图S2H–S2J ),表明GDH1在补偿应激下细胞中的葡萄糖分解代谢和氧化方面是重要的。 然而,由于GDH1敲低的细胞在正常条件下表现出细胞增殖和肿瘤生长减少,我们假设其他代谢缺陷,如氧化还原代谢变化,可能是GDH1敲低导致细胞增殖缺陷的原因。
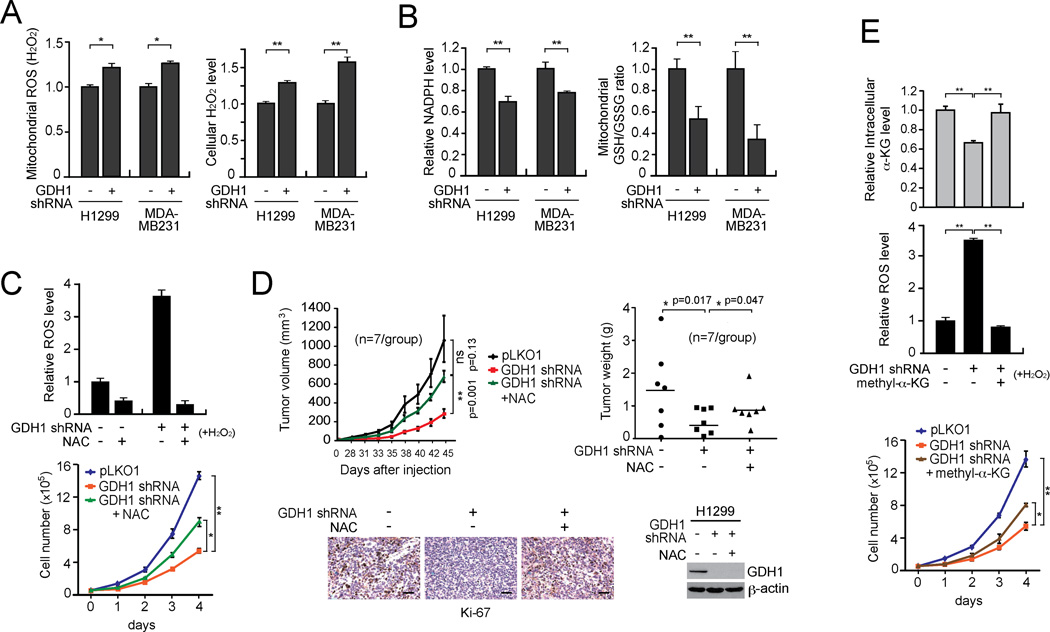
事实上,我们发现GDH1的敲除导致线粒体ROS水平增加( 图3A 左)和细胞内H 2 O(运行) 2 水平( 图3A 右侧),而H引起的应力条件 2 O(运行) 2 或葡萄糖缺乏导致GDH1敲除细胞中ROS水平进一步升高( 图S2K ). 相反,NADPH水平( 图3B 左)和GSH/GSSG比率( 图3B 右)GDH1敲除细胞与对照细胞相比显著减少。 这些数据共同表明,GDH1对癌细胞的氧化还原稳态非常重要,很可能是通过调节ROS水平实现的。 一直以来,抗氧化剂N-乙酰半胱氨酸(NAC)对GDH1敲除细胞的治疗显著挽救了由于GDH1缺陷而导致的ROS增加和细胞增殖减少( 图3C ). 在H诱导的氧化应激条件下,这种解救作用更加明显 2 O(运行) 2 ( 图3C 上部)。 接下来,我们在功能上验证了这一点 体内 通过异种移植实验。 裸鼠皮下注射含有空载体或GDH1敲除细胞的对照H1299细胞。 半数注射GDH1敲除细胞的小鼠通过饮用水服用浓度为10 mg/ml的NAC。 NAC治疗部分挽救了裸鼠移植瘤中H1299 GDH1敲除细胞的减毒肿瘤生长( 图3D ).
图3。 GDH1有助于癌细胞的氧化还原稳态。
(A–B) 线粒体活性氧和细胞H 2 O(运行) 2 用GDH1敲除的H1299和MDA-MB231细胞或空白载体的对照细胞测定其水平(A)、NADPH水平和线粒体GSH/GSSG比率(B)。 (C) 用抗氧化剂NAC(1 mM)处理GDH1敲除的H1299细胞。 ROS公司( 上面的 )和细胞增殖( 降低 )进行了测量。 (D) 对GDH1敲除的H1299异种移植小鼠给予NAC(10 mg/ml饮用水)。 左上: 监测肿瘤生长。 误差条代表SEM。 右上: 在实验终点检查肿瘤重量。 左下方: 肿瘤样品Ki-67 IHC染色的代表性图片。 比例尺=50µm。 右下角: GDH1在肿瘤裂解物中表达。 (E) 在存在和不存在0.5 mM甲基-α-KG的情况下处理H1299细胞( 上面的 )ROS生产( 中间的 )和扩散率( 降低 )如上文所述确定。 数据为三个重复的平均值±SD,但面板D除外。p值由双尾学生的 t吨 试验(ns:无显著性;*:0.01<p<0.05;**:0.01<p<0.01)。 另请参见 图S2 .
为了确定GDH1酶活性对ROS调节是否重要,我们接下来测试了挽救GDH1产物α-KG细胞内水平降低是否可以逆转GDH1敲除细胞中ROS水平升高( 图3E ). 事实上,细胞可渗透的甲基-α-KG显著地挽救了细胞内衰减的α-KG( 图3E 上部),ROS升高( 图3E 中)和细胞增殖降低( 图3E GDH1敲除细胞中的低)水平。 这些数据表明,GDH1需要其酶活性来调节活性氧(ROS),ROS有助于氧化还原平衡和癌细胞增殖。
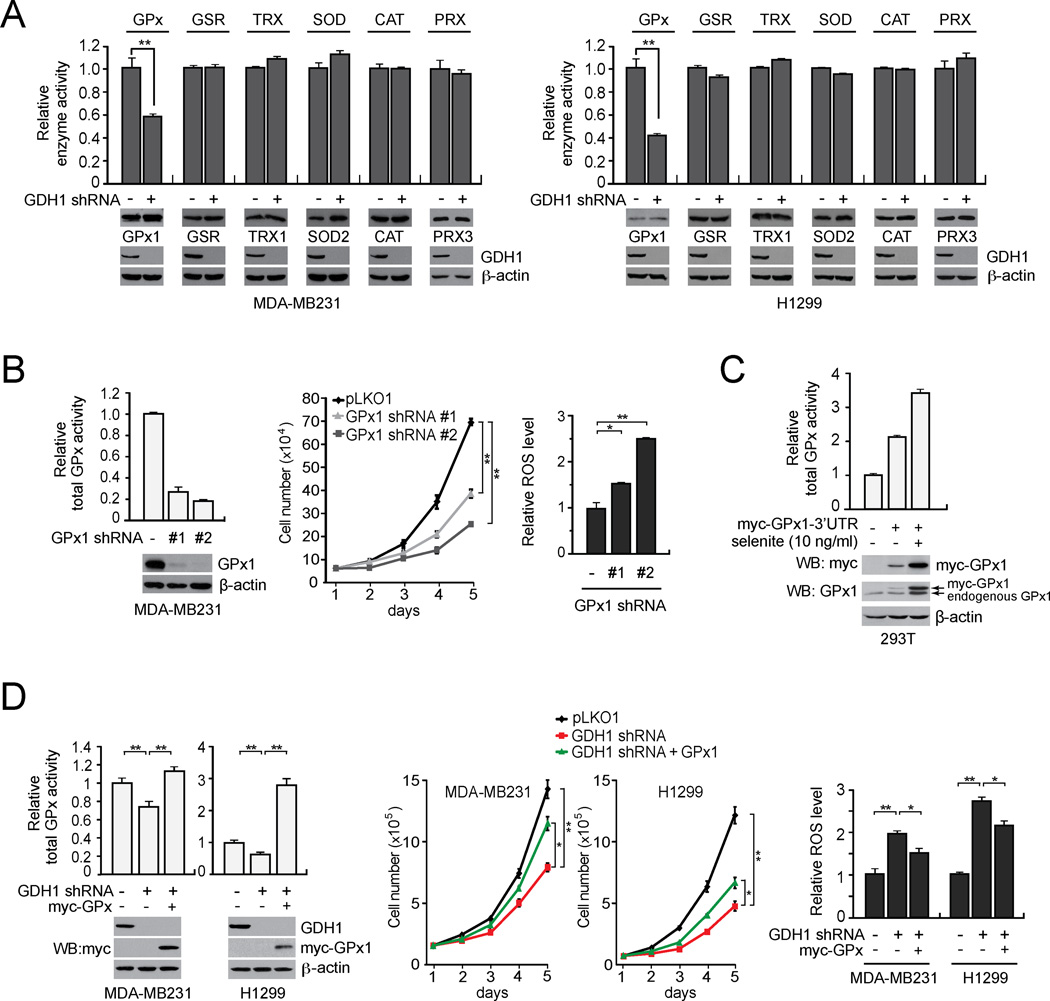
GDH1通过调节癌细胞中谷胱甘肽过氧化物酶(GPx)的活性部分促进氧化还原稳态 为了研究GDH1如何调节癌细胞中的ROS水平,我们测试了GDH1敲除是否会减弱任何已知的ROS清除酶,包括谷胱甘肽过氧化物酶(GPx)、谷胱甘苷还原酶(GSR)、硫氧还蛋白还原酶、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和过氧还蛋白(PRX)。 我们发现,与携带空载体的对照细胞相比,GDH1敲低MDA-MB231细胞中只有GPx酶活性显著减弱( 图4A 左)。 使用肺癌H1299细胞也获得了类似的结果( 图4A 右侧)。
图4。 GDH1通过调节癌细胞中谷胱甘肽过氧化物酶(GPx)的活性,在一定程度上有助于氧化还原稳态。
(A) GDH1敲除对MDA-MB231中GPx和其他ROS清除酶(包括GSR、TRX、SOD、CAT和PRX)活性的影响( 左边 )和H1299( 正确的 )单元格。 Western blot显示GDH1稳定敲除或空载体细胞中GPx1、GSR、TRX1、SOD2、CAT、PRX3和GDH1的表达。 β-actin作为负荷对照。 (B) GPx1敲除对总GPx活性的影响( 左边 ),细胞增殖( 中间的 )和ROS( 右侧) 在MDA-MB231癌细胞中。 通过Western blotting测定GPx1的敲除效率。 通过细胞计数和羧基-H评估细胞增殖率和活性氧水平 2 DCFDA检测。 (C) 在用GPx1表达结构转导的293T细胞中诱导GPx1的表达,该表达结构包含一个3'UTR和一个对亚硒酸盐反应的SECIS元件。 使用抗myc和抗GPx1抗体通过免疫印迹法测定myc标记的GPx1的表达。 (D) myc-GPx1稳定表达对细胞总GPx活性的影响( 左边 ),细胞增殖( 中间的 )和活性氧( 正确的 )在具有稳定敲低GDH1的MDA-MB231和H1299细胞中。 在所有试验的培养基中添加10 ng/ml亚硒酸盐。 Western blot分析显示GDH1敲除和myc-GPx1表达。 数据为三个重复的平均值±SD。 p值由双尾学生的 t吨 测试(*0.01<p<0.05;**0.001<p<0.01)。 另请参见 图S3 .
为了进一步证实GDH1通过GPx控制癌细胞中的ROS水平,我们首先测试了靶向GPx对癌细胞增殖和ROS水平的影响。 尽管GPx1、GPx3、GPx4、GPx6和GPx8存在于人类乳腺癌细胞系MDA-MB231中( 图S3A和S3B ),GPx1是促进癌细胞中GPx活性的主要亚型( 图S3C–S3D ). 因此,我们评估了靶向GPx1的影响。 RNAi介导的GPx1下调有效降低了GPx总活性( 图4B 左)。 此外,GPx1的敲除模拟了GDH1敲除的效果,导致细胞增殖减少,ROS增加( 图4B 中间和右侧)。 接下来,我们测试了活性GPx1的过度表达是否可以逆转GDH1敲除细胞中ROS水平的升高和细胞活力的降低。 GPx1是一种硒蛋白,它需要一个硒代半胱氨酸插入序列(SECIS)元件将GPx1基因中的UGA密码子翻译为硒代半月氨酸( Walczak等人,1998年 ). 我们生成了一个带有3'UTR的GPx1构造,其中包含SECIS元素,用于在细胞中表达GPx1( 图4C ). 我们观察到,与对照组GDH1敲除细胞相比,活性GPx1的稳定过度表达挽救了GDH1击倒细胞中减弱的总GPx活性,导致增殖能力增强,ROS降低( 图4D ). 我们发现GPx1在线粒体中与GDH1共定位( 图S3E–S3G )GDH1调节癌细胞线粒体中GPx1的活性( 图S3H ).
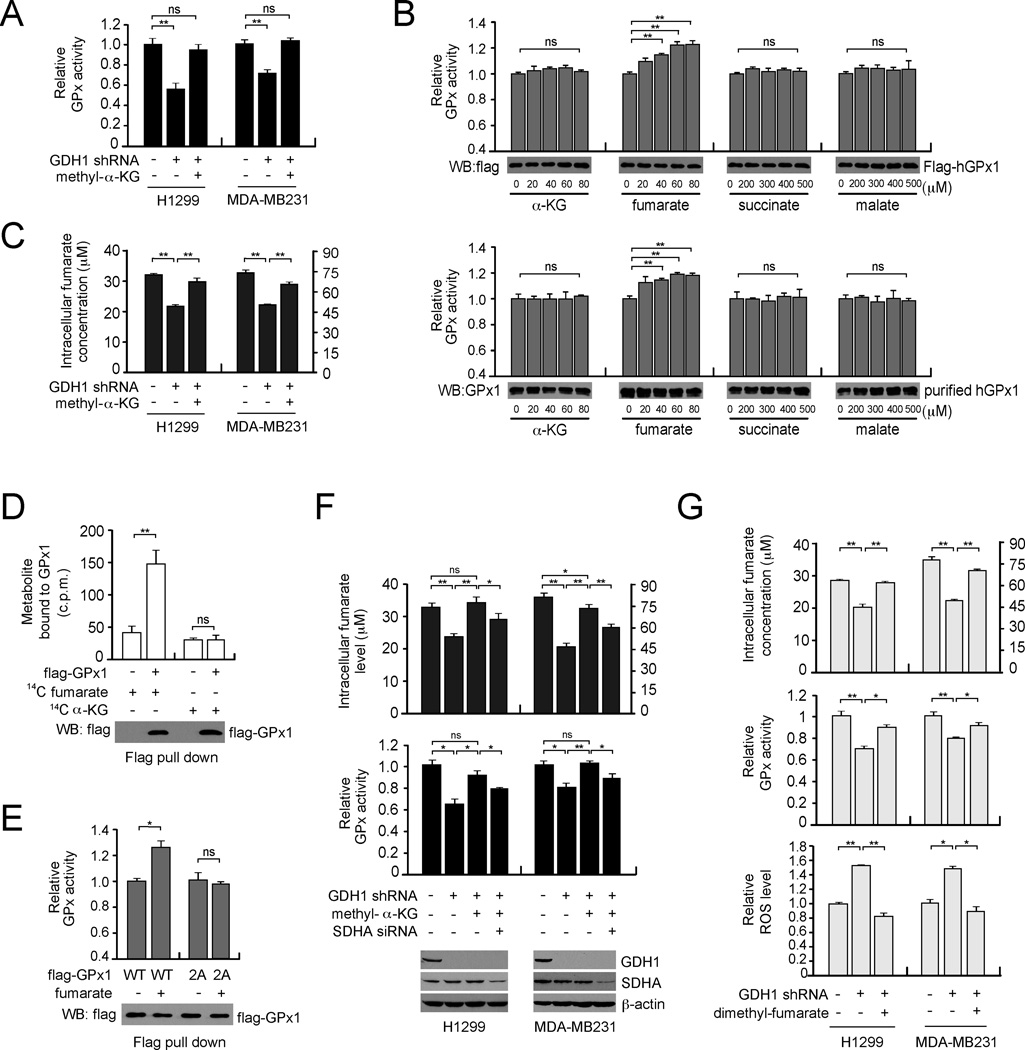
GDH1控制富马酸水平以增强GPx活性 接下来,我们探索了GDH1调节GPx活性的分子机制。 我们发现GDH1没有与GPx1形成蛋白质复合物(数据未显示)。 因此,我们假设GDH1可能通过控制细胞内α-KG水平间接调节GPx活性和随后的ROS水平 图5A ,甲基-α-KG处理完全挽救GDH1敲除细胞中减弱的GPx活性。 接下来,我们将纯化的活性GPx1与生理浓度的α-KG(20–80µM)或来自α-KG的其他代谢物中间体培养,包括富马酸(20–800µM 在体外 ( 图5B ),因为GDH1敲除后,癌细胞中的每一种代谢物都显著减少( 图1A , 5摄氏度 , S4A和S4B )。 有趣的是,纯化的人GPx1在哺乳动物细胞中瞬时表达的活性( 图5B 上部)或人红细胞( 图5B 较低),显著增加 在体外 富马酸,而不是其他代谢物。 此外,GDH1产物甲基-α-KG治疗挽救了癌细胞中减少的富马酸盐,表明GDH1及其产物α-KG控制了细胞内富马酸盐水平( 图5C ). 为了检测富马酸是否与GPx1结合并激活GPx1,我们使用 14 用从细胞中富集的GPx1培养的C-标记代谢物。 GPx1上保留了标记的富马酸,但没有保留α-KG、琥珀酸或苹果酸,表明富马酸直接与GPx1结合( 图5D 和 S4C系列 ). K系列 d日 计算得出GPx1与腐殖酸的相互作用值为75.52±5.22µM( 图S4C ). 为了确定富马酸盐与GPx1结合的选择性,我们产生了在T143和D144处具有取代的GPx1突变体。 通过分子对接研究预测,这些残基对富马酸与GPx1的结合至关重要( 图S4D ). 突变研究表明,GPx1 T143A/D144A(2A)对富马酸结合具有抵抗力,并且富马酸不再增强酶活性( 图S4E 和 第五版 ). 这表明,富马酸诱导的GPx1活化需要GPx1-富马酸相互作用。 此外,在TCA循环中产生富马酸的琥珀酸脱氢酶A(SDHA)的敲除消除了甲基-α-KG对GDH1敲除细胞的拯救作用( 图5F ). 一直以来,GDH1敲除细胞中富马酸水平的下降被细胞可渗透的富马酸二甲酯挽救( 图5G 上部),导致这些细胞中GPx活性部分被挽救,ROS水平降低( 图5G 中间和下部)。 这些数据共同表明,GDH1通过控制细胞内α-KG和富马酸水平来激活GPx1,从而在氧化还原调节中发挥重要作用。
图5。 GDH1通过控制细胞内富马酸水平促进GPx活性。
(A) 在存在或不存在细胞渗透性甲基-α-KG的情况下,测定GDH1稳定敲除的癌细胞中的GPx活性。 (B) 在增加α-KG、富马酸、琥珀酸或苹果酸浓度的情况下,检测293T细胞纯化的鞭毛GPx1或人红细胞内源性GPx1的活性。 Western blot分析显示每个样本的GPx1输入。 (C) 甲基-α-KG处理对GDH1敲除细胞内富马酸水平的影响。 (D) 从转染的293T细胞裂解物中提取Flag-GPx1并与 14 C-富马酸盐或 14 C-α-KG。将未结合的代谢物洗掉,并使用闪烁计数器测量富马酸或α-KG的残留量。 Western blot分析显示每个样本的GPx1输入。 (E) 在富马酸盐(80µM)存在下,检测293T细胞中纯化的标记GPx1野生型(WT)或富马酸结合缺陷突变标记GPx1T143A/D144A(2A)的活性。 Western blot分析显示每个样本的GPx1输入。 (F) 细胞内富马酸水平 (上部) 和内源性GPx的相对酶活性( 降低 )在甲基-α-KG和SDHA siRNA存在或不存在的情况下检测GDH1敲除细胞。Western blot分析显示GDH1和SDHA的敲除。 (G) 细胞内富马酸盐水平( 上面的 ),GPx活动( 中间的 )和ROS水平( 降低 )在肿瘤细胞中,GDH1的稳定敲除是在存在或不存在细胞可渗透的富马酸二甲酯的情况下测定的。 数据为三个重复的平均值±SD。 p值由双尾Student’s t吨 测试(ns:不显著;*0.01<p<0.05;**0.001<p<0.01)。 另请参见 图S4 .
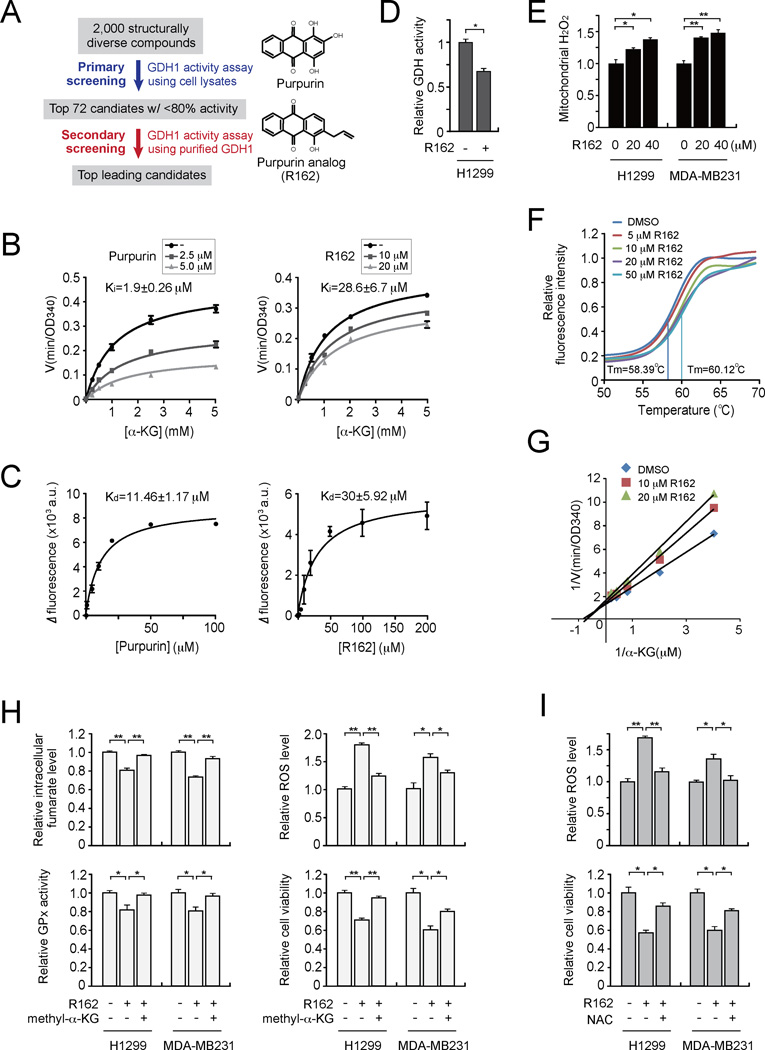
GDH1小分子抑制剂R162的鉴定与表征 我们发现GDH1在人类癌症中上调,GDH1的减弱影响癌细胞增殖和肿瘤生长,这表明GDH1是一个有前途的抗癌靶点。 目前唯一报道的GDH1抑制剂是表没食子儿茶素没食子酸酯(EGCG),一种从绿茶中分离出来的多酚类黄酮。 然而,EGCG针对一组使用NADPH作为辅因子的酶( Li等人,2006年 ; Li等人,2011年a ; Li等人,2011年b ). 因此,我们设计了一系列筛选试验来鉴定GDH1选择性抑制剂。 我们从2000个FDA批准的小分子化合物库中鉴定出一种铅小分子化合物紫红素作为GDH1抑制剂( 图6A 和 S5A–S5C系列 ). Purpurin对重组、纯化的活性GDH1蛋白的酶活性有显著的抑制作用 在体外 用K测定GDH活性 我 和K d日 分别为1.9±0.26µM和11.46±1.17µM( 图6B–6C 左)。 尽管紫癜素对GDH1酶活性有显著抑制作用 在体外 ,该化合物不具有细胞渗透性( 图S5D ). 因此,我们接下来将紫癜蛋白类似物R162鉴定为一组紫癜素衍生物中的一种有效GDH1抑制剂( 图S5E–S5G 和 6B–6C 右侧)。 R162因其烯丙基基团而比紫癜更容易通过细胞渗透,它对线粒体GDH活性和癌细胞中ROS水平的升高表现出更强的抑制作用( 图6D和6E )。 嘌呤特异性抑制GDH的活性,但不抑制其他NADPH依赖酶,如6-磷酸葡萄糖酸脱氢酶(6PGD)和富马酸水合酶(FH) 在体外 而EGCG显著影响6PGD和FH的活性 在体外 ( 图S5H ). 此外,比较紫色素、R162和EGCG表明,紫色素及其类似物R162对GDH1的抑制更有效、更特异 在体外 以及在癌细胞中( 图S5I–S5K ).
图6。 R162作为GDH1小分子抑制剂的鉴定和表征。
(A) 左侧: 用于将先导化合物识别为GDH1抑制剂的筛选策略示意图。 右侧: 嘌呤及其衍生物R162的结构。 (B) 纯化GDH1在不同浓度α-KG和紫癜素存在下的活性( 左边 )或R162( 正确的 ). (C) K(K) d日 通过色氨酸荧光结合试验测定值。 纯化的GDH1与增加浓度的紫癜素孵育( 左边 )或R162( 正确的 ). (D) 用R162(20µM)处理的癌细胞测定GDH活性。 (E) 在R162存在下测定H1299和MDA-MB231细胞中的线粒体ROS水平。 (F) 随着R162浓度的增加,纯化GDH1的热转变熔化曲线。 显示了DMSO控制和50µM R162的熔化温度(Tm)。 (G) R162和α-KG浓度增加时GDH活性的Lineweaver-Burk图。 (H) 甲基-α-KG处理(1mM)对细胞内富马酸水平的影响( 左上角 ),GPx活动( 下左 ),ROS水平( 右上角 )和细胞增殖( 下右 )在R162处理的H1299和MDA-MB231细胞中进行检测。 (一) NAC治疗(3 mM)对ROS水平的影响( 上面的 )和细胞增殖( 降低 )在R162处理的细胞中。 数据为三个重复的平均值±SD。 p值由双尾学生的 t吨 测试(*0.01<p<0.05;**0.001<p<0.01)。 另请参见 图S5 .
为了检测GDH1和R162之间的相互作用,进行了热熔体位移分析。 随着R162浓度的增加培养GDH1,熔化温度(Tm)以剂量依赖的方式升高,表明R162直接与GDH1结合( 图6F ). 此外,在竞争性结合试验中,R162与纯化GDH1蛋白在不同浓度的GDH1底物α-KG存在下孵育,Lineweaver-Burk图显示R162作为GDH1的混合模型抑制剂( 图6G ).
我们还发现,R162处理对GDH1活性的抑制导致H1299和MDA-MB231细胞中细胞内富马酸水平降低,GPx活性减弱,ROS水平升高,细胞增殖降低,而甲基-α-KG处理可以显著地挽救这一现象( 图6H )以及抗氧化剂NAC( 图6I ). 这些数据与GDH1敲除细胞中观察到的表型基本一致,表明R162通过GPx1靶向GDH1破坏氧化还原平衡并抑制癌细胞增殖。
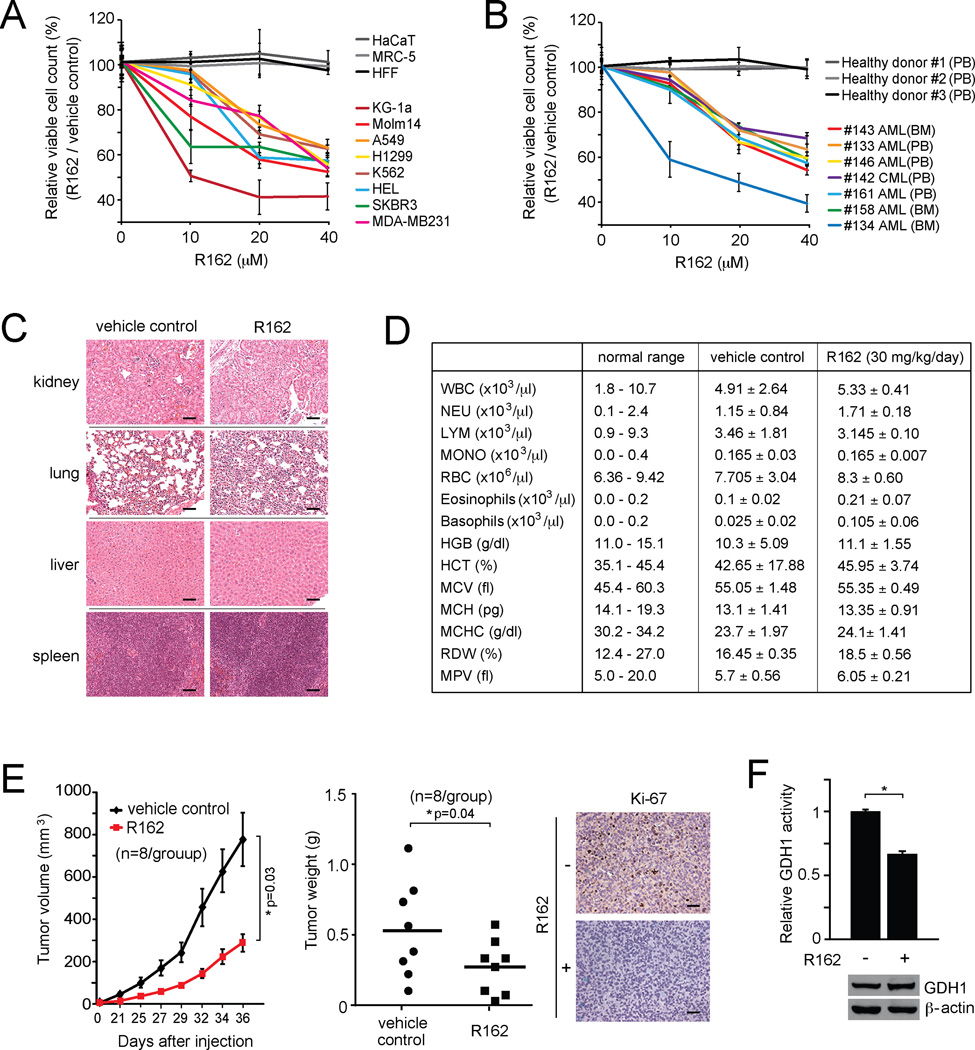
R162显著降低了一组人类肺癌、乳腺癌和白血病细胞系中的细胞活性,但在人类增殖细胞中没有,包括人类角质形成细胞(HaCaT)、人类胎肺成纤维细胞(MRC-5)和人类包皮成纤维细胞,它们起着控制增殖人类细胞的作用( 图7A ). 此外,R162抑制GDH1也会导致髓系白血病患者原代白血病细胞的细胞活性降低,但不会影响健康献血者外周血样本中单核细胞的细胞活力( 图7B ). 这些数据表明R162在人类癌细胞中具有抗增殖的潜力,且毒性最小。
图7。 R162抑制人类癌细胞的细胞增殖和肿瘤生长潜能。
(A) R162存在下不同人类肿瘤和白血病细胞的细胞活性。 对照细胞包括HaCaT、MRC-5和HFF。 (B) R162治疗对髓系白血病患者原发性白血病细胞生存能力的影响。 健康捐献者的外周血细胞作为对照。 BM:骨髓; PB:外周血; AML:急性髓细胞白血病; CML:慢性粒细胞白血病。 (C) R162或溶媒对照治疗组中代表性小鼠苏木精-伊红染色组织切片的组织学分析。 比例尺=50µm。 用R162(30 mg/kg/天)治疗小鼠30天。 (D) R162或载体对照处理小鼠的血液学血液测试。 (E) R162对H1299异种移植小鼠模型肿瘤生长的影响。 左侧: 监测肿瘤生长。 误差条代表SEM。 中间: 在实验终点检查肿瘤重量。 正确的: 对照组或R162治疗组肿瘤样本Ki-67 IHC染色的代表性图片。 比例尺=50µm。 (F) 在解剖的肿瘤样本中测定GDH1蛋白和活性水平。 显示了解剖肿瘤的代表性图片。 Western blotting显示肿瘤裂解物中GDH1的表达。 数据是三个重复的平均值±SD,但面板C和E除外。p值由双尾学生的 t吨 测试(*0.01<p<0.05)。
接下来我们测试了 体内 R162治疗异种移植瘤小鼠模型的疗效。 对于初始 体内 毒性研究中,通过腹腔注射给小鼠30 mg/kg/天的R162。 慢性R162治疗并未导致车辆治疗组和R162治疗组之间的显著组织病理学变化( 图7C )也没有改变全血计数或造血特性( 图7D )表明R162的毒性最小 体内 因此,我们执行了 体内 使用H1299异种裸鼠进行R162治疗。 异种移植注射后一天,将小鼠分为两组(n=8/组),用R162(20 mg/kg/天)或对照二甲基亚砜治疗35天。 与对照组小鼠相比,R162治疗导致小鼠肿瘤生长和肿块显著降低( 图7E ). 此外,R162可有效抑制裸鼠移植瘤中GDH1的活性( 图7F ). 这些结果共同表明R162是一种GDH1抑制剂,在毒性最小的癌细胞中具有潜在的抗增殖潜力 在体外 和 体内 .
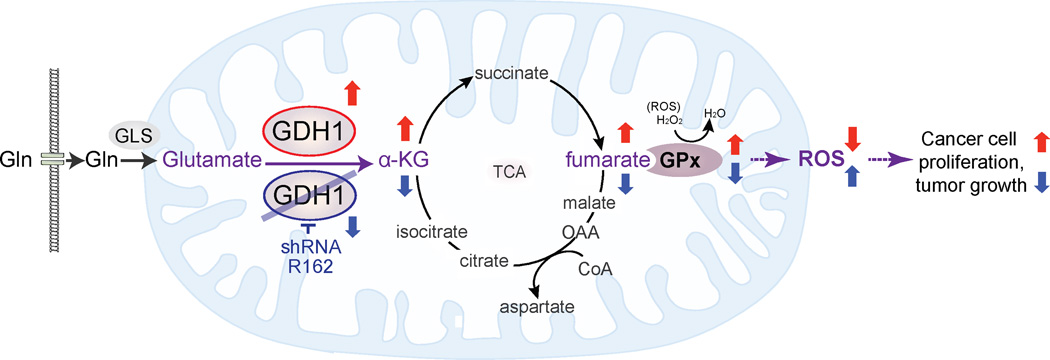
讨论 我们的发现表明线粒体GDH1有助于氧化还原稳态的机制。 GDH1控制其产物α-KG和随后的代谢中间产物富马酸的细胞内水平,富马酸结合并激活ROS清除酶GPx1,为癌细胞增殖和肿瘤生长提供代谢优势( 图8 ). 尽管有报道称,包括GDH1、GOT2和GPT2在内的三种酶可以将谷氨酸转化为α-KG( 科瓦切维奇,1971年 ; Quagliariello等人,1965年 ),我们的研究结果表明,GDH1在维持癌细胞中α-KG的生理水平方面发挥着主要作用。 GDH1还可能在α-KG依赖的生物功能中发挥关键作用,不仅包括TCA循环,还包括涉及多种α-KG-依赖酶的表观遗传调控,如组蛋白和DNA双加氧酶,这些酶调节全基因组组蛋白和DNA甲基化( Loenarz和Schofield,2008年 ; Simmons等人,2008年 ).
图8。 GDH1在癌症代谢中作用的建议模型。
癌细胞中GDH1的上调对于维持α-KG的生理水平以及富马酸的生理水平至关重要。 富马酸可能反过来结合并激活活性氧清除酶GPx,以调节氧化还原内环境平衡,从而为癌细胞和肿瘤生长提供增殖优势。 相反,抑制GDH1可降低α-KG和富马酸水平,导致GPx活性降低,随后ROS升高,从而抑制癌细胞增殖和肿瘤生长。
新的证据表明,除了葡萄糖外,谷氨酰胺作为生物能量学和合成代谢生物合成的替代碳源也很重要。 我们的结果一致表明,抑制GDH1会导致谷氨酰胺分解减少,从而使癌细胞更加依赖糖酵解,并对应激条件更敏感,例如葡萄糖缺乏,而不是低氧。 此外,尽管GDH1缺乏导致来源于谷氨酰胺的脂质和RNA的生物合成减少,但当葡萄糖依赖性生物合成在正常、无应激条件下占主导地位时,这种生物合成的变化对癌细胞来说是可有可无的。 这些代谢变化对癌细胞有利(糖酵解增加)或不必要(生物合成)。 然而,GDH1敲除细胞仍显示细胞增殖和肿瘤生长下降,这表明由于GDH1缺陷导致的其他严重代谢缺陷最终掩盖了这些变化。 我们的研究结果表明,GDH1通过GPx1调节氧化还原稳态,这有助于深入了解目前对GDH1生物学功能的理解,并揭示了谷氨酰胺分解和氧化还原维持之间的明显串扰。
此外,我们发现富马酸结合并激活GPx1提供了另一个例子,支持一种新的机制,即代谢中间产物可能作为信号分子发挥作用,允许代谢和细胞信号通路之间的串扰( Hitosugi等人,2012年 ; Sanders等人,2007年 ). 最近的一份报告表明,FH缺失会增加富马酸水平,并导致FH缺乏肾癌细胞线粒体ROS活化( Sullivan等人,2013年 ). 这意味着富马酸的作用可能取决于癌症类型和离散的TCA循环条件,如细胞内富马酸水平。 我们的研究结果以及其他研究成果展示了癌细胞中复杂的信号特性,这些特性协调代谢和细胞信号网络,为癌细胞提供最终优化的增殖优势。 未来的研究需要破译富马酸调节GPx活性的结构基础。
用shRNA或小分子抑制剂R162靶向GDH1可降低癌细胞增殖和肿瘤生长。 用细胞可渗透的GDH1产品甲基-α-KG治疗,显著挽救了这些表型。 然而,甲基-α-KG对α-KG水平的拯救显著但未完全逆转GDH1敲除细胞中细胞增殖的降低,表明GDH1对细胞增殖的影响不仅依赖于酶活性,还依赖于蛋白质水平。 此外,抗氧化剂NAC治疗可将ROS水平逆转至对照细胞,但不能完全挽救GDH1敲除细胞中细胞增殖或肿瘤生长的降低。 这表明GDH1不仅调节氧化还原状态,还调节其他有助于调节癌细胞增殖和肿瘤生长的细胞特性。 未来的研究需要进一步研究GDH1酶依赖性信号机制,该机制与癌细胞增殖和肿瘤生长有关。
最近的研究表明,靶向Rho GTPase信号依赖性谷氨酰胺酶(GLS),这是谷氨酰胺分解过程中第一个将谷氨酰胺转化为谷氨酸的酶,可以有效抑制癌细胞的生长( Wang等人,2010年 ). 另一种GLS抑制剂双-2-[5-苯基乙酰氨基-1,2,4-噻二唑-2-基]乙基硫醚(BPTES)对谷氨酰胺酶的抑制也能抑制IDH1突变的胶质瘤细胞的生长( Robinson等人,2007年 ; Seltzer等人,2010年 ). 我们的研究表明,GDH1的减弱(通常在人类癌症中上调)特别降低了乳腺癌、肺癌和白血病细胞的增殖,但不降低非恶性人类增殖细胞的增殖。 在这里,我们报告了靶向GDH1调节癌细胞中的谷氨酰胺分解和氧化还原平衡,表明GDH1是一个有吸引力的抗癌靶点。 尽管抗氧化多酚类黄酮EGCG被报道抑制GDH1活性,但它是NADPH依赖酶的一般抑制剂。 我们的小分子R162在抑制癌细胞增殖以及患者的原代白血病细胞方面具有良好的疗效,对人类细胞的细胞毒作用最小。 R162也有很好的疗效 体内 毒性最小。 我们目前的研究证明GDH1可能是严重依赖谷氨酰胺代谢的人类癌症临床治疗的一个有希望的替代治疗靶点。 进一步 体内 需要测试这些小分子GDH1抑制剂在大脑、心脏和肝脏等代谢活跃器官中的毒性,并需要进行详细的药代动力学研究。 这些特性良好的GDH1抑制剂也将是进一步了解GDH1如何调节癌症代谢和肿瘤生长的强大化学工具。
实验程序 试剂 靶向GDH1、GOT2和GPT2的慢病毒短发夹RNA(shRNA)和GDH1图像克隆购自Open Biosystems。 SDHA siRNA来自于Qiagen。 带有3'UTR区域的人GPx1被PCR标记为myc或flag,并亚克隆到pLHCX衍生的Gateway目的载体中。 GPx1变异体由定点突变试剂盒(Aligent Technologies)产生。 使用线粒体分离试剂盒(Pierce)从细胞中分离线粒体。 从人红细胞中纯化的GDH来自Sigma-Aldrich。 14 C-富马酸(60 mCi/mMol)从Moravek生化公司获得。 14 C-酮戊二酸(58.7mCi/mMol)来自Perkin Elmer。 除非特别说明,否则所有化学品均从Sigma-Aldrich公司购买。
抗体 抗GDH1、GOT2、GPT2、GPx1、PRX3和Ki-67的抗体从Abcam购买。 抗钙蛋白酶、抗TRX1、抗SDHA和抗myc抗体来自细胞信号技术。 抗GSR和SOD2的抗体分别来自Santa Cruz Biotechnology和BD Biosciences。 从Sigma-Aldrich获得抗-FLAG和抗β-肌动蛋白抗体。
细胞培养 在含有10%胎牛血清(FBS)的RPMI 1640培养基中培养H1299、A549、HEL、KG1a、Molm14、K562细胞。 293T、MDA-MB231、SKBR3、HaCaT、HFF和MRC-5细胞在含有10%FBS的Dulbecco改良鹰培养基(DMEM)中培养。之前描述了慢病毒的产生、RNAi的细胞感染和人类细胞中蛋白质过度表达以及稳定的细胞选择( Jin等人,2013年 ).
酶活性测定 GDH酶活性测定如前所述( Zaganas等人,2002年 ). 简单地说,将20µg总细胞裂解物或100 ng纯化GDH1添加到含有50 mM三乙醇胺(pH 8.0)、100 mM醋酸铵、100µM NADPH和2.6 mM EDTA的反应混合物中。 通过添加α-KG启动反应,并通过监测NADPH的氧化来评估其活性,即340 nm处吸光度的降低。 根据制造商的说明,使用Biovision的商用试剂盒测定谷胱甘肽过氧化物酶(GPx)、超氧化物歧化酶(SOD)、硫氧还蛋白还原酶(TRX)、谷胱甘苷还原酶和过氧化氢酶(CAT)的活性。 过氧化物酶原(PRX)酶的活性通过硫氧还蛋白还原酶与NADPH的氧化偶联来测定( Nelson和Parsonage,2011年 ).
谷氨酰胺分解率测量 谷氨酰胺氧化测定 14 一氧化碳 2 从 14 用C-谷氨酰胺测定谷氨酰胺水解率。 简单地说,将细胞接种在6厘米的培养皿上,培养皿放置在10厘米的密封培养皿中。 用4µCi/ml的[U培养细胞- 14 C] 谷氨酰胺4小时后,通过添加200µl 70%的高氯酸停止反应,高氯酸也会释放CO 2 将0.5 ml 3 M NaOH注入放置在6 cm培养皿旁边的杯子中,以吸收所有释放的CO 2 在培养12小时后,从细胞中取出20µl NaOH进行液体闪烁计数。
细胞内ATP、乳酸生成和耗氧量测定 使用ATP生物发光体细胞检测试剂盒(Sigma-Aldrich)测量细胞内ATP浓度。 5 × 10 5 细胞悬浮在超纯水中。 通过向细胞悬浮液中添加ATP酶混合物启动反应,并通过荧光分光光度计(分子探针)记录发光。 用基于荧光的乳酸测定试剂盒(MBL)测量细胞乳酸的产生。 将无酚红的普通RPMI培养基加入亚流动细胞中1小时,并评估培养基的乳酸水平。 数值根据细胞数进行标准化。 氧气消耗率是使用连接在782氧气计(Strathkelvin Instruments)上的克拉克型微电极氧电极测量的。
细胞内ROS、NADPH水平和GSH/GSSG比值测量 通过用羧基-H染色细胞来测定细胞内总活性氧 2 DCFDA(Invitrogen)和线粒体ROS水平通过使用特定的线粒体H测定 2 O(运行) 2 探针,MitoPY1(Sigma),如前所述( Dickinson和Chang,2008年 ; Dickinson等人,2013年 ). 2×10 5 用10µM羧基-H培养细胞 2 DCFDA或10µM MitoPY1在37°C下保持30分钟。 用流式细胞仪(BD-FACSCanto)对细胞进行清洗和分析。 细胞内NADPH水平和GSH/GSSG比率分别使用荧光法SensoLyte NADP/NADPH分析(AnaSpec)和GSH/GSSG-Glo™(Promega)进行测定。
细胞内代谢物测量 使用商业试剂盒(Biovision)测定细胞内α-KG、富马酸、琥珀酸和苹果酸的水平。 简言之,2×10 6 细胞在PBS中均质。收集上清液并使用10KD Amicon超离心过滤器(Millipore)去除蛋白质。 按照制造商的说明,含有代谢物的流通液用于测量α-KG、富马酸、琥珀酸和苹果酸。
辐射测量学 14 富马酸C-酯/ 14 C-α-KG–GPx1结合试验 用TBS缓冲液(50 mM Tris,150 mM NaCl,pH 7.5)洗涤从转染的293T细胞裂解液中纯化的珠结鞭毛-GPx1,然后用0.12µCi进行培养 14 C-富马酸或 14 C-α-KG在TBS缓冲液中放置30分钟。 然后用TBS缓冲液清洗珠子。 用10µg标记肽洗脱珠结合GPx1蛋白,并通过液体闪烁计数检测放射性。
细胞增殖试验 5 × 10 4 贴壁细胞或1×10 5 将白血病细胞接种在6孔板中,使用TC10自动细胞计数器(Bio-Rad)通过台盼蓝排除法测定细胞数量。 对于α-KG、NAC和R162处理实验,用不同浓度的α-KG、NAC及R162处理细胞,然后进行上述细胞计数。
异种移植研究 动物实验按照埃默里大学动物护理和使用委员会批准的方案进行。 裸鼠(无胸腺nu/nu,雌性,4-6周龄,Harlan)皮下注射1×10 7 H1299细胞左翼携带空载体,右翼细胞GDH1被稳定击倒。 在NAC拯救实验中,NAC拯救组的小鼠在注射H1299-GDH1 shRNA细胞后的第3天开始,以10 mg/ml的NAC饮用水处理42天。 为了评估R162的疗效,从H1299细胞注射后的第二天开始,通过每天腹膜内注射30mg/kg给药35天。 PBS中50%的DMSO作为稀释剂对照。 通过测量肿瘤的两个垂直直径记录肿瘤生长,并使用公式4π/3×(宽度/2)计算肿瘤大小 2 ×(长度/2)。 在实验终点采集肿瘤并称重。 Ki-67 IHC染色检测肿瘤增殖。
药物筛选使用 在体外 GDH分析 为了筛选潜在的GDH1抑制剂, 在体外 使用GDH1-过表达293T细胞裂解物或纯化GDH(Sigma),在化合物(10µM)存在的情况下,如上所述进行GDH1活性测定。 补充数据中显示了详细的筛选策略和结果 图S7 .
GDH1酶动力学 将2µM纯化的GDH1与不同浓度的紫红素或R162在50 mM Tris-Cl缓冲液(pH 7.5)中孵育,并测量固有色氨酸荧光(Ex:280 nm/Em:350 nm)以进行色氨酸荧光素结合分析。 使用Prism 6(GraphPad)进行非线性回归分析,以计算解离常数(K d日 ). 采用不同底物浓度α-KG的GDH活性测定法测定了紫癜素和R162的抑制常数(Ki),并用Prism 6(GraphPad)计算了抑制常数。
热位移分析 使用蛋白质热转移染料试剂盒(生命技术)进行热转移分析。 将10µM纯化GDH与不同浓度的R162孵育,并将蛋白药物混合物添加到反应混合物中。 使用实时PCR系统(Applied Biosystems)记录荧光,并使用Protein Thermal Shift Software v1.0(Life Technologies)分析数据。
组织芯片分析 石蜡包埋乳腺癌和肺癌组织芯片来自美国Biomax。 根据上述方案对GDH1表达进行IHC分析( Li等人,2013年 ). 埃默里大学机构审查委员会批准使用人体标本。 根据健康保险携带和责任法案(HIPAA)批准的协议,在知情同意的情况下收集所有临床样本。
统计分析 使用Prism 6(GraphPad)进行统计分析和图形显示。 所示数据来自多个独立实验的一个代表性实验,除肿瘤生长曲线代表平均值±SEM外,均以平均值±SD表示。显著性的统计分析基于单向方差分析(单向方差分析) 图1C-1D 和双尾学生的 t吨 测试所有其他数据。
意义。 我们的发现为理解谷氨酰胺分解在氧化还原内环境平衡中的作用提供了见解。 我们证明GDH1主要控制癌细胞内α-KG的细胞内水平,并在氧化还原稳态中发挥关键作用。 此外,我们的研究结果还表明富马酸具有调节GPx1的独特信号功能,允许谷氨酸分解、TCA循环和氧化还原状态之间的额外串扰。 最后,我们的GDH1抑制剂R162在治疗多种人类癌细胞方面表现出了良好的疗效和最小毒性 在体外 和 体内 以及人类患者的原代白血病细胞。 因此,我们的发现提供了原理证明,表明GDH1是治疗与谷氨酰胺代谢升高相关的人类癌症的一个有前途的治疗靶点。
致谢 我们感谢Anthea Hammond博士的编辑协助。 我们感谢埃默里大学的集成细胞成像核心。 这项工作得到了NIH拨款R01 CA175316(S.K.)、F31 CA183365(G.A.)和S10 RR025679 01(P.S.)、ACS拨款RSG-11-081-01(S.K.:)、格鲁吉亚癌症联盟(H.J.K.)和埃默里大学医学院血液组织库的部分支持。 G.A.是NIH的博士前研究员。 H.J.K.、F.R.K.和S.K.是乔治亚癌症联盟学者。 S.K是罗宾斯学者和美国癌症学会基础研究学者。
脚注
出版商免责声明: 这是一份未经编辑的手稿的PDF文件,已被接受出版。 作为对客户的服务,我们正在提供这份早期版本的手稿。 手稿在以最终可引用的形式出版之前,将经过编辑、排版和校对结果证明。请注意,在制作过程中可能会发现可能影响内容的错误,适用于该期刊的所有法律免责声明均适用。
作者贡献
P.J.、M.L.A.、H.J.K.、D.M.S.和F.R.K.提供了关键试剂。 Z.L.、T.J.B.和C.H.进行了结构分析。 H.Y.和E.R.W.进行了电子显微镜实验。 D.D.和N.T.S.进行了基于质谱的分析。 R.E.和R.J.D.进行了代谢通量分析。 K.R.M.进行了组织病理学研究。 L.J.、D.L.、G.N.A.、J.F.、H.-B.K.进行了所有其他实验。 L.J.和S.K.设计了研究并撰写了论文。
参考文献
Boonstra J,《纽约邮报》。 哺乳动物细胞中与活性氧物种和细胞周期进展相关的分子事件。 基因。 2004; 337:1–13. doi:10.1016/j.gene.2004.04.032。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
DeBerardinis RJ,Cheng T.Q的下一篇:谷氨酰胺在新陈代谢、细胞生物学和癌症中的多种功能。 致癌物。 2010; 29:313–324. doi:10.1038/onc.2009.358。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
DeBerardinis RJ、Mancuso A、Daikhin E、Nissim I、Yudkoff M、Wehrli S、Thompson CB。 除了有氧糖酵解:转化细胞可以参与谷氨酰胺代谢,超过蛋白质和核苷酸合成的需要。 美国国家科学院院刊2007; 104:19345–19350. doi:10.1073/pnas.0709747104。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Dickinson BC,Chang CJ。 一种靶向荧光探针,用于成像活细胞线粒体中的过氧化氢。 美国化学学会杂志。 2008; 130:9638–9639. doi:10.1021/ja802355u。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Dickinson BC、Lin VS、Chang CJ。 用于活细胞线粒体过氧化氢成像的MitoPY1的制备和使用。 自然协议。 2013; 8:1249–1259. doi:10.1038/nprot.2013.064。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Frezza C,Gottlieb E.癌症中的线粒体:不仅仅是无辜的旁观者。 塞明癌症生物学。 2009; 19:4–11. doi:10.1016/j.emcancer.2008.11.008。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Friday E,Oliver R,3rd,Welbourne T,Turturro F.曲格列酮对乳腺癌细胞谷氨酰胺裂解和糖酵解的调节:与线粒体膜电位的关系。 细胞生理学杂志。 2011; 226:511–519. doi:10.1002/jcp.22360。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Hitosugi T、Zhou L、Elf S、Fan J、Kang HB、Seo JH、Shan C、Dai Q、Zhang L、Xie J等。磷酸甘油变位酶1协调糖酵解和生物合成,促进肿瘤生长。 癌细胞。 2012; 22:585–600. doi:10.1016/j.ccr.2012.09.020。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Hsu PP,Sabatini DM。癌细胞代谢:Warburg及其他领域。 单元格。 2008; 134:703–707. doi:10.1016/j.cell.2008.08.021。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Jin L,Li D,Lee JS,Elf S,Alesi GN,Fan J,Kang HB,Wang D,Fu H,Taunton J等。p90 RSK2通过转录依赖和独立机制介导抗噪声信号。 分子和细胞生物学。 2013; 33:2574–2585. doi:10.1128/MCB.01677-12。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Kawanishi S、Hiraku Y、Pinlaor S、Ma N.动物和炎症患者的氧化和硝化DNA损伤与炎症相关的致癌作用。 生物化学。 2006; 387:365–372. doi:10.1515/BC.2006.049。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Kim JW,Dang CV.癌症的分子甜食和Warburg效应。 2006年癌症研究; 66:8927–8930. doi:10.1158/0008-5472.CAN-06-1501。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Kovacevic Z.哺乳动物细胞分离线粒体中谷氨酰胺和谷氨酸氧化途径。 生物化学杂志。 1971; 125:757–763. doi:10.1042/bj1250757。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Li C、Allen A、Kwagh J、Doliba NM、Qin W、Najafi H、Collins HW、Matschinsky FM、Stanley CA、Smith TJ。绿茶多酚通过抑制谷氨酸脱氢酶调节胰岛素分泌。 生物化学杂志。 2006; 281:10214–10221. doi:10.1074/jbc。 M512792200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Li C,Li M,Chen P,Narayan S,Matschinsky FM,Bennett MJ,Stanley CA,Smith TJ。绿茶多酚通过劫持ADP激活位点控制转基因小鼠中失调的谷氨酸脱氢酶。 生物化学杂志。 2011年a; 286:34164–34174. doi:10.1074/jbc。 M111.268599。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Li D,Jin L,Alesi GN,Kim YM,Fan J,Seo JH,Wang D,Tucker M,Gu TL,Lee BH,等。促转移核糖体S6激酶2-cAMP反应元件结合蛋白(RSK2-CREB)信号通路上调肌动蛋白结合蛋白fascin-1,促进肿瘤转移。 生物化学杂志。 2013; 288:32528–32538. doi:10.1074/jbc。 M113.500561。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Li M,Li C,Allen A,Stanley CA,Smith TJ。哺乳动物谷氨酸脱氢酶的结构和变构调控。 生物化学与生物物理学Arch Biochem Biophys。 2011年b doi:10.1016/j.abb.2011.10.015。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Loenarz C、Schofield CJ。 2-氧戊二酸加氧酶的扩展化学生物学。 自然化学生物学。 2008; 4:152–156. doi:10.1038/nchembio0308-152。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Lu W,Pelicano H,Huang P。癌症代谢:谷氨酰胺比葡萄糖甜吗? 癌细胞。 2010; 18:199–200. doi:10.1016/j.cr.2010.08.017。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
麦地那MA。谷氨酰胺与癌症。 营养学杂志。 2001; 131:2539S–2542S.doi:10.1093/jn/131.9.2539S。 讨论2550S-2531S。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Moreadith RW,Lehninger AL.肿瘤细胞线粒体氧化谷氨酸和谷氨酰胺的途径.线粒体NAD(P)+依赖苹果酸酶的作用。 生物化学杂志。 1984; 259:6215–6221. [ 公共医学 ] [ 谷歌学者 ]
Nelson KJ,Parsonage D.过氧化物酶原活性的测量。 毒理学/编辑委员会Mahin D Maines的当前方案。 2011; 7(单元7):10。 doi:10.1002/0471140856.tx0710s49。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Niemiec T、Sikorska J、Harrison A、Szmidt M、Sawosz E、Wirth-Dzieciolowska E、Wilczak J、Pierzynowski S.α-酮戊二酸稳定氧化还原内环境并改善老龄小鼠的动脉弹性。 生理学和药理学杂志:波兰生理学会的官方杂志。 2011; 62:37–43. [ 公共医学 ] [ 谷歌学者 ]
Perry G、Raina AK、Nunomura A、Wataya T、Sayre LM、Smith MA。氧化损伤有多重要? 阿尔茨海默病的教训。 自由基生物学与医学。 2000; 28:831–834. doi:10.1016/s0891-5849(00)00158-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Quaglariello E、Papa S、Saccone C、Palmieri F、Francavilla A。大鼠肝线粒体对谷氨酸的氧化作用。生物化学杂志。 1965; 95:742–748. doi:10.1042/bj0950742。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Reitzer LJ、Wice BM、Kennell D。谷氨酰胺而非糖是培养HeLa细胞的主要能量来源的证据。 生物化学杂志。 1979; 254:2669–2676. [ 公共医学 ] [ 谷歌学者 ]
Robinson MM、McBryant SJ、Tsukamoto T、Rojas C、Ferraris DV、Hamilton SK、Hansen JC、Curthoys NP。双-2-(5-苯基乙酰氨基-1,2,4-噻二唑-2-基)乙基硫醚(BPTES)抑制大鼠肾脏型谷氨酰胺酶的新机制。生物化学杂志。 2007; 406:407–414. doi:10.1042/BJ20070039。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Sanders MJ,Grondin PO,Hegarty BD,Snowden MA,Carling D.研究AMP活化蛋白激酶级联的AMP活化机制。 生物化学杂志。 2007; 403:139–148. doi:10.1042/BJ20061520。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Seltzer MJ、Bennett BD、Joshi AD、Gao P、Thomas AG、Ferraris DV、Tsukamoto T、Rojas CJ、Slusher BS、Rabinowitz JD等。谷氨酰胺酶的抑制优先减缓具有突变IDH1的神经胶质瘤细胞的生长。 2010年癌症研究; 70:8981–8987。 doi:10.1158/0008-5472.CAN-10-1666。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Simmons JM、Muller TA、Hausinger RP.参与碱基、核苷、核苷酸和染色质代谢的Fe(II)/α-酮戊二酸羟化酶。 道尔顿交易。 2008:5132–5142. doi:10.1039/b803512a。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Stuart SD、Schauble A、Gupta S、Kennedy AD、Keppler BR、Bingham PM、Zachar Z。一种战略性设计的小分子通过氧化还原过程攻击肿瘤细胞中的α-酮戊二酸脱氢酶。 癌症与新陈代谢。 2014; 2:4. doi:10.1186/2049-3002-2-4。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Sullivan LB、Martinez-Garcia E、Nguyen H、Mullen AR、Dufour E、Sudarshan S、Licht JD、Debrardinis RJ、Chandel NS。 富马酸原红细胞红细胞结合谷胱甘肽来放大ROS依赖信号。 分子细胞。 2013; 51:236–248. doi:10.1016/j.molcel.2013.05.003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Szatrowski TP,Nathan CF。人类肿瘤细胞产生大量过氧化氢。 1991年癌症研究; 51:794–798. [ 公共医学 ] [ 谷歌学者 ]
Toyokuni S,Okamoto K,Yodoi J,Hiai H。癌症中的持续氧化应激。 FEBS信件。 1995; 358:1–3. doi:10.1016/0014-5793(94)01368-b。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Walczak R,Carbon P,Krol A.3'UTR中一个重要的非Watson-Crick碱基对基序,用于介导硒蛋白翻译。 雷纳。 1998; 4:74–84. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Wang JB、Erickson JW、Fuji R、Ramachandran S、Gao P、Dinavahi R、Wilson KF、Ambrosio AL、Dias SM、Dang CV、Cerione RA。 靶向线粒体谷氨酰胺酶活性抑制致癌转化。 癌细胞。 2010; 18:207–219. doi:10.1016/j.ccr.2010.08.009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Warburg O。关于癌细胞的起源。 科学。 1956; 123:309–314. doi:10.1126/science.123.3191.309。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Wise DR,Thompson CB。 谷氨酰胺成瘾:癌症的新治疗靶点。 生物化学科学趋势。 2010; 35:427–433. doi:10.1016/j.tibs.2010.05.003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Zaganas I、Spanaki C、Karpusas M、Plaitakis A。在人类家政(GLUD1)的调节域用Ser替代Arg-443谷氨酸脱氢酶几乎消除了基础活性,并显著改变了ADP和L-亮氨酸对酶的激活。 生物化学杂志。 2002; 277:46552–46558. doi:10.1074/jbc。 m20859.62万元。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。