摘要
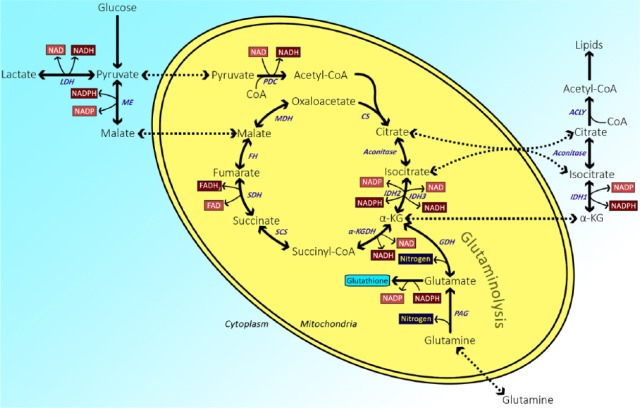
谷氨酸脱氢酶(GDH)催化谷氨酸可逆转化为α-酮戊二酸,伴随NAD(P)的还原+NAD(P)H或反之亦然。GDH活性受到包括底物抑制在内的复杂变构调节。为了原位测定GDH动力学,我们评估了不同谷氨酸浓度与辅酶NAD结合的影响+或NADP+利用代谢图谱研究小鼠肝脏冷冻切片中GDH活性。北美+-依赖GDH V最大值比NADP高2.5倍+-依赖V最大值,而K米相似,当NAD为1.92 mM时为1.66 mM+或NADP+分别使用。辅酶V最大值在10 mM谷氨酸浓度下测定,在较高谷氨酸浓度和K我第12.2条和第3.95条(适用于NAD)+和NADP+分别用作辅酶。北美+-和NADP+-在各种小鼠组织中检测依赖性GDH活性。GDH活性在肝脏中最高,在其他组织中更低。在所有组织中,NAD的活性最高+用作辅酶。总之,含有NAD的小鼠肝脏中GDH活性最高+作为辅酶,在谷氨酸浓度为10 mM时测定GDH活性最高。
材料和方法
鼠标示例
雄性对照野生型C57BI/6J小鼠的各种组织来自学术医学中心动物研究所。将小脑、肝脏、肾脏、胰腺、舌头、小肠、结肠、胃、脾脏、肺、心脏和骨骼肌组织在液氮中快速冷冻,并在-80℃下储存。按照《人类护理和使用实验动物机构标准》对动物进行治疗。机构动物护理和使用委员会批准了这些实验。除肺外,所有组织的未固定冷冻切片均在-20℃下切割,标称厚度为7µm,并在-80℃下保存。肺冷冻切片的标称厚度为8µm。在代谢绘图之前,组织切片在室温下风干30分钟。
代谢图谱
我们使用四氮唑盐来绘制脱氢酶活性的代谢图谱(图2). 在这种方法中,脱氢酶,在这种情况下是GDH,减少NAD(P)+NAD(P)H还原介质中的电子载体,随后将水溶性微黄色硝基蓝四唑(NitroBT)还原为不溶于水的蓝色甲醛沉淀。因此,GDH活性部位沉淀的甲素的吸光度是GDH活性的直接测量值(Chieco等人,2013年;Van Noorden 2010年;Jonker等人,1996年;Van Noorden和Frederiks 1992年). 当使用未固定的冷冻切片时,该方法能够评估其完整细胞微环境中的GDH活性。化学固定影响(通常抑制)酶的活性。为了正确定位所生成的甲胎素的酶活性,在酶孵育期间必须将大分子保存在组织切片中(Van Noorden 2010年;Van Noorden和Vogels 1989年). 实现这一点的最佳方法之一是向培养基中添加水溶性聚合物聚乙烯醇(PVA)。在含有聚乙烯醇的介质中,小分子(如底物和辅酶)可以自由扩散,而大分子(如蛋白质)则不能。此外,PVA保持组织形态完整。这种方法确保酶的翻译后修饰及其微环境尽可能保持完整。
图2。
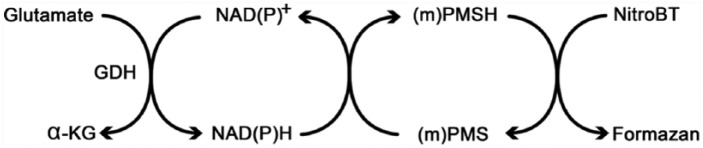
四唑盐法的原理,用于绘制脱氢酶活性的一般代谢图,特别是GDH活性。缩写:(m)PMS:1-(甲氧基)吩嗪甲磺酸盐;PMS:吩嗪甲磺酸酯;硝基BT:硝基蓝四氮唑。
为了绘制GDH活性的代谢图,将三只小鼠的肝组织切片在37℃的温度下,在含有18%PVA(西格玛-阿尔德里奇,密苏里州圣路易斯)的水溶液中,在0.1 M磷酸盐缓冲液(pH 8;默克,德国达姆施塔特)中孵育30分钟,该缓冲液含有5 mM硝基BT(西格马-阿尔德里希),3 mM NAD+或NADP+(瑞士巴塞尔罗氏公司)、2 mM ADP(罗氏)、0.32 mM甲磺酸吩嗪(PMS;德国海德堡Serva)和0-50 mM我-谷氨酸(Sigma-Aldrich)。每个小鼠肝脏的三个切片用于测试每个谷氨酸浓度。对于所有进一步的实验,使用10 mM谷氨酸,每个小鼠使用一个组织切片。在没有谷氨酸、ADP或NAD(P)的情况下进行对照反应+.
PMS原液在黑暗中保持在4C。NAD的所有其他储备溶液+、NADP+,ADP、NitroBT和谷氨酸盐在孵育前新鲜制备。通过加热NitroBT,将其溶解在等量的100%乙醇和二甲基甲酰胺中,最终浓度为2%v/v(0.34 M乙醇和0.26 M二甲基甲胺)。
培养后,使用0.1mM磷酸盐缓冲液(pH 5.3)在60℃下冲洗组织切片30分钟,以立即停止酶反应并直接从切片中去除粘性培养基。然后,用自来水和蒸馏水冲洗切片,并在热板上干燥。干燥后,将组织切片包埋在甘油果冻中作为固定介质(丹麦格罗斯特拉普达科)。
图像分析
根据Chieco等人(2013)使用ImageJ(NIH,Bethesda,MD)获得所有组织的图像(Abrámoff等人,2004年;Schneider等人,2012年)在装有20倍物镜(日本东京奥林巴斯)和Scion cfw-1312灰度相机(亚利桑那州图森市Scion)的Vanox-T显微镜上。记录组织中的以下区域:肝、门脉周围和小叶中央周围区域;胰腺、外分泌组织;肾、皮质;大脑皮层;小脑、分子层、颗粒细胞层、浦肯野细胞层和白质;胃、胃腺;小肠,绒毛;结肠、隐窝;骨骼肌、肌肉组织;脾、红、白髓;肺,肺泡;心脏、肌肉组织;舌头、骨骼肌。每个组织切片测量一个面积(对于小肠,测量两个面积)。以1360×1024像素的分辨率记录图像。用白光照射样品,并通过红外阻挡滤光片进行过滤(Chieco等人,2013年;Jonker等人,1997年). 为了专门记录甲霜的吸光度,使用了585-nm单色滤光片(屠夫1978). 在记录吸光度测量值之前,使用10步校准玻片进行校准(Chieco等人,2013年). 在可能的情况下,对连续切片中的相同区域进行分析。当这不可行时,对可比区域进行了分析。使用ImageJ插件ObjectJ选择图像中感兴趣的区域,并确定平均吸光度作为原位GDH活性的测量值。
统计分析
使用ImageJ获得的所有样品的平均吸光度值在对照反应中进行非特异性染色校正,并使用Excel 2013(Microsoft Corporation,Redmond,WA)根据Lambert-Beer定律转换为μmol/mL/min(Van Noorden和Frederiks 1992年). 该定律规定,A=¦Β·c·d,其中A为吸光度,¦Β为消光系数(585nm时为16000),c为甲酰胺浓度,d为光传播距离(截面的标称厚度为7或8μm,标准偏差为0.7µm)(De Witt Hamer等人,2006年;屠夫1978). 使用Graphpad Prism 6(Graphpad软件,加利福尼亚州拉霍亚)进行统计分析。在Graphpad Prism 6中使用霍尔丹方程进行底物抑制曲线拟合。
结果
小鼠肝脏GDH动力学
为了确定GDH动力学,用八种不同的谷氨酸浓度(0、0.4、1.4、2、5、10、30和50 mM)和NAD对小鼠肝组织切片进行GDH活性的代谢绘图+(图3)或NADP+(图4)作为辅酶。K系列米当NAD时,谷氨酸的GDH值相似+或NADP+用作辅酶(图5;表1),而V最大值GDH与NAD+比NADP高2.5倍+.V型最大值和K米在3 mM NAD时最理想+或NADP+(未显示数据)。GDH在NAD存在下均表现出底物抑制+和NADP+作为辅酶。离解常数(K我)NAD对谷氨酸的抑制作用分别为12.2 mM和4.0 mM+或NADP+分别用作辅酶。这些K我数值表明,当NAD作用于GDH时,其底物谷氨酸对GDH的抑制作用较小+与NADP相比用作辅酶+虽然这种效果并不显著(学生t吨-测试,第页=0.29). 此外,当NADP作用于谷氨酸浓度较高时,GDH活性被完全抑制+用作辅酶,但当NAD+用作辅酶(图5). 谷氨酸不会影响培养基的pH值。因此,高谷氨酸水平下GDH活性降低并不是由pH值降低引起的。图5显示GDH V最大值在培养基中以10 mM的谷氨酸浓度测定。
图3。
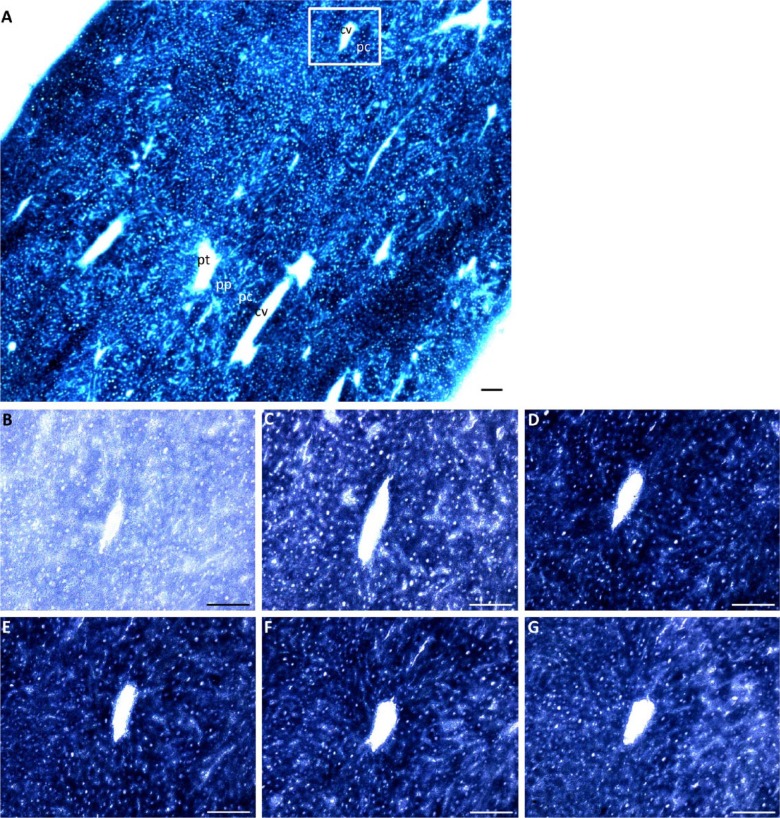
用NAD进行GDH活性染色+作为辅酶和各种谷氨酸浓度。(A) 小鼠肝脏冷冻切片中GDH活性概述,如10 mM谷氨酸的存在所示。GDH活性在(B)0 mM、(C)2 mM、。如矩形所示,图像(B–G)在(A)的串行部分中的区域相同。缩写:pt,门静脉束;pp,门周区;pc,中央周围区;cv,中央静脉。刻度,100µm。
图4。
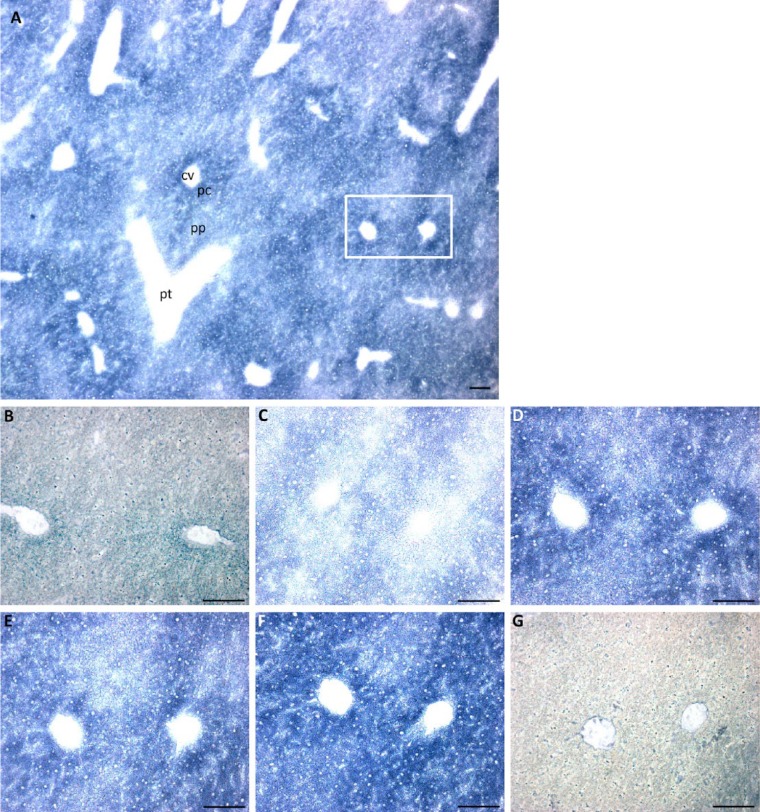
用NADP进行GDH活性染色+作为辅酶和各种谷氨酸浓度。(A) 小鼠肝脏冷冻切片中GDH活性概述,如10 mM谷氨酸的存在所示。GDH活性在(B)0 mM、(C)2 mM、。如矩形所示,图像(B–G)在(A)的串行部分中的区域相同。缩写:pt,门静脉束;pp,门周区;pc,中央周围区;cv,中央静脉。刻度,100µm。
图5。
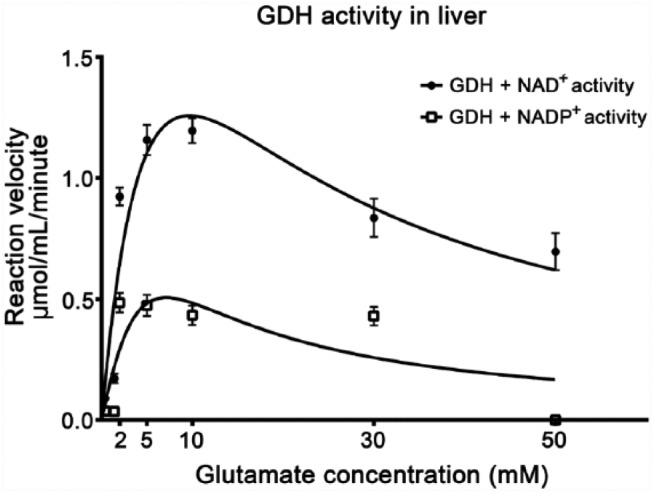
NAD存在下小鼠肝脏中GDH活性对抗不同谷氨酸浓度的动力学+(●)或NADP+(□)作为辅酶。误差条表示SEM(n个=3).
表1。
|
GDH+NAD+
|
GDH+NADP+
|
| V(V)最大值
|
1.26 |
0.51 |
| K(K)米
|
1.92 |
1.66 |
| K(K)我
|
12.2 |
3.95 |
GDH活性在肝脏中的分布
特异性GDH活性均匀分布于肝小叶的门脉周围和中央周围区域。试验和对照反应都表明,在中心周围区域有更多的甲赞形成(图3和4)而减去对照反应的特异性试验表明,门脉周围和中央周围区域的GDH活性没有差异。此外,当NAD激活时,在GDH活性的门脉周围和中央周围区域中formazan形成的定位模式没有发现差异+或NADP+用作辅酶(图3和4).
小鼠不同组织中GDH的活性
用NAD测定不同小鼠组织中的GDH活性+或NADP+作为辅酶(图6). 肝脏具有最高的GDH活性(NAD时,肝脏的活性至少是其他组织的4.5倍+用作辅酶,与NADP的比例至少为3.5倍+作为辅酶)。NADP公司+-依赖性GDH活性仅见于肝脏和胰腺。带有NAD+作为辅助因子,小脑、小肠和心脏也有活性。
图6。
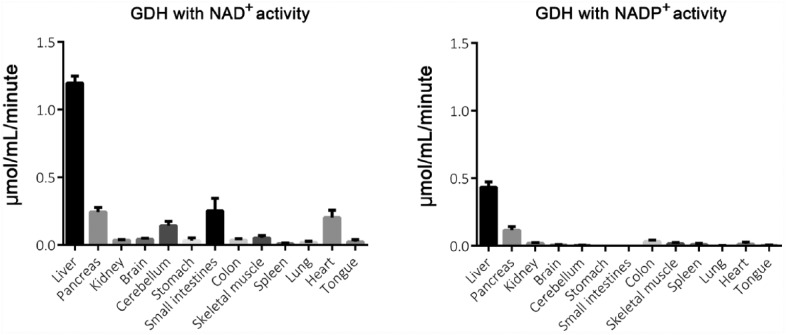
存在10 mM谷氨酸和(A)NAD时的GDH活性+或(B)NADP+作为辅酶校正后用于无底物的非特异性背景染色。活动以平均值V表示最大值±扫描电镜(n个=3).
致谢
我们感谢M.Arendse准备了手稿,感谢A.Jonker博士在图像分析方面的帮助。我们还感谢R.J.Molenaar、M.M.J.Laan和D.Huiskens对手稿的批判性阅读。
脚注
利益冲突声明:作者声明,与本文的研究、作者身份和/或出版没有潜在的利益冲突。
基金:作者没有获得对这篇文章的研究、作者身份和/或出版的资金支持。
工具书类
-
Abrámoff医学博士,Hospitals I,Magalháes PJ,Abrémoff M.(2004)。使用ImageJ进行图像处理。生物光子学国际11:36–42.[谷歌学者]
-
Bailey J,Bell ET,Bell JE.(1982)。牛谷氨酸脱氢酶的调节。pH和ADP的影响。生物化学杂志257:5579–5583.[公共医学] [谷歌学者]
-
Bao X、Pal R、Hascup KN、Wang Y、Wang W-T、Xu W、Hui D、Agbas A、Wang X、Michaelis ML、Choi I-Y、Belousov AB、Gerhardt GA、Michaelis EK。(2009). 神经元中GLUD1(谷氨酸脱氢酶1)的转基因表达:谷氨酸释放增强、突触可塑性改变和选择性神经元脆弱性的体内模型。神经科学29:13929–13944.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Bell ET、Stilwell AM、Bell JE.(1987)。Zn2+和Eu3+与牛肝谷氨酸脱氢酶的相互作用。生物化学杂志246:199–203.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Boon L、Geerts WJ、Jonker A、Lamers WH、Van Noorden CJF。(1999). 高蛋白饮食诱导中枢周围谷氨酸脱氢酶和鸟氨酸转氨酶,为大鼠肝小叶氨的中枢周围解毒提供足够的谷氨酸。组织化学细胞生物学111:445–452.[内政部] [公共医学] [谷歌学者]
-
Brose SA、Marquardt AL、Golovko MY(2013年)。谷氨酸和谷氨酰胺合成脂肪酸是在缺氧条件下神经元细胞中特异性诱导的。神经化学杂志129:400–412.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Burbaeva GS、Boksha IS、Turishcheva MS、Vorobyeva EA、Savushkina OK、Tereshkina EB。(2003). 精神分裂症患者前额叶皮层中的谷氨酰胺合成酶和谷氨酸脱氢酶。进展神经心理药理学生物精神病学27:675–680.[内政部] [公共医学] [谷歌学者]
-
屠夫RG。(1978). 在脱氢酶反应中从硝基蓝四氮唑衍生的两种甲赞烷的组织切片中的测量。组织化学J10:739–744.[内政部] [公共医学] [谷歌学者]
-
Carobbio S、Frigerio F、Rubi B、Vetterli L、Bloksgaard M、Gjinovci A、Pournourmohammadi S、Herrera PL、Reith W、Mandrup S、Maechler P.(2009年)。β细胞中谷氨酸脱氢酶的缺失可消除葡萄糖稳态不需要的部分胰岛素分泌反应。生物化学杂志284:921–929.[内政部] [公共医学] [谷歌学者]
-
Chieco P、Jonker A、De Boer BA、Ruijter JM、Van Noorden CJF。(2013). 图像细胞术:显微图像中2D和3D量化的协议。程序组织化学-细胞化学47:211–333.[内政部] [公共医学] [谷歌学者]
-
Cho S、Lee J、Choi SY.(1995)。牛脑中两种可溶形式的谷氨酸脱氢酶异蛋白。欧洲生物化学杂志233:340–346.[内政部] [公共医学] [谷歌学者]
-
Collins JM、Neville MJ、Pinnick KE、Hodson L、Ruyter B、van Dijk TH、Reijngoud D、Fielding MD、Frayn KN(2011年)。分化的人类脂肪细胞中的从头脂肪生成可以提供成熟所需的所有脂肪酸。脂质研究杂志52:1683–1692.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Curthoys NP.(1995)。谷氨酰胺酶活性和谷氨酰胺的调节。年收入螺母15:133–159.[内政部] [公共医学] [谷歌学者]
-
DeBerardinis RJ、Lum JJ、Hatzivassiliou G、Thompson CB。(2008). 癌症生物学:代谢重组刺激细胞生长和增殖。单元格元7:11–20.[内政部] [公共医学] [谷歌学者]
-
DeBerardinis RJ、Mancuso A、Daikhin E、Nissim I、Yudkoff M、Wehrli S、Thompson CB。(2007). 除了有氧糖酵解:转化细胞可以参与谷氨酰胺代谢,超过蛋白质和核苷酸合成的需要。美国国家科学院程序104:19345–19350.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
De Witt Hamer PC、Bleeker FE、Zwinderman AH、Van Noorden CJF。(2006). 你能相信你的低温恒温器吗?低温恒温器截面厚度的再现性。Microsc Res-Tech公司69:835–838.[内政部] [公共医学] [谷歌学者]
-
Dieter H、Koberstein R、Sund H(1981)。谷氨酸脱氢酶的研究。欧洲生物化学杂志115:217–226.[公共医学] [谷歌学者]
-
Durán RV、Oppliger W、Robitaille AM、Heiserich L、Skendaj R、Gottlieb E、Hall MN(2012)。谷氨酰胺分解激活Rag-mTORC1信号。分子电池47:349–358.[内政部] [公共医学] [谷歌学者]
-
Engel PC,Dalziel K.(1969年)。以谷氨酸和去甲缬氨酸为底物的谷氨酸脱氢酶动力学研究。生物化学杂志115:621–631.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Fahien LA、Kmiotek E.(1981)。棕榈酰辅酶A对谷氨酸的调节212:247–253.[内政部] [公共医学] [谷歌学者]
-
Filipp FV、Scott DA、Ronai ZA、Osterman AL、Smith JW。(2012). 低氧黑色素瘤细胞的脂肪生成需要通过异柠檬酸脱氢酶1和2逆转TCA循环流量。色素细胞黑素瘤研究25:375–383.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Frederiks WM、Bosch KS、De Jong JSSG、Van Noorden CJF。(2003). 大鼠肝脏肿瘤前病变中葡萄糖-6-磷酸脱氢酶活性的翻译后调节。组织化学与细胞化学杂志51:105–112.[内政部] [公共医学] [谷歌学者]
-
Frederiks WM、Kümmerlin IPED、Bosch KS、Vreeling SindelárováH、Jonker A、Van Noorden CJF。(2007). 大鼠肾上腺束状带戊糖磷酸途径产生NADPH。组织化学与细胞化学杂志55:975–980.[内政部] [公共医学] [谷歌学者]
-
Frieden C.(1963年)。谷氨酸脱氢酶Ⅳ.酶失活和辅酶结合的研究。生物化学杂志238:146–154.[公共医学] [谷歌学者]
-
弗里登·C(1965)。谷氨酸脱氢酶VI。嘌呤核苷酸和其他对各种来源的酶的影响的调查。生物化学杂志240:2028–2035.[公共医学] [谷歌学者]
-
Frigerio F、Karaca M、De Roo M、Mlynárik V、Skytt DM、Carobbio S、PajÉcka K、Waagepetersen HS、Gruetter R、Muller D、Maechler P.(2012年)。中枢神经系统中谷氨酸脱氢酶1(GLUD1)的缺失会影响谷氨酸的处理,而不会改变突触传递。神经化学杂志123:342–348.[内政部] [公共医学] [谷歌学者]
-
Geerts WJ、Verburg M、Jonker A、Das AT、Boon L、Charles R、Lamers WH、Van Noorden CJF。(1996). 大鼠肝小叶门脉周围和中央周围区谷氨酸脱氢酶表达的性别依赖性调节。组织化学与细胞化学杂志44:1153–1159.[内政部] [公共医学] [谷歌学者]
-
Jonker A、Geerts WJ、Charles R、Lamers WH、Van Noorden CJF。(1996). 大鼠肝脏谷氨酸脱氢酶局部动力学参数的动态变化。组织化学细胞生物学106:437–443.[内政部] [公共医学] [谷歌学者]
-
Jonker A、Geerts WJ、Chieco P、Moorman AF、Lamers WH、Van Noorden CJF。(1997). 使用图像分析进行有效细胞术的基本策略。组织化学J29:347–364.[内政部] [公共医学] [谷歌学者]
-
Keane TM、Goodstadt L、Danecek P、White MA、Wong K、Yalcin B、Heger A、Agam A、Slater G、Goodson M、Furrotte NA、Eskin E、Nelláker C、Whitley H、Cleak J、Janowitz D、Hernandez-Pliego P、Edwards A、Belgard TG、Oliver PL、McIntyre、Bhomra A、Nico J、Gan X、Yuan W、Van Der Weyden L、Steward CA、Bala S、Stalker J、Mott R、Durbin R、Jackson IJ、,Czechanski A、Guerra-Assunáo JA、Donahue LR、Reinholdt LG、Payseur BA、Ponting CP、Birney E、Flint J、Adams DJ(2011)。小鼠基因组变异及其对表型和基因调控的影响。自然477:289–294.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Koehler A、Van Noorden CJF。(2003). 降低雌性牙鲆的烟酰胺腺嘌呤二核苷酸磷酸和较高的污染诱导肝癌发病率。环境毒物化学22:2703–2710.[内政部] [公共医学] [谷歌学者]
-
Koh H、Lee S、Son B、Lee S、Ryoo ZY、Chang K-T、Park J-W、Park D-C、Song BJ、Veech RL、Song H、Huh T-L.(2004)。胞浆NADP+依赖性异柠檬酸脱氢酶在脂质代谢中起着关键作用。生物化学杂志279:39968–39974.[内政部] [公共医学] [谷歌学者]
-
新泽西州克鲁格(Kruger NJ),冯·舍文(von Schaewen A.)(2003年)。磷酸戊糖氧化途径:结构和组织。当前操作植物生物6:236–246.[内政部] [公共医学] [谷歌学者]
-
库格勒·P、拜尔·G(1992)。青年和老年大鼠海马中与谷氨酸和GABA代谢相关的线粒体酶:一项定量组织化学研究。神经化学研究17:179–185.[内政部] [公共医学] [谷歌学者]
-
Lamers WH、Janzen JW、Moorman AF、Charles R、Knecht E、Martinez-Ramon A、Hernandez-Yago J、Grisolia S.(1988)。大鼠肝脏谷氨酸脱氢酶的免疫组织化学定位:发育过程中的分布可塑性和激素治疗。组织化学与细胞化学杂志36:41–47.[内政部] [公共医学] [谷歌学者]
-
Lattin JE、Schroder K、Su AI、Walker JR、Zhang J、Wiltshire T、Saijo K、Glass CK、Hume DA、Kellie S、Sweet MJ。(2008). 小鼠巨噬细胞g蛋白偶联受体的表达分析。免疫学研究4:1–13.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Lee W、Shin SS、Cho SS、Park J.(1999年)。谷氨酸脱氢酶作为另一种与粗面内质网膜结合的等蛋白的纯化和表征。J细胞生物化学76:244–253.[内政部] [公共医学] [谷歌学者]
-
Li M、Smith CJ、Walker MT和Smith TJ(2009)。与谷氨酸脱氢酶复合的新型抑制剂:通过控制蛋白质动力学进行变构调节。生物化学杂志284:22988–23000.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Lorin S、Tol MJ、Bauvy C、Strijland A、PoüS C、Verhoeven AJ、Codogno P、Meijer AJ。(2013). 谷氨酸脱氢酶在调节自噬中有助于亮氨酸感应。自噬9:850–860.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Maly IP,Sasse D.(1991)。大鼠肝脏谷氨酸脱氢酶腺泡内分布的微量分析。组织化学与细胞化学杂志39:1121–1124.[内政部] [公共医学] [谷歌学者]
-
Markau K,Schneider J,Sund H.(1972)。ADP对谷氨酸脱氢酶反应作用机制的动力学研究。FEBS信函24:32–36.[内政部] [公共医学] [谷歌学者]
-
Mastorodemos V、Kotzamani D、Zaganas I、Arianoglou G、Latsoudis H、Plaitakis A.(2009年)。人GLUD1和GLUD2谷氨酸脱氢酶定位于线粒体和内质网。生物化学细胞生物学87:505–516.[内政部] [公共医学] [谷歌学者]
-
Mastorodemos V、Zaganas I、Spanaki C、Bessa M、Plaitakis A.(2005年)。能量需求变化下人类谷氨酸脱氢酶调节的分子基础。神经科学研究杂志79:65–73.[内政部] [公共医学] [谷歌学者]
-
Mavrothalasitis G、Tzimagiorgis G、Mitsialis A、Zannis V、Plaitakis A、Papamathakis J、Mosconas N.(1988)。编码人肝脏谷氨酸脱氢酶的cDNA克隆的分离和鉴定:一个小基因家族的证据。美国国家科学院程序85:3494–3498.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
McGivan JD、Bradford NM、Crompton M、Chappell JB。(1973). L-亮氨酸对离体大鼠肝线粒体氮代谢的影响。生物化学杂志134:209–215.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Metallo CM、Gameiro PA、Bell EL、Mattaini KR、Yang J、Hiller K、Jewell CM、Johnson ZR、Irvine DJ、Guarente L、Kelleher JK、Vander Heiden MG、Iliopoulos O、Stephanopulos G.(2012)。IDH1的还原性谷氨酰胺代谢介导低氧下的脂肪生成。自然481:380–384.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Michaeldis TM,Tzimagiorgis G.(1993)。人类谷氨酸脱氢酶基因家族:基因组织和结构特征。基因组学16:150–160.[内政部] [公共医学] [谷歌学者]
-
Mohrenz IV、Antonietti P、Pusch S、Capper D、Balss J、Voigt S、Weissert S、Mukrowsky A、Frank J、Senft C、Seifert V、Von Deimling A、Kögel D(2013)。异柠檬酸脱氢酶1突变体R132H使胶质瘤细胞对BCNU诱导的氧化应激和细胞死亡敏感。细胞凋亡18:1416–1425.[内政部] [公共医学] [谷歌学者]
-
Mullen AR,Wheaton WW,Jin ES(2011年)。还原性羧基化支持线粒体缺陷的肿瘤细胞生长。自然481:385–388.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Nissim I、Cattano C、Yudkoff M.(1992年)。谷氨酰胺酶、谷氨酸脱氢酶和AMP-脱氨酶途径在肝脏尿素生成中的相对作用:15N研究。Arch Biochem生物物理292:393–401.[内政部] [公共医学] [谷歌学者]
-
潘迪·A·V,弗里克·CE。(2013). NADPH P450氧化还原酶:结构、功能和疾病病理。药物治疗学138:229–254.[内政部] [公共医学] [谷歌学者]
-
Plaitakis A、Latsoudis H、Kanavouras K、Ritz B、Bronstein JM、Skoula I、Mastorodemos V、Papapetropoulos S、Borompokas N、Zaganas I、Xiromerisiou G、Hadjigeorgiou GM、Spanaki C.(2010)。GLUD2谷氨酸脱氢酶的功能获得性变体可改变帕金森氏病的发病。欧洲人类遗传学杂志18:336–341.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Plaitakis A、Latsoudis H、Spanaki C.(2011年)。人类GLUD2谷氨酸脱氢酶及其在健康和疾病中的调节。神经化学国际59:495–509.[内政部] [公共医学] [谷歌学者]
-
Prisco Di,Banay-Schwartz M,Strecker H.(1968)。大鼠肝脏细胞核和线粒体部分的谷氨酸脱氢酶。生物化学-生物物理研究委员会33:606–612.[内政部] [公共医学] [谷歌学者]
-
Reitzer LJ,Wice BM,Kennell D.(1979年)。有证据表明谷氨酰胺而非糖是培养HeLa细胞的主要能量来源。生物化学杂志254:2669–2676.[公共医学] [谷歌学者]
-
Romero-Garcia S、Lopez-Gonzalez JS、Báez-Viveros JL、Aguilar-Cazares D、Prado-Garcia H.(2011)。肿瘤细胞代谢:整体观点。癌症生物学治疗12:939–948.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Schneider CA、Rasband WS、Eliceiri KW.(2012年)。NIH Image to ImageJ:25年的图像分析。Nat方法9:671–675.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Seltzer MJ、Bennett BD、Joshi AD、Gao P、Thomas AG、Ferraris DV、Tsukamoto T、Rojas CJ、Slusher BS、Rabinowitz JD、Dang CV、Riggins GJ。(2010). 谷氨酰胺酶抑制剂优先减缓IDH1突变的胶质瘤细胞的生长。癌症研究70:8981–8987.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Shashidharan P、Michaelidis TM、Robakis NK、Kresovalis A、Papmathakis J、Plaitakis A.(1994年)。新的人类谷氨酸脱氢酶在神经和睾丸组织中表达,并由一个X连锁无内含子基因编码。生物化学杂志269:16971–16976.[公共医学] [谷歌学者]
-
Smith TJ,Stanley CA(2008)。解开谷氨酸脱氢酶变构噩梦。生物化学科学趋势33:557–564.[内政部] [公共医学] [谷歌学者]
-
Sokal E、Trivedi P、Portmann B、Mowat A.(1989)。大鼠肝脏中琥珀酸脱氢酶、谷氨酸脱氢酶、葡萄糖-6-磷酸酶和NADPH脱氢酶在腺泡内分布的发育变化。小儿胃肠营养杂志8:522–527.[内政部] [公共医学] [谷歌学者]
-
Spanaki C,Plaitakis A.(2012年)。谷氨酸脱氢酶在哺乳动物氨代谢中的作用。神经毒素研究21:117–127.[内政部] [公共医学] [谷歌学者]
-
Spanaki C、Zaganas I、Kleopa KA、Plaitakis A.(2010年)。人GLUD2谷氨酸脱氢酶在神经和睾丸支持细胞中表达。生物化学杂志285:16748–16756.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Stanley CA、Fang J、Kutyna K、Hsu BY、Ming JE、Glaser B、Poncz M.(2000)。高胰岛素血症/高氨血症综合征的分子基础和特征:谷氨酸脱氢酶基因外显子11和12突变的优势。HI/HA特约研究员。糖尿病49:667–673.[内政部] [公共医学] [谷歌学者]
-
Stanley CA、Lieu YK、Hsu BYL、Burline AB、Greenberg CR、Hopwood NJ、Perlman K、Rich BH、Zammarchi E、Poncz M.(1998)。谷氨酸脱氢酶基因调控突变婴儿的高胰岛素血症和高氨血症。新英格兰医学杂志338:1352–1357.[内政部] [公共医学] [谷歌学者]
-
Su AI、Wiltshire T、Batalov S、Lapp H、Ching KA、Block D、Zhang J、Soden R、Hayakawa M、Kreiman G、Cooke MP、Walker JR、Hogenesch JB。(2004). 小鼠和人类蛋白质编码转录体的基因图谱。美国国家科学院程序101:6062–6067.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Tiwari AK、Panda P、Purohit JS。(2014). 果蝇幼虫谷氨酸脱氢酶(GDH)亚细胞分布的评估。组织化学学报116:297–303.[内政部] [公共医学] [谷歌学者]
-
Treberg JR、Brosnan ME、Watford M和Brosnan JT。(2010). 高胰岛素血症/高氨血症综合征中谷氨酸脱氢酶的可逆性和高氨血症的来源。高级酶调节剂50:34–43.[内政部] [公共医学] [谷歌学者]
-
van Lith SAM、Navis AC、Verrijp K、Niclou SP、Bjerkvig R、Wesseling P、Tops B、Molenar R、van Noorden CJF、Leenders WPJ。(2014). 谷氨酸作为弥漫性胶质瘤细胞的趋化燃料;它们是谷氨酸吸入器吗?Biochim生物物理学报1846:66-74.[内政部] [公共医学] [谷歌学者]
-
Van Noorden CJF公司。(2010). 工作中的成像酶:酶组织化学的代谢绘图。组织化学与细胞化学杂志58:481–497.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Van Noorden CJF、Frederiks WM。(1992). 酶组织化学:当前方法的实验室手册。牛津:BIOS科学出版社。[谷歌学者]
-
Van Noorden CJF、Vogels IMC。(1989). 酶组织化学中的聚乙烯醇和其他组织保护剂:消费者指南。组织化学J21:373–379.[内政部] [公共医学] [谷歌学者]
-
Wise DR、DeBerardinis RJ、Mancuso A、Sayed N、Zhang X、Pfeiffer HK、Nissim I、Daikhin E、Yudkoff M、McMahon SB、Thompson CB。(2008). Myc调节一个刺激线粒体谷氨酰胺分解并导致谷氨酰胺成瘾的转录程序。美国国家科学院程序105:18782–18787.[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Wu C、Orozco C、Boyer J、Leglise M、Goodale J、Batalov S、Hodge CL、Haase J、Janes J、Huss JW、Su AI.(2009)。BioGPS:用于查询和组织基因注释资源的可扩展和可定制门户。基因组生物学10:R130。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Yang C、Sudderth J、Dang T、Bachoo RM、Bachoo-RG、McDonald JG、DeBerardinis RJ.(2009)。胶质母细胞瘤细胞需要谷氨酸脱氢酶才能在葡萄糖代谢或Akt信号受损时存活。癌症研究69:7986–7993.[内政部] [PMC免费文章] [公共医学] [谷歌学者]