摘要 目的 头颈部鳞状细胞癌(HNSCC)中表皮生长因子受体(EGFR)和环氧合酶-2(COX-2)通路上调。 临床前模型表明双重阻断具有协同抗肿瘤活性。 我们对EGFR抑制剂厄洛替尼进行了随机、双盲、安慰剂对照的窗口试验; 厄洛替尼加舒林酸(一种非选择性COX抑制剂)与安慰剂的比较。
实验设计 未经治疗的、可手术的II-IVb期HNSCC患者被随机分为5:5:3服用厄洛替尼、厄洛替尼苏林达或安慰剂。 在治疗前和治疗后7-14天收集肿瘤标本。 主要终点是Ki-67增殖指数的变化。 我们假设Ki-67减少的顺序效应:厄洛替尼-苏林达>厄洛替尼>安慰剂。 我们通过免疫组织化学方法评估组织芯片对EGFR和COX-2信号中间产物的药效调节。
结果 从2005-2009年,47名患者被随机分为39名目标可评估患者。 34对肿瘤具有足够的质量来评估生物标记物的调节。 erlotinib或erlotinib-sulindac显著降低Ki-67(综合比较,双侧Kruskal-Wallis,p=0.04)。 Wilcoxon成对对比证实,厄洛替尼组和安慰剂组的Ki-67效应更大(厄洛替尼布-舒林达组与安慰剂组比较p=0.043;厄洛替宁组与安慰剂,p=0.027)。 Ki-67减少顺序有显著趋势:厄洛替尼-苏林达>厄洛替尼>安慰剂(双侧精确的Jonckheere-Terpstra,p=0.0185)。 低基线pSrc与Ki-67减少更大相关(R 2 =312,p=0.024)。
结论 厄洛替尼短期治疗显著降低HNSCC的增殖,舒林酸具有加性作用。 双重EGFR-COX抑制的疗效研究是合理的。 pSrc是抗EGFR治疗的潜在耐药性生物标志物,值得作为分子靶点进行研究。
介绍 表皮生长因子受体(EGFR)是一种跨膜受体酪氨酸激酶(RTK),可传播增殖和抗凋亡信号,在大约90%的头颈部鳞状细胞癌(HNSCC)中扩增和/或过度表达。 ( 1 , 2 )EGFR在由环境致癌物驱动的癌症中的表达高于人乳头瘤病毒(HPV)( 三 )与分期增加、生存率降低和放射抗性相关。 ( 1 , 2 , 4 )EGFR信号也被独立于EGFR表达水平的HPV癌蛋白解除调控。 ( 5 )在纳入HPV阳性和阴性患者的III期试验中,EGFR已被证实为治疗靶点。 ( 6 , 7 )然而,绝对益处很低,单药治疗反应率低意味着对单克隆抗体、西妥昔单抗或小分子RTK抑制剂(吉非替尼、埃洛替尼)的固有耐药性。 ( 8 , 9 )EGFR抑制敏感性的预测性生物标志物是HNSCC中一个尚未满足的主要需求。 与肺癌临床反应相关的EGFR激酶域激活突变在HNSCC中很少被发现。 ( 10 )此外,还没有发现替代的生物标志物。 ( 11 , 12 )
在HNSCC中,EGFR激活的一个重要机制是EGFR配体的自分泌。 G蛋白偶联受体(GPCR)通过触发膜结合脯氨酸的蛋白水解脱落来处理私有EGFR。 ( 13 , 14 )GPCR-EGFR串扰可能代表一种针对EGFR阻断的上游抵抗机制。 ( 15 - 17 )环氧合酶-2(COX-2)是一种合成GPCR配体PGE2的炎症酶,在HNSCC中上调,易于被非甾体抗炎药(NSAID)靶向。 现有的非甾体抗炎药,包括非选择性COX抑制剂舒林酸,抑制HNSCC细胞生长 在体外 ,并在转基因HNSCC模型中抑制癌前病变的形成。 ( 18 )同时EGFR-COX靶向显示了在HNSCC细胞系和异种移植模型中的治疗协同作用。 ( 17 , 19 , 20 )
我们对计划进行最终手术的HNSCC患者进行了厄洛替尼-舒林达、厄洛替尼可或安慰剂对照的随机、双盲、安慰剂对照窗口试验。 我们分析配对、治疗前和治疗后的肿瘤标本,以调节Ki-67增殖指数,以验证双重EGFR-COX靶向作用相对于单独抑制EGFR可增强抗肿瘤作用的假设。 我们研究了EGFR-GPCR信号中间产物的相关药效学变化,以确定抗EGFR治疗的预测性生物标记物,并将其应用于临床。
材料和方法 道德声明 这项多中心试验得到匹兹堡大学(UP)、俄勒冈州健康科学大学和波特兰退伍军人管理局医疗中心的机构审查委员会的批准。 该试验在clinicaltrials.gov上进行了全国注册( NCT01515137号 ). 所有受试者都提供了书面知情同意书。
资格标准 符合条件的受试者符合以下关键纳入标准:根据美国癌症分期联合委员会手册(第6版)的定义,经组织学证实的、先前未经治疗的口腔、口咽、下咽或喉部HNSCC(II-IVA期); 原发肿瘤的计划性完全切除; 年龄≥18岁; 东方合作肿瘤集团绩效状况0-1; 足够的血液、肝和肾功能。 主要排除标准包括:HNSCC既往史; 对非甾体抗炎药过敏; 间质性肺疾病; 长期使用非甾体抗炎药或类固醇。
治疗 受试者由UP生物统计机构按5:5:3的比例随机分为三个新辅助治疗组:厄洛替尼(150 mg daily)、厄洛替尼加舒林酸(150 mg doily 2次)或安慰剂(厄洛替尼)。 舒林酸没有安慰剂。 术前治疗以双盲方式进行7-14天,术前24-36小时停止。 不允许同时使用非研究非甾体抗炎药或类固醇。 毒性根据NCI不良事件通用术语标准3.0版进行描述。 在诊断评估和最终切除时获取治疗前后的肿瘤标本。 样品采用福尔马林固定和石蜡包埋(FFPE),然后运送至UP进行集中分析。
统计方法 报道的窗口试验最初是在一项单臂II期研究中进行的,该研究是针对局部晚期HNSCC的初次手术和(化疗)放疗后的佐剂、开标签厄洛替尼。 所有进入父母试验的受试者首先随机分为三个术前治疗组之一。 在30名患者登记后,由于不可行,父母试验中止。 ( 21 )在停药时,在分析生物样本之前,嵌套窗口试验被重新设计为一项独立研究。 患者分配和随机化未受影响。 主要终点被定义为治疗前后肿瘤标本中Ki-67增殖指数(ΔKi-67)的变化,这在新辅助乳腺癌试验中得到验证。 ( 22 , 23 )我们假设根据治疗组差异ΔKi-67。 39名患者以5:5:3随机分组,双侧Kruskal-Wallis试验在α=0.05时有92%的功效,以检测ΔKi-67中1 log的综合组间差异。 允许过采样达到39名可评估患者的目标,即随机、接受新辅助治疗并提供至少一个组织样本。 我们进一步假设Ki-67下调的顺序为厄洛替尼-苏林达>厄洛替尼>安慰剂; 一个精确的双面Jonckheere-Terpstra测试正式评估了这一趋势。 采用双侧Wilcoxon检验评估成对对比。 精确的双侧Kruskal-Wallis检验评估了随机失衡。 对于观察到的基线Ki-67的随机化失衡(Kruskal-Wallis,p=0.022),我们使用协方差分析来对基线和变化之间的组内关联进行建模。 使用该模型的调整值,我们验证了基线失衡并没有混淆对治疗组ΔKi-67差异的分析( 补充图1 ). 因此,本分析基于观测数据。
次要终点包括25个候选蛋白质生物标记物的调制,其中21个来自临床前信号模型,4个来自质谱(MS)发现。 在2013年2月进行分析之前,我们提出了两个生物标记物层次,并将专门的α支出用于优先考虑的假设驱动分析物。 为了测试趋势,我们指定了三种优先分析物:ΔpSrc、ΔpAkt和ΔpSTAT。 ( 17 , 24 - 28 )我们假设这些关键EGFR信号节点的磷酸化形式介导了增殖信号的短期变化。 我们使用Jonckheere-Terpstra统计数据来测试这样一个假设,即一个有效的生物标记物会重述Ki-67下调的顺序,即厄洛替尼-苏林达>厄洛替尼>安慰剂。 为了进行协方差分析,我们定义了四种可以从机理上解释Ki-67调制抗性的优先基线蛋白:pSrc、pAkt、pSTAT和COX-2。 我们首先估计了灵活的参数回归模型,以评估各治疗组中每个基线蛋白与ΔKi-67的相关性。 然后通过协方差分析测试治疗组的显著基线蛋白差异。 对于优先分析物,显著性设置为α=0.05。 其余分析物是探索性的; 通过本杰米尼和霍奇伯格的方法,对多次测试的错误发现进行了纠正( 29 )
样品分析 分析生物标记物反应的主要方法是组织微阵列(TMA)的免疫组织化学(IHC)分析。 使用来自FFPE块的引导性H&E染色,将0.6 mm的核从每个治疗前和治疗后块分三次转移到空白受体块。 在提交所有肿瘤标本后,组装TMA并进行染色,以尽量减少技术差异。
通过TMA的IHC评估Ki-67和候选生物标记物的药效学调节。 抗体、克隆、公司、稀释和检索技术概述于 补充表1 研究病理学家(LW)通过Aperio计算机辅助数字分析对生物标记物(包括Ki-67)进行定量评分,该研究病理学家对患者身份、治疗分配和标本时间点一无所知。 根据Ki-67的国际共识指南,至少对5000个肿瘤细胞/样本进行了计数。 阳性肿瘤细胞的百分比表示为增殖指数。 ( 30 )对肿瘤进行p16染色,p16是口咽部HPV的一种公认替代物,如果≥70%的肿瘤细胞表现出强烈且弥散的细胞核和细胞质染色,则归类为p16(+)。 ( 31 )
质谱法 作为生物标记物发现的无偏见来源,10个治疗后标本(5个厄洛替尼治疗,5个安慰剂治疗)通过MS评估差异蛋白表达。 如前所述,制备组织并用胰蛋白酶消化。 ( 32 )根据诱饵数据库,使用相同的标准搜索初级串联质谱数据,确定假肽发现率小于2%。 ( 33 )通过光谱计数得出蛋白质丰度的差异。 ( 34 )7390个蛋白质被筛选为低变异性; 其余610个蛋白质通过Wilcoxon检验进行差异表达分析。 在73个未经调整的p值<0.10的蛋白质中,有4个具有市售IHC抗体,并在试验样本中进行了分析:凝胶蛋白、钙网蛋白、桥粒蛋白和GAPDH。
PIK3CA突变测试 从肿瘤核心中分离DNA,并检测其外显子9和20的突变 PIK3CA公司 基因。 ( 35 )
结果 注册和基线特征 2005年12月至2008年12月,三个研究中心共招募了47名受试者,以达到39人的可评估目标。 患者分配显示在组合图中( 图1 ). 接受至少一剂新辅助研究药物的46名受试者的基线特征总结如下 表1 受试者在年龄、性别、疾病部位、分期和p16状态方面在各组之间保持良好平衡。 这是一个主要为HPV阴性的队列; 14例口咽肿瘤中仅有2例为p16(+)。
图1。
CONSORT图。 该流程图描述了签署同意书、随机接受治疗并最终提供足够质量的配对肿瘤标本用于生物标记物分析的患者数量。
表1。 治疗组的受试者特征。
安慰剂 (N=12) 埃罗替尼 (N=18) 埃洛替尼+舒林达克 (N=16) 平等测试 1
年龄
中值的 59 64 49 .8976
范围 33 - 86 44 -73 49 - 68
N个 % N个 % N个 %
性别
女性 三 25 4 22 三 19 .9924
男性 9 75 14 78 13 81
肿瘤部位
口腔 8 67 9 50 9 56 .6606
口咽部 三 35 5 28 6 38
下咽 0 0 2 11 0 0
喉咙 1 8 2 11 1 6
肿瘤(T)分期 2
1 1 9 0 0 0 0 .2371
2 5 45 三 18 三 20
三 三 28 4 24 5 33
4 2 18 10 59 7 47
节点(N)级 三
0 7 70 8 44 6 40 .3389
1 1 10 4 22 6 40
2 2 20 6 33 2 13
三 0 0 0 0 1 7
p16状态 4
积极的 1 11 三 20 0 0 .3579
否定 10 89 12 80 11 100
毒性 在术前设置中,短时间接触厄洛替尼、厄洛替尼苏林达或安慰剂的耐受性良好。 研究治疗引起的临床显著毒性总结如下 表2 不良事件代表EGFR抑制剂的典型类别毒性,包括皮疹和腹泻。 ( 36 )一名患者因2级焦虑停止了研究治疗,另一名患者则因2级粘膜炎需要减少厄洛替尼剂量。 手术住院时间中位数为9天。 未观察到异常的术后并发症发生率或类型; 并发症包括瘘管( 2 ),伤口感染( 2 ),游离皮瓣坏死( 1 )、长时间插管( 2 )手术场外感染( 2 )和出血( 1 ).
表2。 毒性。
非血液毒性 1级 2级 三年级 四年级 总成绩≥3
过敏/免疫学
过敏 1 (2%) 0 0 0 0
宪法的
疲劳 3 (7%) 2 (4%) 1 (2%) 0 1 (2%)
皮肤科
皮疹/脱皮 11 (24%) 5 (11%) 2 (4%) 0 2 (4%)
胃肠道
厌食症 0 1 (2%) 0 0 0
腹泻 4 (9%) 1 (2%) 0 0 0
粘膜炎/口炎 1 (2%) 1 (2%) 0 0 0
纳西 2 (4%) 0 0 0 0
神经病学
焦虑 0 1 (2%) 0 0 0
生物标记物调制 39例患者中有34例(87%)可用于分析至少一种配对特异性生物标记物的可评估组织; 39例患者中有35例(90%)至少有一种基线蛋白可用。 根据检测的生物标记物,34对样本中49-92%(中位数78%)在两个样本中都有可测量的蛋白质。
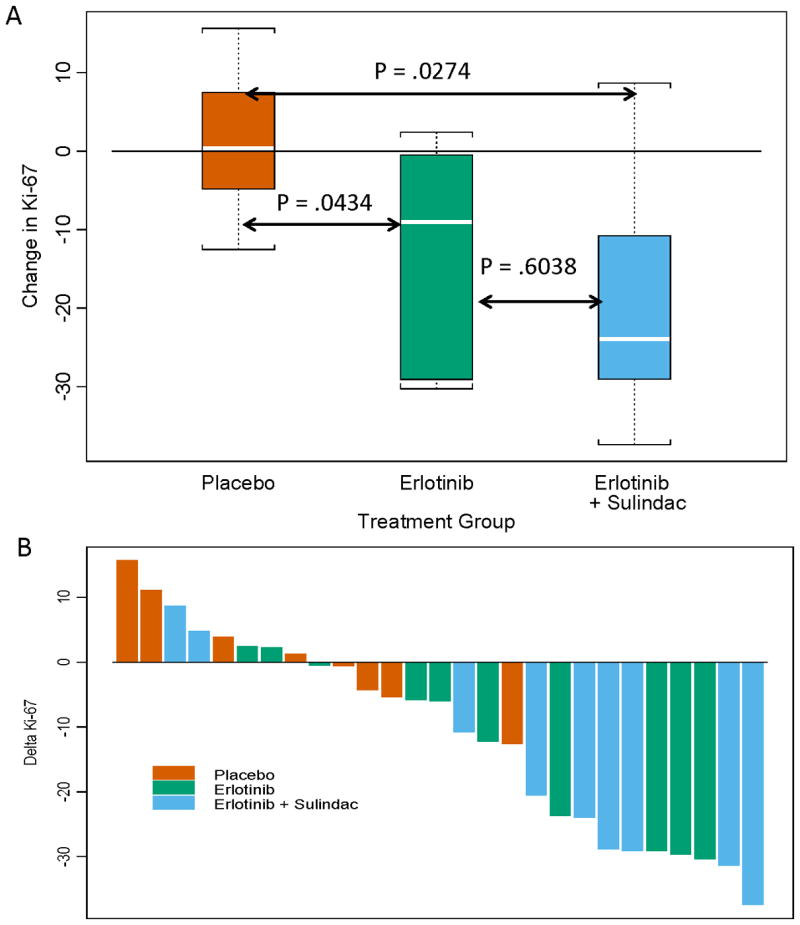
基-67 27名患者(69%)在两个样本中都有可测量的Ki-67。 主要综合假设检验表明,组间ΔKi-67差异显著(Kruskal-Wallis,双侧,p=0.04)。 描述治疗组中位数和四分位范围的方框图见 图2A 。安慰剂对Ki-67无影响。 与安慰剂相比,厄洛替尼(p=0.04)或厄洛替尼苏林达(p=0.03)显著调节Ki-67。 Ki-67下调顺序有显著趋势:厄洛替尼-苏林达>厄洛替尼>安慰剂(Exact Jonckheere-Terpstra,双侧,p=0.02),表明舒林酸具有额外的抗增殖作用。 描述Ki-67患者百分比变化的瀑布图如所示 图2B .
图2。
主要终点,Ki-67增殖指数。 (A) 主要综合假设表明各组间Ki-67调制存在显著差异(双侧Kruskal-Wallis,p=0.04)。 在这个方框和胡须图中描述的是Wilcoxon成对对比,证实接受厄洛替尼或厄洛替尼苏林达与安慰剂治疗的患者Ki-67显著降低。 方框图和晶须图由中间值(白线)、四分位范围(方框)和与观测值之间的距离组成,该距离为四分位间距(晶须)的1.5倍。 (B) 瀑布图描述了治疗前后患者体内肿瘤Ki-67表达的变化。 酒吧根据治疗臂进行彩色编码。
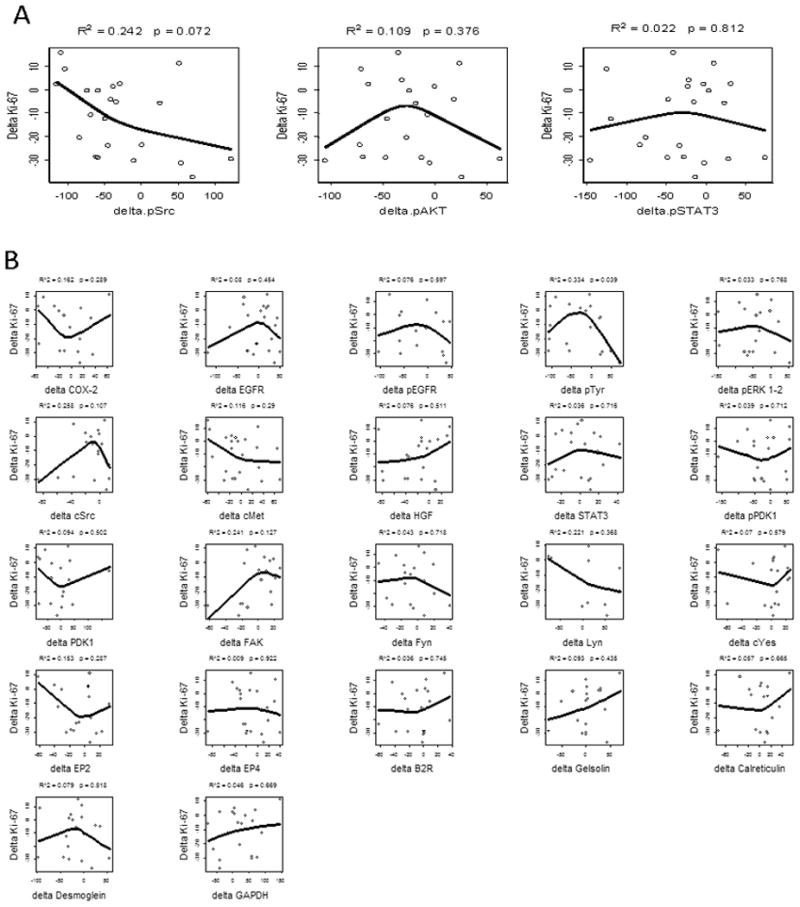
生物标记物中间体 我们假设pSrc、pAkt或pSTAT介导厄洛替尼或厄洛替尼苏林达对Ki-67的显著降低。 如果有效的信号中间产物增殖减少,这些蛋白质的变化将直接与ΔKi-67的排序相关。 如所示 图3A和3B ,三种优先分析物和22种探索性生物标记物均未显示出显著的排序效应。
图3。
生物标记物中间体和ΔKi-67。 我们假设EGFR或COX-2信号通路的成分可能介导观察到的增殖变化。 该线表示用于Δ分析物和ΔKi-67之间关系的受限三次样条拟合。 ΔKi-67与优先分析物ΔpSTAT3、ΔpSrc或ΔpAkt(A)或21个其他候选生物标记物(B)之间没有显著相关性。
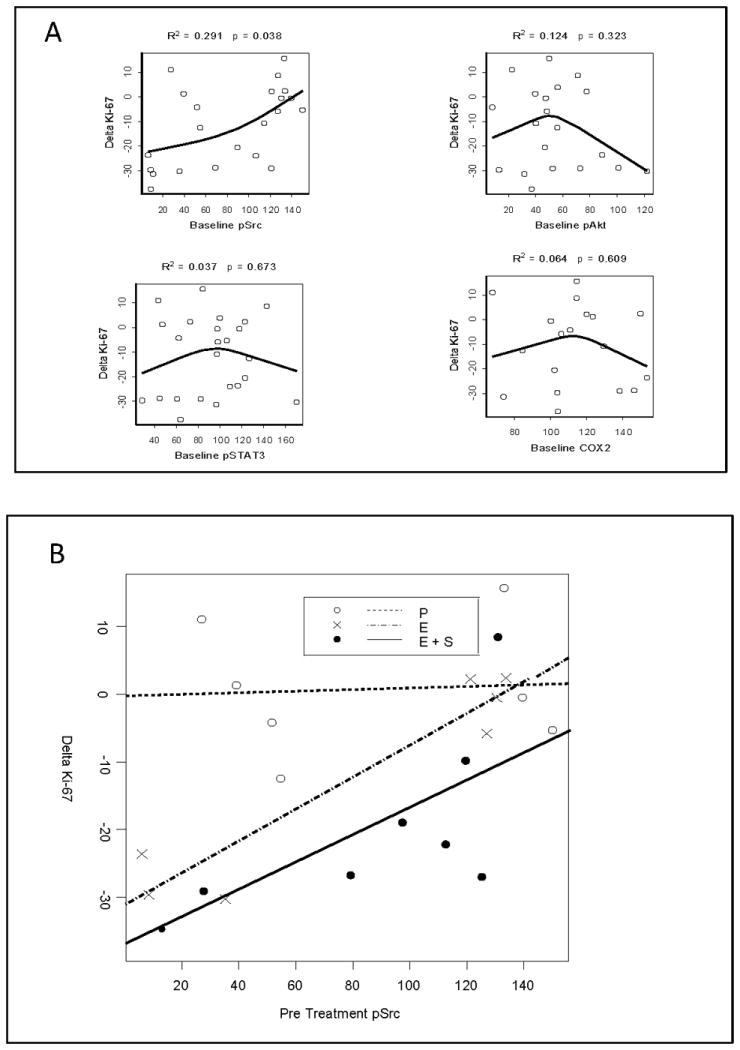
抗性生物标志物 我们假设基线pSrc、pAkt、pSTAT或COX-2增加可能介导对Ki-67调制的抵抗。 我们首先评估了这些候选耐药生物标记物的基线表达与ΔKi-67之间的相关性,这与随机治疗分配无关( 图4A ). 较高的预处理pSrc与Ki-67(R 2 =0.3,p=0.04)。 为了了解这些结果是否代表埃洛替尼耐药,我们在每个治疗组内绘制了pSrc与ΔKi-67的比值。 如中所示 图4B ,仅在活性治疗组中证明了对Ki-67调制的耐受性(斜率与0不同的测试:安慰剂,p=0.8775;厄洛替尼,p=0.0024;厄洛替尼-苏林达,p=0.0150)。 总之,这些发现表明,无论与舒林酸联合治疗,pSrc的高基线表达都是埃洛替尼耐药的生物标志物。 21个探索性生物标记物的基线表达与Ki-67调制之间没有发现显著相关性( 补充图2 ).
图4。
基线pSrc和ΔKi-67。 (A) 评估了四种优先基线分析物(pSrc、pAkt、pSTAT3和COX-2)与Ki-67调制的相关性,直线代表受限的三次样条拟合。 治疗前较高的pSrc与新辅助治疗后Ki-67的下降较小有关。 (B) 每个彩色编码治疗组的基线pSrc与ΔKi-67进行对比。 只有积极治疗组(斜率不同于0的测试:安慰剂,p=0.8775;厄洛替尼,p=0.0024;厄洛替尼-苏林达,p=0.0150)发现了显著的相关性,将基线pSrc作为厄洛替尼耐药性的候选生物标志物。
PIK3CA突变 因为 PIK3CA公司 突变与阿司匹林对结直肠癌患者的化学预防益处相关( 37 ),我们进行了 事后(post-hoc) 之间的相关性 PIK3CA公司 厄洛替尼-苏林达臂的突变状态和ΔKi-67。 9例患者中有2例存在非常见外显子9突变(p.E522K,c.1564G>A;p.A533V,c.1598C>T AND p.I543I,c.1629C>T),而1例患者存在典型外显子20突变(H1047L,c.3140 A>T)。 突变状态与ΔKi-67之间没有关系(数据未显示)。
讨论 虽然EGFR已被证实为HNSCC的第一个分子靶点,但暴露于EGFR抑制剂后临床可靠终点的绝对改善仅限于10-20%的患者,这意味着尽管绝大多数患者EGFR过度表达,但仍存在内在阻力。 ( 6 , 7 , 9 )HNSCC中抗EGFR治疗的预测性生物标志物是一个主要的未满足需求。 本试验利用窗口设计研究HNSCC对短期埃洛替尼(含或不含舒林酸)的反应和耐药性的机制信号假说。 该研究达到了主要终点。 首先,我们观察到与安慰剂相比,治疗组Ki-67增殖指数的差异下调归因于厄洛替尼或厄洛替尼苏林达。 其次,我们在趋势的正式测试中证实舒林酸可增强埃洛替尼的抗增殖作用,表明COX-2和EGFR之间的前向反馈回路是相关的临床靶点。 最后,我们确定pSrc基线表达是埃洛替尼潜在耐药生物标志物。 通过纳入安慰剂对照,研究结果得到了加强。 安慰剂治疗患者中Ki-67缺乏显著变化,提高了其作为主要生物标志物终点有效性的信心。 相反,在接受安慰剂治疗的患者中,认识到GPCR-EGFR信号中间产物的背景变化可以避免过多的机械性结论。
Ki-67是一种核非组蛋白,在增殖的人类组织中表达。 ( 38 )虽然Ki-67增殖指数被认为是乳腺癌的不良预后标志物,但其对HNSCC的预后并不一致。 ( 39 , 40 )ΔKi-67是乳腺癌靶向治疗新辅助研究中经验证的替代生物标记物( 22 , 23 )然而,与HNSCC窗口试验的相关性尚不清楚,因为Ki-67调制尚未直接针对临床结果进行评估。 ( 41 - 43 )这里,母体试验中佐剂埃洛替尼的不可行性排除了我们计划的ΔKi-67和3年PFS的相关性。 在拉帕替尼与安慰剂治疗HNSCC的随机窗口试验中,评估了替代生物标记物TUNEL凋亡指数。 ( 41 )尽管拉帕替尼增加了细胞凋亡,但与安慰剂相比,这种增加并不显著,这突出了安慰剂对照在短期生物标记物调节研究中的价值。 值得注意的是,与安慰剂相比,拉帕替尼显著降低了Ki-67增殖指数,这与我们的结果一致。 总之,这些数据表明,在评估HNSCC靶向治疗的反应时,增殖是一个比凋亡更可靠的短期终点。
该窗口研究的主要次要目标是鉴定引起Ki-67药效学变化的GPCR-EGFR信号中间产物。 然而,在25个候选蛋白质中,没有一个显示出与ΔKi-67一致的排序效应。 临床前HNSCC模型表明,GPCR-EGFR联合抑制相对于单独的EGFR抑制,对多种磷酸蛋白(例如pSrc、pAkt和pSTAT3)的无加性下调。 ( 17 , 20 )我们的假设检验要求有效中间体的线性排序,但这可能并不反映 体内 GPCR-EGFR信号网络的复杂性。候选生物标志物方法进一步受到经验证的商业抗体可用性的限制。 值得注意的是,在安慰剂治疗的患者中,多种信号蛋白发生了显著变化,引发了关于组织异质性、安慰剂治疗期间信号模式的稳定性以及分析可靠性的问题。 虽然我们试图通过标准化组织采集/处理、单批抗体染色和盲法、集中审查来减轻这些变量,但必须强调定量蛋白质表达变化的方法学局限性。 这与我们最近的报告相类似,该报告显示治疗组和安慰剂组在本试验的血清蛋白表达方面没有显著差异。 ( 44 )随着多重蛋白质组学技术被用于药效学评估,安慰剂对照数据对避免I型错误至关重要。
HNSCC中EGFR靶向性预测性生物标记物的缺乏损害了受益患者的选择,也损害了那些不受益患者的重新定向。 这项研究确定高基线pSrc表达是厄洛替尼潜在耐药生物标志物,这一观察结果与机制临床前数据一致。 Src家族激酶被激活以响应EGFR信号。 ( 13 , 45 )GPCR还激活EGFR上游的pSrc,招募pSrc参与复杂的EGFR事务激活中介。 ( 17 )最后,pSrc驱动cMet的配体依赖性激活,这是HNSCC模型中埃洛替尼的主要耐药机制。 ( 46 , 47 )因为舒林达可减少PGE2-GPCR的激活,因此pSrc( 17 ),我们假设舒林酸组pSrc和Ki-67调制抵抗之间的联系将减弱。 但事实并非如此,这表明基线pSrc并非主要由PGE2驱动,而是多个GPCR配体和辅助RTK的聚合影响。 与我们的假设相反,没有其他GPCR-EGFR信号蛋白与ΔKi-67相关,包括临床前模型中描述的PI3K/Akt和STAT3耐药节点。 ( 17 , 20 )虽然我们最近报道过 PIK3CA公司 HNSCC细胞系中的突变与厄洛替尼耐药性相关( 48 )在HNSCC临床队列中未观察到这种情况。 在这里, PIK3CA公司 厄洛替尼-苏林达臂的突变状态与ΔKi-67无关; 由于样本量较小,且基因组激活与 PIK3CA公司 和非甾体抗炎药。 ( 37 )
这项研究有几个重要的局限性。 首先,CONSORT图( 图1 )强调了执行窗口研究的挑战。 尽管39名患者中有35名患者有足够的组织质量来分析一种生物标记物,但只有27对(69%)可以分析主要终点。 第二,未纳入舒林达克单臂。 这一决定基于两个因素:1)EGFR是HNSCC的既定治疗靶点,而非甾体抗炎药单独使用尚未证明有效; 2) 我们的生物标志物假说强调了在GPCR-EGFR反式激活的背景下,舒林酸增强EGFR抑制。 第三,考虑到所观察到的肿瘤蛋白表达的异质性和许多IHC抗体的可靠性未知,Ki-67 IHC作为主要终点可能受到批评。 尽管Ki-67会因预分析处理和观察者间评分而发生变化,但MIB1抗体已经过充分验证,能够耐受一系列固定时间,具有持久抗原性,并且是这里遵循的国际共识标准的主题。 ( 30 )最后,缺乏临床终点限制了对我们的机制研究结果的解释。 ΔKi-67与放射学反应或疾病结局的相关性对于验证Ki-67调制作为HNSCC窗口试验中的短期生物标记终点至关重要。
尽管存在公认的局限性,但我们确认厄洛替尼在短期暴露后显著降低了可手术性HNSCC的增殖,而舒林酸可增强这种作用。 评估EGFR-COX-2双重靶向性的疗效研究是合理的,尤其是考虑到吉非替尼和塞来昔布的一期临床试验,显示复发/转移性HNSCC的有效率为22%。 ( 49 )根据我们对基线pSrc作为埃洛替尼候选耐药生物标志物的鉴定,这种策略在肿瘤pSrc-表达低的患者中可能更有效。 鉴于pSrc在激活代偿途径中的核心作用,pSrcs也作为一种 真诚地 HNSCC中的共同靶点。 尽管Src家族激酶抑制剂达沙替尼在HNSCC中表现出有限的单药活性( 50 ),双EGFR-Src抑制仍然值得关注。 HNSCC的两项翻译研究正在进行中,包括在窗口设置中联合厄洛替尼-达沙替尼和在复发/转移设置中联合西妥昔单抗-达沙替尼( NCT00779389号 ; NCT01488318号 ).
翻译相关性。 头颈部鳞状细胞癌(HNSCC)中表皮生长因子受体(EGFR)和环氧合酶-2(COX-2)通路上调。 串扰会加剧生长、增殖和入侵。 临床前模型表明双重阻断具有协同抗肿瘤活性。 我们对EGFR抑制剂埃洛替尼进行了0期试验; 厄洛替尼加舒林酸,一种非选择性COX抑制剂; 在可手术的HNSCC中与安慰剂进行比较,以机械地描述双重靶向性。 我们证明,厄洛替尼治疗组和对照组的肿瘤Ki-67增殖指数均显著下调,而舒林酸对趋势的正式测试证明其增强作用。 此外,我们确定基线pSrc表达是临床埃洛替尼耐药的候选生物标志物。 该窗口试验提供了首个人体内的机械数据,证明了双重EGFR-COX抑制HNSCC的疗效试验。 pSrc作为EGFR抑制的抗性生物标志物值得研究,目前正在作为HNSCC的真正分子靶点进行研究。
致谢 财务支持: 这项工作得到了国家卫生研究院的资助[R01CA098372;UPCI头颈癌SPORE(P50CA097190),UPCI癌症中心支持资助(P30CA47904)]; 美国癌症学会杰出教授(JRG); 和OSI制药公司。
工具书类
1 Rubin Grandis J、Melhem MF、Gooding WE、Day R、Holst VA、Wagener MM等。头颈部鳞癌TGF-α和EGFR蛋白水平与患者生存率。 1998年国家癌症研究所杂志; 90:824–32. doi:10.1093/jnci/90.11.824。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Chung CH、Ely K、McGavran L、Varella-Garcia M、Parker J、Parker N等。表皮生长因子受体基因拷贝数增加与头颈部鳞状细胞癌预后不良相关。 临床肿瘤学杂志。 2006; 24:4170–6. doi:10.1200/JCO.2006.07.2587。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Troy JD、Weissfeld JL、Youk AO、Thomas S、Wang L、Grandis JR。EGFR、VEGF和NOTCH1的表达表明HPV阳性和HPV阴性头颈鳞癌的肿瘤血管生成存在差异。 头颈病。 2013; 7:344–55. doi:10.1007/s12105-013-0447-y。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
4 Ang KK、Berkey BA、Tu X、Zhang HZ、Katz R、Hammond EH等。表皮生长因子受体表达对晚期头颈癌患者生存和复发模式的影响。 2002年癌症研究; 62:7350–6. [ 公共医学 ] [ 谷歌学者 ]
5 Spangle JM,Munger K。HPV16 E6癌蛋白导致受体蛋白酪氨酸激酶信号传导延长,并增强磷酸化受体物种的内化。 《公共科学图书馆·病理学》。 2013; 9:e1003237。 doi:10.1371/journal.ppat.1003237。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
6 Vermorken JB、Mesia R、Rivera F、Reminar E、Kawecki A、Rottey S等。基于铂的化疗加西妥昔单抗治疗头颈癌。 《N Engl J Med.2008》; 359:1116–27. doi:10.1056/NEJMoa0802656。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
7 Bonner JA、Harari PM、Giralt J、Azarnia N、Shin DM、Cohen RB等。放射治疗加西妥昔单抗治疗头颈鳞状细胞癌。 《新英格兰医学杂志》2006; 354:567–78. doi:10.1056/NEJMoa053422。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
8 Perez CA、Song H、Raez LE、Agulnik M、Grushko TA、Dekker A等。吉非替尼对头颈部复发或转移性鳞癌皮肤毒性适应性剂量递增的二期研究。 口腔癌。 2012; 48:887–92. doi:10.1016/j.oraloncology.2012.03.020。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
9. Vermorken JB,Herbst RS,Leon X,Amellal N,Baselga J.西妥昔单抗对以往铂类治疗失败的头颈部复发和/或转移性鳞癌患者的疗效概述。 癌症。 2008; 112:2710–9. doi:10.1002/ncr.23442。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
10 Stransky N、Egloff AM、Tward AD、Kostic AD、Cibulskis K、Sivachenko A等。头颈部鳞癌的突变景观。 科学。 2011; 333:1157–60. doi:10.1126/science.1208130。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Licitra L、Mesia R、Rivera F、Remenar E、Hitt R、Erfan J等。EGFR基因拷贝数作为预测性生物标志物的评估,以评估西妥昔单抗联合化疗在头颈部复发和/或转移性鳞癌一线治疗中的疗效:EXTREME研究。 安·昂科尔。 2011; 22:1078–87. doi:10.1093/annonc/mdq588。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Licitra L、Storkel S、Kerr KM、Van Cutsem E、Pirker R、Hirsch FR等。表皮生长因子受体表达对头颈癌和结直肠癌患者一线化疗加西妥昔单抗的预测价值:EXTREME和CRYSTAL研究数据分析。 《欧洲癌症杂志》。 2013; 49:1161–8. doi:10.1016/j.ejca.2012.11.018。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
13 Zhang Q,Thomas SM,Xi S,Smithgall TE,Siegfried JM,Kamens J,et al.SRC家族激酶介导表皮生长因子受体配体裂解、增殖和头颈部癌细胞侵袭。 癌症研究2004; 64:6166–73. doi:10.1158/0008-5472.CAN-04-0504。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
14 Zhang Q,Thomas SM,Lui VW,Xi S,Siegfried JM,Fan H,et al.胃泌素释放肽对TNF-α转换酶的磷酸化诱导双调节蛋白释放和EGF受体激活。 美国国家科学院院刊2006; 103:6901–6. doi:10.1073/pnas.0509719103。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
15 Gschwind A,Prenzel N,Ullrich A.溶血磷脂酸诱导的鳞癌细胞增殖和运动涉及表皮生长因子受体信号的转录激活。 2002年癌症研究; 62:6329–36. [ 公共医学 ] [ 谷歌学者 ]
16 Gschwind A,Hart S,Fischer OM,Ullrich A.前角蛋白调节蛋白的TACE裂解调节GPCR诱导的癌细胞增殖和运动。 Embo J.2003; 22:2411–21. doi:10.1093/emboj/cdg231。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
17 Thomas SM、Bhola NE、Zhang Q、Contrucci SC、Wentzel AL、Freilino ML等。G蛋白偶联受体和表皮生长因子受体信号通路之间的交叉对话有助于头颈部鳞癌的生长和侵袭。 2006年癌症研究; 66:11831–9. doi:10.1158/0008-5472.CAN-06-2876。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
18 Zhang W、Bhola N、Kalyankrishna S、Gooding W、Hunt J、Seetha R等。Kinin b2受体介导环氧合酶-2的诱导,在头颈部鳞癌中过度表达。 摩尔癌症研究2008; 6:1946–56. doi:10.1158/1541-7786.MCR-07-2197。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
19 Moraitis D,Du B,De Lorenzo MS,Boyle JO,Weksler BB,Cohen EG等。吸烟者口腔粘膜中环氧合酶-2水平升高:表皮生长因子受体及其配体作用的证据。 2005年癌症研究; 65:664–70. [ 公共医学 ] [ 谷歌学者 ]
20 Chen Z,Zhang X,Li M,Wang Z,Wieand HS,Grandis JR,et al.同时靶向表皮生长因子受体酪氨酸激酶和环氧合酶-2,一种有效抑制头颈部鳞癌的方法。 《临床癌症研究》2004; 10:5930–9. doi:10.1158/1078-0432.CCR-03-0677。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
21 Grandis JR、Lai SY、Kim S、Ferris RL、Gibson MK、Johnson R等。埃罗替尼作为头颈部鳞癌切除患者的辅助治疗,评估埃罗替尼加或不加舒林酸对新辅助生物标记物的调节:可行性报告。 临床肿瘤学杂志。 2008; 26(15S):6037。 [ 谷歌学者 ]
22 Baselga J、Semiglazov V、van Dam P、Manikhas A、Bellet M、Mayordomo J等。雌激素受体阳性乳腺癌患者中新佐剂依维莫司加来曲唑与安慰剂加来曲索的二期随机研究。 临床肿瘤学杂志。 2009; 27:2630–7. doi:10.1200/JCO.2008.18.8391。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
23. Smith IE、Walsh G、Skene A、Llombart A、Mayordomo JI、Detre S等。新辅助阿那曲唑单独或与吉非替尼联合治疗早期乳腺癌的II期安慰剂对照试验。 临床肿瘤学杂志。 2007; 25:3816–22. doi:10.1200/JCO.2006.09.6578。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
24 Molinolo AA、Hewitt SM、Amornphimoltham P、Keelawat S、Rangdaeng S、Meneses Garcia A等。雷帕霉素信号网络的Akt/哺乳动物靶点解剖:头颈癌组织阵列倡议的新结果。 2007年临床癌症研究; 13:4964–73. doi:10.1158/1078-0432.CCR-07-1041。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
25. Bonner JA、Yang ES、Trummell HQ、Nowsheen S、Willey CD、Raisch KP。STAT-3的抑制导致头颈部鳞癌对西妥昔单抗的敏感性更高。 放射疗法。 2011; 99:339–43. doi:10.1016/j.radonc.2011.05.070。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
26 Leeman-Neill RJ、Seetha RR、Singh SV、Freilino ML、Bednash JS、Thomas SM等。厄洛替尼抑制EGFR-STAT3信号传导可预防口腔鳞癌化学诱导小鼠模型的致癌。 2011年癌症预防研究(Phila); 4:230–7. doi:10.1158/1940-6207.CAPR-10-0249。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
27 Kijima T、Niwa H、Steinman RA、Drenning SD、Gooding WE、Wentzel AL等。STAT3激活可消除生长因子依赖性,并有助于头颈部鳞癌肿瘤在体内的生长。 细胞生长差异。 2002; 13:355–62. [ 公共医学 ] [ 谷歌学者 ]
28 Bianco R、Shin I、Ritter CA、Yakes FM、Basso A、Rosen N等。EGF受体表达的肿瘤细胞中PTEN/MMAC1/TEP的缺失可抵消EGFR酪氨酸激酶抑制剂的抗肿瘤作用。 致癌物。 2003; 22:2812–22. doi:10.1038/sj.onc.1206388。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
29 Hochberg Y,Benjamini Y。多重显著性测试的更强大程序。 1990年《统计医学》; 9:811–8. doi:10.1002/sim.4780090710。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
30. Dowsett M、Nielsen TO、A’Hern R、Bartlett J、Coombes RC、Cuzick J等。Ki67在乳腺癌中的评估:国际Ki67在乳腺癌中的工作组的建议。 2011年国家癌症研究所杂志; 103:1656–64. doi:10.1093/jnci/djr393。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
31 Jordan RC、Lingen MW、Perez-Ordonez B、He X、Pickard R、Koluder M等。美国合作组试验中口咽癌HPV状态测定方法的验证。 美国外科病理学杂志。 2012; 36:945–54. doi:10.1097/PAS.0b013e318253a2d1。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 Alkhas A、Hood BL、Oliver K、Teng PN、O利弗J、Mitchell D等。存档子宫内膜癌组织蛋白质组学样品制备和分析工作流程的标准化。 蛋白质组研究杂志2011; 10:5264–71. doi:10.1021/2007736。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
33 Elias JE,Gygi SP。通过质谱法提高大规模蛋白质鉴定信心的目标经济搜索策略。 自然方法。 2007; 4:207–14. doi:10.1038/nmeth1019。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
34 Liu H,Sadygov RG,Yates JR.,猎枪蛋白质组学中随机取样和相对蛋白质丰度估计的第3 A模型。 分析化学。 2004; 76:4193–201. doi:10.1021/ac0498563。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35. Chiosea SI、Grandis JR、Lui VW、Diergaard B、Maxwell JH、Ferris RL等。人类乳头瘤病毒阳性口咽鳞癌中的PIK3CA、HRAS和PTEN。 BMC癌症。 2013; 13:602. doi:10.1186/1471-2407-13-602。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
36 Shepherd FA、Rodrigues Pereira J、Ciuleanu T、Tan EH、Hirsh V、Thongprasert S等。埃罗替尼治疗先前治疗的非小细胞肺癌。 《新英格兰医学杂志》,2005年; 353:123–32. doi:10.1056/NEJMoa050753。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
37 Liao X、Lochhead P、Nishihara R、Morikawa T、Kuchiba A、Yamauchi M等。阿司匹林使用、肿瘤PIK3CA突变和结直肠癌生存率。 《N Engl J Med.2012》; 367:1596–606. doi:10.1056/NEJMoa1207756。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
38 Gerdes J,Li L,Schlueter C,Duchrow M,Wohlenberg C,Gerlach C等。单克隆抗体Ki-67定义的细胞增殖相关核抗原的免疫生化和分子生物学特性。 《美国病理学杂志》。 1991; 138:867–73. [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
39 Liu M,Lawson G,Delos M,Jamart J,Ide C,Coche E,et al.头颈癌活检中增殖细胞核抗原或Ki67免疫标记癌细胞分数对识别淋巴结转移的预测价值:与临床和放射学检查的比较。 头颈。 2003; 25:280–8. doi:10.1002/hed.10218。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
40 Xie X,De Angelis P,Clausen OP,Boysen M。增殖和凋亡标记物在口腔舌鳞癌中的预后意义。 口腔癌。 1999; 35:502–9. doi:10.1016/s1368-8375(99)00024-x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
41 Del Campo JM,Hitt R,Sebastian P,Carracedo C,Lokanatha D,Bourhis J,et al.拉帕替尼单药治疗的效果:局部晚期头颈部鳞癌初诊患者的随机II期研究结果。 英国癌症杂志。 2011; 105:618–27. doi:10.1038/bjc.2011.237。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
42. Sen M、Thomas SM、Kim S、Yeh JI、Ferris RL、Johnson JT等。STAT3诱饵寡核苷酸在头颈部肿瘤中的首次人体试验:对癌症治疗的影响。 癌症发现。 2012; 2:694–705. doi:10.1158/2159-8290.CD-12-0191。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
43 Thomas F、Rochaix P、Benlyazid A、Sarini J、Rives M、Lefebvre JL等。厄洛替尼新辅助治疗非转移性头颈鳞癌的初步研究。 临床癌症研究2007; 13:7086–92. doi:10.1158/1078-0432.CCR-07-1370。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
44. Moskowitz HS、Gooding WE、Thomas SM、Freilino ML、Gross N、Argiris A等。表皮生长因子和环氧合酶途径分子靶向后的血清生物标记物调节:头颈癌随机试验。 口腔癌。 2012; 48:1136–45. doi:10.1016/j.oraloncology.2012.05.015。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
45 Xi S,Zhang Q,Dyer KF,Lerner EC,Smithgall TE,Gooding WE,等。Src激酶介导头颈部鳞状细胞癌的STAT生长途径。 生物化学杂志。 2003; 278:31574–83. doi:10.1074/jbc。 M303499200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
46. Sen B,Peng S,Saigal B,Williams MD,Johnson FM。c-Src和c-Met在介导头颈癌对c-Src-抑制的耐药性中的不同相互作用。 2011年临床癌症研究; 17:514–24. doi:10.1158/1078-0432.CCR-10-1617。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
47 Stable LP、He G、Lui VW、Henry C、Gubish CT、Joyce S等。C-Src激活通过刺激C-Met介导头颈癌中的厄洛替尼耐药性。 2013年临床癌症研究; 19:380–92. doi:10.1158/1078-0432.CCR-12-1555。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
48 Li H,Wawrose JS,Gooding WE,Garraway LA,Lui VW,Peyser ND,等。HNSCC细胞和肿瘤的分子剖析揭示了临床前模型选择的合理方法。 Mol Cancer Res.2014年1月14日; doi:10.1158/1541-7786.MCR-13-0396。 Epub提前打印。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
49 Wirth LJ、Haddad RI、Lindeman NI、Zhao X、Lee JC、Joshi VA等。吉非替尼联合塞来昔布治疗头颈部复发或转移性鳞癌的一期研究。 临床肿瘤学杂志。 2005; 23:6976–81. doi:10.1200/JCO.2005.02.4182。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
50 Brooks HD、Glisson BS、Bekele BN、Johnson FM、Ginsberg LE、El-Naggar A等。达沙替尼治疗头颈部鳞状细胞癌的2期研究。 癌症。 2011; 117:2112–9. doi:10.1002/cncr.25769。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。