摘要
简介
胆汁树生理解剖对创伤愈合的潜在影响
图1。
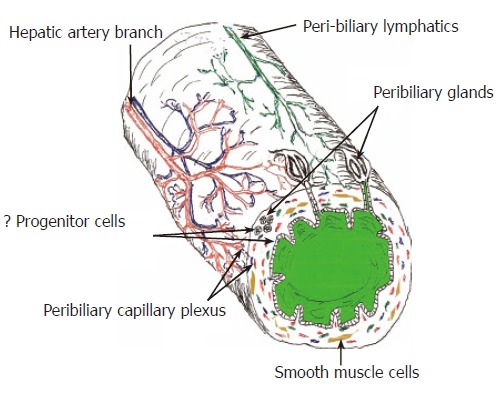
肝外胆管树的伤口愈合
动脉血流量和伤口深度的重要性
图2。
涉及IL-6/gp130信号的BEC修复的细胞和分子机制
胆道导管内小反应的伤口愈合
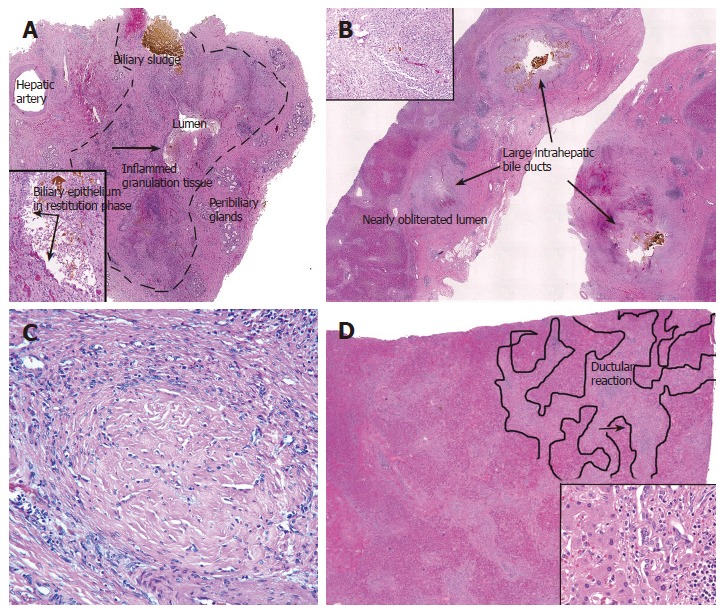
图3。
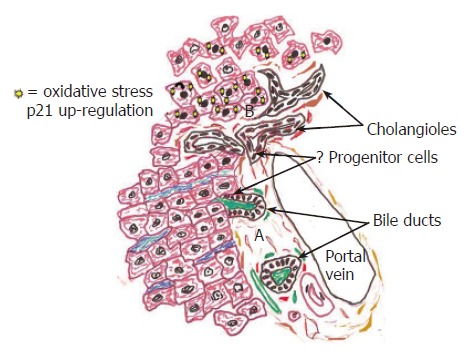
图4。
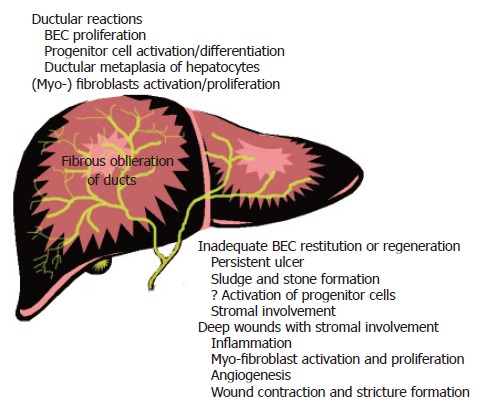
生殖细胞激活、持续创伤修复与癌症
未回答的问题和未来方向
脚注
工具书类
-
1 Lunz JG 3rd、Tsuji H、Nozaki I、Murase N、Demetris AJ。 一种细胞周期素依赖性激酶抑制剂,应激诱导的p21Waf-1/Cip-1,在肝硬化演变过程中介导肝细胞有丝分裂抑制。 肝病学。 2005; 41:1262–1271. doi:10.1002/hep.20709。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
2 Clouston AD、Powell EE、Walsh MJ、Richardson MM、Demetris AJ、Jonsson JR。纤维化与丙型肝炎的导管反应相关:复制受损、祖细胞和脂肪变性的作用。 肝病学。 2005; 41:809–818. doi:10.1002/hep.20650。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
三。 Demetris AJ,Lunz JG,Subbotin V,Wu T,Nozaki I,Contrucci S,Yin X.细胞因子和生长因子在胆管反应期间胆道上皮增殖和有丝分裂抑制中的参与。 In:Alpini G,编辑。 等,编辑。 胆道上皮的病理生理学。 德克萨斯州乔治敦:兰德斯生物科学; 2003年,第167–191页。 [ 谷歌学者 ] -
4. Taupin D,Podolsky DK。三叶因子:粘膜愈合的启动因子。 Nat Rev Mol细胞生物学。 2003; 4:721–732. doi:10.1038/nrm1203。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
5 Jacinto A、Martinez-Arias A和Martin P。上皮融合和修复的机制。 自然细胞生物学。 2001; 3:E117–E123。 doi:10.1038/35074643。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
6 Poli G,Parola M.氧化损伤和纤维化。 自由基生物医药1997; 22:287–305. doi:10.1016/s0891-5849(96)00327-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
7 Redd MJ、Cooper L、Wood W、Stramer B、Martin P。伤口愈合和炎症:胚胎揭示了完美修复的方法。 Philos Trans R Soc Lond B生物科学。 2004; 359:777–784. doi:10.1098/rstb.2004.1466。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
8 Mammen JM、Matthews JB。 胃肠道粘膜修复。 《Crit Care Med.2003》; 31:S532–S537。 doi:10.1097/01.CCM.000081429.89277.AF。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
9 Carlson MA,Longaker MT。成纤维细胞填充的胶原基质作为伤口愈合模型:证据综述。 伤口修复再生。 2004; 12:134–147. doi:10.1111/j.1067-1927.2004.012208.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
10 Hinz B,Gabbiani G.肌成纤维细胞的细胞基质和细胞-细胞接触:在结缔组织重塑中的作用。 血栓止血。 2003; 90:993–1002. doi:10.1160/TH03-05-0328。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
11 Nozaki I、Lunz JG 3rd、Specht S、Park JI、Giraud AS、Murase N、Demetris AJ。 胆道树中三叶因子家族3表达的调节和功能。 《美国病理学杂志》。 2004; 165:1907–1920. doi:10.1016/S0002-9440(10)63243-9。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
12 Jacinto A,Martin P.《形态发生:揭示孔洞闭合的细胞生物学》。 当前生物量。 2001; 11:R705–R707。 doi:10.1016/s0960-9822(01)00414-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
13 Kallui R,Neilson EG.上皮-间质转化及其对纤维化的影响。 临床投资杂志。 2003; 112:1776–1784. doi:10.1172/JCI20530。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
14 Boyer B,Vallés AM,Edme N.上皮-间充质转化的诱导和调节。 生物化学药理学。 2000; 60:1091–1099. doi:10.1016/s0006-2952(00)00427-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
15 宫崎骏H、范·埃肯P、罗斯坎斯T、德沃斯R、德斯梅特VJ。 实验性大鼠肝淤胆纤维化中tenascin的瞬时表达:一项免疫组织化学研究。 肝素杂志。 1993; 19:353–366. doi:10.1016/s0168-8278(05)80543-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
16 Tang L,Tanaka Y,Marumo F,Sato C.胆道纤维化中门静脉成纤维细胞的表型变化。 肝脏。 1994; 14:76–82. doi:10.1111/j.1600-0676.1994.tb00051.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
17. Libbrecht L,Cassiman D,Desmet V,Roskams T。门脉肌成纤维细胞与肝内胆管和肝动脉分支发育的相关性。 肝脏。 2002; 22:252–258. doi:10.1046/j.0106-9543.2002.01674.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
18 Kinnman N、Francoz C、Barbu V、Wendum D、Rey C、Hultcrantz R、Poupon R、Housset C。在肝纤维化形成过程中,不同于肝星状细胞的胆道周围成纤维细胞的肌纤维母细胞转化受到血小板衍生生长因子的刺激。 实验室投资。 2003; 83:163–173. doi:10.1097/01.lab.0000054178.01162.e4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
19. Fickert P、Fuchsbichler A、Wagner M、Zollner G、Kaser A、Tilg H、Krause R、Lammert F、Langner C、Zatloukal K等。泄漏胆管中胆酸的回流导致Mdr2(Abcb4)基因敲除小鼠发生硬化性胆管炎。 胃肠病学。 2004; 127:261–274. doi:10.1053/j.gastro.2004.04.009。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
20 Ramadori G,Saile B.肝脏中的门脉纤维化。 实验室投资。 2004; 84:153–159. doi:10.1038/lipinvest.3700030。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
21 Jhander MN、Kruglov EA、Lavoie EG、Sévigny J、Dranoff JA。 门静脉成纤维细胞通过NTPDase2的表达调节胆管上皮细胞的增殖。 生物化学杂志。 2005; 280:22986–22992. doi:10.1074/jbc。 M412371200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
22 Sobesky R、Chollet JM、Prat F、Karkouche B、Pelletier G、Fritsch J、Choury AD、Allonier C、Bedossa P、Buffet C。总胆管炎性假瘤。 内窥镜检查。 2003; 35:698–700. doi:10.1055/s-2003-41522。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
23 Dehner LP,Coffin CM。特发性纤维硬化性疾病和其他炎性假瘤。 精神病学诊断。 1998; 15:161–173. [ 公共医学 ] [ 谷歌学者 ] -
24 Inaba K、Suzuki S、Yokoi Y、Ota S、Nakamura T、Konno H、Baba S、Takehara Y、Nakamora S。模拟肝内胆管癌的肝脏炎性假瘤:一例报告。 今天的苏格。 2003; 33:714–717. doi:10.1007/s00595-003-2561-z。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
25 山本K,菲利普斯MJ。 通过腐蚀铸型的扫描电子显微镜对肝内淋巴管进行三维观察。 Anat Rec.1986年; 214:67–70. doi:10.1002/ar.1092140111。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
26 SzabóG、Magyar Z、Szentirmai A、Jakab F、Mihaly K。胆道梗阻期间血液和淋巴中的胆汁成分。 二、。 胆汁酸和胆红素的吸收和运输。淋巴学。 1975; 8:36–42. [ 公共医学 ] [ 谷歌学者 ] -
27. Tsuboi K,Tazuma S,Nishioka T,Chayama K。卵磷脂对胆盐诱导的胆管损伤细胞保护机制的部分特征。 胃肠病学杂志。 2004; 39:955–960. doi:10.1007/s00535-003-1432-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
28 Barone M、Maiorano E、Ladisa R、Pece A、Berloco P、Strazabosco M、Caruso ML、Valentini AM、Ierardi E、Di Leo A等。熊去氧胆酸盐进一步增加大鼠部分胆管结扎诱导的胆管细胞增殖反应。 维丘建筑。 2004; 444:554–560. doi:10.1007/s00428-004-0998-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
29 Patel T、LaRusso NF、Gores GJ。 白细胞介素-6通过下调Bax抑制胆管细胞凋亡。 肝病学。 1997; 26时226分。 [ 谷歌学者 ] -
30 Que FG,Gores GJ,LaRusso NF.啮齿动物胆管细胞凋亡体外模型的建立和初步应用。 美国生理学杂志。 1997; 272:G106–G115。 doi:10.1152/ajpgi.1997.272.1.G106。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
31 Komichi D、Tazuma S、Nishioka T、Hyogo H、Une M、Chayama K。卵磷脂和细胞保护性胆汁盐对永生化小鼠胆管细胞中胆汁盐诱导的凋亡的独特抑制作用。 挖掘与疾病科学。 2003; 48:2315–2322. doi:10.1023/b:ddas.00007869.67105.27。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
32 Werneburg NW、Yoon JH、Higuchi H、Gores GJ。 胆汁酸通过TGF-α依赖机制激活人胆管细胞系中的EGF受体。 美国生理学杂志胃肠病学肝病生理学。 2003; 285:G31–G36。 doi:10.11152/ajpgi.00536.2002。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
33 Yoon JH、Higuchi H、Werneburg NW、Kaufmann SH、Gores GJ。 胆汁酸通过人胆管癌细胞系中的表皮生长因子受体诱导环氧合酶-2的表达。 胃肠病学。 2002; 122:985–993. doi:10.1053/gast.2002.32410。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
34 Lamireau T、Zoltowska M、Levy E、Yousef I、Rosenbaum J、Tuchweber B、Desmoulière A。胆汁酸对胆道上皮细胞的影响:增殖、细胞毒性和细胞因子分泌。 生命科学。 2003; 72:1401–1411. doi:10.1016/s0024-3205(02)02408-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
35 Kristiansen TZ、Bunkenborg J、Gronborg M、Molina H、Thuluvath PJ、Argani P、Goggins MG、Maitra A、Pandey A。人类胆汁的蛋白质组分析。 分子细胞蛋白质组学。 2004; 3:715–728. doi:10.1074/mcp。 M400015-MCP200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
36. Paumgartner G,Beuers U。胆汁淤积性肝病中的熊去氧胆酸:作用机制和治疗应用回顾。 肝病学。 2002; 36:525–531. doi:10.1053/jhep.2003.306088。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
37 科伦坡C、克罗西亚尼A、阿萨索·M、巴蒂扎蒂PM、波达M、吉安达A、齐默尔·内切米亚斯L、塞切尔KD。 熊去氧胆酸治疗囊性纤维化相关肝病:一项剂量反应研究。 肝病学。 1992; 16:924–930. doi:10.1002/hep.1840160412。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
38 AJ株、Crosby HA株、Nijjar S株、Kelly DA株、Hubscher SG株。人肝源性干细胞。 塞米恩肝病。 2003; 23:373–384. doi:10.1055/s-2004-815563。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
39 Roskams TA、Libbrecht L、Desmet VJ。 患病人类肝脏中的祖细胞。 塞米恩肝病。 2003; 23:385–396. doi:10.1055/s-2004-815564。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
40 Saxena R,Theise N.Hering运河:最新见解和当前知识。 塞米恩肝病。 2004; 24:43–48. doi:10.1055/s-2004-823100。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
41 Thorgeirsson SS,Grisham JW。 肝干细胞的最新实验研究概述。 塞米恩肝病。 2003; 23:303–312. doi:10.1055/s-2004-815559。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
42 POPPER H,KENT G,STEIN R.肝损伤时肝脏中的导管细胞反应。 J Mt Sinai Hosp,纽约,1957年; 24:551–556. [ 公共医学 ] [ 谷歌学者 ] -
43 Demetris AJ、Sakamoto T、Liu Z、Yokomuro S、Ezure T、Murase N等。肝脏疾病中的导管反应强调I型反应。 收录人:编辑Fleig WE。 正常和恶性肝细胞生长。 Dordecht:Kluwer学术出版社; 1999年,第141-155页。 [ 谷歌学者 ] -
44 Lunz JG 3rd、Contrucci S、Ruppert K、Murase N、Fung JJ、Starzl TE、Demetris AJ。 慢性肝移植排斥反应中,胆道上皮细胞的复制性衰老先于胆管丢失:p21(WAF1/Cip1)表达增加作为疾病标志物以及免疫抑制剂的影响。 《美国病理学杂志》。 2001; 158:1379–1390. doi:10.1016/S0002-9440(10)64089-8。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
45 Blakolmer K、Seaberg EC、Batts K、Ferrell L、Markin R、Wiesner R、Detre K、Demetris A。慢性肝移植排斥反应可逆性对分期方案的影响分析。 美国外科病理学杂志。 1999; 23:1328–1339. doi:10.1097/00000478-1991100-00003。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
46 Demetris A、Crawford J、Nalesnik M、Randhawa P、Wu T、Minervini M。肝脏移植病理学。 收录人:Odze RD、Goldblum JR、Crawford JM,编辑。 胃肠道、肝脏、胆道和胰腺的外科病理学。 费城:WB桑德斯; 2004年,第909–966页。 [ 谷歌学者 ] -
47 Wanless I.生理解剖学考虑。 收件人:希夫·ER、索雷尔·MF、马德丽·WC,编辑。 肝脏疾病。 费城:Lippincott Williams&Wilkins; 1999年,第3-37页。 [ 谷歌学者 ] -
48 德米特里斯·AJ。 缺血性胆管炎。 梅奥临床程序。 1992; 67:601–602. doi:10.1016/s0025-6196(12)60470-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
49 Ludwig J、Batts KP、MacCarty RL。同种异体肝移植中的缺血性胆管炎。 梅奥临床程序。 1992; 67:519–526. doi:10.1016/s0025-6196(12)60457-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
50 Kukan M,Haddad PS。肝细胞和胆管细胞在肝移植保存-再灌注损伤中的作用。 肝脏转运。 2001; 7:381–400. doi:10.1053/jlts.2001.23913。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
51 Teoh NC,Farrell GC。 肝脏缺血再灌注损伤:病理机制和肝保护的基础。 胃肠病学肝病杂志。 2003; 18:891–902. doi:10.1046/j.1440-1746.2003.03056.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
52. Noack K、Bronk SF、Kato A、Gores GJ。 胆管细胞对再氧损伤的敏感性大于缺氧。 肝移植后胆道狭窄发病机制的意义。 移植。 1993; 56:495–500. doi:10.1097/00007890-199309000-00001。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
53 Carrasco L、Sanchez-Bueno F、Sola J、Ruiz JM、Ramirez P、Robles R、Rodriquez JM、Parrilla P。原位肝移植术后冷缺血时间对移植物的影响。 胆汁细胞学研究。 移植。 1996; 61:393–396. doi:10.1097/00007890-199602150-00012。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
54 Busuttil RW,Tanaka K。边际供者在肝移植中的作用。 肝脏转运。 2003; 9:651–663. doi:10.1053/jlts.2003.50105。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
55 Demetris AJ、Fontes P、Lunz JG、Specht S、Murase N、Marcos A.肝移植胆道树的伤口愈合。 细胞移植。 2006; 15补充1:S57–S65。 doi:10.3727/00000006783982386。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
56 Pirenne J、Gunson B、Khaleef H、Hubscher S、Afford S、McMaster P、Adams D。肝移植术后缺血再灌注损伤对排斥反应的影响。 移植程序。 1997; 29:366–367. doi:10.1016/s0041-1345(96)00122-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
57 Shivakumar P、Campbell KM、Sabla GE、Miethke A、Tiao G、McNeal MM、Ward RL、Bezerra JA。 在实验性胆道闭锁中,淋巴细胞对肝外胆管的阻塞受到IFN-γ的调节。 临床投资杂志。 2004; 114:322–329. doi:10.1172/JCI21153。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
58 耿志明、姚莹、刘庆刚、牛晓杰、刘晓刚。 良性胆管狭窄的机制:形态学和免疫组织化学研究。 世界胃肠病杂志。 2005; 11:293–295. doi:10.3748/wjg.v11.i2.293。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
59 Tebbutt NC、Giraud AS、Inglese M、Jenkins B、Waring P、Clay FJ、Malki S、Alderman BM、Grail D、Hollande F等。通过SHP2和STAT介导的三叶草基因激活对gp130突变小鼠胃肠道稳态的相互调节。 《国家医学》,2002年; 8:1089–1097. doi:10.1038/nm763。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
60 Lin ZQ、Kondo T、Ishida Y、Takayasu T、Mukaida N。IL-6缺乏小鼠延迟伤口愈合证明了IL-6在皮肤创伤愈合过程中的重要作用。 白血病生物学杂志。 2003; 73:713–721. doi:10.1189/jlb.0802397。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
61 Gallucci RM、Simeonova PP、Matheson JM、Kommineni C、Guriel JL、Sugawara T、Luster MI。白介素-6缺乏和免疫抑制小鼠皮肤伤口愈合受损。 FASEB J.2000; 14:2525–2531. doi:10.1096/fj.00-0073com。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
62. Müller-Newen G.细胞因子受体gp130:完全混杂。 科学STKE。 2003; 2003年:PE40。 doi:10.1126/stke.2003.201.pe40。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
63 Kamimura D,Ishihara K,Hirano T.IL-6信号转导及其生理作用:信号协调模型。 生理生化药理学评论。 2003; 149:1–38. doi:10.1007/s10254-003-0012-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
64 Ishihara K,Hirano T.细胞因子作用的细胞特异性的分子基础。 Biochim生物物理学报。 2002; 1592:281–296. doi:10.1016/s0167-4889(02)00321-x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
65 Inghirami G、Chiarle R、Simmons WJ、Piva R、Schlessinger K、Levy DE。STAT3的新旧功能:癌症个体化治疗的关键靶点。 细胞周期。 2005; 4:1131–1133. doi:10.44161/cc.4.9.1985。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
66 Yasoshima M、Kono N、Sugawara H、Katayanagi K、Harada K、Nakanuma Y。病理性胆道上皮细胞中白细胞介素-6和肿瘤坏死因子α表达增加:原位和培养研究。 实验室投资。 1998; 78:89–100. [ 公共医学 ] [ 谷歌学者 ] -
67 Liu Z、Sakamoto T、Ezure T、Yokomuro S、Murase N、Michalopoulos G、Demetris AJ。 小鼠I型导管反应期间胆道上皮细胞中的白细胞介素-6、肝细胞生长因子及其受体:导管周围炎性细胞和基质细胞与胆道上皮之间的相互作用。 肝病学。 1998; 28:1260–1268. doi:10.1002/hep.510280514。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
68 Liu Z、Sakamoto T、Yokomuro S、Ezure T、Subbotin V、Murase N、Contrucci S、Demetris AJ。 白细胞介素-6缺乏小鼠的急性梗阻性胆道病:白血病抑制因子(LIF)的补偿表明gp-130信号在导管反应中的重要性。 肝脏。 2000; 20:114–124. doi:10.1034/j.1600-0676.2000.020002114.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
69 Rosen HR、Winkle PJ、Kendall BJ、Diehl DL。 接受内镜逆行胰胆管造影患者的胆汁白细胞介素-6和肿瘤坏死因子-α。 挖掘与疾病科学。 1997; 42:1290–1294. doi:10.1023/a:1018822628096。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
70 Scotte M、Davou M、Hiron M、Delers F、Lemeland JF、Teniere P、Lebreton JP。胆汁败血症大鼠的白细胞介素-6(IL-6)和急性期蛋白。 欧洲细胞因子网。 1991; 2:177–182. [ 公共医学 ] [ 谷歌学者 ] -
71 Kimmings AN、van Deventer SJ、Obertop H、Rauws EA、Huibregtse K、Gouma DJ。梗阻性黄疸和术前胆道引流后的内毒素、细胞因子和内毒素结合蛋白。 内脏。 2000; 46:725–731. doi:10.1136/gut.46.5.725。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
72 Akiyama T、Hasegawa T、Sejima T、Sahara H、Seto K、Saito H、Takashima S。经皮肝穿刺胆管引流后的血清和胆汁白细胞介素6。 肝肠病学。 1998; 45:665–671. [ 公共医学 ] [ 谷歌学者 ] -
73 Nozaki I、Lunz JG 3rd、Specht S、Stolz DB、Taguchi K、Subbotin VM、Murase N、Demetris AJ。 胆管结扎后,IL-6/STAT3信号非协调上调富含脯氨酸的小蛋白2。 实验室投资。 2005; 85:109–123. doi:10.1038/lipinvest.3700213。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
74 Ezure T、Sakamoto T、Tsuji H、Lunz JG 3rd、Murase N、Fung JJ、Demetris AJ。 白细胞介素-6缺乏小鼠胆汁性肝硬化的发生和代偿。 《美国病理学杂志》。 2000; 156:1627–1639. doi:10.1016/s0002-9440(10)65034-1。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
75 Ernst M、Inglese M、Waring P、Campbell IK、Bao S、Clay FJ、Alexander WS、Wicks IP、Tarlinton DM、Novak U等。gp130介导的信号转导和转录激活物(STAT)信号缺陷导致关节退行性疾病、胃肠道溃疡和子宫植入失败。 实验医学杂志,2001年; 194:189–203. doi:10.1084/jem.194.2.189。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
76 Kanai M,Mullen C,Podolsky DK.肠三叶因子诱导肠上皮细胞中细胞外信号调节蛋白激酶的失活。 美国国家科学院院刊,1998年; 95:178–182. doi:10.1073/pnas.95.1.178。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
77 Mashimo H,Wu DC,Podolsky DK,Fishman MC。缺乏肠三叶因子的小鼠肠粘膜防御受损。 科学。 1996; 274:262–265. doi:10.1126/science.274.5285.262。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
78 Podolsky DK、Lynch-Devaney K、Stow JL、Oates P、Murgue B、DeBeaumont M、Sands BE、Mahida YR.人体肠道三叶因子的鉴定。 针对顶端分泌的肽的杯状细胞特异性表达。 生物化学杂志。 1993; 268:6694–6702. [ 公共医学 ] [ 谷歌学者 ] -
79 Matsumoto K、Fujii H、Michalopoulos G、Fung JJ、Demetris AJ。 人胆道上皮细胞在体外分泌细胞因子和肝细胞生长因子并对其作出反应:白细胞介素-6、肝细胞生长素和表皮生长因子在体外促进DNA合成。 肝病学。 1994; 20:376–382. [ 公共医学 ] [ 谷歌学者 ] -
80 Yokomuro S、Lunz JG 3rd、Sakamoto T、Ezure T、Murase N、Demetris AJ。 白细胞介素-6(IL-6)/gp130信号传导对体外胆管上皮细胞生长的影响。 细胞因子。 2000; 12:727–730. doi:10.1006/cyto.1999.0612。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
81 Yokomuro S、Tsuji H、Lunz JG 3rd、Sakamoto T、Ezure T、Murase N、Demetris AJ。 白细胞介素6、肝细胞生长因子、转化生长因子β1和激活素A对人胆管上皮细胞的生长控制:胆管癌细胞系与非肿瘤性胆管上皮细胞原代培养的比较。 肝病学。 2000; 32:26–35. doi:10.1053/jhep.2000.8535。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
82 Tomasetto C、Masson R、Linares JL、Wendling C、Lefebvre O、Chenard MP、Rio MC。pS2/TFF1直接与VWFC富含半胱氨酸的粘蛋白域相互作用。 胃肠病学。 2000; 118:70–80. doi:10.1016/s0016-5085(00)70415-x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
83 Gum JR、Hicks JW、Gillespie AM、Carlson EJ、Kömüves L、Karnik S、Hong JC、Epstein CJ、Kim YS。 MUC2黏蛋白基因启动子介导的转基因小鼠肠道中杯状细胞特异性表达。 美国生理学杂志。 1999; 276:G666–G676。 doi:10.1152/ajpgi.1999.276.3.G666。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
84 Kindon H、Pothoulakis C、Thim L、Lynch-Devaney K、Podolsky DK。三叶肽对肠上皮屏障功能的保护:与粘蛋白糖蛋白的协同作用。 胃肠病学。 1995; 109:516–523. doi:10.1016/0016-5085(95)90340-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
85 Dignass A、Lynch-Devaney K、Kindon H、Thim L、Podolsky DK。三叶肽通过转化生长因子β非依赖性途径促进上皮迁移。 临床投资杂志。 1994; 94:376–383. doi:10.1172/JCI117332。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
86 Tomasetto C、Rio MC、Gautier C、Wolf C、Hareuveni M、Chambon P、Lathe R.hSP是pS2蛋白的结构域重复同源物,在胃中与pS2共表达,但在乳腺癌中不表达。 EMBO J.1990; 9:407–414. doi:10.1002/j.1460-2075.1990.tb08125.x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
87 Rio MC、Bellocq JP、Daniel JY、Tomasetto C、Lathe R、Chenard MP、Batzenschlager A、Chambon P。乳腺癌相关pS2蛋白:正常胃粘膜的合成和分泌。 科学。 1988; 241:705–708. doi:10.1126/science.3041593。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
88 Hertel SC、Chwieralski CE、Hinz M、Rio MC、Tomasetto C、Hoffmann W。分析小鼠三叶因子家族(TFF)的表达:肾脏和肝脏中反义TFF相关转录物的鉴定。 肽。 2004; 25:755–762. doi:10.1016/j.peptides.2003.11.021。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
89 Sasaki M、Tsuneyama K、Saito T、Kataoka H、Mollenhauer J、Poustka A、Nakanuma Y。正常和患病肝内胆管中三叶因子家族1、2和3以及恶性脑肿瘤1的位点特征表达和诱导与胆道病理生理学有关。 《肝脏国际》2004; 24:29–37. doi:10.1111/j.1478-3231.2004.00883.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
90 Sasaki M,Tsuneyama K,Nakanuma Y。肝胆管结石和胆管癌患者胆道上皮三叶因子家族1的异常表达。 实验室投资。 2003; 83:1403–1413. doi:10.1097/01.lab.0000092230.59485.9e。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
91 Srivatsa G、Giraud AS、Ulaganathan M、Yeomans ND、Dow C、Nicoll AJ。 胆道疾病中胆道上皮三叶肽表达增加。 组织病理学。 2002; 40:261–268. doi:10.1046/j.1365-2559.2002.01347.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
92 Kimura Y、Leung PS、Kenny TP、Van De Water J、Nishioka M、Giraud AS、Neuberger J、Benson G、Kaul R、Ansari AA等。原发性胆汁性肝硬化胆道上皮细胞中肠三叶因子的差异表达。 肝病学。 2002; 36:1227–1235. doi:10.1053/jhep.2002.36157。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
93 Marenholz I,Zirra M,Fischer DF,Backendorf C,Ziegler A,Mischke D.通过将整个YAC消减杂交到网格化角质形成细胞cDNA文库来鉴定人类表皮分化复合体(EDC)编码的基因。 基因组研究2001; 11:341–355. doi:10.1101/gr.114801。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
94 Cabral A、Voskamp P、Cleton-Jansen AM、South A、Nizetic D、Backendorf C。角质化包膜前体小脯氨酸丰富家族的结构组织和调控表明其在适应性屏障功能中起作用。 生物化学杂志。 2001; 276:19231–19237. doi:10.1074/jbc。 M100336200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
95 Patel S、Kartasova T、Segre JA。 小鼠Sprr基因座:协调调控基因的串联阵列。 哺乳动物基因组。 2003; 14:140–148. doi:10.1007/s00335-002-2205-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
96 Mischke D,Korge BP,Marenholz I,Volz A,Ziegler A.编码表皮角化结构蛋白和S100钙结合蛋白的基因在人类染色体1q21上形成基因复合体(“表皮分化复合体”)。 《皮肤病学杂志》。 1996; 106:989–992. doi:10.1111/1523-1747.ep12338501。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
97 Elder JT,Zhao X.表皮分化复合体中基因表达局部控制的证据。 实验皮肤病。 2002; 11:406–412. doi:10.1034/j.1600-0625.2002.110503.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
98 Tarcsa E、Candi E、Kartasova T、Idler WW、Marekov LN、Steinert PM。富含脯氨酸的小细胞膜蛋白2家族的结构和转谷氨酰胺酶底物特性。 生物化学杂志。 1998; 273:23297–23303. doi:10.1074/jbc.273.36.23297。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
99 Stern LE、Erwin CR、Falcone RA、Huang FS、Kemp CJ、Williams JL、Warner BW。肠切除术后适应肠的cDNA微阵列分析。 《儿科外科杂志》,2001年; 36:190–195. doi:10.1053/jpsu.2001.20050。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
100 Hooper LV、Wong MH、Thelin A、Hansson L、Falk PG、Gordon JI。 肠内共生宿主-微生物关系的分子分析。 科学。 2001; 291:881–884. doi:10.1126/science.291.5505.881。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
101. Mueller A、O’Rourke J、Grimm J、Guillemin K、Dixon MF、Lee A、Falkow S。独特的基因表达谱表征了幽门螺杆菌诱导的粘膜相关淋巴组织淋巴瘤的病理组织学阶段。 美国国家科学院院刊,2003年; 100:1292–1297. doi:10.1073/pnas.242741699。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
102 Knight PA、Pemberton AD、Robertson KA、Roy DJ、Wright SH、Miller HR。表达谱分析揭示了旋毛虫感染期间空肠上皮细胞的新型先天性和炎症反应。 感染免疫。 2004; 72:6076–6086. doi:10.1128/IAI.72.10.6076-6086.2004。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
103 Hong SH、Nah HY、Lee JY、Lee YJ、Lee JW、Gye MC、Kim CH、Kang BM、Kim MK。雌激素调节小鼠子宫中富含脯氨酸的小基因家族的表达。 摩尔细胞。 2004; 17:477–484. [ 公共医学 ] [ 谷歌学者 ] -
104 Tan YF、Li FX、Piao YS、Sun XY、Wang YL。 发情周期中小鼠子宫的整体基因图谱分析。 繁殖。 2003; 126:171–182. doi:10.1530/rep.0.12601。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
105 Song HJ,Poy G,Darwiche N,Lichti U,Kuroki T,Steinert PM,Kartasova T。小鼠Sprr2基因:显示上皮组织差异表达的基因簇家族。 基因组学。 1999; 55:28–42. doi:10.1006/geno.1998.5607。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
106 Zimmermann N、Doepker MP、Witte DP、Stringer KF、Fulkerson PC、Pope SM、Brandt EB、Mishra A、King NE、Nikolaidis NM等。小脯氨酸丰富蛋白2在过敏性炎症中的表达和调节。 美国呼吸细胞分子生物学杂志。 2005; 32:428–435. doi:10.1165/rcmb.2004-0269OC。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
107 Michalopoulos GK,DeFrances MC。肝脏再生。 科学。 1997; 276:60–66. doi:10.1126/science.276.5309.60。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
108 Clouston AD,Powell EE。非酒精性脂肪性肝病与其他肝病的相互作用。 最佳实践研究临床胃肠病。 2002; 16:767–781. doi:10.1053/bega.2002.329。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
109 Demetris AJ、Sakamoto T、Liu Z、Yokomuro S、Ezure T、Murase N、Blakolmer K。肝病中的导管反应强调I型反应。 收件人:Fleig WE,编辑,编辑。 正常和恶性肝细胞生长。 Dordecht:Kluwer学术出版社; 1999年,第141–155页。 [ 谷歌学者 ] -
110 Sirica AE、Mathis GA、Sano N、Elmore LW。 肝内胆管上皮细胞和卵圆细胞的分离、培养和移植。 病理生物学。 1990; 58:44–64. doi:10.1159/000163564。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
111 张M,Thorgeirsson SS。 连接蛋白在卵圆细胞向肝细胞分化过程中的调控。 实验细胞研究1994; 213:37–42. doi:10.1006/excr.1994.1170。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
112. Martin KR、Barrett JC。 活性氧作为细胞过程中的双刃剑:低剂量细胞信号与高剂量毒性。 人类实验毒物。 2002; 21:71–75. doi:10.11191/0960327102ht213oa。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
113 Marshall A、Rushbrook S、Davies SE、Morris LS、Scott IS、Vowler SL、Coleman N、Alexander G。慢性丙型肝炎病毒感染中肝细胞G1停滞、肝再生受损和纤维化之间的关系。 胃肠病学。 2005; 128:33–42. doi:10.1053/j.gastro.2004.09.076。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
114 Kobayashi S、Matsushita K、Saigo K、Urashima T、Asano T、Hayashi H、Ochiai T。乙型肝炎、丙型肝炎病毒感染的人肝癌组织中P21WAF1/CIP1信使RNA的表达。 癌症。 2001; 91:2096–2103. doi:10.1002/1097-0142(20010601)91:11<2096::aid-cncr1237>3.0.co; 2-9. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
115 Torbenson M,Yang SQ,Liu HZ,Huang J,Gage W,Diehl AM。STAT-3过度表达和p21上调伴随脂肪肝再生受损。 《美国病理学杂志》。 2002; 161:155–161. doi:10.1016/S0002-9440(10)64167-3。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
116 Sawada N、Kojima T、Obata H、Isomura H、Atsumi S、Sawaki M、Tsuzuki N、Tobioka H、Kokai Y、Satoh M等。p21(waf-1/cip-1)的表达在患有慢性肝损伤的LEC大鼠的肝脏中显著诱导。 Jpn J癌症研究1996; 87:1102–1105. doi:10.1111/j.1349-7006.1996.tb03117.x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
117 Koteish A,Yang S,Lin H,Huang J,Diehl AM。乙醇诱导氧化还原敏感细胞周期抑制剂并抑制肝部分切除术后的肝再生。 2002年酒精临床实验研究; 26:1710–1718. doi:10.1097/01.ALC.000036923.77613.59。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
118 Blakolmer K、Jain A、Ruppert K、Gray E、Duquesnoy R、Murase N、Starzl TE、Fung JJ、Demetris AJ。 以他克莫司作为基线免疫抑制治疗的人群中的慢性肝移植排斥反应:长期随访和组织病理学分期特征评估。 移植。 2000; 69:2330–2336. doi:10.1097/00007890-200006150-00019。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
119 Demetris A、Adams D、Bellamy C、Blakolmer K、Clouston A、Dhillon AP、Fung J、Gouw A、Gustafsson B、Haga H等。肝移植排斥反应国际班夫模式更新:组织病理学分期和慢性排斥反应报告的工作建议。 国际小组。 肝病学。 2000; 31:792–799. doi:10.1002/hep.510310337。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
120 Oguma S、Belle S、Starzl TE、Demetris AJ。 慢性排斥人类同种异体肝移植的组织计量学分析:胆管丢失机制的见解:直接免疫和缺血因素。 肝病学。 1989; 9:204–209. doi:10.1002/hep.1840090207。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
121 Omori N、Evarts RP、Omori M、Hu Z、Marsden ER、Thorgeirsson SS。 成年大鼠肝再生过程中白血病抑制因子及其受体的表达。 实验室投资。 1996; 75:15–24. [ 公共医学 ] [ 谷歌学者 ] -
122 Sakamoto T、Ezure T、Lunz J、Murase N、Tsuji H、Fung JJ、Demetris AJ。 伴刀豆球蛋白A同时启动小鼠肝部分切除术后肝再生过程中肝造血和上皮祖细胞的平行扩增。 肝病学。 2000; 32:256–267. doi:10.1053/jhep.2000.9406。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
123. Chan KS、Sano S、Kiguchi K、Anders J、Komazawa N、Takeda J、DiGiovanni J。Stat3的破坏揭示了在上皮癌变的起始和促进阶段中的关键作用。 临床投资杂志。 2004; 114:720–728. doi:10.1172/JCI21032。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
124. 坎皮西·J·癌症与衰老:敌对的恶魔。 Nat Rev癌症。 2003; 3:339–349. doi:10.1038/nrc1073。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
125 Haura EB,Turkson J,Jove R.《疾病机制:癌症中信号转导器和转录激活器的新兴作用》。 Nat Clin Pract肿瘤。 2005; 2:315–324. doi:10.1038/ncponc0195。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
126 Hodge DR、Hurt EM、Farrar WL。 IL-6和STAT3在炎症和癌症中的作用。 《欧洲癌症杂志》。 2005; 41:2502–2512. doi:10.1016/j.ejca.2005.08.016。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
127 Koike N,Saitoh K,Todoroki T,Kawamoto T,Iwasaki Y,Nakamura K。大鼠胆管上皮细胞增殖动力学。 细胞增殖。 1993; 26:183–193. doi:10.1111/j.1365-2184.1993.tb00018.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
128 Nakanuma Y,Kono N.非肿瘤性肝胆疾病中增生和受损的胆管和小叶间胆管中波形蛋白的表达。 中度病理学。 1992; 5:550–554. [ 公共医学 ] [ 谷歌学者 ] -
129 Milani S、Herbst H、Schuppan D、Niedobitek G、Kim KY、Stein H.在继发性胆道纤维化中新生大鼠胆管上皮细胞的Vimentin表达。 Virchow Arch A Pathol Anat Histopathol公司。 1989; 415:237–242. doi:10.1007/BF00724910。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
130 Haruna Y,Saito K,Spaulding S,Nalesnik MA,Gerber MA。人类肝脏发育中双潜能祖细胞的鉴定。 肝病学。 1996; 23:476–481. doi:10.1002/hep.510230312。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
131 Terada T、Ashida K、Kitamura Y、Matsunaga Y、Takashima K、Kato M、Ohta T。人肝内胆管发育过程中上皮钙粘蛋白、α-钙粘蛋白和β-连环蛋白的表达:在胆管形态发生中的可能作用。 肝素杂志。 1998; 28:263–269. doi:10.1016/0168-8278(88)80013-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
132 Camargo CA Jr、Madden JF、Gao W、Selvan RS、Clavien PA。白细胞介素-6保护肝脏免受热缺血/再灌注损伤,并促进啮齿动物肝细胞增殖。 肝病学。 1997; 26:1513–1520. doi:10.1002/hep.510260619。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
133 高B.白细胞介素-6在预防肥胖和酒精相关脂肪肝移植失败中的治疗潜力。 酒精。 2004; 34:59–65. doi:10.1016/j.alcohol.2004.07.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
134. Hong F,Radaeva S,Pan HN,Tian Z,Veech R,Gao B.白细胞介素6减轻脂肪肝小鼠的肝脏脂肪变性和缺血/再灌注损伤。 肝病学。 2004; 40:933–941. doi:10.1002/hep.20400。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
135 Selzner M,Graf R,Clavien PA。IL-6:肝移植的神奇药剂。 胃肠病学。 2003; 125:256–259. doi:10.1016/s0016-5085(03)00811-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
136 Sun Z、Klein AS、Radaeva S、Hong F、El-Assal O、Pan HN、Jaruga B、Batkai S、Hoshino S、Tian Z等。体外白细胞介素-6治疗可预防大鼠脂肪肝移植相关的死亡率。 胃肠病学。 2003; 125:202–215. doi:10.1016/s0016-5085(03)00696-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
137 Kimizuka K、Nakao A、Nalesnik MA、Demetris AJ、Uchiyama T、Ruppert K、Fink MP、Stolz DB、Murase N。外源性IL-6抑制急性炎症反应,防止肠移植后缺血/再灌注损伤。 《美国移植杂志》。 2004; 4:482–494. doi:10.1111/j.1600-6143.2004.00368.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
138 Safadi R,Friedman SL。肝纤维化——肝星状细胞活化的作用。 医学GenMed。 2002; 4:27. [ 公共医学 ] [ 谷歌学者 ] -
139. Tillmann HL,Manns MP,Rudolph KL。丙型肝炎病毒发病机制的合并模型。 塞米恩肝病。 2005; 25:84–92. doi:10.1055/s-2005-864784。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
140 Watanabe S、Matsuda A、Suzuki Y、Kondo K、Ikeda Y、Hashimoto H、Umemura K。曲尼司特由于阻断PDGF-BB受体而抑制人冠状动脉平滑肌细胞增殖的机制。 英国药理学杂志。 2000; 130:307–314. doi:10.1038/sj.bjp.0703285。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
141 Ikeda H,Inao M,Fujiwara K。曲尼司特对培养的大鼠星状细胞中活化和转化生长因子β1表达的抑制作用。 生物化学与生物物理研究委员会。 1996; 227:322–327. doi:10.1006/bbrc.1996.1508。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
142 Naftalin R.低钠饮食或电离辐射引起的结肠屏障功能改变。 《环境病理毒理学杂志》。 2004; 23:79–97. doi:10.1615/jenvpathtoxoncol.v23.i2.10。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
143 Wengrower D、Zanninelli G、Pappo O、Latella G、Sestieri M、Villanova A、Faitelson Y、Pines M、Goldin E。卡托普利预防实验性结肠炎纤维化:tgf-beta1的作用。 炎症性肠病。 2004; 10:536–545. doi:10.1097/00054725-200409000-00007。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
144. Ramos SG、黑山AP、Goissis G、Rossi MA。卡托普利可减少猪血清诱导的大鼠肝纤维化中胶原、肥大细胞和嗜酸性粒细胞的积聚。 《病理学国际》1994; 44:655–661. doi:10.1111/j.1440-1827.1994.tb02944.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
145 袁国杰、张美林、龚志杰。 PPARg激动剂吡格列酮对大鼠肝纤维化的影响。 世界胃肠病杂志。 2004; 10:1047–1051. doi:10.3748/wjg.v10.i7.1047。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
146 川口K、坂田I、津也M、大森K、高美T、大田K。吡格列酮可预防因缺乏胆碱的L-氨基酸饮食导致的大鼠肝硬化中的肝脂肪变性、纤维化和酶替代性病变。 生物化学与生物物理研究委员会。 2004; 315:187–195. doi:10.1016/j.bbrc.2004.01.038。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
147 Miyahara T、Schrum L、Rippe R、Xiong S、Yee HF、Motomura K、Anania FA、Willson TM、Tsukamoto H。过氧化物酶体增殖物激活受体和肝星状细胞激活。 生物化学杂志。 2000; 275:35715–35722. doi:10.1074/jbc。 M006577200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]


