摘要 虽然抗精神病药物可以在几个小时内减少精神病行为,但在几周内并没有达到完全疗效,这意味着神经功能可能会出现快速、短期的变化,并巩固为长期的变化。 在这里,我们发现抗精神病药物氟哌啶醇,一种多巴胺受体2型(D 2 R) 拮抗剂,刺激激酶Akt激活雷帕霉素复合物1(mTORC1)哺乳动物靶点介导的mRNA翻译途径。 初级纹状体D 2 R阳性神经元、氟哌啶醇介导的mTORC1激活导致核糖体蛋白S6(S6)和真核生物翻译起始因子4E-结合蛋白(4E-BP)磷酸化增加。 蛋白质组质谱显示,培养的纹状体神经元急性暴露于氟哌啶醇后,蛋白质合成模式发生了显著变化,包括细胞骨架蛋白质和与翻译机制相关的蛋白质丰度增加。 这些蛋白质组学变化与神经元形态复杂性增加相一致,而mTORC1下游效应器的抑制降低了神经元形态复杂性,表明mTORC1-依赖性翻译增强了神经元对氟哌啶醇的反应复杂性。 在体内,我们观察到氟哌啶醇注射小鼠皮层神经元中细胞骨架蛋白丰度随形态快速变化而增加。 这些结果提示了抗精神病药物的急性和长期作用机制。
介绍 抗精神病药物于20世纪50年代末开发,目前用于治疗与精神分裂症和难治性抑郁症相关的精神病。 第一代典型抗精神病药物,如氟哌啶醇,主要拮抗多巴胺受体2型(D 2 R) 在大脑中。 尽管许多第二代抗精神病药物可对抗D 2 类R和5-羟色胺 2 -就像已经引入的受体一样,这些药物改善疗效的最初报告也受到质疑( 1 ). 两组抗精神病药物主要针对精神分裂症的阳性症状,如幻觉和妄想,它们对这些精神病性行为的改善作用最早可在治疗后2小时开始,24小时后明显改善( 2 , 三 ). 然而,患者在接受三周或更长时间的治疗后才能获得充分疗效( 4 )这意味着神经元功能可能会发生快速、短期的变化,随着时间的推移,这些变化会被巩固为持久的变化( 5 ).
抗精神病药物的信号作用之一是激酶Akt(也称为蛋白激酶B(PKB))磷酸化增加,这表明激酶活性增加( 6 , 7 ). 注射氟哌啶醇后两小时内测量到Akt磷酸化增加( 6 ). 大多数研究调查D的影响 2 R拮抗剂主要关注Akt对糖原合成酶激酶3β(GSK3β)的磷酸化和抑制,因为该信号通路与其他行为障碍有关,例如双相情感障碍( 8 ). 然而,锂治疗增强了GSK3β的磷酸化,对精神分裂症的疗效有限( 9 )提示GSK3β磷酸化可能不能完全解释氟哌啶醇抗精神病作用的机制。
突触功能的长期变化受到跨突触信号和树突状蛋白合成的动态变化的紧密调节( 10 ). Akt-mTORC1(哺乳动物或雷帕霉素复合物1的机械靶点)通路是蛋白质合成(包括参与突触信号传递的突触蛋白)的一个明确的调节器。 mTORC1依赖性翻译与突触可塑性、记忆巩固和自闭症有关( 11 – 14 ). Akt激活减轻对mTORC1活性的抑制,进而通过磷酸化和抑制4E-BP促进cap依赖性翻译。 mTORC1的另一个下游效应器p70 S6激酶1(S6K1)磷酸化核糖体蛋白S6,这也与翻译增加有关( 15 , 16 ). 在这里,我们询问Akt-mTORC1通路是否参与抗精神病药物的神经元反应。
我们分析了氟哌啶醇对Akt信号传导和mTORC1效应子S6和4E-BP的急性影响,以及随后培养的纹状体神经元的蛋白质组学变化。 我们鉴定了在接触氟哌啶醇的前48小时内合成的蛋白质,并发现与细胞骨架相关的蛋白质和蛋白质合成机制的组成部分增加。 我们还观察到形态复杂性增加; 特别是增加了神经元投射形态的复杂性,这依赖于mTORC1效应器。 除了形态复杂度增加外,我们还观察到,服用氟哌啶醇24小时后,纹状体神经元体外的脊椎数量增加,第5层皮层锥体神经元体内的脊椎形成增加。 因此,氟哌啶醇激活Akt-mTORC1通路导致蛋白质合成的离散变化,与总体形态复杂性增加相关,这代表了以前抗精神病药物作用的一种非特征性机制。
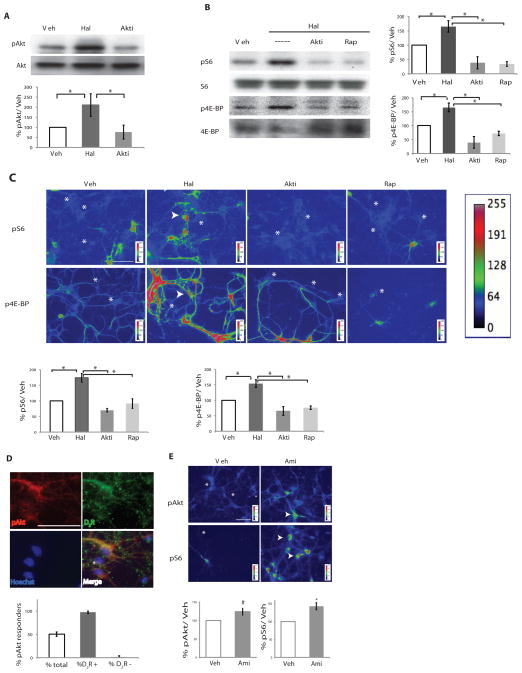
结果 氟哌啶醇增加Akt-mTORC1信号 典型抗精神病药物拮抗D 2 R、 导致Akt磷酸化增加( 7 , 17 ). 因此,我们询问抗精神病药物氟哌啶醇是否在短于两小时的时间点增加了初级纹状体神经元培养物中的Akt磷酸化。 我们关注纹状体神经元,因为D 2 R在这些神经元中含量丰富( 18 ). 氟哌啶醇被选为模型药物,因为它与D的结合亲和力和临床特征 2 R已确立( 19 ). 我们根据其结合亲和力和人类患者的临床效力特征选择了20 nM的浓度( 20 ),并证实该浓度可有效刺激小鼠初级纹状体神经元中Akt的磷酸化( 图S1A–B ). 用20 nM氟哌啶醇对体外7天(DIV7)初级纹状体神经元进行20分钟的治疗,显著增加了Akt在Ser 473 ( 图1A )被膜透性Akt PH结构域抑制剂Akti废除( 21 ).
图1。 急性抗精神病药物治疗增加D 2 R阳性神经元。
在Akt抑制剂(Akti)或雷帕霉素(Rap)存在下,用氟哌啶醇(Hal)或二甲基亚砜(Veh)处理原代DIV7小鼠纹状体神经元20分钟。 ( A类 )对暴露于指定条件下的裂解物中磷酸化Akt和总Akt进行Western blot分析(左,代表性blot;右量化n=4,单向方差分析p<0.0001,事后分析Veh vs Hal p<0.01,Hal vs Akti,p<0.001)。 ( B类 )Western blot分析暴露于指定条件下的裂解液中磷酸化的S6和总S6和4E-BP【左,代表性blot;右定量S6(n=3,单向方差分析p<0.0008,Veh vs Hal p<0.05,Hal vs Akti和Hal vs-Rap p<0.01)】 和4E-BP(n=3,单向方差分析p<0.0003,Veh vs Hal p<0.05,Hal vs Akti p<0.001,Hal vs Rap p<0.01)。 所示的所有图表均为平均值±SEM( C类 )免疫荧光检测到纹状体神经元中指示磷酸化蛋白丰度的变化。 箭头表示有反应的神经元,星星表示没有反应的细胞。 pS6的量化(n=4,单向方差分析p<0.05,所有显示的单个比较p<0.05)和p4E-BP的量化(n=4,双向方差分析p<0.0001,Veh vs Hal p<0.01,Hal vs Akti和Hal-Rap p<0.001)。 ( 天 )D类 2 几乎所有pAkt增加的细胞都检测到Rs( 箭头 ). 无响应的单元格用星号表示。 反应细胞和D的量化 2 R阳性(D 2 R+)和D 2 R-负极(D 2 R−)细胞(n=3,计109个细胞)。 天 2 R图像在ImageJ中进行了迭代反褶积,以提高信号的清晰度。 ( E类 )暴露于氨磺吡啶(1μM)或载体20分钟的纹状体神经元中磷酸化Akt和S6的丰度(pAkt,n=3,p<0.06;pS6,n=3,p<0.03)。 比例尺指示50μm。
Western blot显示,氟哌啶醇与Akt激活一起增加了DIV7纹状体神经元中S6和4E-BP的磷酸化( 图1B )和免疫荧光( 图1C ). Akti或mTORC1抑制剂雷帕霉素预处理纹状体神经元可减少神经元数量,并减弱氟哌啶醇诱导的S6和4E-BP磷酸化增加的强度( 图1B和1C ). 只有一部分细胞(40%)对氟哌啶醇治疗有反应( 图1D ),这些被确定为D 2 R阳性纹状体神经元( 图1D ). 只有D 2 在来自D 2 R-EGFP转基因小鼠(95%重叠, 图S1C ).
为了测试观察到的Akt活化是否对氟哌啶醇特异,我们测试了1μM阿米苏必利( 图1E ),一种具有不同亲和力特征的非典型抗精神病药物,并发现该浓度的氨苏必利也增加了磷酸化Akt和磷酸化S6,表明mTORC1通路激活。 因此,氟哌啶醇和阿米苏必利在20分钟内激活了Akt-mTORC1通路及其下游翻译效应器,表明mTORC1途径在典型和非典型抗精神病药物的急性作用机制中发挥作用。 此外,该反应在D的一个子集中特别富集 2 R阳性纹状体神经元,表明该受体可能介导这些药物对蛋白质合成的影响。
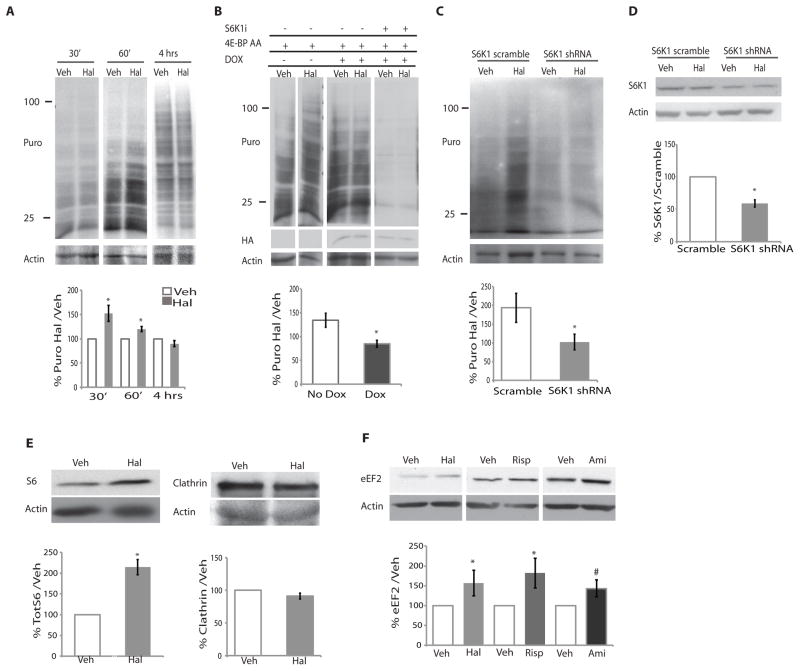
氟哌啶醇促进培养纹状体神经元蛋白质合成 测试核糖体S6和4E-BP磷酸化的增加是否与蛋白质合成增强一致( 15 ),我们使用SUnSET,这是一种监测培养细胞中全局蛋白质合成的非放射性方法,使用嘌呤霉素标记新生蛋白质( 13 , 22 – 23 ). 嘌呤霉素与tRNA共价整合到新生的多肽链中,从而“标记”新合成的蛋白质,然后可以用嘌呤菌素单克隆抗体检测这些蛋白质。 为了确定这些实验的最佳嘌呤霉素浓度,我们检测了在有无氟哌啶醇的情况下嘌呤菌素的掺入,发现1μg/ml在标记大分子量蛋白质比例较大时产生最佳信号,表明蛋白质截短和降解最小( 图S2A ). 时间-过程实验表明,在经过氟哌啶醇处理的样品中,嘌呤霉素掺入量在30分钟内显著增加,并且在1小时后仍然增加,然后在4小时后恢复到与经车辆处理的样品相匹配的水平( 图2A ). 因此,氟哌啶醇暂时增加纹状体神经元的蛋白质合成。
图2。 急性氟哌啶醇治疗导致mTORC1依赖的蛋白质合成短暂增加。
( A类 )用氟哌啶醇(Hal)或二甲基亚砜(Veh)和1μg/ml嘌呤霉素处理原代DIV7纹状体神经元30、60分钟或4小时。 用Western blotting检测嘌呤霉素。 显示了一个具有代表性的斑点。 由于信号的强度,4小时的斑点曝光较轻。 数据被量化为氟哌啶醇处理样品中嘌呤霉素信号的百分比/归一化为肌动蛋白的载体处理样品中的嘌呤菌素信号,并显示为平均值(30分钟;n=8,p=0.007;60分钟,n=7,p=0.005;4小时,n=4,不显著)。 Actin是一个加载控件。 ( B类 )S6K1 shRNA或多西环素诱导(DOX)显性负4E-BP AA对氟哌啶醇介导的翻译刺激的影响。 4E-BP AA“开”(Dox;n=4)和“关”(No Dox;n=3)状态的数据在面板A中进行了量化。* p=0.02)。 含或不含S6K1抑制剂(S6K1i)的多西环素,n=3,由于信号相对较轻,未定量。 HA表示存在4E-BP AA。肌动蛋白是一种负载控制。 ( C类 )S6K1敲低(S6K1 shRNA)或对照(S6K1加扰)对氟哌啶醇诱导的puromocyin掺入增加的影响。 数据按面板A进行量化(n=4,p=0.03,)。 ( 天 )每个实验中都对S6K1敲除的有效性进行了量化,敲除平均值为41%(n=4 p<0.0003)。 ( E类 )在用于嘌呤霉素分析的相同条件下,暴露于载体或氟哌啶醇的纹状体神经元中S6和克雷菊酯丰度的Western blot分析(%氟哌啶醇/载体归一化为肌动蛋白负载控制)。 (S6,n=3,p=0.003)(氯菊酯,n=4,p=不显著)。 ( F类 )Western blot分析暴露于载体或氟哌啶醇(20μM,n=7,p=0.027)、利培酮(利培酮100 nM,n=,5,p<0.06)或氨磺吡啶(Ami,1μM,n=5,p=0.08)4小时的纹状体神经元中eEF2丰度。 所有图表均为平均值±SEM,并通过Student t检验进行分析。 P<0.05被认为是显著的,用星号标记; P<0.1用#标记。
为了探讨氟哌啶醇诱导的翻译增加是否依赖于mTORC1信号传导,我们阻断了mTORC1-的两个特征良好的效应器:真核细胞起始因子4E(eIF4E),当4E-BP被mTORC-1磷酸化时激活,以及S6K1,一种直接的mTORC1.底物。 通过表达作为组成活性eIF4E阻遏物的4E-BP1(4E-BP AA)的多西环素诱导磷酸化缺陷突变体( 24 )在纹状体神经元中,我们发现氟哌啶醇介导的翻译增加在多西环素治疗后通过4E-BP AA的表达而减少( 图2B ). 相反,在没有强力霉素的情况下,氟哌啶醇介导的嘌呤霉素掺入没有受到抑制( 图S2B ). 在载体和氟哌啶醇条件下,用S6K1抑制剂PF-4708671处理表达4E-BP AA的神经元后,蛋白质合成进一步减少( 图2B ) ( 25 ). 为了独立检测S6K1在氟哌啶醇诱导的翻译增加中的作用,我们使用靶向S6K1的shRNA( 24 ). S6K1敲低也降低了氟哌啶醇诱导的原代纹状体神经元培养物中蛋白质合成的增加( 图2C ; 图2D ).
我们研究了mTORC1激活的增加如何促进氟哌啶醇影响神经元功能的机制。 一种可能性是mTORC1的激活和随后翻译的增加导致特定蛋白质的合成,而不仅仅是翻译的全球增加。 事实上,在小鼠胚胎成纤维细胞中,刺激mTORC1两小时足以改变核糖体上mRNA的分布,从而可能影响特定转录物的翻译( 26 ). 因为体内长期抗精神病药物治疗后也会发生蛋白质组变化( 27 – 28 )我们预测,相对蛋白质丰度的早期变化可能会随着时间的推移而累积,导致大规模的蛋白质组变化,类似于慢性抗精神病治疗后所描述的变化( 27 – 28 ). 为了确定氟哌啶醇是否刺激特定蛋白质的产生,我们结合了两种技术。 我们使用细胞培养中氨基酸的稳定同位素标记(SILAC)来测量相对蛋白质量( 29 )结合SUnSET富集新合成的蛋白质( 23 )这使得对氟哌啶醇治疗后立即产生的新生蛋白质进行标记、分离和量化成为可能。 在有无嘌呤霉素的情况下,用内源性神经营养配体脑源性神经营养因子刺激神经元(以刺激蛋白质合成),验证了抗嘌呤霉菌素抗体对免疫沉淀的特异性,并表明信号仅限于接触嘌呤菌素的细胞( 图S2C ). 此外,细胞暴露于嘌呤霉素4小时后,抗体免疫沉淀蛋白( 图S2D )并且该信号足够强,能够在暴露于嘌呤霉素4小时后检测免疫沉淀物中单个新合成的蛋白质,如S6( 图S2E ).
培养纹状体神经元经puromcyin和SILAC标记培养5小时后,蛋白质合成增加,用puromycin靶向抗体进行免疫沉淀,增加了SILAC标签新合成蛋白质的数量( 图S3A ). 氟哌啶醇治疗使特定蛋白质子集的合成发生了可检测的变化( 图S3A ). 我们在细胞中鉴定出269种嘌呤霉素标记(新合成)蛋白质,这些蛋白质在氟哌啶醇暴露5小时后增加,139种蛋白质丰度减少( 表S1 ). 此外,在氟哌啶醇治疗和随后的嘌呤霉素免疫沉淀后,我们检测到S6的数量增加,这是一种在5小时筛选中确定增加的蛋白质( 图S2E )这表明该技术可用于评估新生蛋白质合成的变化。 因为单剂抗精神病药物可以在两小时内改变行为,24小时后这些改变会更加明显( 2 , 三 ),我们还分析了暴露于氟哌啶醇或载体48小时的纹状体神经元中SILAC标记的和富含嘌呤霉素的蛋白质( 图S3B ). 在48小时的研究中,我们鉴定了3209种至少测得一次的蛋白质( 表S2 ). 我们将5小时和48小时研究的蛋白质组结果与先前研究中确定的mTORC1特异性mRNA进行了比较( 26 )并注意到,在我们的研究中,氟哌啶醇治疗上调的蛋白质与那些在mTORC1抑制剂存在下核糖体结合降低的mRNA之间存在着显著的相似性,这表明mTORC 1具有正向调节作用( 表S3 ). 综上所述,这些数据表明氟哌啶醇可以增加特异性mTORC1调节蛋白的丰度。
为了验证暴露于氟哌啶醇的神经元的质谱分析结果,我们将培养的纹状体神经元暴露于氟烷哌啶醇4小时,并监测S6和甲氰菊酯的变化( 图2E )和eEF2中的( 图2F )通过蛋白质印迹。 与质谱结果一致( 表S1 ),我们发现S6的数量增加( 图2E )和eEF2( 图2F )含氟哌啶醇,但不增加氯氰菊酯( 图2E ). 为了确定eEF2的增加是否是氟哌啶醇特异性的,用两种非典型抗精神病药物阿米磺吡啶或利培酮治疗DIV7纹状体神经元4小时。 两种药物治疗均导致eEF2增加( 图2E ). 综上所述,这些发现表明,氟哌啶醇以及阿米苏必利和利培酮可以增加培养纹状体神经元中平移机制成分的合成。
质谱分析表明,与翻译和细胞骨架相关的蛋白质是在体内外对氟哌啶醇的反应中产生的
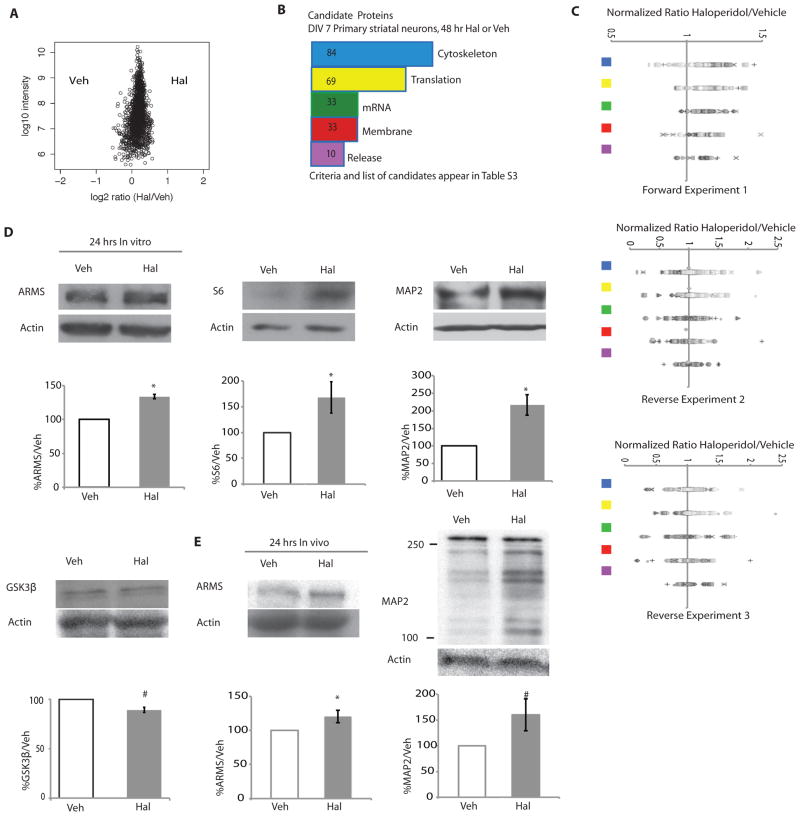
用三个独立的复制品对暴露于氟哌啶醇48小时的神经元进行蛋白质组学分析。 我们使用了三种不同的严格性来确定在48小时氟哌啶醇治疗后增加的蛋白质( 表S4 ). 这项48小时质谱研究与5小时筛选一致,该筛选确定了与翻译相关的蛋白质( 图3A )还揭示了蛋白质丰度的变化,并确定了参与细胞骨架的蛋白质的几种变化( 图3B ). 将5小时的筛选结果与48小时的研究数据进行比较,结果表明,在随后的时间里,氟哌啶醇与对照样品之间的巨大差异小于在氟哌啶醇暴露5小时的样品中观察到的差异, 这表明载体和氟哌啶醇处理的神经元在48小时时具有更相似的翻译特征(相比之下 图3A 具有 图S3A ). 如果蛋白质的标准化比率(折叠变化)至少为1.2(用氟哌啶醇治疗测量的蛋白质量/用载体治疗测量的蛋白量),则蛋白质被描述为“候选”[标准基于( 29 – 31 )]. 我们将这些在最不严格的条件下增加1.2倍的蛋白质称为候选蛋白质,因为它们对抗精神病药物诱导的蛋白质合成变化具有一致的反应,尽管它们不符合最严格的标准。候选蛋白质分为翻译、细胞骨架、, mRNA处理、膜或释放相关列在 表S4 (有关类别的解释,请参见材料和方法)。 使用最严格的标准,即在至少2个实验中增加1.2倍,我们发现44个增加的蛋白质中有17个与细胞骨架相关,10个与翻译相关( 表1 ). 候选蛋白似乎是特异性的,因为并不是所有细胞骨架或翻译蛋白在氟哌啶醇作用下都发生了变化( 图3C ).
图3。 氟哌啶醇治疗导致参与蛋白质合成并与细胞骨架相关的蛋白质发生特定的早期蛋白质组学变化。
( A) 氟哌啶醇或载体治疗48小时后,通过质谱测定的所有标准化蛋白质的代表性图,并进行SILAC标记。 ( B类 )在48小时质谱分析中,对氟哌啶醇处理后增加的候选蛋白质进行生物信息学分析。 该图显示了UniProtKB前五类蛋白质丰度变化的频率(参见材料和方法, 表S4 ). 翻译=与蛋白质翻译相关的蛋白质; mRNA=与mRNA合成和运输相关的蛋白质; 细胞骨架=与细胞骨架相关或部分细胞骨架的蛋白质; 膜=与质膜整合的蛋白质; 释放=与突触小泡释放或突触胞吐有关的蛋白质。 ( C类 )前5个候选蛋白质类中所有蛋白质的标准化折叠变化。 这些符号并不表示任何特殊含义。 彩色方块对应于B中着色的类( 天 )暴露于氟哌啶醇或载体24小时的DIV7纹状体神经元裂解物的Western blot分析。 分析了候选蛋白S6(n=4,p=0.06)、ARMS(n=3,p<0.0001)和MAP2(n=3,p=0.02),以及GSK3β,一种非候选蛋白(n=4,p=0.006)。 ( E类 )用0.25 mg/kg氟哌啶醇或载体治疗24小时的成年小鼠纹状体裂解物中ARMS和MAP2的Western blot分析。 ARMS(n=6/组,p=0.048); MAP2(n=6/组,p=0.08)。 所有图表均为平均值±SEM,并通过Student t检验进行分析。 P<0.05被认为是显著的,用星号标记; p<0.1被视为趋势水平,并标有#。
表1。 在至少两个实验中达到增加至少1.2倍的最高严格性的候选蛋白质。 蛋白质按UniProt KB定义的功能分组。 提供了蛋白质名称或缩写及其国际蛋白质指数(IPI)标识符。 符合较低严格性的蛋白质列表可以在 表S4 .
细胞骨架和运输相关蛋白 法案1,IPI00194087 IAP与细胞骨架1的蛋白质连接,IPI00203373 伽玛-阿杜辛,IPI00209216 Coronin-1A,IPI00210071 造血系统调节肽,IPI00230925 发育调节脑蛋白,IPI00231407 Ttll12,IPI00361443 丛蛋白A2,IPI00363440(也可以列为膜蛋白) Tbc1d17,IPI00364330 Tpm1,IPI00391997 Intersectin-1,IPI00554196 星形细胞磷酸蛋白PEA-15,IPI00555213 蛋白质-L-异天冬氨酸(D-天门冬氨酸)O-甲基转移酶,IPI00555303 IPI00561918号 热休克蛋白1,IPI00566286 酪氨酸蛋白磷酸酶非受体23型,IPI00782007 catenin,α2,IPI00870129 Snx4,IPI00373092(也可被认为是内吞蛋白) 翻译、氨基酸生物合成和蛋白质折叠蛋白 清管器,IPI00194996 eif1b,IPI00196316 60S酸性核糖体蛋白P1,IPI00196316 IPI00365169 ER膜蛋白复合物亚基2,IPI00366247 真核翻译起始因子4H; IPI00370315 Rrbp1核糖体结合蛋白1,IPI00769110 IPI00870393 电话:00876578 Psat1,IPI00951316 突触末端的蛋白质,参与突触释放,或secre蛋白质 突触素-1,IPI00209284 突触蛋白-3,IPI00390215 颗粒蛋白,IPI00213847 前脑啡肽-A,IPI00324459 多肽,IPI00204373 络合剂2,IPI00190397 mRNA相关蛋白 钙调节热稳定蛋白1,IPI00201548 LSM5同源物,IPI00210564 NOP58核糖核蛋白,IPI00214536 Srpk2 SRSF,IPI00372013 CELF1,IPI00373642 U2sup,IPI00560940 Rbmxl1,IPI00763272 Snrpf,IPI00768974 血浆膜相关蛋白 Nlgn2,IPI00209308 Ephrin-B1,IPI00209416
为了验证蛋白质丰度的这些变化,并确定它们是否也在24小时出现,此时人类患者的临床症状有所改善( 2 , 三 ),我们将初级纹状体神经元暴露于氟哌啶醇24小时,并通过Western blot分析蛋白质丰度。 我们选择研究在感兴趣的蛋白质类中至少是低严格度“候选”的蛋白质的丰度:与翻译相关的蛋白质(核糖体蛋白S6)、细胞骨架[微管相关蛋白2(MAP2)]或形态复杂性[锚蛋白重复丰富膜跨越蛋白(ARMS)] 也称为220 kD的激酶D相互作用底物(Kidins220)]。 核糖体蛋白S6在4小时时大量增加,在暴露于氟哌啶醇24小时和48小时的样品中出现这种增加( 图3D , 表2 )表明抗精神病药物作用机制中蛋白质合成机制的增加具有长期作用。 MAP2是一种与神经元微管稳定性和形态学复杂性相关的体细胞树突蛋白( 32 ). 与蛋白质组数据一致( 表2 ),24小时氟哌啶醇暴露导致MAP2丰度增加( 图3D ). ARMS与分支和脊椎有关( 33 – 35 )并且在培养的纹状体神经元暴露于氟哌啶醇24小时和48小时后大量增加( 图3D , 表2 ). 我们还检测了GSK3β的丰度,在氟哌啶醇治疗24小时后,GSK3的丰度没有增加( 图3D )与未确定为候选的质谱结果一致( 表S2 ).
表2。 蛋白质蛋白质印迹和质谱分析总结。 候选严格性意味着丰度在一个实验中增加了1.2倍(处理/未处理蛋白质丰度的标准化比率),在至少一个其他独立实验中增加(完整列表见 表S4 ). Western blot增加或减少表示具有统计显著性或趋势水平的变化,如 图2 和 三 在质谱(MS)5小时屏幕和48小时质谱研究中测量的所有蛋白质的完整表格见 表S1 和 S2系列 分别是。
蛋白质 氟哌啶醇培养5小时 MS屏幕 氟哌啶醇培养4小时 蛋白质印迹 氟哌啶醇培养48小时 微软 氟哌啶醇培养24小时 蛋白质印迹 氟哌啶醇体内24小时 蛋白质印迹
RpS6系列 核糖体蛋白S6 增加 增加 增加(候选人严格性) 增加 未测试
电子EF2 真核延伸因子2 增加 增加 变量 未测试 未测试
手臂(Kidins220) 富含锚蛋白重复序列的膜跨蛋白 未检测到 未测试 增加(候选人严格性) 增加 增加
地图2 微管相关蛋白2 增加 未测试 增加(候选人严格性) 增加 增加
GSK3β 糖原合成酶激酶3β 未检测到 未测试 未更改 降低 未测试
氯菊酯 未改变(氯氰菊酯重链1 未更改 增加(氯菊酯重链1(不变为增加) 氯菊酯轻链(增加,候选严格性) 未测试 未测试
为了研究体内是否也发生了细胞骨架蛋白的变化,成年雄性小鼠经腹腔注射0.25 mg/kg氟哌啶醇,24小时后通过Western blot检测纹状体裂解物。 我们注意到ARMS和MAP2的丰度增加( 图3E )与培养神经元的蛋白质组分析和Western blot数据一致( 表2 ). 我们还注意到,24小时氟哌啶醇治疗在培养的大鼠纹状体神经元中诱导了270 kD MAP2免疫反应带的增加( 图3D 和 图S4A ). 氟哌啶醇还刺激小鼠纹状体裂解物中100-250kD之间的数条MAP2免疫反应带的丰度增加( 图3E )以及体外培养的纹状体神经元( 图S4B ). 当用MAP2 shRNA预处理体外纹状体神经元时,氟哌啶醇不会诱导这些额外的蛋白质物种( 图S4B ). 这些发现与报告的小鼠MAP2亚型数量高于大鼠一致( 36 ). 总之,氟哌啶醇诱导了参与细胞骨架结构和组织的蛋白质合成的特定变化,这表明氟哌啶醇可能会改变神经元形态。
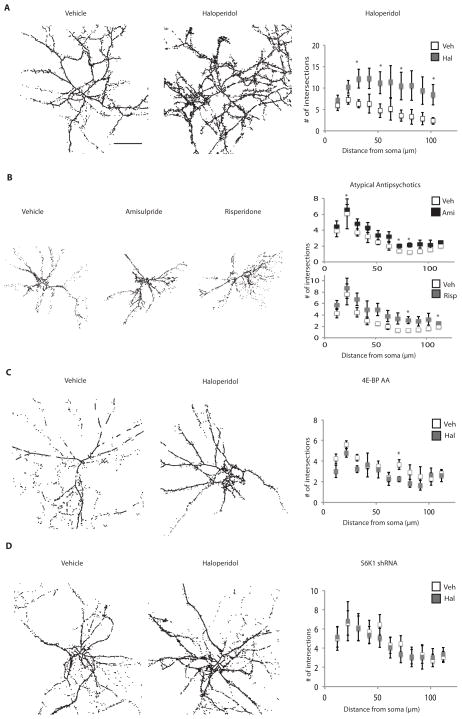
氟哌啶醇增加神经元复杂性 由于24小时接触氟哌啶醇会增加MAP2和ARMS的合成,这是调节神经元树状化的两个关键蛋白,我们认为抗精神病药物治疗可能导致形态复杂性的改变。 增强培养神经元形成生理相关形态学的能力( 37 ),我们共同培养了大鼠纹状体神经元和皮层神经元。 虽然有一些D 2 R阳性皮层神经元占总神经元数的比例很低。 因此,我们通过纹状体标记物DARPP32的染色来鉴定纹状体神经元( 38 ). DIV14之后( 图4 ),我们用氟哌啶醇处理神经元24小时,并通过对DARPP32阳性神经元的Sholl分析量化神经元复杂性( 39 ).
图4。 氟哌啶醇治疗导致纹状体DARPP32阳性神经元的形态学复杂性增加。
初级纹状体神经元与野生型皮层神经元共培养(2:3比例),生长至DIV14,并暴露于载体、氟哌啶醇、氨磺吡啶或利培酮中24小时。 用抗DARPP32抗体对神经元进行染色,并通过Sholl分析量化形态学复杂性。 所示图像经过线条增强,便于可视化。 在图像上量化体细胞100μm内的交点数量,无需进行线条增强。 ( A类 )氟哌啶醇对野生型纹状体神经元形态复杂性的影响。 (n=4,p<0.000001,分析的细胞数=19(溶媒治疗组),20(氟哌啶醇治疗组)( B类 )非典型抗精神病药物对野生型纹状体神经元形态复杂性的影响。 利培酮(n=3,p=0<0.002,分析的细胞数=24,用于载体治疗,23用于药物治疗); 阿米索必利(n=3,p<0.01,分析细胞=24,用于载体治疗,21用于药物治疗)。 ( C类 )氟哌啶醇对表达4E-BP AA的纹状体神经元的影响。4E-BP AA-表达纹状体神经细胞与上述野生型皮层神经元共培养,然后用多西环素诱导过夜,并暴露于氟哌啶醇24小时。 对DARPP32和4E-BP AA上HA标记均染色阳性的细胞进行Scholl分析。 ( 天 )氟哌啶醇对纹状体神经元的影响,其中S6K1被敲低。 如上所述,S6K1 shRNA表达的纹状体神经元与野生型皮层神经元共培养,并暴露于氟哌啶醇24小时。 对标记shRNA-表达细胞的DARPP32和GFP染色阳性的细胞进行Scholl分析。 (n=3,p=不显著)。 比例尺指示50μm。 所有显示的图表均为平均值±SEM。星号表示p≤0.06。
氟哌啶醇引发分支增加( 图4A )24小时后,对应于质谱和Western blot检测到细胞骨架蛋白增加的时间( 表2 ). 这种形态复杂性的增加也发生在接触非典型抗精神病药物阿米苏普利和利培酮的纹状体神经元中,尽管其反应不如氟哌啶醇强烈( 图4B ). 氟哌啶醇引起的形态复杂度增加被显性负4E-BP-AA的表达减弱( 图4C )或用S6K1靶向shRNA处理培养物( 图4D ),与涉及mTORC1信号传导的形态学变化一致。 因此,急性接触氟哌啶醇(24小时)可通过可能由mTORC1信号转导的翻译机制深刻影响树突状突起的分支和生长,这可能会改变信号整合和神经元的输出。
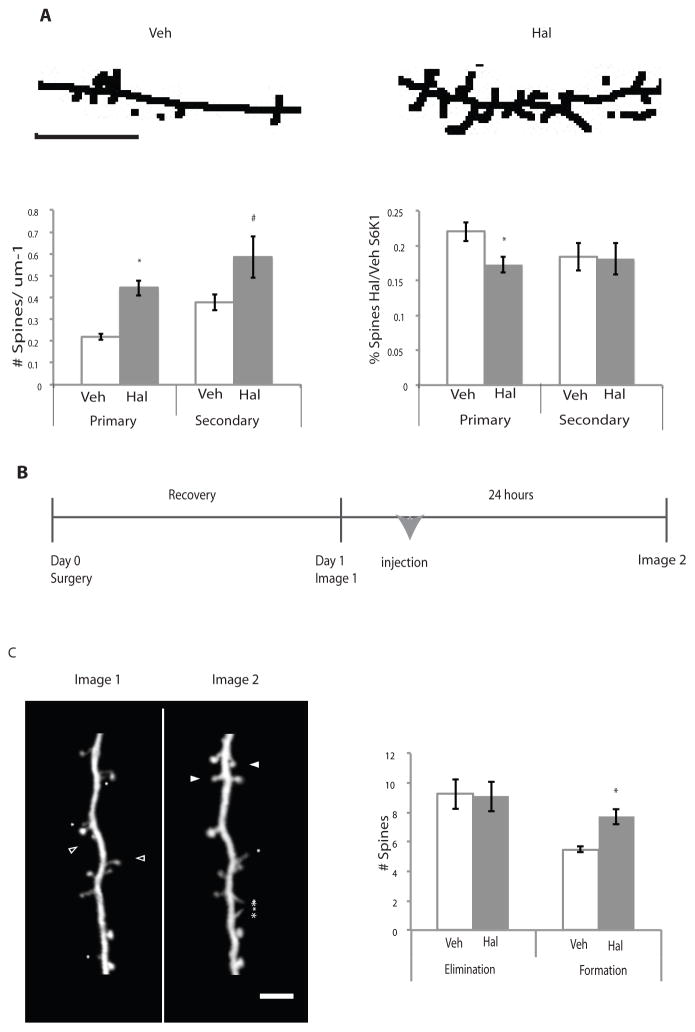
因为ARMS与脊柱稳定性和维护有关( 34 ),我们在暴露于氟哌啶醇24小时后,使用DARPP32抗体检测了DIV14培养的纹状体神经元的棘突外观( 图S5 ). 我们注意到,在氟哌啶醇治疗组中,来自胞体的初级突起和直接从初级突起分支的次级突起上的棘显著增加,这两种突起在表达S6K1 shRNA的神经元中都减弱了( 图5A ). 这些数据表明,氟哌啶醇以mTORC1依赖的方式增加脊椎的数量。
图5。 氟哌啶醇治疗导致体外纹状体神经元和体内皮层第5层锥体神经元的棘突增加。
( A类 )初级纹状体培养物与皮层神经元共培养,生长至DIV14,并用氟哌啶醇或载体治疗24小时。 使用ImageJ处理图像,并在可检测到的初级和次级投影上量化脊椎。 显示了具有代表性的骨骼图像,并对其进行了线条增强以实现可视化。 对符合规定标准(见材料和方法)的脊柱进行量化(n=4,p<0.0001)。 Primary(初级)表示脊椎在体细胞的初级投射上计数; secondary表示从主投影分支的次级投影上计数的脊椎。 比例尺指示5μm。 S6K1 shRNA处理的神经元( B类 )体内研究的实验程序。 一个月大的Thy-1 YFP小鼠在初始成像期(第0天)之前接受手术放置头部固定棒,进行成像,然后注射氟哌啶醇或载体,24小时后再次成像。 ( C类 )为了清晰起见,显示了经处理的大脑皮层Thy-1 YFP阳性神经元的代表性图像。 星号表示丝状伪足,闭合箭头表示形成的脊椎,开放箭头表示消除的脊椎。 绘制消除或形成的脊椎数。 (Veh=4,Hal=6,p=0.006)。 所有图表均为平均值±SEM,并通过Student t检验进行统计差异分析。 p≤0.05用星号表示。
氟哌啶醇诱导纹状体神经元的神经元形态复杂度和脊椎数量增加,纹状体是一个D丰度相对较高的脑区 2 与大脑其他区域相比,如大脑皮层。 我们研究了氟哌啶醇是否在其他D含量较低的区域引起形态变化 2 R、 如果我们能在体内观察到这些变化。 为了观察氟哌啶醇治疗动物的神经元形态,我们使用双光子显微镜观察了1个月大的Thy1-YFP小鼠额叶关联皮层上层第5层锥体神经元的棘,显示YFP+神经元的孤立表达( 40 ). 我们对Thy1-YFP小鼠一次性腹腔注射0.25 mg/kg氟哌啶醇,并在24小时后使用薄颅骨制剂检查脊椎的消除和形成( 图5B ) ( 40 ). 选择这个大脑区域是因为它对D呈阳性 2 R位于皮质层1/2和5,包含终止于纹状体的突起( 41 – 42 )并与灵长类动物的认知处理能力有关( 43 ). 我们注意到氟哌啶醇治疗24小时后,第5层锥体神经元顶端树突棘的形成显著增加,但没有消除( 图5C ). 因此,氟哌啶醇在24小时内改变了活体小鼠额叶结合皮层的脊柱形成。 在体外和体内观察到纹状体中细胞骨架相关蛋白的表达增加( 表2 )这些结果表明,氟哌啶醇急性诱导纹状体和皮层的形态学改变。
讨论 在这里,我们介绍了Akt-mTORC1信号通路在氟哌啶醇反应中的作用,导致纹状体神经元从头合成蛋白的诱导和形态复杂性的增加。 我们还提供了证据,证明第二代非典型抗精神病药物阿米磺吡啶和利培酮可以诱导这些从头蛋白质合成和形态复杂性的变化。 虽然我们不能排除其他细胞过程对抗精神病药物疗效的影响,但数据支持Akt-mTORC1诱导的从头合成蛋白变化在抗精神病药急性作用机制中发挥作用的观点。
Akt活性参与许多抗精神病药物的反应( 7 ); 然而,建议的下游靶点GSK3β可能无法完全解释抗精神病药物的作用机制。 在这里,我们证明了Akt-mTORC1通路的激活以及随后的蛋白质合成增加,这在抗精神病药物的作用中是没有描述过的。
观察到响应氟哌啶醇的Akt-mTORC1信号增加,这被Akt抑制剂和雷帕霉素减弱。 抗精神病药物引起的Akt活性增加的发现与以前的报道一致( 6 , 7 ); 然而,mTORC1信号的增加及其在抗精神病作用中的潜在作用尚未得到充分研究。 瓦尔詹特 等 在体内对氟哌啶醇的反应进行了S6磷酸化检查,并报告S6未受到影响( 44 ). S6反应性差异的一种解释可能是由于氟哌啶醇的不同剂量和给药方式。 我们还发现,另一个mTORC1靶点4E-BP也受到氟哌啶醇的类似调节。 此外,通过敲低mTORC1效应器S6K1,氟哌啶醇诱导的蛋白质合成变化显著减弱,这证明mTORC2正在调节氟哌啶醇的反应。 这些数据与Bonito-Oliva一致 等 . ( 45 )他证明氟哌啶醇以mTORC1依赖性方式诱导D 2 体内R阳性纹状体神经元。 因此,我们得出结论,Akt-mTORC1途径被氟哌啶醇激活,并诱导蛋白质合成的特定变化。
用显性负4E-BP(4E-BP-AA)抑制eIF4E或用shRNA抑制S6K1可减少氟哌啶醇诱导的蛋白质合成和形态复杂性增加。 这些数据与之前的报道相反,4E-BP是导致分裂细胞中mTORC1依赖性翻译的主要mTORC1effector( 26 ). 我们推测,氟哌啶醇诱导的蛋白质合成增加和随后的形态变化可能需要4E-BP磷酸化介导的翻译起始和S6K1磷酸化和活化介导的转换延长( 43 ). 这可能是分裂细胞和有丝分裂后神经元之间翻译控制的关键区别。
除了证明氟哌啶醇诱导Akt-mTORC1依赖性蛋白质合成变化外,蛋白质组学和细胞生物化学表明,参与翻译控制的蛋白质属于新合成的蛋白质,且丰度增加。 尽管经过几个小时的氟哌啶醇暴露后,蛋白质合成的基本速率恢复了,但与翻译相关的蛋白质的丰度仍在增加,这表明氟哌啶醇可能会启动神经元,使其能够快速合成蛋白质,并改变蛋白质组特征,以应对随后的刺激。
因为之前的研究表明,至少3周的慢性抗精神病药物治疗可以改变人类患者和啮齿动物大脑中的蛋白质丰度( 26 , 27 ),我们比较了48小时治疗后的蛋白质组分析,以确定在长期和短期治疗下是否有相同的蛋白质发生改变。 MAP2是一种经验证的蛋白质,符合蛋白质组研究中的候选标准( 图3 ),在mRNA转录水平上增加( 47 )其磷酸化状态增加( 48 ),进一步表明其在抗精神病药物反应中的作用。 将培养的纹状体神经元暴露于氟哌啶醇48小时后的蛋白质组数据与48种蛋白质进行比较,48种蛋白质在接受氟哌啶醇治疗21天的大鼠皮层中的丰度发生变化( 27 )结果显示,在35个共同测定的蛋白质中,有27个朝着同一方向移动。 其中,27个中的12个符合我们为候选蛋白设定的标准( 表S4 ). 与抗精神病药物治疗患者死后大脑皮层的蛋白质组研究相比较( 28 ),我们的蛋白质组数据也与之前观察到的抗精神病药物诱导的变化相关。 Chan测量的34种蛋白质 等 . ( 27 )共检测到19个蛋白质中,有13个蛋白质发生了相同方向的改变,其中6个符合候选标准( 表S4 ). 因此,这些动物和人类的结果表明,抗精神病药物通过增加mTORC1依赖性翻译来调节与神经元功能相关的蛋白质的丰度,这是一种趋同机制。
我们测量了大量蛋白质,并在纹状体神经元中获得了一个独特的翻译图谱,该图谱因抗精神病药物治疗而改变。 值得注意的是,我们的研究包括了与翻译和细胞骨架功能有关的经验证的蛋白质。 这里获得的数据集与在动物和人身上进行的慢性抗精神病药物治疗研究的数据集之间的共性进一步证实了本研究中观察到的新合成蛋白质丰度的变化不仅是短期接触药物的结果,也不是体外系统特有的结果。 此外,重叠可能表明这些变化可能不仅限于纹状体神经元,而是可能预示着其他D区的变化 2 研发 2 大脑中的R型电路。
除了响应氟哌啶醇激活mTORC1外,与mTORC1信号传导相关的具有5′-末端寡嘧啶(TOP)和TOP样序列的几种mRNA的翻译( 26 )已确定。 氟哌啶醇在早期和晚期都增加了这些mRNA编码的许多蛋白质( 表S3 ). 这些已知mTORC1靶点的相对丰度进一步支持了mTORC1-信号在抗精神病药物急性作用中的特定作用。
虽然这里提供的大多数数据是从体外培养系统收集的,但有多条证据表明其与患者和体内啮齿动物数据的相关性。 我们提供了氟哌啶醇治疗后分支和脊椎数量增加的证据,氟哌啶醇治疗依赖于mTORC1,并且在最初的24小时内出现。 这一发现也支持了先前临床MRI研究显示纹状体体积增加的结果,这可能是因为在使用典型抗精神病药物进行慢性治疗后纹状体分支增加,而使用非典型抗精神疾病药物治疗后纹状体分支增加[回顾于( 49 )]. 虽然我们注意到,当暴露于非典型抗精神病药物时,纹状体神经元的形态复杂度增加,但这种变化远不如暴露于氟哌啶醇时明显,这与人类患者的数据一致。
除了我们在大脑皮层观察到的脊椎形成增加外,暴露于非典型抗精神病药物的海马神经元中的轴突长度也增加( 50 )这表明,D 2 R不太丰富。 这些形态复杂性的增加与人类患者的报告一致,特别是在抗精神病药物治疗的早期阶段和在抗精神疾病药物治疗的啮齿动物中( 49 , 51 , 52 ). 相反,据报道,在服用抗精神病药物的啮齿动物和人类精神分裂症患者中,大脑体积减小,在对精神分裂症病人的尸检研究中观察到大脑皮层树突状分支和脊椎密度减少( 53 – 56 )这表明在精神分裂症的后期,连通性可能会下降。 治疗后期的体积减少与使用抗精神病药物治疗的患者和啮齿动物中观察到的纹状体体积增加不一致,后者与治疗反应呈正相关( 49 , 55 – 58 )我们在这里检测到的快速形态变化。 目前尚不清楚这种差异是由于治疗方案还是抗精神病药物未能阻止神经元随时间修剪所致。 尽管对这些体积变化的功能后果仍存在疑问,但确定其中一些变化的机制是探索抗精神病药物作用的重要一步,这将为今后的研究提供依据。
总之,我们已经提供了证据,证明抗精神病药物的一些观察到的作用与蛋白质合成机制的诱导有关。 我们将抗精神病药物刺激的Akt信号增强与mTORC1依赖的蛋白质合成增强联系起来,后者反过来增加了翻译机制组成部分的蛋白质丰度。 此外,抗精神病药物增加了细胞骨架相关蛋白的生成,这些蛋白与形态复杂度增加相关,这与先前报道的啮齿动物和患者数据一致。
材料和方法 质粒 如前所述,产生了强力霉素诱导的HA标记的T37A/T46A 4E-BP1双突变体(4E-BP AA)、空载体、野生型4E-BP、扰乱shRNA和S6K1 shRNA 3159( 24 ).
纹状体细胞培养 如前所述,从E17-18 C57Bl/6小鼠或E18-19 Sprague-Dawley大鼠胚胎中制备初级神经元( 59 )并在涂有0.1μg/ml聚-d-赖氨酸的平板上培养(用于DIV7神经元的Western blotting实验)或涂有0.1微克/毫升聚-d-鸟氨酸的盖玻片(用于DIV14-22神经元的免疫荧光和Sholl分析)。 纹状体神经元在Neurobased和B27(Invitrogen,Grand Island,NY)中生长。 电镀前,根据制造商在DIV0的说明,使用AMAXA核感染系统(Lonza,Allendale,NJ)通过电穿孔将强力霉素诱导的组成活性4E-BP AA、WT 4E-BP、空载体、S6K1 shRNA或干扰shRNA导入纹状体神经元。 Scramble构建物、S6K1 shRNA和MAP2 shRNA(宾夕法尼亚州匹兹堡开放生物系统公司)与GFP(新泽西州阿伦代尔市Lonza)共转染。 在用氟哌啶醇治疗前,用0.5μg/ml多西环素诱导4E-BP-AA过夜。 在氟哌啶醇治疗前,在10μM下使用S6K1抑制剂20分钟。 对于24小时内的药物治疗,神经元被血清饥饿,并用氟哌啶醇、阿米苏必利或利培酮(Sigma-Aldrich)治疗。 神经元预先用5μM Akt-VIII抑制剂(Akti)或125μM雷帕霉素(Sigma-Aldrich)孵育,然后用氟哌啶醇处理。 对于Western blotting,神经元在1×10 6 /6孔板中的孔。 对于免疫荧光,纹状体细胞培养在3.33×10 5 /12孔板中的盖卡瓦上的井。 在共同培养中,纹状体神经元以3:4的比例与皮层神经元一起培养14天。
用于原代细胞培养的Western Blot 处理后,根据前述方案裂解并制备细胞( 59 ). 大多数蛋白质印迹是在10%或12%丙烯酰胺凝胶上进行的。 4E-BP、磷酸化4E-BP,磷酸化Akt、总Akt,磷酸化S6和S6的抗体来自Cell Signaling(Danvers,MA)。 先前描述了识别ARMS(892)的抗体( 34 ). 识别GSK3β和氯氰菊酯的抗体来自Transduction Laboratories/BD Biosciences(加州圣何塞),识别MAP2的抗体来自Chemicon/Millipore(马萨诸塞州Billerica)。
免疫荧光 免疫荧光细胞被涂布在盖玻片上,生长7天,并固定在4%多聚甲醛/20%蔗糖中,并按前面所述进行染色( 59 ). 初级抗体识别pAkt或pS6(同上),DARPP32(小休·海明斯博士赠送)( 60 )]、HA(3F10,罗氏诊断,印第安纳波利斯)或GFP(abcam)。 使用配备60X相位3、NA 1.40油浸物镜的Eclipse E800显微镜和由NIS Elements F 3.0软件驱动的DigiSight单色相机(全尼康)拍摄了一些图像(纽约州梅尔维尔)。 使用图像J(美国国立卫生研究院)进行强度量化,方法是在原始图像文件中选择体感兴趣的区域(不包括细胞核),并测量每个视图中每个可见细胞的强度,每个封面的平均视图,减去背景,然后按治疗分组, 按车辆基线划分,并与其他治疗组进行比较。 共焦成像使用配备40x Plan Neofluor[数字孔径(NA)1.3]DIC油浸物镜(卡尔蔡司显微成像)的LSM 510激光扫描共焦显微镜进行。 对于Sholl分析,拍摄图像,增强对比度,手动去除DARPP32阳性细胞周围的背景,并对细胞进行骨骼化和检查。 使用ImageJ和Advanced Sholl Analysis插件处理图像( 37 ). 线路扩大只是为了便于演示( 图4D ),使用较薄的骨架线进行分析。 因为DARPP32存在于脊椎中( 61 ),使用ImageJ用DARPP32染色法对脊椎进行定量。 对距躯体前100μm处的脊椎进行分析,并根据以下标准进行鉴定,脊椎必须包含一个亮点,其颈部靠近大小至少为1μm×1μm的投影,并存在于至少两个1μm厚的z堆栈框架中。
SUnSET系列 /SILAC公司
纹状体培养物以3×10的速度生长 7 Neurobasic和B27(Invitrogen)中的细胞/治疗组。 48小时研究中使用的神经元被换成含有氟哌啶醇或载体的SILAC培养基,并在裂解前培养48小时。 在5小时的研究中,将细胞进行血清饥饿处理,并在SILAC培养基和1μg/ml嘌呤霉素中培养5小时,同时加入或不加入20 nM氟哌啶醇。 治疗后,细胞被裂解、离心以去除DNA和碎片,所有新生蛋白用识别嘌呤霉素的抗体进行免疫沉淀( 23 ).
由于SILAC氨基酸标签的重量与治疗组(溶媒或氟哌啶醇)相关,因此可以将样本合并并免疫沉淀在一起,以避免治疗组之间的偏差和差异。 免疫沉淀缓冲液为50 mM Tris-HCl(pH 8.0)、140 mM NaCl、1%NP-40和10%甘油。 用氟哌啶醇标记中位标签和载体筛选重标签进行一次嘌呤霉素-SILAC初始筛选(5小时研究)。 在48小时的研究中,进行了3个独立的生物复制:前向实验(氟哌啶醇有重标记,载体有中标记)和两个反向实验(标记被反转)。 用于48小时蛋白质组研究。 3 × 10 7 纹状体细胞/治疗组生长至DIV7,并在SILAC培养基中加入20nM氟哌啶醇或载体48小时。 如前所述进行样品制备和LC/MS分析( 29 ). 简单地说,免疫沉淀蛋白通过SDS-PAGE分离,用胰蛋白酶在凝胶中消化过夜。 将凝胶带切成小块,并在25 mM NH中脱色 4 HCO公司 三 /50%乙腈,用乙腈脱水并干燥。 将凝胶片用12.5ng/ml胰蛋白酶在25mM NH中的溶液再水合 4 HCO公司 三 并在37℃下孵育过夜。 用5%甲酸/50%乙腈提取两次肽,然后用乙腈进行最终提取。 样品通过真空离心浓缩至干燥,并在进一步分析之前用2%乙腈在0.1%甲酸中再溶解。
使用配备纳米电喷雾离子化源(杰米·希尔仪器服务公司)的LTQ-Orbitrap质谱仪,通过纳米流RPLC/MS分析产生的肽,并使用公开的方法制备质谱( 29 ). 对于48小时正向1小时和5小时屏幕样品,配备75μm×12-cm反相自组装柱(Reprosil C18,3μm,Dr.Maisch GmbH,德国)的Eksigent纳米LC系统(Eksigen Technologies)直接连接到质谱仪。 在110分钟内,用3%–40%乙腈和0.1%甲酸的梯度洗脱肽。在数据依赖模式下,使用Orbitrap进行一次60 000分辨率的MS扫描,并在LTQ中进行多达八次MS/MS扫描,同时进行Orbitrap扫描,以获得从每个扫描中选择的最强烈峰值的质谱。 Orbitrap测量扫描的自动增益控制目标值设置为500 000,LTQ MS/MS扫描的自动增量控制目标值为10 000。 测量扫描在剖面模式下采集,MS/MS扫描在质心模式下采集。
为了分析48小时反向SILAC样品,使用了与Q Exactive质谱仪(Thermo Fisher Scientific)耦合的Thermo Scientistic EASY-nLC 1000。 采用自组装75μm×50-cm反相柱(Reprosil C18,1.9μm,Dr.Maisch GmbH,Germany)进行肽分离。 以250 nL/min的流速,在240 min内用3–30%乙腈和0.1%甲酸的梯度洗脱肽。Q Exactive在数据依赖模式下操作,在m/z 400下以50000的分辨率进行测量扫描(瞬态时间=256 ms)。 从调查扫描中选出的前10个最丰富的前兆,其隔离窗为1.6汤姆逊,并被高能碰撞离解碎片化,归一化碰撞能量为27。 测量扫描和MS/MS扫描的最大离子注入时间分别为60 MS,两种扫描模式的离子目标值均设置为1000000。
蛋白质鉴定和定量 使用MaxQuant计算蛋白质组学平台版本1.2.0.18处理原始文件。 根据IPI大鼠蛋白质数据库(3.68版)搜索片段光谱,允许最多两次遗漏胰蛋白酶裂解。 半胱氨酸的氨基甲酰化被设定为固定修饰。 蛋氨酸氧化,蛋白质N-末端乙酰化,D 4 -赖氨酸, 13 C类 6 -精氨酸, 13 C类 6 -15亿 2 -赖氨酸,以及 13 C类 6 - 15 N个 4 -精氨酸被用作数据库搜索的变量修改。 对于LTQ-Orbitrap数据,前体和碎片质量容差分别设置为7 ppm和0.5 Da。 对于Q Exactive数据,前体和碎片质量容差分别设置为7 ppm和20 ppm。 基于诱饵数据库搜索的估计肽和蛋白质假阳性率为1%。
蛋白质组数据分析 根据UniProtKB上的描述,人工将识别的蛋白质分类为(i)翻译相关蛋白(伴侣蛋白、折叠蛋白、核糖体蛋白和tRNA合成酶),(ii)细胞骨架相关蛋白(肌动蛋白、微管、细胞骨架结合蛋白、细胞骨架修饰剂和运动蛋白),(iii) 膜结合蛋白,(iv)膜信号蛋白(与膜相互作用并具有直接信号级联的蛋白),(v)转录和核蛋白,(vi)mRNA处理蛋白(前mRNA到mRNA的转运和剪接到实际的核糖体相互作用),(vii)转运蛋白(内吞和细胞器处理), (viii)与降解相关的蛋白质(例如,那些参与蛋白酶体介导的降解、溶酶体蛋白质或任何其他蛋白质分解过程的蛋白质),(ix)与突触释放相关的蛋白(积极参与突触胞吐),(x) 参与翻译后修饰的蛋白质,不属于已知信号复合体的一部分,(xi)线粒体蛋白质,(xii)与脂肪代谢相关的蛋白质,以及(xiii)其他未分类的蛋白质。 在所有三个实验中变化不一致的蛋白质或仅在一个实验中测量的蛋白质不包括在分析中。 选择增加1.2倍的临界值(氟哌啶醇/载体的蛋白质量比率为1.2(到一个显著数字)或更大),因为Western blot可以可靠地检测到该范围内的报告变化,并且以前在文献中的神经元质谱分析中也使用过该值( 30 ). 候选人必须在三次重复中至少被测量和增加两次的标准也是基于以前的出版物( 29 , 31 ). 那些在同一方向上至少有一个其他变化的情况下变化了1.2倍的蛋白质被宣布为低严格候选。 那些变化了1.2倍,但三次都在同一方向上发生了变化,即中等强度。 那些在同一方向上至少有两次变化超过1.2倍的人被宣布为高度严格。 然后从候选蛋白库中选择三种低严格度候选蛋白进行验证。 使用非正常肽比率计算这些候选的显著性,并对每个质谱实验进行t检验分析。
体内实验:给小鼠注射氟哌啶醇 成年雄性C57/Bl6小鼠经腹腔注射0.25 mg/kg氟哌啶醇或溶于0.9%盐水中的载体(DMSO),并返回笼子24小时。 通过颈椎脱位处死动物,在冰上对纹状体进行显微解剖,并对组织进行快速冷冻。 纹状体裂解物在存在磷酸酶和蛋白酶抑制剂的冰上进行超声处理,并通过Western blot进行分析。 裂解缓冲液如所述( 13 ).
双光子成像 1个月大的Thy1-YFP阳性小鼠接受了杆植入手术,以固定头部,并在待成像区域将颅骨减薄至20μm:0.2×0.2 mm区域,中心位于+2.8 mm Bregma,+1.2 mm中线[额叶联合皮质(第0天)]。 动物被允许恢复24小时,然后进行成像( 40 )然后,将0.25 mg/kg氟哌啶醇或溶于0.9%生理盐水中的溶媒注射到它们的笼子中。 24小时后,相同的树突被重新破坏。 ImageJ软件用于分析图像堆栈。 从不同时间点采集的具有高图像质量(信噪比>4:1)的三维堆栈中识别出相同的树突状片段。 树突突起的数量和位置(突起长度超过树突轴直径的三分之一)在每个视图中都进行了识别,而之前对动物的治疗一无所知。 丝足被鉴定为长而薄的结构(通常大于平均脊柱长度的两倍,头部直径与颈部直径之比<1.2:1,长度与颈部直径的比>3:1)。 其余突起被归类为脊椎。 没有分离出棘的亚型。 使用三维堆栈确保组织运动和成像间隔之间的旋转不会影响脊柱识别。 如果脊柱或丝状伪足的位置与相对相邻的地标保持相同的距离,则认为它们在不同视图之间是相同的。 如果根据第一个视图,脊柱与预期位置的距离超过0.7 mm,则视为不同。
统计分析 在GraphPad Prism、InStat软件(GraphPad软件,加利福尼亚州,美国)或Microsoft Office Excel中进行统计分析。 为了比较两组,使用了Student的双尾t检验。 为了进行多组比较,采用了单向单因素方差分析。 对于Sholl分析的统计分析,使用了Kolmogorov–Smirnov检验,发现总体正常,因此使用了逐点学生t检验。 除非另有说明,否则显著性设为p<0.05,趋势水平设为p<0.1。
补充材料
补充数据 补充图1:氟哌啶醇介导的pAkt反应的表征。
补充图2:用于基因操作的嘌呤霉素剂量和控制实验。
补充图3:测量蛋白质的蛋白质组分析
补充图4:体外与小鼠纹状体神经元或大鼠纹状体神经细胞中MAP2抗体反应的氟哌啶醇诱导蛋白。
补充图5:DARPP32可以标记DIV14培养的纹状体神经元的棘
补充表3 补充表3:氟哌啶醇诱导与mTORC1信号相关的蛋白质增加
补充表4 补充表4:来自细胞骨架、翻译、mRNA、膜和释放蛋白组的候选蛋白质
补充表5:感兴趣的选定蛋白质的3个生物复制的统计显著性
致谢 我们感谢小休·海明斯(Hugh Hemmings,Jr.)和菲利普·皮埃尔(Philippe Pierre)慷慨捐赠抗体(分别为DARPP32和嘌呤霉素),并感谢伊恩·莫尔(Ian Mohr)的实验室对SK61 shRNA、显性阴性4E-BP AA、WT和plko.3的干扰。 我们感谢Freddy Jeanneteau、Emanuela Santini、Hanoch Kaphzan以及Klann和Chao实验室的支持和讨论; Jeffrey Savas讨论蛋白质组分析。 此外,我们要感谢罗伯特·施耐德和唐纳德·戈夫对手稿的贡献。
资金:这项工作得到了NIH的支持(向HB提供培训拨款T32 MH019524-20;向EK提供NS034007和NS047384;向MVC提供NS21072和HD23315;向TAN提供NS050276和RR017990)。
脚注
作者贡献:H.B、G.Z、A.B.和L.M.P执行并分析了数据。 H.B.、C.A.H.T.A.N、K.D.、W-B G.、E.K.和M.V.C.设计了实验并撰写了论文。
工具书类
1 Lieberman JA、Stroup TS、McEvoy JP、Swartz MS、Rosenheck RA、Perkins DO、Keefe RS、Davis SM、Davis CE、Lebowitz BD、Severe J、Hsaio JK。 干预有效性临床抗精神病试验(CATIE)研究人员。 抗精神病药物对慢性精神分裂症患者的疗效。 《新英格兰医学杂志》。 2005; 353:1209–1223. doi:10.1056/NEJMoa051688。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Kapur S、Arenovich T、Agid O、Zipursky R、Lindborg S、Jones B。治疗后24小时内抗精神病药物起效的证据。 美国精神病学杂志。 2005; 162:939–946. doi:10.1176/appi.ajp.162.5.939。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Wright P、Lindborg SR、Birkett M、Meehan K、Jones B、Alaka K、Ferchland-Howe I、Pickard A、Taylor CC、Roth J、Battaglia J、Bitter I、Chouinard G、Morris PL、Breier A.肌肉注射奥氮平和肌肉注射氟哌啶醇治疗急性精神分裂症:治疗前24小时的抗精神病疗效和锥体外系安全性。 加拿大精神病学杂志。 2003; 48(11):716–21. doi:10.1177/070674370304801102。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
4 Volavka J、Cooper TB、Czobor P、Meisner M.精神分裂症和分裂情感障碍患者的血浆氟哌啶醇水平和临床疗效。 普通精神病学档案。 1995; 52(10):837–45. doi:10.1001/archpsyc.1995.03950220047010。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
5 Bunney BS。抗精神病药物对多巴胺能神经元电活动的影响。 神经科学趋势。 1984; 7:212–5. [ 谷歌学者 ]
6 Emamian ES,D厅,Birnbaum MJ,Karayiorgou M,Gogos JA。 精神分裂症AKT1-GSK3β信号受损的一致证据。 自然遗传学。 2004; 36(2):131–137. doi:10.1038/ng1296。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
7 Del’Guidice T,Lemasson M,Beaulieu JM.基底神经节多巴胺受体下游β-arrestin 2的作用。 神经解剖学前沿。 2011; 5(58)doi:10.3389/fnana.2011.00058。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
8 Jope RS,Roh MS,《精神疾病和治疗干预中的糖原合酶激酶-3(GSK3)》。 当前药物目标。 2006; 7(11):1421–1434. doi:10.2174/1389450110607011421。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
9 Leucht S、Kissling W、McGrath J.锂治疗精神分裂症。 Cochrane系统评论数据库。 2003; (3) :CD003834。 doi:10.1002/14651858.CD003834。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
10 霍尔特·CE,舒曼·EM。中心法则分散:RNA功能和神经元局部翻译的新视角。 神经元。 2013; 80(3):648–657. doi:10.1016/j.neuron.2013.10.36。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Antion MD、Merhav M、Hoeffer CA、Reis G、Kozma SC、Thomas G、Schuman EM、Rosenblum K、Klann E.移除S6K1和S6K2会导致学习、记忆和突触可塑性的不同改变。 学习和记忆。 2008; 15(1):29–38. doi:10.1101/lm.661908。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Hoeffer CA、Cowansage KK、Arnold EC、Banko JL、Moerke NJ、Rodriguez R、Schmidt EK、Lloyd RE、Pierre P、Wagner G、LeDoux JE、Klann E.翻译因子eIF4E和eIF4G之间相互作用的抑制会损害长期联想记忆巩固,但不会影响再巩固。 美国国家科学院院刊。 2011; 108(8):3383–8. doi:10.1073/pnas.1013063108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
13 Bhattacharya A、Kaphzan H、Alvarez-Dieppa AC、Murphy JP、Pierre P、Klann E。p70 S6激酶1的基因去除可纠正脆性X综合征小鼠的分子、突触和行为表型。 神经元。 2012; 76(2):325–37. doi:10.1016/j.neuron.2012.07.022。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
14 Santini E,Klann E.调节失调的mTORC1依赖性翻译控制:从大脑疾病到精神活性药物。 行为神经科学前沿。 2011; 5:76. doi:10.3389/fnbeh.2011.00076。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
15 Meyuhas O.核糖体蛋白S6的生理作用:其类型之一。 细胞和分子生物学国际评论。 2008; 268:1–37. doi:10.1016/S1937-6448(08)00801-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
16 Ruvinsky I,Meyuhas O.核糖体蛋白S6磷酸化:从蛋白质合成到细胞大小。 生物化学科学趋势。 2006; 31(6):342–348. doi:10.1016/j.tibs.2006.04.003。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
17 Beaulieu JM、Tirotta E、Sotnikova TD、Masri B、Salahpour A、Gainetdinov RR、Borrelli E、Caron MG。体内D2和D3多巴胺受体对Akt信号的调节。 神经科学杂志。 2007; 27(4):881–5. doi:10.1523/JNEUROSCI.5074-06.2007。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
18 Bertran-Gonzalez J、Bosch C、Maroteaux M、Matamales M、Herve D、Valjent E、Girault JA。 多巴胺D1和D2受体表达纹状体神经元对可卡因和氟哌啶醇反应的信号激活模式相反。 神经科学杂志。 2008; 28(22):5671–5685. doi:10.1523/JNEUROSCI.1039-08.2008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
19 Donnelly L、Waraich PS、Adams CE、Hamill KM、Marti J、Roque I、Figuls M、Rathbone J.氟哌啶醇治疗精神分裂症急性期的剂量。 Cochrane系统评价数据库。 2010年:CD001951。 doi:10.1002/14651858.CD001951.pub2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
20 Seeman P,Lee T.抗精神病药物:临床疗效与多巴胺神经元突触前作用之间的直接关系。 科学。 1975; 188(4194):1217–9. doi:10.1126/science.1145194。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
21 Okuzumi T、Fiedler D、Zhang C、Gray DC、Aizenstein B、Hoffman R、Shokat KM。Akt激活的抑制剂劫持。 自然化学生物学。 2009; 5(7):484–93. doi:10.1038/nchembio.183。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
22 Santini E、Huynh TN、MacAskill AF、Carter AG、Pierre P、Ruggro D、Kaphzan H、Klann E。过度翻译会导致与自闭症相关的突触和行为异常。 自然。 2013; 493(7432):411–5. doi:10.1038/nature11782。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
23 Schmidt EK、Clavarino G、Ceppi M、Pierre PP.SUnSET,一种监测蛋白质合成的非放射性方法。 自然方法。 2009; 6(4):275–7. doi:10.1038/nmeth.1314。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
24 Kobayashi M,Wilson AC,Chao MV,Mohr I.通过轴突mTOR信号和4E-BP翻译阻遏物控制神经元中的病毒潜伏期。 基因与发育。 2012; 26:1527–1532. doi:10.1101/gad.190157.112。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
25 Pearce LR、Alton GR、Richter DT、Kath JC、Lingardo L、Chapman J、Hwang C、Alessi DR。p70核糖体S6激酶(S6K1)新型高度特异性抑制剂PF-4708671的表征。生物化学杂志。 2010; 432(2):245–255. doi:10.1042/BJ20101024。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
26 Thoreen CC,Chantranupong L,Keys HR,Wang T,Gray NS,Sabatini DM。mTORC1介导的mRNA翻译调控的统一模型。 自然。 2012; 485(7396):109–13. doi:10.1038/nature11083。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
27 Ma D,Chan MK,Lockstone HE,Pietsch SR,Jones DN,Cilia J,Hill MD,Robbins MJ,Benzel IM,Umrania Y,Guest PC,Levin Y,Maycox PR,Bahn S.抗精神病治疗改变与大鼠额叶皮层突触前功能和神经系统发育相关的蛋白表达。 蛋白质组研究杂志。 2009; 8(7):3284–97. doi:10.1021/pr800983p。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
28 Chan MK,Tsang TM,Harris LW,Guest PC,Holmes E,Bahn S.精神分裂症患者死后大脑中疾病和抗精神病药物作用的证据。 分子精神病学。 2011; 16(12):1189–202. doi:10.1038/mp.2010.100。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
29 Spellman DS、Deinhardt K、Darie CC、Chao MV、Neubert TA。 培养的原代神经元中氨基酸的稳定同位素标记:应用于脑源性神经营养因子依赖的磷酸酪氨酸相关信号。 分子和细胞蛋白质组学。 2008; 7(6):1067–76. doi:10.1074/mcp。 M700387-MCP200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
30 Butko MT、Savas JN、Friedman B、Delahunty C、Ebner F、Yates JR、III、Tsien RY。体感皮层突触的体内定量蛋白质组学显示哪些蛋白质水平受到感觉剥夺的调节。 美国国家科学院院刊。 2013; 110(8):E726–35。 doi:10.1073/pnas.1300424110。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
31 Hodas JJ、Nehring A、Höche N、Sweredoski MJ、Pielot R、Hess S、Tirrell DA、Dieterich DC、Schuman EM。通过生物正交非经典氨基酸标记(BONCAT)蛋白质组学鉴定的海马神经膜蛋白质组的多巴胺能调节。 2012; 12(15–16):2464–76. doi:10.1002/pmic.201200112。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 Harada A、Teng J、Takei Y、Oguchi K、Hirokawa N。树突伸长、树突中的PKA锚定和适当的PKA信号转导都需要MAP2。 细胞生物学杂志。 2002; 158(3):541–549. doi:10.1083/jcb.200110134。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
33 Chen Y、Fu WY、Ip JP、Ye T、Fu AK、Chao MV、Ip NY。 富含锚蛋白的跨膜蛋白(kidins220)是神经营养素和肾上腺素受体依赖性树突发育所必需的。 神经科学杂志。 2012; 2(24):8263–8269. doi:10.1523/JNEUROSCI.1264-12.2012。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
34 Wu SH,Arevalo JC,Sarti F,Tessarolo L,Gan WB,Chao MV。富含锚蛋白重复序列的膜生成/Kidins220蛋白在体内调节树突分支和脊柱稳定性。 发育神经生物学。 2009; 69(9):547–57. doi:10.1002/dneu.20723。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
35 Neubrand VE、Cesca F、Benfenati F、Schiavo G.Kidins220/ARMS作为多受体信号通路的功能介质。 细胞科学杂志。 2012; 125(8):1845–1854. doi:10.1242/jcs.102764。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
36 E! 合奏.org
37 Penrod RD、Kourrich S、Kearney E、Thomas MJ、Lanier LM。 用于研究纹状体中层棘神经元树突状棘发育和可塑性的胚胎培养系统。 神经科学方法杂志。 2011; 200(1):1–13. doi:10.1016/j.jneumeth.2011.05.029。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
38 Walaas SI、Greengard P.DARPP-32,一种多巴胺和周期性AM P调节的神经元磷蛋白。 一级结构和与蛋白磷酸酶抑制剂-1的同源性。 生物化学杂志。 1984; 61:1890–1903. [ 公共医学 ] [ 谷歌学者 ]
39 Ferreira TA、Iacono LL、Gross CT。血清素受体1A调节肌动蛋白动力学并限制海马神经元的树突状生长。 欧洲神经科学杂志。 2010; 32(1):18–26. doi:10.1111/j.1460-9568.2010.07283.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
40 Yang G、Pan F、Chang PC、Gooden F、Gan WB。 清醒的头枕紧张小鼠大脑皮层突触结构的经颅双光子成像。 分子生物学方法。 2013; 1010:35–43. doi:10.1007/978-1-62703-411-1-3。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
41 脑图谱
42 Bouthenet ML、Martres MP、Sales N、Schwartz JC。 通过[125I]碘磺酸盐放射自显影术对大鼠中枢神经系统多巴胺D-2受体进行详细定位。 神经科学。 1987; 20(1):117–155. doi:10.1016/0306-4522(87)90008-x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
43 Goldman-Rakic PS.认知拓扑:灵长类动物联想皮层中的并行分布式网络。 神经科学年度评论。 1988; 11:137–56. doi:10.1146/annurev.ne.11.030188.001033。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
44 Valjent E、Bertran-Gonzalez J、Bowling H、Lopez S、Santini E、Matamales M、Bonito-Oliva A、Herve D、Hoeffer C、Klann E、Girault JA、Fisone G.氟哌啶醇通过激活PKA和DARPP-32的磷酸化调节核糖体蛋白S6的磷酸化状态。 神经精神药理学。 2011; 36:2561–2570. doi:10.1038/npp.2011.144。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
45 Bonito-Oliva A、Pallottino S、Bertran-Gonzalez J、Girault JA、Valjent E、Fisone G.氟哌啶醇通过多巴胺和cAMP调节的32 kDa磷酸蛋白促进核糖体蛋白S6的mTORC1依赖性磷酸化,并抑制蛋白磷酸酶-1。 神经药理学。 2013; 72:197–203. doi:10.1016/j.neuropharm.2013.04.043。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
46 Silvera D、Formenti SC、Schneider RJ。癌症转化控制。 《自然》杂志评论癌症。 2010; 10:254–266. doi:10.1038/nrc2824。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
47 Law AJ、Hutchinson LJ、Burnet PW、Harrison PJ。 抗精神病药物增加大鼠海马和皮层中微管相关蛋白2 mRNA,但不增加棘球蛋白mRNA。 神经科学研究杂志。 2004; 76(3):376–82. doi:10.1002/jnr.20092。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
48 Lidow MS、Song ZM、Castner SA、Allen PB、Greengard P、Goldman-Rakic PS。抗精神病治疗导致灵长类大脑皮层多巴胺丰富区域的树突和棘相关蛋白发生改变。 生物精神病学。 2001; 49(1):1–12. doi:10.1016/s0006-3223(00)01058-1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
49. Navari S,Dazzan P。抗精神病药物会影响大脑结构吗? MRI检查结果的系统和批判性回顾。 心理医学。 2009; 39(11):1763–77. doi:10.1017/S0033291709005315。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
50 Park SW、Lee CH、Cho HY、Seo MK、Lee JG、Lee BJ、Seol W、Kee BS、Kim YH。 抗精神病药物对海马神经元培养物中突触蛋白表达和树突状突起生长的影响。 突触。 2013; 67(5):224–34. doi:10.1002/syn.21634。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
51 Benes FM,Paskevich PA,Domesick VB。氟哌啶醇诱导大鼠黑质轴突终末的可塑性。 科学。 1983; 221(4614):969–71. doi:10.1126/science.6879197。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
52 Meredith GE、De Souza IE、Hyde TM、Tipper G、Wong ML、Egan MF。抗精神病药诱导运动障碍大鼠伏隔核壳内树突、棘和强啡肽能突触的持续性改变。 神经科学杂志。 2000; 20(20):7798–806. doi:10.1523/JNEUROSCI.20-20-07798.2000。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
53 Glantz LA,Lewis DA。精神分裂症患者前额皮质锥体神经元的树突棘密度降低。 普通精神病学档案。 2000; 57(1):65–73. doi:10.1001/archpsyc.57.165。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
54 Kreczmanski P、Heinsen H、Mantua V、Woltersdorf F、Masson T、Ulfig N、Schmidt-Kastne R、Korr H、Steinbusch HW、Hof PR、Schmitz C.精神分裂症五个皮层下区域的体积、神经元密度和总神经元数。 大脑。 2007; 130(第3部分):678–92。 doi:10.1093/brain/awl386。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
55 Ho BC、Andreasen NC、Ziebell S、Pierson R、Magnotta V。长期抗精神病药物治疗和脑容量:首发精神分裂症的纵向研究。 普通精神病学档案。 2011; 68(2):128–37. doi:10.1001/archgen精神病学2010.199。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
56 Vernon AC、Natesan S、Modo M、Kapur S。慢性抗精神病药物治疗对大脑结构的影响:一项体外和尸检证实的系列磁共振成像研究。 生物精神病学。 2011; 69(10):936–44. doi:10.1016/j.biopych.2010.11.010。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
57 Hutcheson NL、Clark DG、Bolding MS、White DM。未服药精神分裂症患者的基底节容积与抗精神病药物治疗反应相关。 精神病学研究。 2013年doi:10.1016/j.pscychresns.2013.10.002。 Epub提前打印。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
58 Okugawa G、Nobuhara K、Takase K、Saito Y、Yoshimura M、Kinoshita T。奥氮平增加精神分裂症患者尾状核的灰质和白质体积。 神经心理生物学。 2007; 55(1):43–6. doi:10.1159/000103575。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
59 Deinhardt K、Kim T、Spellman DS、Mains RE、Eipper BA、Neubert TA、Chao MV、Hempstead BL。神经生长锥回缩依赖于Rac传递的前神经营养素受体信号。 科学信号。 2011; 4(202):ra82。 doi:10.1126/scisional.20020。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
60 Bálint E,Kitka T,Zachar G,Adám A,Hemmings HC,Jr,Csillag A.DARPP-32在家鸡纹状体-被盖回路中的丰度和位置。 化学神经解剖学杂志。 2004; 28(1–2):27–36. doi:10.1016/j.jchemneu.2004.05.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
61 Ouimet CC,Greengard P.DARPP-32在基底神经节的分布:电子显微镜研究。 神经细胞学杂志。 1990; 19(1):39–52. doi:10.1007/BF01188438。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。
补充资料
补充数据 补充图1:氟哌啶醇介导的pAkt反应的表征。
补充图2:用于基因操作的嘌呤霉素剂量和控制实验。
补充图3:测量蛋白质的蛋白质组分析
补充图4:体外与小鼠纹状体神经元或大鼠纹状体神经细胞中MAP2抗体反应的氟哌啶醇诱导蛋白。
补充图5:DARPP32可以标记DIV14培养的纹状体神经元中的棘
补充表3 补充表3:氟哌啶醇诱导与mTORC1信号相关的蛋白质增加
补充表4 补充表4:来自细胞骨架、翻译、mRNA、膜和释放蛋白组的候选蛋白质
补充表5:感兴趣的选定蛋白质的3个生物复制的统计显著性