肝细胞癌(HCC)是世界上第五大常见癌症,也是导致癌症相关死亡的第三大常见原因。1,2尽管目前使用肝切除术和肝移植来提高根治性治愈率,三由于肝内外转移和术后复发,复发率仍然很高。4,5在发生显性转移之前,肿瘤细胞会从原发肿瘤扩散到远处,如血液循环、骨髓或淋巴系统。6由于血行播散是肝癌转移的主要途径,7检测循环肿瘤细胞(CTC)可能是对当前用于肿瘤分期和监测治疗反应的诊断技术的补充。8然而,CTC的表型改变可能影响预后评估的准确性。9有趣的是,最近的一份报告表明,CTC中存在间充质标记物可以更准确地预测不良预后。10
上皮-间充质转化(EMT)是一个复杂的过程,使上皮细胞具有更强的转移和侵袭潜能。11EMT的一个特征是上皮特性的丧失,例如细胞粘附分子E-cadherin的表达减少,间充质表型的获得伴随着波形蛋白的表达增加。EMT相关转录因子,如twist、snail、slug、ZEB1和ZEB2,协调EMT并实现转移的早期步骤,主要包括肿瘤细胞的局部侵袭和随后向远处扩散。12这些转录因子通过与E-cadherin基因启动子中的E-box结合来抑制E-cadherin的表达,进而促进EMT。13,14,15,16,17据报道,EMT标记物snail、twist和slug在肝癌中表达,并证实了snail和twist对肝癌转移的独立协同作用。18此外,一些EMT转录因子的高表达已被用于评估整体生存率和无病生存率。19
扩散到循环中的CTC似乎是一个非常异质的细胞群体,具有建立远处转移的可变潜力。20,21CTC通过表型改变从原发肿瘤扩散,使细胞穿透血管。6,22根据对小鼠模型和人类肿瘤细胞系的研究,EMT的异常激活与这一过程有关。23,24最近一份关于CTC中EMT标记物表达与乳腺癌进展之间的相关性的报告鼓励了关于CTC和癌症进展中EMT相关标记物表达的未来研究。25此外,最近的研究表明,波形蛋白在乳腺癌和晚期前列腺癌患者的CTC中表达。11,26然而,目前尚不清楚EMT相关标记物是否在CTC中表达或参与HCC的进展。
由于EMT似乎在促进肿瘤细胞亚群向更具攻击性表型的进化中发挥作用,因此确定EMT是否发生在HCC组织中,并将EMT的发生与CTC的形成联系起来,将是非常有趣的。此外,研究EMT相关标记物是否在CTC中表达以及它们的表达水平是否可以作为HCC患者的预后因素将具有极其重要的意义。
结果
生物素化无唾液酸胎球蛋白能敏感、特异地标记肝癌细胞
据报道,去唾液酸糖蛋白受体(ASGPR)在人肝癌细胞系中独家表达。27与此相一致,我们的结果证实了生物素化无唾液酸胎球蛋白与ASGPR表达细胞之间相互作用的特异性。生物素化无唾液酸胎球蛋白能有效结合人肝癌细胞株HepG2、MHC97H、PLC、SMMC-7721、SK-Hep1;然而,它与非肝癌细胞株MGC-803和HeLa的相互作用较差(图1). 当我们使用siRNA寡核苷酸干扰肝癌细胞系中ASGPR的表达时(补充图1),与HepG2或PLC结合的生物素化无唾液酸胎球蛋白显著减少。这些结果证实了生物素化无唾液酸胎球蛋白与肝癌细胞之间的特异性相互作用。
图1。
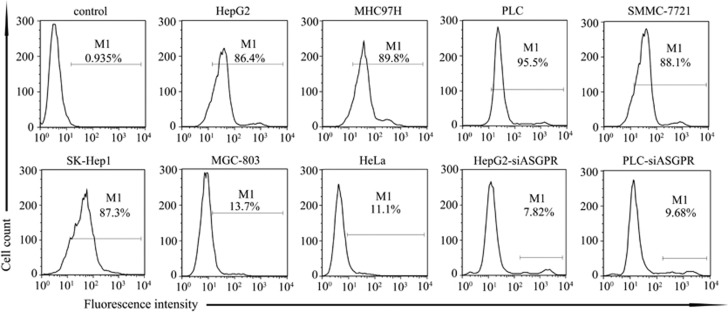
流式细胞术分析证实了生物素化无唾液酸胎球蛋白与ASGPR的特异性结合。HepG2、MHC97H、PLC、SMMC-7721和SK-Hep1是表达ASGPR的人肝癌细胞系。人胃癌细胞株MGC-803和HeLa人宫颈腺癌细胞株ASGPR均为阴性。所有细胞均使用生物素化无唾液酸胎球蛋白和抗生物素荧光素异硫氰酸盐(FITC)进行染色,但不包括用PBS和抗生素FITC染色的HepG2细胞,后者作为对照。在HepG2和PLC细胞中敲除ASGPR后,在这两个细胞系中几乎检测不到生物素化的无唾液酸胎球蛋白结合
CTC可作为评价HCC进展和预后的有效指标
从HCC患者样本中获得的CTC的特征包括较大的细胞大小、完整的细胞核和较高的核质比。HCC患者的CTC HSA和DAPI染色阳性,CD45染色阴性(图2a). 从60例HCC患者中46例(76.7%)的血样中分离出CTC。门静脉癌栓患者CTCs阳性率(96.9%)明显高于无门静脉癌血栓患者(53.6%)P(P)<0.001) (表1). Edmondson–Steiner III级或IV级患者的CTC阳性率(87.5%)显著高于I级或II级患者(33.3%)P(P)=0.005)(表1). 在米兰标准以外的患者中,CTC的阳性率(90.5%)也显著高于米兰标准以内的患者(44.4%)P(P)<0.001)(表1). Spearman的秩相关分析表明,CTC的阳性率与肿瘤大小高度相关(第页=0.371,P(P)=0.003)(表1). 此外,CTC的阳性率与TNM分期密切相关,从I期的47.4%到IV期的100%(第页=0.471,P(P)<0.001) (表1). 然而,CTC的阳性率与其他临床病理因素,如年龄、性别、病因、Child-Pugh分级、肝硬化、血清AFP水平或肿瘤数之间没有显著相关性(表1). 健康志愿者或诊断为良性肝病或非肝癌的患者的血液样本中均未检测到CTC。
图2。
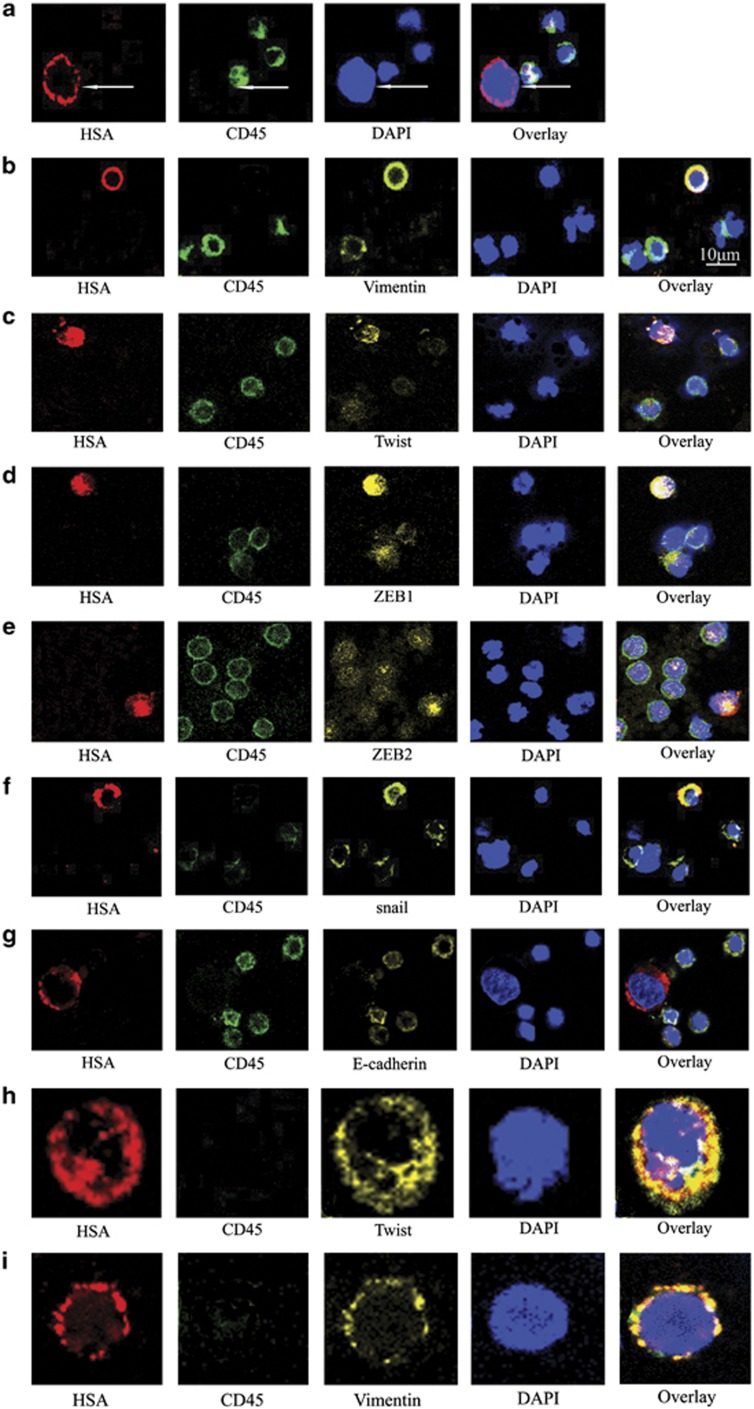
免疫荧光染色鉴定了不同疾病阶段HCC患者CTC中EMT相关基因的表达。(一)用HSA抗小鼠抗体/Alexa Fluor 647兔抗小鼠IgG(红色)和CD45抗大鼠抗体/Alexa Fluor 488兔抗大鼠IgG(绿色)对CTC和血液细胞进行染色。细胞核用DAPI(蓝色)染色。(b–克)三重免疫荧光显示CTC分别表达波形蛋白、twist、ZEB1、ZEB2、snail和E-cadherin。用兔抗vimentin、twist、ZEB1、ZEB2、snail和E-cadherin的一级抗体对这些CTC进行染色,相应的二级抗体为Alexa Fluor 555驴抗兔IgG(黄色)。其余的染色程序与所述的双重免疫荧光染色程序相同。条形=10μm.同一患者的CTC中扭曲和波形蛋白共表达。从同一患者不同视野获得的CTC的代表性显微照片。(小时)CTC表达HSA和twist,但不表达CD45。(我)一种CTC,表达HSA和波形蛋白,但不表达CD45。原始放大倍数×800
表1。肝癌患者孤立CTC阳性率与临床变量的相关性。
| 临床变量 |
P(P)-价值
|
| 年龄 |
NS公司一
|
| 性别 |
NS公司一
|
| 肝硬化 |
NS公司一
|
| 肿瘤编号 |
NS公司一
|
| 病因学 |
NS公司b
|
| 儿童-普格班 |
NS公司b
|
| 法新社 |
NS公司b
|
| 门静脉癌栓 |
<0.001一
|
| 埃德蒙森-斯坦纳级 |
0.005一
|
| 米兰标准 |
<0.001一
|
| 肿瘤大小 |
0.003b
|
| TNM公司c(c)
|
<0.001b
|
同时,到目前为止,我们对31例接受肝癌切除或肝动脉化疗栓塞的肝癌患者进行了至少1年的随访。结果表明,CTC+患者组的复发或转移率(88.0%)显著高于CTC-患者组(16.7%)P(P)=0.002) (表2). 同时,CTC+患者组的死亡率(64.0%)也显著高于CTC+病人组(0.0%)P(P)=0.007) (表2).
表2。31例HCC患者的预后。
| 分类 |
患者编号 |
复发/转移次数 |
无复发无转移数 |
复发或转移率 |
P(P)-价值
|
死亡人数 |
存活人数 |
死亡率 |
P(P)-价值
|
| CTC+组 |
25 |
22 |
三 |
88.0% |
0.002一
|
16 |
9 |
64.0% |
0.007一
|
| CTC组 |
6 |
1 |
5 |
16.7% |
|
0 |
6 |
0.0% |
|
CTC中EMT标记物表达的临床病理意义
人宫颈腺癌细胞系HeLa细胞被用作阳性对照物,以检测扭曲和波形蛋白11(补充图2a). 同样,对高EMT HCC细胞系SK-Hep1细胞进行HSA/twist/CD45和HSA/vimentin/CD45的三重免疫荧光28(补充图2b)作为阳性对照,用于随后鉴定具有twist和vimentin表达的CTC(补充图2c). 同时,在外周血单个核细胞(PBMC)中也观察到twist和vimentin的表达(补充图2d)作为阳性对照,用于特异性地在造血细胞以外的CTC中表达twist和vimentin。
在46例不同分期的患者中,37例(80.4%)和39例(84.8%)的CTC中观察到波形蛋白和twist的阳性表达(图2b和c). 门静脉癌栓患者CTC中波形蛋白和twist的阳性表达率(分别为93.5%和100%)显著高于无门静脉癌血栓患者(分别为53.3%和53.3%);P(P)=0.003,P(P)<0.001) (表3). CTC中vimentin和twist表达的阳性率与TNM分期高度相关,Ⅰ期阳性率为55.6%和66.7%,Ⅳ期阳性率分别为100.0%和100.0%(第页=0.424,第页=0.305;P(P)=0.003,P(P)=0.04),分别(表3). CTC中波形蛋白表达的阳性率在Milan标准以外的患者中也显著高于Milan标准以内的患者(86.8%)(50.0.0%)P(P)=0.036)(表3). 此外,CTC中波形蛋白表达的阳性率与肿瘤大小有高度相关性(第页=0.561,P(P)<0.001). 然而,CTC中twist和vimentin表达的阳性率在其他临床参数(包括年龄、性别、肝硬化、肿瘤数量、病因学、Child-Pugh分级、血清AFP水平或Edmondson-Steiner分级)方面没有显著差异(表3).
表3。肝细胞癌患者CTC扭转、波形蛋白表达阳性率与临床变量的相关性。
| |
扭曲
|
波形蛋白
|
扭曲与波形蛋白共表达
|
| 临床变量 |
P(P)-价值
|
P(P)-价值
|
P(P)-价值
|
| 年龄 |
NS公司一
|
NS公司一
|
NS公司一
|
| 性别 |
NS公司一
|
NS公司一
|
NS公司一
|
| 肝硬化 |
NS公司一
|
NS公司一
|
NS公司一
|
| 肿瘤编号 |
NS公司一
|
NS公司一
|
NS公司一
|
| 病因学 |
NS公司b
|
NS公司b
|
NS公司b
|
| 儿童pugh类 |
NS公司b
|
NS公司b
|
NS公司b
|
| 法新社 |
NS公司b
|
NS公司b
|
NS公司b
|
| 门静脉癌栓 |
<0.001一
|
0.003一
|
<0.001一
|
| 埃德蒙森-斯坦纳级 |
NS公司一
|
NS公司一
|
NS公司一
|
| 米兰标准 |
NS公司一
|
0.036一
|
0.044一
|
| 肿瘤大小 |
NS公司b
|
<0.001b
|
0.004b
|
| TNM公司c(c)
|
0.04b
|
0.003b
|
0.001b
|
三重免疫荧光实验显示,在同一患者获得的46个CTC中,32个(70.9%)同时表达twist和vimentin(图2h和i). 门静脉癌栓患者(93.5%)和超出Milan标准的患者(76.3%)CTC中twist和vimentin共表达的阳性率显著高于无门静脉癌血栓患者(20.0%,P(P)<0.001)或符合米兰标准(37.5%P(P)=0.044) (表3). 此外,CTC中twist和vimentin共表达的阳性率与肿瘤大小有显著相关性(第页=0.414,P(P)=0.004) (表3). CTC中twist和vimentin共表达的阳性率也与TNM分期相关,I期阳性率为33.3%,IV期阳性率100.0%(第页=0.476,P(P)=0.001) (表3). 然而,与其他临床变量相比,CTC中twist和vimentin共表达的阳性率没有显著差异(表3). 同时,我们还在CTC中检测到其他与EMT相关的转录因子。我们发现ZEB1、ZEB2和snail的表达也可以在CTC中部分检测到(图2d–f)所有CTC患者均无E-cadherin表达(图2g). 然而,这些转录因子在CTC中的阳性率与任何临床参数无关(补充表1). 在所有样本中均未检测到CTC中slug的表达。
EMT标记物在原发性肝癌中的差异表达
应用免疫组织化学方法检测28例HCC手术标本中EMT相关基因的表达。结果表明,肝癌组织中E-cadherin的表达明显低于邻近非肿瘤肝组织。波形蛋白、twist和ZEB1在肝癌组织中的表达显著高于邻近非肿瘤肝组织。与邻近的非肿瘤肝组织相比,肝癌组织中ZEB2的表达容易下调。肝癌组织与邻近非肿瘤肝组织的蜗牛表达水平无明显差异。在HCC肿瘤或邻近的非肿瘤肝组织中几乎未检测到Slug(图3A). 此外,为了进一步确定原发性肝癌标本中是否发生EMT,进行了定量荧光western blot。分析显示,肝癌肿瘤中E-cadherin的相对表达水平(0.096±0.011)显著低于配对的相邻非肿瘤肝脏(0.196±0.031,P(P)=0.003)(图3B和D). 在HCC肿瘤中,波形蛋白、扭曲蛋白和ZEB1的相对表达水平(0.495±0.055、0.217±0.035、0.145±0.017)显著高于成对的相邻非肿瘤肝脏(0.336±0.039、0.095±0.015、0.102±0.010);P(P)=0.002,P(P)<0.001,P(P)分别=0.016)(图3B和D). ZEB2在HCC肿瘤中的表达(0.096±0.013)显著低于配对的相邻非肿瘤肝脏(0.138±0.018;P(P)=0.030) (图3B和D). HCC肿瘤和配对的相邻非肿瘤肝脏之间蜗牛或蛞蝓的表达没有统计学上的显著差异,并且蛞蝓在肝组织中的表达极低(图3B和D). 此外,在一系列肝癌细胞系和HeLa细胞中也检测到E-cadherin、twist和vimentin(图3C).
图3。
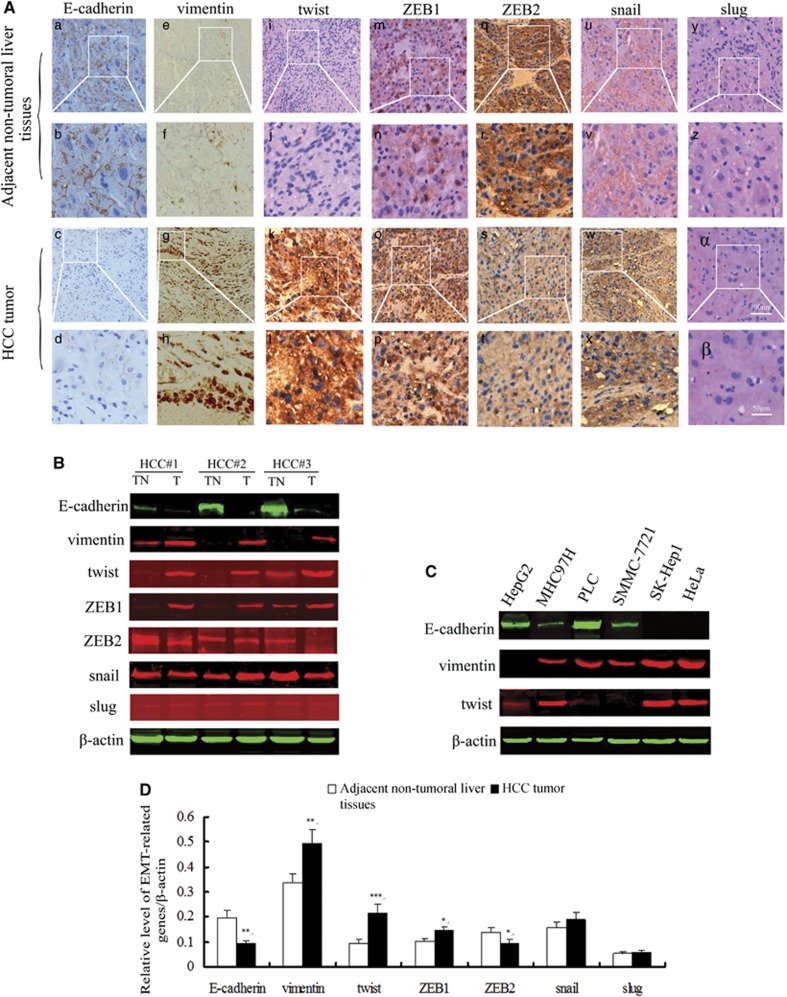
与邻近的非肿瘤组织相比,原发性肝癌组织中EMT相关标记物的表达存在显著差异。(A类)E-cadherin在邻近的非肿瘤肝组织(a,b)中高表达,而在肿瘤组织(c,d)中几乎没有E-cadherin的表达。波形蛋白、twist和ZEB1在邻近非肿瘤肝组织(e,f;i,j;m,n)中的表达显著低于原发性肝癌组织(g,h;k,l;o,p)。与相邻的非肿瘤肝组织(q,r)相比,ZEB2在HCC肿瘤(s,t)中的表达更容易下调。蜗牛在邻近非肿瘤肝组织(u,v)和HCC肿瘤(w,x)中的表达没有明显差异。在邻近的非肿瘤肝组织(y,z)或HCC肿瘤中几乎检测不到Slug的表达(α,β). 原始放大倍数×100(a、c、e、g、i、k、m、o、q、s、u、w、y、,α),巴=100μm.以及放大倍数较高的相应区域×200(b、d、f、h、j、l、n、p、r、t、v、x、z,β),巴=50μ米(B类)相邻非肿瘤肝组织(TN)和肝癌(T)中E-cadherin、vimentin、twist、ZEB1、ZEB2、蜗牛和蛞蝓蛋白水平的代表性免疫印迹。β-肌动蛋白被用作蛋白质负载的内标。(C类)几个肝癌细胞系和HeLa细胞中E-cadherin、vimentin和twist表达的代表性免疫印迹。(D类)相对定量分析显示,与邻近的非肿瘤肝组织相比,HCC肿瘤中的E-钙粘蛋白显著下调(n个=28, **P(P)=0.003). 与邻近的非肿瘤肝组织相比,波形蛋白、扭曲和ZEB1在HCC肿瘤中的表达水平显著上调(n个=28, **P(P)=0.002, ***P(P)<0.001, *P(P)=0.016). 与邻近的非肿瘤肝组织相比,肝癌组织中ZEB2的表达显著降低(n个=28, *P(P)=0.030). 肝癌肿瘤或成对的相邻非肿瘤肝组织中蜗牛和蛞蝓的表达无统计学差异
肝癌标本中的EMT促进原发性肝癌细胞的血源性传播
我们试图确定特异性EMT标记物是否在促进原发性肝癌肿瘤细胞的播散中起作用。相关性分析表明,波形蛋白和twist的相对表达水平与肝癌组织中E-cadherin的表达呈负相关(第页=−0.604,P(P)=0.001;第页=−0.437,P(P)=0.020) (图4a和b). 然而,肝癌中ZEB1、ZEB2、蜗牛或蛞蝓表达的相对水平与E-cadherin表达之间没有显著相关性(补充图3). 此外,有门静脉癌栓的HCC患者肝细胞癌组织中E-钙粘蛋白的相对水平(0.066±0.008)明显低于无门静脉癌血栓的患者(0.112±0.011,P(P)=0.007) (图4c). 此外,有门静脉癌栓的肝癌患者肝细胞癌中波形蛋白和twist的相对表达水平(0.764±0.079,0.365±0.071)显著高于无门静脉癌血栓的肝癌患者(0.346±0.044,0.134±0.020;P(P)<0.001,P(P)分别=0.004)(图4c). 然而,其余转录因子表达的相对水平与门静脉癌栓之间没有显著差异(图4c).
图4。
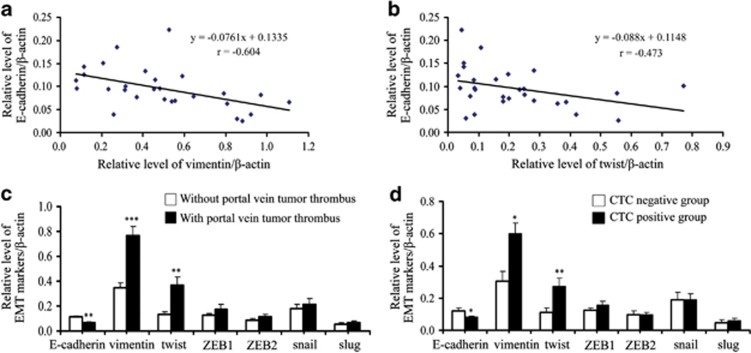
肝癌中EMT的发生与门静脉癌栓相关,并促进CTC的形成。(一)肝细胞癌中波形蛋白表达的相对水平与E-cadherin表达呈负相关(n个=28,第页=-0.604,P(P)=0.001). (b)肝癌组织中twist表达的相对水平与E-cadherin表达呈负相关(n个=28,第页=−0.437,P(P)=0.020). (c(c))门静脉癌栓患者肝癌组织中E-cadherin的表达显著降低(n个=10)比没有门静脉癌栓的患者(n个=18) (**P(P)=0.007),门静脉癌栓患者HCC肿瘤中波形蛋白和扭曲蛋白的表达显著升高(n个=10)比没有门静脉癌栓的患者(n个=18) (***P(P)<0.001, **P(P)分别为=0.004)。其他转录因子的表达与门静脉癌栓无明显相关性。(d日)CTC阳性患者肝癌组织中E-cadherin的表达显著降低(n个=18)比CTC阴性患者(n个=10) (*P(P)=0.013). CTC阳性患者HCC肿瘤中波形蛋白和twist的表达显著增高(n个=18)比CTC阴性患者(n个=10) (*P(P)=0.012, **P(P)分别为0.009)。其他转录因子的表达水平与CTC的阳性率无关
令人鼓舞的是,CTC阳性患者E-cadherin的相对表达水平(0.081±0.009)显著低于CTC阴性患者(0.122±0.015;P(P)=0.013) (图4d). 同时,CTC阳性患者波形蛋白和twist的相对表达水平(0.599±0.068,0.275±0.047)显著高于CTC阴性患者(0.307±0.058,0.111±0.029;P(P)=0.012,P(P)分别=0.009)(图4d). 然而,其余EMT标记物的相对水平与CTC的阳性率之间没有显著相关性(图4d). 这些结果表明,EMT的发生程度与HCC患者外周血CTC的形成呈正相关。
讨论
CTC中EMT相关标记物的表达为临床疗效评估提供了重要信息。由于EMT,CTC改变了它们的形态、细胞间连接、物理特性、分子标记表达和细胞骨架组织。29原代肿瘤细胞需要具备侵袭性和运动性,才能向远处器官扩散。不同的转移模式需要不同的启动机制,并以EMT依赖或非依赖的方式进行,这可能反映在持续或肿瘤细胞改变的表型上。30,31有趣的是,据报道,CTC上EMT相关标记物的存在比单纯上皮标记物的表达更能准确预测肿瘤进展。32到目前为止,对于CTC中EMT相关标记表达的临床相关性知之甚少。因此,本研究表明,CTC中twist和vimentin的表达可作为HCC转移的诊断和预后生物标志物,并且它们在HCC肿瘤中的表达水平与CTC的形成有关。
分离技术的使用对CTC的形态和基因组分析产生了巨大的影响。针对CTC上特异表达的标记物的免疫磁性分离技术是目前分离CTC最广泛使用的方法。33然而,越来越多的证据表明,从癌症患者血液中分离CTC受到CTC常见的可塑性和表型改变的严重阻碍。21,34已经证明,目前基于上皮抗原的方法可能无法检测到可能经历过EMT的最具攻击性的CTC亚群。35因此,有必要优化CTC检测方法,包括在EMT期间未被抑制但仍能将CTC与周围血细胞区分开来的标记物。考虑到这些因素,我们为CTC应用了一种独特的磁分离系统,该系统利用ASGPR与生物素化的积雪草素的结合。该系统以前曾被用于分离肝癌患者的功能性原代小鼠肝细胞和CTC。36,37肝细胞特异性抗原用于识别CTC,并被认为对正常和肿瘤肝细胞具有特异性。
CTCs的阳性率在评估转移和预后方面具有独特的优势。本研究纳入的60名HCC患者根据公认的UICC TNM第六版分期系统和米兰标准进行分类。38,3960例(76.7%)肝癌患者中46例(包括肿瘤直径<3cm的患者和Edmondson–Steiner I级或II级患者)的血液样本中的CTC检测证实了该分离系统的有效性。已经证明门静脉癌栓在肝内转移中起着关键作用。40与这一观察结果一致,我们的结果表明,肝癌患者孤立CTC的阳性率与门静脉癌栓之间存在显著相关性。这一发现表明门静脉癌栓也可能是CTC系统性扩散的结果,是微转移形成的基础。根据Edmondson–Steiner分级,我们研究中CTC检测的阳性率也与分化状态显著相关,41这在一定程度上反映了肝癌细胞的侵袭转移能力。此外,十多年来,米兰标准(单个肿瘤≤5 cm或≤3个肿瘤,每个肿瘤≤3 cm且无大血管侵犯)在肝移植候选人的选择中应用最为广泛。在米兰标准内接受肝移植治疗HCC的患者预后良好。39CTCs阳性率与Milan标准之间的密切相关性表明,CTCs的检测可能在选择肝移植候选人方面具有潜在的应用价值。到目前为止,随访结果与复发率或转移率、死亡率与CTC阳性率显著相关。这些结果表明,CTC的阳性率可以作为一个独立的预后指标,与其他传统的临床诊断方法相比具有独特的优势。
据我们所知,本研究首次调查了不同疾病阶段HCC患者单个CTC中EMT标记物的表达,并评估了这些基因在CTC中的阳性率与临床变量之间的相关性。据报道,扭曲过度表达与HCC转移呈正相关,并通过激活转移性HCC组织和细胞系中的EMT增强侵袭性和运动性。42,43我们发现CTC中twist表达的阳性率与门静脉癌栓密切相关。这一结果表明,扭曲在促进CTC的EMT中起着关键作用,并且与之前的报告一致,这些报告表明扭曲增加了HCC细胞的侵袭性和运动性。EMT可能在肿瘤进展的早期阶段引起肿瘤细胞表型的改变,这些改变可能在早期阶段启动肿瘤细胞的播散并导致微转移的建立。10因此,可以理解的是,与Milan标准或肿瘤大小相关的HCC肿瘤中CTC扭曲表达没有显著差异。我们推测,twist作为一种抑制E-cadherin表达的转录因子,可能促进肝癌进展早期的EMT。
波形蛋白现在被认为是EMT的典型标志物,其过度表达与转移表型和不良预后密切相关。44同样,我们的结果表明,CTC中波形蛋白表达的阳性率与几个重要的临床参数有关,包括门静脉癌栓、Milan标准、肿瘤大小和TNM分期。这表明波形蛋白作为一种EMT相关标记物,可以作为肝癌患者有效的预后生物标记物。此外,在同一患者的CTC中可以同时检测到twist和vimentin,这表明EMT在CTC中发生彻底。CTC中twist和vimentin的阳性率与门静脉癌栓有显著相关性(P(P)<0.001),提示CTC中twist和vimentin的检测可以更准确地预测HCC转移。然而,基于E-钙粘蛋白在所有CTC中的负表达,可以假设进入循环的CTC的特征是细胞-细胞粘附的丧失。其他转录因子在CTC中的阳性表达与HCC患者的临床参数之间没有显著差异,这可能反映了不同的EMT相关转录因子在EMT过程中的作用取决于肿瘤类型。
研究肝癌组织中的EMT标志物对探讨CTC中EMT的机制具有指导意义。尽管免疫组化和western blot分析显示,肝癌组织中E-cadherin、twist、vimentin、ZEB1和ZEB2的表达水平与邻近非肿瘤肝组织相比有显著差异,但只有twist和vimentin的表达水平和肝癌组织中的E-cadherin表达呈负相关。这一结果表明,扭曲和波形蛋白在促进原发性肝癌的EMT中起着关键作用。此外,肝癌肿瘤和门静脉癌栓中E-cadherin、twist和vimentin的相对表达之间的相关性表明twist、vimentin和E-cadherin在促进肝癌转移中的重要作用。此外,肝癌组织中twist、vimentin和E-cadherin的相对表达水平与外周血CTC的阳性率密切相关,表明EMT的发展程度与HCC患者CTC的形成呈正相关。换言之,肝癌肿瘤中的EMT在促进原发性肝癌细胞的血行播散中起着作用。
总之,本研究明确表明,CTC中twist和vimentin表达的阳性率与一系列临床变量显著相关。因此,CTC中扭曲和波形蛋白的表达可能是一种有吸引力且有前途的临床早期诊断工具,用于评估转移和预后。我们证明EMT在促进原发性肝癌细胞的血源性传播中发挥作用。为了进一步证实这一假设体内迫切需要动态EMT过程和动物模型来阐明CTC中EMT的分子机制,这将有助于肿瘤转移的靶向治疗和改善预后。
材料和方法
患者和样本采集
2012年2月至2013年8月,采集了60例HCC患者、10例良性肝病患者(包括肝硬化、慢性乙型肝炎、肝血管瘤和肝囊肿患者)、10名健康志愿者和10例非HCC的其他晚期癌症患者(如乳腺癌)的外周血样本,肺癌或结直肠癌。通过28名受试者的手术切除标本或肝活检,对HCC进行组织学诊断。从28名接受肝切除或肝活检的患者中获取了HCC肿瘤和配对相邻非肿瘤肝组织的速冻和石蜡包埋样本。其余HCC患者根据临床特征、HCC的CT征象、肝动脉造影和AFP水平升高进行诊断。其他非HCC癌症通过组织病理学检查确诊。肝癌患者的临床特征总结如下表4从每个患者中抽取血液样本(10 ml),并收集在含有K的BD真空管中2EDTA(美国新泽西州富兰克林湖贝克顿·迪金森)。样品储存在冰上,并在采集后6小时内进行处理。切除后立即获取速冻组织,并将其储存在−80°C下以备进一步研究。将石蜡包埋样品新鲜切割成5个-μm切片,免疫组化前贴载于显微镜切片上。所有参与本研究的患者和健康志愿者均获得书面知情同意书。本研究得到了本机构伦理和科学委员会的批准。
表4。60例肝癌患者的临床特征。
| 临床变量 |
n个 |
% |
| 年龄,平均值±S。D.,年份 |
51±10 |
|
| <50 |
34 |
56.7 |
| ≥50 |
26 |
43.3 |
| |
|
|
| 性别 |
| 男性 |
54 |
90 |
| 女性 |
6 |
10 |
| |
|
|
| 病因学 |
| 仅HBV |
54 |
90 |
| 仅HCV |
1 |
1.7 |
| HBV和HCV |
1 |
1.7 |
| 非HBV、非HCV |
4 |
6.6 |
| |
|
|
| 儿童——普格班 |
| A类 |
47 |
78.3 |
| B类 |
9 |
15 |
| C类 |
4 |
6.7 |
| |
|
|
| 肝硬化 |
| 与 |
53 |
88.3 |
| 没有 |
7 |
11.7 |
| |
|
|
| AFP,ng/ml |
| <20 |
16 |
26.7 |
| 20–100 |
8 |
13.3 |
| 100–400 |
10 |
16.7 |
| ≥400 |
26 |
43.3 |
| |
|
|
| 肿瘤编号 |
| 单个 |
45 |
75 |
| 多个 |
15 |
25 |
| |
|
|
| 肿瘤大小,cm |
| <三 |
11 |
18.3 |
| 3–5 |
12 |
20 |
| ≥5 |
37 |
61.7 |
| |
|
|
| 门静脉癌栓 |
| 没有 |
28 |
46.7 |
| 与 |
32 |
53.3 |
| |
|
|
| 埃德蒙森-斯坦纳级 |
| I或II |
12 |
20 |
| III或IV |
16 |
26.7 |
| 不适用一
|
32 |
53.3 |
| |
|
|
|
TNM公司b
|
| 第一阶段 |
19 |
31.7 |
| 第二阶段 |
4 |
6.7 |
| 第三阶段 |
32 |
53.3 |
| 第四阶段 |
5 |
8.3 |
| |
|
|
| 米兰标准 |
| 在 |
18 |
30 |
| 超越 |
42 |
70 |
| 总计 |
60 |
100 |
细胞培养
人类肝癌细胞系HepG2和MHC97H是陈永彪博士(重庆西南医院肝胆外科)送的礼物。人肝癌细胞系SMMC-7721、PLC和SK-Hep1购自中国科学院细胞库上海研究所并经鉴定。胃癌细胞株MGC-803和HeLa腺癌细胞由重庆新桥医院肿瘤科张安梅博士提供。人类肝癌细胞系HepG2、MHC97H、SMMC-7721、PLC和HeLa腺癌细胞在添加10%FBS(Hyclone、Logan、UT、USA)和1%(v/v)青霉素/链霉素溶液(Beyotime,中国上海)的Dulbecco改良Eagle's培养基(Gibco、Invitrogen、Carlsbad,CA,USA)中培养。肝癌细胞系SK-Hep1在添加15%FBS和1%青霉素/链霉素的最低必需培养基(Hyclone)中培养。胃癌细胞株MGC-803在添加10%FBS和1%青霉素/链霉素的RPMI 1640(Invitrogen)中培养。所有细胞在含有5%CO的湿润气氛中保持在37°C2使用前用胰蛋白酶收获。
亚氯芬酸生物素化
根据制造商的协议,使用磺化NHS-LC-生物素(美国马萨诸塞州沃尔瑟姆的赛默科学公司)对亚氯芬丁(美国密苏里州圣路易斯Sigma-Aldrich)进行生物素化。简单地说,将1毫克积雪草素溶于1毫升磷酸盐缓冲盐水中。将大约20倍摩尔的磺化NHS-LC-生物素溶液添加到蛋白质溶液中,并在室温下培养60分钟。然后,使用脱盐柱去除多余的生物素试剂。最后,使用HABA试验测量生物素掺入水平,该试验检测添加含生物素样品前后HABA–亲和素溶液的吸光度。当掺入达到每个蛋白质分子4-6个生物素基团时,样品被认为适合后续应用。
流式细胞术分析
为了测定ASGPR与生物素化无唾液酸胎球蛋白的结合效率,本试验使用了几种肿瘤细胞系和ASGPR敲除细胞系。按照制造商的说明,使用ASGPR1基因特异性siRNA寡核苷酸(意义:5′-GAGGCAAUGGGGGAGAAATT-3′和反义:5′-UUUCUUCCCACAUGCCUCTT-3′)(从Invitrogen购买)沉默ASGPR基因表达。简单地说,HepG2和PLC细胞根据制造商的方案进行转染。然后,将细胞培养48小时,然后使用western blot和流式细胞仪分析检测ASGPR的表达。流式细胞仪分析的主要步骤如下:5×105抑制ASGPR表达的HepG2、MHC97H、PLC、SMMC-7721、SK-Hep1、HeLa、MGC-803和HepG2PLC与100μl生物素化无唾液酸胎球蛋白在37°C下放置45分钟。然后通过添加1–2 ml缓冲液清洗细胞,然后在4°C的黑暗中用抗生物素-异硫氰酸荧光素(FITC;Miltenyi Biotec Gmbh,Bergisch Gladbach,德国)孵育5分钟。最后,细胞颗粒在200年被重新悬浮μ用于FACSCalibur流式细胞仪分析的缓冲液(Becton Dickinson)。使用CellQuest软件(Becton Dickinson)对数据进行分析。
单核细胞富集
由于单核细胞和肿瘤细胞位于同一层,使用1.077 g/ml Ficoll-Paque PLUS产品(GE Healthcare,Pittsburgh,CA,USA)通过密度梯度离心法从外周血样本中分离单核细胞与肿瘤细胞。简单地说,新鲜抗凝处理血液和Ficoll-Paque培养基在18–20°C下制备。将10毫升外周血与等量的平衡盐溶液(氯化钠溶液,0.14 mol/l)混合。然后将混合物小心地分层到Ficoll-Paque培养基溶液上,并在400×克在20°C的温度下,在50毫升离心管中放置35分钟(美国亚利桑那州格伦代尔市科宁公司)。然后,将单核细胞层转移到无菌离心管中,并添加至少3体积的平衡盐溶液。洗涤两次后,将细胞颗粒重新悬浮在适当的培养基中进行分离实验。
磁性分离和胞浆制备
细胞在37°C培养箱中用生物素化无唾液酸胎球蛋白培养45分钟,并用缓冲液(含有0.5%牛血清白蛋白(BSA)和2 mM EDTA的PBS,pH=7.2)清洗。对于磁性标记,将细胞与抗生物素微珠(Miltenyi Biotec GmbH)在4°C下孵育15分钟。然后,将细胞清洗一次,并在500分钟内重新悬浮μl缓冲器。根据用户手册,使用MiniMACS分离器(Miltenyi Biotec GmbH)和MS柱分离磁性标记细胞。简单地说,MS柱被放置在磁性分拣架上的MiniMACS分离器中。用500英镑冲洗柱子μl缓冲液和细胞悬液添加到柱中。排空色谱柱储液罐后,用500毫升的水冲洗色谱柱三次μl缓冲器。将该柱从分离器中取出并放置在收集管上。用移液管将一毫升缓冲液移到柱上。通过将柱塞用力推入色谱柱,磁性标记的细胞立即被冲洗出来。计数并稀释分离细胞后,等分5×105将阳性细胞在800 r.p.m.下在聚赖氨酸包被的载玻片上进行细胞离心5分钟,并在室温下干燥细胞自旋30–60分钟。将载玻片在PBS(pH 7.4)中的4%多聚甲醛中在室温下固定15分钟。立即进行实验,或将样品储存在−20°C下,直至后续处理。
免疫荧光染色
为了鉴定载玻片上的CTC,使用抗肝细胞特异性抗原的鼠抗人单克隆抗体(美国马萨诸塞州坎布里奇Abcam)检测正常和肿瘤性肝细胞,并使用大鼠抗人CD45单抗(美国加利福尼亚州圣克鲁斯Santa Cruz Biotechnology Inc.)检测血液细胞。根据制造商的方案进行双重免疫荧光染色。简单地说,用洗涤缓冲液(含0.5%吐温-20的PBS)冲洗载玻片,用0.25%Triton渗透细胞10分钟。用1%BSA在PBST中阻断非特异性结合位点30分钟随后,用HSA抗体和相应的二级Alexa Fluor 647兔抗鼠IgG抗体(Invitrogen)对载玻片进行过夜染色。然后在室温下将载玻片与大鼠抗人CD45单克隆抗体孵育90分钟,然后与相应的Alexa Fluor 488兔抗鼠IgG抗体(Invitrogen)孵育60分钟。细胞核用4′,6-二氨基-2-苯基吲哚(DAPI),并使用防褪色试剂安装载玻片。此外,使用HSA抗体、CD45抗体和以下主要抗体的三重免疫荧光法,研究CTC中的波形蛋白、twist、ZEB1、ZEB2、snail、slug和E-cadherin表达水平:兔抗人多克隆twist/ZEB1/ZEB2抗体(Abcam)、,兔抗人多克隆波形蛋白/蜗牛/E-钙粘蛋白抗体(Santa Cruz Biotechnology Inc.)和兔抗人单克隆蛞蝓抗体(Cell Signaling)。使用Alexa Fluor 555驴抗兔IgG(Invitrogen)作为相应的二级抗体。整个免疫荧光方案在加湿室中进行。最后,使用共焦激光扫描显微镜(Leica TCS SP5 MP,Wetzlar,德国)对载玻片进行分析。
蛋白质印迹
使用SDS-PAGE分析从原发性肝癌组织、邻近非肿瘤肝组织和一系列肝癌细胞系中提取的蛋白样品。将样品转移至硝化纤维素膜后,在室温下将膜封闭60分钟,并在4°C下与各种初级抗体孵育过夜。以下主要抗体用于western blot分析:小鼠抗人E-cadherin抗体(Abcam)、兔抗人扭转抗体(Gene Tex,Irvine,CA,USA)、兔抗人ZEB1和ZEB2抗体(Abcam)、兔对抗人波形蛋白、蜗牛抗体(Santa Cruz Biotechnology Inc.)、,兔抗人鼻涕抗体(细胞信号)和鼠抗人β-肌动蛋白抗体(Sigma-Aldrich)。特殊的奥德赛二级抗体为IRDye680驴抗兔IgG抗体和IRDye800驴抗鼠IgG(LI-COR,Lincoln,NE,USA)。使用奥德赛红外成像系统检测并量化荧光信号45(LI-COR)。
免疫组织化学
用5μm的石蜡包埋的肿瘤样品和邻近的非肿瘤肝组织切片进行免疫组织化学染色。切片在68°C下培养20分钟,然后在二甲苯中脱蜡,在分级乙醇中再水化,并用PBS淬火三次。为了进行热诱导抗原回收,将载玻片在微波炉中煮沸15分钟(0.01 mmol/l柠檬酸缓冲液),并在室温下冷却20分钟为抑制内源性过氧化物酶活性,在室温下用10%正常山羊血清孵育30min,可阻断非特异性结合位点。将载玻片与原代小鼠抗人E-钙粘蛋白抗体(Abcam)、兔抗人扭曲抗体、ZEB1和ZEB2抗体(Abcam)、兔抗人波形蛋白、蜗牛抗体(Santa Cruz Biotechnology Inc.)和兔抗人蛞蝓抗体(Cell Signaling)在4°C下孵育过夜。用PBS清洗后,用二级抗体与过氧化物酶偶联聚合物(Beyotime)孵育20分钟。根据制造商的说明,使用DAB辣根过氧化物酶显色试剂盒(Beyotime)检测目标抗原。最后,用苏木精对切片进行复染,在分级乙醇中脱水并装裱。使用光学显微镜对载玻片进行分析(德国莱卡Wetzlar)。
统计分析
使用Fisher精确检验分析了列联表中描述的两列两行分类数据。非参数相关分析采用Spearman秩相关分析。使用配对样本比较EMT相关基因在HCC肿瘤和配对相邻非肿瘤肝组织中的表达t吨-测试。曼·惠特尼U型-本试验用于检测两组独立肝癌患者EMT相关基因表达的差异。所有统计分析均使用SPSS统计软件包进行,实验数据以平均值±S表示。E.M.A双面P(P)<0.05被认为具有统计学意义。
致谢
我们感谢在第三军医大学新桥医院接受治疗的患者,感谢他们愿意参与本研究,感谢我们部门的几位护士在采集外周血样时给予的热情协助。本工作得到了国家自然科学基金(No.81001105)和重庆市自然科学基金(No.cstc2011jjA0670和No.cstc2010BB5183)的资助。
词汇表
- CTC公司
循环肿瘤细胞
- 电子病历
上皮-间充质转化
- 肝癌
肝细胞癌
- ASGPR公司
去唾液酸糖蛋白受体
- PBMC公司
外周血单核细胞
- HSA公司
肝细胞特异性抗原
- 免疫球蛋白G
免疫球蛋白G
- DAPI公司
4′,6-二氨基-2-苯基吲哚
脚注
补充信息附在细胞死亡与疾病网站上的这篇论文(网址:http://www.nature.com/cddis)
工具书类
-
El-Serag HB,Rudolph KL。肝细胞癌:流行病学和分子致癌。胃肠病学。2007;132:2557–2576. doi:10.1053/j.gastro.2007.04.061。[内政部][公共医学][谷歌学者]
-
Altekruse SF,McGlynn KA,Reichman ME。1975年至2005年美国肝细胞癌发病率、死亡率和生存趋势。临床肿瘤学杂志。2009;27:1485–1491. doi:10.1200/JCO.2008.20.7753。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Yoo HY、Patt CH、Geschwind JF、Thuluvath PJ。1988年至2001年美国肝细胞癌患者肝移植的结果:5年生存率随着时间的推移而显著提高。临床肿瘤学杂志。2003;21:4329–4335。doi:10.1200/JCO.2003.11.137。[内政部][公共医学][谷歌学者]
-
丁伟,尤赫,当赫,勒布朗F,加利西亚V,卢SC,等。小鼠肝肿瘤细胞的上皮-间充质转化促进侵袭。肝病学。2010;52:945–953. doi:10.1002/hep.23748。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Vogel I,Kalthoff H.播散性肿瘤细胞。胃肠道和胰腺癌的检测及其预后意义。Virchows拱门。2001;439:109–117. doi:10.1007/s004280100476。[内政部][公共医学][谷歌学者]
-
Pantel K,Brakenhoff RH。解剖转移级联。Nat Rev癌症。2004;4:448–456. doi:10.1038/nrc1370。[内政部][公共医学][谷歌学者]
-
Imamura H、Matsuyama Y、Tanaka E、Ohkubo T、Hasegawa K、Miyagawa S等。肝切除术后肝细胞癌早期和晚期肝内复发的危险因素。肝素杂志。2003;38:200–207。doi:10.1016/s0168-8278(02)00360-4。[内政部][公共医学][谷歌学者]
-
Bednarz-Knoll N,Alix-Panabieres C,Pantel K。循环肿瘤细胞的临床相关性和生物学。2011年乳腺癌研究;13:228. doi:10.1186/bcr2940。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Giesing M,Driesel G,Molitor D,Suchy B.前列腺癌患者循环肿瘤细胞的分子表型:远处转移的预测。北京大学国际2012;110(11部分C:E1202–E1211。doi:10.1111/j.1464-410X.2012.11534.x。[内政部][公共医学][谷歌学者]
-
Bednarz-Knoll N,Alix-Panabieres C,Pantel K。上皮性恶性肿瘤患者中扩散癌细胞的可塑性。2012年癌症转移评论;31:673–687. doi:10.1007/s10555-012-9370-z。[内政部][公共医学][谷歌学者]
-
Kallergi G、Papadaki MA、Politaki E、Mavroudis D、Georgoulias V、Agelaki S.早期和转移性乳腺癌患者循环肿瘤细胞中表达的上皮-间叶过渡标记物。2011年乳腺癌研究;13:R59。doi:10.1186/bcr2896。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Scheel C,Weinberg RA。肿瘤干细胞和上皮-间充质转化:概念和分子联系。塞明癌症生物学。2012;22:396–403. doi:10.1016/j.semcancer.2012.04.001。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Yang J、Mani SA、Donaher JL、Ramaswamy S、Itzykson RA、Come C等。Twist是形态发生的主要调节因子,在肿瘤转移中起着重要作用。单元格。2004;117:927–939. doi:10.1016/j.cell.2004.06.006。[内政部][公共医学][谷歌学者]
-
Batlle E、Sancho E、Franci C、Dominguez D、Monfar M、Baulida J等。转录因子蜗牛是上皮肿瘤细胞中E-钙粘蛋白基因表达的阻遏物。自然细胞生物学。2000;2:84–89. doi:10.1038/35000034。[内政部][公共医学][谷歌学者]
-
Hajra KM,Chen DY,Fearon ER。SLUG锌指蛋白抑制乳腺癌中的E-cadherin。2002年癌症研究;62:1613–1618.[公共医学][谷歌学者]
-
Eger A、Aigner K、Sonnederger S、Dampier B、Oehler S、Schreiber M等。DeltaEF1是E-cadherin的转录抑制因子,调节乳腺癌细胞的上皮可塑性。致癌物。2005;24:2375–2385. doi:10.1038/sj.onc.1208429。[内政部][公共医学][谷歌学者]
-
Comijn J、Berx G、Vermassen P、Verschueren K、van Grunsven L、Bruyneel E等。双手E盒结合锌指蛋白SIP1下调E钙粘蛋白并诱导侵袭。分子细胞。2001;7:1267–1278. doi:10.1016/s1097-2765(01)00260-x。[内政部][公共医学][谷歌学者]
-
Yang MH,Chen CL,Chau GY,Chiou SH,Su CW,Chou TY等。扭曲和蜗牛在促进肝细胞癌转移中的独立作用的综合分析。肝病学。2009;50:1464–1474. doi:10.1002/hep.23221。[内政部][公共医学][谷歌学者]
-
周亚明,曹磊,李斌,张瑞X,隋希杰,殷志发,等。肝细胞癌患者ZEB1蛋白的临床病理学意义。安·苏格·昂科尔。2012;19:1700–1706. doi:10.1245/s10434-011-1772-6。[内政部][公共医学][谷歌学者]
-
Swennenhuis JF、Tibbe AG、Levink R、Sipkema RC、Terstappen LW。荧光原位杂交法鉴定循环肿瘤细胞。细胞测定。2009;75:520–527. doi:10.1002/cyto.a.20718。[内政部][公共医学][谷歌学者]
-
Hou JM、Krebs M、Ward T、Sloane R、Priest L、Hughes A等。循环肿瘤细胞作为肺癌转移生物学的窗口。《美国病理学杂志》。2011;178:989–996. doi:10.1016/j.ajpath.2010.12.003。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Ksiazkiewicz M、Markiewicz A、Zaczek AJ。上皮-间充质转化:循环肿瘤细胞和肿瘤干细胞之间转移形成的标志。病理生物学。2012;79:195–208. doi:10.1159/000337106。[内政部][公共医学][谷歌学者]
-
Kalluri R,Weinberg RA。上皮-间充质转化的基础。临床研究杂志。2009;119:1420–1428. doi:10.1172/JCI39104。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Thiery JP。肿瘤进展中的上皮-间充质转化。Nat Rev癌症。2002;2:442–454. doi:10.1038/nrc822。[内政部][公共医学][谷歌学者]
-
Kasimir-Bauer S、Hoffmann O、Wallwiener D、Kimmig R、Fehm T。具有循环肿瘤细胞的原发性乳腺癌患者中干细胞和上皮-间充质过渡标记物的表达。2012年乳腺癌研究;14:R15。doi:10.1186/bcr3099。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Armstrong AJ、Marengo MS、Oltean S、Kemeny G、Bitting RL、Turnbull JD等。晚期前列腺癌和乳腺癌患者的循环肿瘤细胞同时显示上皮和间叶标记物。2011年摩尔癌症研究;9:997–1007。doi:10.1158/1541-7786.MCR-10-0490。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Wang S,Cheng L,Yu F,Pan W,Zhang J.使用N-硬脂酰内酰胺修饰脂质体向HepG2细胞输送不同长度的聚赖氨酸共轭ODN及其增强的细胞生物学效应。国际药学杂志,2006年;第311:82–88页。doi:10.1016/j.ijpharm.2005.12.014。[内政部][公共医学][谷歌学者]
-
Tanaka S、Shiraha H、Nakanishi Y、Nishina S、Matsubara M、Horiguchi S等。Runt-related transcription factor 3逆转肝细胞癌中的上皮-间质转化。国际癌症杂志。2012;131:2537–2546. doi:10.1002/ijc.27575。[内政部][公共医学][谷歌学者]
-
Christiansen JJ,Rajasekaran AK。重新评估上皮细胞向间充质细胞转化是肿瘤侵袭和转移的先决条件。2006年癌症研究;66:8319–8326. doi:10.1158/0008-5472.CAN-06-0410。[内政部][公共医学][谷歌学者]
-
Friedl P,Alexander S.《癌症侵袭与微环境:可塑性和相互作用》。单元格。2011;147:992–1009. doi:10.1016/j.cell.2011.11.016。[内政部][公共医学][谷歌学者]
-
Nieto MA。健康和疾病中上皮细胞向间充质细胞转化的过程。年收入细胞开发生物。2011;27:347–376. doi:10.1146/annurev-cellbio-092910-154036。[内政部][公共医学][谷歌学者]
-
Gradilone A、Naso G、Raimondi C、Cortesi E、Gandini O、Vincenzi B等。转移性乳腺癌(MBC)中的循环肿瘤细胞(CTC):预后、耐药性和表型特征。安·昂科尔。2011;22:86–92. doi:10.1093/annonc/mdq323。[内政部][公共医学][谷歌学者]
-
孙义夫,杨学瑞,周J,邱SJ,樊J,徐勇。循环肿瘤细胞:检测方法、生物学问题和临床相关性的进展。癌症研究临床肿瘤学杂志。2011;137:1151–1173. doi:10.1007/s00432-011-0988-y。[内政部][公共医学][谷歌学者]
-
Mego M、Mani SA、Lee BN、Li C、Evans KW、Cohen EN等。原发性乳腺癌中上皮-间质转化诱导转录因子的表达:新辅助治疗的效果。国际癌症杂志。2012;130:808–816. doi:10.1002/ijc.26037。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Konigsberg R、Obermayr E、Bises G、Pfeiler G、Gneist M、Wrba F等。转移性乳腺癌患者中EpCAM阳性和阴性循环肿瘤细胞的检测。《Oncol学报》。2011;50:700–710. doi:10.3109/0284186X.2010.549151。[内政部][公共医学][谷歌学者]
-
Severgnini M、Sherman J、Sehgal A、Jayaprakash NK、Aubin J、Wang G等。一种快速分离功能性原代小鼠肝细胞的两步方法:细胞特征和基于去唾液酸糖蛋白受体的分析开发。细胞技术。2012;64:187–195. doi:10.1007/s10616-011-9407-0。[内政部][PMC免费文章][公共医学][谷歌学者]
-
徐伟,曹磊,陈磊,李杰,张福芳,钱浩,等。用新型细胞分离策略分离肝细胞癌患者循环肿瘤细胞。2011年临床癌症研究;17:3783–3793. doi:10.1158/1078-0432.CCR-10-0498。[内政部][公共医学][谷歌学者]
-
Kee KM,Wang JH,Lee CM,Chen CL,Changchien CS,Hu TH,等。肝细胞癌临床AJCC/UICC TNM分期系统的验证:台湾南部某医疗中心5613例病例分析。国际癌症杂志。2007;120:2650–2655. doi:10.1002/ijc.22616。[内政部][公共医学][谷歌学者]
-
Mazzaferro V、Llove JM、Miceli R、Bhoori S、Schiavo M、Mariani L等。米兰标准以外肝癌患者肝移植后生存预测:一项回顾性探索性分析。柳叶刀Oncol。2009;10:35–43. doi:10.1016/S1470-2045(08)70284-5。[内政部][公共医学][谷歌学者]
-
Toyosaka A、Okamoto E、Mitsunobu M、Oriyama T、Nakao N、Miura K。肝细胞癌肝内转移:经门静脉作为传出血管扩散的证据。美国胃肠病杂志。1996;91:1610–1615.[公共医学][谷歌学者]
-
Edmondson HA,Steiner PE。原发性肝癌:48900例尸检中100例的研究。癌症。1954;7:462–503. doi:10.1002/1097-0142(195405)7:3<462::aid-cncr2820070308>3.0.co;2-e。[内政部][公共医学][谷歌学者]
-
Lee TK、Poon RT、Yuen AP、Ling MT、Kwok WK、Wang XH等。扭曲过度表达通过诱导上皮-间质转化与肝细胞癌转移相关。2006年临床癌症研究;12:5369–5376. doi:10.1158/1078-0432.CCR-05-2722。[内政部][公共医学][谷歌学者]
-
孙涛,赵恩,赵XL,顾强,张世伟,车恩,等。Twist1在肝细胞癌中的表达及其功能意义:在血管生成拟态中的作用。肝病学。2010;51:545–556. doi:10.1002/hep.23311。[内政部][公共医学][谷歌学者]
-
Satelli A,Li S.波形蛋白在癌症中的作用及其作为癌症治疗分子靶点的潜力。细胞分子生命科学。2011;68:3033–3046. doi:10.1007/s00018-011-0735-1。[内政部][PMC免费文章][公共医学][谷歌学者]
-
Xu S,Pi H,Chen Y,Zhang N,Guo P,Lu Y等。镉通过干扰其肝毒性中的钙稳态,诱导Drp1依赖性线粒体断裂。细胞死亡疾病。2013;4:e540。doi:10.1038/cddis.2013.7。[内政部][PMC免费文章][公共医学][谷歌学者]
关联数据
本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。






