摘要
非酒精性脂肪性肝炎(NASH)通常与促凋亡半胱天冬酶激活有关。促炎症半胱天冬酶的潜在作用尚不完全清楚。我们的目的是研究半胱天冬酶1在NASH肝损伤和纤维化发展中的潜在作用。C57BL/6野生型(WT)在接受甲硫氨酸缺乏(MCD)饮食时,出现明显的脂肪性肝炎、HSC活化、纤维化,并增加肝脏胱天蛋白酶1和IL-1β的表达。喂食MCD小鼠的肝脏中检测到caspase 1的显著激活。肝细胞和肝脏的非实质分馏进一步证明,喂食MCD后caspase 1的激活主要局限于非实质细胞。半胱氨酸天冬氨酸蛋白酶1敲除(案例1−/−)MCD饮食的小鼠显示,参与炎症和纤维化的基因的mRNA表达显著减少(野生型小鼠的TNFα是野生型小鼠的7.6倍。案例1−/−MCD喂养小鼠;F4/80与WT相比增加了1.5倍。案例1−/−MCD喂养小鼠;与对照组相比,WT组α-SMA增加了3.2倍。案例1−/−MCD喂养小鼠;胶原蛋白1-alpha在WT中是7.6倍。案例1−/−MCD喂养小鼠;WT组TGFβ是WT组的2.4倍。案例1−/−MCD喂养小鼠;WT组CRP2是WT组的3.2倍。案例1−/−喂食MCD的小鼠)。此外,肝胶原沉积的天狼星红染色在案例1−/−喂食MCD的小鼠与喂食WT MCD的动物相比。然而,血清转氨酶(ALT)水平、caspase 3活性和TUNEL阳性细胞在案例1−/−MCD饮食中的WT小鼠。通过注射氯膦酸钠选择性去除枯否细胞可显著抑制MCD诱导的caspase 1激活,并保护小鼠免受与此饮食相关的纤维化和纤维化。结论:本研究揭示了半胱天冬酶1在NASH发展过程中炎症和纤维化中的新作用。
关键词:非酒精性脂肪性肝病(NAFLD)、非酒精性肝炎(NASH)、炎症组、半胱氨酸天冬氨酸蛋白酶、炎症、纤维化
非酒精性脂肪性肝病(NAFLD)是目前影响成人和儿童的最常见慢性肝病,与肥胖和胰岛素抵抗密切相关(1,2). 在美国,三分之一的成年人和十分之一的儿童或青少年患有肝脂肪变性,这是NAFLD的一个阶段,其特征是肝细胞中的甘油三酯积聚,并遵循良性非进展性临床过程(三,4). 非酒精性脂肪性肝炎(NASH)被定义为脂肪堆积,有细胞损伤、炎症和不同程度的疤痕或纤维化的迹象(5). NASH是一种严重的疾病,大约25%的患者会发展为肝硬化,并可能出现门脉高压、肝衰竭和肝细胞癌等并发症(6-8). NAFLD/NASH的发病机制,尤其是导致肝损伤和疾病进展的机制尚不完全清楚,但具有重要的生物医学意义,因为识别这些过程可能有助于确定这种高度流行和潜在严重疾病的新诊断和治疗靶点。
自从最初描述caspase激活和肝细胞凋亡是NASH患者肝脏的特征性病理特征以来(9)越来越多的数据表明,半胱氨酸蛋白酶依赖性细胞死亡在NASH发病机制中起着关键作用(10-13). 半胱氨酸蛋白酶是一个半胱氨酸蛋白酶家族,具有独特的底物特异性,在凋亡机制中发挥核心作用(14,15). 它们被合成为惰性酶原,在接受凋亡刺激后,细胞激活启动子caspase,如caspase 1、2、8、9和10,这些caspase反过来通过蛋白水解裂解并激活效应子caspases,包括caspase 3、6和7。半胱氨酸天冬氨酸蛋白酶被进一步分类为促炎症或促凋亡,这取决于它们参与这些细胞程序。促炎性半胱氨酸天冬氨酸蛋白酶包括小鼠体内的半胱氨酸蛋白酶1、11和12,以及人类体内的半胱天冬酶1、4和5(16). 针对半胱氨酸天冬氨酸蛋白酶活性和细胞凋亡的研究对于NASH患者的新型治疗诊断策略的开发具有重要意义。最近的数据表明,在不同的饮食小鼠模型中,泛酸抑制可再次保护饮食诱导的脂肪性肝炎(17-19). 这些泛酶抑制剂不仅抑制caspase介导的细胞凋亡,还阻断caspase 1依赖性的加工和激活各种蛋白,这些蛋白在组织损伤期间具有炎症和组织修复功能。然而,caspase 1依赖过程对肝损伤和纤维化的作用尚不清楚。在本研究中,我们检测了胱天蛋白酶1激活在NASH中的发生和意义。
实验程序
动物研究
这些实验方案得到克利夫兰诊所动物护理和使用委员会的批准。雄性C57BL/6小鼠,体重20至25克,购自Jackson实验室。C57BL/6半胱氨酸蛋白酶1(案例1−/−)敲除小鼠(由位于康涅狄格州纽黑文的耶鲁大学的理查德·弗拉维尔博士慷慨提供)的描述如下(20,21). 将小鼠置于甲硫氨酸和胆碱缺乏(MCD)饮食(TD 90262,Teklad Mills)中,这已被广泛证明会导致与严重炎症和进行性纤维化相关的脂肪变性,病理学上与人类严重脂肪性肝炎相似(22,23). 在这个模型中,脂肪变性是由于脂肪酸线粒体氧化减少和脂肪酸以极低密度脂蛋白的形式输出减少所致(24). 相同的动物群(n个=每组5-7人)接受含5%脂肪的标准饮食(TD 2918,Teklad Mills,Madison,WI)作为对照(CTL)。在0周、1周、3周和6周时测量总体重。每组动物在6周后按各自的饮食进行处死。
在选择性研究中,将体重为20-25 g的C57BL/6雄性小鼠置于MCD饮食中,用于静脉注射包裹磷酸盐(PBS)或氯膦酸盐(CLOD)的脂质体(每组3~7只)。在MCD饮食5周后,每隔5天向动物注射两次,每次注射0.1毫升/10克体重的1毫克/毫升脂质体悬浮液,如前所述(25). 每组动物在6周后分别接受相应的治疗。
细胞系与培养
采用6周MCD饮食从C57BL/6小鼠中分离出原代小鼠肝细胞和总非实质细胞。将小鼠麻醉,用温热氧合Hanks(-)灌注肝脏,再灌注1mM EGTA和10mM HEPES,然后用每只小鼠含有10mg胶原酶的Williams E培养基。离心后收集肝细胞,用所得细胞悬液用Percoll梯度离心法收集非实质细胞总数。Caspase 1和IL-1β的表达通过western blot分析确定,详情如下。
组织病理学、免疫染色和血清分析
如前所述,禁食5小时后,在深度麻醉下采集血样和肝组织(26). 将肝组织固定在10%福尔马林中,并嵌入tissue Path(宾夕法尼亚州匹兹堡Fisher Scientific)。苏木精和曙红以及油红O染色的肝脏标本通过光学显微镜进行评估。按照制造商的说明,使用特定试剂盒进行肝甘油三酯测定(Pointe Scientific)。使用商业试剂盒(Sigma Diagnostics)进行血清丙氨酸氨基转移酶测定。由经验丰富的病理学家(BGP)以盲法对喂食MCD和CTL的动物的个体特征,包括脂肪变性程度、炎症和肿胀进行评估。根据NAFLD活动评分(NAS)对脂肪变性、炎症和膨胀进行评分(27).
肝caspase-1激活和细胞定位的评估
使用从Abcam购买的Caspase 1荧光测定试剂盒(cat.ab39412),使用200μg全肝蛋白测定Caspase l活性。使用标准DAB技术,用石蜡包埋的肝组织进行caspase 1的免疫组织化学。使用以下主要抗体:从Millipore购买的兔抗半胱氨酸天冬氨酸蛋白酶1(猫06-503稀释1:80)。
细胞凋亡评估
制备组织切片(4μm),并按照制造商的说明进行末端脱氧核苷酸转移酶dUTP缺口末端标记(TUNEL)测定(就地细胞死亡检测试剂盒;罗氏分子生物化学公司,德国曼海姆)。通过使用裂解的Caspase-3抗体(细胞信号)对活性Caspase 3进行免疫染色来量化Caspase激活。如前所述,通过在5个随机显微镜场(40倍)中计数TUNEL阳性或活性caspase 3阳性细胞的数量来量化肝切片中的肝细胞凋亡(12).
肝纤维化的测定
肝纤维化用天狼星红定量。直接红80和快速绿FCF(颜色指数42053)由Sigma-Aldrich提供。肝切片在室温下在黑暗中与含有0.1%固绿FCF和0.1%直接红的饱和苦味酸水溶液孵育2小时(26). 将染色的载玻片在流动的蒸馏水下缓慢洗涤6分钟,脱水(每个步骤3分钟),安装,并通过光学显微镜检查。通过数字图像分析对红色胶原纤维进行定量,不包括血管。
免疫印迹和免疫沉淀分析
用购自Millipore的5μg兔抗caspase-1抗体(cat.06-503)免疫沉淀500μg总肝蛋白。使用30-40μg全肝裂解物、20μg肝细胞或非实质部分或免疫沉淀的裂解物进行免疫印迹分析。全肝裂解物和肝细胞/非实质样品用12-15%SDS-PAGE进行分离,免疫沉淀的肝裂解物样品用从Invitrogen购买的4-20%梯度凝胶(cat.EC60285BOX)进行分离,转移到硝酸纤维素膜上,并用适当的一级抗体进行印迹。用过氧化物偶联二级抗体(稀释度1:10000(BIOSOURCE International,Camarillo,CA)培养膜,并使用化学发光底物(ECL,Amersham Biosciences)和柯达X-OMAT胶片(Eastman Kodak,Rochester,NY)观察结合抗体。使用以下主要抗体:从Millipore购买的兔抗Caspase 1(cat.06-503稀释度1:80),从Abcam购买的兔抗白细胞介素1β(cat.Ab9722,稀释度1:5000);从Abcam购买的含有caspse募集域(ASC)的兔抗凋亡相关斑点样蛋白(cat.ab64808稀释度1:1000);从Abcam购买的兔抗α-平滑肌肌动蛋白(cat.ab5694稀释度1:500)。
实时PCR
使用RNeasy tissue Mini试剂盒(加利福尼亚州巴伦西亚,齐亚根)从肝组织中分离出总RNA。使用iScript cDNA合成试剂盒(Bio-Rad)从1μg总RNA合成逆转录本(cDNA)。进行实时PCR定量。简言之,25μl反应混合物包含:cDNA、Syber-Green缓冲液、Gold Taq聚合酶、dNTP和最终浓度为200μm的引物。用于定量PCR的引物序列如下:αSMA 5′-GTC CCA GAC ATC AGG GAG TAA和5′-TCG GAT TCA GCG TCA GGA;COL1A1 5′-CAA GAA CAG CAA CGA GTA CCG和GTC ACT GGT CAA CTC CAG CAC;转化生长因子-β5′-CTCCCTGGCTTCTAGTGC和5′-GCCTTGTGGAGAGGATCTGG;TNFα5′-CCC TCA CAC TCA GAT CAT CTT CT和5′-GCT ACG TGG GCT ACA G;F4/80 5′-CCCAGTGTCTTACAGAGTG和5′-GTGCCAGAGGTGTGTGTCT;CD11c 5′-CTG GAT AGC CTT TCT TCT GCT G和5′-GCA CAC TGT GTC CGA ACT CA;ASC 5′CTT GTC AGG GGA TGA ACT CAA AA和5′GCC ATA CGA CTC CAG ATA GTA GC;Casp1 5′ACA AGG CAC GGG ACC TAT G和5′TCC CAG TCA GTC CTG GAA ATG;IL-1 5′GCA ACT GTT CCT GAA CTC AAC T和5′ATC TTT TGG GGT CCG TCA ACT;IL-18 5′GAC-TCT-TGC-GTC-AAC-TTC-AAG-G和5′CAG-GCT-GTT-TGT-CAA-CGA;CRP2 5′GCTACGGAAAAG AAGTATGGACC和5′CTCAGTCAGTTAGACTCC.18S核糖体RNA 5′-和ACG GAA GGG CAC CAC CAG GA 5′-CAC CAC CCA CGG AAT CG作为内源性对照。在Mx3000P循环器(Stratagene)中进行RT-PCR:95°C 10 min,40个循环,在95°C下15 s,在60°C下30 s,在72°C下30s,然后在95°C下1min,在55°C下30ms,在95℃下30s。使用CT、ΔCT和ΔΔCT值,使用MxPro软件(Stratagene)计算对照样品的折叠变化。
统计分析
除非另有说明,否则所有数据均表示为平均值±S.E.M。通过方差分析比较3个或更多组之间的差异,然后进行事后Newman Keuls检验参数检验或Kruskall-Wallis非参数检验。通过双边学生t检验比较两组标准化数据之间的差异。差异被认为具有统计学意义第页< 0.05. 使用GraphPad Prism 4.0c进行所有统计分析。
结果
肝Caspase-1激活是实验性NASH的一个显著病理特征
为了研究半胱氨酸天冬氨酸蛋白酶-1激活在NASH发病机制中的作用,我们首先将C57BL/6小鼠置于蛋氨酸和胆碱缺乏(MCD)饮食中,该饮食已被广泛证明与进展性纤维性脂肪性肝炎相关,其病理学类似于人类严重脂肪性肝炎(22,23). 在分别喂食6周后,我们观察到MCD喂养诱导的显著肝脏脂肪积累(图1A)伴随着肝损伤组织学参数的增加,包括肝脏炎症和肝细胞膨胀(图1A和表1). 与对照组相比,喂食MCD的小鼠中caspase 1的表达显著增加(图1B)伴随着ASC mRNA水平的增加,ASC是炎症小体的关键组成部分,是激活caspase 1和IL-1的蛋白平台,但不是IL-18(图1B). 喂食MCD饮食的小鼠肝脏的这些变化与炎症小体激活显著增加有关(图1C和D),以及胱天蛋白酶1蛋白的表达和活性水平(图1E-G)与这些数据一致,与CTL小鼠相比,喂食MCD的动物肝脏活性成熟IL-1β蛋白表达也显著增加(图1H和I). 对两组小鼠肝脏切片的免疫组织化学分析显示,胱天蛋白酶1主要定位于非实质正弦细胞,在较小程度上定位于肝细胞(图1J). 通过将喂食MCD动物的肝组织分馏成肝细胞和总非实质细胞进一步证实了这一点,这进一步表明,与肝细胞相比,非实质部分中caspase 1和IL1β蛋白的表达显著增强(图1K).
图1。饮食诱导脂肪性肝炎期间肝脏caspase 1激活。
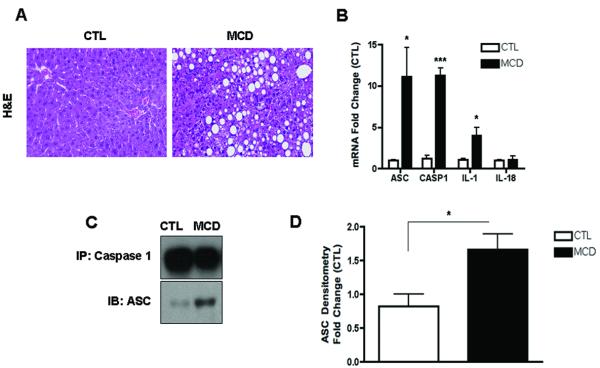
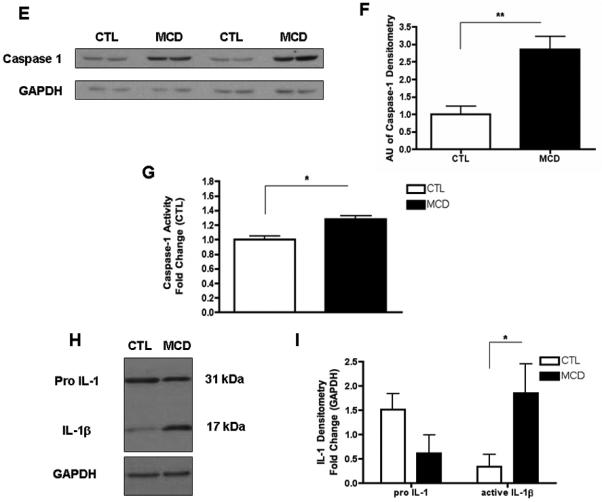
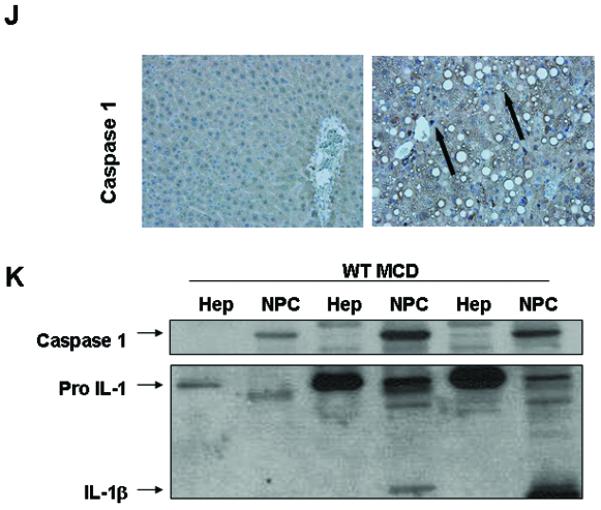
(A类)将C57BL/6小鼠置于蛋氨酸和胆碱缺乏(MCD)饮食或对照(CTL)饮食中6周(每组n=5-7)。两组(40倍)小鼠苏木精和伊红染色的代表性显微照片。(B) RT-PCR分析肝WT小鼠(每组4只)中炎症组分凋亡斑点样蛋白(包含CARD(ASC)、NACHT、LRR和PYD结构域包含蛋白3(NALP3)、半胱氨酸天冬氨酸蛋白酶1(CASP1)、白介素-1(IL-1)和白介素-18(IL-18))。(C) 对喂食WT MCD的小鼠与喂食WT-CTL的小鼠的caspase 1免疫沉淀全肝裂解物进行ASC的Western blot,并对ASC进行(D)密度分析(n=4)。(E) 与WT CTL喂养的小鼠相比,WT MCD喂养的小鼠的全肝裂解物上caspase 1的Western blot和(F)GAPDH的相应密度分析(n=4)。(G) 对喂食WT MCD的小鼠的全肝裂解物进行Caspase-1活性测定,并与喂食CTL的小鼠进行比较(每组9只)。(H) 与喂食CTL的小鼠相比,喂食MCD的小鼠的全肝裂解液中IL-1前体蛋白印迹显示IL-1处理为活性IL-1β,并对GAPDH进行相应的(I)密度分析。(J) 喂食MCD的小鼠与喂食CTL的动物的石蜡包埋肝脏切片中caspase 1免疫组织化学的代表性显微照片(放大40倍)。(K) 对来自分离的原代肝细胞和来自MCD喂养动物的总非实质细胞的细胞裂解液进行caspase 1和IL-1的Western blot。结果表示为平均值±S.E.M..*P<0.05;**P<0.01;与对照组相比。
表1。
|
重量 |
案例1-/- |
|
|
|
CTL公司 |
MCD公司 |
CTL公司 |
MCD公司 |
| 脂肪变性 |
0.0 ± 0.0 |
2.8 ± 0.2 *** |
0.3 ± 0.3 |
3.0 ± 0.0 *** |
| 炎症 |
0.0 ± 0.0 |
1.3 ± 0.2 ** |
0.3 ± 0.0 |
0.3 ± 0.3 # |
| 气球运动 |
0.0 ± 0.0 |
0.7 ± 0.2 * |
0.0 ± 0.0 |
1.0 ± 0.0 * |
| 北美 |
0.0 ± 0.0 |
4.8 ± 0.5 *** |
0.3 ± 0.3 |
4.3 ± 0.3 *** |
半胱氨酸天冬氨酸蛋白酶-1抑制与肝甘油三酯积累和炎症活动之间的分离有关
在确定MCD喂养小鼠肝脏中存在炎症小体激活和caspase-1活性增加后,我们接下来利用caspase-1基因敲除小鼠研究caspase-2是否参与NASH的发育(案例1−/−). 我们首先调查了案例1−/−小鼠对肝脏脂肪变性和炎症具有抵抗力。将C57BL/6野生型Casp1基因敲除小鼠置于MCD饮食或对照(CTL)饮食中6周案例1−/−小鼠在MCD饮食中的体重变化相似(图2A). 然而,H&E和油红O染色的显微镜检查显示Casp1−/−与食用MCD饮食的WT小鼠相比,食用MCD食物的小鼠发生了更为显著的大泡状肝脂肪变性(图2B、C). 与这些结果一致,肝甘油三酯水平在案例1−/−与MCD饮食的WT小鼠相比(图2D). 对与NASH相关的其他个体特征的肝脏样本进行组织学检查,发现炎症灶减少,导致炎症活动评分降低案例1−/−MCD饮食小鼠与WT饮食小鼠的比较(表1). 然而,两组小鼠的总NAFLD活性评分(NAS)相似,这主要是因为MCD-fed Casp1中脂肪变性程度较高以及肝细胞气球化程度较高−/−老鼠(表1). 血清ALT水平在案例1−/−与喂食对照饮食的动物相比,喂食MCD饮食的小鼠和WT小鼠(图2E). 接下来,我们在分子和细胞水平上检查了肝脏的炎症状态,发现喂食MCD的MCD-α、F4/80和CD11c的mRNA水平显著降低案例1−/−小鼠与MCD饮食中的WT动物的比较(图2F、G、H).
图2。在饮食诱导的脂肪性肝炎中,半胱氨酸天冬氨酸蛋白酶1的抑制与肝甘油三酯积累和炎症活动之间的分离有关。
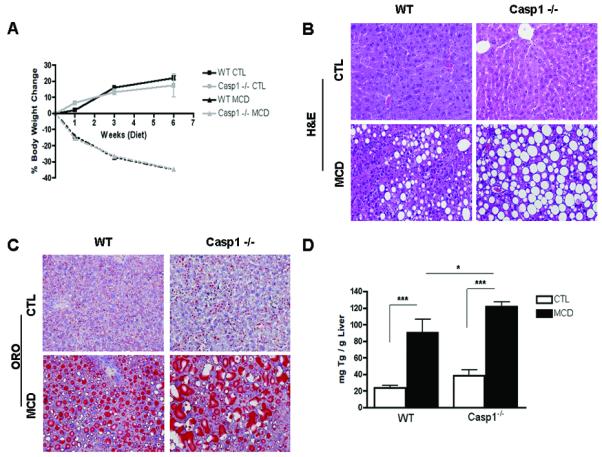
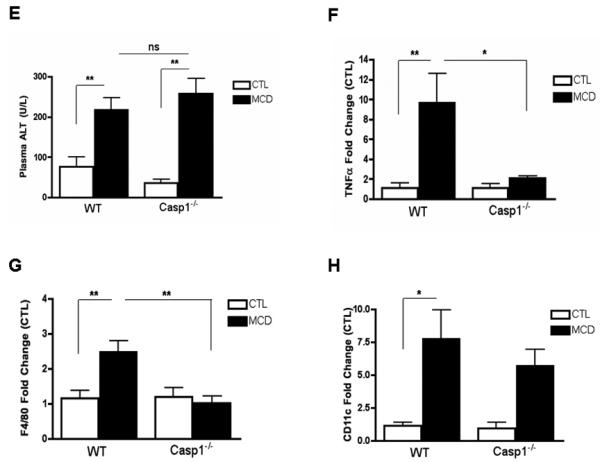
(A) 在WT的第0、1、3和6周测量体重案例1−/−喂食6周CTL或MCD饮食的小鼠(每组5-7只)。(B,C)肝组织H&E和油红O染色(ORO)的代表性图像显示了细胞损伤的严重程度,进一步通过:(D)肝甘油三酯(TG)(n=4-5)和(E)血清丙氨酸氨基转移酶(ALT)水平(n=5-6)进行研究。(F) 肝组织中促炎细胞因子肿瘤坏死因子(TNFα)(n=3-4)、巨噬细胞标志物F4/80(n=6-8)和CD11c(n=4-5)的RT-PCR分析案例1−/−小鼠与WT小鼠进行比较。结果表示为平均值±S.E.M.*P<0.05;**P<0.01***与对照组相比,P<0.001。
通过不依赖于caspase 3激活和凋亡的caspase 1抑制,MCD饮食诱导的HSC激活和胶原沉积减少
caspase 1在肝细胞损伤和炎症信号传导中的关键作用(这两个事件与HSC激活有关)的发现使我们进一步研究了caspase 2在MCD饮食诱导的纤维化和纤维化中的作用。然而,正如预期的那样,在MCD饮食六周后,野生型动物HSC活化和纤维化相关基因的mRNA表达显著增加,如TGFβ、αSMA、COL1A1和CRP2(图3A-D). 这些变化在案例1−/−MCD喂养的小鼠。此外,在喂食WT MCD的小鼠中,αSMA蛋白表达增加,而在案例1−/−MCD喂养小鼠(图3E、F). 更重要的是,与对照组动物相比,MCD饮食中的野生型动物的胶原蛋白沉积几乎增加了四倍,这一点可以通过肝组织天狼星红染色结合数字图像分析定量来证明(图3G,H)而胶原蛋白沉积的增加在案例1−/−小鼠,尽管仍高于CTL饮食的小鼠(图3G,H). 接下来,我们量化了不同组小鼠中肝细胞死亡的数量。在WT动物和案例1−/−MCD饮食小鼠与CTL饮食动物的比较(图4A–D).
图3。饮食诱导脂肪性肝炎期间HSC活化和胶原沉积在案例1−/−.
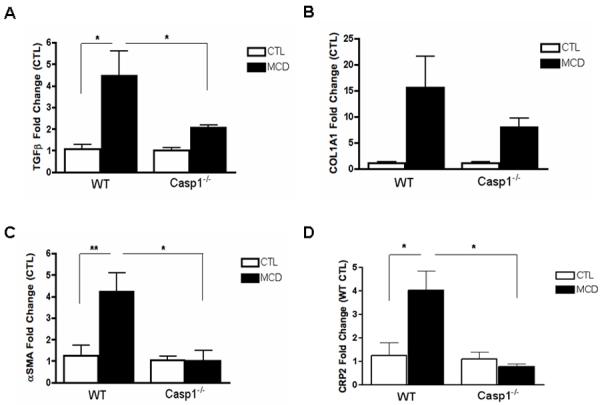
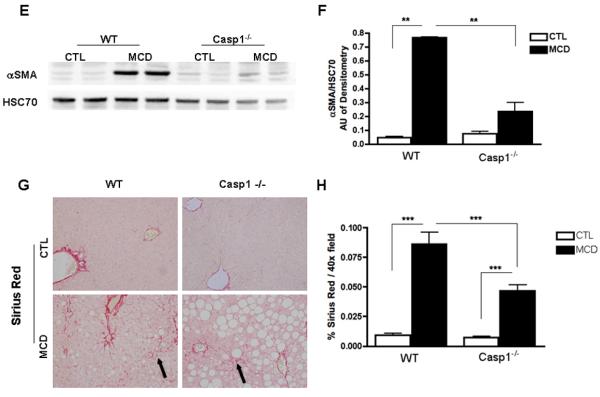
(A-D)RT-PCR分析HSC激活标记物转化生长因子β(TGFβ)、I型胶原α1(COL1A1)、α-平滑肌肌动蛋白(αSMA)、富含半胱氨酸和甘氨酸的蛋白2(CRP2)、肝组织中mRNA表达案例1−/−小鼠与WT小鼠进行比较(每组n=5-7)。(E) WT和WT中全肝裂解物上αSMA的Western blot案例1−/−喂食MCD的小鼠与喂食CTL的小鼠进行比较,(F)对HSC70进行相应的密度分析(n=3)。(G) 胶原纤维用天狼星红染色,(H)用每40x场面积染色的表面积进行量化(每组5~7个),不包括血管。结果表示为平均值±S.E.M.*P<0.05;**P<0.01***与对照组相比,P<0.001。
图4。预防MCD饮食诱导的纤维化案例1−/−与caspase3激活和肝细胞凋亡无关。
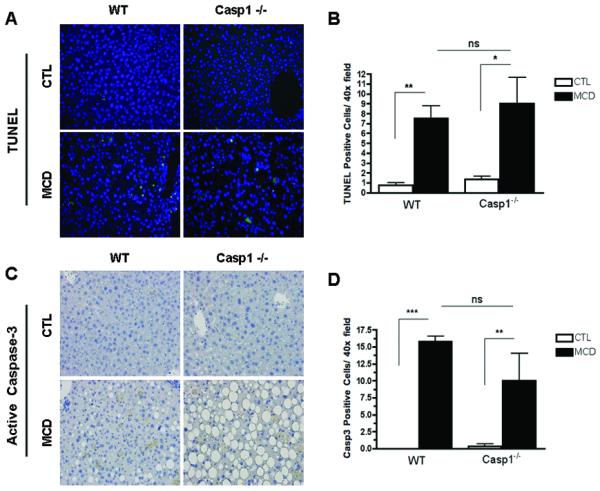
(A,B)TUNEL染色和活性caspase 3免疫组织化学的代表性显微照片(40x)。(C,D)通过计算TUNEL阳性细胞数和5个随机显微镜视野(40倍)中裂解caspase 3阳性细胞数,定量肝切片中的肝细胞凋亡。结果表示为平均值±S.E.M.*P<0.05;**与对照组相比,P<0.01。
综上所述,这些观察结果表明,在NASH发育过程中,肝细胞中caspase 1的激活在肝细胞损伤、炎症信号传导、HSC激活和肝纤维化中起着重要作用,与caspase 3激活和肝细胞凋亡无关。
MCD诱导的脂肪性肝炎中选择性Kupffer细胞耗竭可减少caspase 1的激活并防止纤维化和纤维化
炎症小体激活的发现以及caspase 1和IL-1β的显著增加,主要来自喂食MCD的动物肝脏的非实质细胞,再加上炎症小体主要存在于单核细胞和巨噬细胞,这一事实导致我们假设Kupffer细胞,即肝内驻留的巨噬细胞,是这些变化的主要来源。为了验证这一假设,我们接下来研究选择性耗尽枯否细胞对caspase 1表达和MCD诱导的肝损伤的影响。在喂食6周MCD饮食的C57BL/6 WT小鼠的最后一周内,用氯膦酸盐(CLOD)或PBS载体(PBS)脂质体静脉注射两次。CLOD和PBS处理的MCD喂养小鼠的肝脏脂肪变性没有变化(图5A). 肝脏F4/80免疫染色证明了CLOD治疗对肝脏Kupffer细胞耗竭的有效性(图5A). 通过RT-PCR测定TNFα、F4/80和CD68的mRNA水平,进一步证实了这一点,与PBS处理的MCD喂养小鼠相比,CLOD处理组的TNFα,F4/80及CD68 mRNA水平显著降低(图5B). 更重要的是,通过肝组织免疫组织化学和全肝裂解物免疫组化分析检测到,在CLOD治疗的MCD喂养小鼠中,caspase 1蛋白表达也显著降低(图5C-E). 这些变化与纤维生成相关基因表达减少有关(图5F)以及CLOD处理的MCD喂养小鼠胶原沉积显著减少(图5G). 这些数据强烈表明,Kupffer细胞是MCD饮食诱导的脂肪性肝炎中活性caspase 1的主要细胞来源。
图5。枯否细胞缺失可消除caspase 1介导的饮食诱导脂肪性肝炎。
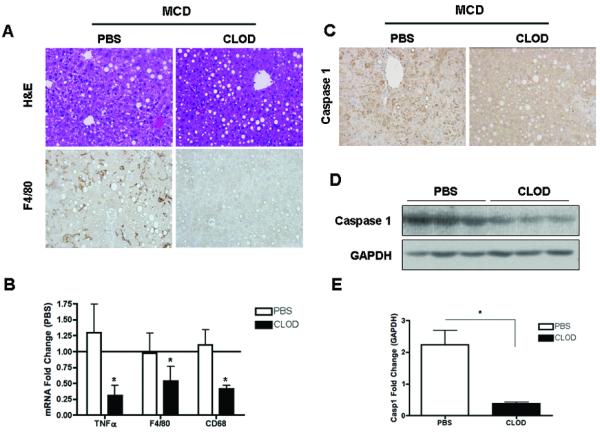
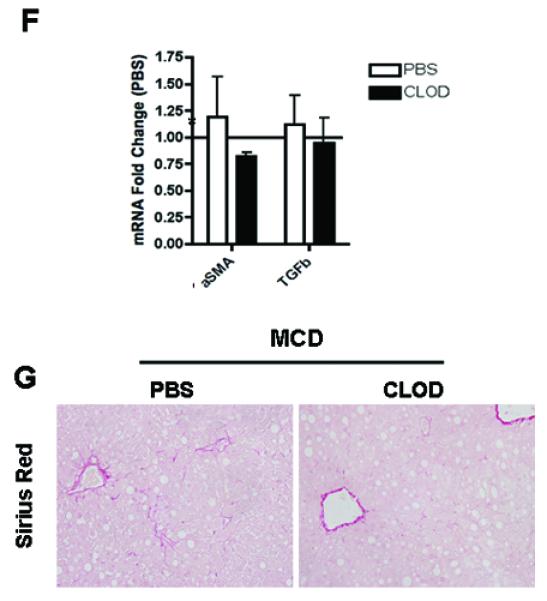
(A) PBS(n=7)或CLOD治疗(n=3)MCD喂养小鼠肝脏中H&E和F4/80免疫染色的代表性显微照片。(B) RT-PCR分析PBS(n=7)或CLOD治疗(n=3)MCD喂养小鼠肝脏中肿瘤坏死因子(TNFα)、巨噬细胞标志物F4/80和CD68的表达。(C) 两组小鼠肝组织上caspase 1免疫染色的代表性显微照片,以及用密度分析法对PBS(n=7)或CLOD治疗(n=3)MCD喂养小鼠的全肝组织裂解物进行的caspase l的(D,E)Western blot分析。(F) RT-PCR分析PBS(n=5)或CLOD处理(n=3)MCD喂养的小鼠(G)肝脏中纤维生成基因αSMA和TGFβ的表达。用天狼星红染色胶原纤维。与对照组相比,结果表示为平均值±S.E.M.*P<0.05。
讨论
本研究的主要发现与半胱天冬酶1在NASH发育过程中的作用有关。结果表明,MCD喂养诱导的NASH与肝脏中caspase 1的激活有关,而caspase l的抑制与肝脏甘油三酯积累和炎症活动之间的解离有关,并保护HSC的激活和纤维化的发展。这些作用与胱天蛋白酶-3的激活和肝细胞死亡无关。此外,我们确定Kupffer细胞是MCD饮食诱导脂肪性肝炎期间caspase 1活性的关键细胞来源。
由于最初的描述是caspase-3和-7激活和TUNEL阳性细胞是NASH患者肝脏的特征性病理特征(9),主要来自实验研究的数据增长表明,caspase激活,主要是caspase-3是参与NASH发病的关键过程(10). 因此,半胱氨酸天冬氨酸蛋白酶活性的靶向性在NASH患者新的治疗和诊断策略的开发中得到了极大的关注。最近的一项临床前研究在NASH动物模型中测试了泛酶抑制剂VX-166(19). 肥胖瘦素受体缺陷db/db小鼠喂食蛋氨酸和胆碱缺乏(MCD)饲料诱导NASH和肝纤维化。每日灌胃VX-166的小鼠显示肝半胱天冬酶活性显著降低,肝脏中成熟IL-1β和IL-18水平降低,肝纤维化。
半胱氨酸天冬氨酸蛋白酶属于一个高度保守的半胱氨酸依赖性天冬氨酸特异性酸蛋白酶家族,该家族使用半胱氨酸残基作为催化亲核试剂,并在靶蛋白中的天冬氨酸残基后对切割其底物具有严格的特异性(15). 它们被合成为惰性酶原,在接受凋亡刺激后,细胞激活启动子caspase,如caspase 1、2、8、9和10,这些caspase反过来可水解蛋白质并激活效应caspase(包括caspase 3、6和7)(16). 半胱氨酸天冬氨酸蛋白酶被进一步分类为促炎症或促凋亡,这取决于它们参与这些细胞程序。促炎性半胱氨酸蛋白酶包括小鼠体内的半胱氨酸天冬氨酸蛋白酶1、11和12,以及人类体内的半胱天冬酶1、4和5。促凋亡和促炎半胱天冬酶在NASH发展过程中对肝脏病理的相对贡献以及泛半胱天冬酶抑制剂的保护作用仍不完全清楚。我们的结果证实了Witek及其同事的发现(19)证明MCD喂养导致显著的caspase-1激活。我们目前的数据进一步扩展了这些观察结果,表明活化的裂解caspase 1主要定位于肝脏的非实质性正弦细胞,在较小程度上定位于肝细胞。尽管甘油三酯沉积和肝脏脂肪变性增加,caspase-1激活的抑制导致组织炎症减少。此外,正如预期的那样,六周MCD饮食后,野生型动物HSC激活和纤维化相关的各种基因的表达显著增加,但这些变化在案例1−/−老鼠。更重要的是,野生型动物吃MCD,但不吃案例1−/−小鼠胶原沉积显著增加。这些变化与肝细胞caspase-3激活、肝细胞气球状变性和血清转氨酶升高导致的肝细胞损伤以及WT动物和Casp1中发生的类似程度的细胞死亡无关−/−MCD饮食小鼠。在NASH发育过程中,将前caspase-1催化加工成其酶活性形式的确切机制需要进一步研究,但已知有多种过程可诱导炎症小体、caspase-1-激活复合物的组装,例如活性氧生成增加,溶酶体通透性和组织蛋白酶释放到胞浆中,已知在NASH的实验模型和患有这种疾病的人中都存在(13,28).
我们在脂肪性肝炎模型中发现了caspase-1的混合细胞表达模式,结合最近的报告,脂肪酸可能会在分离的肝细胞中诱导caspase 1的激活(29)引导我们进一步研究这种蛋白酶的潜在细胞来源。有趣的是,我们观察到,通过氯膦酸钠治疗选择性去除枯否细胞,显著降低了喂食MCD动物肝脏中caspase 1的蛋白表达,并显著降低了胶原沉积促炎细胞因子TNFα的数量,其方式与案例1−/−MCD饮食小鼠。这些结果强烈表明Kupffer细胞是MCD诱导的脂肪性肝炎中caspase 1活性的关键细胞来源。,它通过炎症、肝星状细胞活化和纤维化在该模型的发病机制中发挥重要作用。未来的研究,如那些使用细胞型特异性caspase 1敲除小鼠的研究,将需要进一步剖析caspase l激活在肝脏其他细胞类型中的作用体内以及它们在NASH发育过程中观察到的病理生理变化中的潜在独特作用。
总之,目前的研究揭示了肝脏caspase 1激活在实验性NASH中的作用。这一结果支持了一个模型,即在NASH的发育过程中,Kupffer细胞中caspase 1的激活导致促炎信号的诱导和肝星状细胞的激活,进而导致胶原沉积和纤维化(图6). 这些数据为NASH肝损伤的发病机制提供了新的见解,并确定了这种高度常见和潜在严重疾病的治疗干预潜在的新分子靶点。
图6。炎症小体和半胱氨酸天冬氨酸蛋白酶1激活在脂肪性肝炎组织损伤和纤维化中作用的模型。
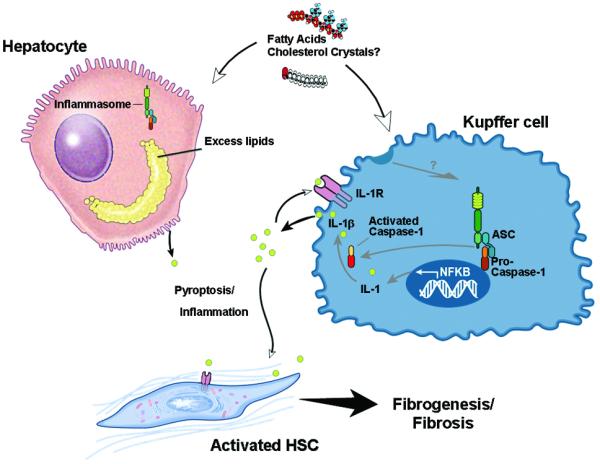
在NASH的发育过程中,胆固醇晶体或游离脂肪酸等不同的脂毒性物质可能会诱导caspase 1的加工和激活,主要在肝脏的Kupffer细胞中,在肝细胞中的作用较小。肝半胱氨酸天冬氨酸蛋白酶1激活可诱导IL-1分裂为其成熟形式的IL-1β,导致炎症和组织损伤增加,包括肝星状细胞的激活。这导致了纤维化的发生和发展。抑制炎症小体或caspase 1激活的治疗靶点可能是NASH治疗的新靶点。
致谢
这项工作得到了NIH向AEF提供的赠款(DK076852)和(DK082451)的支持。
异常情况
- 麦当劳
蛋氨酸-胆碱缺乏饮食
- NAFLD公司
非酒精性脂肪肝
- 美国国立卫生研究院
非酒精性脂肪性肝炎
- 中高音
丙氨酸氨基转移酶
- 隧道
末端脱氧核苷酸转移酶dUTP镍标记
工具书类
-
1.Wieckowska A,Feldstein AE.儿童非酒精性脂肪肝:综述。当前儿科手术。2005;17:636–641. doi:10.1097/01.mop.0000172816.79637.c5。[内政部] [公共医学] [谷歌学者]
-
2Angulo P.非酒精性脂肪肝。《新英格兰医学杂志》,2002年;346:1221–1231. doi:10.1056/NEJMra011775。[内政部] [公共医学] [谷歌学者]
-
三。Browning JD、Szczepaniak LS、Dobbins R、Nuremberg P、Horton JD、Cohen JC、Grundy SM等。美国城市人群中肝脂肪变性的患病率:种族的影响。肝病学。2004;40:1387–1395. doi:10.1002/20466年9月。[内政部] [公共医学] [谷歌学者]
-
4Schwimmer JB、Deutsch R、Kahen T、Lavine JE、Stanley C、Behling C.儿童和青少年脂肪肝的患病率。儿科。2006;118:1388–1393. doi:10.1542/peds.2006-1212。[内政部] [公共医学] [谷歌学者]
-
5Brunt EM、Neuschwander-Tetri BA、Oliver D、Wehmeier KR、Bacon BR。非酒精性脂肪性肝炎:组织学特征和30例盲检活检标本的临床相关性。Hum Pathol(Hum病态)。2004;35:1070–1082. doi:10.1016/j.humpath.2004.04.017。[内政部] [公共医学] [谷歌学者]
-
6Adams LA、Lymp JF、St Sauver J、Sanderson SO、Lindor KD、Feldstein A、Angulo P。非酒精性脂肪肝的自然病史:一项基于人群的队列研究。胃肠病学。2005;129:113–121. doi:10.1053/j.gastro.2005.04.014。[内政部] [公共医学] [谷歌学者]
-
7Matteoni CA、Younossi ZM、Gramlich T、Boparai N、Liu YC、McCullough AJ。非酒精性脂肪肝:临床和病理严重程度谱。胃肠病学。1999;116:1413–1419. doi:10.1016/s0016-5085(99)70506-8。[内政部] [公共医学] [谷歌学者]
-
8Ekstedt M、Franzen LE、Mathiesen UL、Thorelius L、Holmqvist M、Bodemar G、Kechagias S。NAFLD和肝酶升高患者的长期随访。肝病学。2006;44:865–873. doi:10.1002/hep.21327。[内政部] [公共医学] [谷歌学者]
-
9Feldstein AE、Canbay A、Angulo P、Taniai M、Burgart LJ、Lindor KD、Gores GJ。肝细胞凋亡和fas表达是非酒精性脂肪性肝炎的显著特征。胃肠病学。2003;125:437–443. doi:10.1016/s0016-5085(03)00907-7。[内政部] [公共医学] [谷歌学者]
-
10Cazanave SC,Gores GJ公司。肝细胞脂肪凋亡的机制和临床意义。临床利培多。2010;5:71–85. doi:10.2217/clp.09.85。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
11Feldstein A,Gores GJ公司。脂肪性肝炎与细胞凋亡:治疗意义。美国胃肠病杂志。2004;99:1718–1719. doi:10.1111/j.1572-0241.2004.40573.x。[内政部] [公共医学] [谷歌学者]
-
12Feldstein AE、Canbay A、Guicciardi ME、Higuchi H、Bronk SF、Gores GJ。饮食相关性肝脂肪变性对Fas介导的小鼠肝损伤敏感。肝素杂志。2003;39:978–983. doi:10.1016/s0168-8278(03)00460-4。[内政部] [公共医学] [谷歌学者]
-
13Feldstein AE、Werneburg NW、Canbay A、Guicciardi ME、Bronk SF、Rydzewski R、Burgart LJ等。游离脂肪酸通过溶酶体途径刺激TNF-α表达,促进肝脏脂质毒性。肝病学。2004;40:185–194. doi:10.1002/hep.20283。[内政部] [公共医学] [谷歌学者]
-
14乔杜里一世、塔拉坎B、巴特GK。半胱氨酸蛋白酶-更新。复合生物化学物理B生物化学分子生物学。2008;151:10–27. doi:10.1016/j.cbpb.2008.05.010。[内政部] [公共医学] [谷歌学者]
-
15李杰,袁杰。细胞凋亡及其后半胱氨酸蛋白酶。致癌物。2008;27:6194–6206. doi:10.1038/onc.2008.297。[内政部] [公共医学] [谷歌学者]
-
16Weber IT、Fang B、Agniswamy J.Caspases:控制细胞死亡药物的结构导向设计。迷你版医学化学。2008;8:1154–1162. doi:10.2174/1389557087859098999。[内政部] [公共医学] [谷歌学者]
-
17Anstee QM、Concas D、Kudo H、Levene A、Pollard J、Charlton P、Thomas HC等。泛酸抑制对已建立脂肪变性和非酒精性脂肪性肝炎动物模型的影响。肝素杂志。2010年doi:10.1016/j.jhep.2010.03.016。新闻界。[内政部] [公共医学] [谷歌学者]
-
18Barreyro FJ、Holod S、Finocchietto PV、Avagnina A、Camino AM、Biondo CM、Aquino JB等。PF-03491390泛胱天蛋白酶抑制剂可减少非酒精性脂肪性肝炎(NASH)小鼠模型中的肝损伤和纤维化。2010;52:S303。doi:10.1111/liv.12570。[内政部] [公共医学] [谷歌学者]
-
19Witek RP、Stone WC、Karaca FG、Syn WK、Pereira TA、Agboola KM、Omenetti A等。泛酶抑制剂VX-166可降低非酒精性脂肪性肝炎动物模型中的纤维化。肝病学。2009;50:1421–1430. doi:10.1002/hep.23167。[内政部] [公共医学] [谷歌学者]
-
20Kuida K、Lippke JA、Ku G、Harding MW、Livingston DJ、Su MS、Flavell RA。白细胞介素-1β转化酶缺乏小鼠细胞因子输出和细胞凋亡的改变。科学。1995;267:2000. doi:10.1126/science.7535475。[内政部] [公共医学] [谷歌学者]
-
21Li P、Allen H、Banerjee S、Franklin S、Herzog L、Johnston C、McDowell J等。缺乏IL-1β转化酶的小鼠在产生成熟IL-1β方面存在缺陷,并且能够抵抗内毒素休克。单元格。1995;80:401. doi:10.1016/0092-8674(95)90490-5。[内政部] [公共医学] [谷歌学者]
-
22Dela Pena A、Leclercq I、Field J、George J、Jones B、Farrell G.NF-kappaB活化(而非TNF)在脂肪性肝炎小鼠饮食模型中介导肝脏炎症。胃肠病学。2005;129:1663–1674. doi:10.1053/j.gastro.2005.09.004。[内政部] [公共医学] [谷歌学者]
-
23Den Boer M、Voshol PJ、Kuipers F、Havekes LM、Romijn JA。肝脂肪变性:代谢综合征的介导因素。动物模型的教训。动脉硬化、血栓形成和血管生物学。2004;24:644. doi:10.1161/01.ATV.0000116217.57583.6e。[内政部] [公共医学] [谷歌学者]
-
24London RM,George J.NASH的发病机制:动物模型。肝病临床。2007;11:55–74. doi:10.1016/j.cld.2007.02.010。[内政部] [公共医学] [谷歌学者]
-
25Van Rooijen N,Sanders A.Kupffer细胞通过脂质体递送药物耗竭:细胞内氯膦酸盐、丙脒和乙二胺四乙酸的比较活性。肝病学。1996;23:1239–1243. doi:10.1053/jhep.1966.v23pm0008621159。[内政部] [公共医学] [谷歌学者]
-
26Canbay A、Guicciardi ME、Higuchi H、Feldstein A、Bronk SF、Rydzewski R、Taniai M等。组织蛋白酶B失活可减轻胆汁淤积期间的肝损伤和纤维化。临床研究杂志。2003;112:152–159. doi:10.1172/JCI17740。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
27Kleiner DE、Brunt EM、Van Natta M、Behling C、Contos MJ、Cummings OW、Ferrell LD等。非酒精性脂肪肝组织学评分系统的设计与验证。肝病学。2005;41:1313–1321. doi:10.1002/hep.20701。[内政部] [公共医学] [谷歌学者]
-
28Li Z,Berk M,McIntyre TM,Gores GJ,Feldstein AE.游离脂肪酸诱导肝脂肪毒性中的溶酶体线粒体轴。肝病学。2008;47:1495–1503. doi:10.1002/hep.22183。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
29Csak T、Ganz M、Pespisa J、Kodys K、Dolganiuc A、Szabo G。脂肪酸和内毒素激活小鼠肝细胞中的炎症小体,释放危险信号刺激免疫细胞。肝病学。54:133–144. doi:10.1002/hep.24341。[内政部] [PMC免费文章] [公共医学] [谷歌学者]













