摘要 当再生过程不能跟上细胞死亡的步伐时,功能性上皮被疤痕取代。 瘢痕的特征是纤维基质过度堆积,以及在成功伤口愈合期间短暂积聚的细胞类型持续生长,包括肌成纤维细胞(MF)和祖细胞。 这表明通常引导这些细胞修复受损上皮的信号被解除了调控。 为了评估这种可能性,我们在表达MF相关基因α 座椅模块组件 令人惊讶的是,阻断MFs中典型的Hh信号不仅可以抑制肝纤维化,还可以阻止肝祖细胞的积聚。 通过对其他3株小鼠的血统追踪研究,结合使用流式细胞术、免疫荧光共聚焦显微镜、RT-PCR和原位杂交分析高纯度HSC制剂,确定Hh敏感的肝星状细胞(HSC)是MF和祖细胞的来源。 结果表明,SMO是肝上皮再生的主要调节因子,其能够促进HSC衍生MF亚群中具有多能干祖细胞特征的间质-上皮转化。
介绍 肝硬化是所有慢性肝病的致命终点,由于最近慢性病毒性肝炎和肥胖相关肝病的流行,肝硬化正以惊人的速度增长( 1 ). 当再生过程不能跟上肝细胞死亡的步伐时,就会发生肝硬化,导致功能性上皮逐渐替换为瘢痕( 2 , 三 ). 肝纤维化是肝硬化的标志,纤维化(即瘢痕形成)被认为会导致肝功能和血流的变化,从而导致肝脏相关的发病率和死亡率( 三 , 4 ). 由于旨在逆转纤维基质过度堆积的医疗干预措施不成功,肝移植是唯一可用的治疗方法。 然而,由于供体器官相对缺乏,绝大多数肝硬化患者无法进行移植。 预计供需之间的差距将扩大( 1 )除非开发出改善慢性损伤肝脏再生的治疗方法,否则肝硬化死亡人数将增加。 成功需要更好地理解在慢性损伤期间控制功能性肝上皮重建的机制。
瘢痕的特征是胶原蛋白基质过度积累,以及在成功伤口愈合过程中短暂积累的细胞类型持续生长,包括MF和祖细胞( 1 , 5 ). 这两种细胞类型都介导肝脏修复的关键方面。 除了产生和吸收基质外,MFs也是肝上皮祖细胞营养因子的重要来源( 5 , 6 ). 反过来,后一种细胞不仅分化为替代死亡的肝上皮细胞,还产生控制MF种群的可溶性因子( 7 , 8 ). 由于MFs和肝上皮祖细胞在瘢痕形成区域聚集在一起,肝硬化患者通常会解除自分泌/旁分泌信号传导,该信号通常引导这些细胞修复受损的肝上皮细胞。 由于损伤相关因素的过多以及由此产生的创伤修复反应的复杂性,确定驱动解除管制修复的精确信号通路和特定细胞类型一直是一项挑战。
刺猬(Hedgehog,Hh)是一种多效性、形态发生的信号通路,在胎儿发育期间协调组织生长,在各种原因的损伤期间活跃于成人肝脏( 9 , 10 ). Hh信号在成年期受到严格调控。 健康肝脏几乎不表达Hh配体,成熟肝细胞和胆管细胞都不显示活跃的Hh信号( 11 – 13 ). 然而,当受到致命应激或某些损伤相关细胞因子的影响时,这两种类型的成熟肝上皮细胞都开始产生Hh配体( 7 , 14 ). 这些配体从受伤的、产生配体的上皮细胞扩散开来,进入胆管和肝窦,激活排列在这些结构中的活性Hh反应细胞。 后者包括Diss空间中的常驻周细胞(也称为肝星状细胞[HSCs])和Hering管沿线的祖细胞。Hh途径激活刺激HSC成为增殖性纤维原性肌成纤维细胞(MFs)。 它还促进肝祖细胞的生长和存活。 反过来,HSC-衍生MF(MF-HSC)和肝祖细胞也会产生Hh配体,用这些因子进一步丰富受损的肝微环境( 10 ).
Hh配体与Hh应答细胞表面的跨膜受体Patched(PTC)相互作用,从而沉默信号活性辅受体Smoothened(SMO)的PTC抑制。 激活的SMO促进胶质瘤(Gli)家族转录因子的稳定和核定位,这些转录因子调节Hh靶基因的表达,控制细胞活力、生长和分化( 9 ). 除了Hh配体-PTC相互作用外,SMO活性还通过多种途径调节,包括G蛋白偶联受体和TGF-β/TTGF-β-受体相互作用( 15 – 17 ). Gli因子也受SMO非依赖(即非经典)机制控制,这些机制由其他损伤相关因子启动,包括关键促纤维化细胞因子TGF-β( 16 – 18 ).
经典SMO-依赖性Hh信号和SMO-非依赖性机制对受损成人肝脏正常再生的相对重要性尚不清楚。 然而,新的证据支持典型Hh信号在成人肝脏修复中的重要作用。 对用SMO药物拮抗剂进行全身治疗的小鼠的研究表明,急性激活典型Hh通路对肝上皮再生是必要的( 19 )但也表明持续的SMO激活促进瘢痕形成( 20 ). 经典Hh信号传导对肝脏修复的这些差异作用的基础尚不清楚。 对这个问题的进一步研究是有道理的,因为替换受损的肝上皮而不留下疤痕似乎取决于SMO活性的适当调节。
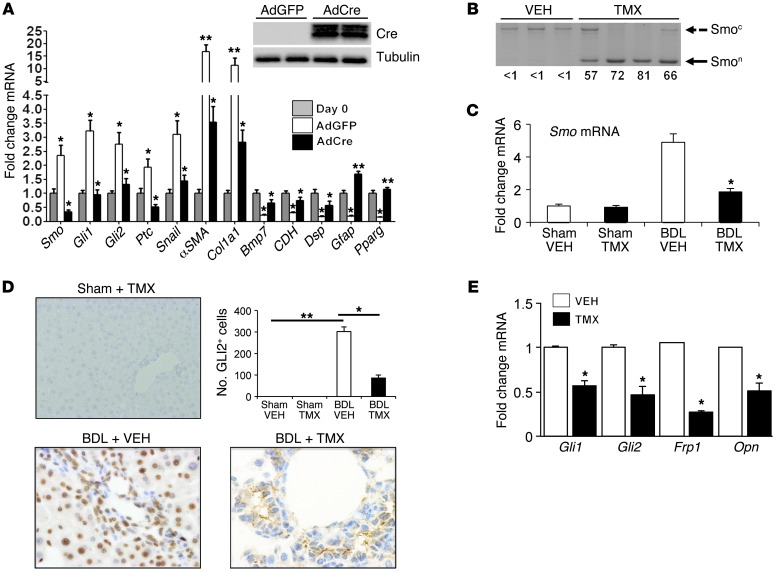
结果 αSMA中SMO的条件性破坏 + 细胞干扰MFs中的Hh信号。 为了研究Hh-responsive MFs在成人肝脏修复中的作用,我们使用Cre-LoxP系统破坏表达MF相关基因α-平滑肌肌动蛋白(α 座椅模块组件 ). 由于常驻HSC既具有Hh反应性,又是肝损伤期间MF的主要来源,因此首先在从SMO-flox小鼠中获得的原代HSC中测试了Cre介导的SMO重组的功效,这些HSC是为了使其转变为MF而培养的, 然后用表达GFP的对照腺病毒或携带Cre重组酶的腺病毒进行处理。 与新分离的(第0天)HSC相比,培养的HSC经AdGFP处理后,其表达增加 平滑(Smo) ,几个Hh调节基因( Gli1公司 , Gli2公司 、和 私人投资公司 ),前上皮-间充质转化(前EMT)转录因子、SNAIL和MF基因,如α 座椅模块组件 和胶原蛋白1α1( 第1a1列 ). 相反,对抗EMT的基因表达( Bmp7型 ,E-钙粘蛋白[ 鼎晖 ]和促结蛋白[ Dsp公司 ])和标志HSC静止的基因( Gfap公司 和 Pparg公司 )低于新鲜分离的HSC。 用AdCre处理培养激活的HSC显著抑制 平滑(Smo) Hh靶基因mRNA表达减少, 蜗牛 和MF基因,而拮抗EMT的基因被诱导,HSC静止标记物被上调(图 1 A) ●●●●。 正如预期的那样,敲低MF-HSC中的SMO阻止了重组Sonic hedgehog配体诱导Hh-调节转录因子或增加MF基因的表达(补充图1;本文在线提供的补充材料;doi: 10.1172/JCI66904DS1 ). 因此,总的数据验证了该方法抑制SMO的有效性,并证明MF-HSCs需要激活SMO才能完成典型的Hh信号传导并在培养中保持促纤维生成表型。
图1。 αSMA中SMO的条件性破坏 + 细胞抑制MFs中的Hh信号。
( A类 )从Smo-flox小鼠中分离出HSC。 在培养第4天添加AdGFP或AdCre(MOI 25),3天后收获细胞。 通过qRT-PCR评估对基因表达的影响。 结果归一化为第0天的HSC* P(P) < 0.05. 插图显示了Cre和微管蛋白表达的代表性蛋白质印迹。 ( B类 )漂浮SMO等位基因的寡核苷酸(参考文献。 56 , 63 ; 补充表3)用于区分未排列的等位基因(Smo c(c) ; 1.7 Kb)来自Cre-recombined null等位基因(Smo n个 ; 0.5 Kb)。 从用载体(VEH, n个 =3)或TMX( n个 =4)BDL和Smo后第4–10天 n个 和Smo c(c) 扩增产物被扩增。 通过密度测定法对扩增产物进行定量,以评估Cre介导的重组效率。 结果表示为Smo n个 /平滑(Smo) n个 +平滑(Smo) c(c) x 100,显示在每条车道下方。 ( C类 )假手术或BDL后14天,从载体和TMX处理的DTG小鼠的肝脏中分离出总RNA。 通过qRT-PCR评估SMO的表达,结果以假手术加载体对照的倍数表示* P(P) < 0.05. ( D类 )肝脏GLI2的代表性免疫组织化学。 GLI2型 + 在假手术组和BDL组中,对车辆治疗和TMX治疗的DTG小鼠的细胞进行量化,并用每个场的阳性细胞数表示( n个 =11/组; 原始放大倍数,×20[Sham]; ×63[BDL])* P(P) < 0.05, ** P(P) < 0.01. ( 电子 )BDL后14天,从载体和TMX处理的DTG小鼠的肝脏中分离出总RNA,并通过qRT-PCR分析Hh调节基因的表达。 结果以折叠载体处理组表示* P(P) < 0.05.
此外,数据支持HSC的固有可塑性,表明这些细胞同时存在上皮和间充质基因,并表明HSC根据Hh配体等环境线索调节这些基因的相对表达水平。 HSC静止时上皮基因的表达占主导地位,而Hh途径激活后间充质基因的表达则占主导地位。 事实上,新分离的HSC(以结蛋白标记)共表达E-钙粘蛋白,其定位于相邻HSC之间的界面(补充图2A)。 尽管以前曾报道过健康肝脏HSC之间的钙粘蛋白连接( 21 – 23 )通常不认为HSC具有上皮特性。 因此,我们使用免疫组织化学方法确认E-钙粘蛋白与结蛋白在成年小鼠未受损肝脏中共定位(补充图2B)。 结果证明,静止的HSC(Q-HSC)在完整组织和新分离的组织中是相对上皮性的,但在培养过程中Hh信号被激活时转变为肌纤维母细胞。 在培养的MF-HSCs中,敲低SMO会消除Hh信号,这显然允许细胞恢复到更上皮化的表型。 因此,在体外,HSC是能够进行EMT/间质-上皮转换(EMT/MET)的过渡细胞。 随后的研究旨在确定体内是否可能发生类似的转变。
将SMO-flox小鼠与αSMA-Cre-ER杂交产生双转基因(DTG)小鼠 T2段 小鼠,其中αSMA启动子驱动三苯氧胺依赖型(TMX依赖型)Cre重组酶-雌激素受体融合蛋白的表达( 24 ). TMX驱动Cre重组酶进入细胞核,删除漂浮的SMO外显子,从而选择性地消除αSMA表达细胞中的Hh信号。 为了检测Hh信号在体内MFs中的作用,对DTG小鼠进行假手术或胆管结扎(BDL)14天,以促进来源于门静脉成纤维细胞(PFs)、造血干细胞和骨髓纤维细胞的MFs在肝脏中的积聚( 25 , 26 ). 在第4天到第10天期间,每组中一半的小鼠接受TMX治疗,另一半接受溶媒治疗。 全肝DNA的PCR分析表明,经载体治疗的小鼠中没有可检测到的转基因重排,但经TMX治疗的小鼠体内漂浮的SMO等位基因大量丢失,缺失的等位基因积累(图 1 B) ●●●●。 整个肝脏SMO表达显著下降(图 1 C和补充图3),表明DTG小鼠可用于确定MFs中的Hh信号是否对体内肝脏修复重要。
与健康肝脏几乎没有Hh途径活性的事实一致,GLI2(图 1 D) SMO(补充图3)的表达在错误操作的小鼠中可以忽略不计,并且不受TMX的影响。 正如BDL激活肝脏Hh信号的证据所预测的那样,BDL增加 平滑(Smo) (图 1 C和补充图3),并在车用DTG小鼠中诱导GLI2的核蓄积。 TMX显著抑制了这一现象(图 1 ,C和D,以及补充图3),导致GLI2靶基因的mRNA表达降低, Gli1公司 以及抑制各种GLI1调节基因,包括卷曲相关肽1( Frp1基因 )和骨桥蛋白( Opn(操作) )(图 1 E) ●●●●。 因此,αSMA表达细胞中SMO的条件性破坏抑制体内Hh信号传导。
出乎意料的是,在BDL后用TMX处理的DTG小鼠的导管细胞和门周肝细胞中观察到核GLI2减少(图 1 D) ●●●●。 未成熟导管细胞和门脉周围肝细胞来源于位于Hering门脉周围通道的双功能肝上皮祖细胞( 27 ). 因此,我们评估了非手术小鼠和BDL小鼠肝脏中α-甲胎蛋白(AFP)的表达,AFP是肝细胞祖细胞的标记物。 假手术DTG控制的患者仅表现出罕见的AFP + 单元格(未显示数据)。 相反,BDL处理的DTG小鼠在BDL后接受载体,在门管区内和周围显示出大量AFP表达细胞(补充图4)。 在许多AFP中发现GLI2的结肠化 + 细胞,包括从Hering样结构的管道中出现的表达AFP的肝细胞。 一些AFP阴性的肝细胞和导管细胞以及许多基质细胞也表达GLI2。 相反,在BDL后接受TMX的DTG小鼠GLI2数量减少 + 细胞和AFP积累失败 + BDL后的单元格。
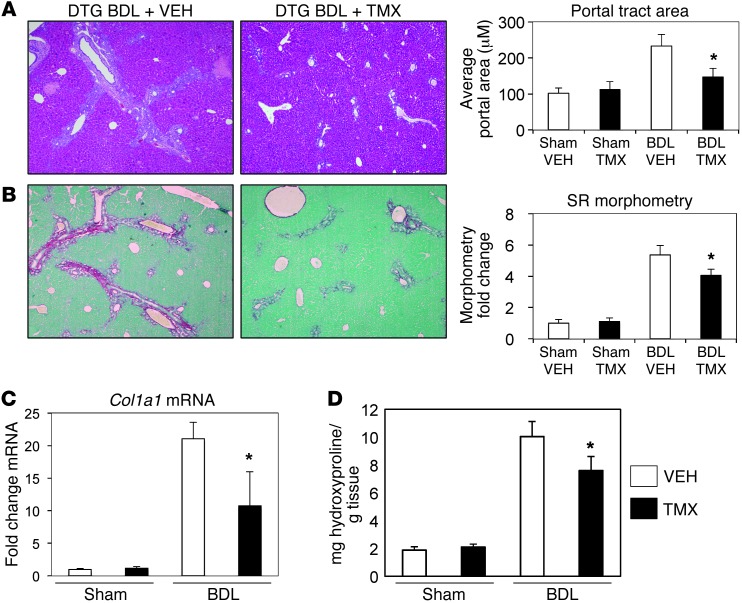
阻断MFs中的Hh信号抑制损伤肝脏中MFs和导管细胞的纤维化和积聚。 BDL引起纤维化反应,相对于未受损肝脏而言,门静脉束增大(图 2 ,补充图5和6,以及参考。 28 ). 这发生在车辆治疗的DTG小鼠中,但在TMX治疗的DTG-小鼠中显著减弱(图 2 A和补充图6)。 天狼星红染肝切片的形态计量学(图 2 B) ,全肝胶原mRNA表达(图 2 C) 和肝脏羟脯氨酸含量(图 2 D) 证实肝纤维化减轻。
图2。 阻断Hh信号抑制受损肝脏的门脉扩张和纤维化。
( A类 )假手术或BDL后14天,来自代表性载体和TMX处理的DTG小鼠的肝切片的H&E染色(原始放大倍数,×4)。 通过对所有小鼠的H&E染色切片进行形态计量学分析来评估门脉大小( n个 =假载体中的4只小鼠; n个 =4只假TMX小鼠; n个 =BDL载具中的11只小鼠; n个 =11只小鼠BDL TMX),表示为门脉大小的平均值±SEM,并绘制了与车辆处理的假手术小鼠相关的图表* P(P) 与车辆处理假手术组相比,<0.05。 ( B类 )其他切片用天狼星红/固绿染色以显示纤维化(原始放大倍数×4)。 形态测量数据显示为平均值±SEM* P(P) 与BDL后的车用DTG小鼠相比,<0.05。 ( C类 )分离肝脏总RNA 第1a1列 用qRT-PCR分析mRNA水平。 结果表示为折叠车处理的混合操作DTG组* P(P) 与车用BDL组相比,<0.05。 ( D类 )各组肝羟脯氨酸的定量。 结果表示为相对于车辆处理的混合操作DTG组* P(P) 与车用BDL组相比,<0.05。
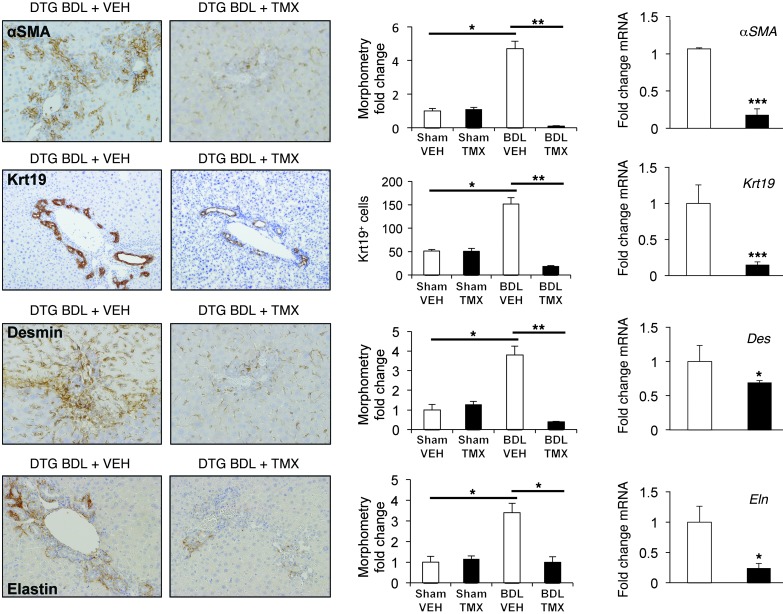
胆道梗阻引起的纤维化反应涉及各种MF和导管细胞在门脉周围的积聚( 4 ). 因此,我们比较了表达αSMA的细胞数量,αSMA是MFs的通用标志物( 6 )或角蛋白19(Krt19),导管细胞的标记( 29 ),在两组中。 BDL后,经车载治疗的DTG小鼠积聚了大量αSMA-和Krt19-阳性细胞。 在TMX处理的DTG小鼠中,两种细胞类型的积累均受到显著抑制。 免疫组化显示αSMA和Krt19的减少与α 座椅模块组件 和 Krt19 mRNA(图 三 ).
图3。 阻断MFs中的Hh信号抑制损伤诱导的MFs和导管细胞的积累。
DTG小鼠在假手术或BDL后用载体或TMX治疗,如方法所述。 显示了αSMA、Krt19、结蛋白和弹性蛋白的代表性免疫组织化学、全肝形态计量学和全肝mRNA表达。 结果表示为折叠车辆处理的混操作对照(计算机辅助形态测量)或每个场阳性染色细胞的总数( n个 =11/组; 原始放大倍数,×20)* P(P) < 0.05; ** P(P) < 0.001. 显示了从载体(白条)或TMX处理(黑条)BDL组分离的全肝总RNA中基因表达的qRT-PCR分析。 结果表示为折叠车用BDL组* P(P) < 0.05; *** P(P) < 0.01.
BDL肝脏中的MFs来源于两个主要来源,HSC和PFs( 4 , 28 ). 因此,对肝脏切片进行结蛋白染色,结蛋白是MF-HSCs的标记物( 30 )或弹性蛋白,PFs的标志物( 31 ). 车辆处理小鼠积累了大量的两种结蛋白 + 和弹性蛋白 + BDL后的单元格(图 三 ). 在TMX治疗的DTG小鼠中,两种细胞类型的积累均显著减少,并且相应的mRNA也受到类似的抑制(图 三 ). 正如我们观察到的 烟雾 在培养的MF-HSC中条件删除(图 1 A) ,删除αSMA中的SMO + BDL后的细胞增加了各种EMT抑制剂的表达,上调了Q-HSC基因(补充图7)和E-cadherin(补充图2B),表明MF-HSC在完整组织中的命运通过破坏Hh信号而改变。
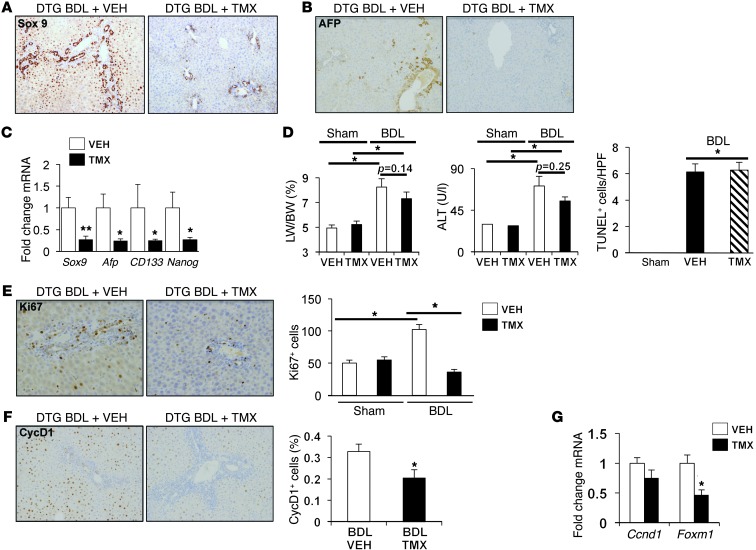
MFs中Hh信号的阻断抑制了损伤肝脏中肝上皮祖细胞的积累,并导致肝萎缩。 导管细胞来源于表达转录因子SOX9的多能干祖细胞( 32 – 35 ). BDL诱导SOX9显著积累 + 车辆处理DTG小鼠中的细胞,但TMX处理的DTG小鼠没有(图 4 A和补充图8)。 如前所示(补充图4),TMX阻止了表达AFP的细胞的聚集(图 4 B) ,肝细胞前体的标记物,并降低 Sox9指数 , Afp公司 以及各种干细胞标记,例如 CD133型 和 纳克 (图 4 C) ●●●●。
图4。 阻断MFs中的Hh信号抑制肝上皮祖细胞的积累,导致肝萎缩,并阻断BDL损伤后的肝细胞增殖。
( A类 )BDL后14天(原始放大倍数,×20),车用或TMX处理的DTG小鼠代表性免疫染色肝切片中SOX9蛋白的表达。 ( B类 )AFP免疫染色的代表性肝脏切片(原始放大倍数,×20)。 ( C类 )qRT-PCR分析 Sox9指数 , Afp公司 , CD133型 、和 纳克 DTG动物的全肝RNA。 结果表示为相对于车用BDL组的平均值±SEM** P(P) < 0.01; * P(P) < 0.05. ( D类 )经溶媒或TMX治疗的DTG小鼠BDL后14天,肝/体重(LW/BW)比值、血清丙氨酸氨基转移酶(ALT)水平和完整肝组织中TUNEL阳性细胞。 结果用平均值±SEM表示* P(P) < 0.05. ( 电子 )BDL后14天,在代表性车辆治疗和TMX治疗小鼠中Ki67染色。 Ki67阳性细胞被量化,并以平均值±扫描电镜(SEM)的形式绘制出与车辆处理假手术组相关的图表* P(P) 与车用BDL组相比,<0.05(原始放大倍数,×20)。 ( F类 )具有代表性的cyclin D1(CycD1)染色类似地显示,cyclin D1-阳性细胞的图示为相对于载体处理的假手术组的平均值±SEM(原始放大倍数,×20)* P(P) 与车用BDL组相比,<0.05。 ( G公司 )细胞周期蛋白D1的qRT-PCR分析( 抄送1 )和 福克斯1 全肝mRNA表达。TMX治疗BDL组的结果与载体治疗BDL的结果相关(平均值±SEM)* P(P) < 0.05.
经TMX治疗的DTG小鼠的肝脏/体重比在BDL后也有所降低(图 4 D) ●●●●。 SMO缺失可能通过加重BDL后的肝损伤而促进相对肝萎缩,但BDL相关的血清丙氨酸转氨酶和TUNEL数量增加 + TMX治疗组的细胞没有恶化(图 4 D) ●●●●。 此外,TMX并没有增加肝脏的梗死或充血(图 2 A和补充图5和6)或肝外器官(如肺或肾;补充图9和10),如果αSMA + 血管平滑肌细胞发生改变。 因此,不太可能因为血流改变或肝细胞死亡增加而导致肝质量恢复失败。 相反,我们注意到Ki67核染色的肝细胞和导管细胞显著减少,Ki67是增殖的标志(图 4 E) ●●●●。 Hh途径激活刺激细胞周期蛋白D1和FOXM1的表达,这些因子促进细胞周期进展,并且是部分肝切除术后肝再生所必需的( 36 , 37 ). 与车载治疗的DTG小鼠相比,cyclin D1表达细胞的数量和cyclin D2的全肝表达( 抄送1 )和 福克斯1 mRNA(图 4 F和G)在BDL后TMX处理的DTG小鼠中显著减少。 因此,消除αSMA中SMO依赖的信号 + 细胞主要抑制淤胆性肝损伤的再生反应。
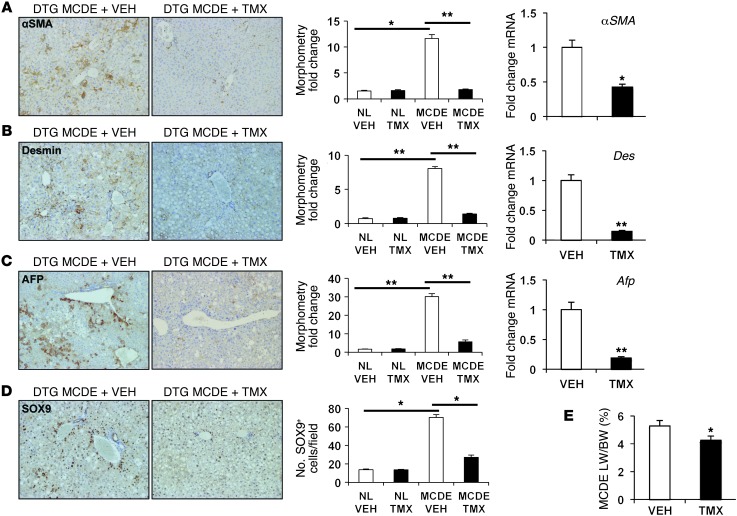
为了进一步研究Hh-responsive MFs在祖细胞介导的肝脏修复中的意义,我们给DTG小鼠喂食缺乏蛋氨酸胆碱、补充乙硫氨酸(MCDE)的饮食1周,以刺激肝脏脂质积聚,损伤肝实质细胞,抑制肝细胞复制, 并触发MFs和未成熟肝上皮细胞的代偿性生长( 8 ). 正如预期的那样,这引发了肝脏脂肪变性(补充图11),并触发了αSMA表达细胞在肝脏的显著积聚(图 5 A) ,结蛋白 + 单元格(图 5 B) 和祖细胞(图 5 、C和D)。 虽然TMX对喂食对照饮食的DTG小鼠中的任何这些标记物都没有影响(数据未显示),也没有减轻MCDE饮食诱导的DTG鼠脂肪变性(补充图11),但它显著阻止了表达αSMA、结蛋白、AFP、, 和SOX9,并且在喂食MCDE饮食的DTG小鼠中这些标记的mRNA表达降低(图 5 ,A–D)。 如BDL小鼠(图 4 D) ,抑制了MCDE饮食中MF和祖细胞的积累——喂食小鼠的肝脏/体重比降低(图 5 E) ●●●●。 同样与BDL小鼠的研究结果一致,SMO的缺失导致Hh调节基因的表达降低 Gli2公司 以及其他各种MF基因( 第1a1列 、弹性蛋白和波形蛋白)和祖细胞标记物( Krt7 和 Krt19 ; 补充图12)。 因此,在慢性胆道损伤(BDL)和慢性肝细胞损伤(MCDE饮食)小鼠模型中,未能扩大肝MF数量与肝上皮祖细胞生长受限相关,并导致肝萎缩。 这可能是由于缺乏MF衍生的营养因子或作为肝上皮前体的MF池耗尽所致。
图5。 阻断MFs中的Hh信号抑制肝上皮祖细胞的积累,导致肝萎缩,并在MCDE饮食诱导的损伤后阻断肝细胞增殖。
( A类 – D类 )代表性免疫组织化学、肝脏形态计量学数据和全肝mRNA表达( A类 )αSMA( B类 )结蛋白( C类 )AFP和( D类 )MCDE饮食诱导损伤后DTG小鼠体内的SOX9。 给小鼠喂食MCDE饮食1周,每组在第0、2、4和6天接受载体或TMX注射,并在第7天收获肝脏。 结果表示为折叠载体处理的假手术对照(计算机辅助形态计量学)或每个视野的阳性染色细胞总数(原始放大倍数,×20)。 NL,正常* P(P) < 0.05; ** P(P) < 0.01. 显示了MCDE组基因表达的qRT-PCR分析结果,结果表示为折叠车用MCDE处理组* P(P) < 0.05; ** P(P) < 0.01. ( 电子 )经溶媒或TMX治疗的DTG小鼠MCDE后7天的典型肝脏/体重比率。 结果用平均值±SEM表示* P(P) < 0.05.
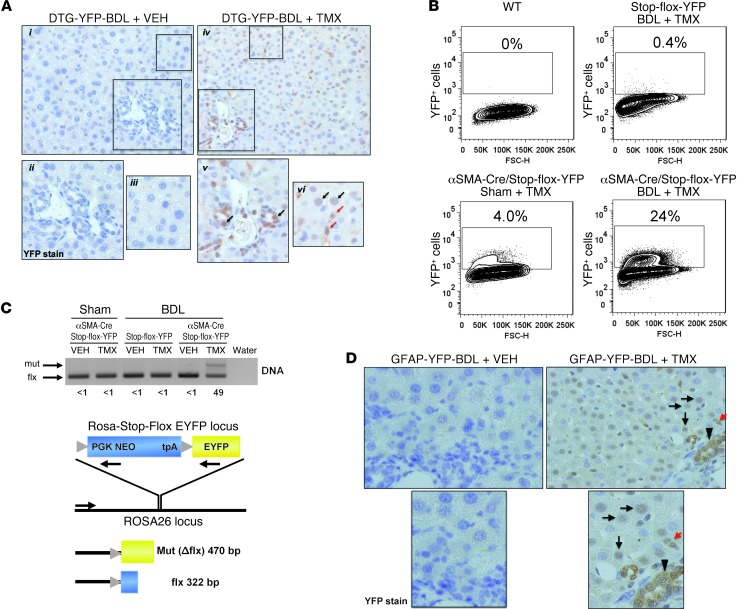
命运图显示上皮细胞和基质细胞都是表达HSC标记的细胞的后代。 为了区分这些可能性,我们交叉了αSMA-Cre-ER T2段 ROSA-Stop-flox-YFP小鼠( 38 )以产生另一种DTG系,其中TMX可用于用YFP标记表达αSMA的细胞及其后代。 免疫组织化学显示,在假手术和BDL后,新DTG株中αSMA的表达与WT小鼠的表达相同(补充图13)。 在WT小鼠或使用载体治疗的DTG小鼠中未显示YFP染色(图 6 A和补充图13)。 然而,当用TMX处理DTG小鼠以激活Cre重组酶时,发现YFP标记的细胞(图 6 A和补充图13)。 至关重要的是,还有更多YFP + BDL后这些小鼠体内的细胞比假手术后的细胞聚集。 YFP标记的细胞定位于损伤肝脏的3个不同组织分区:导管结构、基质和肝细胞板(图 6 A和补充图13)。 为了评估这些发现是否可能是由于Cre重组酶的错误调节和/或错误的抗体特异性所致,从不同组中分离出肝细胞,并通过流式细胞术和直接荧光法进行进一步分析(图 6 B) ●●●●。 还通过PCR分析评估肝细胞中的基因重排(图 6 C) ●●●●。 这两种方法都证实了免疫组化数据,所有分析都表明至少四分之一的肝细胞来自αSMA表达细胞(范围24%-34%,图 6 ,B和C,以及补充图14),从而支持Hh-反应性MF人群包括成人肝细胞前体的假设。
图6。 上皮细胞和基质细胞是表达HSC标志物的细胞的后代。
( A类 )αSMA-核心-ER T2段 x只ROSA-Stop-flox-YFP小鼠接受假手术或14天BDL治疗,并用载体或TMX治疗。 对YFP进行免疫组化,并显示代表性图像(原始放大倍数×40[i–i])。 方框区域显示门脉周围区域的导管细胞(v;箭头)和中区的肝细胞和基质细胞(vi;分别为黑色和红色箭头;原始放大倍数×100[v和vi])的代表性YFP染色放大倍数增加。 还显示了车辆处理控制装置(分别为ii和iii)。 ( B类 )野生型、ROSA-Stop-flox-YFP(无Cre)和αSMA-Cre-ER T2段 /ROSA-Stop-flox-YFP(DTG-YFP)小鼠接受假手术或BDL,并用载体或TMX治疗。 BDL后14天分离原代肝细胞,并通过流式细胞术分析直接YFP荧光。 显示了YFP阳性细胞相对于WT对照的百分比。 ( C类 )从ROSA-Stop-flox-YFP和DTG-YFP小鼠中分离肝细胞; 通过PCR分析DNA以检查ROSA26位点的重排(灰色三角形表示LoxP位点)。 一个普通正向引物与2个下游引物一起用于指定区域(PGK-Neo,EYFP;补充表3)。 如图所示,对Cre介导的重组进行量化 1 显示在每条车道下方。 ( D类 )此外,还对14天BDL损伤的GFAP-Cre-ERTM x ROSA-Stop-flox-YFP小鼠进行了血统追踪,并用溶媒或TMX治疗。 对肝脏YFP进行免疫组化,并显示了代表性的YFP图像 + 导管区(箭头)、基质区(红色箭头)和肝细胞区(黑色箭头)的细胞(原始放大倍数,×40[顶部];×100[底部])。
αSMA是MFs的一般标记,因此由来自骨髓纤维细胞、PFs和HSC的MFs表达( 31 , 39 ). 为了区分哪些肌纤维母细胞类型可能在肝损伤期间产生肝上皮细胞,我们建立了第三个DTG细胞系,其中TMX可用于用YFP条件性标记GFAP表达细胞及其子代。 因为GFAP由HSC表达,而不是骨髓纤维细胞或PFs( 31 )GFAP-Cre-ERTM/ROSA-Stop-flox-YFP-DTG小鼠将HSC产生的肝上皮细胞(YFP阳性)与PF或纤维细胞产生的肝表皮细胞(YFP阴性)区分开来。 当GFAP-Cre-ERTM/ROSA-Stop-flox-YFP DTG小鼠受到BDL刺激HSC-衍生和非MF-HSC扩张时(图 三 ),我们观察到YFP标记的肝细胞和导管细胞显著聚集(图 6 D和补充图15),证明表达GFAP的细胞是至少一些肝上皮细胞的前体。 这些发现反映了αSMA-Cre-ER血统追踪研究的结果 T2段 /ROSA-Stop-flox-YFP小鼠(图 6 A和补充图13),并扩展了培养HSC的发现(图13 1 和补充图2),共同支持HSC作为BDL损伤肝脏中肝上皮细胞的前体细胞的作用,因为HSC是已知表达GFAP和αSMA的唯一类型的成人肝细胞。
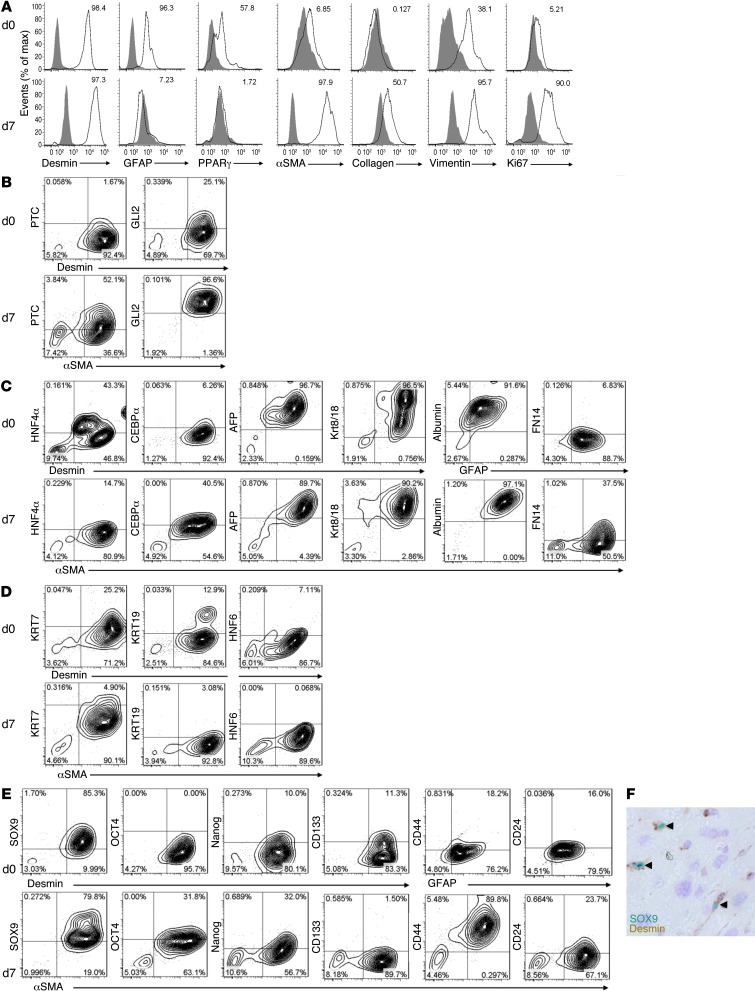
FACS和命运映射证明HSC和MF-HSC可重新编程。 HSC能够分化为肝细胞和导管细胞的概念与当前的教条相反,但并不完全新颖。 其他一些研究小组报告称,HSC可以在体外表达各种祖细胞标记,包括SOX9( 40 , 41 ). 我们发现Hh信号能够差异性地调节上皮和间充质标记物的HSC表达,我们之前对构成性GFAP-Cre/ROSA-Stop-flox-YFP和GFAP-Cre/ROSA-Stop-flox-LacZ小鼠在MCDE诱导的肝损伤期间的血统追踪研究表明,肝细胞和胆管细胞来源于表达GFAP的细胞( 8 ). 然而,其他工作人员无法证明成人肝损伤期间上皮-间充质转化的发生( 42 , 43 ). 因此,为了进一步研究损伤肝脏中的一些MF-HSC可能成为肝上皮细胞的可能性,我们使用了FACS分析(图 7 ,A-E和补充图16,A和B),RT-PCR(图 8 A和补充图17),以及免疫荧光和共焦显微镜(图 8 B) 分析从健康成年WT小鼠分离的原代HSC,并立即(第0天)或培养7天后进行分析。 HSC分离株用BODIPY染色以显示脂质球,并用紫色激光分析以鉴定维生素A + 细胞符合Kisseleva和Brenner的方案( 44 ). 我们新分离的HSC中98%的BODIPY和维生素A呈阳性(补充图16C)。 97%–98%的细胞也表达HSC标记结蛋白,进一步确保新鲜分离物和培养细胞都是高纯度的(图 7 A) ●●●●。 正如预期的那样,我们发现某些蛋白质在第0天的HSC和培养激活的(第7天)HSC中差异表达。 最值得注意的是,第7天98%的HSC表达MF-HSC标记物αSMA,而第0天不到7%的HSC表示该蛋白(图 7 A) ●●●●。 对PTC和GLI2的FACS分析也证实,MF-HSC中的Hh信号传导比新分离的HSC中的更为活跃(图 7 B) ●●●●。 令人惊讶的是,不管文化如何,SOX9在80%以上的HSC中始终得到证实(图 7 E) ●●●●。 通过对两个新分离的HSC进行免疫染色,证实了该多能干祖细胞标记物和一个成熟的HSC标记物(结蛋白)的克隆化(图 8 B) 和完整的肝脏切片(图 7 F) ●●●●。 基于其他干/祖细胞相关标记物的表达,如OCT4和Nanog,MF-HSC比新分离的HSC更富含原始祖细胞型细胞(图 7 、C–E和补充图17)。 相反,表达肝上皮标记物的细胞,如HNF4α和Krt19,在新鲜HSC分离物中相对富集(图 7 、C和D以及补充图17)。
图7。 FACS证明HSC和MF-HSC可重新编程。
( A类 )培养7天后,对新分离的小鼠HSC(第0天小鼠HSC)和MF-HSCs(第7天小鼠HSCs)进行星状细胞标记物desmin、GFAP、PPARγ、αSMA、胶原、波形蛋白和Ki67的细胞内染色。 阴影区域表示同型控制。 在第0天或第7天小鼠HSC中使用结蛋白、GFAP或αSMA( B类 )Hh信号传导因子(PTC1、GLI2)( C类 )肝细胞和/或其祖细胞的标记物(HNF4α、CCAAT/增强子结合蛋白α[CEBPα]、AFP、Krt8/18、白蛋白、成纤维细胞生长因子诱导分子14[FN14])( D类 )导管细胞标记物(Krt7、Krt19、HNF6)和( 电子 )祖细胞标记物(SOX9、OCT4、Nanog、CD133、CD44、CD24)。 ( A类 – 电子 )显示了相对于同型对照的相应标记阳性细胞的百分比。 ( F类 )WT(C57BL/6)肝脏结蛋白(棕色)和SOX9(绿色)的双重免疫组化显示这些标记物(箭头)的共定位(原始放大倍数×100)。
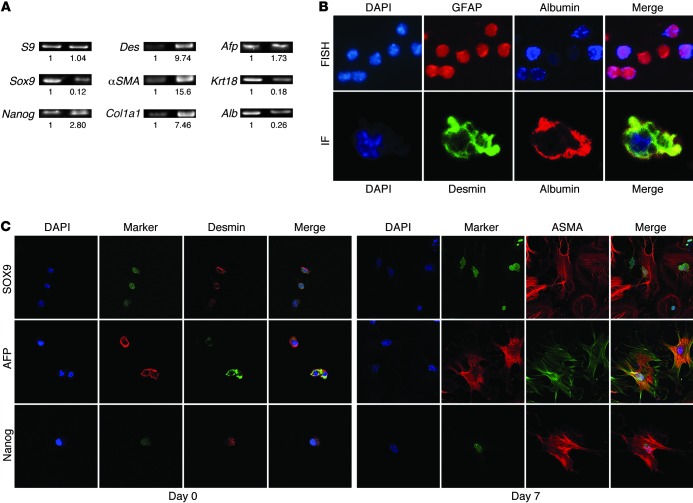
图8。 肝细胞、祖细胞和MF的HSC差异共表达标记物。
( A类 )从WT小鼠中分离出HSC。 从新鲜分离的细胞或培养7天的细胞中纯化总RNA,并通过RT-PCR进行分析。 琼脂糖凝胶电泳显示扩增子。 根据第0天的mRNA水平量化和表达谱带强度。 ( B类 )FISH检测新分离Q-HSC中GFAP(红色)和白蛋白(蓝色)mRNA(原始放大倍数×100)(上图)。 免疫荧光(IF)染色显示共聚焦显微镜显示第0天HSC中结蛋白(绿色)和白蛋白蛋白的共定位。 DAPI染色显示细胞核(原始放大倍数×100)(底部)。 ( C类 )共聚焦显微镜观察第0天HSC(结蛋白阳性)和第7天培养激活的小鼠HSC(αSMA阳性)中代表性肝细胞和祖细胞标记物(AFP、SOX9、Nanog)的表达。 通过DAPI染色显示细胞核(原始放大倍数,×100[第0天小鼠HSCs];×40[第7天小鼠HSC])。
为了确定新分离的HSC制剂中的上皮样细胞是否是静止的HSC,我们评估了白蛋白和静止的HSC标记物(结蛋白或GFAP)的共表达,推断白蛋白是肝细胞及其直接前体的相对特异性标记物( 45 , 46 ). 流式细胞术显示,90%以上新分离的HSC中白蛋白和结蛋白共存(图 7 C) ●●●●。 新鲜分离的HSC的qRT-PCR分析也显示白蛋白mRNA(图 8 A) 原位杂交证实了白蛋白和GFAP转录物的共表达(图 8 B) ●●●●。 新分离的HSC中白蛋白表达的直接证据补充了结蛋白 + 这些细胞共同表达E-钙粘蛋白(补充图2),以及其他流式细胞术和PCR数据(图 7 和 8 以及补充图16和17),证实Q-HSC是具有肝细胞祖细胞特征的上皮样细胞。
众所周知,Q-HSC在损伤肝脏和培养过程中成为MF。 因此,我们检测了第7天培养激活的HSC,以获得白蛋白表达的证据。 我们无法使用FISH证明第7天HSC中的白蛋白转录物(补充图18)。 与此相一致,qRT-PCR证实MF-HSC中白蛋白mRNA水平相对于新分离的HSC中的白蛋白mRNA显著下调(图 8 A) ●●●●。 然而,流式细胞术显示,超过90%的MF-HSCs同时表达白蛋白和αSMA(图 7 C) ●●●●。 虽然来自培养基的细胞粘附白蛋白可能解释了不一致的流式细胞术和mRNA数据,但考虑到白蛋白蛋白的半衰期较长,也可以想象MF-HSC保留了它们在较早时间点产生的白蛋白。
后一种可能性意味着MF-HSCs将展示之前白蛋白基因表达的其他独立证据。 因此,我们检测了从IKKβ ΔHep 小鼠,一种白蛋白基因调控元件驱动Cre-relubise表达的菌株,破坏抑制剂κβ激酶β( IKK公司 β) 肝细胞中的基因( 47 ). 在新分离的HSC和IKKβ培养激活的原代MF-HSCs的RNA和DNA中均发现突变的IKK?和Cre重组酶 ΔHep 小鼠,而突变等位基因和Cre都不能在从IKKβ中获得的HSC中显示 飞行/飞行 对照组小鼠(补充图19)。 这些发现是用BDL小鼠的HSC复制的,以刺激HSC体内重编程为MF。 虽然可以想象,新分离的HSC制剂可能含有污染的肝细胞,但肝细胞在常规用于诱导HSC转分化为MF的条件下无法存活7天。 因此,结果证明小鼠MF-HSCs来源于具有足够内源性白蛋白转录活性的细胞,以驱动Cre重组酶的表达并影响 IKK公司 β基因重排。
为了评估这些数据的通用性,我们对2个克隆性肌纤维母细胞HSC株进行了FACS分析。 大多数克隆人MF-HSC(LX2细胞)和克隆大鼠MF-HSCs(8B细胞)是Hh反应性的,共表达白蛋白和αSMA。 AFP和αSMA的高度共表达,以及αSMA和各种其他干/祖细胞标记的共表达也得到了同样的证明(补充图20和21)。
尽管我们的FACS研究结果支持我们对完整αSMA-Cre-ER进行的命运图研究的结果 T2段 /ROSA Stop flox YFP DTG小鼠和GFAP Cre ERTM/ROSA Stop flox YFP DTG小鼠(图 6 ,A和D),HSC可以同时成为MF和肝上皮细胞的证据似乎反驳了中胚层在胚胎发生过程中产生HSC的报道( 48 )以及成人肝脏中不存在上皮-间充质转化的说法( 42 , 43 , 49 ). 因此,关键是要确定我们的发现是否可以通过另一种方法得到证实。 为此,我们在第四个DTG系(GFAP-Cre/ROSA-Stop-flox-LacZ小鼠)中进行了谱系追踪,在该系中,健康成年小鼠的组成性GFAP表达用于标记GFAP表达细胞及其后代。 Hering(公认的SOX9蓄水池)的HSC和管壁细胞 + 双功能肝上皮祖细胞)为LacZ + 在这些老鼠身上( 8 ). 肝外胆管、胆囊和胰管中也有LacZ染色(补充图22)。 已知所有后一种结构都来自SOX9阳性多能祖细胞( 32 ). SOX9与Hh途径相互作用以控制祖细胞命运决定( 50 , 51 )表明健康成人胰胆管树中可能存在一定水平的Hh基础信号。 为了解决这个问题,我们对PTC-LacZ小鼠的组织进行染色,其中β-半乳糖苷酶的表达由Hh靶基因的启动子元件控制, 私人投资公司 ( 7 ). 胆囊、肝外胆管和胰腺管中可见微弱的LacZ染色(补充图22)。
讨论 本研究证明,SMO是典型Hh信号通路中的专性中间产物,它控制成人肝脏中MFs和肝祖细胞的损伤相关积累。 此外,研究结果揭示了我们认为是一种新的机制来替代受损的肝上皮,该机制依赖于SMO对HSC上皮-间充质转化的直接调节,HSC是驻留的肝周细胞,是多种肝损伤期间MFs的主要来源。
这些发现有几个重要的意义。 首先,他们表明,单个分子SMO最终协调各种损伤相关因子与其受体相互作用时启动的纤维生成和再生信号,因为简单地删除MF中的SMO就足以阻止MF和肝上皮祖细胞在肝脏的蓄积。 尽管出乎意料,但这一结果与SMO整合了至少3种主要形态发生信号通路Hh、Wnt和TGF-β的证据一致( 16 , 52 )表明SMO是肝纤维化和再生的中枢调节器。 反过来,这一观点将SMO确定为预防肝硬化和优化肝损伤恢复的治疗靶点。 第二,SMO在成人肝脏修复中的重要性证明了肝上皮损伤相关诱导Hh配体生成以及由此导致的Hh应答MF和祖细胞的肝蓄积的假定病理生物学意义( 10 ). 这证明了旨在通过减少肝上皮损伤来预防肝纤维化的策略是合理的,因为成功中止了Hh配体的产生,否则Hh配体将为MFs中的SMO激活以及随后的MF积聚和肝纤维化提供主要的旁分泌刺激。 第三,有证据表明,MF中SMO的条件性缺失阻断了肝上皮祖细胞的肝蓄积(并加剧了肝萎缩),这为先前的观察结果提供了一个解释,即MF缺失会损害成人的肝再生( 53 , 54 )这意味着祖细胞在成人肝脏再生中的作用比一般认为的更重要。 第四,证明常驻HSC需要SMO依赖性信号才能成为增殖性MF,再加上MF-HSC表达多潜能祖细胞标记的证据,支持补充的血统追踪证据,即HSC作为兼性祖细胞来替代受损肝脏中受损的肝上皮细胞。
总的来说,这些数据表明了一个新的、公认有争议的模型,根据该模型,SMO通过调节保留多能性的常驻肝细胞亚群的分化来决定肝损伤的结果。 最近,在成人乳腺中发现了一个共表达上皮和间充质标记物的移行细胞亚群。 上皮样乳腺细胞能够上调其多能因子的表达,以获得更多的间充质干细胞样表型。 过渡期乳腺细胞对病毒传递的癌基因的重新编程特别敏感。 尽管驱动这一过程的信号尚未阐明,但也发生了自发的重新编程( 55 , 56 ). 我们的研究结果支持HSC是肝细胞的概念,并确定SMO激活是重编程过程中的关键事件。 在缺乏Hh配体和其他激活SMO的信号的健康肝脏中,HSC是非纤维和非增殖(即静止)周细胞。 像其他组织中的过渡乳腺细胞和周细胞一样,这些静止的HSC表达一些间充质基因( 55 , 57 – 59 ). HSC也表达许多肝细胞和胆管细胞前体的标记物,这表明如果需要替换成熟的肝上皮细胞,他们将接受MET。 相反,在慢性肝损伤期间,HSC微环境逐渐且持续地富含Hh配体和激活SMO的其他促纤维化因子( 7 , 20 ). HSC中SMO的激活启动信号,下调上皮基因,但上调驱动HSC增殖、成肌纤维细胞和成纤维细胞的基因表达。 多潜能因子的表达,如Nanog和OCT4( 60 ),也出现在一些MF HSC中。 因此,通过产生持续的旁分泌信号持续激活HSC中的SMO,慢性肝上皮损伤有利于MF和多能干细胞的积累,同时抑制这些多能干祖细胞分化为静止的HSC和更成熟的肝上皮细胞。 尽管这些反应可能被视为一种适当的适应,可确保肝毒性威胁消失后肝上皮最终替换,但随着肝脏逐渐被相对未分化和肌纤维母细胞多能干祖细胞及其直系后代重新填充,纤维化随之发生。
该模型并不排除其他类型的肝上皮前体细胞在维持肝上皮稳态中的作用。 事实上,后者很可能提供了强有力的证据,证明肝祖细胞群体是异质的,不同的情况引发了对肝上皮细胞替换的需求( 61 ). 该模型也没有定义HSC的最终来源。 这与成人HSC来源于成人胆道树中假定的前体细胞的可能性完全一致( 33 , 61 , 62 )或残留间皮( 48 , 63 ). 在新模型中,来自HSC以外细胞的MFs也有空间。 与MF-HSC不同,MF-HSC能够转变回非纤维细胞,PF和骨髓衍生纤维细胞似乎提供了一致的胶原基质来源( 26 ). 不同MF人群的相对重要性已被认为因肝损伤的类型和持续时间而异( 26 , 31 ). 需要进一步的研究来阐明哪些类型的MF持续存在并在上皮损伤消退后继续产生胶原基质。 最后,该模型对具有常驻星状细胞/周细胞群的其他上皮组织的再生具有潜在相关性,如成人胰腺和肾脏( 64 ). 我们的研究表明,αSMA表达细胞中SMO的条件性缺失减少了肾脏αSMA的数量 + 单元格(补充图10)。 如果这些组织中的星状细胞/周细胞也能保持足够的可塑性以转化为替代上皮细胞,那么SMO可能是成年人上皮修复的主要调节器。 此外,因为SMO的激活受到许多不同的细胞表面分子的调节,这些分子影响着细胞的命运决定( 15 ),它可能是一种新的“药物”靶点,以防止纤维化,并确保在多种组织损伤期间健康上皮的再生。
方法 动物和实验设计。 平滑(Smo) tm2麦克 /J(SMO-flox)小鼠( 65 )和ROSA Stop flox YFP小鼠( 38 )从Jackson实验室获得,并与αSMA-Cre-ER杂交 T2段 转基因小鼠( 24 )在αSMA启动子的控制下表达TMX调节的Cre重组酶。 DTGαSMA-Core×SMO/flox纯合子对照小鼠通过SMO/flo纯合子、αSMA-Cre-ER杂交获得 T2段 SMO/flox纯合子小鼠的半合子小鼠。 此外,αSMA-Cre-ER T2段 通过杂交ROSA-Stop-flox-YFP纯合子、αSMA-Cre-ER培育×ROSA-Sop-flox-YFP小鼠 T2段 带有ROSA-Stop-flox-YFP纯合子小鼠的半合子小鼠。 如前所述,成年(8-12周龄)小鼠接受BDL或假手术( 66 ) ( n个 =每组11只小鼠)。 术后14天处死动物; 采集血液和肝脏样本。
诱导氧化性肝损伤并激活HSC和肝祖细胞群,αSMA-Cre-ER T2段 如前所述,给×SMO/flox DTG小鼠喂食添加0.15%乙硫氨酸(MCDE)的缺乏蛋氨酸/胆碱的饮食( 7 ). 将动物分为两组,每组接受其中一种运载工具( n个 =5)或TMX( n个 =6),喂食MCDE饮食1周后处死存活小鼠。 Chow-fedαSMA-Cre-ER公司 T2段 ×SMO/flox DTG小鼠( n个 =6)或TMX( n个 =6)也在同一时间点被处死。
IKKβ 飞行/飞行 和IKKβ ΔHep 这些老鼠是迈克尔·卡林(美国加利福尼亚州圣地亚哥UCSD)送的礼物。 IKKβ 飞行/飞行 用蛋白核心小鼠繁殖小鼠,以产生蛋白表达细胞及其后代IKKβ缺陷的动物(即IKK ΔHep ) ( 67 ). 所有老鼠都被关在一个设施中,光照/黑暗周期为12小时,允许自由获取食物和水。 两种单转基因IKKβ 飞行/飞行 和DTG IKKβ ΔHep 如上所述,动物受到BDL( n个 =每组4只小鼠)。
ROSA-Stop-flox-LacZ小鼠来自Jackson实验室( http://www.jax.org ). 在构成性GFAP调节元件(GFAP-Cre-ER小鼠)的控制下表达Cre重组酶的小鼠与先前描述的ROSA-Stop-flox-LacZ转基因小鼠杂交( 8 ). 成年雄性PTC LacZ报告小鼠先前已有描述( 18 ).
TMX注入。 为了启动Cre介导的漂浮等位基因的基因重排,接受假手术或BDL(约25 g体重)的DTG小鼠以每公斤体重10 mg的剂量腹腔注射TMX(Sigma-Aldrich)。 GFAP小鼠在第0天开始注射BDL损伤,αSMA小鼠在第4天开始注射。 每隔一天注射一次,直到手术后第14天采集组织。 对于MCDE饮食诱导的损伤,从MCDE膳食给药的第0天开始注射TMX,每隔一天注射一次,直到第7天收获组织。
β-半乳糖苷酶染色。 如前所述,使用β-半乳糖苷酶检测试剂盒(Promega)对全山组织和石蜡包埋组织中的β-半乳糖苷酶进行染色( 68 ).
羟脯氨酸测定。 如前所述,用比色法定量快速冷冻肝脏样品中的肝羟脯氨酸含量( 7 ). 根据用高纯度羟脯氨酸(Sigma-Aldrich)制备的标准曲线计算浓度,并以每克肝脏中的羟脯氨酸毫克数表示。
免疫组织化学。 肝组织用福尔马林固定,石蜡包埋。 根据制造商的方案,使用DAKO Envision System(DAKO Corporation)进行免疫组织化学染色,检测GLI2、SMO、αSMA、弹性蛋白、Krt19、SOX9、AFP、结蛋白、Ki67和细胞周期蛋白D1。 如前所述进行免疫染色( 69 ). 简单地说,福尔马林固定石蜡包埋的肝组织被切割成5μm的切片,并放置在玻璃载玻片上。 切片用二甲苯脱蜡,用乙醇脱水,然后用3%过氧化氢孵育以阻断内源性过氧化物酶。 通过在10 mM柠檬酸钠缓冲液(pH 6.0)中加热或与胃蛋白酶(00-3009;Invitrogen)孵育进行抗原回收。 在DAKO蛋白块(X9090;DAKO)中阻断切片,然后与一级抗体孵育。 使用了以下主要抗体:GLI2(GWB-EB3B44;1:4500;GenWay Biotech)、结蛋白(ab6322;1:1000;Abcam)、弹性蛋白(BA-4;1:2000;Santa Cruz Biotechnology Inc.)、Krt19(Troma III,1:400;Hydroma Bank)、AFP(A0008,1:400)、αSMA(M0851;1:500;DAKO)、SOX9(AB5535;1:1000、Millipore)、Ki67(NCL-Ki67-MM1;1:1000,Novocast)、, 细胞周期蛋白D1(ab16663;1:1000;Abcam); SMO(sc-6366;1:150;圣克鲁斯生物技术公司); YFP(GFP-1020;1:600;Aves实验室); 和GFAP(DAKO;1:1000;Novus)。 HRP缀合的抗兔(K4003;DAKO)、抗小鼠(K4001;DAKO)二级抗体用于观察靶蛋白。 检测过程中使用DAB试剂(K3466;DAKO)。 用Aqua Hematoxylin INNOVEX(INNOVEX Biosciences)对组织切片进行复染。 根据制造商的建议(BioCare Medical),使用Vina Green进行双重免疫组化。 阴性对照组包括暴露于1%牛血清白蛋白而非各自的主要抗体的肝脏标本。
通过形态计量学(MetaView软件,Universal Imaging Corp.)评估天狼星红染色和αSMA、结蛋白和弹性蛋白免疫组化染色。 为了进行形态计量量化,对每只小鼠的10个随机选择的场进行了评估,每个截面放大×20倍。 使用类似方法量化GLI2、SOX9、Ki67和cyclin D1染色:对于每个参数,在每只小鼠每节10个随机选择的×20个区域内计数细胞核染色的细胞数量。
原位杂交。 为了检测分离的HSC和肝细胞内的特定转录物,根据制造商的协议,使用针对小鼠白蛋白(VB6-12839,Panomics)、胶原蛋白1α1(VB1-13595,Panomic)和GFAP(VB1-10623,Panommics)mRNA的经验证探针进行FISH。 简单地说,使用4%甲醛将新分离的HSC和肝细胞或第7天培养激活的HSC固定在盖玻片上。 细胞被渗透并与图中所示的探针杂交 8 B.Q-HSC多重杂交为GFAP(Cy3)和白蛋白(Cy5)。 MF-HSC复合杂交为COL1A1(Cy3)和白蛋白(Cy5。 然后使用DAPI(Vector Laboratories)将载玻片安装在Vectashide水性安装介质中。 用蔡司710倒置共聚焦显微镜通过杜克共聚焦显微镜核心设备观察载玻片。
免疫细胞化学。 HSC被胞浆或生长在盖玻片上7天。 细胞被清洗,固定在4%多聚甲醛中,用冷甲醇渗透,并在室温下与一级抗体孵育2小时。 细胞在PBS中清洗,并在室温下与Alexa Fluor 594山羊抗鼠IgG或Alexa Fluor 488山羊抗兔IgG(H+L)孵育45分钟。 使用Prolong Gold防褪色试剂(Invitrogen)将载玻片安装在载玻片上,并使用蔡司710倒置共焦显微镜(卡尔蔡司)进行观察。
HSC隔离和培养。 从DTG小鼠和IKKβ中分离出原代HSC 飞行/飞行 和IKKβ ΔHep 老鼠。 评估分离的HSC的纯度和活力(补充图16C),并以3×10的密度播种 2 每毫米电池数 2 如前所述,补充10%胎牛血清和青霉素/链霉素的DMEM( 11 ).
HSC的腺病毒转导。 如前所述,在培养第4天,将携带GFP基因(AdGFP)或Cre重组酶基因(AdCre)的腺病毒以50的MOI添加到原代小鼠HSC中( 11 ). 24小时后,抽吸含病毒培养基并用新鲜培养基替换。 通过共聚焦显微镜评估AdGFP感染的病毒效率,发现>95%的感染细胞为GFP阳性。 通过对细胞全细胞提取物的Western分析证实了感染细胞的Cre表达。
伤害措施。 根据制造商的说明,分别使用Biotron Diagnostics(66-D)和Cayman Chemicals(10010303)的商用试剂盒测量血清丙氨酸氨基转移酶和甘油三酯。 使用罗氏应用科学公司(In-Situ Cell Death Detection assay,11-684-817-910)提供的商用分析对石蜡包埋组织进行TUNEL分析
细胞系维护。 人类MF-HSC线LX2(由美国纽约州纽约市西奈山医学院斯科特·弗里德曼提供)( 70 )在Dulbecco改良的Eagle's培养基中培养,补充10%胎牛血清,1 mM 我 -谷氨酰胺和100IU/ml青霉素/链霉素。
克隆衍生大鼠MF-HSC 8B系( 71 )在RPMI 1640培养基中培养,并补充10%胎牛血清和100 IU/ml青霉素/链霉素。 所有细胞均通过胰蛋白酶消化获得并用于流式细胞仪分析。 补充表1提供了所有HSC株系的表型特征
两步实时RT-PCR和常规RT-PCR。 使用TRI从细胞、肝脏或大脑中提取总RNA 佐尔 (Invitrogen),然后进行无RNase DNase I治疗(Qiagen)。 使用随机引物和SuperScript RNase H-reverse Transcriptase(Invitrogen)将RNA反向转录到cDNA模板并扩增。
对于半定量qRT-PCR,使用StepOne Plus Real-Time PCR Platform(ABI/Life Technologies)和靶序列的特异性寡核苷酸引物以及核糖体S9看家基因扩增1.5%的第一链反应。 qRT-PCR参数如下:在95℃下变性3分钟,然后在95℃变性40个周期10秒,在最佳引物温度下退火/延伸60秒。 阈值周期( C类 t吨 )由StepOne Plus实时检测系统自动计算。 细胞中的靶基因水平以与根据2 –ΔΔCt 方法。 补充表3列出了引物序列。
流式细胞术。 所有染色步骤均在4°C的黑暗中进行,并用BD-Fc Block封闭。 对于表面染色,细胞在流式细胞术染色缓冲液(eBioscience)中与抗体孵育30分钟,并用流式细胞仪缓冲液清洗3次。 对于细胞内染色,细胞用Cytofix/Cytoperm缓冲液(BD-PharMinen)固定并渗透20分钟,用Perm/Wash缓冲液(BG-PharMineng)洗涤两次,然后用抗体在Perm/Wash-缓冲液中培养30分钟。 流式细胞术数据采集采用LSR II(BD)和FACSDiva软件,分析采用FlowJo软件(TreeStar)。 用BODIPY 493/503(4,4-二氟-1,3,5,7,8-五甲基-4-bora-3a,4a-diaza- 秒 -茚)(20μg/ml;Invitrogen)30分钟,并使用FITC通道进行分析。 用FITC通道分析肝细胞中YFP的表达。 抗体和结合物列于补充表2中。
统计学。 所有数据均表示为平均值±SEM。使用Student’s t吨 测试。 所有分析均使用GraphPad Prism 4软件(GraphPad-software Inc.)进行。 与的差异 P(P) ≤0.05被认为具有统计学意义。
研究批准。 动物护理和手术程序由杜克大学医学中心机构动物护理和使用委员会批准,如 实验动物护理和使用指南 由美国国立卫生研究院出版。
致谢 这项工作得到了NIH拨款R37 AA010154和R01 DK077794(给A.M.Diehl)的部分支持。
脚注
关于本手稿评估的说明: 杜克大学、北卡罗来纳大学教堂山分校、杜克-美国和桑福德-伯纳姆医学研究所的科学家撰写的手稿,不是由编辑委员会成员处理,而是由科学编辑处理,他们与选定的外部编辑和审稿人协商。
本文引文: 临床投资杂志。 2013; 123(6):2380–2394. doi:10.1172/JCI66904。
工具书类
1 Pinzani M,Rosselli M,Zuckermann M。肝硬化。 临床胃肠病学最佳实践研究。 2011; 25(2):281–290. doi:10.1016/j.bpg.2011.02.009。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Lee UE,Friedman SL。肝纤维化的机制。 临床胃肠病学最佳实践研究。 2011; 25(2):195–206. doi:10.1016/j.bpg.2011.02.005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
三。 威尔斯RG。 肝纤维化中细胞外基质的细胞来源。 临床肝病。 2008 12 4 759 768 ,viii。 2016年10月10日/j.cld.2008.07.008 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
4 Hernandez-Gea V,Friedman SL.肝纤维化的发病机制。 《病理学年鉴》。 2011; 6:425–456. doi:10.1146/annurev-pathol-011110-130246。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
5 罗斯卡姆T。 星形细胞活化、祖细胞和肝再生之间的关系。 临床肝病。 2008 12 4 853 860 、ix。 2016年10月10日/j.cld.2008.07.014 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
6 Hinz B等人,《肌成纤维细胞生物学的最新发展:结缔组织重塑范式》。 《美国病理学杂志》。 2012; 180(4):1340–1355. doi:10.1016/j.ajpath.2012.02.004。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
7 Jung Y等。来自死亡肝细胞的信号触发肝祖细胞的生长。 内脏。 2010; 59(5):655–665. doi:10.1136/gut.2009.204354。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
8 Yang L等。肝星状细胞是成年小鼠肝脏上皮祖细胞的命运图证据。 干细胞。 2008; 26(8):2104–2113. doi:10.1634/stemcells.2008-0115。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
9. Beachy PA、Hymowitz SG、Lazarus RA、Leahy DJ、Siebold C。Hedgehog蛋白质及其结合伙伴之间的相互作用被纳入考虑范围。 基因开发2010; 24(18):2001–2012. doi:10.1101/gad.1951710。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
10 Omenetti A,Choi S,Michelotti G,Diehl AM。肝脏中的刺猬信号。 肝素杂志。 2011; 54(2):366–373. doi:10.1016/j.jhep.2010.10.03。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Choi SS等人Leptin通过激活hedgehog通路促进肝星状细胞中的肌成纤维细胞表型。 生物化学杂志。 2010; 285(47):36551–36560. doi:10.1074/jbc。 M110.168542。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Omenetti A等。Hedgehog介导的间质-上皮相互作用调节肝对胆管结扎的反应。 实验室投资。 2007; 87(5):499–514. doi:10.1111/1523-1747.ep12455571。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
13 Yang L等。声波刺猬是肌纤维母细胞肝星状细胞的自分泌生存因子。 肝素杂志。 2008; 48(1):98–106. doi:10.1016/j.jep.2007.07.32。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
14 Omenetti A,Diehl AM。胆管细胞中的Hedgehog信号。 胃肠病学当前操作。 2011; 27(3):268–275. doi:10.1097/MOG.0b013e32834550b4。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
15 陈伟,等。β-arrestin 2和GRK2介导的平滑肌细胞活性依赖性内化。 科学。 2004; 306(5705):2257–2260. doi:10.1126/science.1104135。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
16 Javelaud D、Alexaki VI、Dennler S、Mohammad KS、Guise TA、Mauviel A.肿瘤进展和转移中的TGF-beta/SMAD/GLI2信号轴。 2011年癌症研究; 71(17):5606–5610. doi:10.1158/0008-5472.CAN-11-1194。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
17 Fan Q等。SMO介导的致癌作用对TGF-β信号的要求。 生物化学杂志。 2010; 285(47):36570–36576. doi:10.1074/jbc。 C110.164442。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
18 Sicklick JK等。人类肝癌发生过程中Hedgehog通路的失调。 致癌。 2006; 27(4):748–757. doi:10.1093/carcin/bgi292。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
19 Ochoa B等。Hedgehog信号对小鼠部分肝切除术后的正常肝再生至关重要。 肝病学。 2010; 51(5):1712–1723. doi:10.1002/hep.23525。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
20 Philips GM等。Hedgehog信号拮抗剂促进原发性肝癌小鼠模型中肝纤维化和肝癌的消退。 公共科学图书馆一号。 2011; 6(9):e23943。 doi:10.1371/journal.pone.0023943。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
21 Higashi N、Kojima N、Miura M、Imai K、Sato M、Senoo H。哺乳动物(人和大鼠)肝星状细胞之间的细胞-细胞连接。 细胞组织研究2004; 317(1):35–43. doi:10.1007/s00441-004-0891-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
22. Lim YS、Lee HC和Lee HS。 大鼠肝星状细胞激活过程中钙粘蛋白表达从E型转变为N型。 组织化学细胞生物学。 2007; 127(2):149–160. doi:10.1007/s00418-006-0233-y。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
23. Cho IJ等。E-cadherin通过抑制RhoA-依赖性Smad3磷酸化,拮抗肝星状细胞中转化生长因子β1基因的诱导。 肝病学。 2010; 52(6):2053–2064. doi:10.1002/hep.23931。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
24 O Wendling,Bornert JM,Chambon P,Metzger D.在成年小鼠平滑肌细胞中进行有效的时间控制靶向诱变。 起源。 2009; 47(1):14–18. doi:10.1002/dvg.20448。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
25. Li Z、Dranoff JA、Chan EP、Uemura M、Sevigny J、Wells RG。 转化生长因子β和基质硬度调节培养中门静脉成纤维细胞的活化。 肝病学。 2007; 46(4):1246–1256. doi:10.1002/hep.21792。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
26 Iwaisako K、Brenner DA、Kisseleva T。肝纤维化有什么新进展? 肝纤维化中肌成纤维细胞的起源。 胃肠病学肝病杂志。 2012; 2:65–68. doi:10.1111/j.1440-1746.2011.07002.x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
27 Zhang L、Theise N、Chua M、Reid LM。 人类肝脏干细胞生态位:发育和再生之间的对称性。 肝病学。 2008; 48(5):1598–1607. doi:10.1002/hep.22516。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
28 李明明,克劳福德。胆汁淤积的病理学。 塞米恩肝病。 2004; 24(1):21–42. doi:10.1055/s-2004-823099。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
29 Durnez A等。肝细胞癌中细胞角蛋白7和19表达的临床病理学和预后相关性。 一种可能的祖细胞来源。 组织病理学。 2006; 49(2):138–151. doi:10.1111/j.1365-2559.2006.02468.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
30. Novo E、di Bonzo LV、Cannito S、Colombatto S、Parola M。肝肌成纤维细胞:肝纤维化中多功能细胞的异质群体。 国际生物化学与细胞生物学杂志。 2009; 41(11):2089–2093. doi:10.1016/j.biccel.2009.03.010。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
31 Dranoff JA,Wells RG。 门静脉成纤维细胞:未被充分认识的胆道纤维化介质。 肝病学。 2010; 51(4):1438–1444. doi:10.1002/hep.23405。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
32 Furuyama K等人。成年肝脏、外分泌胰腺和肠道中Sox9表达祖细胞区的持续细胞供应。 自然遗传学。 2011; 43(1):34–41. doi:10.1038/ng.722。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
33 Cardinale V等人。人类胆道树中的多能干/祖细胞产生肝细胞、胆管细胞和胰岛。 肝病学。 2011; 54(6):2159–2172. doi:10.1002/hep.24590。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
34 Dorrell C等。在成年小鼠中前瞻性分离双潜能克隆原性肝祖细胞。 基因开发2011; 25(11):1193–1203. doi:10.1101/gad.2029411。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
35. Carpino G等人。肝外和肝内胆管腺体中的胆汁树干/祖细胞:一项解剖原位研究,提供成熟谱系的证据。 J Anat杂志。 2012; 220(2):186–199. doi:10.1111/j.1469-7580.2011.01462.x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
36 Kalinichenko VV等。叉头盒M1B转基因的普遍表达加速了肺损伤后不同类型肺细胞的增殖。 生物化学杂志。 2003; 278(39):37888–37894. doi:10.1074/jbc。 M305555200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
37 Nelsen CJ、Rickheim DG、Tucker MM、Hansen LK、Albrecht JH。 有证据表明,细胞周期蛋白D1介导肝细胞TOR下游的生长和增殖。 生物化学杂志。 2003; 278(6):3656–3663. doi:10.1074/jbc。 M209374200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
38 Srinivas S等人通过将EYFP和ECFP靶向插入ROSA26基因座产生的Cre报告菌株。 BMC开发生物。 2001; 1:4. doi:10.1186/1471-213X-1-4。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
39 Hinz B、Phan SH、Thannickal VJ、Galli A、Bochaton-Piallat ML、Gabbiani G。肌成纤维细胞:一种功能,多种来源。 《美国病理学杂志》。 2007; 170(6):1807–1816. doi:10.2353/ajpath.2007.070112。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
40 Kordes C等。CD133+肝星状细胞是祖细胞。 生物化学与生物物理研究委员会。 2007; 352(2):410–417. doi:10.1016/j.bbrc.2006.11.029。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
41 Hanley KP、Oakley F、Sugden S、Wilson DI、Mann DA、Hanley NA。异位SOX9介导器官纤维化的细胞外基质沉积特征。 生物化学杂志。 2008; 283(20):14063–14071. doi:10.1074/jbc。 M707390200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
42. Chu AS等。血统追踪显示,在肝纤维化小鼠模型中没有胆管细胞上皮-间充质转化的证据。 肝病学。 2011; 53(5):1685–1695. doi:10.1002/hep.24206。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
43 Troeger JS等。小鼠肝纤维化消退过程中肝星状细胞的失活。 胃肠病学。 2012; 143(4):1073–1083. doi:10.1053/j.gastro.2012.06.036。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
44. Kisseleva T等。在肝纤维化消退过程中,肌成纤维细胞恢复为非活性表型。 美国国家科学院院刊2012; 109(24):9448–9453. doi:10.1073/pnas.1201840109。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
45 Elmaouhoub A、Dudas J、Ramadori G。大鼠肝脏发育过程中白蛋白和α-脂肪蛋白生成的动力学。 组织化学细胞生物学。 2007; 128(5):431–443. doi:10.1007/s00418-007-0338-y。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
46. Gailhouste L.小鼠胚胎成肝细胞的分离纯化方法。 方法分子生物学。 2012; 826:33–47. doi:10.1007/978-1-61779-468-14。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
47 Arkan MC等。IKK-β将炎症与肥胖诱导的胰岛素抵抗联系起来。 《国家医学》,2005年; 11(2):191–198. doi:10.1038/nm1185。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
48 Asahina K,Zhou B,Pu WT,Tsukamoto H.横隔来源的间皮在发育中的小鼠肝脏中产生肝星状细胞和血管周围间充质细胞。 肝病学。 2011; 53(3):983–995. doi:10.1002/hep.24119。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
49 Scholten D等。基因标记不能检测到小鼠肝纤维化中胆管细胞的上皮-间充质转化。 胃肠病学。 2010; 139(3):987–998. doi:10.1053/j.gastro.2010.05.005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
50 Bien-Willner GA、Stankiewicz P、Lupski JR.SOX9cre1是位于SOX9上游1.1 Mb的顺式调节元件,通过SHH途径调节其增强。 人类分子遗传学。 2007; 16(10):1143–1156. doi:10.1093/hmg/ddm061。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
51 Cervantes S、Lau J、Cano DA、Borromeo-Austin C、Hebrok M。初级纤毛调节胰腺中的Gli/Hedgehog激活。 美国国家科学院院刊2010; 107(22):10109–10114. doi:10.1073/pnas.0909900107。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
52 Katoh Y,Katoh M.Hedgehog信号转导,上皮-间充质转化和miRNA(综述)。 国际分子医学杂志,2008年; 22(3):271–275. [ 公共医学 ] [ 谷歌学者 ]
53 Shen K,等。在对乙酰氨基酚诱导的肝损伤中,活化肝星状细胞的耗竭与严重肝损伤和异常肝再生相关。 生物化学学报(上海)。 2011; 43(4):307–315. doi:10.1093/abbs/gmr005。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
54 Kalinichenko VV等。Foxf1+/-小鼠在CCl4损伤后表现出有缺陷的星状细胞激活和异常的肝再生。 .肝病学。 2003; 37(1):107–117. doi:10.1053/jhep.com3.50005。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
55 Chaffer CL等人。正常和肿瘤性非干细胞可以自发转化为干样状态。 美国国家科学院院刊2011; 108(19):7950–7955. doi:10.1073/pnas.1102454108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
56 Scheel C等。旁分泌和自分泌信号诱导并维持乳腺中的间充质和干细胞状态。 单元格。 2011; 145(6):926–940. doi:10.1016/j.cell.2011.04.029。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
57 达菲尔德JS。 肌成纤维细胞难以捉摸的来源:问题解决了吗? 《国家医学》2012; 18(8):1178–1180. doi:10.1038/nm.2867。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
58 Duffield JS、Lupher M、Thannickal VJ、Wynn TA。 组织修复和纤维化中的宿主反应。 《病理学年鉴》。 2013; 8:241–276. doi:10.1146/annurev-pathol-020712-163930。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
59 Hutchison N、Fligny C、Duffield JS。 常驻间充质细胞和纤维化。 生物化学生物物理学报。 2012; pii:S0925-4439(12)00275-X.doi:10.1016/j.badis.2012.11.015。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
60 Heng JC、Orlov YL、Ng HH。 调节多能性和重编程的转录因子。 冷泉Harb Symb Quant生物。 2010; 75:237–244. doi:10.1101/sqb.2010.75.003。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
61 Duncan AW、Dorrell C、Grompe M.干细胞与肝再生。 胃肠病学。 2009; 137(2):466–481. doi:10.1053/j.gastro.2009.05.044。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
62 Michalopoulos GK公司。 肝再生:替代上皮途径。 国际生物化学与细胞生物学杂志。 2011; 43(2):173–179. doi:10.1016/j.bicel.2009.09.014。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
63 Yin C,Evason KJ,Maher JJ,Stainier DY。bHLH转录因子Hand2标记斑马鱼肝星状细胞:星状细胞进入发育中肝脏的分析。 肝病学。 2012; 56(5):1958–1970. doi:10.1002/hep.25757。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
64 Nagy NE等。正常大鼠肝外星状细胞中维生素A的储存。 1997年《脂质研究杂志》; 38(4):645–658. [ 公共医学 ] [ 谷歌学者 ]
65. Long F、Zhang XM、Karp S、Yang Y、McMahon AP。 软骨内骨骼中刺猬信号的基因操纵揭示了其在软骨细胞增殖调控中的直接作用。 发展。 2001; 128(24):5099–5108. doi:10.1242/dev.128.24.5099。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
66 Omenetti A等。Hedgehog信号调节啮齿动物和人类胆道纤维化期间的上皮-间充质转化。 临床投资杂志。 2008; 118(10):3331–3342. doi:10.1172/JCI35875。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
67 Beraza N、Ludde T、Assmus U、Roskams T、Vander Borght S、Trautwin C。肝细胞特异性IKKγ/NEMO表达决定了肝损伤的程度。 胃肠病学。 2007; 132(7):2504–2517. doi:10.1053/j.gastro.2007.03.045。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
68 Sicklick JK等人。刺猬信号在一生中维持着常驻肝祖细胞。 美国生理学杂志胃肠病学肝病生理学。 2006; 290(5):G859–G870。 doi:10.1152/ajpgi.00456.2005。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
69 Omenetti A等。胆管细胞5-羟色胺合成的旁分泌调节调节调节成人胆道重塑。 美国生理学杂志胃肠病学肝病生理学。 2011; 300(2):G303–G315。 doi:10.1152/ajpgi.00368.2010。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
70 Xu L,等。人肝星状细胞系,LX-1和LX-2:肝纤维化分析的新工具。 内脏。 2005; 54(1):142–151. doi:10.1136/gut.2004.042127。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
71 Greenwel P、Schwartz M、Rosas M、Peyrol S、Grimaud JA、Rojkind M。正常和CCl4-肝硬化脂肪储存细胞系的特征。 白细胞介素-6产生的差异。 实验室投资。 1991; 65(6):644–653. [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。