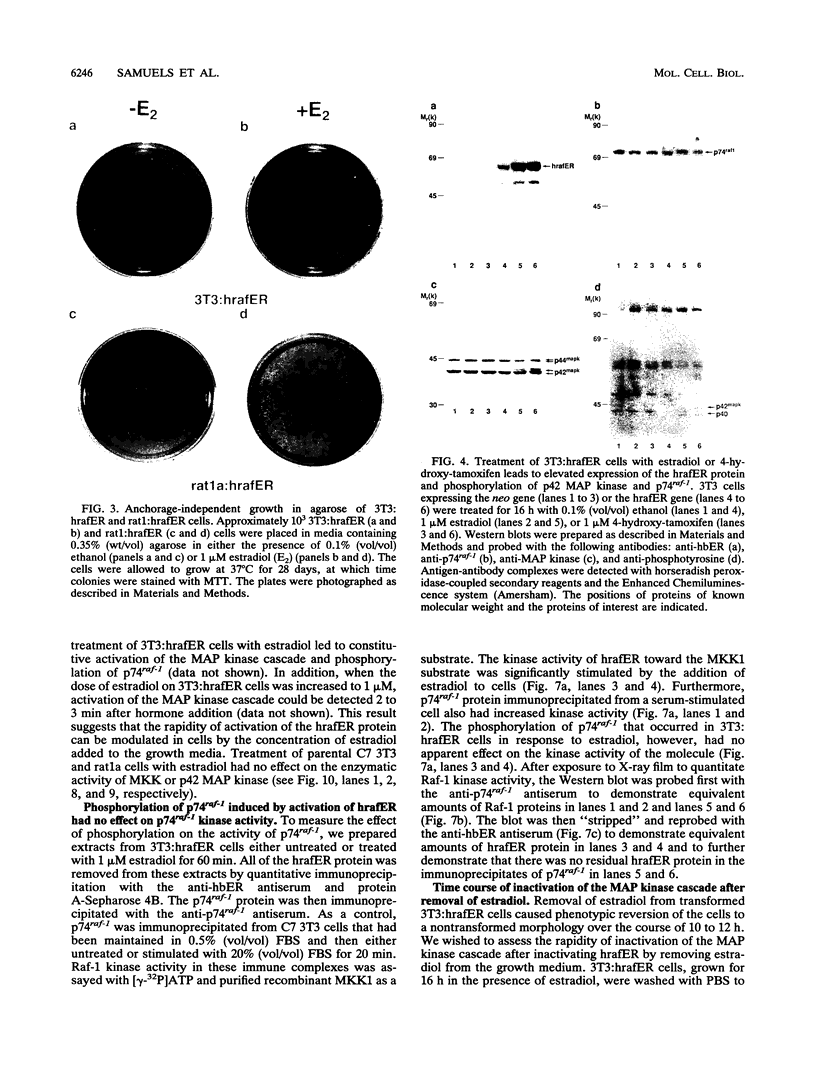
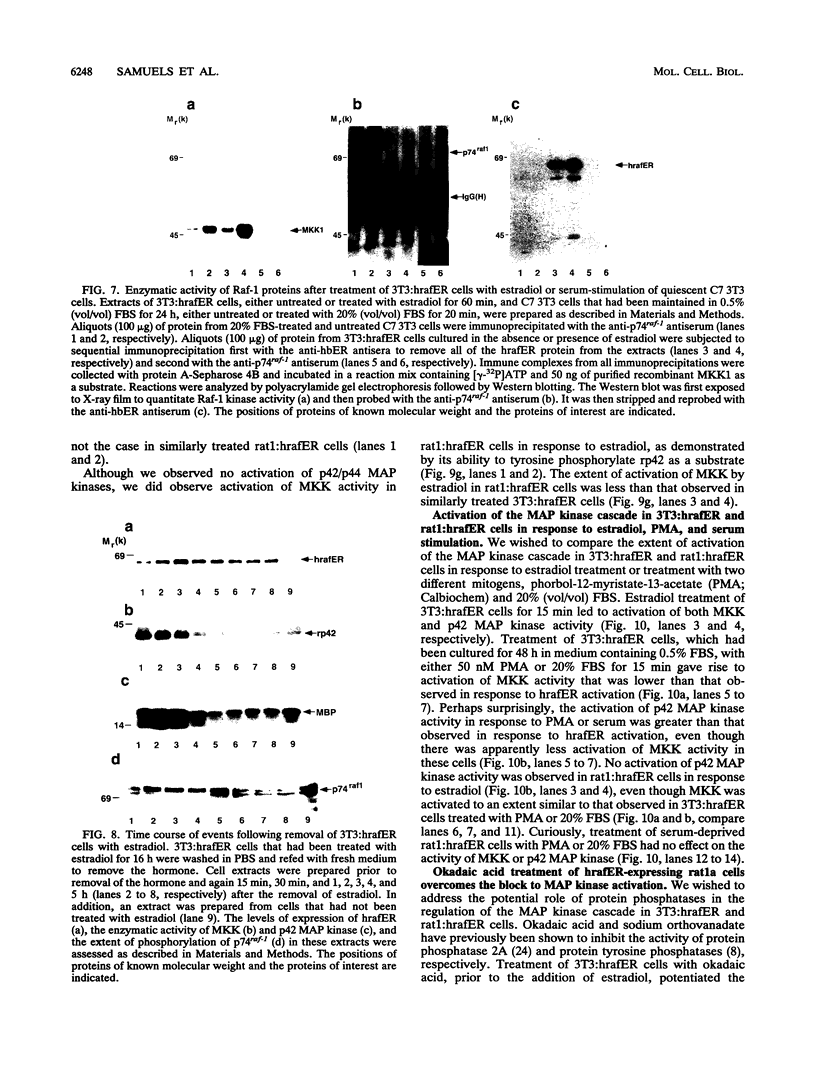
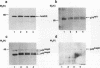
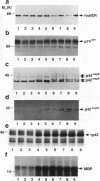
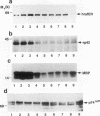
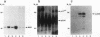摘要
我们报道了一种调节细胞质信号分子(由raf-1编码的蛋白激酶)活性的策略。构建了编码人类p74raf-1致癌形式与人类雌激素受体(hrafER)激素结合域之间基因融合的逆转录病毒。融合蛋白在不存在雌二醇的情况下是不转化的,但可以通过添加雌二醇或从生长培养基中去除雌二醇而可逆地激活。在C7 3T3细胞中,hrafER的激活伴随着丝裂原活化蛋白(MAP)激酶激酶和p42/p44 MAP激酶的快速蛋白合成依赖性激活,以及电泳迁移率降低所证明的常驻p74raf-1蛋白的磷酸化。p74raf-1的磷酸化对蛋白的激酶活性没有影响,表明迁移率变化是p74rav-1酶活性的不可靠指标。从生长介质中去除雌二醇导致MAP激酶级联快速失活。这些结果表明,Raf-1可以在体内激活MAP激酶级联,而不依赖于其他“上游”信号成分。对经hrafER条件转化的rat1a细胞进行的平行实验表明,MAP激酶激酶在雌二醇作用下激活,但随后没有激活p42/p44 MAP激酶或p74raf-1磷酸化。这一结果表明,在rat1a细胞中,Raf-1介导的致癌转化不需要p42/p44 MAP激酶激活。然而,当细胞用冈田酸预处理时,在表达hrafER的rat1a细胞中观察到p42/p44 MAP激酶的雌二醇依赖性激活和p74raf-1的磷酸化。这一结果表明,蛋白磷酸酶活性水平可能在MAP激酶级联的调节中发挥关键作用。我们的结果提供了第一个细胞溶质信号传感器通过与雌激素受体的激素结合域融合而被利用的例子。这个条件系统不仅有助于阐明Raf-1的功能,而且可能更广泛地用于构建其他激酶和信号分子的条件形式。
选定的引用
这些参考文献在PubMed中。这可能不是本文的完整参考文献列表。
-
Ahn N.G.、Robbins D.J.、Haycock J.W.、Seger R.、Cobb M.H.、Krebs E.G.用神经生长因子或缓激肽刺激的PC12细胞中微管相关蛋白2激酶ERK1和ERK2的激活剂的鉴定。神经化学杂志。1992年7月;59(1):147–156。doi:10.1111/j.1471-4159.1992.tb08885.x。[内政部] [公共医学] [谷歌学者]
-
Ambrosio L.、Mahowald A.P.、Perrimon N.果蝇raf同系物对躯干功能的要求。自然。1989年11月16日;342(6247):288–291. doi:10.1038/342288a0。[内政部] [公共医学] [谷歌学者]
-
Anderson N.G.、Li P.、Marsden L.A.、Williams N.、Roberts T.M.、Sturgill T.W.Raf-1是体内有丝分裂原活化蛋白激酶的潜在底物。《生物化学杂志》1991年7月15日;277(第2部分):573–576。doi:10.1042/bj2770573。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Ashworth A.、Nakielny S.、Cohen P.和Marshall C.哺乳动物MAP激酶的氨基酸序列。致癌物。1992年12月;7(12):2555–2556.[公共医学] [谷歌学者]
-
Beck T.W.、Huleihel M.、Gunnell M.、Bonner T.I.、Rapp U.R.人类A-raf-1癌基因的完整编码序列和携带逆转录病毒的人类A-raf的转化活性。《核酸研究》1987年1月26日;15(2):595–609. doi:10.1093/nar/15.2595。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
布莱尼斯J.通过MAP激酶进行信号转导:在你自己的RSK上进行。美国国家科学院院刊1993年7月1日;90(13):5889–5892. doi:10.1073/pnas.90.13.5889。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Boehmelt G.、Walker A.、Kabrun N.、Mellizer G.、Beug H.、Zenke M.、Enrietto P.J.激素调节的v-rel雌激素受体融合蛋白:可逆诱导细胞转化和细胞基因表达。EMBO J.1992年12月;11(12):4641–4652. doi:10.1002/j.1460-2075.1992.tb05566.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Brown D.J.,Gordon J.A.钒酸盐对完整细胞中pp60v-src激酶活性的刺激伴随着酶的新磷酸化状态。生物化学杂志。1984年8月10日;259(15):9580–9586.[公共医学] [谷歌学者]
-
Burk O.,Klempnauer K.H.由v-myb/雌激素受体融合蛋白引起的髓系细胞分化状态中的雌激素依赖性改变。EMBO J.1991年12月;10(12):3713–3719. doi:10.1002/j.1460-2075.1991.tb04939.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Charles C.H.、Sun H.、Lau L.F.、Tonks N.K.。生长因子诱导的即刻早期基因3CH134编码蛋白酪氨酸磷酸酶。美国国家科学院院刊1993年6月1日;90(11):5292–5296. doi:10.1073/pnas.90.11.5292。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Chen R.H.,Sarnecki C.,Blenis J.erk和rsk编码蛋白激酶的核定位和调控。分子细胞生物学。1992年3月;12(3):915–927. doi:10.1128/mcb.12.3.915。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Christopherson K.S.、Mark M.R.、Bajaj V.、Godowski P.J.果蝇蜕皮激素受体和嵌合反式激活剂对哺乳动物细胞中基因的蜕皮激素依赖性调节。美国国家科学院院刊1992年7月15日;89(14):6314–6318. doi:10.1073/pnas.89.14.6314。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Cobb M.H.、Robbins D.J.、Boulton T.G.ERKs,细胞外信号调节MAP-2激酶。当前操作细胞生物学。1991年12月;3(6):1025–1032. doi:10.1016/0955-0674(91)90124-h。[内政部] [公共医学] [谷歌学者]
-
机组人员C.M.、Alessandrini A.、Erikson R.L.Erks:他们的十五分钟到了。细胞生长差异。1992年2月;3(2):135–142.[公共医学] [谷歌学者]
-
Crews C.M.、Alessandrini A.、Erikson R.L.MEK的一级结构,MEK是一种磷酸化ERK基因产物的蛋白激酶。科学。1992年10月16日;258(5081):478–480. doi:10.1126/science.1411546。[内政部] [公共医学] [谷歌学者]
-
Dent P.、Haser W.、Haystead T.A.、Vincent L.A.、Roberts T.M.、Sturgill T.W.通过v-Raf在NIH 3T3细胞和体外激活有丝分裂原活化蛋白激酶。科学。1992年9月4日;257(5075):1404–1407. doi:10.1126/science.1326789。[内政部] [公共医学] [谷歌学者]
-
Dickson B.、Sprenger F.、Morrison D.、Hafen E.Raf在Ras1下游的Sevenless信号转导途径中发挥作用。自然。1992年12月10日;360(6404):600–603. doi:10.1038/360600a0。[内政部] [公共医学] [谷歌学者]
-
Eilers M.、Picard D.、Yamamoto K.R.、Bishop J.M.Chimaeras的myc癌蛋白和类固醇受体导致细胞的激素依赖性转化。自然。1989年7月6日;340(6228):66–68. doi:10.1038/340066a0。[内政部] [公共医学] [谷歌学者]
-
Gallego C.,Gupta S.K.,Heasley L.E.,Qian N.X.,Johnson G.L.,NIH 3T3和大鼠1a细胞中选择性癌基因表达导致的有丝分裂原激活蛋白激酶激活。美国国家科学院院刊1992年8月15日;89(16):7355–7359. doi:10.1073/pnas.89.16.7355。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Godowski P.J.、Picard D.、Yamamoto K.R.糖皮质激素受体-LexA融合蛋白的信号转导和转录调控。科学。1988年8月12日;241(4867):812–816。doi:10.1126/science.3043662。[内政部] [公共医学] [谷歌学者]
-
Gupta S.K.、Gallego C.、Johnson G.L.、Heasley L.E.MAP激酶在gip2和src转化的大鼠1a成纤维细胞中组成性激活。生物化学杂志。1992年4月25日;267(12):7987–7990.[公共医学] [谷歌学者]
-
Han M.、Golden A.、Han Y.、Sternberg P.W.C.elegans lin-45 raf基因参与let-60 ras刺激的外阴分化。自然。1993年5月13日;363(6425):133–140。doi:10.1038/363133a0。[内政部] [公共医学] [谷歌学者]
-
Haystead T.A.、Sim A.T.、Carling D.、Honnor R.C.、Tsukitani Y.、Cohen P.、Hardie D.G.肿瘤促进剂冈田酸对细胞内蛋白质磷酸化和代谢的影响。自然。1989年1月5日;337(6202):78–81. doi:10.1038/337078a0。[内政部] [公共医学] [谷歌学者]
-
Hill C.S.、Marais R.、John S.、Wynne J.、Dalton S.、Treisman R.生长因子应答转录因子复合体的功能分析。单元格。1993年4月23日;73(2):395–406. doi:10.1016/0092-8674(93)90238-l。[内政部] [公共医学] [谷歌学者]
-
Howe L.R.、Leevers S.J.、Gómez N.、Nakielny S.、Cohen P.、Marshall C.J.通过蛋白激酶raf激活MAP激酶途径。单元格。1992年10月16日;71(2):335–342. doi:10.1016/0092-8674(92)90361-f。[内政部] [公共医学] [谷歌学者]
-
Ikawa S.、Fukui M.、Ueyama Y.、Tamaoki N.、Yamamoto T.、Toyoshima K.B-raf是raf家族的新成员,通过DNA重排激活。分子细胞生物学。1988年6月;8(6):2651–2654. doi:10.1128/mcb.8.6.2651。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Kosako H.、Gotoh Y.、Matsuda S.、Ishikawa M.、Nishida E.爪蟾MAP激酶激活剂是一种通过苏氨酸磷酸化激活的丝氨酸/苏氨酸/酪氨酸激酶。EMBO J.1992年8月;11(8):2903–2908. doi:10.1002/j.1460-2075.1992.tb05359.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Kumar V.、Green S.、Staub A.和Chambon P.人类雌激素受体的雌二醇结合域和假定的DNA结合域的定位。EMBO J.1986年9月;5(9):2231–2236. doi:10.1002/j.1460-2075.1986.tb04489.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Kyriakis J.M.、App H.、Zhang X.F.、Banerjee P.、Brautigan D.L.、Rapp U.R.、Avruch J.Raf-1激活MAP激酶。自然。1992年7月30日;358(6385):417–421. doi:10.1038/358417a0。[内政部] [公共医学] [谷歌学者]
-
Lee R.M.、Cobb M.H.、Blackshear P.J.细胞外信号调节激酶是胰岛素激活的Raf-1激酶激酶的证据。生物化学杂志。1992年1月15日;267(2):1088–1092。[公共医学] [谷歌学者]
-
Li P.、Wood K.、Mamon H.、Haser W.、Roberts T.Raf-1:一种目前无原因但不缺乏作用的激酶。单元格。1991年2月8日;64(3):479–482. doi:10.1016/0092-8674(91)90228-q。[内政部] [公共医学] [谷歌学者]
-
Lin L.L.、Wartmann M.、Lin A.Y.、Knopf J.L.,Seth A.、Davis R.J.cPLA2被MAP激酶磷酸化并激活。单元格。1993年1月29日;72(2):269–278. doi:10.1016/0092-8674(93)90666-e。[内政部] [公共医学] [谷歌学者]
-
MacNicol A.M.、Muslin A.J.、Williams L.T.Raf-1激酶对非洲爪蟾的早期发育至关重要,并介导FGF对中胚层的诱导。单元格。1993年5月7日;73(3):571–583. doi:10.1016/0092-8674(93)90143-e。[内政部] [公共医学] [谷歌学者]
-
Marais R.、Wynne J.和Treisman R.SRF辅助蛋白Elk-1包含一个生长因子调节的转录激活域。单元格。1993年4月23日;73(2):381–393. doi:10.1016/0092-8674(93)90237-k。[内政部] [公共医学] [谷歌学者]
-
Mark G.E.、MacIntyre R.J.、Digan M.E.、Ambrosio L.、Perrimon N.果蝇raf癌基因同源物。分子细胞生物学。1987年6月;7(6):2134–2140. doi:10.1128/mcb.7.6.2134。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Matsuda S.、Kosako H.、Takenaka K.、Moriyama K.、Sakai H.、Akiyama T.、Gotoh Y.、Nishida E.Xenopus MAP激酶激活剂:作为磷酸化级联反应中的关键中间产物的鉴定和功能。EMBO J.1992年3月;11(3):973–982. doi:10.1002/j.1460-2075.1992.tb05136.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
McMahon M.、Schatzman R.C.、Bishop J.M.。v-src的氨基酸末端14氨基酸可以在功能上取代v-erbB的细胞外和跨膜结构域。分子细胞生物学。1991年9月;11(9):4760–4770. doi:10.1128/mcb.11.9.4760。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Miller A.D.、Rosman G.J.改良逆转录病毒载体用于基因转移和表达。生物技术。1989年10月;7(9):980-2, 984-6, 989-90.[PMC免费文章] [公共医学] [谷歌学者]
-
Morrison D.K.Raf-1激酶作为有丝分裂信号的传感器。癌细胞。1990年12月;2(12):377–382.[公共医学] [谷歌学者]
-
Nishida Y.、Hata M.、Ayaki T.、Ryo H.、Yamagata M.、Shimizu K.、Nishizuka Y.果蝇raf原癌基因突变体中体细胞和生殖细胞的增殖都受到影响。EMBO J.1988年3月;7(3):775–781. doi:10.1002/j.1460-2075.1988.tb02875.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Payne D.M.、Rossomando A.J.、Martino P.、Erickson A.K.、Her J.H.、Shabanowitz J.、Hunt D.F.、Weber M.J.、Sturgill T.W.pp42/丝裂原活化蛋白激酶(MAP kinase)中调节性磷酸化位点的鉴定。EMBO J.1991年4月;10(4):885–892. doi:10.1002/j.1460-2075.1991.tb08021.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Picard D.、Salser S.J.、Yamamoto K.R.糖皮质激素受体类固醇结合域内的一种可移动和可调节的失活功能。单元格。1988年9月23日;54(7):1073–1080. doi:10.1016/0092-8674(88)90122-5。[内政部] [公共医学] [谷歌学者]
-
Raf-1丝氨酸/苏氨酸蛋白激酶在生长因子信号转导中的作用。致癌物。1991年4月;6(4):495–500.[公共医学] [谷歌学者]
-
Stanton V.P.,Jr,Nichols D.W.,Laudano A.P.,Cooper G.M.通过缺失突变对人类raf氨基末端调节区的定义。分子细胞生物学。1989年2月;9(2):639–647。doi:10.128/cb.9.2.639。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Storm S.M.、Cleveland J.L.、Rapp U.R.正常小鼠组织中raf家族原癌基因的表达。致癌物。1990年3月;5(3):345–351.[公共医学] [谷歌学者]
-
Sturgill T.W.、Ray L.B.、Erikson E.、Maller J.L.胰岛素刺激的MAP-2激酶磷酸化并激活核糖体蛋白S6激酶II。自然。1988年8月25日;334(6184):715–718. doi:10.1038/334715a0。[内政部] [公共医学] [谷歌学者]
-
Superti-Furga G.、Bergers G.、Picard D.、Busslinger M.Fos-steroid受体融合蛋白的激素依赖性转录调控和细胞转化。美国国家科学院院刊1991年6月15日;88(12):5114–5118. doi:10.1073/pnas.88.12.5114。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Thomas G.MAP激酶别称,闻起来也一样香。单元格。1992年1月10日;68(1):3–6. doi:10.1016/0092-8674(92)90199-m。[内政部] [公共医学] [谷歌学者]
-
Thompson E.W.,Katz D.,Shima T.B.,Wakeling A.E.,Lippman M.E.,Dickson R.B.ICI 164384,一种雌激素刺激MCF-7细胞增殖和侵袭性的纯拮抗剂。癌症研究1989年12月15日;49(24第1部分):6929–6934。[公共医学] [谷歌学者]
-
Tsuda L.、Inoue Y.H.、Yoo M.A.、Mizuno M.、Hata M.、Lim Y.M.、Adachi-Yamada T.、Ryo H.、Masamune Y.、Nishida Y.一种类似MAP激酶激活剂的蛋白激酶作用于果蝇raf激酶的下游。单元格。1993年2月12日;72(3):407–414. doi:10.1016/0092-8674(93)90117-9。[内政部] [公共医学] [谷歌学者]
-
Umek R.M.、Friedman A.D.、McKnight S.L.CCAAT增强子结合蛋白:分化开关的组成部分。科学。1991年1月18日;251(4991):288–292. doi:10.1126/science.1987644。[内政部] [公共医学] [谷歌学者]
-
Webster N.J.、Green S.、Jin J.R.、Chambon P.雌激素和糖皮质激素受体的激素结合域包含诱导转录激活功能。单元格。1988年7月15日;54(2):199–207. doi:10.1016/0092-8674(88)90552-1。[内政部] [公共医学] [谷歌学者]
-
Wiseman L.R.,Wakeling A.E.,May F.E.,Westley B.R.抗雌激素ICI 164384对MCF-7细胞中雌激素诱导RNA的影响。类固醇生物化学杂志。1989年7月;33(1):1–6. doi:10.1016/0022-4731(89)90349-x。[内政部] [公共医学] [谷歌学者]
-
Wood K.W.、Sarnecki C.、Roberts T.M.、Blenis J.ras介导三种信号转导蛋白激酶(MAP激酶、Raf-1和RSK.Cell)的神经生长因子受体调节。1992年3月20日;68(6):1041–1050。doi:10.1016/0092-8674(92)90076-o。[内政部] [公共医学] [谷歌学者]
-
Wu J.、Harrison J.K.、Vincent L.A.、Haystead C.、Haystated T.A.、Michel H.、Hunt D.F.、Lynch K.R.、Sturgill T.W.激活p42有丝分裂原活化蛋白(MAP)激酶的蛋白-酪氨酸/苏氨酸激酶的分子结构:MAP激酶激酶。美国国家科学院院刊1993年1月1日;90(1):173–177. doi:10.1073/pnas.90.1.173。[内政部] [PMC免费文章] [公共医学] [谷歌学者]