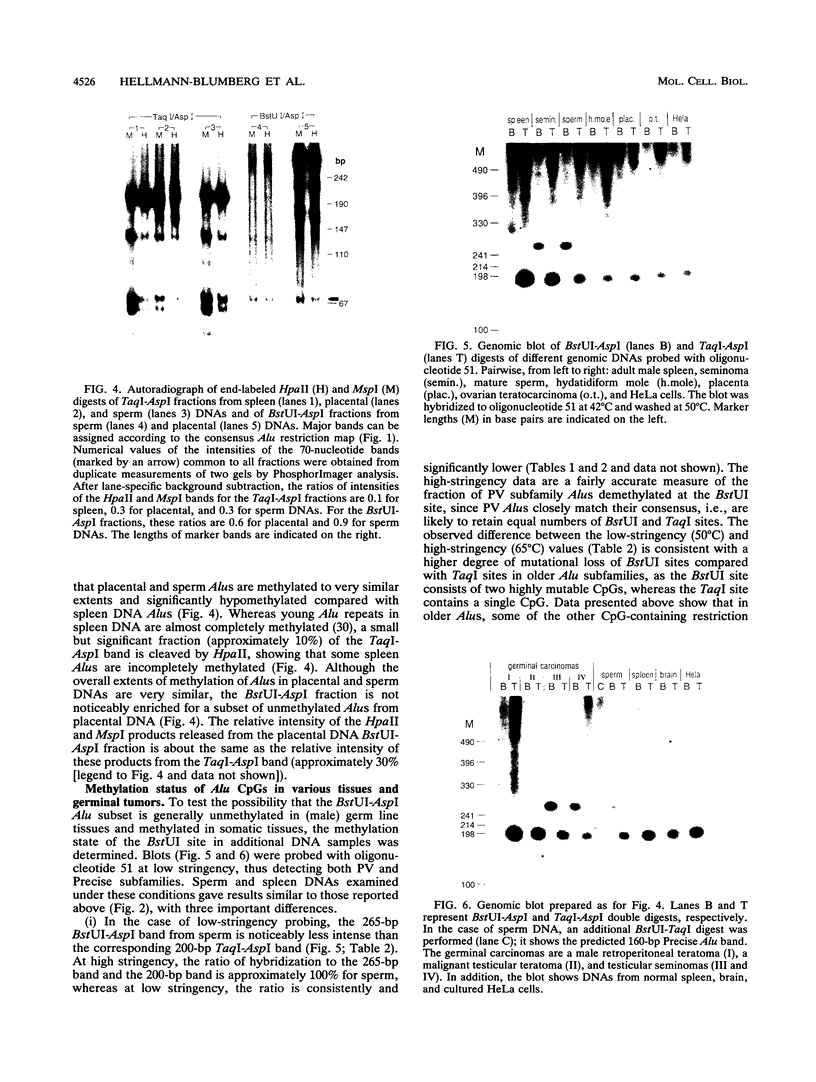
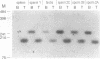
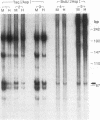
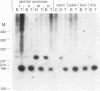
摘要
Alu重复序列富含CpG二核苷酸,是真核生物DNA甲基化的主要靶点。利用有关Alu序列进化的最新理论和实践进展,通过简单、直接的基因组印迹分析来研究不同人类组织中Alu的甲基化状态。虽然Alus在体细胞组织(如脾脏)中几乎完全甲基化,但在雄性生殖系和依赖于父系基因组补体差异表达的组织中,它们甲基化程度较低。特别是,我们发现了一个在年轻的Alus中富集的亚群,其CpG在精子DNA中几乎完全未甲基化。该亚群的存在可能解释了活性Alu源基因中CpG二核苷酸的保守性。Alu重复序列甲基化状态中这些深刻的、序列特异性的发育变化表明Alu序列在DNA水平上具有功能,例如在基因组印迹中的作用。
选定的引用
这些参考文献在PubMed中。这可能不是本文参考文献的完整列表。
-
Batzer M.A.,Deininger P.L.一个人类特有的Alu序列亚家族。基因组学。1991年3月;9(3):481–487. doi:10.1016/0888-7543(91)90414-a。[内政部] [公共医学] [谷歌学者]
-
Batzer M.A.、Kilroy G.E.、Richard P.E.、Shaikh T.H.、Desselle T.D.、Hoppens C.L.、Deininger P.L.最近插入的Alu家族成员的结构和变异性。《核酸研究》,1990年12月11日;18(23):6793–6798. doi:10.1093/nar/18.23.6793。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Besser D.,Götz F.,Schulze-Forster K.,Wagner H.,Kröger H.,Simon D.DNA甲基化通过tRNA基因的RNA聚合酶III抑制转录,但不抑制5S rRNA基因的转录。FEBS信函。1990年9月3日;269(2):358–362. doi:10.1016/0014-5793(90)81193-r。[内政部] [公共医学] [谷歌学者]
-
Bickmore W.A.、Sumner A.T.哺乳动物染色体带带——基因组组织的表达。趋势Genet。1989年5月;5(5):144–148. doi:10.1016/0168-9525(89)90055-3。[内政部] [公共医学] [谷歌学者]
-
富含CpG的鸟岛和DNA甲基化的功能。自然。1986年5月15日;321(6067):209–213. doi:10.1038/321209a0。[内政部] [公共医学] [谷歌学者]
-
鸟类A.P.DNA甲基化和动物DNA中CpG的频率。《核酸研究》,1980年4月11日;8(7):1499–1504. doi:10.1093/nar/8.7.1499。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
鸟A.DNA甲基化的本质。单元格。1992年7月10日;70(1):5–8. doi:10.1016/0092-8674(92)90526-i。[内政部] [公共医学] [谷歌学者]
-
Cedar H.DNA甲基化和基因活性。单元格。1988年4月8日;53(1):3–4. doi:10.1016/0092-8674(88)90479-5。[内政部] [公共医学] [谷歌学者]
-
Deininger P.L.,Batzer M.A.,Hutchison C.A.,3rd,Edgell M.H.掌握哺乳动物重复DNA扩增中的基因。趋势Genet。1992年9月;8(9):307–311. doi:10.1016/0168-9525(92)90262-3。[内政部] [公共医学] [谷歌学者]
-
Driscoll D.J.,Migeon B.R.人类减数分裂生殖细胞中单拷贝基因甲基化的性别差异:X染色体失活、亲本印记和CpG突变起源的意义。体细胞分子遗传学。1990年5月;16(3):267–282. doi:10.1007/BF01233363。[内政部] [公共医学] [谷歌学者]
-
Ehrlich M.、Gama-Sosa M.A.、Huang L.H.、Midgett R.M.、Kuo K.C.、McCune R.A.、Gehrke C.不同类型细胞组织中人类DNA中5-甲基胞嘧啶的数量和分布。《核酸研究》1982年4月24日;10(8):2709–2721. doi:10.1093/nar/10.8.2709。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Gama-Sosa M.A.、Wang R.Y.、Kuo K.C.、Gehrke C.W.、Ehrlich M.人类DNA中高度重复序列的5-甲基胞嘧啶含量。《核酸研究》,1983年5月25日;11(10):3087–3095. doi:10.1093/nar/1110.3087。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Groudine M.,Conkin K.F.精子DNA的染色质结构和从头甲基化:父亲基因组激活的意义。科学。1985年5月31日;228(4703):1061–1068. doi:10.1126/science.2986289。[内政部] [公共医学] [谷歌学者]
-
Howlett S.K.,Reik W.着床前发育期间母体和父体基因组的甲基化水平。发展。1991年9月;113(1):119–127. doi:10.1242/dev.113.119。[内政部] [公共医学] [谷歌学者]
-
Jelinek W.R.,Schmid C.W.真核生物DNA中的重复序列及其表达。Annu Rev生物化学。1982;51:813–844. doi:10.1146/annurev.bi.51.070182.004121。[内政部] [公共医学] [谷歌学者]
-
Jurka J.,Milosavljevic A.人类Alu基因的重建和分析。分子进化杂志。1991年2月;32(2):105–121. doi:10.1007/BF02515383。[内政部] [公共医学] [谷歌学者]
-
Jüttermann R.、Hosokawa K.、Kochanek S.、Doerfler W.聚合酶III对腺病毒2型VAI RNA的转录被序列特异性甲基化阻断。《维罗尔杂志》。1991年4月;65(4):1735–1742. doi:10.1128/jvi.65.4.1735-1742.1991。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Kafri T.、Ariel M.、Brandeis M.、Shemer R.、Urven L.、McCarrey J.、Cedar H.、Razin A.小鼠胚胎和种系中基因特异性DNA甲基化的发育模式。Genes Dev.1992年5月;6(5):705–714. doi:10.1101/gad.6.5.705。[内政部] [公共医学] [谷歌学者]
-
Kochanek S.、Renz D.、Doerfler W.二倍体和单倍体原始人类细胞Alu序列中的DNA甲基化。EMBO J.1993年3月;12(3):1141–1151. doi:10.1002/j.1460-2075.1993.tb05755.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Liu W.M.、Schmid C.W.提出了DNA甲基化在Alu转录抑制和突变失活中的作用。《核酸研究》1993年3月25日;21(6):1351–1359. doi:10.1093/nar/21.6.1351。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Matera A.G.、Hellmann U.、Hintz M.F.、Schmid C.W.最近转座的Alu重复序列来自多个源基因。《核酸研究》,1990年10月25日;18(20):6019–6023. doi:10.1093/nar/18.20.6019。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Matera A.G.、Hellmann U.、Schmid C.W.一个转座和转录能力强的Alu亚家族。分子细胞生物学。1990年10月;10(10):5424–5432. doi:10.1128/mcb.10.10.5424。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Monk M.、Boubelik M.和Lehnert S.小鼠胚胎发育期间胚胎、胚外和生殖细胞系DNA甲基化的时间和区域变化。发展。1987年3月;99(3):371–382. doi:10.1242/dev.99.3.371。[内政部] [公共医学] [谷歌学者]
-
Monk M.、Grant M.首选X染色体失活、DNA甲基化和印迹。Dev Suppl.1990年:55–62。[公共医学] [谷歌学者]
-
Ponzetto-Zimmerman C.,Wolgemuth D.J.小鼠生精和体细胞DNA中卫星序列的甲基化。《核酸研究》1984年3月26日;12(6):2807–2822. doi:10.1093/nar/12.6.2807。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Sanford J.、Forrester L.、Chapman V.、Chandley A.、Hastie N.小家鼠生殖细胞中重复DNA序列的甲基化模式。《核酸研究》1984年3月26日;12(6):2823–2836. doi:10.1093/nar/12.62823。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Sapienza C.、Peterson A.C.、Rossant J.和Balling R.转基因的甲基化程度取决于来源配子。自然。1987年7月16日;328(6127):251–254. doi:10.1038/328251a0。[内政部] [公共医学] [谷歌学者]
-
Schmid C.W.人类Alu亚家族及其甲基化通过杂交显示。《核酸研究》,1991年10月25日;19(20):5613–5617. doi:10.1093/nar/19.20.5613。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Schmid C.,Maraia R.活性SINE序列的转录调控和转座选择。当前操作基因开发,1992年12月;2(6):874–882. doi:10.1016/s0959-437x(05)80110-8。[内政部] [公共医学] [谷歌学者]
-
Shemer R.、Kafri T.、O'Connell A.、Eisenberg S.、Breslow J.L.、Razin A.小鼠胚胎发育期间载脂蛋白AI基因的甲基化变化。美国国家科学院院刊1991年12月15日;88(24):11300–11304. doi:10.1073/pnas.88.24.11300。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Surani M.A.、Barton S.C.和Norris M.L.。重组小鼠卵的发育表明在配子发生过程中基因组会留下印记。自然。1984年4月5日;308(5959):548–550. doi:10.1038/308548a0。[内政部] [公共医学] [谷歌学者]
-
Swain J.L.、Stewart T.A.、Leder P.父母遗传决定常染色体转基因的甲基化和表达:父母印记的分子机制。单元格。1987年8月28日;50(5):719–727. doi:10.1016/0092-8674(87)90330-8。[内政部] [公共医学] [谷歌学者]
-
Wallace M.R.、Andersen L.B.、Saulino A.M.、Gregory P.E.、Glover T.W.、Collins F.S.A从头插入导致1型神经纤维瘤病。自然。1991年10月31日;353(6347):864–866. doi:10.1038/353864a0。[内政部] [公共医学] [谷歌学者]
-
Weinbauer G.F.、Behre H.M.、Fingscheidt U.、Nieschlag E.人类卵泡刺激激素对促性腺激素释放激素拮抗剂治疗的非人类灵长类(猕猴)的精子发生、睾丸大小和血清抑制素水平产生刺激作用。内分泌学。1991年10月;129(4):1831–1839. doi:10.1210/endo-129-4-1831。[内政部] [公共医学] [谷歌学者]