摘要
1.简介
2.材料和方法
2.1. 材料
表1。
|
| ||||||
|
|
||||||
|
|
||||||
|
|
||||||
|
|
||||||
|
| ||||||
|
| ||||||
|
|
||||||
|
|
||||||
|
|
||||||
|
|
||||||
2.2. 方法
2.2.1. 电子显微镜
2.2.2. 光学显微镜
2.2.3. 形态测量学
2.2.4. 统计分析
3.结果
3.1. 灰色物质
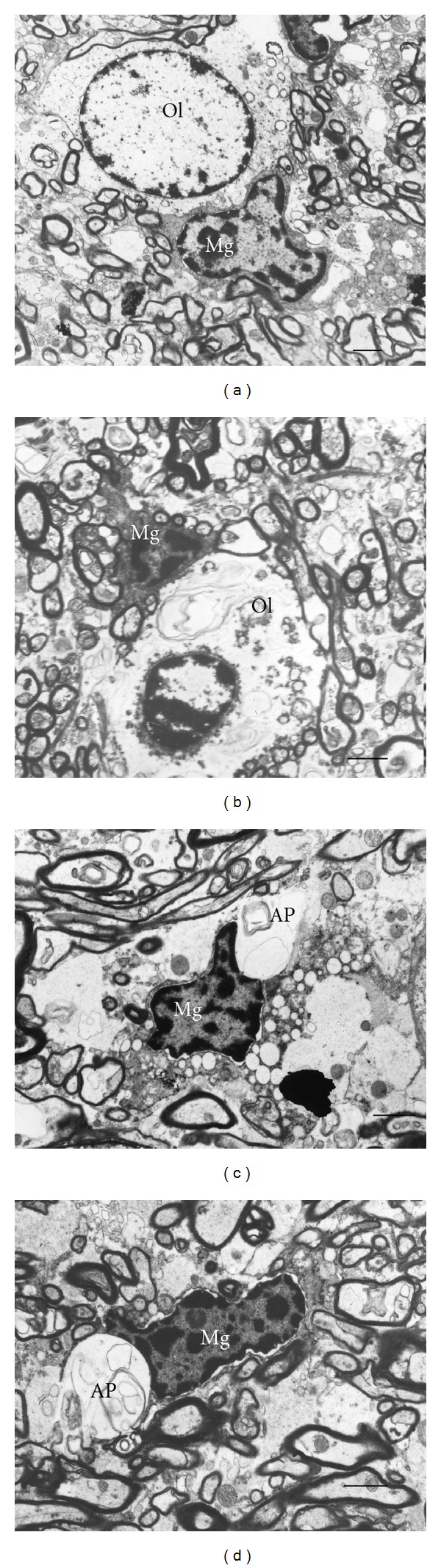
3.1.1. 定性研究
图1。
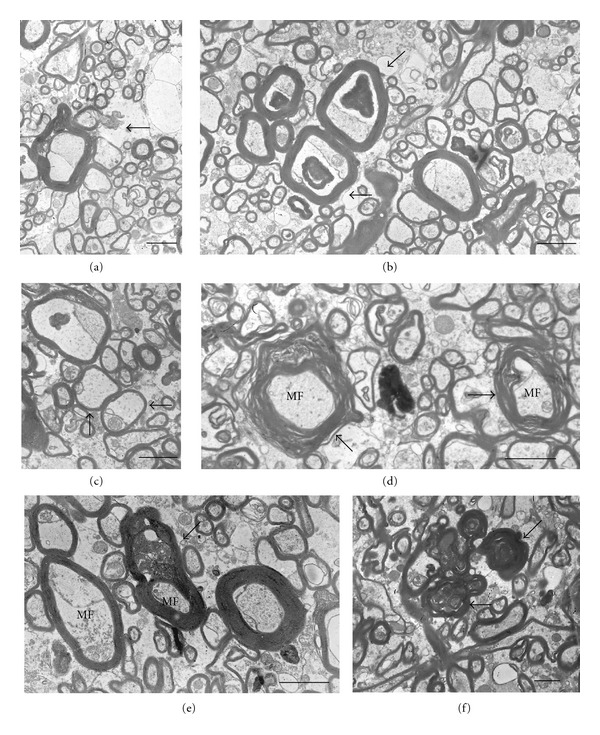
图2。
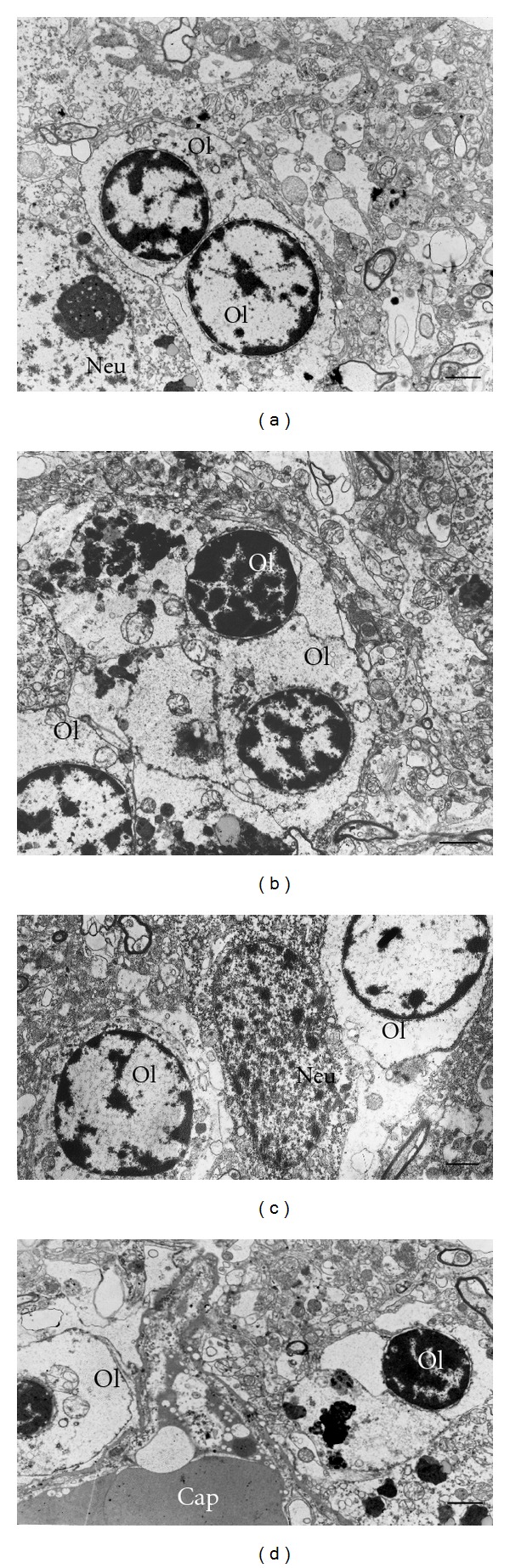
3.1.2. 形态测量学
(1) 疾病和年龄的影响-
形态计量学研究表明,有髓纤维的面积密度没有显著差异:(平均值±SEM)101±6.0/1000 μ 米 2 对照组为105±6.4/1000 μ 米 2 精神分裂症组。
与对照组相比,精神分裂症组所有病理性有髓纤维的频率显著增加( F类 = 12.9, 数据流 = 1.78, P(P) = .0006). P1纤维的频率与对照组无显著差异。 两条P2光纤的频率显著增加( F类 = 8.6, 数据流 = 1.78, P(P) 与对照组相比,精神分裂症中发现了=0.004)和P3纤维( F类 = 62.6, 数据流 = 1.78, P(P) < .0001). ( 图3(a) ).
对以阳性症状为主、以阴性症状为主的亚组和对照组的比较表明,所有病理性有髓纤维的频率存在显著差异( F类 = 6.25, 数据流 = 2.75, P(P) =0.003)以及P2光纤的频率( F类 =6.49, 数据流 = 2.75, P(P) =0.0025)和P3光纤( F类 = 30.3, 数据流 = 2.75, P(P) < .0001). 事后研究表明,在以阳性症状为主的亚组患者中,所有病理性有髓纤维和P2纤维的频率显著增加( P(P) = .002). 在以阳性症状为主的亚组中,P3纤维的频率增加( P(P) =0.0001),与对照组相比,主要表现为阴性症状( P(P) = .0001) ( 图3(a) ).
精神分裂症组P2纤维频率与P3纤维频率呈显著负相关( 第页 = −0.36, P(P) <.05),而对照组没有发现显著相关性( 第页 = −0.06, P(P) = .7).
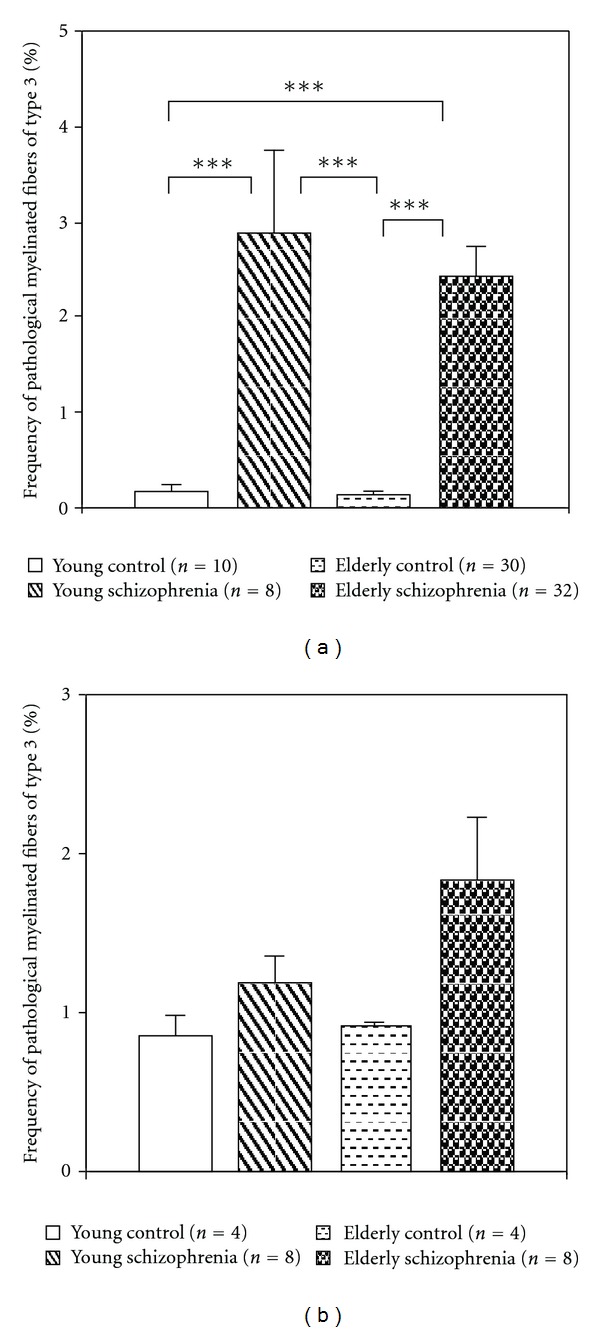
精神分裂症组和对照组的估计参数和年龄无相关性。 然而,年轻(≤45岁)和老年(>45岁)精神分裂症患者与年轻和老年对照组的比较表明,年轻和老年精神分裂症病人与两个对照组的P3纤维频率不同( 图4(a) ). 其他类型纤维的年龄亚组之间没有显著差异。
我们没有发现性别对对照组或精神分裂症组的影响。 有髓纤维参数与精神分裂症发病年龄或病程无相关性。
图3。
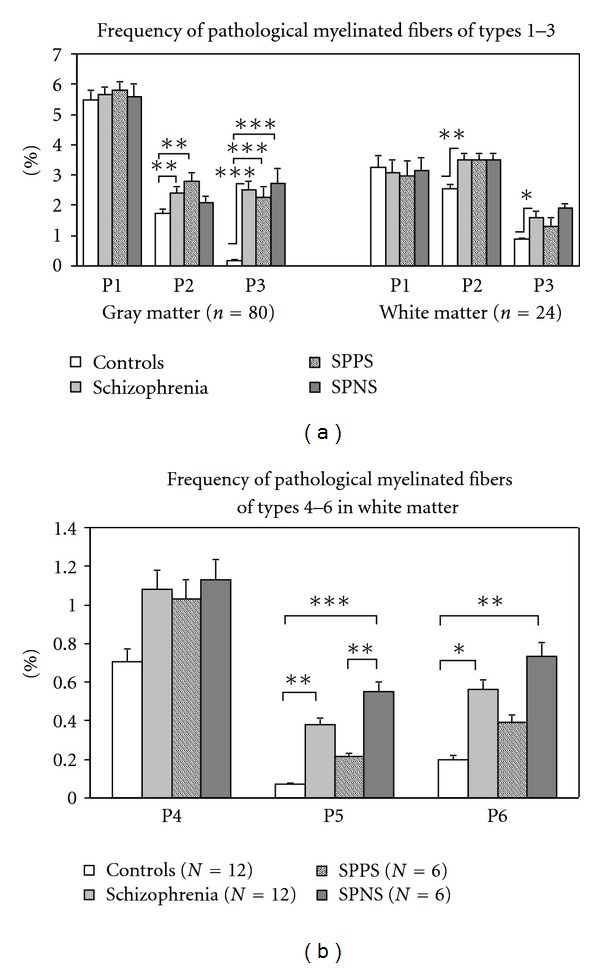
图4。
(2) 其他混淆变量的影响-
我们没有发现死后延迟和服用抗精神病药物对有髓纤维频率的影响。
3.2. 白质
3.2.1. 定性研究
图5。
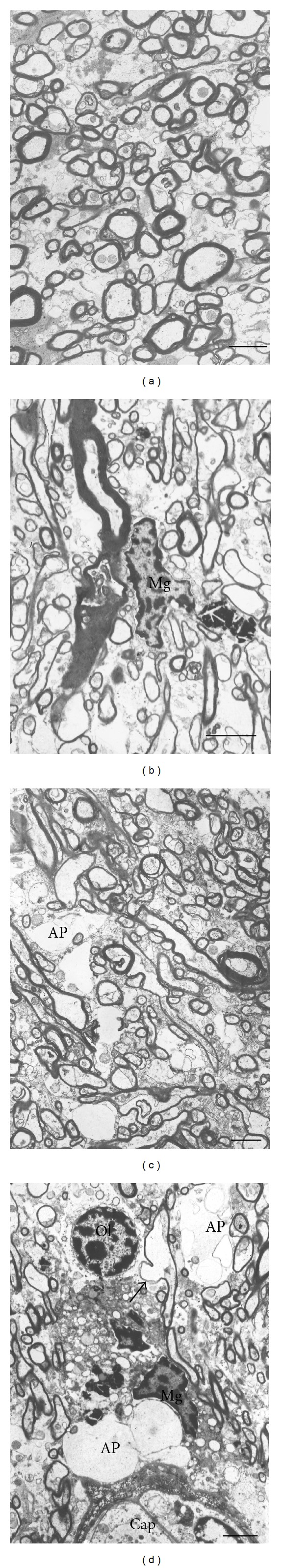
图6。
3.2.2. 形态测量学
(1) 疾病和年龄的影响-
形态计量学研究表明,精神分裂症患者有髓纤维的面积密度无显著下降(-7%):323±29.07/1000 μ 米 2 与正常对照组相比:345±31,1/1000 μ 米 2 。
与对照组相比,精神分裂症患者所有病理性有髓纤维的频率增加( F类 = 5.33, 数据流 = 1.22, P(P) = .03). 其中,P1纤维频率无显著增加,P2和P3纤维频率显著增加( 图3(a) ),P4纤维的频率趋于增加( P(P) =0.08),P5和P6纤维的频率显著增加( 图3(b) ). 无论是精神分裂症组还是对照组,P2纤维的频率与P3纤维的频度均不相关,而灰质与这些参数显著相关。
对以阳性症状为主、以阴性症状为主的亚组和对照组进行比较,发现P3的频率存在显著差异( F类 = 3,6, 数据流 = 2,21, P(P) <.05),第5页( F类 = 11.05, 数据流 = 2.21, P(P) <.001)和P6( F类 = 5.45, 数据流 = 2.21, P(P) =0.01)光纤。 事后发现P5的频率显著增加( P(P) =0.004)和P6有髓纤维,在主要具有阴性症状的亚组中( P(P) = .006) ( 图3(b) ). 此外,与以阳性症状为主的亚组相比,以阴性症状为主的子组P5纤维的频率明显较高( P(P) = .005).
精神分裂症组P1和P6纤维的频率与年龄显著相关( 第页 = 0.74, P(P) < .01, 第页 = 0.62, P(P) 分别<.05) 但对照组没有,因为只有P5的频率与年龄显著相关( 第页 =0.6时, P(P) <.05)。 没有发现有髓纤维与年龄的其他相关性。 年轻和老年对照组患者的年轻(≤45岁)和老年(>45岁)亚组的比较显示,与灰质参数的显著变化相比,P3纤维亚组之间没有显著差异( 图4 ). 在其他类型纤维的年龄亚组之间没有发现显著差异。 病变纤维的频率与发病时的年龄无关。
在研究组中未发现性别的影响。
(2) 其他混淆变量的影响-
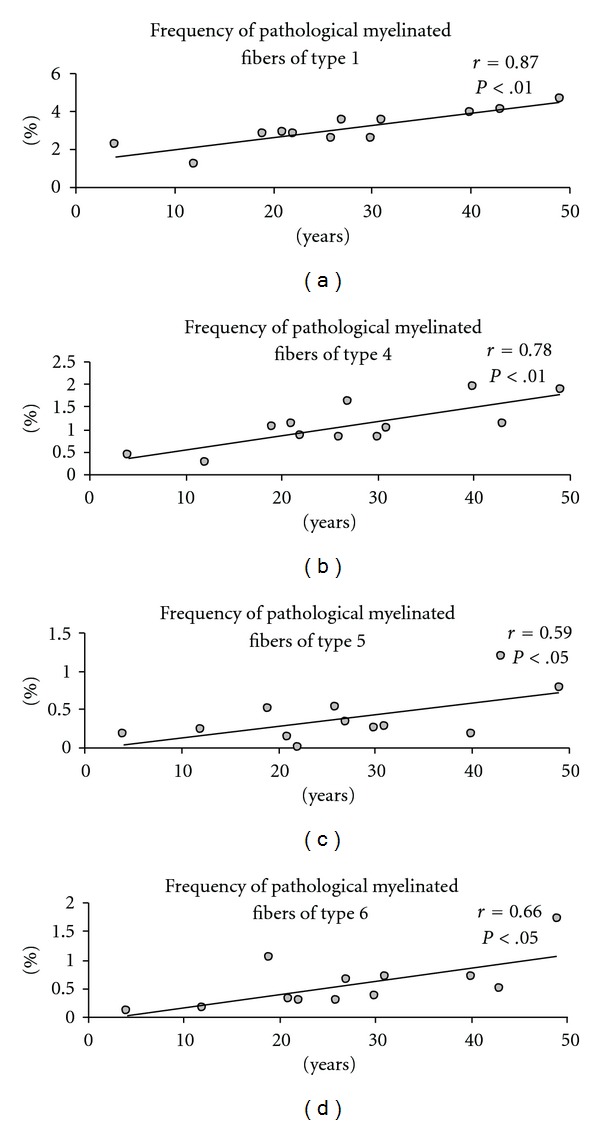
我们没有发现死后延迟和服用抗精神病药对有髓纤维参数的影响。 然而,发现了疾病持续时间的影响。 病理性有髓纤维(P1、P4-6)的频率与病程呈显著正相关( 图7 ).
图7。
4.讨论
5.结论
利益冲突
确认
工具书类
-
1 Davis KL、Stewart DG、Friedman JI等。精神分裂症患者白质改变与髓磷脂相关功能障碍的证据。 普通精神病学档案。 2003; 60(5):443–456. doi:10.1001/archpsyc.60.5443。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
2 Bartzokis G、Nuechterlein KH、Lu PH、Gitlin M、Rogers S、Mintz J.成年男性精神分裂症患者大脑发育异常:一项磁共振成像研究。 生物精神病学。 2003; 53(5):412–421. doi:10.1016/s0006-3223(02)01835-8。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
三。 Bartzokis G,Lu PH,Stewart SB等。典型和非典型抗精神病药物对成人精神分裂症患者皮质内髓磷脂的差异影响的体内证据。 精神分裂症研究。 2009; 113(2-3):322–331. doi:10.1016/j.schres.2009.06.014。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
4 Kubicki M,McCarley RW,Shenton ME。精神分裂症患者白质异常的证据。 精神病学的当前观点。 2005; 18(2):121–134. doi:10.1097/00001504-200503000-00004。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
5 Kubicki M、McCarley R、Westin CF等。精神分裂症弥散张量成像研究综述。 《精神病学研究杂志》。 2007; 41(1-2):15–30. doi:10.1016/j.jpsychires.2005.05.005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
6 Dwork AJ,Mancevski B,Rosoklija G.精神分裂症患者的白质和认知功能。 国际神经精神药理学杂志。 2007; 10(4):513–536. doi:10.1017/S1461145707007638。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
7 Höistad M、Segal D、Takahashi N、Sakurai T、Buxbaum JD、Hof PR。精神分裂症中白质和灰质的联系:前额叶皮层少突胶质细胞和神经元病理学。 神经解剖学前沿。 2009; 3:第9页。 doi:10.3389/neuro.05.009.2009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
8 Konrad A,Winter G.精神分裂症的结构连接紊乱是病理学或副现象的主要因素吗? 精神分裂症公报。 2008; 34(1):72–92. doi:10.1093/schbul/sbm034。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
9 Zalesky A、Fornito A、Seal ML等。精神分裂症患者轴突纤维连接中断。 生物精神病学。 2011; 69(1):80–89. doi:10.1016/j.biopych.2010.08.022。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
10 Walterfang M、Wood SJ、Velakoulis D、Pantelis C。精神分裂症患者白质病理学的神经病理学、神经遗传学和神经影像学证据。 神经科学和生物行为评论。 2006; 30(7):918–948. doi:10.1016/j.neu-biorev.2006.02.001。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
11 Buchsbaum MS、Buchsbaom BR、Hazlett EA等。精神分裂症患者白质中相对葡萄糖代谢率较高。 美国精神病学杂志。 2007; 164(7):1072–1081. doi:10.1176/ajp.2007.164.7.1072。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
12 Beasley CL、Dwork AJ、Rosoklija G等。精神分裂症患者额叶-纹状体-丘脑白质束代谢异常。 精神分裂症研究。 2009; 109(1–3):159–166. doi:10.1016/j.schres.2009.01.017。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
13 Szeszko PR、Robinson DG、Ashtari M等。新近发作精神分裂症白质异常的临床和神经心理学相关性。 神经精神药理学。 2008; 33(5):976–984. doi:10.1038/sj.npp.1301480。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
14 Skelly LR、Calhoun V、Meda SA、Kim J、Mathalon DH、Pearlson GD。精神分裂症扩散张量成像:与症状的关系。 精神分裂症研究。 2008; 98(1–3):157–162. doi:10.1016/j.schres.2007.10.009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
15 Wolkin A、Sanfilipo M、Wolf AP、Angrist B、Brodie JD、Rotrosen J.慢性精神分裂症患者的阴性症状和额叶下垂。 普通精神病学档案。 1992; 49(12):959–965. doi:10.1001/archpsyc.1992.01820120047007。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
16 Ho BC、Andreasen NC、Nopoulos P、Arndt S、Magnotta V、Flaum M。进展性脑结构异常及其与临床结果的关系:精神分裂症早期纵向磁共振成像研究。 普通精神病学档案。 2003; 60(6):585–594. doi:10.1001/archpsyc.60.6585。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
17 Hof PR、Haroutunian V、Copland C、Davis KL、Buxbaum JD。 精神分裂症少突胶质细胞异常的分子和细胞证据。 神经化学研究。 2002年; 27(10):1193–1200. doi:10.1023/a:10209981510759。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
18 Hof PR,Haroutunian V,Friedrich VL,Jr.等。精神分裂症患者额上回少突胶质细胞的缺失和空间分布改变。 生物精神病学。 2003; 53(12):1075–1085. doi:10.1016/s0006-3223(03)00237-3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
19 Uranova NA、Vostrikov VM、Orlovskaya DD、Rachmanova VI。精神分裂症和情绪障碍患者前额叶皮质的少突胶质密度:一项来自Stanley神经病理学联合会的研究。 精神分裂症研究。 2004; 67(2-3):269–275. doi:10.1016/S0920-9964(03)00181-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
20 Vostrikov VM、Uranova NA、Orlovskaya DD。精神分裂症和情绪障碍患者前额叶皮层神经元周少突胶质细胞缺乏。 精神分裂症研究。 2007; 94(1–3):273–280. doi:10.1016/j.schres.2007.04.014。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
21 Vostrikov V,Orlovskaya D,Uranova N。精神分裂症患者前额叶皮层毛细血管少突胶质细胞缺乏。 世界生物精神病学杂志。 2008; 9(1):34–42. doi:10.1080/15622970701210247。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
22 Vostrikov VM、Uranova NA、Rakhmanova VI、Orlovskaia DD。精神分裂症患者前额叶皮质少突胶质细胞密度降低。 朱纳尔·内夫罗基一世(Zhurnal Nevrologii I Psikhiatrii Imeni S.S.Korsakova)。 2004; 104(1):47–51. [ 公共医学 ] [ 谷歌学者 ] -
23 Marner L,Pakkenberg B.慢性精神分裂症患者前额叶和全脑白质中神经纤维的总长度。 精神病学研究杂志。 2003; 37(6):539–547. doi:10.1016/s0022-3956(03)00069-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
24 Uranova N、Orlovskaya D、Vikhreva O等。严重精神疾病中少突胶质细胞的电子显微镜观察。 大脑研究公告。 2001; 55(5):597–610. doi:10.1016/s0361-9230(01)00528-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
25 Uranova NA、Vostrikov VM、Vikhreva OV、Zimina IS、Kolomeets NS、Orlovskaya DD。少突胶质细胞病理在精神分裂症中的作用。 国际神经精神药理学杂志。 2007; 10(4):537–545. doi:10.1017/S1461145707007626。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
26 Davis JM。抗精神病药物的剂量当量。 精神病学研究杂志。 1974年; 11:65–69. doi:10.1016/0022-3956(74)90071-5。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
27 Segal D,Schmitz C,Hof PR。精神分裂症患者扣带束少突胶质细胞的空间分布和密度没有改变。 神经病理学学报。 2009; 117(4):385–394. doi:10.1007/s00401-008-0379-x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
28 Highley JR、Walker MA、Esiri MM、Crow TJ、Harrison PJ。 钩束不对称:一项对正常受试者和精神分裂症患者的尸检研究。 大脑皮层。 2002年; 12(11):1218–1224. doi:10.1093/cercor/12.11.218。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
29 Mitelman SA、Brickman AM、Shihabuddin L等。精神分裂症患者灰质和白质体积及其与预后和严重程度的关系的综合评估。 神经影像。 2007; 37(2):449–462. doi:10.1016/j.neuroimage.2007.04.070。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
30 Mori T,Ohnishi T,Hashimoto R,等。弥散张量成像显示精神分裂症患者白质完整性的进展性变化。 精神病学研究。 2007; 154(2):133–145. doi:10.1016/j.pscychrens.2006.09.004。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
31 DeLisi LE、Sakuma M、Tew W、Kushner M、Hoff AL、Grimson R.精神分裂症作为一种慢性活动性脑过程:精神分裂症发病后进行性脑结构变化的研究。 精神病学研究。 1997; 74(3):129–140. doi:10.1016/s0925-4927(97)00012-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
32 JI Friedman,Tang C,Carpenter D,等。首发和慢性精神分裂症患者的弥散张量成像表现。 美国精神病学杂志。 2008; 165(8):1024–1032. doi:10.1176/appi.ajp.2008.07101640。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
33 Borgwardt SJ、Dickey C、Pol HH、Whitford TJ、DeLisi LE。 精神分裂症患者进行性脑改变重要性定义研讨会:2008年12月12日,美国神经精神药理学学院(ACNP)全天卫星,亚利桑那州斯科茨代尔。 报告员的报告。 精神分裂症研究。 2009; 112(1–3):32–45. doi:10.1016/j.schres.2009.04.025。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
34 霍普特曼MJ、Volavka J、Johnson G、Weiss E、Bilder RM、Lim KO。 精神分裂症男性额叶白质微结构、攻击性和冲动性:一项初步研究。 生物精神病学。 2002年; 52(1):9–14. doi:10.1016/s0006-3223(02)01311-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
35 Wolkin A、Choi SJ、Szilagyi S、Sanfilipo M、Rotrosen JP、Lim KO。 精神分裂症的额叶下白质各向异性和阴性症状:弥散张量成像研究。 美国精神病学杂志。 2003; 160(3):572–574. doi:10.1176/appi.ajp.160.3.572。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
36 Bai YM,Chou KH,Lin CP,等。患有迟发性运动障碍的精神分裂症患者的白质异常:扩散张量图像研究。 精神分裂症研究。 2009; 109(1–3):167–181. doi:10.1016/j.schres.2009.02.003。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
37 Wible CG、Anderson J、Shenton ME等。前额叶皮层、阴性症状和精神分裂症:一项MRI研究。 精神病学研究。 2001; 108(2):65–78. doi:10.1016/s0925-4927(01)00109-3。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
38 Sanfilipo M,Lafargue T,Rusinek H等。精神分裂症患者额叶和颞叶区域的容量测量:与阴性症状的关系。 普通精神病学档案。 2000; 57(5):471–480. doi:10.1001/archpsyc.57.5471。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
39 Kirkpatrick B,Messias NC,Conley RR,Roberts RC。 缺陷型和非缺陷型精神分裂症患者背外侧前额叶皮层白质间质细胞。 神经与精神疾病杂志。 2003; 191(9):563–567. doi:10.1097/01.nmd.0000087181.61164.e1。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
40 Sanfilipo M、Lafargue T、Rusinek H等。精神分裂症的认知表现:与区域脑容量和精神症状的关系。 精神病学研究。 2002年; 116(1-2):1–23. doi:10.1016/s0925-4927(02)00046-x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
41 精神分裂症的认知神经科学。 临床心理学年度回顾。 2005; 1:321–353. doi:10.1146/annrev.clinpsy.1.102803.143959。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
42 Bowley MP,Cabral H,Rosene DL,Peters A.恒河猴扣带回束和胼胝体有髓神经纤维的年龄变化。 比较神经学杂志。 2010; 518(15):3046–3064. doi:10.1002/cne.22379。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
43 Sandell JH,Peters A.年龄对恒河猴视神经中神经纤维的影响。 比较神经学杂志。 2001; 429(4):541–553. doi:10.1002/1096-9861(20010122)429:4<541::aid-cne3>3.0.co; 2-5. [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
44 Peters A,Sethares C.衰老与猴子前额叶皮层和胼胝体中的有髓纤维。 比较神经病学杂志。 2002年; 442(3):277–291。 doi:10.1002/cne.10099。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
45 Peters A.正常衰老对猴中枢神经系统有髓神经纤维的影响。 神经解剖学前沿。 2009; 3:第11页。 doi:10.3389/neuro.05.011.2009。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
46 Luebke J,Barbas H,Peters A.正常衰老对恒河猴前额46区的影响。 大脑研究评论。 2010; 62(2):212–232. doi:10.1016/j.brainesrev.2009.12.002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
47 Mitterauer B.精神分裂症的非相干假说:基于分解的少突胶质细胞-异体关系。 医学假设。 2007; 69(6):1299–1304. doi:10.1016/j.mehy.2007.03.024。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
48 Uranova NA、Orlovskaya DD、Zimina IS等。精神分裂症有髓纤维的超微结构病理学:前额叶和视觉皮层的形态计量学研究。 第九届国际精神分裂症研究大会摘要。 精神分裂症研究。 2003; 60(1):第76页。 [ 谷歌学者 ] -
49 Kolomeets NS,Uranova NA。精神分裂症患者海马少突胶质细胞和有髓纤维的病理学(超微结构和形态计量学研究)Zhurnal Nevrologii I Psikhiatrii Imeni S.S.Korsakova。 2008; 108(8):52–60. (俄罗斯)。 [ 公共医学 ] [ 谷歌学者 ] -
50 Uranova NA,Orlovskaya DD,Zimina IS。精神分裂症皮层突触尺寸减小:一项死后形态计量电子显微镜研究。 摘自:《神经科学学会第30届年会论文集》,第26卷; 2000; 第1558页。 [ 谷歌学者 ] -
51 Uranova NA、Vikhreva OV、Zimina IS等。精神分裂症患者大脑皮层突触连接的异常模式。 Vestnik Rossiiskoi Akademii Meditsinskikh Nauk公司。 2007; (3) :8-14。 (俄罗斯)。 [ 公共医学 ] [ 谷歌学者 ] -
52 Haroutunian V,Katsel P,Dracheva S,Stewart DG,Davis KL。多个皮层区域少突胶质细胞相关基因表达的变化:对精神分裂症病理生理学的影响。 国际神经精神药理学杂志。 2007; 10(4):565–573. doi:10.1017/S1461145706007310。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
53 Byun N,Delpire E.在KCC3基因敲除小鼠中,轴突和轴突周围肿胀先于外周神经变性。 疾病的神经生物学。 2007; 28(1):39–51. doi:10.1016/j.nbd.2007.06.014。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
54 中脑KA,Trapp BD。轴突-神经胶质信号传导和神经胶质对轴突功能的支持。 神经科学年度评论。 2008; 31:535–561。 doi:10.1146/anurev.neuro.30.051606.094309。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
55 Rasband MN、Tayler J、Kaga Y等。CNP是维持中枢神经系统中ranvier节点的轴突-神经胶质相互作用所必需的。 格利亚。 2005; 50(1):86–90. doi:10.1002/glia.20165。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
56 Mitkus SN,Hyde TM,Vakkalanka R等。精神分裂症患者背外侧前额叶皮层少突胶质细胞相关基因的表达。 精神分裂症研究。 2008; 98(1–3):129–138. doi:10.1016/j.schres.2007.09.032。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
57 扣带回皮质与精神分裂症和其他精神疾病的关系。 作者:Vogt BA,Gabriel M,编辑。 扣带回和边缘丘脑的神经生物学:综合手册。 美国马萨诸塞州波士顿:Birkhauser; 1993年,第581-605页。 [ 谷歌学者 ] -
58 Flynn SW、Lang DJ、Mackay AL等。通过MRI在体内检测到精神分裂症的髓鞘异常,通过寡突胶质细胞蛋白分析在死后检测到。 分子精神病学。 2003; 8(9):811–820. doi:10.1038/sj.mp.4001337。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
59 郝毅,颜强,刘浩,等。精神分裂症患者及其健康同胞的左前额叶皮层和海马白质完整性受损,但前扣带回皮层受损。 精神分裂症研究。 2009; 114(1–3):128–135. doi:10.1016/j.schres.2009.07.001。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
60 Bartzokis G,Altshuler L.精神分裂症患者皮质内髓鞘减少。 美国精神病学杂志。 2005; 162(6):1229–1230. doi:10.1176/appi.ajp.162.6.1229-a。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
61 MacKay A、Laule C、Vavasour I、Bjarnason T、Kolind S、Mädler B。从T2分布深入了解大脑微观结构。 磁共振成像。 2006; 24(4):515–525. doi:10.1016/j.mri.2005.12.037。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
62 Kyriakopoulos M、Perez-Iglesias R、Woolley JB等。精神分裂症发病年龄对白质异常的影响。 英国精神病学杂志。 2009; 195(4):346–353. doi:10.1192/bjp.bp.108.055376。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
63 Reddy R,Keshavan MS。磷磁共振波谱:在检验精神分裂症膜假说中的应用。 前列腺素、白三烯和必需脂肪酸。 2003; 69(6):401–405. doi:10.1016/j.plefa.2003.08.011。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
64 Prabakaran S,Swatton JE,Ryan MM等。精神分裂症的线粒体功能障碍:大脑代谢和氧化应激受损的证据。 分子精神病学。 2004; 9(7):第643页。 doi:10.1038/sj.mp.4001511。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
65 Schwarz E、Prabakaran S、Whitfield P等。精神分裂症和双相情感障碍脑组织的高通量脂质分析揭示了游离脂肪酸、磷脂酰胆碱和神经酰胺的变化。 蛋白质组研究杂志。 2008; 7(10):4266–4277. doi:10.1021/pr800188y。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
66 Martins-de-Souza D、Gattaz WF、Schmitt A等。背外侧前额叶皮层的蛋白质组学分析表明,细胞骨架、少突胶质细胞、能量代谢和新的潜在标记物参与了精神分裂症。 精神病学研究杂志。 2009; 43(11):978–986. doi:10.1016/j.jpsychires.2008.11.006。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
67 Tkachev D、Mimmack ML、Huffaker SJ、Ryan M、Bahn S.精神分裂症患者髓磷脂生物合成改变和谷氨酸能功能障碍的进一步证据。 国际神经精神药理学杂志。 2007; 10(4):557–563. doi:10.1017/S1461145706007334。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
68 Dracheva S、Marras SA、Elhakem SL、Kramer FR、Davis KL、Haroutunian V.老年精神分裂症患者背外侧前额叶皮层的N-甲基-D-天冬氨酸受体表达。 美国精神病学杂志。 2001; 158(9):1400–1410. doi:10.1176/appi.ajp.158.9.1400。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]


