摘要 半乳糖凝集素具有高度保守的碳水化合物结合域,各种含半乳糖的糖类,包括β-半乳糖苷和α-半乳糖苷,可以与之发生不同程度的亲和作用。 最近,我们证明了相对较大的α(1→6)- d日 -半乳糖-β(1→4)- d日 -甘露聚糖(Davanat)主要在替代的碳水化合物结合域结合半乳糖凝集素-1(gal-1)。 在这里,我们使用了一系列甘露糖与半乳糖比率不同的α-半乳甘露聚糖(GM),以深入了解GM与gal-1结合的最佳结构特征。 异核单量子相干核磁共振波谱 15 N标记的gal-1和统计模型表明,最佳签名由α组成- d日 -吡喃半乳糖双链被大约四个或更多“裸”甘露糖残基区域包围。 这些相对较大且复杂的GM似乎都在gal-1上基本相同的结合面上不同程度地相互作用,其中包括Davanat替代结合位点和典型β-半乳糖苷结合区的元素。 使用两个小的、定义明确的GM[6 1 -α(1 → 6)- d日 -半乳糖基-β- d日 -甘露三糖和6 三 ,6 4 -di-α(1→6)- d日 -半乳糖基-β- d日 -甘露opentaose]有助于描述一般情况下,GM是如何部分地与规范位点相互作用的。 总的来说,我们的发现有助于更好地理解gal-1与更大复杂多糖的相互作用,并有助于开发基于转基因的临床治疗药物。
介绍 半乳糖凝集素,通常在碳水化合物识别域的典型位置与β-半乳糖苷结合( Barondes等人,1994年 ),表现出多种细胞外活性,通过与细胞表面糖复合物的各种聚糖基团相互作用,介导细胞-细胞和细胞-基质的粘附和迁移( 刘和拉宾诺维奇2005 ). 例如,半乳糖凝集素-1(gal-1)与细胞外基质的各种糖复合物(例如层粘连蛋白、纤维连接蛋白、整合素β1亚单位、神经节苷脂GM1和溶酶体膜相关蛋白lamp 1和2)以及内皮细胞上的糖复合物相互作用( 内里和比克内尔2005 ; 例如整合素α v(v) β 三 和α v(v) β 5 ROBO4、CD36和CD13)和已知可诱导凋亡的T淋巴细胞(例如CD7、CD43和CD45( Perillo等人,1995年 , 1997 ). 它们与细胞表面糖蛋白的结合也可以触发细胞内活动,例如Ras-MEK-ERK途径的元件( Fischer等人,2005年 ).
半乳糖苷乳糖(Gal-β(1→4)-Glc)是半乳糖凝集素在体外与之相互作用的最简单的碳水化合物之一( Barondes等人,1994年 ),糖-半乳糖凝集素相互作用的结构知识通常仅限于对此类简单糖的研究( Nesmelova,Dings等人,2008年 ). 然而,原位聚糖较大,大小和组成不均一,且密度较高,体内gal-1可能在一定程度上与其他各种糖单元相互作用。 尽管β- d日 -半乳糖单元占哺乳动物细胞表面聚糖中所有末端单糖的23%,α- d日 -半乳糖和 d日 -甘露糖(在各种异聚状态下)分别占它们的约2.3和18.9%( Werz等人,2007年 ). 我们最近报道了α-半乳甘露聚糖(GM)Davanat,来源于 四棱锥孢 (瓜尔胶)确实与gal-1相互作用,其表面积相对较大,主要位于蛋白质表面与其典型乳糖结合位点相对的位置( Miller、Klyosov、Mayo等人,2009年 ).
Davanat目前正在II期临床试验中用于治疗转移性结直肠癌( http://clinicaltrials.gov/ct2/show/NCT00110721 )并被认为是gal-1的拮抗剂,已知gal-1在肿瘤中高增殖内皮细胞的粘附和迁移中起关键作用( 拉宾诺维奇2005 ; Thijssen等人,2006年 ). gal-1显然不参与正常的身体过程,如伤口愈合( Cao等人,2002年 )表明gal-1在肿瘤中的表达增加( Thijssen等人,2006年 )使蛋白质成为治疗目的的良好靶点。 更好地理解Davanat等促进与半乳糖凝集素相互作用的GM的结构特征,将对开发其他基于GM的抗癌药物非常有用。
GM通常用其化学名称1,4-β来描述- d日 -半乳甘露聚糖,或更具体地说,如(1→6)-α- d日 -半乳糖-(1→4)-β- d日 -甘露聚糖。 通常,它们由线性(1→4)-β组成- d日 -甘露吡喃糖基聚合物主链,单个α- d日 -吡喃半乳糖残基以或多或少的随机方式附着。 然而,从文献来看,半乳糖残基在甘露吡喃糖链上的分布是随机分布还是“块状分布”尚不清楚。 然而,本研究强烈表明,在所有研究的GM中,半乳糖残基的随机分布相对较好地描述了GM与gal-1的结合模式。 据报告,来自不同植物来源的GM的Man/Gal比率介于,例如1.1(in 东方山羊豆 和 镰刀苜蓿 分别为山羊rue和黄色苜蓿)和4.0(in 西力克角鲨 ,槐豆)或甚至5.0-5.5( 槐即国槐 、日本槐树、豆科树)[ Mestechkina和Shcherbukhin,1991年 以及其中的参考文献; Shcherbukhin 1992年 ; Daas等人,2000年 ; Ilyina等人,2006年 ]. Davanat的Man/Gal比值为1.7。 已经详细研究了植物源转基因的化学结构,特别是使用 1 H和 13 核磁共振波谱( Platt等人,2006年 ). 与微生物来源的转基因不同,植物来源的转基因仅由α- d日 -吡喃半乳糖和β- d日 -甘露糖基残基具有相对明确的(1→6)-α结构- d日 -半乳糖-(1→4)-β- d日 -甘露聚糖。
在本研究中,我们使用核磁共振波谱研究了gal-1与一系列Man/gal比值范围为1.1到4的GM的结合,目的是确定最佳结构特征,以更好地促进GM与gal-1以及可能与其他Galectin的相互作用。 结果表明,gal-1优先在α- d日 -被“裸露”的Man残基区域包围的吡喃半乳糖双链体。 这项工作拓展了我们对半乳糖凝集素如何与更复杂的聚糖相互作用的观点,并有助于GM作为潜在的抗炎和抗癌治疗药物在临床上的发展。
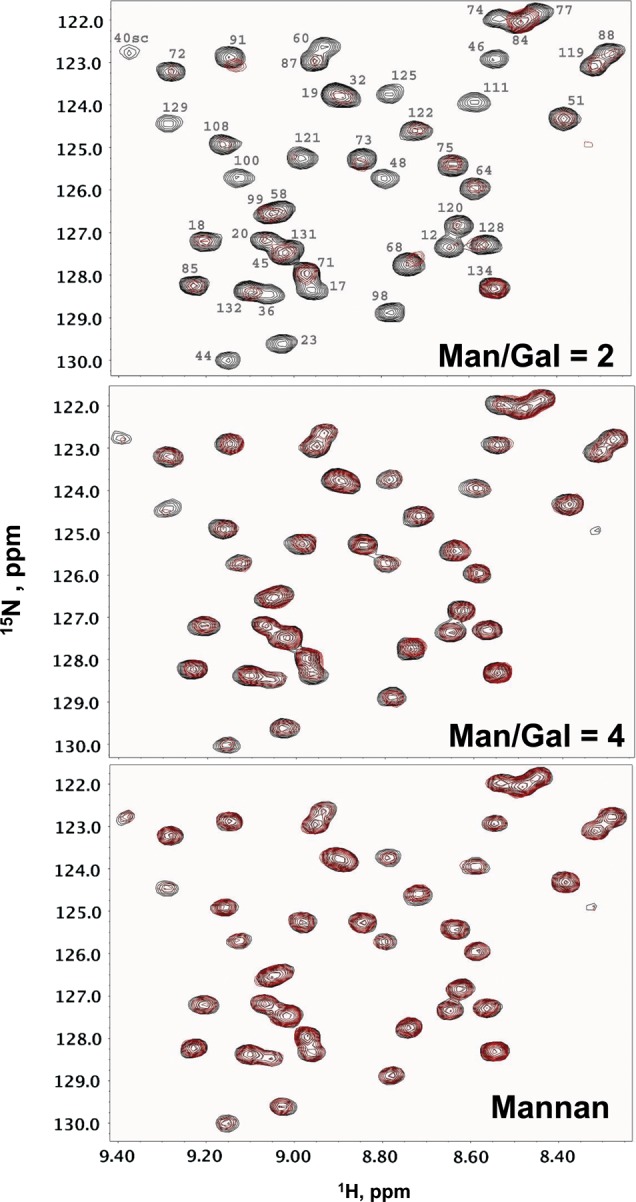
结果 gal-1与GM的结合 使用固定浓度(1 mg/mL)的 15 富氮gal-1( 15 N-gal-1),我们收购了 1 H– 15 N异核单量子相干(HSQC)光谱作为下列八种GM中每一种浓度的函数 方法和材料 以及两种聚甘露聚糖对照物[一种来自酵母的α-甘露聚糖和一种来自象牙坚果植物的β(1→4)-甘露糖]。 由于这些GM具有不同的Man/Gal比率,即1.1、1.7、1.8、2、2.2、2.4、3和4,为了便于讨论,我们将其称为该比率。 HSQC光谱示例如下 15 N-gal-1在没有GM 2(黑色交叉峰)和存在GM 2(红色交叉峰)的情况下(图 1 A) ,GM 4(图 1 B) 和β(1→4)-甘露聚糖(无半乳糖,图 1 C) ●●●●。 15 图中标记了N-gal-1交叉峰 1 A、 如前所述( Nesmelova,Pang等人,2008年 ). 为了更全面地比较研究的所有聚糖对gal-1的影响, 补充材料,图S1 绘制10个GM和甘露聚糖在相同浓度(mg/mL)下的相同HSQC光谱区域。 将每个GM(或甘露聚糖)添加到溶液中后,gal-1共振的强度不同地降低(变宽),如HSQC光谱扩展所示 15 N-gal-1在这些GM存在的情况下。 在所示的等高线水平上,一些交叉峰明显完全消失,一些强度部分降低,其他基本不变。 我们从这些数据得出结论,gal-1与所有这些GM相互作用,尽管程度不同,与甘露聚糖的相互作用最小。 关于甘露聚糖,这一点很有趣,因为虽然β-甘露聚糖与β(1→4)连接的甘露糖残基呈线性关系(与所有这些GM一样),但这种α-甘露糖被认为是高度分支的,可能由α(1→6)-甘露寡糖主链和各种连接的α(1。 然而,这两种甘露聚糖与gal-1的相互作用程度基本相同,尽管最小。
图1。
1 H– 15 N HSQC谱扩展显示为 15 仅N-gal-1(1 mg/mL)(黑色交叉峰 A类 – C类 )以及3 mg/mL的GM 2(A)、GM 4(B)和β(1→4)-甘露聚糖(C)。 共振标记在(A)中,之前报告的分配由 Nesmelova,Pang等人(2008) .
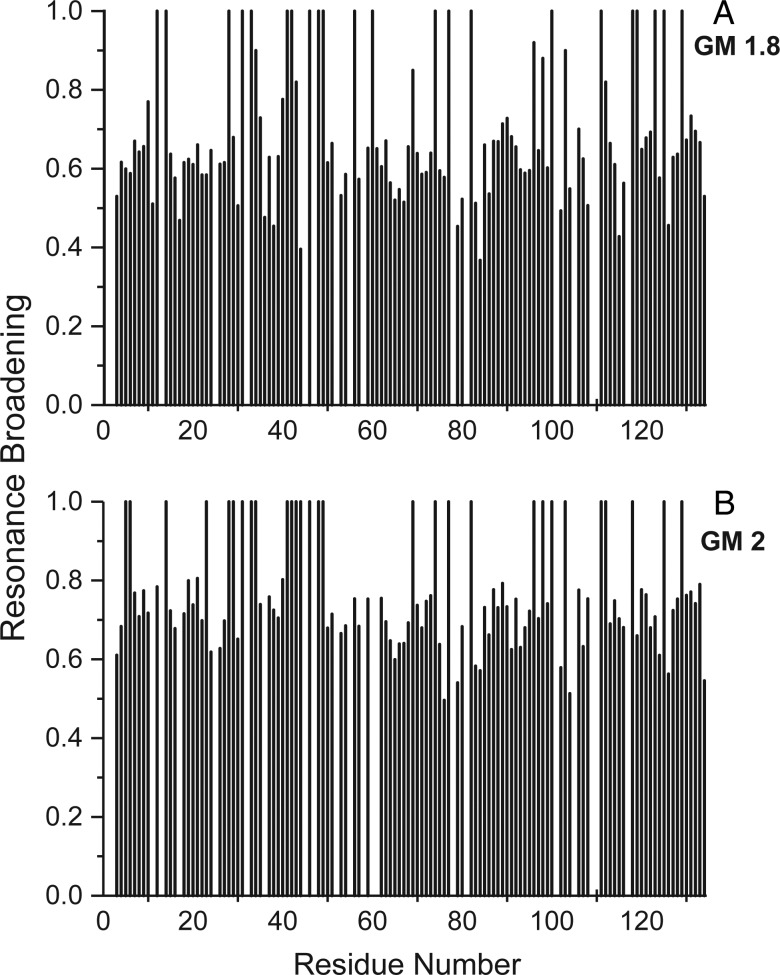
在所有情况下,gal-1共振强度的差异变化主要是由于gal-1和这些GM上的结合位点之间的交换,这种交换发生在中间化学位移时间尺度上( 基勒2005 ). HSQC数据还表明,gal-1的整体折叠结构没有受到GM或甘露聚糖结合的显著干扰,因为滴定过程中剩余共振的化学位移基本不变。 由于GM-gal-1约束事件属于中间汇率制度,图 2 显示了两个HSQC共振展宽图的示例( Miller、Klyosov、Mayo等人,2009年 )对于通用汽车1.8和通用汽车2。 在这里,我们显示了这些GM中每一个的摩尔比下的差异展宽,其中仍然观察到大多数共振,但由于明显展宽,其强度较低。 HSQC加宽图的解释与HSQC化学位移图的解释基本相同( Rajagopal等人,1997年 )也就是说,那些最宽的共振与gal-1上聚糖相互作用的位点有关。 分数变化是通过从1中减去给定HSQC交叉峰的强度除以相同蛋白质浓度下纯gal-1中的交叉峰强度来计算的。 值为1表示共振不再明显,值为零表示共振强度没有变化。
图2。
显示了GM与gal-1结合的HSQC共振展宽图。 通过GM 1.8(3 mg/mL, A类 )和GM 2(1.8 mg/mL, B类 )gal-1的氨基酸序列。 数据显示的条件是大多数gal-1共振仍然明显。 值为1表示与该特定残留物相关联的共振不再明显,值为零表示共振强度没有变化。
由于中间交换体系中的共振最初随着它们的展宽而发生化学位移(有些比其他的更大),我们还显示了HSQC化学位移图( Rajagopal等人,1997年 )图中的一些GM 三 。当然,这些曲线图中不存在在显著位移变化之前高度加宽的共振,对于在所示HSQC数据中可能不太明显的其他一些共振,可以通过深入等高线图的谱层来跟踪交叉峰。 化学位移差Δ的相关图 δ 对于一个GM与另一个GM,所有相关系数均在0.6-0.72范围内,表明与gal-1的相互作用模式相似。
图3。
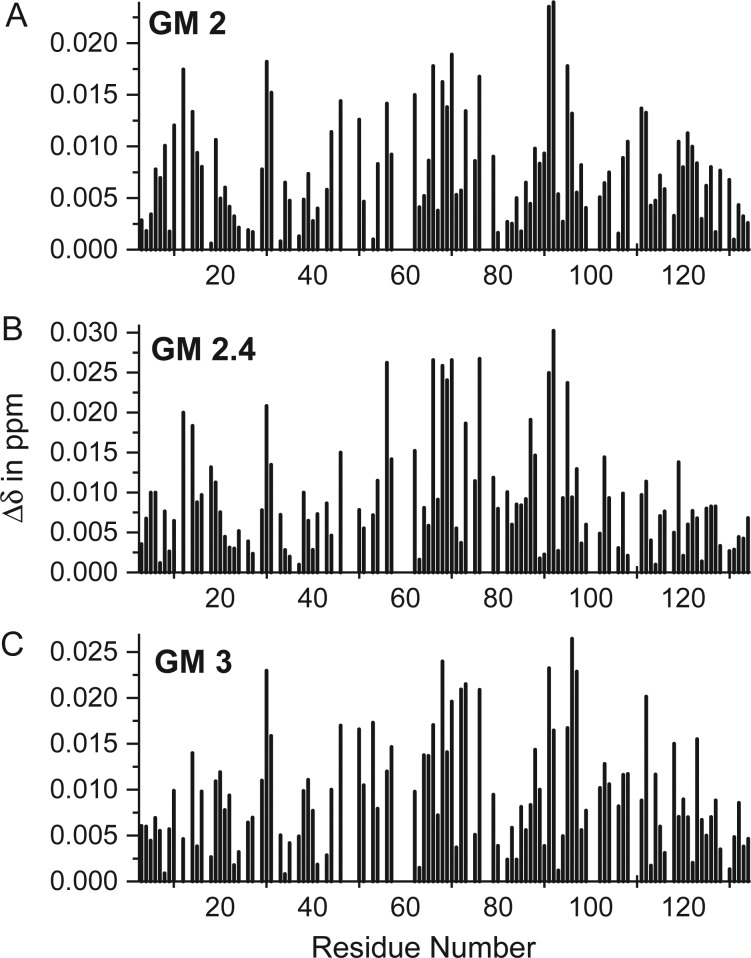
显示了GM与gal-1结合的HSQC化学位移映射。 15 N-和 1 H加权化学位移变化Δ δ ,协议双方 15 N-gal-1(不存在配体)和 15 N-半乳糖-1在GM 2接近饱和浓度下( A类 ),通用2.4( B类 )和GM 3( C类 )绘制了gal-1的氨基酸序列。
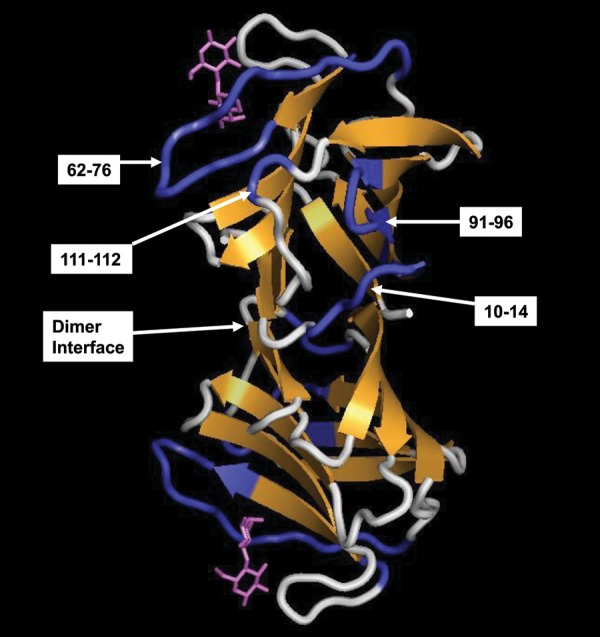
加宽和化学位移图(图 2 和 三 )就这些GM在gal-1上的相互作用提供一个相当一致的图片。 虽然可能存在多种相互作用模式,但似乎GM主要与gal-1上的同一区域相互作用,如图所示 4 Gal-1具有由11条β链组成的β-三明治结构,乳糖结合位点主要由β链4、5、6和9组成,二聚体界面由链1和11组成。 如图所示,拟定的主要相互作用位点位于β-三明治的边缘,从典型β-半乳糖苷结合位点的顶部一直到二聚体界面,包括环10–14、62–76、91–96和111–112。 典型β-半乳糖苷结合位点及其周围的残留物也受到影响(图中未突出显示 4 ),但通常程度较小。 然而,残基29-31和其他44至57,主要位于gal-1的经典β-半乳糖苷结合面上,也受到了显著的干扰。 这一观察结果表明,单个GM结合表位与gal-1上的两个区域协同相互作用,和/或两个或多个GM结合表位与这两个区域独立相互作用,因此我们在 15 N-gal-1 HSQC光谱。
图4。
图中显示了gal-1上提议的GM-结合域。 如文中所述,含有通常受这些GM结合影响最大的残基的片段被标示出来,并在gal-1二聚体的结构上以蓝色突出显示。 图中使用了乳糖结合的人gal-1的X射线结构(pdb访问代码:1gzw, Lopez-Lucendo等人,2004年 ),结合乳糖分子显示为紫色。
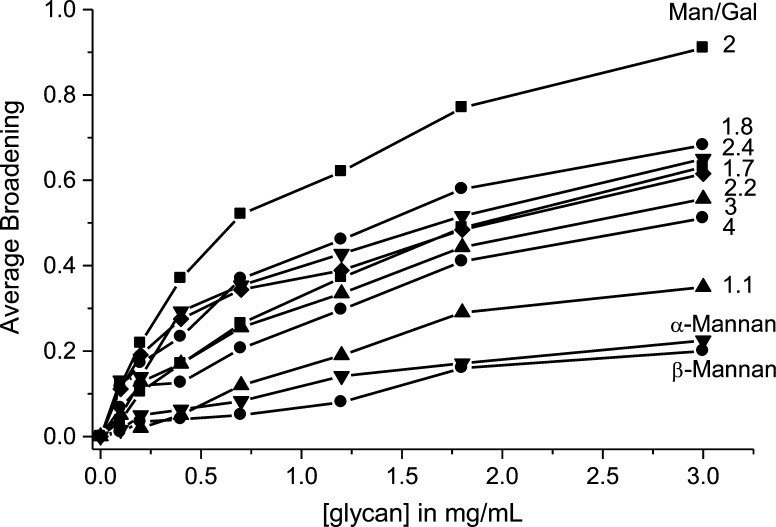
由于GM 2诱导gal-1共振的最大展宽,我们得出结论,gal-1与GM 2的相互作用最强,而与Man/gal比值较小或较大的GM的相互作用较弱。 图 5 绘制了所有gal-1残基的平均加宽变化与每个GM的聚糖浓度。尽管将这些图中的中点解释为表观平衡离解常数的估计值很有吸引力, K(K) d日 这是一种误导,主要是因为每个GM的gal-1结合化学计量比未知。 更恰当的做法是将这些中间点视为净绑定或总体绑定亲和力的指示。 然而,这一趋势是明显的,我们可以得出结论,gal-1与GM 2的相互作用最强。
图5。
共振展宽的平均分数 15 显示了N-gal-1 HSQC共振强度随GM和甘露聚糖浓度(mg/mL)的变化。 实线用作视觉辅助工具,简单地连接每条曲线中的数据点。
我们还应该强调,gal-1总亲和力的差异与这些GM的重量平均分子量的差异无关。 图中所示的趋势 5 不考虑大小差异。 例如,GM 2(690 kDa)、GM 2.4(790 kDa的)和GM 3(685 kDa的)大小相似,但GM 2对gal-1的亲和力最大。 此外,GM 1.7(60 kDa)小于GM 1.1(83 kDa。 因此,总体亲和力的趋势(图 5 )主要通过Man/Gal比率的差异来解释。
统计建模 平均Man/Gal比为2的GM 2并不意味着聚合物是均匀的,在整个多糖中,每两个Man残基中就有一个Gal残基。 对于这些GM中的任何一个,都会有一个分布,例如,每个Man都有一个连接的Gal的区域,以及骨干Man残基没有连接的Gals的区域(即“裸”甘露聚糖序列)。 根据组合数学原理,可以对这种分布进行统计建模,并与我们的实验数据进行比较。 虽然gal-1具有不同亲和力的GM结构可能有无限多的组合和排列,但我们的目标是确定一个简单的模型(基于甘露聚糖骨架中半乳糖残基的随机分布),该模型可以解释为什么Man/gal比为2.0的GM与gal-1结合最好。
对于随机分布,具有的统计概率(Gal/Man) n个 甘露聚糖骨架上的簇由下式给出:
以及“裸体”集群的概率(人类) n个 残留物计算公式如下:
哪里 q个 是转基因中“裸露”人类残留物的比例; (1 − q个 )Gal/Man团簇的分数和 n个 被“裸”Man残留物包围的连续Gal/Man残渣的数量。
例如,Man/Gal比率为1.0表示(Gal/Man)没有孤立的“簇” n个 或(男子) n个 ,因此 P(P) 在这两种情况下均为0。 或者,对于2.0的男子/女孩, P(P) = 0.5 2 × 0.5 n个 这个公式也给出了“裸”Man残基的双、三、四倍体等的概率。 如果我们将“裸”Man残留物取为1.0,Man/Gal=2, P(P) (1 − q个 ) = 0.5 2 × 0.5 1 =0.125或12.5%。 对于Man/Gal=1.1,Gal/Man残留物和“裸”Man残渣的平均比率为0.909:0.091,并且存在孤立Gal/Man-单峰的概率( n个 =1),双绞线( n个 =2)等,取0.091 2 × 0.909 n个 这些概率对于序列(人)来说是相同的 n个 GM主干中的残留物。
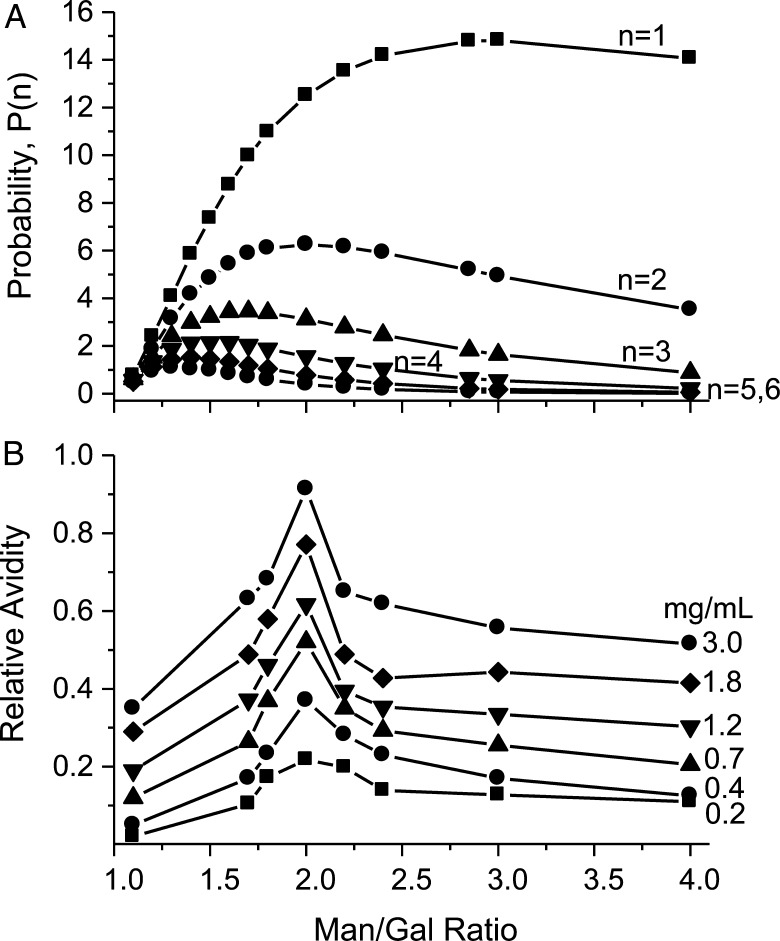
我们可以通过简单地“抛硬币”(例如300次)随机生成概率分布,从而获得基本相同的结果,尾部表示有(Man)残留物,头部表示有(Gal/Man)剩余物沿着GM主干。 对于 n个 =1至 n个 =6,我们可以根据这些概率计算出百分比,分别为13.3±2.1、6.3±1.4、3.0±1.0、1.6±0.7、0.7±0.5和0.3±0.3%。 这表明,对于Man/Gal=2,上述公式充分描述了(Gal/Man)和(Man)残基沿着GM主链的分布。
图 6 A绘图 P(P) ( n个 )与的Man/Gal比率 n个 =1至 n个 = 6. 可以进行三个观察:(i) P(P) ( n个 )Man/Gal比值为~3时的最大位移 n个 =1至~1.3 n个 = 6; (ii)在较低的Man/Gal比率下 P(P) ( n个 )当 n个 值降低,并且(iii)在较高的Man/Gal比率下 P(P) ( n个 )当 n个 值增加。 为了将这些趋势与实验进行比较,图 6 对于在0.2至3 mg/mL GM浓度下采集的数据,所有残留物上平均的gal-1 HSQC共振展宽的B图变化与Man/gal比率成正比。展宽增加与这些GM的gal-1亲和力增加成正比。 在任何GM浓度下,GM 2的展宽最大(Man/Gal比率为2),并且在Man/Gal比值的两侧都会减小。 的概率分布 n个 =2(图 6 A) 与这些实验数据最为一致的是 P(P) ( n个 )最大值出现在约为2的Man/Gal比率。 对于 n个 = 1, P(P) ( n个 )最大值约为3 n个 = 3, P(P) ( n个 )最大值约为1.6或1.7。 此外,对于 n个 = 2, P(P) ( n个 )Man/Gal比值为4时,与最大值相比下降了约35%,这与实验观察到的下降百分比大致相同(图 6 B) ●●●●。 在相同的范围内, P(P) ( n个 )最多下降10% n个 =1,乘以~70% n个 =3,且大于 n个 值进一步增加。
图6。
( A类 )概率(相对分布) P(P) ( n个 )孤立序列(Gal/Man) n个 对于 n个 沿着半乳甘露聚糖主链在1到6之间。 在本文中,“隔离”是指被“裸”(未取代)单或多(Man)残基包围。 只有一个Gal残基可以附着到一个Man残基上,形成(Gal/Man)对。 Gal残基沿着半乳甘露聚糖主链的随机分布,因此,(Gal/Man)的随机分布 n个 组合( n个 =1–6)。 这种随机分布由以下公式描述 P(P) = q个 2 × (1 − q个 ) n个 ,其中 q个 是半乳甘露聚糖中“裸”人残基的一部分,以及(1− q个 )是半乳甘露聚糖中Gal/Man对的一部分。 ( B类 )1,4-β的影响- d日 -不同附着度(1→6)-α的半乳甘露聚糖(GM)- d日 -Gal残基到(1→4)-β- d日 -GM骨架中的Man残基被描述为(Man/Gal)比率,与这些GM与Gal-1的结合亲和力有关。 这里的结合亲和力定义为 15 与这些GM相互作用时的N-gal-1 HSQC光谱峰。
这个简单的模型与我们的实验数据一致,有力地表明gal-1与GMs结合的结构特征是α- d日 -吡喃半乳糖双链,随机分布在GM主干上,并点缀有“裸”甘露糖区域。
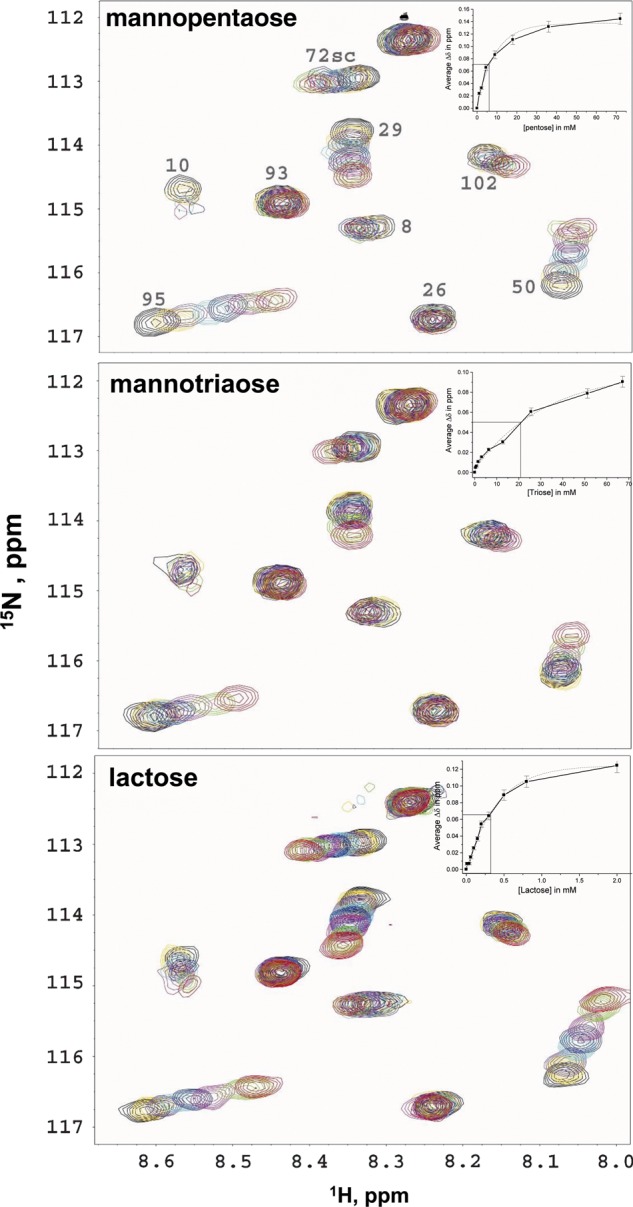
gal-1与甘露三糖和甘露五糖的结合 接下来我们研究了gal-1是否结合α- d日 -简单甘露五糖背景下的吡喃半乳糖双标记[6 三 ,6 4 -di-α(1→6)- d日 -半乳糖基-β- d日 -甘露五糖],与甘露三糖[6 1 -α(1 → 6)- d日 -半乳糖基-β- d日 -甘露糖]和乳糖作为对照。 为此,我们执行了相同的操作 15 使用这些简单糖进行N-gal-1 HSQC滴定。 图 7 A和B显示了通过这些滴定的HSQC扩展和光谱叠加,图 7 C与乳糖的对比结果相同。 从这些数据中可以明显看出,GM甘露三糖和甘露五糖与乳糖一样与gal-1相互作用。 此外,因为gal-1共振主要是化学位移(如乳糖; Miller,Nesmelova等人,2009年 )与gal-1对更大和更复杂的GM的结合亲和力相比,内部结合亲和力相对较弱。 图中的插入 7 A–C分别绘制了前30个移位残基与糖浓度的平均化学移位变化。 从这些曲线的中点,我们可以估计明显的 K(K) d日 ~21×10的值 −3 和~6×10 −3 M分别代表GM甘露三糖和GM甘露五糖,与~0.3×10相比 −3 M代表乳糖。 正如预期的那样,GM甘露三糖和甘露五糖结合gal-1的亲和力比乳糖低得多。
图7。
15 图中显示了N-gal-1 HSQC光谱扩展,每个有八个覆盖层,一个仅用于gal-1(0.3 mM)(黑色交叉峰),另一个用于 15 存在1.1–72 mM(红色)GM甘露糖五糖6的N-gal-1 三 ,6 4 -di-α(1→6)- d日 -半乳糖基-β- d日 -甘露五糖, A类 ); 0.4–67 mM(红色)6 1 -α(1 → 6)- d日 -半乳糖基-β- d日 -甘露三糖(甘露三糖, B类 )和0.04–10 mM(红色)乳糖( C类 ). 每个面板的插入部分分别绘制了前30个移位残基与糖浓度的平均化学移位变化。 这些曲线上的中点允许估计平衡解离常数, K(K) d日 ,用于每种糖与gal-1的结合,如文中所述。
这里使用的甘露糖[6 三 ,6 4 -di-α(1→6)- d日 -半乳糖基-β- d日 -甘露五糖; 补充材料,图S2 ]基本上具有与我们的统计分析所建议的相同的基本结构单元,根据α- d日 -吡喃半乳糖双重标记,确实比甘露三糖对gal-1的结合力高4倍[6 1 -α(1 → 6)- d日 -半乳糖基-β- d日 -甘露三糖]只有一个半乳糖残基。 此外,甘露五糖结合gal-1的亲和力与半乳糖本身的亲和力大致相同,这表明甘露糖在这种情况下对亲和力没有任何贡献。 这支持了我们从统计分析中得出的结论,即α- d日 -吡喃半乳糖双链与gal-1结合更好。
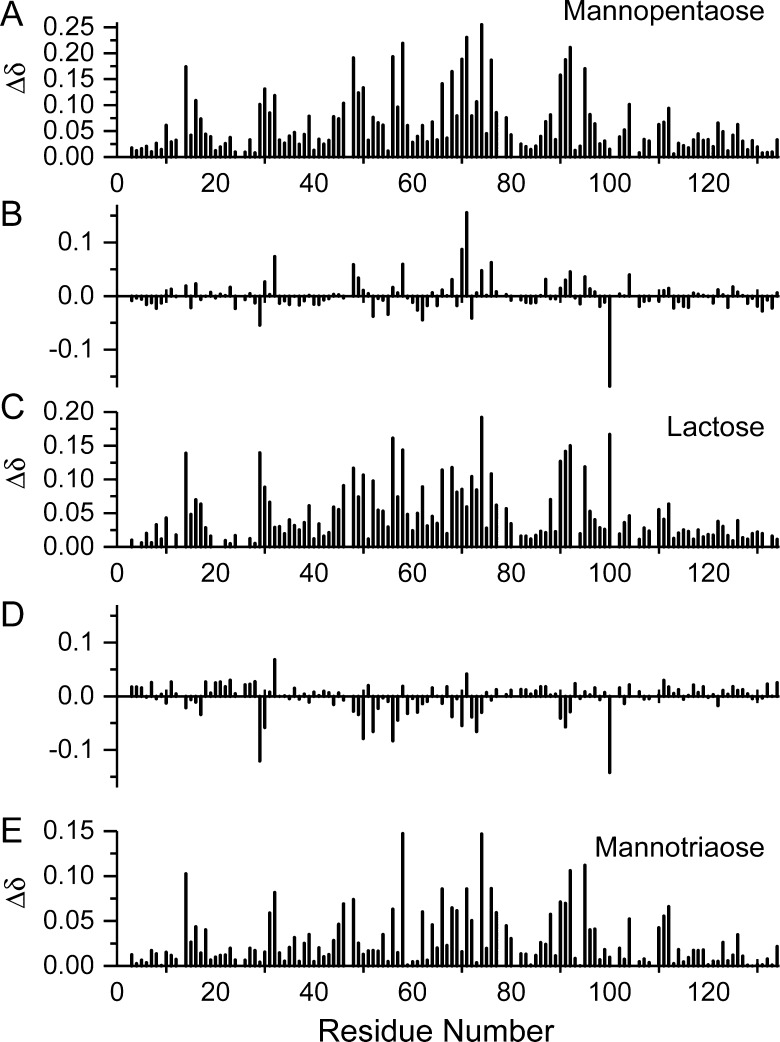
为了评估这些糖在gal-1上的相互作用,图 8 A、 C和E分别显示了转基因甘露聚糖五糖、转基因甘露三糖和乳糖的化学位移图。 所有三幅图看起来都很相似,相关系数由Δ图导出 δ 乳糖与GM甘露三糖或GM甘露五糖的值分别为0.68和0.74。 因此,我们得出结论,GM甘露三糖和GM甘露五糖在gal-1的典型乳糖结合位点上相互作用。 然而,如图所示,他们在该站点的交互模式存在差异 8 ,表示Δ δ 甘露五糖减去乳糖的差异图(图 8 B) 和不含乳糖的甘露糖(图 8 D) ●●●●。 Δ中的正差异越大 δ 表明GM甘露opentaose或甘露三糖在这些位置发挥更大的作用,而Δ越负 δ 差异表明乳糖的影响更大。
图8。
HSQC化学位移图显示了GM甘露三糖和GM甘露五糖与gal-1的结合。 15 N-和 1 H加权化学位移变化(ppm),Δ δ 在存在35 mM甘露五糖的情况下,在gal-1(无配体)和gal-1之间(0.3 mM)( A类 ),10 mM乳糖( C类 )和70 mM甘露糖( E类 )绘制了gal-1的氨基酸序列。 另外两个面板显示了Δ δ 甘露聚糖酶减去Δ δ 乳糖( B类 )和Δ δ 甘露三糖减去Δ δ 乳糖( D类 ),如文中所述。
在这两种情况下,表现出最大差异的gal-1序列包括残基29-32、48-76、90-92和100/104。 48-76序列中的残基(β-链4和5,以及圈51-54和环65-76)基本上形成了典型的乳糖结合位点。 例如,R48、N61和E71与乳糖基团形成氢键,W68通过CH–π堆积相互作用直接与乳糖的半乳糖环相互作用( Nesmelova等人,2010年 ). 进入β-链3的环中残基29–32的差异主要是由于接近R48–F49。 残基87/90–92和100也存在显著差异,它们位于β-三明治的对面。 例如,内部β-夹心残基L100与I58直接相互作用,这可能解释了这种差异。 然而,尚不清楚为什么残基90-92受到如此影响,因为它们距离乳糖结合域相对较远,而不是说它们受到糖类结合的高度干扰。 总的来说,GM甘露五糖对R48/L32、I58、T70、E71、E74和V76的影响更大。 这很有趣,因为GM甘露五糖与gal-1的结合比与乳糖的结合弱得多,而较大的甘露五聚糖似乎表现出更大的相互作用,尤其是在位于乳糖结合域顶部的70-76环。 然后,该区域流向β-三明治的一侧,较大的GM与之相互作用,如前几节所述。
讨论 使用一系列具有不同Man/Gal比率的GM,我们在这里报告了GM与Gal-1最佳结合的结构特征。 此签名的一个特征是α的存在- d日 -吡喃半乳糖双链,随机分布在GM主干上。 这是基于HSQC共振展宽的实验观察结果,这表明gal-1与Man/gal比值为2的GM之间的相互作用最强,而与Man/Gal2或更小或更大的GM之间则更少。 这一结论得到了使用一个简单模型的统计分析的支持,该模型被参数化为Gal/Man簇的分数、“裸”Man残基的分数以及被“裸”Man残基包围的序列Gal/Man残基的数量。 最可接受的概率分布是Man/Gal比率为2,与实验观察结果一致。 当Man/Gal比率高于2时,Gal残基将更分散在甘露糖基聚合物链上,具有Gal孤立簇的概率更低 n个 残留物。 在接近1.0的较低Man/Gal比率下(即所有Man残基都会附着Gal残基),被“裸”Man残余物包围的孤立Gal簇的概率也很低。
这项研究还提出了最佳签名的另一个方面,即α- d日 -吡喃半乳糖双链的两侧应该是“裸”甘露聚糖区域。 这样做可以减少α的空间位阻- d日 -吡喃半乳糖双链与gal-1相互作用。 我们的实验观察支持了这一建议,即gal-1与GM的结合相对较大,Man/gal与GM的比值为3或4,而Man/gal的比值为1.1,基本上没有“裸”甘露聚糖的延伸。 仍然会发生绑定,但程度较小。 先前的研究还表明,gal-1可以与聚甘露聚糖结合,尽管比与GM结合更弱( Miller、Klyosov、Mayo等人,2009年 ). 此外,HSQC加宽映射表明,这些具有不同Man/Gal比率的GM中的任何一个至少部分地在邻近典型乳糖结合域的替代位点和Gal-1β-三明治的背面β-板上相互作用。 这一观察结果也与早先报道的聚甘露聚糖与gal-1相互作用的结果一致( Miller、Klyosov、Mayo等人,2009年 ).
β- d日 -对具有不同Man/Gal比率的GM的甘露聚糖酶水解研究(如本文所研究的GM)确实表明,具有Gal残基随机分布的GM将包含大量不含半乳糖部分的甘露糖主链残基。 尽管不同的β- d日 -甘露聚糖酶表现出不同的GM水解模式( McCleary and Matheson 1983年 ; McCleary等人,1983年 , 1984 )通常情况下,Man/Gal比率为~2及以上的GM将具有四个或更多“裸”甘露聚糖段。 例如 黑曲霉 β- d日 -几种具有不同Man/Gal比率的GM的甘露聚糖酶消化表明,当存在四个或更多“裸”甘露聚糖时,水解程度最大,可能是因为其他区域的半乳糖部分的空间位阻(参见 McCleary and Matheson 1983年 ). 在另一项研究中,使用两种内β-甘露聚糖酶(来自 幸运金孢霉 和 里氏木霉 )结果相对转化度分别为1.0:3.3:4.4和1.0:3.3:3.3。 假设β-甘露聚糖酶催化水解可以发生在来自 n个 =1至 n个 =6,则这些Man/Gal比率的有限转换度为0.6:0.8:1.0,这与实验观察到的结果(即3.3/4.4:3.3:1.0)大不相同。 计算的概率 n个 =1至 n个 =6表明这些β-甘露聚糖酶优先在聚合物骨架中含有四个(或更多)“裸”Man残基的位点消化GM(来自A.P.Synitsyn教授的个人信息 等 ,莫斯科州立大学化学系,未发表结果)。
我们的核磁共振gal-1结合研究 1 -α(1 → 6)- d日 -半乳糖基-β- d日 -甘露三糖和6 三 ,6 4 -di-α(1→6)- d日 -半乳糖基-β- d日 -甘露opentaose表明α- d日 -这两个小GM的吡喃半乳糖双链在典型乳糖结合区相互作用。 然而,它们在该位点的相互作用预计与β-半乳糖苷的相互作用不同,因为结合引起的间接构象效应也不同。 与乳糖相比,GM甘露聚糖酶尤其对位于乳糖结合结构域顶部的70-76环内的残基表现出更大的影响。 有趣的是,这是由于GM甘露opentaose与该环的直接相互作用所致,该环是较大GM主要与之相互作用的部位的一部分。 因此,较大的GM如何与gal-1相互作用的一个可能的结构模型是,具有半乳糖部分的片段在典型乳糖结合位点相互作用,而“裸”甘露聚糖片段折叠并与β-三明治的侧面相互作用,如图所示 4 .
了解GM与gal-1结合的这种结构特征不仅对更好地理解galectin–聚糖相互作用很重要,而且对设计更好的gal-1(也许还有其他galectins)拮抗剂用于临床也很重要。 目前,Davanat(一种Guar-derived GM,Man/Gal比率为1.7)正在开发中,作为癌症的治疗干预( http://clinicaltrials.gov/ct2/show/NCT00110721 ). Davanat通过促进肿瘤内皮细胞的粘附和迁移,与已知对肿瘤生长至关重要的gal-1相互作用( Thijssen等人,2006年 ). Davanat的作用机制可以通过隔离gal-1来干扰正常的gal-1质量作用,通过诱导gal-1和细胞表面聚糖周围微环境的变化,或者通过影响gal-1糖共轭超分子结构来解释。 其中任何一种都可能影响gal-1在细胞粘附/迁移、聚糖交联和/或糖共轭受体信号方面的功能。 目前的结果可用于推导更为理想的Man/Gal比为2的GM。
总之,这些结果表明gal-1在α- d日 -吡喃半乳糖双链体,随机分布在GM主链上,并被“裸露”的Man残基区域包围。 这些研究扩展了我们对半乳糖凝集素通常如何与更复杂的聚糖相互作用的看法,并将有助于开发基于转基因的半乳糖凝集素阻断剂,作为对抗多种病理性疾病的候选药物。
材料和方法 Gal-1制备 统一 15 如Nesmelova,Pang等人(2008)所述,N标记的人gal-1在BL21(DE3)活性细胞(Novagen)中表达,在最小培养基中生长,在β-乳糖亲和柱上纯化,并在凝胶过滤柱上进一步分离。 通常,从1 L细胞培养物中获得44 mg纯化蛋白。 最终样品的纯度通过Biorad蛋白质分析进行量化,并通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳检查纯度。 通过T细胞死亡试验评估纯化蛋白的功能活性。
聚糖制备 1,4-β- d日 -半乳甘露聚糖 四分体梭菌 重量平均分子量为59 kDa的(瓜尔胶;Man/Gal=1.7)( Miller、Klyosov、Platt等人,2009年 )由Galectin Therapeutics Inc.(马萨诸塞州牛顿市)以商业名称Davanat®生产,美国专利号6642205和7893252对其进行了描述,并于 Platt等人(2006年) Miller、Klyosov、Platt等人(2009年)。 1,4-β- d日 -半乳甘露聚糖 C.西力克 (刺槐豆;>1000 kDa;Man/Gal=4.0)来自西格玛化学公司(密苏里州圣路易斯),目录号G-0753,批号109H0899。 其他1,4-β- d日 -这里使用的半乳甘露聚糖由俄罗斯莫斯科俄罗斯科学院生物化学研究所的弗拉基米尔·德·谢尔布金博士善意提供,并在 Ilyina等人(2006年) ), Shcherbukhin(1992年 )和 Mestechkina和Shcherbukhin(1991年 ). 其中包括以下内容,括号中给出了重均分子量和Man/Gal比率:
总经理来自 镰刀菌 (黄色苜蓿)(83 kDa;Man/Gal 1.1)
总经理来自 四分体梭菌 (瓜尔胶)(100 kDa;Man/Gal 1.8)
总经理来自 扇叶卫矛 (含羞草)(690 kDa;Man/Gal 2)
总经理来自 美国皂荚 (蜜蜂蝗虫)(215 kDa;人/Gal 2.2)
来自的GM 三刺五加 (刺槐)(790 kDa;Man/Gal 2.4)
总经理来自 皂荚 (槐树)(685 kDa;Man/Gal 3)
乳糖和α-甘露聚糖 酿酒酵母 (重量平均分子量为50 kDa)购自Sigma Chemical,使用时无需进一步纯化。 这种α-甘露聚糖来自 酿酒酵母 (酵母)被认为是高度分枝的,可能由α(1→6)-甘露聚糖主链和各种连接的α(1~2)和α(1×3)甘露糖残基组成。 6 1 -α(1 → 6)- d日 -半乳糖基-β- d日 -甘露糖三糖(GM甘露糖),6 三 ,6 4 -di-α(1→6)- d日 -半乳糖基-β- d日 -从爱尔兰Megazyme International Ireland(Wicklow,Ireland)购买象牙坚果植物中的甘露聚糖(GM甘露聚糖)和β(1→4)-甘露聚糖。
异核核磁共振波谱 统一 15 将N标记的gal-1以1 mg/mL的浓度溶解在20 mM磷酸钾缓冲液中,pH值为7.0,使用95%的H配制 2 O/5%D(开/关) 2 O混合物。 1 H– 15 N HSQC NMR实验用于研究一系列GM多糖与gal-1的结合。 1 H和 15 以前曾报道过重组gal-1的N共振分配(Nesmelova和Pang等人,2008)。
所有核磁共振实验均在30°C下,在配备H/C/N三重共振探针的Varian Unity Inova 600-MHz光谱仪上进行 x个 / 年 / z(z) 三轴脉冲场梯度单元。 二维梯度灵敏度增强版 1 H– 15 N HSQC应用于256( t吨 1) × 2048 ( t吨 2) 氮和质子维度的复杂数据点。 使用NMRPipe转换和处理原始数据( Delaglio等人,1995年 )并使用NMRview进行分析( 约翰逊和布莱文斯1994 ).
基金 这项工作得到了国家癌症研究所(NIH)的研究资助 R01 CA096090)到KHM。 MCM得到了美国国立卫生研究院(NIH)向明尼苏达大学提供的癌症生物学培训拨款的支持 T32 CA009138)。 核磁共振仪器由国家科学基金会(BIR-961477)、明尼苏达大学医学院和明尼苏苏达医学基金会资助。
缩写 半乳糖凝集素-1; GM,α-半乳甘露聚糖; 异核单量子相干; 15 N-半乳糖-1, 15 富氮gal-1; 核磁共振,核磁共振。
致谢 我们非常感谢加州大学洛杉矶分校病理和实验医学系的Linda Baum教授和Mabel Pang教授为我们提供了人类gal-1的表达系统(载体/质粒)。
工具书类
Barondes SH、Castronovo V、Cooper DN、Cummings RD、Drickamer K、Feizi T、Gitt MA、Hirabayashi J、Hughes C、Kasai K等。半乳糖凝集素:动物β-半乳糖苷结合凝集素家族。 单元格。 1994; 76:597–598. doi:10.1016/0092-8674(94)90498-7。 doi:10.1016/0092-8674(94)90498-7 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Cao Z、Said N、Amin S、Wu HK、Bruce A、Garate M、Hsu DK、Kuwabara I、Liu FT、Panjwani N.Galectins-3和-7,但不是galectin-1,在伤口的再上皮化中起作用。 生物化学杂志。 2002; 277:42299–42305. doi:10.1074/jbc。 M200981200。 doi:10.1074/jbc。 M200981200型 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Daas PJH、Schols HA、de Jongh HHJ。 商业半乳甘露聚糖的半乳糖分布。 碳水化合物研究2000; 329:609–619. doi:10.1016/s0008-6215(00)00209-3。 doi:10.1016/S0008-6215(00)00209-3 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Delaglio F、Grzesiek S、Vuister GW、Zhu G、Pfeifer J、Bax A.J生物分子核磁共振。 1995; 6:277–293. doi:10.1007/BF00197809。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Fischer C、Sanchez-Ruderisch H、Welzel M.Galectin-1与α5β1纤维连接蛋白受体相互作用,通过诱导p21和p27限制癌细胞生长。 生物化学杂志。 2005; 280:37266–37277. doi:10.1074/jbc。 M41158200。 doi:10.1074/jbc。 M41158200个 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Ilyina AV,Mestechkina NM,Shcherbukhin VD,Varlamov VP。 纤维素酶G20x对豆科种子半乳甘露聚糖的解聚作用。 Prikladnaya Biokhimiya I Mikrobiologiya公司。 2006; 42:580–586. [ 公共医学 ] [ 谷歌学者 ]
约翰逊BA,布莱文斯RA。 生物分子核磁共振杂志。 1994; 4:603–614. doi:10.1007/BF00404272。 doi:10.1007/BF00404272 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Keeler J.了解核磁共振波谱。 纽约:威利父子公司; 2005 [ 谷歌学者 ]
Liu FT,Rabinovich GA.半乳糖凝集素作为肿瘤进展的调节剂。 Nat Rev癌症。 2005; 5:29–41. doi:10.1038/nrc1527。 doi:10.1038/nrc1527 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Lopez-Lucendo MF、Solís D、Andre s、Hirabayashi J、Kasai K、Kaltner H、Gabius H-J、Romero A.Growth-调节性人类半乳糖凝集素-1:单位点突变引起的结构变化的结晶特征及其对配体结合热力学的影响。 分子生物学杂志。 2004; 343:957–970. doi:10.1016/j.jmb.2004.08.078。 doi:10.1016/j.jmb.2004.08.078 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
McCleary BV,Dea ICM,Windust J,Cooke D.D-半乳糖缺失瓜尔半乳甘露聚糖样品的相互作用特性。 羧基聚合物。 1984; 4:253–270. doi:10.1016/0144-8617(84)90002-X . [ 谷歌学者 ]
McCleary BV,Matheson NK公司。 β-D-甘露聚糖酶与甘露糖和甘露聚糖型多糖的作用模式和底物结合需求。 1983年《碳水化合物研究》; 119:191–219. doi:10.1016/0008-6215(83)84056-7 . [ 谷歌学者 ]
McCleary BV、Nurthen E、Taravel FR、Joseleau J-P。半乳甘露聚糖与β-D-甘露聚糖酶水解产生的低聚糖的表征。 1983年《碳水化合物研究》; 118:91–109. doi:10.1016/0008-6215(83)88038-0 . [ 谷歌学者 ]
新墨西哥州Mestechkina,弗吉尼亚州Shcherbukhin。 产于Galega orientalis Lam的半乳甘露聚糖。 种子。 应用生物化学-微生物。 1991; 26:648–651. [ 谷歌学者 ]
Miller MC,Klyosov AA,Mayo KH。α-半乳甘露聚糖Davanat在不同于传统半乳糖结合域的位置结合半乳糖凝集素-1。 糖生物学。 2009; 19:1034–1045. doi:10.1093/glycob/cwp084。 doi:10.1093/乙二醇/cwp084 . [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Miller M,Klyosov A,Platt D,Mayo KH。使用脉冲场梯度核磁共振扩散测量确定聚糖制剂中的分子量分布。 碳水化合物研究2009; 344:1205–1212. doi:10.1016/j.cares.2009.04.010。 doi:10.1016/j.carres.2009.04.010 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Miller MC、Nesmelova IV、Platt D、Klyosov A、Mayo KH。半乳糖凝集素-1上的碳水化合物结合域对于复杂聚糖比简单糖更广泛:细胞表面半乳糖-聚糖相互作用的含义。 生物化学杂志2009; 421:211–221. doi:10.1042/BJ20090265。 doi:10.1042/BJ20090265 . [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Neri D,Bicknell R.《血管靶向肿瘤》。 Nat Rev癌症。 2005; 5:436–446. doi:10.1038/nrc1627。 数字对象标识代码:10.1038/nrc1627 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Nesmelova IV,Dings RPM,Mayo KH。了解半乳糖凝集素结构-功能关系以设计有效拮抗剂。 收录人:Klyosov AA、Witchzak ZJ、Platt D,编辑。 半乳糖凝集素。 新泽西州霍博肯:约翰·威利父子公司; 2008年,第33–69页。 [ 谷歌学者 ]
Nesmelova IV、Ermakova E、Daragan VA、Pang M、Menéndez M、Lagartera L、Solís D、Baum LG、Mayo KH。乳糖与半乳糖凝集素-1结合可调节结构动力学,增加构象熵,并具有明显的负协同性。 分子生物学杂志。 2010; 397:1209–1230. doi:10.1016/j.jmb.2010.02.033。 doi:10.1016/j.jmb.2010.02.033 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Nesmelova IV、Pang M、Baum LG、Mayo KH.1H、13C和15N 29 kDa人半乳糖凝集素-1蛋白二聚体的骨架和侧链化学位移分配。 J NMR分配。 2008; 2:203–205. doi:10.1007/s12104-008-9121-9。 doi:10.1007/s12104-008-9121-9 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Perillo NL、Pace KE、Seilhamer JJ、Baum LG。 半乳糖凝集素-1介导的T细胞凋亡。 自然。 1995; 378:736–739. doi:10.1038/378736a0。 数字对象标识代码:10.1038/378736a0 . [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
Perillo NL、Uittenbogaart CH、Nguyen JT、Baum LG。 半乳糖凝集素-1是胸腺上皮细胞产生的内源性凝集素,可诱导人胸腺细胞凋亡。 《实验医学杂志》1997; 185:1851–1858. doi:10.1084/jem.185.10.1851。 doi:10.1084/jem.185.10.1851 . [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Platt D、Klyosov AA、Zomer E.In:碳水化合物药物设计。 Klyosov AA、Witchzak ZJ、Platt D编辑。 第932卷。 华盛顿(DC):ACS研讨会系列; 2006年,第49–66页。 美国化学学会。 [ 谷歌学者 ]
Rabinovich GA.半乳糖凝集素-1作为潜在的癌症靶点。 英国癌症杂志。 2005; 92:1188–1192. doi:10.1038/sj.bjc.6602493。 doi:10.1038/sj.bjc.6602493 . [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Rajagopal P、Waygood EB、Reizer J、Saier MH、Klevit RE。通过核磁共振化学位移映射证明蛋白质相互作用的特异性。 蛋白质科学。 1997; 6:2624–2627. doi:10.1002/pro.5560061214。 数字对象标识代码:10.1002/pro.5560061214 . [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Shcherbukhin VD公司。 豆科植物种子中的半乳甘露聚糖。 苏联食品亲水胶体。 1992; 6:3–7. doi:10.1016/S0268-005X(09)80054-4 . [ 谷歌学者 ]
Thijssen VL、Postel R、Brandwijk RJ、Dings RP、Nesmelova I、Satijn S、Verhofstad N、Nakabeppu Y、Baum LG、Bakkers J等。半乳糖凝集素-1对肿瘤血管生成至关重要,是抗血管生成治疗的靶点。 美国国家科学院院刊2006; 103:15975–15980. doi:10.1073/pnas.0603883103。 doi:10.1073/pnas.0603883103 . [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
Werz DB、Ranzinger R、Herget S、Adibekian A、von der Lieth C-W、Seeberger PH。通过统计数据库分析探索哺乳动物碳水化合物(“糖空间”)的结构多样性。 化学生物。 2007; 2:685–691. doi:10.1021/cb700178s。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。