摘要
早先在胚胎肾组织中检测到AP-2转录因子的表达。我们在这里展示AP-2β−/−小鼠完成胚胎发育,出生后第1天和第2天死于多囊肾病。肾脏发育分析表明,AP-2β缺陷小鼠正常发生上皮转化、间充质凝集以及进一步的肾小球和肾小管分化。胚胎发育结束时bcl-X公司L(左)、bcl-w、,和bcl-2基因在集合管和远端小管上皮大量凋亡死亡的同时下调。针对分子机制,我们表明,在体外将AP-2转染到细胞系中可强烈抑制细胞凋亡-myc公司-诱导凋亡表明AP-2在胚胎发生过程中对细胞存活进行编程。人类的位置AP-2β该基因位于染色体6p12–p21.1处,位于常染色体隐性遗传性多囊肾病(ARPKD)的定位区域。ARPKD患者的序列分析和使用基因内多态性标记进行的连锁分析表明,AP-2β基因与ARPKD基因非常接近,但又不同。
关键词:AP-2β,基因靶向,细胞凋亡,c-myc公司,ARPKD
AP-2转录因子的三种不同亚型,AP-2α、AP-2β、,和AP-2γ(后者也被称为AP-2.2版)已确认(Williams等人,1988年;Moser等人,1995年;Oulad Abdelghani等人,1996年). 各自的蛋白质由三个不同的基因转录而成,显示出一个独特的模块化结构,由富含脯氨酸和谷氨酰胺的氨基末端转录激活域和一个复杂的螺旋-跨度-螺旋基序组成,对于同聚体化和位点特异性DNA结合来说是必要的和足够的(Williams和Tjian 1991a,b条).
所有这三个基因在早期繁殖前和迁移的神经嵴细胞中强烈共存。不同但部分重叠的表达模式在生后10天(dpc)和整个妊娠后期变得明显。在前神经管中AP-2γ只在前脑表达,AP-2β在中脑,以及两者AP-2α和AP-2β在后脑。AP-2型在中枢和外周神经系统的许多组织以及肢体芽、表皮、面部和泌尿生殖器官组织中都检测到了这种表达(Mitchell等人,1991年;Chazaud等人,1996年;Moser等人,1997年). 特别地,AP-2α在近端肾小管上皮细胞中表达,AP-2β远端肾小管上皮细胞,以及AP-2γ在生殖芽中(Moser等人,1997年). 在肾脏,AP-2α但不是AP-2β出生后表达下调,表明AP-2β可能在肾上皮持续需要。
在这项研究中,我们对小鼠进行了突变AP-2β基因并描述AP-2β−/−小鼠因集合管和远端小管上皮细胞的暴发性凋亡而死亡。当与c共转染时-我的名字,二者都AP-2α和AP-2β能够抑制myc公司-诱导凋亡细胞死亡。这些结果为AP-2型在调节凋亡细胞死亡和建立AP-2β在收集管和管状上皮细胞的存活和维持方面。肾脏AP-2β−/−小鼠在肾髓质和副皮质区发育小囊肿,类似常染色体隐性遗传性多囊肾病(ARPKD)的肾囊肿。虽然AP-2β无效表型显示ARPKD的一些特征,该基因与ARPKD基因座密切相关,我们没有检测到AP-2βARPKD患者的突变。
结果
AP-2β基因的基因组结构
之前,我们描述了分离部分跨越人类的两个重叠λ噬菌体AP-2β基因(Moser等人,1995年). 进一步分离出两个含有5′和3′基因末端的重组噬菌体。获得了覆盖所有七个外显子和六个内含子的连续32.5-kb序列,并提交给EMBL数据库(图。1A;加入编号。Y09912年). 人类的比较AP-2β和人类AP-2α顺序(Bauer等人,1994年)揭示了所有七个外显子的基因结构和大小都是高度保守的,这表明这两个基因是由一个共同祖先基因的复制而来的。
图1。
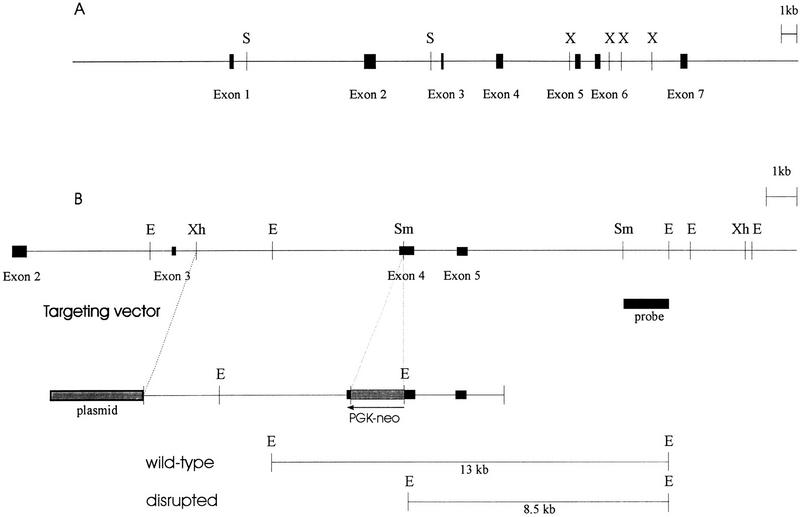
的结构AP-2β基因和靶向载体。(A类)人类的结构AP-2β基因。方框代表外显子。(十)Xba公司我;(S)萨尔一、(B类)小鼠的部分结构AP-2β基因显示在AP-2β目标向量。PGK–新将盒插入外显子4,用于Southern blot分析的探针显示为实心盒。(E)生态RI;(小)Sma公司我;(X小时)Xho公司一、。
AP-2β缺陷小鼠的建立
生成老鼠AP-2β我们进一步筛选了SVJ129文库,并分离出一个跨越小鼠基因外显子3–5的10-kb克隆(图。1B) ●●●●。一种磷酸甘油激酶(PKG)——新将选择盒插入小鼠基因的外显子4AP-2β对DNA结合和二聚化至关重要(Williams和Tjian 1991a). 将靶向载体电穿孔到R1胚胎干细胞(ES)中。通过Southern blot分析评估野生型13-kb的G418-耐药菌落(360个)生态RI和新-中断8.5 kb生态RI碎片。在360个菌落中,6个菌落通过同源重组整合了靶向载体;克隆27和176如图所示2将A注射到C57B6囊胚中以产生种系嵌合体。嵌合体的杂合子代正常且可生育。图中显示了从野生型、杂合型和纯合突变小鼠尾部活检中获得的基因组DNA的代表性Southern blot和PCR分析2B。
图2。
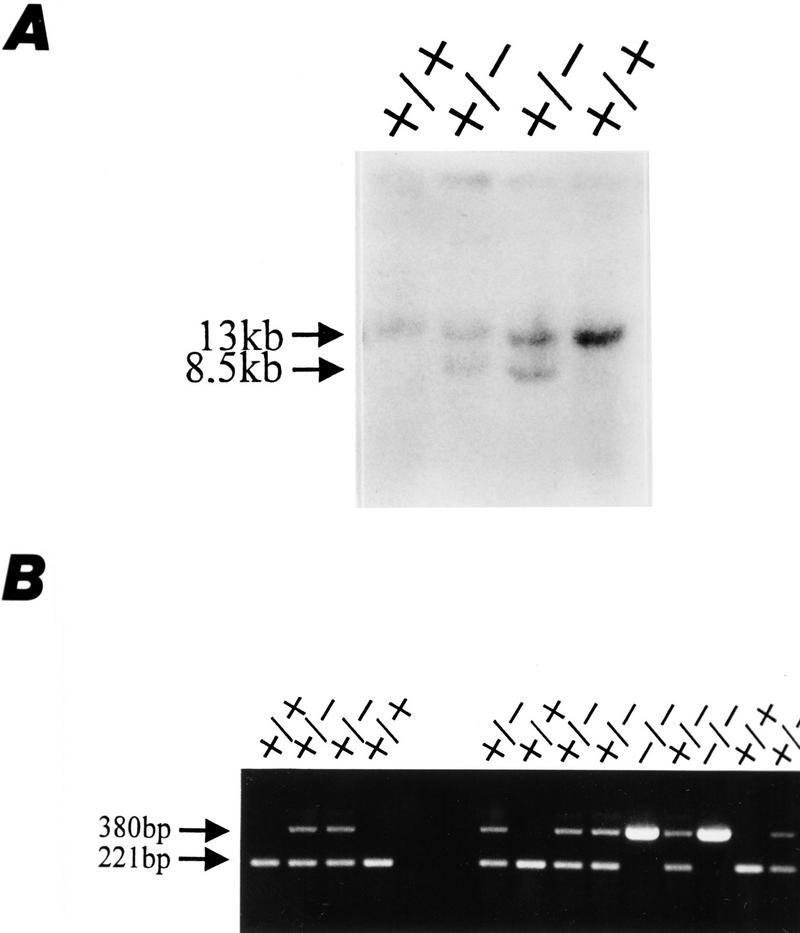
的生成AP-2β突变小鼠。(A类)两个野生型(+/+)和两个突变型(+/-)R1 ES细胞的Southern blot分析。显示了用于胚泡注射的两个不同的突变克隆(27和176)。(B类)对相同的四个ES细胞克隆进行PCR分析(在左边)以及来自交配杂合子后代的尾部活组织检查DNA(在正确的). 使用材料和方法中描述的引物扩增野生型等位基因的221bp片段和突变等位基因的380bp片段。
缺乏AP-2β的小鼠出现多囊肾
交配小鼠杂合性AP-2β突变产生的后代具有预期的孟德尔频率(图。2B) ●●●●。经检查,突变纯合子新生儿没有明显的外部畸形。超过一半的AP-2β然而,新生儿在出生后死亡,并被母亲蚕食(表1). 剩下的AP-2β−/-动物出生后24小时内死亡。
表1。
交配后代的基因型AP-2β+/−E18.5和出生后1 dpn的小鼠
|
小鼠
|
图18.5
|
新生儿
|
| +/+ |
50 (22%) |
100 (31%) |
| +/负极 |
128 (57%) |
194 (60%) |
| −/− |
48 (21%) |
30 ( 9%) |
中的空变异AP-2β该基因由野生型、杂合型和纯合型动物中脑提取物的Northern和Western印迹证实。我们对中脑进行了分析,因为此前已有研究表明AP-2β,但不是AP-2α和AP-2γ信使核糖核酸在该区域表达(Chazaud等人,1996年;Moser等人,1997年). 如图所示三,A和B,两者的水平都降低了AP-2β杂合子中的mRNA和蛋白质在AP-2β−/−小鼠,但未发现信号。因此,AP-2β纯合突变体中没有mRNA和蛋白质。
图3。
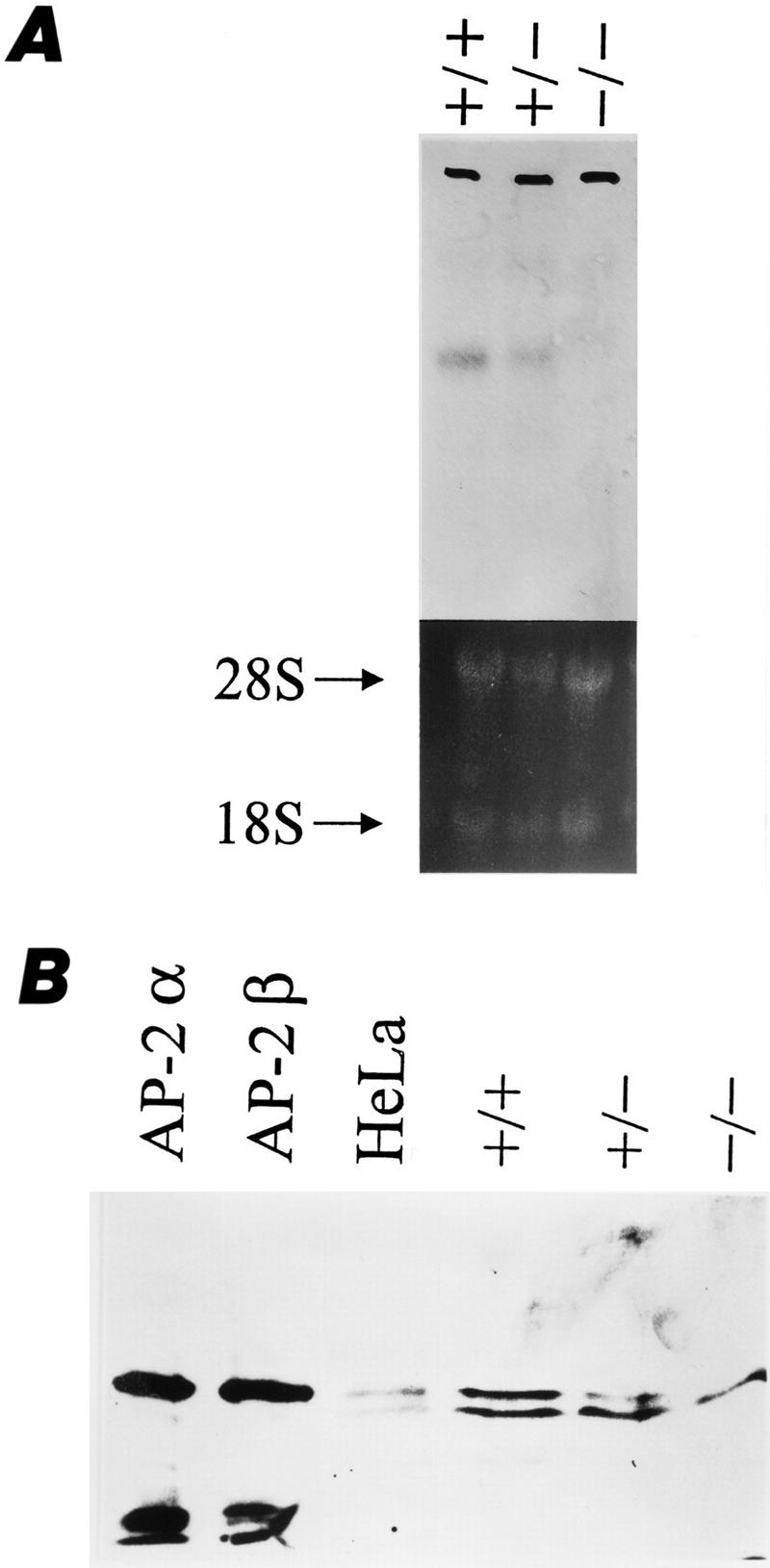
AP-2β在野生型和突变型小鼠中的表达。(A类)中脑裂解物的Northern印迹分析。6-kbAP-2β杂合突变体中mRNA减少,纯合突变体则缺失。(B类)体外翻译的免疫印迹分析AP-2α,AP-2β,HeLa细胞核提取物和带有多克隆AP-2抗血清的+/+、+/-和−/−小鼠。+/-小鼠的上部特异性带减少,而−/-小鼠则没有。低条带是非特异性免疫反应的结果,在AP-2型-HepG2细胞阴性(数据未显示)。
接下来,我们解剖了AP-2β−/−小鼠,并寻找内部畸形。宏观上,所有内脏器官均正常;然而,肾脏似乎稍小。显微镜下,肾集合管系统和远端小管中有许多小囊肿AP-2β-缺陷小鼠(图。4A–C)。这些囊肿的大小为远端小管直径的2至15倍。有趣的是AP-2β肾显示正常的输尿管、肾盂和正常的肾原区。此外AP-2β突变不影响皮质结构,如肾小球和近端小管。对连续组织切片进行的彻底组织学检查没有发现除肾脏以外的任何器官出现异常。
图4。
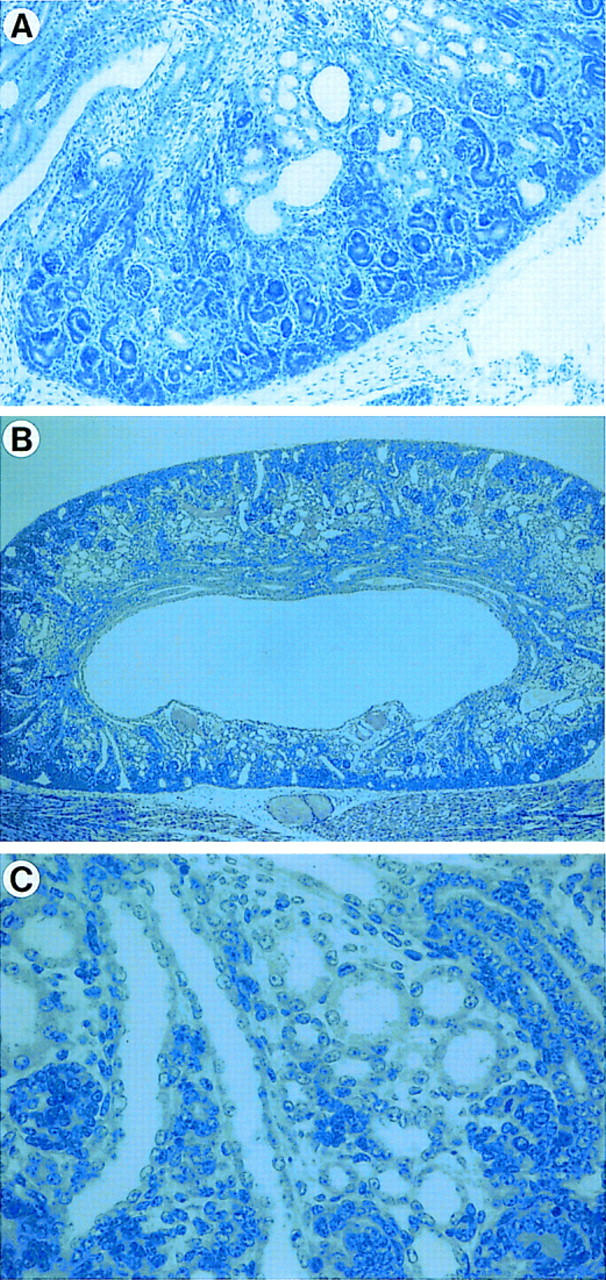
肾组织学检查AP-2β−/−小鼠。(A类)E18.5处的肾脏显示少量囊肿,主要位于远端小管区域(放大,20倍;染色,苏木精和伊红(H&E))。(B、 C类)新生儿肾脏AP-2β−/−小鼠。低倍放大时(B、,20倍;染色,H&E)肾髓质中的细胞大量减少,而肾皮质的外肾原区似乎正常。更高的放大倍数(C,200倍)显示远端小管和集合管区域有许多小囊肿。
为了确定胚胎肾发生期间囊肿的发育时间AP-2β在不同时间点对−/−小鼠进行分析。在15.5 dpc时AP-2β在形态学上,−/−小鼠与野生型同窝鼠的肾脏无法区分。在16.5 dpc时首次检测到大约两到三倍的扩张远端小管和集合管(数据未显示)。少量囊肿,如图所示4A、 在E18.5期动物中存在,但只有出生时动物的肾脏显示出完整的表型,有许多小囊肿(图。4B、 C)。这些发现清楚地表明肾脏畸形AP-2β-在输尿管芽发芽、上皮转化诱导和肾小球分化完成后,null小鼠出现在肾脏发育的晚期。
AP-2β−/−肾细胞凋亡增强
肾囊肿内上皮细胞的详细分析AP-2β−/−小鼠和囊肿之间的小管经常出现核固缩,表明凋亡死亡。因此,我们对片段核DNA进行了TUNEL染色,并在AP-2β−/−和AP-2β+/+胚胎第13.5天(E13.5)和出生后第1天(pnd)之间的小鼠(图。5). 在E13.5和E18.5阶段之间AP-2β与野生型动物相比,−/−肾脏略微增强(不到两倍)。相比之下,肾脏的凋亡死亡率增加了八倍AP-2β出生时的突变小鼠,揭示了胚胎发育结束时发生的大规模细胞死亡(图。6A、 B)。作为内部对照,我们测量了突变和野生型动物脊髓中凋亡细胞死亡的频率(突变小鼠的频率没有改变;图。6A) ●●●●。在野生型动物的肾脏中(图。5A) 在肾原区和髓质乳头中检测到正常的碎裂核DNA模式,与先前正常肾脏发育的特征区域精确重叠(Coles等人,1993年). 与这种野生型模式相比,我们在突变小鼠中观察到凋亡细胞,尤其是在集合管和远端小管中(图。5B、 C)。对碘化丙啶染色切片的进一步显微分析表明,大多数TUNEL标记的细胞核都是碎片(图。5D) ●●●●。我们还通过BrdU掺入测量了细胞分裂率,这在野生型和AP-2β−/−动物(数据未显示)。
图5。
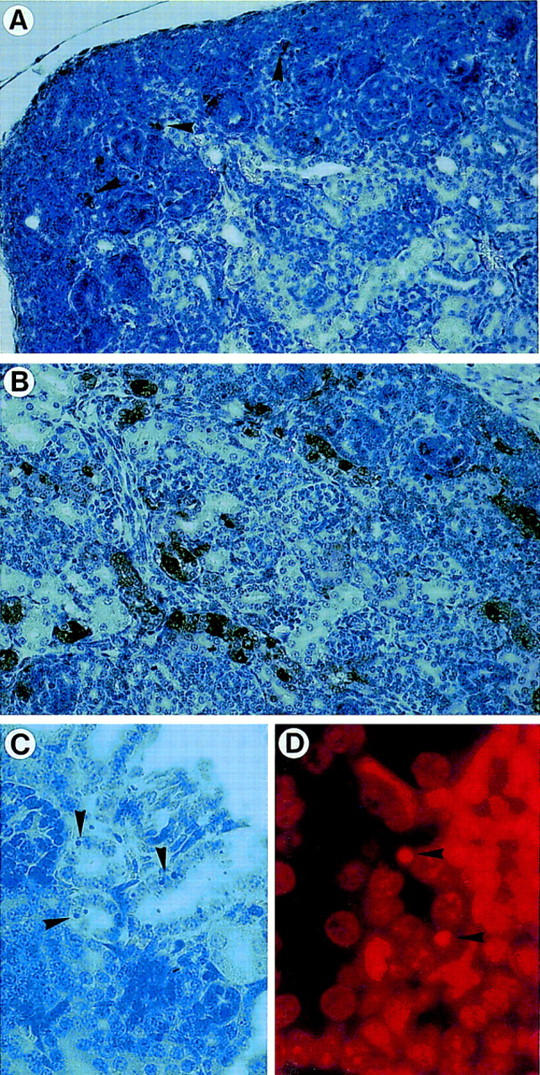
检测野生型(+/+)和AP-2β突变(−/−)小鼠。(A、 B类)野生型肾脏的TUNEL染色(A类)和突变型(B类)小鼠(放大20倍,用hemalaun复染)。箭头输入A类表明肾原区TUNEL阳性细胞很少,而肾小管远端和集合管中有大量细胞染色B。(C、 D类)−/−小鼠上皮细胞的核碎裂[放大200倍;(C)H&E;(D)碘化丙啶染色]。
图6。
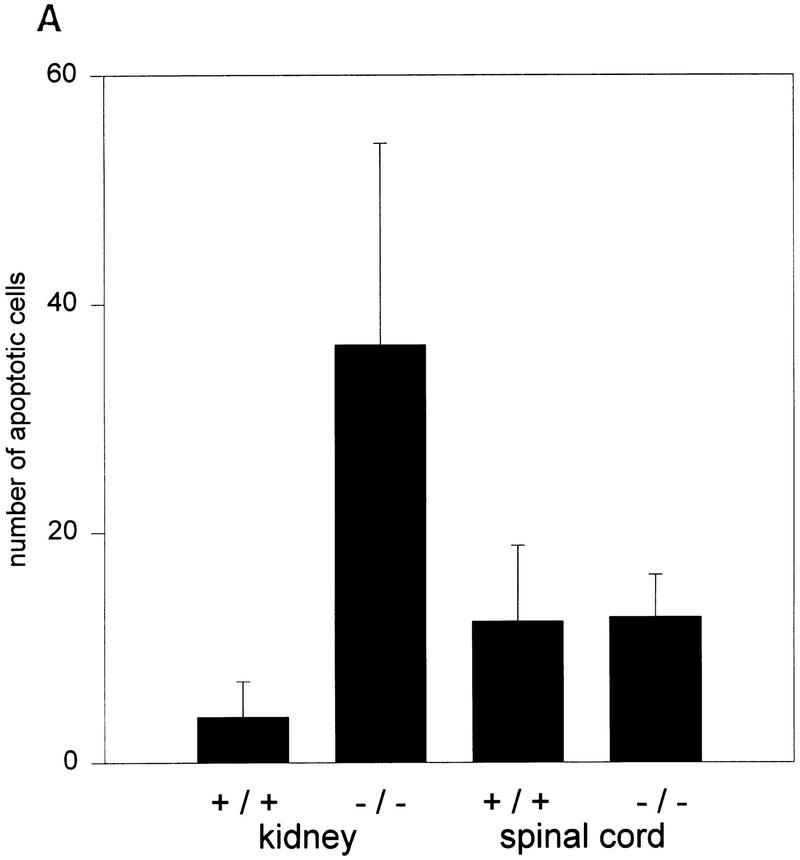
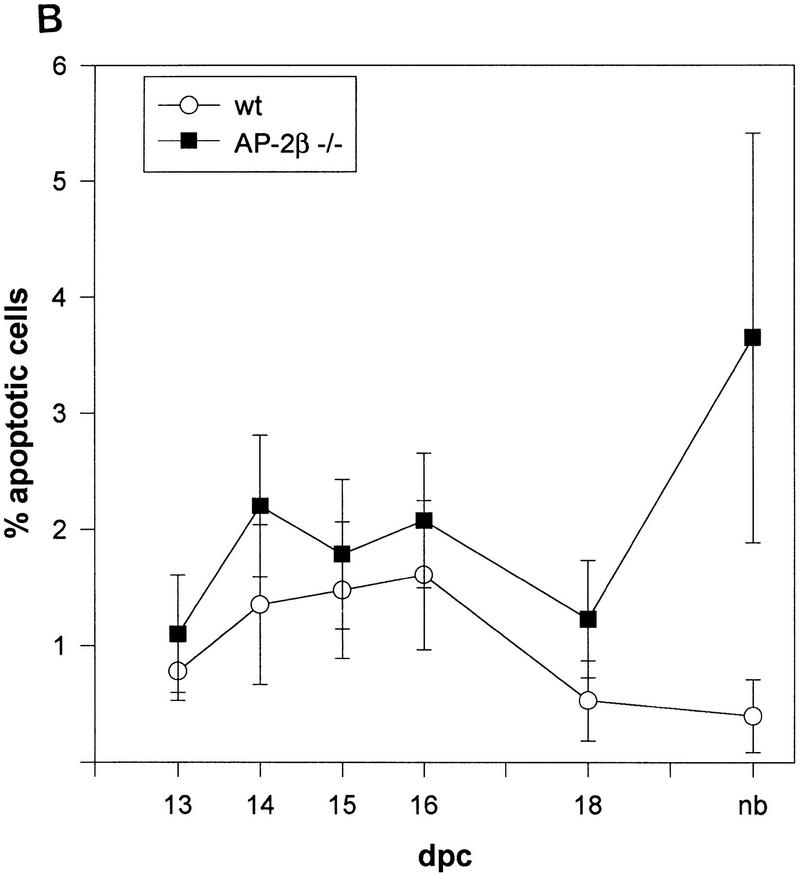
(A类)比较野生型(+/+)和突变型(−/−)小鼠肾上皮细胞和脊髓细胞的凋亡死亡率。(B类)E13.5和出生期间野生型(+/+)和突变型(−/−)小鼠肾脏细胞凋亡的时间过程。图中显示了三个独立肾脏切片中每1000个细胞的TUNEL染色细胞核。
为了确定凋亡细胞死亡率增加本身是否可以解释肾囊肿的形成,我们分析了与肾脏发育特定步骤相关的基因的表达。对孕龄13.5和15.5 dpc的胚胎进行原位杂交WT-1、乘客2、乘客8、wnt-4、AP-2α、,和AP-2β核糖探针(见图。7A) ●●●●。工作任务-1在诱导的间充质上检测到信号,wnt-4型浓缩肾间质并形成逗号和S形小体,以及乘客2和乘客8人发展管状结构。比较野生型和突变型小鼠的杂交信号,发现基因表达模式相同。据最近报道,AP-2α15.5dpc时,信号局限于皮质区发育中的近端小管区域(Moser等人,1997年).AP-2β野生型动物在发育中的远端小管中检测到信号,但在AP-2β-突变体。这些结果表明,间充质的聚集和增殖以及上皮细胞向间充质转化的诱导在AP-2β-缺陷小鼠。
图7。
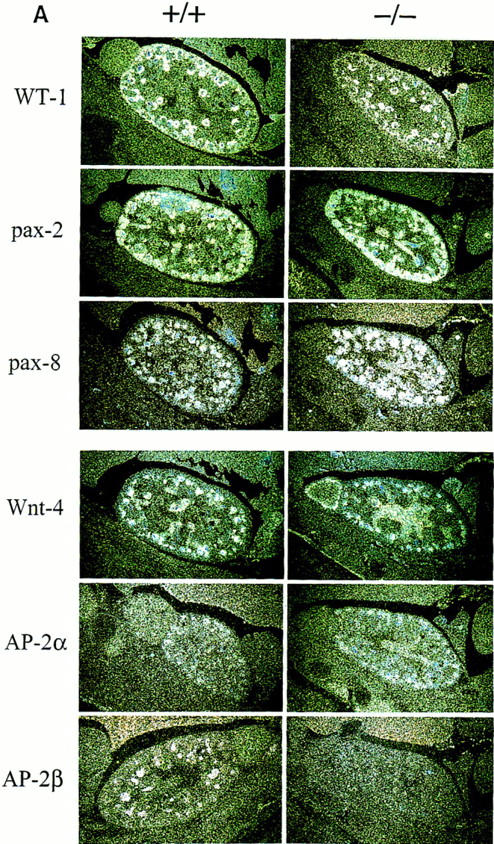
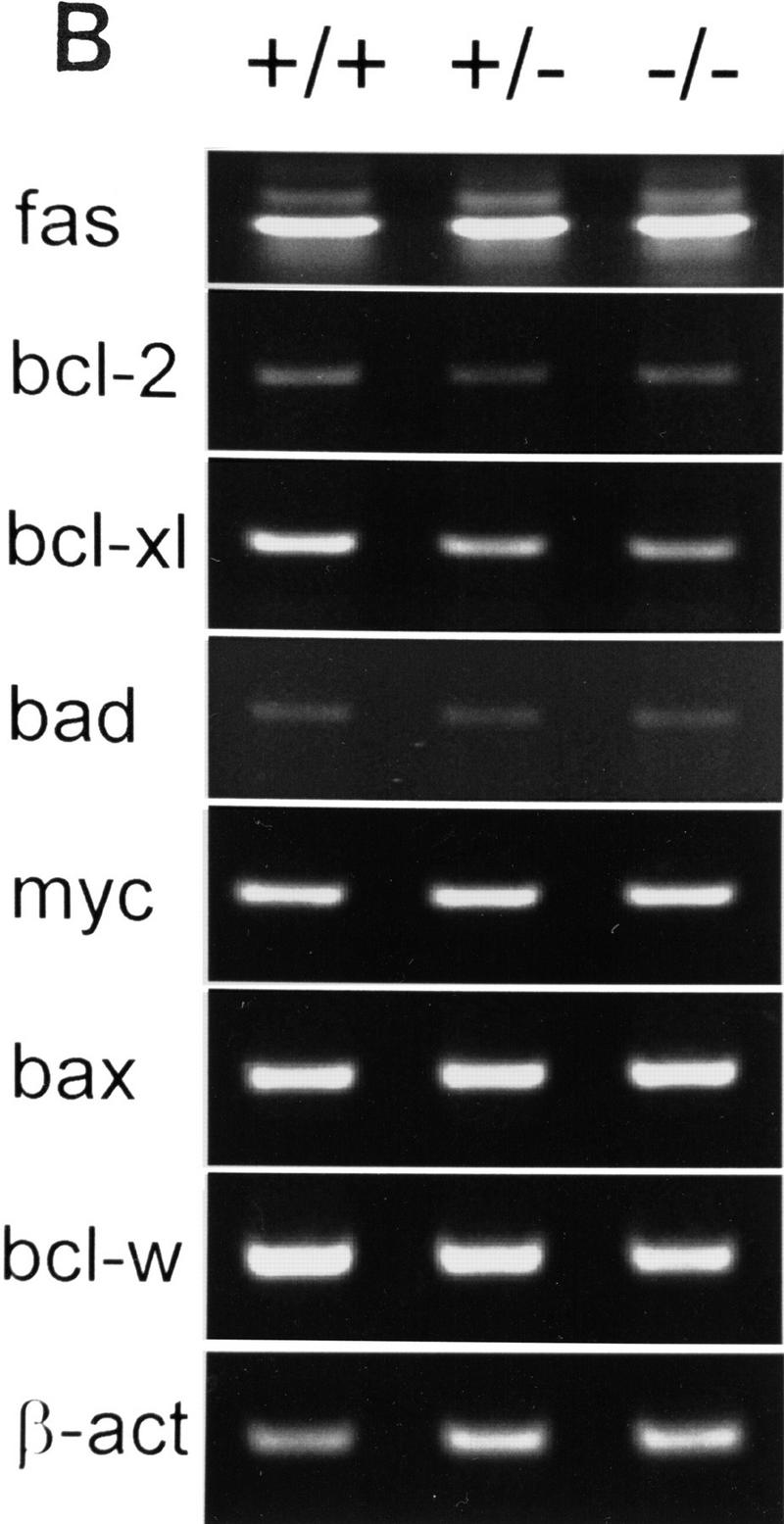
(A类)的表达式WT-1,乘客,wnt-4,和AP-2型野生型(+/+)和AP-2β-缺陷小鼠(−/−)。(左侧)野生型E15.5胚胎肾切片的原位杂交;(正确的)在−/−胚胎肾切片中进行杂交。所有反应的特异性通过在相同条件下用感测探针进行杂交来控制(数据未显示)。(B类)RT-PCR扩增促凋亡和抗凋亡基因。通过30个PCR循环(β-actin的20个循环除外)扩增从显微解剖肾脏中获得的2微克RNA,并在2%琼脂糖凝胶上分离。
接下来,我们确定了促凋亡和抗凋亡基因在小鼠肾脏中的表达模式AP-2β突变小鼠与野生型和杂合型动物的比较。我们选择在E18.5分析肾脏中的RNA,因为根据我们的TUNEL染色(图。6B) ●●●●。使用分别从两种野生型、杂合型和突变型动物的显微解剖肾脏中获得的模板RNA,进行30个周期的RT-PCR。结果如图所示7B显示促凋亡基因的表达,fas、bad、bax、,和我的名字,在这些动物的肾脏中是相同的,但抗凋亡基因显著减少bcl-X公司L(左)、bcl-w、,和bcl-2基因观察到。在32个循环时bcl-2基因在肾脏中的表达AP-2β与野生型小鼠相比,−/−小鼠的检测结果更加清晰(数据未显示)。
总之,我们的分析定义了AP-2β用于维持远端小管和集合管的肾上皮。在胚胎发育末期,抗凋亡基因的表达减少bcl-X公司L(左)、bcl-w、,和bcl-2基因在诱导大量凋亡细胞死亡之前。同时,肾髓质出现严重的囊性变。
AP-2对myc诱导的细胞凋亡的负调控
为了探讨AP-2转录因子是否可以直接调节细胞凋亡,我们测试了AP-2对细胞凋亡的影响-myc公司-体外共转染细胞后诱导细胞死亡程序。我们选择分析胚胎细胞系PA-1克隆1,因为这些细胞表达极低水平的AP-2(Kannan等人,1994年)和港湾野生型内源性myc公司没有任何突变或扩增的基因。使用巨细胞病毒(CMV)–拉奇对照质粒我们进一步确定,脂质体瞬时转染24小时后,>50%的PA-1克隆1细胞表达高水平的对照基因(数据未显示)。转染人c后8小时-myc,AP-2α或AP-2β在低生长因子供应条件下【1%胎牛血清】培养细胞24小时,诱导表达质粒凋亡。然后使用商用ELISA测定核小体释放到组织培养上清液中的情况。结果如图所示8证明c的表达式-myc公司在克隆1细胞中,核小体释放的急剧增加超过了ELISA测定的线性范围。核小体释放被等量的AP-2α或AP-2β表达质粒。始终,亚系克隆1-911A含有稳定转染的SV40-AP-2α表达质粒对瞬时转染c的影响完全抵抗-myc公司关于核碎裂和核小体释放。使用小鼠NIH–3T3成纤维细胞获得了相同的数据(数据未显示)。
图8。
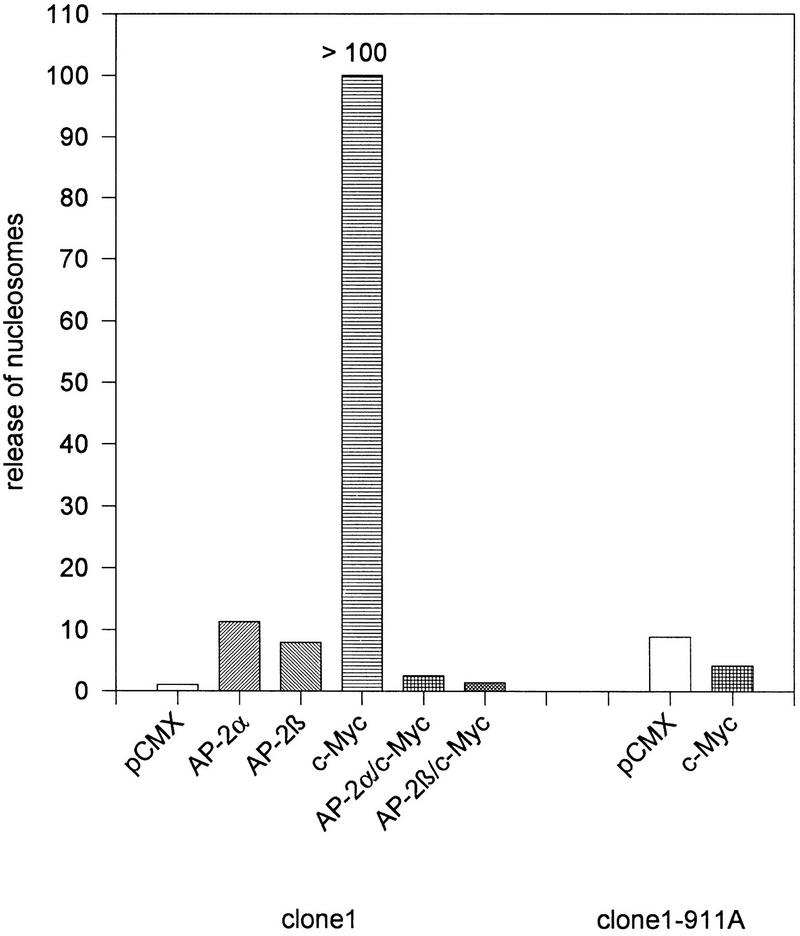
c的负调节-myc公司-诱导细胞死亡AP-2。用1μg空pCMX载体或含有人AP-2α、AP-2β、,或c-myc公司表达盒。在1%FCS中生长36小时后,碎片DNA(核小体)释放到组织培养上清液中,如图所示年-轴。数字是从两个独立的实验中得出的,每个实验有四个平行组。野生型PA-1克隆1细胞的转染如图所示左;转染到稳定含有稳定转染的AP-2α表达质粒(克隆1–911A)正确的。
总之,这些结果表明AP-2转录因子在负调控中具有一种新的分子功能myc公司-诱导细胞死亡。
ARPKD患者AP-2β基因分析
肾脏集合管型囊肿和远端肾小管扩大的形态学特征与人类ARPKD相似。此外,AP-2βmRNA在胚胎发育过程中在被认为是这些患者囊肿形成来源的结构中表达。因此,我们解决了以下问题:AP-2β是ARPKD的候选基因。通过在中期染色体上进行荧光原位杂交(FISH),人类基因的基因组位置确定在染色体6p12–p21.1上(数据未显示),这与之前的研究结果一致(Williamson等人,1996年). 有趣的是,ARPKD突变以前被映射到同一区域(Zerres等人,1994年).
接下来,我们对20名无关的ARPKD患者和10名对照进行了序列分析。全部七个AP-2β外显子通过PCR扩增,使用侧翼内含子区域内的引物(表中列出2). 外显子2太大,无法通过单一反应进行可靠的扩增和测序,因此,在本例中进行了两次重叠PCR反应。测定了涵盖七个外显子的全部八个PCR反应的整个序列,包括剪接位点,但在编码区没有发现突变。在分析的三分之一样本中,我们观察到外显子1上游有一个1-bp多态性68个碱基(7591 G→a)。此外,约50%的样本显示,在核酸残基12593和12612之间,靠近外显子2的3′剪接位点的变异,包括CAAA的四核苷酸重复四或五次。通过PCR/SSCP进一步分析了分别由40名患者和对照组组成的扩大组中的这些多态性,并在ARPKD患者和对照中以相同的频率检测到这些多态性(数据未显示)。
表2。
外显子
|
|---|
没有。
|
大小(bp)
|
引物序列5′→3′
|
底漆的位置
|
| 1 |
48 |
向上的 |
G公司 |
A类 |
G公司 |
A类 |
C类 |
A类 |
A类 |
C类 |
A类 |
G公司 |
A类 |
T型 |
A类 |
T型 |
A类 |
A类 |
G公司 |
T型 |
T型 |
G公司 |
C类 |
G公司 |
|
|
|
7497–7518 |
|
|
向下 |
C类 |
A类 |
T型 |
T型 |
T型 |
G公司 |
G公司 |
G公司 |
G公司 |
T型 |
A类 |
T型 |
C类 |
A类 |
A类 |
G公司 |
A类 |
A类 |
G公司 |
C类 |
T型 |
C类 |
|
|
|
7783–7762 |
| 2 |
453 |
向上的 |
G公司 |
C类 |
C类 |
G公司 |
G公司 |
G公司 |
C类 |
T型 |
T型 |
C类 |
T型 |
C类 |
C类 |
A类 |
T型 |
T型 |
T型 |
G公司 |
T型 |
C类 |
A类 |
C类 |
|
|
|
12000–12021 |
|
|
向下 |
C类 |
C类 |
G公司 |
T型 |
T型 |
G公司 |
C类 |
C类 |
C类 |
C类 |
C类 |
A类 |
G公司 |
G公司 |
G公司 |
A类 |
T型 |
G公司 |
T型 |
T型 |
G公司 |
C类 |
|
|
|
12373–12352 |
|
|
向上的 |
C类 |
C类 |
T型 |
A类 |
C类 |
C类 |
A类 |
C类 |
C类 |
A类 |
G公司 |
A类 |
G公司 |
C类 |
C类 |
A类 |
G公司 |
G公司 |
A类 |
C类 |
C类 |
C类 |
|
|
|
12279–12300 |
|
|
向下 |
C类 |
C类 |
C类 |
C类 |
C类 |
C类 |
C类 |
T型 |
C类 |
C类 |
A类 |
G公司 |
A类 |
A类 |
G公司 |
C类 |
A类 |
T型 |
T型 |
C类 |
C类 |
T型 |
|
|
|
12649–12628 |
| 三 |
63 |
向上的 |
G公司 |
A类 |
G公司 |
T型 |
A类 |
A类 |
A类 |
T型 |
T型 |
T型 |
C类 |
A类 |
T型 |
T型 |
C类 |
T型 |
C类 |
T型 |
A类 |
T型 |
G公司 |
T型 |
C类 |
|
|
17178–17200 |
|
|
向下 |
C类 |
A类 |
A类 |
A类 |
T型 |
A类 |
A类 |
T型 |
G公司 |
A类 |
A类 |
T型 |
T型 |
C类 |
C类 |
C类 |
C类 |
C类 |
A类 |
A类 |
A类 |
G公司 |
T型 |
G公司 |
|
17487–17464 |
| 4 |
222 |
向上的 |
C类 |
A类 |
T型 |
T型 |
C类 |
T型 |
A类 |
T型 |
C类 |
A类 |
G公司 |
C类 |
C类 |
G公司 |
G公司 |
T型 |
C类 |
A类 |
T型 |
C类 |
A类 |
G公司 |
|
|
|
24449–24471 |
|
|
向下 |
T型 |
G公司 |
G公司 |
A类 |
A类 |
C类 |
C类 |
T型 |
T型 |
C类 |
T型 |
C类 |
C类 |
T型 |
C类 |
A类 |
C类 |
T型 |
G公司 |
T型 |
C类 |
C类 |
|
|
|
24834–24813 |
| 5 |
117 |
向上的 |
G公司 |
C类 |
T型 |
A类 |
A类 |
G公司 |
T型 |
C类 |
T型 |
A类 |
A类 |
A类 |
C类 |
T型 |
T型 |
T型 |
G公司 |
T型 |
T型 |
T型 |
C类 |
A类 |
G公司 |
G公司 |
A类 |
26627–26650 |
|
|
向下 |
C类 |
A类 |
T型 |
G公司 |
A类 |
A类 |
A类 |
T型 |
G公司 |
T型 |
G公司 |
T型 |
T型 |
A类 |
A类 |
A类 |
A类 |
T型 |
G公司 |
T型 |
C类 |
A类 |
G公司 |
C类 |
C类 |
26895–26871 |
| 6 |
144 |
向上的 |
A类 |
A类 |
A类 |
G公司 |
C类 |
T型 |
G公司 |
A类 |
C类 |
A类 |
A类 |
G公司 |
G公司 |
G公司 |
A类 |
A类 |
T型 |
G公司 |
T型 |
C类 |
T型 |
C类 |
C类 |
|
|
28798–28821 |
|
|
向下 |
T型 |
T型 |
A类 |
G公司 |
G公司 |
T型 |
C类 |
T型 |
A类 |
G公司 |
A类 |
C类 |
A类 |
A类 |
C类 |
C类 |
C类 |
T型 |
C类 |
T型 |
G公司 |
G公司 |
C类 |
|
|
29136–29114 |
| 7 |
300 |
向上的 |
G公司 |
A类 |
G公司 |
C类 |
G公司 |
T型 |
C类 |
T型 |
C类 |
C类 |
T型 |
T型 |
T型 |
C类 |
T型 |
A类 |
A类 |
T型 |
G公司 |
C类 |
C类 |
|
|
|
|
31745–31765 |
|
|
向下 |
T型 |
T型 |
A类 |
C类 |
T型 |
A类 |
C类 |
C类 |
T型 |
G公司 |
G公司 |
G公司 |
C类 |
C类 |
T型 |
T型 |
C类 |
C类 |
C类 |
C类 |
A类 |
|
|
|
|
32084–32065 |
要排除AP-2β作为ARPKD候选基因,我们确定了适合ARPKD家族连锁分析的基因内多态性。共鉴定出两个多态性位点,一个位于内含子3内的核酸残基22252和22281之间的双列位点(AAAAA C)n个 = 5–6其中一个内含子2在核酸残基15285和15320之间有五个等位基因(GC)n个 = 20/(燃气轮机)n个 = 8.
在之前研究过的总共102个ARPKD家族中(Zerres等人,1996年),利用这两个标记进行连锁分析。在这个初步的家族集合中,包括在ARPKD区域发生重组事件的八个关键家族AP-2βARPKD基因已被鉴定(数据未显示)。然而,在对六个美国关键重组家族的扩大搜索中AP-2β观察到ARPKD基因,将该基因定位在ARPKD的远端(图。9). 综上所述,这些数据表明AP-2β该基因与ARPKD基因座紧密相连,但在ARPKD患者中没有突变。
图9。
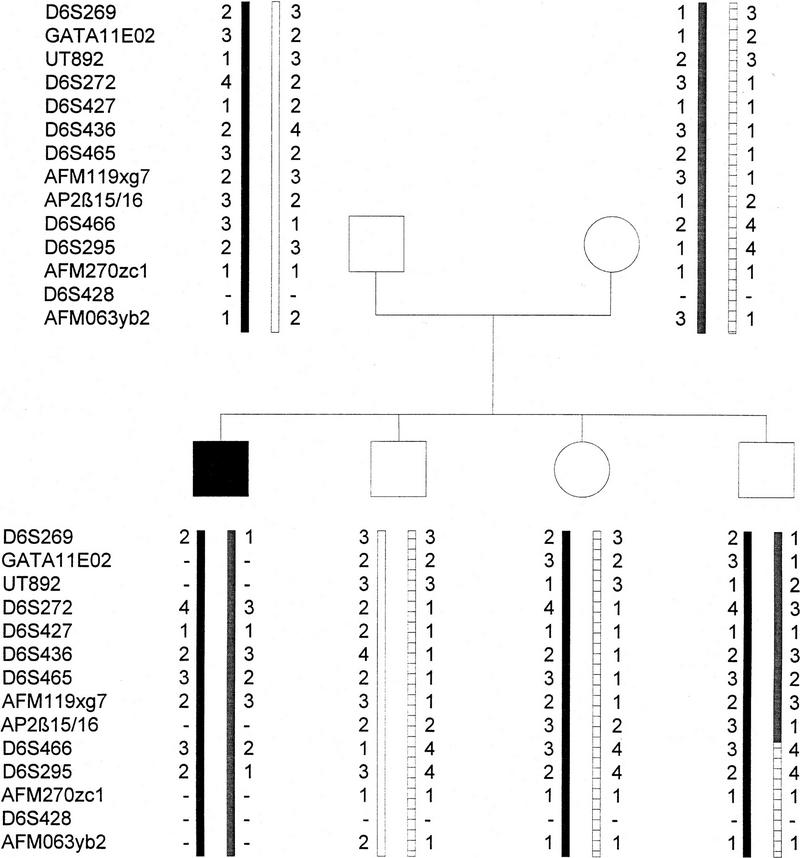
单倍型分析揭示了AP-2βARPKD基因位点。多态位点的相对位置根据ARPKD联盟确定的物理图谱进行指示(Lens等人,1997年).
讨论
在这项研究中,我们产生了AP-2β-通过引入新插入第四个外显子。中断AP-2β揭示了其在正常肾脏发育中的重要作用,特别是在维持分化的肾上皮中。尽管广泛的胚胎表达AP-2β在许多胚胎组织中,包括繁殖前和迁移的神经嵴细胞、神经管衍生物、表面外胚层和肾脏(Moser等人,1995年,1997),AP-2β−/−小鼠完成胚胎发育,除肾脏畸形外无其他异常。
AP-2α最近对null小鼠进行了分析,发现前神经管和面部神经外胚层的颅骨闭合存在严重缺陷(Schorle等人,1996年;Zhang等人,1996年). 将我们的结果与AP-2α-缺陷小鼠得出结论,尽管这两个基因高度同源,并且在胚胎发育过程中表达,具有部分重叠的时空模式,但这两种基因在胚胎发育期间的功能差异很大。有趣的是,AP-2α-null小鼠显示包括颅神经节在内的神经结构中有明显的细胞丢失,这增加了在分子水平上这两个基因可能是抑制凋亡细胞死亡的关键因素的可能性。
AP-2β−/−小鼠的细胞凋亡与多囊肾病
我们的研究定义了AP-2β在调节肾细胞凋亡中,细胞死亡进一步证实了凋亡在肾囊肿发育中的作用。原位杂交结果重量-1,乘客2,乘客8,和wnt-4型mRNA表明AP-2β小鼠完成肾脏发育的完整胚胎程序,包括输尿管芽萌发、诱导间充质-上皮细胞转化、肾小球和肾小管细胞分化。然而,胚胎发育结束时,骨髓区域的上皮细胞AP-2β-缺陷小鼠在下调抗凋亡基因之前发生凋亡bcl公司基因家族。这些结果表明AP-2β在胚胎发育完成后下调细胞凋亡。远端小管、Henle氏环和集合管系统中的上皮细胞对于水分保持和电解质稳态的调节是必不可少的;因此,AP-2β−/−小鼠出生后不久死亡。
我们的瞬时转染研究结果进一步明确了AP-2在控制myc公司-诱导程序性细胞死亡。这些数据强烈表明AP-2β-缺乏控制的小鼠myc公司在分子水平上起作用。虽然在E13.5和E18.5之间,肾上皮细胞凋亡死亡率仅略有增加,但在生长因子供应有限的情况下,在出生前后发生大量死亡(Coles等人,1993年). 我们一致检测到抗凋亡基因的表达减少bcl2、bcl-w,和bcl-X公司L(左),已知其在肾上皮中表达并控制细胞存活(Veis等人,1993年;Gonzalez-Garcia等人,1994年;Sorenson等人,1995年). 此外,已经证明bcl-2基因可以覆盖myc公司-诱导细胞死亡(Bissonnette等人,1992年).
在发育中的大鼠肾脏中已经有大量的程序性细胞死亡的记录,并且证明在肾原区和髓质乳头都会发生(Coles等人,1993年). 根据这些研究,估计50%或更多的肾细胞在正常发育过程中死亡。细胞凋亡区域AP-2β突变小鼠与AP-2β远端小管上皮和集合管上皮的mRNA表达。因此,AP-2β似乎对肾髓质上皮细胞的存活至关重要。事实上AP-2βmRNA在成年小鼠肾脏中也高水平表达,进一步表明AP-2β因为肾上皮细胞的存活在整个成年期是不可或缺的。是否需要调查AP-2β在涉及肾上皮损伤和再生的病理条件中起作用。有趣的是,我们观察到AP-2型mRNAs出现在肾细胞癌的一个亚群中(M.Moser,未解释)。因为显著提高了AP-2型在乳腺癌细胞和正常乳腺上皮中也有表达(Bosher等人,1995年),很容易推测AP-2型基因可能保护增殖细胞免受myc公司-在限制生长因子供应的条件下诱导细胞凋亡。
我们的研究确定,调节细胞死亡的缺陷是肾囊肿形成的重要疾病机制。持续的转基因和敲除研究-myc公司和bcl-2基因也发现了相应小鼠的囊肿形成(特鲁德尔等人,1991年;Veis等人,1993年). 因此,囊肿形成可能是肾上皮细胞死亡的不同调节基因改变导致的下游病理生理事件。更有趣的是,最近有研究表明,c-myc公司目标基因受阴性控制AP-2型(Gaubatz等人,1995年). AP-2α和AP-2β蛋白与myc公司/最大值异二聚体,防止DNA与典型E-box元件结合。c的病理学部分重叠-myc公司-过度表达转基因和AP-2β肾囊肿形成相关基因敲除增加了通过以下途径抑制凋亡细胞死亡的可能性AP-2型涉及c的下游转录靶点-myc公司原癌基因。
AP-2β和ARPKD
最近,在揭示人类ARPKD的遗传基础方面取得了重大进展。不同家族的临床和遗传分析证明,这种疾病的严重和轻微形式是由同一基因座的不同突变引起的,而不是由不同基因的突变引起的。此外,重组家族多态性标记的连锁分析已将ARPKD基因定位在染色体6p21–cen(着丝粒)的一个区域内(Zerres等人,1994年). 严重的情况下,患者通常在出生后死亡,表现为双侧肾脏增大,伴有广泛扩张和集合管囊肿(Zerres等人,1996年). 这种疾病总是与先天性肝纤维化有关,而肝纤维化是由胆管畸形引起的;然而,肝脏病理的程度可能有很大差异。组织病理学发现AP-2β−/−小鼠与ARPKD的特征表现出惊人的相似性,但它们显然不相同。最重要的是,我们在胚胎或出生后的肝脏中都没有发现胆道形成的任何失败AP-2β-缺陷小鼠。在分子水平上,我们没有检测到任何AP-2β20名不同ARPKD患者的突变。然而,连锁分析表明,该基因与ARPKD基因非常接近,使得所识别的多态性标记有助于诊断目的。正在进行的研究将解决以下问题:AP-2β该表达被修改为ARPKD突变的下游靶点。
材料和方法
小鼠和人AP-2β基因的分离及FISH
商用人类和小鼠SVJ 129基因组文库的斑块(德国海德堡Stratagene Lambda FIXII)(5×105)被筛选为AP-2β使用标准程序的cDNA探针(Sambrook等人,1989年). 使用自动DNA测序仪(Applied Biosystems,Boulder,CO)进行循环测序。对于人类中期染色体中的FISH萨尔人5′区覆盖10kb和8kb的I片段AP-2β通过缺口翻译用bio-dUTP标记该基因,并如前所述进行杂交(Lichter等人,1990年).
AP-2β靶向载体的构建及基因敲除小鼠的产生
使用一个包含10 kb小鼠SVJ129基因组DNA的克隆,跨越外显子3、4和5,插入PGK–新将磁带插入Sma公司外显子4的I位点。将线性化质粒DNA(75μg)电穿孔成5×107R1 ES细胞悬浮在磷酸盐缓冲盐水中。最近描述了ES细胞的转染和培养条件(Pfeifer等人,1996年). 简单地说,ES细胞在存在白血病抑制因子(GIBCO BRL,Gaithersburg,MD)的辐照小鼠胚胎成纤维细胞上培养,并用400μg/ml G418(GIBCO-BRL)进行筛选;然后360新-从基因组中挑选、扩增和分析抗性克隆生态RI通过Southern blot消化DNA。包含1-kb基因组的外部探针生态RI–Sma公司I片段AP-2β基因(见图。1B) 用于鉴定13-kb野生型等位基因和8.5-kb突变等位基因。
两个不同的ES细胞克隆AP-2β在注射前3天解冻等位基因,将10个细胞分别微量注射到2.5 dpc收获的C57B6囊胚中。同一天,将微量注射的囊胚重新植入3.5天的假孕雌性体内。雄性嵌合体与C57B6雌性嵌合体交配。
原位杂交、Western blot、核固缩的碘化丙啶染色、TUNEL分析和细胞死亡检测
在适当的时间,用4%新鲜多聚甲醛/0.5%戊二醛0.15灌注怀孕小鼠米pH 7.4的二甲氨基甲酸缓冲液。将胚胎解剖并固定2小时35石蜡包埋组织切片中的S标记cRNA探针已在前面详细描述(Moser等人,1995年). 在每张载玻片上安装两个平行的组织切片,反义和正义(作为对照)RNA探针在相同条件下与这些切片反应。
为了进行Western分析,对18.5 dpc的胚胎中脑进行显微解剖,并用2×Laemmli缓冲液提取。加载赖氨酸盐(150 mg/泳道),在12.5%SDS-聚丙烯酰胺凝胶上分离,并转移到硝化纤维素上。将印迹与1:8000稀释的市售兔多克隆AP-2抗血清(Santa Cruz Biotech,Santa Cruz,CA)反应,并使用化学发光反应试剂盒(ECL,Amersham,Braunschweig,Germany)开发。
用碘化丙啶观察核固缩(Coles等人,1993年). 新生小鼠在10%磷酸盐缓冲福尔马林中固定24小时,并包埋在石蜡中。将脱水的组织载玻片再水化,在37°C下用4μg/ml碘化丙啶和100μg/ml RNase A在PBS中染色30分钟;然后冲洗载玻片并在荧光显微镜上分析。
用末端脱氧核苷酸转移酶(Tdt)标记片段核DNA基本上如所述(Gavrieli等人,1992年). 简单地说,将10%福尔马林固定组织和石蜡包埋组织的复水切片与10–40μg/ml蛋白酶K在37°C下孵育30分钟,然后用4%多聚甲醛固定5分钟。用0.1%Triton X-100在0.1℃下渗透膜米柠檬酸钠,并按照制造商的说明与TUNEL试剂(德国曼海姆Boehringer)孵育。
为了检测瞬时转染PA-1细胞中的细胞死亡,4组平行的8×104细胞被镀成12孔板,并保存在Dulbecco改良的Eagle's培养基(DMEM)中,补充10%的FCS(GIBCO BRL,Eggenstein,德国)。16小时后,1μg CMV–AP-2α,CMV–AP-2β,或CMV–c-myc公司质粒用脂质体转染(GIBCO BRL)。转染8小时后,将培养基改为DMEM/1%FCS,36小时后收集组织培养上清液。使用基于抗组蛋白的商用细胞死亡检测ELISA定量核小体的释放Plus(加)(德国曼海姆Boehringer)严格遵守制造商的说明。
RT–PCR扩增
总RNA是在E18.5从小鼠肾脏的显微解剖中制备的。如前所述,使用2μg总RNA进行反转录(Moser等人,1995年). 将10%的反应物(3μl)添加到10 m的1μl中米dNTP,5μl 10×PCR缓冲液,2μl正反义引物(25 pmoles/μl),0.5μl塔克聚合酶(德国曼海姆Boehringer)和36.5μl H2O.分别在以下条件下进行30个和32个PCR循环:94°C下1 min,62°C下1min,72°C下1.5 min。β-肌动蛋白扩增仅进行了20个周期。小鼠PCR引物显示为5′至3′:fas公司意义,ATGCTGTGGATCTCT;fas公司反义GCATATGGTTCTTGTCCATG;bcl-2基因感官,CTTGACAGAGATCATGCCGTCC;bcl-2基因反义,GTATGTACTTCATCACGATCTCC;c(c)-myc公司意义,CTCCTCGAGCTGTTTGAAGGC;c(c)-myc公司反义TGAAGGTCGTCGTCAGGATC;坏的感官,CTGGAGGACTTATCAGCCGAAG;坏的反义ATGTGGAGAGAGATCACTGG;bcl-x公司感觉,GAGTTTGAACTGGTACCGG;bcl-x公司反义,TTCCGACTGAAGAGTGAGCCC;bcl-w公司意义,ATGGCGACCACGCTCAACC;bcl-w公司反义,GTATAGAGCTGTGAACTCCGC;bax基因感觉,GAGACACCTGGCTGACCTTGG;bax基因反义,TCAGCCACTCTTCTTCCAGATGG;β-肌动蛋白感觉,TGGAATCCTGTGGCATCCATGAAAC;β-肌动蛋白反义。
ARPKD家族的序列和单倍型分析
用于序列分析AP-2β外显子使用表中列出的引物对从外周血DNA进行PCR扩增2PCR条件为35个周期,在95℃下40秒,在65℃下60秒,在72℃下60秒钟。PCR反应产物进行凝胶分析,然后用聚乙二醇8000沉淀纯化,并用5n测序米每个PCR引物的循环测序塔克聚合酶协议(Perkin Elmer,Norwalk,CT)。所有PCR产物完全在两条链上测序。我们分析了20名患者的不同临床表现,从围产期致死到轻度成年期(Zerres等人,1996年).
为了扩增分别位于内含子3(22252-22281)和内含子2(15285-15320)的基因内多态性重复序列,设计了以下两个引物对,并在与上述相同的PCR条件下使用:5′-CAAGCATCTCTGACATTGTCC-3′(匹配碱基22208-22232)和5′-TATACACTGCATACCCC-3′; 5′-AGCAAATCGCTGTTTGGTTCTGGG-3′(15232–15256)和5′-CAAACTAAAACAATCCCAACTAGGTG-3′。核酸残基与完整的人类基因组有关AP-2β提交给EMBL数据库的序列(登录号:。Y09912年).
对110个表现为严重ARPKD的家庭进行单体型分析(Zerres等人,1996年).
致谢
这项工作得到了德国基金会(Deutsche Forschungsgemeinschaft)对K.Z.、R.B.和R.F.的资助。;从威廉·桑德基金会到R.B。;从赫尔曼和莉莉·席林基金会到R.F.我们感谢Peter Gruss、Andrew McMahon和Helen Hurst博士乘客2,乘客8,乘客4,和AP-2γ质粒;Rudi Balling进行了有益的讨论,整个雷根斯堡医学院的摄影实验室都在进行摄影艺术品。
这篇文章的出版费用部分是通过支付版面费来支付的。因此,根据《美国法典》第18卷第1734节,本篇文章必须标记为“广告”,以表明这一事实。
脚注
电子邮件reinhart.buettner@klinik.uni-regensburg.de; 传真:(49)941-944-6602。
工具书类
-
Bauer R、Pscherer A、Imhof A、Moser M、Kopp H、Seegers S、Kerscher M、Tainsky MA、Hofstaedter F、Buettner R。人类AP-2基因的基因组结构。核酸研究,1994年;22:1413–1420. doi:10.1093/nar/22.8.1413。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Bissonnette RP、Echeverri F、Mahboubi A、Green DR。bcl-2抑制c-myc诱导的凋亡细胞死亡。自然。1992;359:552–554. doi:10.1038/359552a0。[内政部] [公共医学] [谷歌学者]
-
Bosher JM、Williams T、Hurst HC。发育调节转录因子AP-2参与人乳腺癌中c-erbB-2的过度表达。国家科学院院刊。1995;92:744–747. doi:10.1073/pnas.92.3.744。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Chazaud C、Oulad-Abdelghani M、Bouillet P、Decimo D、Chambon P、Dolle P.AP-2.2是一个与AP-2相关的新基因,在小鼠胚胎发生期间在前脑、四肢和面部表达。机械发展,1996年;54:83–94. doi:10.1016/0925-4773(95)00463-7。[内政部] [公共医学] [谷歌学者]
-
Coles HSR,Burne JF,Raff MC。发育中大鼠肾脏的大规模正常细胞死亡及其被表皮生长因子减少。发展。1993;118:777–784. doi:10.1242/dev.118.3.777。[内政部] [公共医学] [谷歌学者]
-
Gaubatz S、Imhof A、Dosch R、Werner O、Mitchell P、Buettner R、Eilers M。转录因子AP-2通过myc负调控基因激活。EMBO J.1995;14:1508–1519. doi:10.1002/j.1460-2075.1995.tb07137.x。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Gavrieli Y,Sherman Y,Ben-Sasson SA。通过核DNA片段的特异性标记鉴定原位程序性细胞死亡。细胞生物学杂志。1992;119:493–501. doi:10.1083/jcb.119.3.493。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
Gonzalez-Garcia M、Perez-Ballestro R、Ding L、Duan L、Boise LH、Thompson CB、Nunez G.Bcl-XL是小鼠发育过程中表达的主要Bcl-X mRNA形式,其产物定位于线粒体。发育。1994;120:3033–3042. doi:10.1242/dev.120.10.3033。[内政部] [公共医学] [谷歌学者]
-
Kannan P、Buettner R、Chiao PJ、Yim SO、Sarkiss M、Tainsky MA。N-ras癌基因引起AP-2转录自我干扰,导致转化。《基因与发育》1994;8:1258–1269. doi:10.11101/gad.8.11.1258。[内政部] [公共医学] [谷歌学者]
-
Lens XM、Onuchic LF、Wu G、Hayashi T、Daoust M、Mochizuki T、Santarina LB、Stockwin JM、Muecher G、Becher J、Sweeny WE、Avner ED、Guay Woodford L、Zerres K、Somlo S、Germino GG。常染色体隐性多囊肾病区域的综合遗传和物理图谱。基因组学。1997;41:463–466。doi:10.1006/geno.1997.4671。[内政部] [公共医学] [谷歌学者]
-
Lichter P、Tang CJ、Call K、Hermanson G、Evans GA、Housman D、Ward DC。通过与粘粒克隆的原位杂交对人类11号染色体进行高分辨率定位。科学。1990;247:64–69. doi:10.1126/science.2294592。[内政部] [公共医学] [谷歌学者]
-
Mitchell PJ、Timmons PM、Hebert JM、Rigby PW、Tjian R.转录因子AP-2在小鼠胚胎发育期间在神经嵴谱系中表达。《基因与发育》1991;5:105–119. doi:10.1101/gad.5.1.105。[内政部] [公共医学] [谷歌学者]
-
Moser M、Pscherer A、Imhof A、Bauer R、Kerscher M、Amselgruber W、Sinowatz F、Hofstaedter F、Schüle R、Buettner R。第二个AP-2转录激活基因AP-2β的分子克隆和表征。发展。1995;121:2779–2788. doi:10.1242/dev.121.9.2779。[内政部] [公共医学] [谷歌学者]
-
Moser M,Rüschof J,Buettner R。小鼠胚胎发生过程中AP-2α和AP-2β基因表达的比较分析。开发动态。1997;208:115–124. doi:10.1002/(SICI)1097-0177(199701)208:1<115::AID-AJA11>3.0.CO;2-5.[内政部] [公共医学] [谷歌学者]
-
Oulad-Abdelghani M,Bouillet P,Chazaud C,DolléP,Chambon P.AP-2.2:在P19胚胎癌细胞分化过程中由维甲酸诱导的新型AP-2相关转录因子。实验细胞研究1996;225:338–347. doi:10.1006/excr.1996.0184。[内政部] [公共医学] [谷歌学者]
-
Pfeifer A、Aszódi A、Seidler U、Ruth P、Hofmann F、Fässler R。缺乏cGMP依赖性蛋白激酶II小鼠的肠道分泌缺陷和侏儒症。科学。1996;274:2082–2086. doi:10.1126/science.274.5295.2082。[内政部] [公共医学] [谷歌学者]
-
Sambrook J、Fritsch EF、Maniatis T。分子克隆:实验室手册。第二版,纽约州冷泉港:冷泉港实验室出版社;1989[谷歌学者]
-
Schorle H、Meier P、Buchert M、Jaenisch R、Mitchell PJ。转录因子AP-2对颅骨闭合和颅面发育至关重要。自然。1996;381:235-238之间。doi:10.1038/381235a0。[内政部] [公共医学] [谷歌学者]
-
Sorenson,C.M.、S.A.Rogers、S.J.Korsmeyer和M.R.Hammerman。bcl-2缺乏小鼠的暴发性后肾细胞凋亡和肾脏发育异常。美国生理学杂志。F73–F81。[内政部] [公共医学]
-
Trudel M,D’Agati V,Costantini F.c-myc作为转基因小鼠多囊肾病的诱导剂。《肾脏国际》1991;第39:665–671页。doi:10.1038/ki.1991.80。[内政部] [公共医学] [谷歌学者]
-
Veis DJ、Sorenson CM、Shutter JR、Korsmeyer SJ。Bcl-2缺陷小鼠表现出暴发性淋巴细胞凋亡、多囊肾和毛发色素沉着。单元格。1993;75:229–240. doi:10.1016/0092-8674(93)80065-m。[内政部] [公共医学] [谷歌学者]
-
Williams T,Tjian R.人类转录因子AP-2的DNA结合和激活特性的分析。基因与发育1991a;5:670–682. doi:10.1101/gad.5.4.670。[内政部] [公共医学] [谷歌学者]
-
Williams T,Tjian R.AP-2中二聚化基序的表征及其在异源DNA结合蛋白中的功能。科学。1991年b;251:1067–1071. doi:10.1126/science.1998122。[内政部] [公共医学] [谷歌学者]
-
Williams T,Admon A,Lüscher B,Tjian R。激活诱导增强子元件的细胞型特异性转录因子AP-2的克隆和表达。《基因与发育》1988;2:1557–1569. doi:10.1101/gad.2.12a.1557。[内政部] [公共医学] [谷歌学者]
-
Williamson JA、Bosher JM、Skinner A、Sheer D、Williams T、Hurst C。AP-2转录因子家族两个新成员的人类和小鼠同源物的染色体定位。基因组学。1996;35:262–264. doi:10.1006/geno.1996.0351。[内政部] [公共医学] [谷歌学者]
-
Zerres K、Mücher G、Bachner L、Deschennes G、Eggermann T、Kärriäinen H、Knapp M、Lennert T、Misselwitz J、von Mühlendahl KE、Neumann HPH、Pirson Y、Rudnik-Schöneborn S、Steinbicker V、Wirth B、Schärer K。常染色体隐性多囊肾病(ARPKD)基因到染色体6p21-cen的定位。自然遗传学。1994;7:429–432. doi:10.1038/ng0794-429。[内政部] [公共医学] [谷歌学者]
-
Zerres K、Rudnik-Schöneborn S、Deget F、Holtkamp U、Brodehl J、Geisert J、Schärer K。115名儿童常染色体隐性遗传性多囊肾病:临床表现、病程和性别影响。儿科学报。1996;85:437–445. doi:10.1111/j.1651-2227.1996.tb14056.x。[内政部] [公共医学] [谷歌学者]
-
Zhang J、Hagopin-Donaldson S、Serbed zija G、Elsemore J、Plehn-Dujowich D、McMahon AP、Flavell RA、Williams T。缺乏转录因子AP-2小鼠的神经管、骨骼和体壁缺陷。自然。1996;381:238–241. doi:10.1038/381238a0。[内政部] [公共医学] [谷歌学者]













