摘要
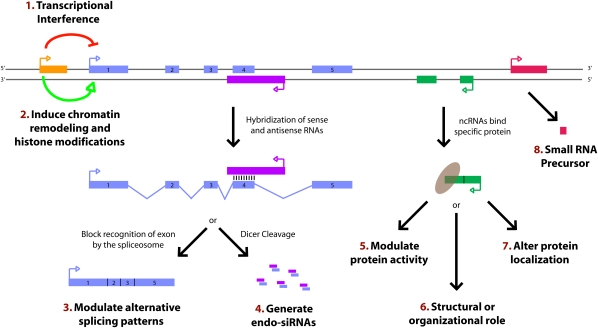
图1。
当ncRNA转录的行为可能就足够了
长ncRNAs将蛋白质靶向特定基因组位点以影响转录模式
长ncRNAs调节蛋白结合伙伴的活性
长ncRNAs作为小RNA的前体
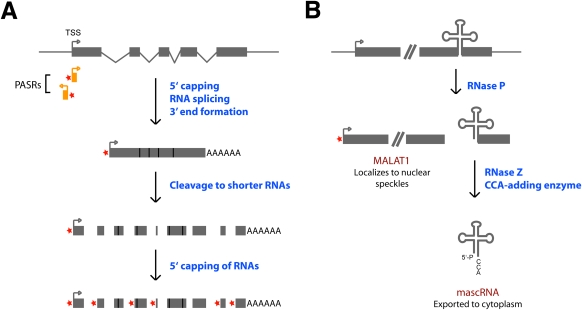
图2。
长ncRNAs影响其他RNAs的处理
长ncRNAs作为结构RNA
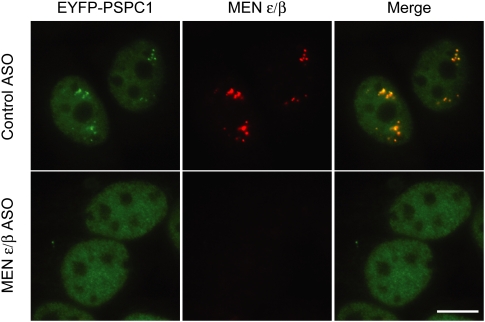
图3。
不太快的短ORF可以翻译
视角
致谢
脚注
工具书类
-
Allen TA,Von Kaenel S,Goodrich JA,Kugel JF。SINE编码的小鼠B2 RNA抑制热休克时的mRNA转录。 自然结构分子生物学。 2004; 11:816–821. doi:10.1038/nsmb813。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Amaral PP,Mattick JS公司。 发育中的非编码RNA。 哺乳动物基因组。 2008; 19:454–492. doi:10.1007/s00335-008-9136-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Aravin AA、Hannon GJ、Brennecke J.Piwi–piRNA途径在转座子军备竞赛中提供适应性防御。 科学。 2007; 318:761–764. doi:10.1126/science.1146484。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Beltran M、Puig I、Pena C、Garcia JM、Alvarez AB、Pena R、Bonilla F、de Herreros AG。天然反义转录物在Snail1诱导的上皮-间质转化过程中调节Zeb2/Sip1基因表达。 基因与发育2008; 22:756–769. doi:10.1101/gad.455708。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Bender W,Fitzgerald DP。 转录激活了黑腹果蝇复合体中的受抑制结构域。 发展。 2002; 129:4923–4930. doi:10.1242/dev.129.21.4923。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Berretta J,Pinskaya M,Morillon A.一种隐秘的不稳定转录物介导酿酒酵母中Ty1反转录转座子的转录转义。 基因与发育2008; 22:615–626. doi:10.1101/gad.458008。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Bertone P、Stolc V、Royce TE、Rozowsky JS、Urban AE、Zhu X、Rinn JL、Tongprasit W、Samanta M、Weissman S等。利用基因组拼接阵列对人类转录序列进行全球鉴定。 科学。 2004; 306:2242–2246. doi:10.1126/science.1103388。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Birney E、Stamatoyannopoulos JA、Dutta A、Guigo R、Gingeras TR、Margulies EH、Weng Z、Snyder M、Dermitzakis ET、Thurman RE等。通过ENCODE试点项目鉴定和分析1%人类基因组中的功能元件。 自然。 2007; 447:799–816. doi:10.1038/nature05874。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Blackshaw S、Harpavat S、Trimarchi J、Cai L、Huang H、Kuo WP、Weber G、Lee K、Fraioli RE、Cho SH等。小鼠视网膜发育的基因组分析。 《公共科学图书馆·生物》。 2004; 2:E247。 doi:10.1371/journal.pbio.0020247。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Blower MD,Nachury M,Heald R,Weis K.有丝分裂纺锤体组装需要含Rae1的核糖核蛋白复合物。 单元格。 2005; 121:223–234. doi:10.1016/j.cell.2005.02.016。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Blume SW,Meng Z,Shrestha K,Snyder RC,Emanuel PD。人类dhfr次要转录物的5′-非翻译RNA改变了主要(核心)启动子处的转录起始复合物组装。 细胞生物化学杂志。 2003; 88:165–180. doi:10.1002/jcb.10326。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Boyer LA、Plath K、Zeitlinger J、Brambrink T、Medeiros LA、Lee TI、Levine SS、Wernig M、Tajonar A、Ray MK等。多梳复合物抑制小鼠胚胎干细胞中的发育调节因子。 自然。 2006; 441:349–353. doi:10.1038/nature04733。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Bracken AP、Dietrich N、Pasini D、Hansen KH、Helin K。Polycomb靶基因的全基因组定位揭示了它们在细胞命运转变中的作用。 基因与发育2006; 20:1123–1136. doi:10.1101/gad.381706。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Cai X,Hagedorn CH,Cullen BR。人类microRNAs是从也可以作为mRNAs起作用的带帽多聚腺苷酸转录物中处理的。 RNA。 2004; 10:1957–1966. doi:10.1261/rna.7135204。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Camblong J,Iglesias N,Fickentscher C,Diepois G,Stutz F.反义RNA稳定通过组蛋白去乙酰化诱导酿酒酵母中转录基因沉默。 单元格。 2007; 131:706–717. doi:10.1016/j.cell.2007.09.014。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Carninci P、Kasukawa T、Katayama S、Gough J、Frith MC、Maeda N、Oyama R、Ravasi T、Lenhard B、Wells C等。哺乳动物基因组的转录图谱。 科学。 2005; 309:1559–1563. doi:10.1126/science.1112014。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Carrozza MJ、Li B、Florens L、Suganuma T、Swanson SK、Lee KK、Shia WJ、Anderson S、Yates J、Washburn MP等。组蛋白H3甲基化通过Set2指导Rpd3S对编码区的去乙酰化,以抑制假基因内转录。 单元格。 2005; 123:581–592. doi:10.1016/j.cell.2005.10.023。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Cheng J、Kapranov P、Drenkow J、Dike S、Brubaker S、Patel S、Long J、Stern D、Tammana H、Helt G等。5核苷酸分辨率下10条人类染色体的转录图谱。 科学。 2005; 308:1149–1154. doi:10.1126/science.1108625。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
克莱姆森CM、哈钦森JN、萨拉SA、恩斯明格AW、福克斯AH、国际象棋A、劳伦斯JB。 核非编码RNA的结构作用:NEAT1 RNA对副啄木鸟的结构至关重要。 分子细胞。 2009; 33:717–726. doi:10.1016/j.molcel.2009.01.026。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
核心LJ,瀑布JJ,Lis JT。 新的RNA测序揭示了人类启动子的广泛暂停和发散启动。 科学。 2008; 322:1845–1848. doi:10.1126/science.1162228。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
非编码RNA:真核生物的新参与者。 基因。 2005; 357:83–94. doi:10.1016/j.gene.2005.06.019。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Czech B、Malone CD、Zhou R、Stark A、Schlingeheyde C、Dus M、Perrimon N、Kellis M、Wohlschlegel JA、Sachidanandam R等。果蝇内源性小干扰RNA途径。 自然。 2008; 453:798–802. doi:10.1038/nature07007。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Davis CA,Ares M.,Jr酿酒酵母细胞核外泌体亚基Rrp6p缺失时不稳定启动子相关转录物的积累。 美国国家科学院院刊。 2006; 103:3262–3267. doi:10.1073/pnas.0507783103。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
de Kok JB、Verhaegh GW、Roelofs RW、Hessels D、Kiemeney LA、Aolders TW、Swinkels DW、Schalken JA。 DD3(PCA3)是检测前列腺肿瘤的一种非常敏感和特异的标记物。 2002年癌症研究; 62:2695–2698. [ 公共医学 ] [ 谷歌学者 ] -
Deng X,Meller VH。苍蝇剂量补偿中的非编码RNA。 生物化学科学趋势。 2006; 31:526–532. doi:10.1016/j.tibs.2006.07.007。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Dettiller S、Aringhieri C、Cardinale S、Keller W、Barabino SM。切割因子Im的68-kDa亚单位内的独特序列模体介导RNA结合、蛋白质相互作用和亚细胞定位。 生物化学杂志。 2004; 279:35788–35797. doi:10.1074/jbc。 M403927200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Dinger ME、Amaral PP、Mercer TR、Pang KC、Bruce SJ、Gardiner BB、Askarian-Amiri ME、Ru K、Solda G、Simons C等。小鼠胚胎干细胞多能性和分化中的长非编码RNA。 基因组研究2008; 18:1433–1445. doi:10.1101/gr.078378.108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Dreyfuss G、Kim VN、Kataoka N.信使RNA结合蛋白及其携带的信息。 Nat Rev Mol细胞生物学。 2002; 3:195–205. doi:10.1038/nrm760。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Ebert MS、Neilson JR、Sharp PA。微RNA海绵:哺乳动物细胞中小RNA的竞争性抑制剂。 自然方法。 2007; 4:721–726. doi:10.1038/nmeth1079。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Ebisuya M、Yamamoto T、Nakajima M、Nishida E.相邻转录的波纹。 自然细胞生物学。 2008; 10:1106–1113. doi:10.1038/ncb1771。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
加利福尼亚州埃斯皮诺扎、艾伦·TA、希布·AR、库格尔·JF、佐治亚州古德里奇。 B2 RNA直接与RNA聚合酶II结合以抑制转录物的合成。 自然结构分子生物学。 2004; 11:822–829. doi:10.1038/nsmb812。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Faghihi MA、Modarresi F、Khalil AM、Wood DE、Sahagan BG、Morgan TE、Finch CE、St Laurent G、3rd、Kenny PJ、Wahlestedt C。阿尔茨海默病中非编码RNA的表达升高,并推动β分泌酶的快速前馈调节。 《国家医学》2008; 14:723–730. doi:10.1038/nm1784。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Fejes-Toth K、Sotirova V、Sachidanandam R、Assaf G、Hannon GJ、Kapranov P、Foissac S、Willingham AT、Duttagupta R、Dumais E等。转录后处理产生5′修饰的长RNA和短RNA的多样性。 自然。 2009; 457:1028–1032. doi:10.1038/nature07759。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Feng J、Bi C、Clark BS、Mady R、Shah P、Kohtz JD。 Evf-2非编码RNA是从Dlx-5/6超保守区域转录而来,并作为Dlx-2转录辅激活子发挥作用。 基因与发展2006; 20:1470-1484。 doi:10.1101/gad.1416106。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Fox AH、Lam YW、Leung AK、Lyon CE、Andersen J、Mann M、Lamond AI。Paraspeckles:一个新的核域。 当前生物量。 2002; 12:13–25. doi:10.1016/s0960-9822(01)00632-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Fox AH、Bond CS、Lamond AI。P54nrb与PSP1形成异二聚体,以RNA依赖的方式定位于副啄木鸟。 分子生物学细胞。 2005; 16:5304–5315. doi:10.1091/mbc。 E05-06-0587。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Franco-Zorrilla JM、Valli A、Todesco M、Mateos I、Puga MI、Rubio-Somoza I、Leyva A、Weigel D、Garcia JA、Paz-Ares J。靶向模拟为微RNA活性的调节提供了一种新机制。 自然遗传学。 2007; 39:1033–1037. doi:10.1038/ng2079。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Galindo MI、Pueyo JI、Fouix S、Bishop SA、Couso JP。短ORF编码的肽控制发育并定义新的真核基因家族。 《公共科学图书馆·生物》。 2007; 5:e106。 doi:10.1371/journal.pbio.0050106。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Ganesan G,Rao SM。一种由Drosha处理的新型非编码RNA仅限于小鼠细胞核。 RNA。 2008; 14:1399–1410. doi:10.1261/rna.838308。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Ghildiyal M、Seitz H、Horwich MD、Li C、Du T、Lee S、Xu J、Kittler EL、Zapp ML、Weng Z等。果蝇体细胞中转座子和mRNA衍生的内源性siRNA。 科学。 2008; 320:1077–1081. doi:10.1126/science.1157396。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Ginger MR、Shore AN、Contreras A、Rijnkels M、Miller J、Gonzalez-Rimbau MF、Rosen JM。非编码RNA是乳腺发育过程中细胞命运的潜在标记。 国家科学院院刊。 2006; 103:5781–5786. doi:10.1073/pnas.0600745103。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Guttman M、Amit I、Garber M、French C、Lin MF、Feldser D、Huarte M、Zuk O、Carey BW、Cassady JP等。染色质特征揭示了哺乳动物中超过1000个高度保守的大型非编码RNA。 自然。 2009; 458:223–227。 doi:10.1038/nature07672。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Han J,Kim D,Morris KV。人类细胞中RNA定向转录基因沉默需要启动子相关RNA。 国家科学院院刊。 2007; 104:12422–12427. doi:10.1073/pnas.0701635104。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
He Y、Vogelstein B、Velculescu VE、Papadopoulos N、Kinzler KW。人类细胞的反义转录体。 科学。 2008; 322:1855–1857. doi:10.1126/science.1163853。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Heasman J、Wessely O、Langland R、Craig EJ、Kessler DS。母体mRNAs的植物定位被VegT缺失所破坏。 开发生物。 2001; 240:377–386. doi:10.1006/dbio.2001.0495。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Hellwig S,Bass BL。饥饿诱导的非编码RNA调节Dicer调节基因的表达。 国家科学院院刊。 2008; 105:12897–12902. doi:10.1073/pnas.0805118105。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Hirota K,Ohta K。mRNA型长非编码RNA(mlonRNAs)的级联转录和局部染色质重塑。 表观遗传学。 2009; 4:5–7. doi:10.4161/epi.4.1.7353。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Hirota K、Miyoshi T、Kugou K、Hoffman CS、Shibata T、Ohta K。通过非编码RNA的级联转录启动逐步进行染色质重塑。 自然。 2008; 456:130–134. doi:10.1038/nature07348。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Hogan PG,Chen L,Nardone J,Rao A.钙、钙调神经磷酸酶和NFAT的转录调控。 基因与发育2003; 17:2205–2232. doi:10.1101/gad.1102703。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Hogga I,Karch F.通过bithorax复合体的iab-7顺调控域转录干扰多囊介导沉默的维持。 发展。 2002; 129:4915–4922. doi:10.1242/dev.129.21.4915。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Hongay CF、Grisafi PL、Galitski T、Fink GR。反义转录控制酿酒酵母的细胞命运。 单元格。 2006; 127:735–745. doi:10.1016/j.cell.2006.09.038。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Houseley J、Rubbi L、Grunstein M、Tollervey D、Vogelauer M。ncRNA调节酵母GAL基因簇中的组蛋白修饰和mRNA诱导。 分子细胞。 2008; 32:685–695. doi:10.1016/j.molcel.2008.09.027。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Hutchinson JN、Ensminger AW、Clemson CM、Lynch CR、Lawrence JB、Chess A。核转录物屏幕识别与SC35剪接域相关的两个链接非编码RNA。 BMC基因组学。 2007; 8:39. doi:10.1186/1471-2164-8-39。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
国际人类基因组测序协会。 完成人类基因组的常染色体序列。 自然。 2004; 431:931–945. doi:10.1038/nature03001。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Jaskiewicz L,Filipowicz W。Dicer在转录后RNA沉默中的作用。 当前顶级微生物免疫学。 2008; 320:77–97. doi:10.1007/978-3-540-75157-14。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Ji P、Diederichs S、Wang W、Boing S、Metzger R、Schneider PM、Tidow N、Brandt B、Buerger H、Bulk E等。新型非编码RNA MALAT-1和胸腺肽β4预测早期非小细胞肺癌的转移和生存。 致癌物。 2003; 22:8031–8041. doi:10.1038/sj.onc.1206928。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Joshi AA,Struhl K.Eaf3与甲基化H3-K36的色域相互作用将组蛋白脱乙酰化与Pol II伸长联系起来。 分子细胞。 2005; 20:971–978. doi:10.1016/j.molcel.2005.11.021。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Kanduri C,Thakur N,Pandey RR。Kcnq1ot1反义启动子编码的转录物的长度决定了沉默的程度。 EMBO J.2006; 25:2096–2106. doi:10.1038/sj.emboj.7601090。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Kanellopoulou C、Muljo SA、Dimitrov SD、Chen X、Colin C、Plath K、Livingston DM.X染色体在没有Dicer的情况下失活。 国家科学院院刊。 2009; 106:1122–1127. doi:10.1073/pnas.0812210106。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Kapranov P、Cheng J、Dike S、Nix DA、Duttagupta R、Willingham AT、Stadler PF、Hertel J、Hackermuler J、Hofacker IL等。RNA图谱揭示了新的RNA类别和普适转录的可能功能。 科学。 2007年a; 316:1484–1488. doi:10.1126/science.1138341。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Kapranov P、Willingham AT、Gingeras TR。基因组全转录及其对基因组组织的影响。 Nat Rev基因。 2007年b; 8:413–423. doi:10.1038/nrg2083。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Katayama S、Tomaru Y、Kasukawa T、Waki K、Nakanishi M、Nakamura M、Nishida H、Yap CC、Suzuki M、Kawai J等。哺乳动物转录组中的反义转录。 科学。 2005; 309:1564–1566. doi:10.1126/science.1112009年。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Keogh MC、Kurdestani SK、Morris SA、Ahn SH、Podolny V、Collins SR、Schuldiner M、Chin K、Punna T、Thompson NJ等。组蛋白H3赖氨酸36的共转录Set2甲基化招募抑制性Rpd3复合物。 单元格。 2005; 123:593–605. doi:10.1016/j.cell.2005.10.025。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Kloc M、Wilk K、Vargas D、Shirato Y、Bilinski S、Etkin LD。 非编码和编码RNA在爪蟾卵母细胞植物皮层细胞骨架组织中的潜在结构作用。 发展。 2005; 132:3445–3457. doi:10.1242/dev.01919。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Kloc M,Bilinski S,Dougherty MT。非洲爪蟾卵母细胞植物皮层中细胞角蛋白细胞骨架和种质的组织取决于编码和非编码RNA:三维和超微结构分析。 实验细胞研究2007; 313:1639–1651。 doi:10.1016/j.yexcr.2007.02.018。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Kohlmaier A、Savarese F、Lachner M、Martens J、Jenuwein T、Wutz A。Xist触发的染色体记忆调节X失活中的组蛋白甲基化。 《公共科学图书馆·生物》。 2004; 2:E171。 doi:10.1371/journal.pbio.0020171。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Kondo T、Hashimoto Y、Kato K、Inagaki S、Hayashi S、Kageyama Y。多顺反子mRNA编码的肌动蛋白基细胞形态发生的小肽调节物。《自然细胞生物学》。 2007; 9:660–665. doi:10.1038/ncb1595。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Krystal GW、Armstrong BC、Battey JF。N-myc mRNA与内源性反义转录物形成RNA-RNA双链。 分子细胞生物学。 1990; 10:4180–4191. doi:10.1128/mcb.10.8.4180。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Lamond AI,斯佩克特DL。 核斑点:核细胞器的模型。 Nat Rev Mol细胞生物学。 2003; 4:605–612. doi:10.1038/nrm1172。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Lanz RB、McKenna NJ、Onate SA、Albrecht U、Wong J、Tsai SY、Tsai-MJ、O'Malley BW。类固醇受体辅激活剂SRA作为RNA发挥作用,存在于SRC-1复合物中。 单元格。 1999; 97:17–27. doi:10.1016/s0092-8674(00)80711-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Lecuyer E、Yoshida H、Parthasarathy N、Alm C、Babak T、Cerovina T、Hughes TR、Tomancak P、Krause HM。mRNA定位的全球分析揭示了mRNA在组织细胞结构和功能中的重要作用。 单元格。 2007; 131:174–187. doi:10.1016/j.cell.2007.08.003。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Lee Y,Kim M,Han J,Yeom KH,Lee S,Baek SH,Kim VN。微RNA基因通过RNA聚合酶II转录。 EMBO J.2004; 23:4051–4060. doi:10.1038/sj.emboj.7600385。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Lee Y、Han J、Yeom KH、Jin H、Kim VN。初级微RNA加工中的Drosha。 冷泉Harb Symb Quant生物。 2006; 71:51–57. doi:10.1101/sqb.2006.71.041。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Lempradl A,Ringrose L.非编码转录如何调节Hox基因? 生物论文。 2008; 30:110–121. doi:10.1002/bies.20704。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Leygue E.类固醇受体RNA激活剂(SRA1):与乳腺癌相关的异常分叉基因产物。 Nucl Recept Signal(零接收信号)。 2007; 5:e006。 doi:10.1621/nrs.05006。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Lin R,Maeda S,Liu C,Karin M,Edgington TS。一种大的非编码RNA是小鼠肝细胞癌和一系列人类癌的标记物。 致癌物。 2007; 26:851–858. doi:10.1038/sj.onc.1209846。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Mariner PD、Walters RD、Espinoza CA、Drullinger LF、Wagner SD、Kugel JF、Goodrich JA。 人Alu RNA是热休克期间mRNA转录的模块化转录抑制因子。 分子细胞。 2008; 29:499–509. doi:10.1016/j.molcel.2007.12.013。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Martens JA、Laprade L、Winston F.抑制酿酒酵母SER3基因需要基因间转录。 自然。 2004; 429:571–574. doi:10.1038/nature02538。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Martianov I,Ramadass A,Serra Barros A,Chow N,Akoulitchev A.通过非编码干扰转录物抑制人二氢叶酸还原酶基因。 自然。 2007; 445:666–670. doi:10.1038/nature05519。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Masui O,Heard E.RNA和X染色体失活中的蛋白质作用体。 冷泉Harb Symb Quant生物。 2006; 第71:419–428页。 doi:10.10101/sqb.2006.71.058。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Mattick JS公司。 RNA调节:一种新的遗传学? Nat Rev基因。 2004; 5:316–323. doi:10.1038/nrg1321。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Mercer TR、Dinger ME、Sunkin SM、Mehler MF、Mattick JS。 小鼠脑中长非编码RNA的特异性表达。 国家科学院院刊。 2008; 105:716–721. doi:10.1073/pnas.0706729105。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Mohammad F、Pandey RR、Nagano T、Chakalova L、Mondal T、Fraser P、Kanduri C.Kcnq1ot1/Lit1非编码RNA通过靶向核周区域介导转录沉默。 分子细胞生物学。 2008; 28:3713–3728. doi:10.1128/MCB.02263-07。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Munroe SH,Lazar MA。天然反义RNA对c-erbA mRNA剪接的抑制。生物化学杂志。 1991; 266:22083–22086. [ 公共医学 ] [ 谷歌学者 ] -
Nagano T、Mitchell JA、Sanz LA、Pauler FM、Ferguson-Smith AC、Feil R、Fraser P.The Air非编码RNA通过将G9a靶向染色质,表观遗传学沉默转录。 科学。 2008; 322:1717–1720. doi:10.1126/science.1163802。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Neil H,Malabat C,d'Aubenton-Carafa Y,Xu Z,Steinmetz LM,Jacquier A.广泛存在的双向启动子是酵母中隐秘转录物的主要来源。 自然。 2009; 457:1038–1042. doi:10.1038/nature07747。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Nesterova TB、Popova BC、Cobb BS、Norton S、Senner CE、Tang YA、Spruce T、Rodriguez TA、Sado T、Merkenschlager M等。Dicer通过Dnmt3a的转录控制间接调节ES细胞中Xist启动子甲基化。 表观遗传学染色质。 2008; 1:2. doi:10.1186/1756-8935-1-2。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Ogawa Y、Sun BK、Lee JT。 RNA干扰和X失活途径的交叉。 科学。 2008; 320:1336–1341。 doi:10.1126/science.1157676。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Okamura K,Chung WJ,Ruby JG,Guo H,Bartel DP,Lai EC。果蝇发夹RNA途径产生内源性短干扰RNA。 自然。 2008; 453:803–806. doi:10.1038/nature07015。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Pandey RR、Mondal T、Mohammad F、Enroth S、Redrup L、Komorowski J、Nagano T、Mancini-Dinardo D、Kanduri C.Kcnq1ot1反义非编码RNA通过染色质水平调节介导谱系特异性转录沉默。 分子细胞。 2008; 32:232–246. doi:10.1016/j.molcel.2008.08.022。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Payer B,Lee JT。 X染色体剂量补偿:哺乳动物如何保持平衡。 年度版次Genet。 2008; 42:733–772. doi:10.1146/annrev.genet.4210807.091711。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Peters J,Robson JE。印迹非编码RNA。 哺乳动物基因组。 2008; 19:493–502. doi:10.1007/s00335-008-9139-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Petruk S、Sedkov Y、Riley KM、Hodgson J、Schweisguth F、Hirose S、Jaynes JB、Brock HW、Mazo A。通过转录干扰抑制顺式细胞中的Ubx,转录由trithorax促进的bxd非编码RNA。 单元格。 2006; 127:1209–1221. doi:10.1016/j.cell.2006.10.039。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Petruk S,Sedkov Y,Brock HW,Mazo A.早期胚胎中非编码RNA启动镶嵌HOX基因表达模式的模型。 RNA生物学。 2007; 4:1–6. doi:10.4161/rn1.4.1.4300。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
野鸡M,Mattick JS。 提高对人类功能序列的估计。 基因组研究2007; 17:1245–1253. doi:10.1101/gr.6406307。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Plath K,Fang J,Mlynarczyk-Evans SK,Cao R,Worringer KA,Wang H,de la Cruz CC,Otte AP,Panning B,Zhang Y.组蛋白H3赖氨酸27甲基化在X失活中的作用。 科学。 2003; 300:131–135. doi:10.1126/science.1084274。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Pollard KS、Salama SR、Lambert N、Lambot MA、Coppens S、Pedersen JS、Katzman S、King B、Onodera C、Siepel A等。人类皮层发育期间表达的RNA基因快速进化。 自然。 2006; 443:167–172. doi:10.1038/nature05113。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Ponjavic J、Ponting CP、Lunter G.功能性或转录噪声? 长非编码RNA内选择的证据。 基因组研究2007; 17:556–565. doi:10.1101/gr.6036807。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Prasanth KV,Spector DL公司。 真核调控RNA:“基因组复杂性”难题的答案。 基因与发育2007; 21:11–42. doi:10.1101/gad.1484207。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Prasanth KV、Prasanth-SG、Xuan Z、Hearn S、Freier SM、Bennett CF、Zhang MQ、Spector DL。 通过RNA核保留调节基因表达。 单元格。 2005; 123:249–263. doi:10.1016/j.cell.2005.08.033。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Preker P、Nielsen J、Kammler S、Lykke-Andersen S、Christensen MS、Mapendano CK、Schierup MH、Jensen TH。RNA外体缺失揭示了活性人类启动子的转录上游。 科学。 2008; 322:1851–1854. doi:10.1126/science.1164096。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Pueyo JI,Couso JP。11个氨基酸长的无Tarsal肽在果蝇腿部发育中触发细胞信号。 开发生物。 2008; 324:192–201. doi:10.1016/j.ydbio.2008.08.025。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Rank G,Prestel M,Paro R.通过果蝇复合物的基因间染色体记忆元件转录与表观遗传开关相关。 分子细胞生物学。 2002; 22:8026–8034. doi:10.1128/MCB.222.82.8026-8034.2002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Ravasi T、Suzuki H、Pang KC、Katayama S、Furuno M、Okunishi R、Fukuda S、Ru K、Frith MC、Gongora MM等。小鼠基因组中大量非编码RNA调控表达的实验验证。 基因组研究2006; 16:11–19. doi:10.1101/gr.4200206。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Rinn JL、Kertesz M、Wang JK、Squazzo SL、Xu X、Brugmann SA、Goodnough LH、Helms JA、Farnham PJ、Segal E等。通过非编码RNA对人类HOX基因座中活性和沉默染色质域的功能划分。 单元格。 2007; 129:1311–1323. doi:10.1016/j.cell.2007.05.022。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Royo H,Cavaille J.印迹基因簇中的非编码RNA。 生物细胞。 2008; 100:149–166. doi:10.1042/BC20070126。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Sanchez-Elsner T、Gou D、Kremmer E、Sauer F。三胸反应元件的非编码RNA将果蝇Ash1招募到Ultrabithorax。 科学。 2006; 311:1118–1123. doi:10.1126/science.1117705。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Sasaki YTF、Ideue T、Sano M、Mituyama T、Hirose T.MEN/β非编码RNA对核副啄木鸟的结构完整性至关重要。 国家科学院院刊。 2009; 106:2525–2530. doi:10.1073/pnas.0807899106。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Schmitt S,Prestel M,Paro R.通过多梳群反应元件的基因间转录抵消沉默。 《基因与发育》2005; 19:697–708. doi:10.10101/gad.326205。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Seidl CI、Stricker SH、Barlow DP。 印迹的Air-ncRNA是一种非典型的RNAPII转录物,可以避免剪接并逃避核输出。 EMBO J.2006; 25:3565–3575. doi:10.1038/sj.emboj.7601245。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Seila AC、Calabrese JM、Levine SS、Yeo GW、Rahl PB、Flynn RA、Young RA、Sharp PA。活性启动子的发散转录。 科学。 2008; 322:1849–1851. doi:10.1126/science.1162253。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Shamovsky I、Ivannikov M、Kandel ES、Gershon D、Nudler E.哺乳动物细胞中RNA介导的热休克反应。 自然。 2006; 440:556–560. doi:10.1038/nature04518。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Silva J、Mak W、Zvetkova I、Appanah R、Nesterova TB、Webster Z、Peters AH、Jenuwein T、Otte AP、Brockdorff N。在非活性X染色体上建立组蛋白H3甲基化需要Eed–Enx1多梳群复合物的瞬时募集。 开发单元。 2003; 4:481–495. doi:10.1016/s1534-5807(03)00068-6。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Sleutels F、Zwart R、Barlow DP。 非编码的Air RNA是沉默常染色体印迹基因所必需的。 自然。 2002; 415:810–813. doi:10.1038/415810a。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Sone M、Hayashi T、Tarui H、Agata K、Takeichi M、Nakagawa S。类mRNA非编码RNA Gomafu在神经元子集中构成一个新的核结构域。 细胞科学杂志。 2007; 120:2498–2506. doi:10.1242/jcs.009357。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Spector DL公司。 核领域。 细胞科学杂志。 2001; 114:2891–2893. doi:10.1242/jcs.114.16.2891。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Spector DL公司。 快照:细胞体。 单元格。 2006; 127:1071. doi:10.1016/j.cell.2006.11.026。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Struhl K.转录噪声和RNA聚合酶II启动的保真度。 自然结构分子生物学。 2007; 14:103–105. doi:10.1038/nsmb0207-103。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Sunwoo H、Dinger ME、Wilusz JE、Amaral PP、Mattick JS、Spector DL。 MENɛ/β保留核的非编码RNA在肌肉分化时上调,是副啄木鸟的重要组成部分。 基因组研究2009; 19:347–359. doi:10.1101/gr.087775.108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Szymanski M,Barcissewska MZ,Erdmann VA,Barciszewski J.分子医学的新前沿:非编码RNA。 Biochim生物物理学报。 2005; 1756年6月65日至75日。 doi:10.1016/j.bbcan.2005.07.005。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Taft RJ、Glazov EA、Cloonan N、Simons C、Stephen S、Faulkner GJ、Lassmann T、Forrest AR、Grimmond SM、Schroder K等。与动物转录起始位点相关的微小RNA。 自然遗传学。 2009; 41:572–578. doi:10.1038/ng.312。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Tam OH、Aravin AA、Stein P、Girard A、Murchison EP、Cheloufi S、Hodges E、Anger M、Sachidanandam R、Schultz RM等。伪基因衍生小干扰RNA调节小鼠卵母细胞中的基因表达。 自然。 2008; 453:534–538. doi:10.1038/nature06904。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Uhler JP、Hertel C、Svejstrup JQ。 非编码转录在酵母PHO5基因激活中的作用。 国家科学院院刊。 2007; 104:8011–8016。 doi:10.1073/pnas.0702431104。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
王杰、张杰、郑赫、李杰、刘德、李赫、沙姆达拉R、于杰、王国科。 小鼠转录组:“非编码”互补DNA的中性进化。 自然。 2004; 431:757. doi:10.1038/nature03016。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Wang X,Arai S,Song X,Reichart D,Du K,Pascual G,Tempst P,Rosenfeld MG,Glass CK,Kurokawa R.诱导的ncRNAs变构修饰顺式RNA结合蛋白以抑制转录。 自然。 2008; 454:126–130. doi:10.1038/nature06992。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Watanabe T、Totoki Y、Toyoda A、Kaneda M、Kuramochi-Miyagawa S、Obata Y、Chiba H、Kohara Y、Kono T、Nakano T等。来自天然形成的dsRNA的内源性siRNA调节小鼠卵母细胞中的转录物。 自然。 2008; 453:539–543. doi:10.1038/nature06908。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Willingham AT、Orth AP、Batalov S、Peters EC、Wen BG、Aza-Blanc P、Hogenesch JB、Schultz PG。探索非编码RNA功能的策略发现NFAT的阻遏物。 科学。 2005; 309:1570–1573. doi:10.11126/science.1115901。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Wilusz JE、Freier SM、Spector DL。 长核保留非编码RNA的3′末端处理产生tRNA-like细胞质RNA.Cell。 2008; 135:919–932. doi:10.1016/j.cell.2008.10.012。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Wyers F、Rougemaille M、Badis G、Rousselle JC、Dufour ME、Boulay J、Regnault B、Devaux F、Namane A、Seraphin B等。涉及新聚(A)聚合酶的核质量控制途径降解了隐秘pol II转录物。 单元格。 2005; 121:725–737. doi:10.1016/j.cell.2005.04.030。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Xu Z、Wei W、Gagneur J、Perocchi F、Clauder-Munster S、Camblong J、Guffanti E、Stutz F、Huber W、Steinmetz LM。 双向启动子在酵母中产生普遍转录。 自然。 2009; 457:1033–1037. doi:10.1038/nature07728。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Yan MD,Hong CC,Lai GM,Cheng AL,Lin YW,Chuang SE。从Fas相反链转录的一个新基因Saf的鉴定和表征。 人类分子遗传学。 2005; 14:1465–1474. doi:10.1093/hmg/ddi156。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Young TL,Matsuda T,Cepko CL。非编码RNA牛磺酸上调基因1是小鼠视网膜分化所必需的。 当前生物量。 2005; 15:501–512. doi:10.1016/j.cub.2005.02.027。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
Yu W,Gius D,Onyango P,Muldoon-Jacobs K,Karp J,Feinberg AP,Cui H。反义RNA对肿瘤抑制基因p15的表观遗传沉默。《自然》。 2008; 451:202–206. doi:10.1038/nature06468。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
Zhang LF、Huynh KD、Lee JT。 S期核仁周靶向非活性X:维持沉默作用的证据。 单元格。 2007; 129:693–706. doi:10.1016/j.cell.2007.03.036。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
赵杰,孙BK,Erwin JA,宋俊杰,Lee JT。 短重复RNA靶向小鼠X染色体的多梳蛋白质。 科学。 2008; 322:750–756. doi:10.1126/science.1163045。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]