摘要
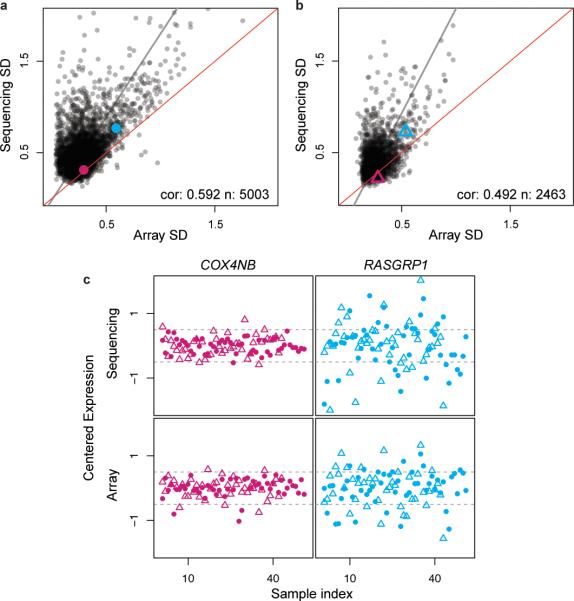
图1。
补充材料
工具书类
-
1 Wang ET等人,《人类组织转录组中的替代异构体调节》。 自然。 2008; 456:470–476. doi:10.1038/nature07509。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
2 Mortazavi A、Williams BA、McCue K、Schaeffer L、Wold B.通过RNA-Seq对哺乳动物转录体进行定位和量化。 自然方法。 2008; 5:621–628. doi:10.1038/nmeth.1226。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
三。 Bullard JH,Purdom E,Hansen KD,Dudoit S。mRNA-Seq实验中归一化和差异表达统计方法的评估。 BMC生物信息学。 2010; 11:94. doi:10.1186/1471-2105-11-94。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
4 Marioni JC、Mason CE、Mane SM、Stephens M、Gilad Y.RNA-seq:技术再现性评估和与基因表达阵列的比较。 基因组研究2008; 18:1509–1517. doi:10.1101/gr.079558.108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
5 Wang Z,Gerstein M,Snyder M.RNA-Seq:转录组学的革命性工具。 自然资源部Genet。 2009; 10:57–63. doi:10.1038/nrg2484。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
6 Elowitz MB,Levine AJ,Siggia ED,Swain PS。单细胞中的随机基因表达。 科学。 2002; 297:1183–1186. doi:10.1126/science.1070919。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
7 Whitney AR等人。人类血液中基因表达模式的个体性和变异。 美国国家科学院院刊,2003年; 100:1896–1901. doi:10.1073/pnas.252784499。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
8 Churchill GA。cDNA微阵列实验设计基础。 自然遗传学。 2002; 32(补充):490-495。 doi:10.1038/ng1031。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
9 Golub TR等。癌症的分子分类:通过基因表达监测进行分类发现和分类预测。科学。 1999; 286:531–537. doi:10.1126/science.286.5439.531。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
10 Irizarry RA等。微阵列平台的多实验室比较。 自然方法。 2005; 2:345–350. doi:10.1038/nmeth756。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
11 Shi L等。微阵列质量控制(MAQC)项目显示了基因表达测量的平台间和平台内再现性。 国家生物技术。 2006; 24:1151–1161. doi:10.1038/nbt1239。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
12. Leek JT等人。解决高吞吐量数据中批量效应的广泛而关键的影响。 自然资源部Genet。 2010; 11:733–739. doi:10.1038/nrg1825。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
13 蒙哥马利·SB等人。在高加索人群中使用第二代测序的转录组遗传学。 自然。 2010; 464:773–777. doi:10.1038/nature08903。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
14 Pickrell JK等人。通过RNA测序了解人类基因表达变异的机制。 自然。 2010; 464:768–772. doi:10.1038/nature08872。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
15 Stranger BE等。核苷酸和拷贝数变异对基因表达表型的相对影响。 科学。 2007; 315:848–853. doi:10.1126/science.1136678。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
16 Choy E等。体外人类性状的遗传分析:淋巴母细胞系中的药物反应和基因表达。 公共科学图书馆-遗传学。 2008; 4:e1000287。 doi:10.1371/journal.pgen.1000287。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]