摘要
循环缺氧现在是动物和人类实体肿瘤中公认的现象。循环缺氧可以存在于距离微血管100μm以上的地方,其中一些区域已被证明存在于正常组织附近。pO波动2大约20 mmHg的汞柱可能以几分钟到几小时甚至几天的周期出现。这些波动归因于红细胞流量、灌注的变化以及新血管网络的形成。循环缺氧已被证明可诱导低氧诱导转录因子-1α(HIF-1α)的表达,并使肿瘤细胞和肿瘤血管内皮细胞具有增强的促生存途径,使肿瘤对放疗和化疗的反应性降低。通过考虑波动的幅度和频率以及它们与正常组织相邻的位置,肿瘤循环缺氧的成像可以提供帮助规划适当治疗的能力。电子顺磁共振成像(EPRI)能够区分慢性和循环缺氧区域,并具有所需的空间和时间分辨率,以提供肿瘤pO的定量地图2EPRI可以作为检测肿瘤pO的有用工具2纵向响应治疗,并在实验选择的时间窗口内空间映射pO波动2在植入或原位肿瘤的动物模型中无创,具有潜在的人类应用价值。
关键词:血管生成,周期性缺氧,EPR成像,HIF-1,氧合
背景
由供氧和供氧失衡引起的实体肿瘤缺氧可能是对放疗和化疗产生耐药性的原因(1). 肿瘤缺氧通常归因于血管系统混乱和组织结构不良(2,三). 根据组织学评估,Thomlinson和Gray假设人类肿瘤中存在缺氧及其在治疗抵抗中的作用(4)在啮齿动物肿瘤中得到证实(5)后来也在人类身上(6). 众所周知,慢性缺氧存在于氧扩散距离以外的肿瘤区域,最近是急性缺氧或间歇性缺氧,由于肿瘤细胞和肿瘤血管内皮细胞对治疗抵抗力的显著影响,现在被称为循环缺氧正受到越来越多的关注(7,8).
几十年前,在动物模型中研究了周期性缺氧及其与肿瘤放射生物学/放射抗性的相关性(9,10). 卓别林等人研究了肿瘤氧合的时间曲线,发现循环缺氧是由肿瘤灌注的短暂波动引起的(11). 对这种现象进行了更详细的研究,发现它与红细胞流量的波动有关,而红细胞流量波动又归因于包括暂时性血管闭塞和血管狭窄在内的因素(2,12). 随后的研究表明,波动不仅发生在血管附近,甚至可能发生在离微血管130μm的地方(13). SCC VII肿瘤中至少20%的肿瘤细胞经历循环缺氧的观察结果(11)支持循环缺氧是实体肿瘤的常见特征,可以被视为肿瘤微循环的标志(2,14).
循环频率
已经使用多种技术在几个模型系统中研究了循环缺氧的频率(2). 这些研究的研究表明,尽管循环在异种移植、原位实体瘤和人类肿瘤中普遍存在,但循环频率可以在几周/分钟到几小时甚至几天之间(2,14). 虽然较高频率的循环缺氧与几个因素有关,包括灌注、红细胞流量、血管闭塞等的变化,但在一段时间内观察到的循环缺氧被归因于新生血管导致的血管网络结构的变化(2,14).
循环缺氧的后果
周期性缺氧的一个后果是肿瘤细胞在经历急性缺氧期和复氧期后的转移潜能增加。这种现象背后的机制与原代肿瘤细胞中诱导的表型变化有关(15). Dewhirst及其同事研究了缺氧循环对肿瘤细胞和内皮细胞的细胞效应(16). 他们发现,即使在有氧条件下,肿瘤细胞辐射后复氧也会导致活性氧(ROS)显著增加,同时HIF-1α也会稳定(16). 此外,还发现辐射后复氧增加了血管内皮生长因子(VEGF)水平,并赋予内皮细胞抵抗辐射损伤的能力(7,8). 这些作用被抗氧化酶模拟物抑制,这表明活性氧在细胞水平上的观察到的反应中起着重要作用(16). 对HIF-1α在辐射反应中的作用进行了更详细的研究,发现其可能参与肿瘤细胞的放射增敏,甚至通过刺激依赖于治疗顺序的内皮细胞生存途径而引起放射抗性(17). 最近的一项研究检查了实验性施加的缺氧循环和复氧对内皮细胞的影响,发现内皮细胞对辐射有抵抗力,并增加了迁移和组装成微血管的能力(8). 在诱导缺氧期间,发现这种耐药表型伴随着HIF-1α的积累。在荷瘤小鼠中进行的类似实验,当接受含有高(21%)和低(7%)氧气的呼吸气体循环时,导致内皮细胞和肿瘤细胞中辐射诱导的凋亡死亡水平降低,肿瘤再生率增加(8).
肿瘤缺氧与HIF-1α
肿瘤内缺氧导致HIF-1α的表达和活性增加,HIF-1在肿瘤进展、血管生成、代谢转换为有氧糖酵解、转移和治疗抵抗中起关键作用(14). 实验动物模型显示HIF-1α过度表达与不良临床结果相关,对肿瘤生长有显著影响,使其成为癌症治疗中的重要抑制靶点(18). 暴露于电离辐射会上调肿瘤中HIF-1α的活性,最终通过ROS支持的过程介导的血管放射防护导致肿瘤的放射抗性,使其成为放射增敏的重要靶点(16). 研究发现,HIF-1α抑制和放射治疗的测序对治疗结果很重要(17). 这些观察结果表明,在观察窗期间,无创性连续检查肿瘤氧合状态和肿瘤氧含量波动,以设计具有辐射和HIF-1α抑制作用的有效治疗序列。
一个主要问题是,循环缺氧如何导致HIF-1、缺氧和患者预后之间的复杂关系。Martinive等人最近报道,与慢性缺氧细胞相比,暴露于实验性循环缺氧中的内皮细胞表现出更强的HIF-1α蓄积(8). 实验性循环缺氧条件下的内皮细胞获得促血管生成表型和对凋亡治疗的抵抗,这似乎是由HIF-1α介导的,因为HIF-1β-siRNA消除了循环缺氧诱导的表型。据报道,在小鼠颈动脉体和离体灌注心脏模型中,实验性强制循环缺氧导致HIF-1α信号的大量积累(2,14). 值得注意的是,HIF-1α的循环低氧诱导的强健积累仅在低氧期观察到,但由于其快速降解,在中断复氧期不能观察到(8)而HIF-1α调节基因的表达增强甚至在复氧期也能观察到。总之,与慢性缺氧区域相比,肿瘤中的循环缺氧更有可能促进HIF-1α的稳定,甚至在血管壁近端区域(氧扩散距离内)HIF-1调节蛋白的过度表达。这开启了促血管生成开关,有助于内皮细胞存活,并有助于肿瘤细胞对抗细胞毒治疗。需要进一步研究自发循环缺氧对肿瘤细胞和周围支持细胞HIF-1α积累的影响。
成像循环缺氧
虽然循环缺氧现象最初是在体内卓别林等人在体外评估之后进行的放射生物学实验获得了强有力的实验证据,直接证明了这种现象在动物模型中的发生(11). 随后的窗口室实验深入了解了这一现象背后的机制,并从血管中确定了这种现象发生的时间剖面和空间范围(2,12). 自先验的有关肿瘤缺氧循环的信息可能有助于规划放疗和化疗方案,目前正在积极探索成像技术,以所需的空间和时间分辨率监测这一现象。
最初对循环缺氧的非侵入性研究采用了窗室模型,并获得了实验数据,这些数据有助于深入了解循环缺氧的现象和机制(2). 随后的工作集中在使用临床可用的成像模式来研究这些现象。Gallez和他的同事是第一个使用基于MRI的方法(如T2*加权MRI和(动态对比增强)DCE-MRI在动物模型中监测肿瘤氧合的时间变化(19). 在这项研究中,他们注意到肿瘤中的两种区域与pO的时间依赖性变化有关2T的典型上下波动区域2*观察到循环缺氧的迹象以及pO持续下降的模式2在其他地区。这些研究通过成像方法验证了肿瘤中存在循环缺氧,成像方法原则上可以在人体中进行。然而,正如该报告所指出的那样,其他因素对氧合测定的贡献使得这些基于MRI的方法的广泛应用并非最佳。Dewhirst及其同事使用磷光寿命成像检查了三种不同的大鼠肿瘤模型,并检测了所有三种模型中循环缺氧的发生情况,其特征周期性表明了循环缺氧的一般特征(13). 此外,在两种肿瘤类型中,他们发现肿瘤内波动的时空相关性(13).
为了利用动物研究产生的丰富信息,开发能够监测循环缺氧的成像策略非常重要,最好是定量监测动物和人类的缺氧。基于光学的成像技术虽然在定义明确的动物模型系统中很有价值,并且有助于深入了解循环缺氧的生物学,但由于穿透深度有限,无法对更大的动物肿瘤或人类进行研究,因此可能存在局限性。正电子发射断层扫描是第一种用于研究人类循环缺氧的成像技术(20). 虽然可以使用PET成像,使用硝基咪唑药物(例如18F-米索尼达唑,该方法仅在给药后的预定时间窗内对缺氧进行综合评估;它不能监测循环缺氧,除非循环缺氧的频率超过几天。当使用免疫化学方法评估缺氧时,情况类似体外注射吡莫硝唑的荷瘤动物肿瘤切除后组织分析(21). 理想的缺氧成像技术是:1)无创性;2) 以pO表示的数量2测量;3) 可在分钟/小时-天内重复;4) 具有与解剖图像共同注册的能力;和5)原则上可以针对人类应用进行缩放。
主要预付款
最近描述了动态三维电子顺磁共振成像(EPRI)及其在小鼠肿瘤模型中无创显示自发循环缺氧的能力(22). EPRI是一种类似于核磁共振(NMR)的低场磁共振技术。顺磁性分子氧与外源顺磁性示踪剂之间的碰撞相互作用拓宽了示踪剂的EPR线宽,从而对组织氧浓度进行了定量估计。虽然有使用MRI、PET和光学成像等临床可用模式的无创性低氧成像技术,但EPRI比它们有几个独特的优势,例如:1)它是无创的,可以测量pO2在没有放射性同位素的组织深处,2)提供绝对pO2分辨率为3-4毫米汞柱的数值,以及3)每2–3分钟获得1–2毫米空间分辨率的动态3D氧气成像。
我们之前已经证明了EPRI与MRI耦合的可行性,其工作频率为300 MHz,磁场分别为10 mT和7 T(23). EPRI和MRI的连续扫描有助于更全面地检查肿瘤缺氧、血液灌注和能量代谢。仪器和图像采集策略的最新发展使得获得三维pO成为可能23分钟内绘制地图,实现肿瘤循环缺氧的无创成像。此外,在30分钟的时间窗内用EPRI进行成像实验时,使用简单的空气-碳-空气激发策略,可以在动物模型中从空间上区分慢性缺氧区域和循环缺氧区域(22).图1A显示pO2在30分钟的成像时间窗口内,来自基于EPRI的肿瘤氧合评估的3、18和27分钟的图像。两个感兴趣区域(ROI)1和2分别被识别为慢性或循环缺氧区域。平均pO2在拍摄图像的不同时间绘制这些区域的值,如所示图1B下曲线对应于ROI 1,表示一个经历慢性缺氧的区域,而上曲线代表ROI 2,这是一个典型的循环缺氧区域,pO波动约20mm Hg2随着时间的推移。在循环缺氧区,可以观察到急性缺氧期,然后恢复到接近常压状态。图1C显示了根据中所示的动态图像构造的两个参数化图像图1A和B。中左侧的图像图1C是时间平均pO2图像时间窗口30分钟内肿瘤的地图图1C表示pO的标准偏差230分钟时间窗内拍摄的10张肿瘤图像的地图。此图像中显示的数据包含时间pO范围的信息2波动。与其他pO相比2组织评估技术,EPRI显然提供了优势。基于硝基咪唑的PET成像和免疫化学提供的图像类似于图1C(左)其中时间波动是时间平均的,肿瘤pO的静态评估2获得。因此,这些技术不能提供与pO时间波动有关的信息2另一方面,中显示的图像图1A、1B和右侧的参数化图像图1C包含pO波动的空间地图2极谱氧电极或基于磷光寿命的光学成像能够监测pO的波动2在肿瘤的窗腔模型中,时间分辨率以秒为单位提高。然而,由于电极的使用以及磷光成像对光的组织穿透,取样量有限,且侵入性测量可能会影响对深层肿瘤的评估。
图1。
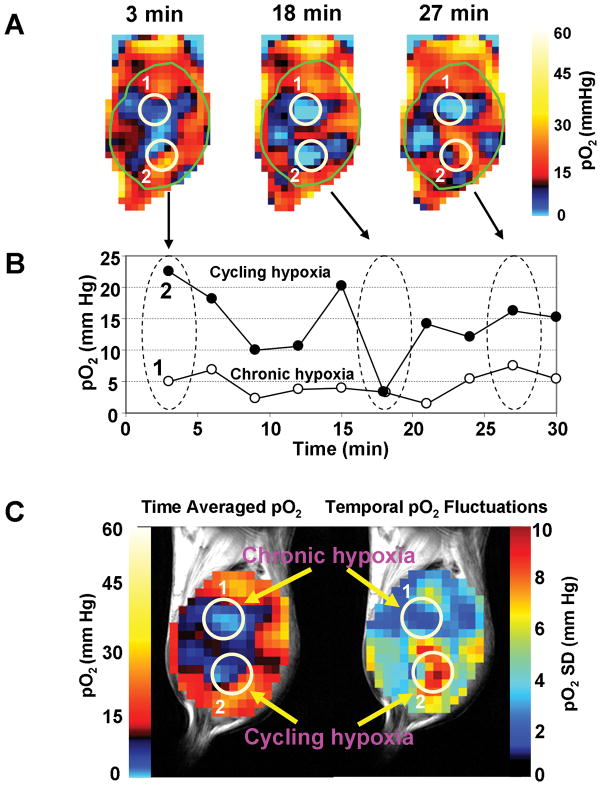
植入SCCVII肿瘤的小鼠的慢性和循环肿瘤缺氧的非侵入性成像。A) 在30分钟的时间窗内,每3分钟获取一次3D-EPR氧气图像。显示了在3、18和27分钟时获得的三个代表性图像。在肿瘤(1和2)和pO中选择了两个ROI2在ROI中评估超过30分钟。B)ROI 1(开环)表示慢性缺氧区域;然而,ROI 2(闭圈)代表一个循环缺氧区域,显示pO的时间波动2.C)时间平均pO2pO图(左)和标准差图2(右)根据30分钟时间窗口内拍摄的10幅图像计算。有关用于成像的典型实验条件,请参阅参考文献22和23.
基于EPRI的方法,同时能够监测pO22–3分钟时间分辨率的波动,可以以约1–2毫米的空间分辨率在三维范围内对肿瘤进行全面评估。可以直接测量自发的近实时循环缺氧,而无需使用实验性强制循环缺氧。利用EPRI,我们最近的研究表明,pO的波动幅度2在自发循环中,肿瘤中的缺氧与肿瘤血管的成熟有关(22). 这一结果需要对不同类型的肿瘤进行进一步研究,但表明EPRI可以有效地无创地检测循环性缺氧,并基于先前报告中研究所得的丰富信息(2,8,11–14,16,17,19,24,25).
未来发展方向
最近的数据表明肿瘤pO的波动2通过产生具有转移潜能的侵袭性肿瘤细胞表型,可以对放射治疗产生耐药性。肿瘤血管内皮细胞中也可以启动缺氧介导的促生存循环途径,进一步导致治疗抵抗(8,17). 循环性肿瘤缺氧如何影响化疗、分子靶向或免疫导向治疗尚不清楚,但迄今为止的研究表明,这在治疗反应中非常重要。
具有无创、时间性评估肿瘤pO的能力2由EPRI提供,可以通过使用图像引导的活检来评估在经历循环和/或慢性缺氧的肿瘤的微区域中HIF-1α的诱导和由HIF-1α调节的下游基因。此外,随着HIF-1α抑制剂的开发用于癌症治疗,EPRI可用于肿瘤pO的纵向监测2以及对应治疗的时间波动。同样,基于EPRI的pO2评估可以很容易地与其他磁共振技术联系起来,以进一步研究肿瘤生理学。例如,磁共振波谱(MRS)等非侵入性方法可以对肿瘤的微区域进行生物化学评估,已经提供了与生物化学变化及其与治疗反应的关系相关的重要信息(26). 此外,基于MRI的分子成像技术现在可以通过跟踪超极化丙酮酸的代谢物来评估肿瘤/正常组织的代谢情况(27). 这些基于MR的图像可以很容易地与ERPI生成的pO叠加2建立组织pO之间联系的地图2和新陈代谢。EPRI pO公司2评估,再加上基于MR的代谢图像,可以与调强放射治疗的治疗计划相结合,以增加肿瘤循环和/或慢性缺氧区域的辐射剂量。然后,肿瘤放射“剂量画”的概念可以基于个体肿瘤的动态生理学,目的是改善治疗结果。基于EPRI的pO的监测功能也可能有助于疾病或障碍的治疗或诊断2评估包括心血管疾病、糖尿病继发疾病和炎症相关疾病。
工具书类
-
1Vaupel P,Mayer A.癌症中的缺氧:意义和对临床结果的影响。癌症转移2007年修订版;26:225–39. doi:10.1007/s10555-007-9055-1。[内政部] [公共医学] [谷歌学者]
-
2Dewhirst MW。循环缺氧、HIF-1、血管生成和氧化应激之间的关系。辐射研究2009;172:653–65. doi:10.1667/RR1926.1。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
三。Jain RK。肿瘤血管生成和可及性:血管内皮生长因子的作用。塞明·昂科尔。2002;29:3–9. doi:10.1053/son.2002.37265。[内政部] [公共医学] [谷歌学者]
-
4.汤姆林森右侧,灰色左侧。一些人类肺癌的组织结构及其对放射治疗的可能影响。英国癌症杂志。1955;9:539–49. doi:10.1038/bjc.1955.55。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
5Powers WE,托尔马赫LJ。通过照射后存活的体内试验证明小鼠肿瘤细胞群中的缺氧成分。放射科。1964;83:328–36. doi:10.1148/83.2328。[内政部] [公共医学] [谷歌学者]
-
6Gatenby RA、Coia LR、Richter MP等。人类肿瘤中的氧张力:使用CT引导探针进行体内定位。放射科。1985;156:211–4. doi:10.1148/radiology.156.1.4001408。[内政部] [公共医学] [谷歌学者]
-
7Dewhirst MW。间歇性低氧进一步说明了低氧诱导因子-1靶向的原理。癌症研究2007;67:854–5. doi:10.1158/0008-5472.CAN-06-4744。[内政部] [公共医学] [谷歌学者]
-
8Martinive P,Defresne F,Bouzin C等。间歇性缺氧对肿瘤血管系统和肿瘤细胞的预处理:对抗癌治疗的启示。2006年癌症研究;66:11736–44. doi:10.1158/0008-5472.CAN-06-256。[内政部] [公共医学] [谷歌学者]
-
9Brown JM。小鼠肿瘤中急性缺氧细胞的证据,以及可能的复氧机制。英国无线电杂志。1979;52:650–6. doi:10.1259/0007-1285-52-620-650。[内政部] [公共医学] [谷歌学者]
-
10Yamura H,Matsuzawa T.照射后肿瘤再生;实验方法。国际放射生物学与化学医学研究杂志,1979年;35:201–19. doi:10.1080/09553007914550241。[内政部] [公共医学] [谷歌学者]
-
11卓别林·DJ,奥利夫·PL,杜兰德·RE。小鼠肿瘤中的间歇性血流:放射生物学效应。1987年癌症研究;47:597–601.[公共医学] [谷歌学者]
-
12Kimura H、Braun RD、Ong ET等。肿瘤微血管中红细胞流量的波动可导致肿瘤实质的短暂缺氧和复氧。1996年癌症研究;56:5522–8.[公共医学] [谷歌学者]
-
13.Cardenas-Navia LI、Mace D、Richardson RA等。肿瘤中普遍存在的氧合波动。癌症研究2008;68:5812–9. doi:10.1158/0008-5472.CAN-07-6387。[内政部] [公共医学] [谷歌学者]
-
14Dewhirst MW,Cao Y,Moeller B.循环缺氧和自由基调节血管生成和放射治疗反应。Nat Rev癌症。2008;8:425–37. doi:10.1038/nrc2397。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
15.Cairns RA、Kalliomaki T、Hill RP。急性(周期性)缺氧增强KHT小鼠肿瘤的自发转移。2001年癌症研究;61:8903–8.[公共医学] [谷歌学者]
-
16Moeller BJ,Cao Y,Li CY,Dewhirst MW。辐射激活HIF-1以调节肿瘤中的血管放射敏感性:复氧、自由基和应激颗粒的作用。癌细胞。2004;5:429–41. doi:10.1016/s1535-6108(04)00115-1。[内政部] [公共医学] [谷歌学者]
-
17Moeller BJ,Dreher MR,Rabbani ZN,等。HIF-1阻断对肿瘤放射敏感性的多效作用。癌细胞。2005;8:99–110. doi:10.1016/j.ccr.2005.06.016。[内政部] [公共医学] [谷歌学者]
-
18用于癌症治疗的HIF-1抑制剂:从基因表达到药物发现。当前药物设计。2009;15:3839–43. doi:10.2174/138161209789649402。[内政部] [公共医学] [谷歌学者]
-
19Baudelet C,Ansiaux R,Jordan BF,等。使用T2*加权梯度回波成像在小鼠实体瘤中的生理噪声:肿瘤急性缺氧的标志物?物理医学生物学。2004;49:3389–411. doi:10.1088/0031-9155/49/15/006。[内政部] [公共医学] [谷歌学者]
-
20Lee N,Nehmeh S,Schoder H等。结合治疗前/治疗中期[18F]-咪唑正电子发射断层扫描的前瞻性试验,用于同时接受放化疗的头颈癌患者。国际放射肿瘤生物学杂志。2009;75:101–8. doi:10.1016/j.ijrobp.2008.10.49。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
21Bennewith KL、Raleigh JA、Durand RE。口服吡莫尼唑标记缺氧肿瘤细胞。2002年癌症研究;62:6827–30.[公共医学] [谷歌学者]
-
22Yasui H、Matsumoto S、Devasahayam N等。低场磁共振成像对荷瘤小鼠慢性和循环缺氧的可视化。癌症研究2010 doi:10.1158/0008-5472.CAN-10-1350。新闻界。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
23Matsumoto S、Hyodo F、Subramanian S等。小鼠肿瘤氧合和糖酵解活性的低场顺磁共振成像。临床投资杂志。2008;118:1965–73. doi:10.1172/JCI34928。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
24Bennewith KL,Durand RE。用流式细胞术定量人类肿瘤异种移植物中的短暂缺氧。癌症研究2004;64:6183–9. doi:10.1158/0008-5472.CAN-04-0289。[内政部] [公共医学] [谷歌学者]
-
25Lanzen J、Braun RD、Klitzman B等。实验性肿瘤血管外室内氧浓度不稳定性的直接证明。2006年癌症研究;66:2219–23. doi:10.1158/0008-5472.CAN-03-2958。[内政部] [公共医学] [谷歌学者]
-
26Kurhanewicz J、Swanson MG、Nelson SJ、Vigneron DB。磁共振成像和光谱成像相结合的方法用于前列腺癌的分子成像。J Magn Reson成像。2002;16:451–63. doi:10.1002/jmri.10172。[内政部] [PMC免费文章] [公共医学] [谷歌学者]
-
27.Golman K、Zandt RI、Lerche M、Pehrson R、Ardenkjaer-Larsen JH。超极化13C磁共振成像代谢成像在体内肿瘤诊断中的应用。2006年癌症研究;66:10855–60. doi:10.1158/0008-5472.CAN-06-2564。[内政部] [公共医学] [谷歌学者]



