摘要 在人类神经母细胞瘤中 MYCN公司 该基因预测预后不良和对治疗的抵抗。 由于低氧主要通过两种结构相关的低氧诱导因子HIF-1α和HIF-2α促进侵袭性肿瘤表型,因此我们检测了低氧对肿瘤细胞的影响 MYCN公司 扩增的神经母细胞瘤细胞。 我们在这里证明HIF-1α,而不是HIF-2α,优先在两者中表达 MYCN公司 扩增的神经母细胞瘤细胞和原发性肿瘤与未扩增样本的比较 MYCN公司 放大。 我们的结果表明,N-Myc和HIF-1α之间的相互作用在神经母细胞瘤中起着关键作用。 例如,高水平的N-Myc可以覆盖HIF-1α对细胞周期进程的抑制,使细胞在缺氧条件下继续增殖。 此外,HIF-1α和N-Myc通过激活多个糖酵解基因的转录,对神经母细胞瘤的Warburg效应(需氧糖酵解法)至关重要。 值得注意的是,磷酸甘油酸激酶1的表达( PGK1系列 ),己糖激酶2( 香港2号 )和乳酸脱氢酶A( LDHA公司 ),分别显著高于 MYCN公司 扩增的神经母细胞瘤与未扩增的肿瘤的比较 MYCN公司 放大。 有趣的是, MYCN公司 扩增后的神经母细胞瘤细胞对LDHA酶活性“上瘾”,因为其耗竭完全抑制肿瘤发生 体内 因此,我们的结果提供了机制性见解,解释了 MYCN公司 扩增的神经母细胞瘤细胞与缺氧应激作斗争,矛盾的是,缺氧如何通过N-Myc和HIF-1α的组合作用导致神经母细胞瘤的侵袭性。 这些结果还表明,LDHA是神经母细胞瘤治疗的一个新的、药理学上易于控制的靶点。
关键词: N-Myc、缺氧诱导因子、神经母细胞瘤、肿瘤发生、Warburg效应
介绍 神经母细胞瘤是婴幼儿最常见的实体瘤之一( 1 ). 预后不良的危险因素包括诊断时年龄>18个月、不良组织学分级以及 MYCN公司 放大( 1 , 2 ). 最近的研究表明间变性淋巴瘤激酶的突变( ALK公司 )基因导致家族性神经母细胞瘤,而一些常见的多态性,如BRCA1相关环域-1中的多态性( 钢筋1 )基因,影响神经母细胞瘤易感性( 三 , 4 ). 然而, MYCN公司 扩增仍然是最重要和最可靠的致癌标志物,与疾病晚期和生存率低下密切相关。 MYCN公司 扩增发生在20-25%的患者中,并且始终与高水平的N-Myc蛋白相关( 1 )可能直接影响肿瘤细胞的行为( 5 ). 据推测,N-Myc通过调节和/或与其他致癌途径合作促进神经母细胞瘤肿瘤进展。 然而,这些途径的确切性质在很大程度上仍不清楚。
低氧是实体瘤的常见特征,可导致侵袭性肿瘤表型。 在O的自适应响应中 2 剥夺后,细胞主要通过激活缺氧诱导因子(HIF)-1α和HIF-2α来改变其基因表达( 6 ). HIF作为异二聚体发挥作用,其中O 2 -不稳定的α亚单位与稳定的β亚单位(也称为ARNT)形成二聚体复合物,并激活编码血管生成、代谢和转移因子的基因的转录( 6 ). 众所周知,HIF-1α和HIF-2α具有共同和独特的靶基因( 7 – 9 ). 虽然HIF-α亚单位共同调节参与血管生成和转移的基因( 8 ),HIF-1α选择性激活参与糖酵解和表观遗传学的基因,而HIF-2α刺激 10月4日 和促红细胞生成素( 欧洲专利局 )表达式( 7 , 10 – 12 ). 有趣的是,对25500多个人类基因启动子中HIF-1α和HIF-2α结合位点的全基因组分析表明,尽管这两种HIF-α亚型的结合有很大程度的重叠,但HIF-1和HIF-1( 13 ),进一步强调HIF-α在缺氧适应中的独特作用( 13 , 14 ).
MYC公司 在许多类型的人类癌症中,家族基因经常失调。 While期间 C-MYC公司 在多种人类肿瘤中表达, MYCN公司 表达主要局限于来自神经系统的肿瘤,如神经母细胞瘤( 15 ). 当Myc与其伙伴Max形成二元复合物时,Myc激活参与细胞增殖、血管生成、凋亡和代谢的靶基因的转录( 15 ). c-Myc和HIF通路之间的“串扰”已被明确记录,但它非常复杂,取决于细胞类型和Myc蛋白水平( 16 ). 作为对缺氧的反应,由于HIF-1α介导的c-Myc活性抑制,细胞增殖通过增加p21和p27的表达和减少cyclin D2和E2F1的表达而降低( 17 , 18 ). 与HIF-1α直接相反,HIF-2α似乎增强了透明细胞肾癌细胞(ccRCCs)和原发性肿瘤的c-Myc活性( 18 , 19 ). 然而,在c-Myc过度表达的Burkitt淋巴瘤细胞中,HIF-1α实际上与c-Myc合作,而不是拮抗c-Myc,选择性增强己糖激酶2的表达( 香港2号 ),丙酮酸脱氢酶激酶1( PDK1系列 )和血管内皮生长因子( 血管内皮生长因子 ) ( 20 ). 似乎特定的靶基因启动子、细胞类型和缺氧条件决定了HIF-1α和HIF-2α参与c-Myc途径的方式,从而导致靶基因表达增加或减少。 HIF-α/c-Myc相互作用的复杂性提出了重要问题:涉及HIF-α/c-Myc的机制是否适用于其他肿瘤微环境,包括神经母细胞瘤? 之前的一项研究表明,N-Myc和c-Myc只共享大约40%的目标基因( 21 ); 因此,HIF-1α和HIF-2α是否使用类似机制与其他Myc家族成员(如N-Myc)相互作用?
HIF-2α以前被认为与促进侵袭性神经母细胞瘤表型有关( 22 – 24 )HIF-2α(而非HIF-1α)与不良临床结局相关( 24 ). 这些研究强调了区分HIF-1α和HIF-2α表达的重要性 体内 然而,HIF-α对Myc的影响没有得到解决,神经母细胞瘤也没有根据 MYCN公司 放大状态。 为了研究HIF-α和N-Myc如何调节神经母细胞瘤的进展,我们系统地分析了HIF-1α和HIF-2α的表达动态,并随后评估了HIF- 在体外 和 体内 有趣的是,我们发现HIF-1α,而不是HIF-2α,优先表达于两者 MYCN公司 扩增的神经母细胞瘤细胞和原发肿瘤与非扩增样本的比较。 我们的数据表明,神经母细胞瘤可以根据Myc和HIF-α的表达模式分为两组,N-Myc/HIF-1α协同表达 MYCN公司 扩增的神经母细胞瘤,而c-Myc/HIF-2α似乎在 MYCN公司 单拷贝肿瘤。 我们的数据还表明,靶向肿瘤代谢的小分子可能是神经母细胞瘤患者的一种有希望且有效的治疗方法。 此外,本研究结合先前关于伯基特淋巴瘤的报告( 20 ),证明 MYC公司 家族基因和HIF-1α可能在人类肿瘤进展中起着全球作用。
材料和方法 细胞培养 HCT116细胞保存在含有10%FBS的DMEM培养基中,所有神经母细胞瘤细胞均保存在含有10%FBS的RPMI培养基中。缺氧处理时,细胞在缺氧工作站(Ruskin Technologies)中培养,温度为1.5%O 2 .
细胞周期分析 分析前,HCT116或LAN5细胞在常氧或缺氧条件下培养48小时。 在使用10µM BrdU脉冲30分钟后,按照标准方案(Becton Dickinson)进行BrdU掺入。 用Alexa 488抗BrdU(Invitrogen)和0.1M碘化丙啶对细胞进行染色,并在LSR FACS机器(Becton Dickinson)中进行分析。
QRT-PCR 按照制造商的说明,使用Trizol试剂从细胞中提取总RNA(Invitrogen)。 使用Superscript II(Invitrogen)和随机六聚体引物(Boehringer Mannheim)从1µg RNA中产生cDNA。 在7900HT序列检测系统中,使用特定的Taqman引物(Applied Biosystems)对基因表达进行分析。
shRNA分析 从Open Biosystems获得针对人类HIF-1α、N-Myc和LDHA的特异性shRNA或对照shRNA。 病毒转导后,用嘌呤霉素(Sigma)筛选细胞。
染色质免疫沉淀(ChIP)、免疫沉淀(IP)和蛋白质印迹分析 ChIP按照Upstate Biotech的标准方案进行。 对于IP分析,细胞在25 mM Tris(pH 8.0)、100 mM NaCl和含有完整蛋白酶抑制剂(Roche)和200µM DFX的1%Triton X-100中溶解。 对于所有其他Western blot,细胞在RIPA中溶解,每个blot使用50µg总细胞蛋白。 抗体使用如下:人HIF-1α(BD,Biosciences)、人HIF-2α(Novus NB 100–122)、肌动蛋白(Sigma AC-15)、c-Myc(Santa Cruz N-262和c-33)和N-Myc(圣克鲁斯B8.4.B)。
异种移植瘤 在雌性BALB/C裸鼠(Charles River)两侧皮下注射300万个Kelly细胞(对照细胞或LDHA shRNA),稀释在含有50%基质凝胶的200µl PBS中(BD Bioscience)。 牺牲时测量肿瘤重量。
免疫组织化学 原发性神经母细胞瘤的切片在二甲苯中脱蜡,并在分级酒精中再水化。 内源性过氧化物酶活性被3%的过氧化氢阻断20分钟。 将载玻片与HIF-1α抗体(Labvision HIF-1A67)和HIF-2α抗体(新生兔多克隆)在4℃孵育过夜。 其余步骤是使用DAKO CSA工具包执行的。 取肾透明细胞癌切片作为HIF-α染色对照。
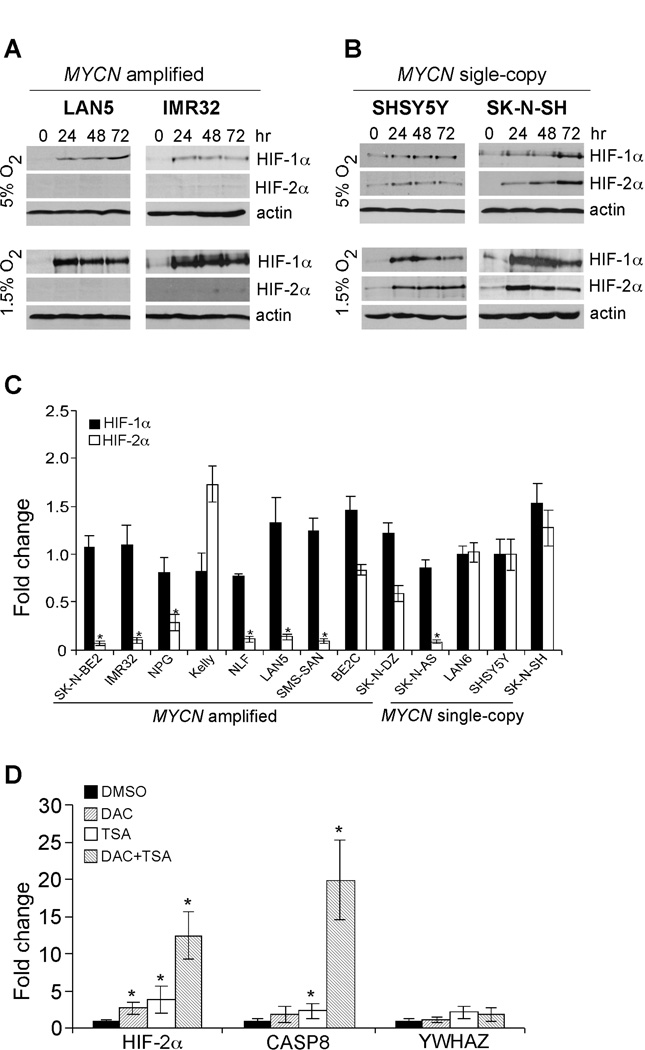
结果 HIF-1α而非HIF-2α优先在晚期表达, MYCN公司 扩增的神经母细胞瘤细胞 在神经母细胞瘤细胞中,HIF-2α在生理氧条件下选择性稳定 2 条件(5%O 2 )并控制慢性缺氧下的长期缺氧适应( 22 ). 为了评估HIF-α(HIF-1α和HIF-2α)与N-Myc之间的功能性相互作用,我们首先检测了两个组织中HIF- MYCN公司 在5%O培养的扩增细胞系(LAN5和IMR32) 2 和1.5%O 2 ,分别在不同的时间点。 我们还检测了两组患者的HIF-α水平 MYCN公司 单拷贝细胞系(SHSY5Y和SK-N-SH)。 有趣的是,不像 MYCN公司 表达HIF-1α和HIF-2α的单拷贝细胞( 图1B ),两个 MYCN公司 扩增细胞系选择性表达HIF-1α( 图1A ). 我们在一系列研究中扩展了HIF-α表达的研究 MYCN公司 5%氧浓度下的扩增和单拷贝细胞系 2 ( 图S1 ). HIF-1α选择性表达于 MYCN公司 扩增细胞,凯利细胞系是唯一的例外。 然后我们将神经母细胞瘤细胞系暴露于1.5%的O 2 分别持续24、48和72小时。 我们再次在所有测试细胞系中检测到大量HIF-1α蛋白( 图1A、1B 和 S2系列 ); 然而,HIF-2α在大多数 MYCN公司 扩增细胞系。 此外,在这些条件下,单拷贝系SK-N-AS也表现出无法检测到的HIF-2α表达。 因此,大多数人缺乏可检测的HIF-2α表达 MYCN公司 扩增细胞和SK-N-AS细胞在很大程度上独立于O 2 浓度。 与之前的研究相比,HIF-1α衰变时,HIF-2α水平保持较高( 22 ),我们发现在大多数细胞系中,慢性低氧应激以相似的动力学破坏了HIF-α蛋白的稳定性( 图1A、1B 和 S2系列 ). 为了支持我们的数据,最近的几项研究也独立地证明,慢性缺氧导致HIF-1α和HIF-2α降解,在其他情况下具有类似的动力学( 25 – 27 )表明慢性缺氧期间HIF-α亚型的失稳是一种普遍的适应机制。
图1。 MYCN公司 扩增的神经母细胞瘤细胞优先表达HIF-1α。
(A) 5%O培养不同时间点LAN5和IMR32细胞HIF-α表达的Western blot分析 2 和1.5%O 2 条件。 β-actin作为负荷对照。
(B) 5%O培养不同时间点SHSY5Y和SK-N-SH细胞HIF-α表达的Western blot分析 2 和1.5%O 2 条件。 β-actin作为负荷对照。
(C) 缺氧诱导因子-α在不同神经母细胞瘤细胞系中的表达。 将SHSY5Y细胞中HIF-1α或HIF-2α的mRNA水平任意设置为1,并计算其余细胞系的相对表达,如图所示。 数据以三倍平均数表示,并归一化为β-肌动蛋白mRNA。*p<0.001。
(D) 协同调节 HIF-2A型 通过DNA甲基化和组蛋白去乙酰化表达 MYCN公司 放大的细胞。 用载体或3µM DAC、500 nM TSA以及DAC和TSA组合处理LAN5细胞。 CASP8公司 和 YWHAZ公司 分别作为阳性对照和阴性对照。 数据以三份的平均数表示* p<0.01。
HIF-1α稳定,而HIF-2α在大多数低氧状态下不稳定 MYCN公司 扩增的细胞表明HIF-2α的表达在转录水平上被特异性沉默。 为了研究相关的潜在机制,我们定量了13个神经母细胞瘤细胞系中HIF-1α和HIF-2αmRNA的丰度,9 MYCN公司 正常氧条件下扩增和4个单拷贝。 我们选择单拷贝细胞系SHSY5Y作为对照,因为该细胞系在缺氧条件下表现出丰富的HIF-1α和HIF-2α表达。 用QRT-PCR分析其他神经母细胞瘤细胞中HIF-1α和HIF-2αmRNA的相对水平。 与蛋白表达模式一致,HIF-1αmRNA丰度在所有受试细胞系中没有显著差异; 然而,大多数人的HIF-2α水平显著降低 MYCN公司 扩增细胞和单拷贝细胞系SK-N-AS表明HIF-2α表达缺乏是由于基础mRNA水平低( 图1C ). 由于目前可用的所有神经母细胞瘤细胞系均来自高危肿瘤,因此我们无法比较细胞系中不同风险组HIF-α的相对mRNA水平。 因此,我们分析了101例从低风险到高风险的原发性神经母细胞瘤肿瘤的微阵列数据( 图S3 ). 有趣的是,HIF-1α的表达在 MYCN公司 放大组与 MYCN公司 单拷贝低风险肿瘤(p=0.0201),而HIF-2α在 MYCN公司 肿瘤扩大(p=0.0611)。
基因功能经常被表观遗传改变所破坏。 确定是否 高频2a 在表观遗传学沉默的情况下,我们给LAN5细胞注射了两种影响染色质结构的不同化学物质,甲基转移酶抑制剂5-氮杂-2’-脱氧胞苷(DAC)和组蛋白脱乙酰化酶抑制剂曲古菌素a(TSA),在这些细胞中HIF-2α表达基本缺失( 图1D ). 编码Caspase 8的基因( CASP8公司 )和酪氨酸3-单氧化酶/色氨酸5-单氧化酶激活蛋白、zeta多肽( YWHAZ公司 )作为对照 CASP8公司 在大多数情况下都是沉默的 MYCN公司 通过DNA甲基化和组蛋白去乙酰化机制扩增细胞( 28 ),同时 YWHAZ公司 是一种组成型表达的“持家”基因。 有趣的是,DAC或TSA均显著增加了两者的表达 高频2a 和 CASP8公司 这两种化学物质的结合导致mRNA水平进一步增加( 图1D ). 值得注意的是, YWHAZ公司 这些治疗的表达基本上没有变化,反对增加 高频2a 表达是由于转录的整体激活。 相反,这些数据表明 MYCN公司 扩增细胞、DNA甲基化和组蛋白去乙酰化协同作用沉默 高频2a 转录。
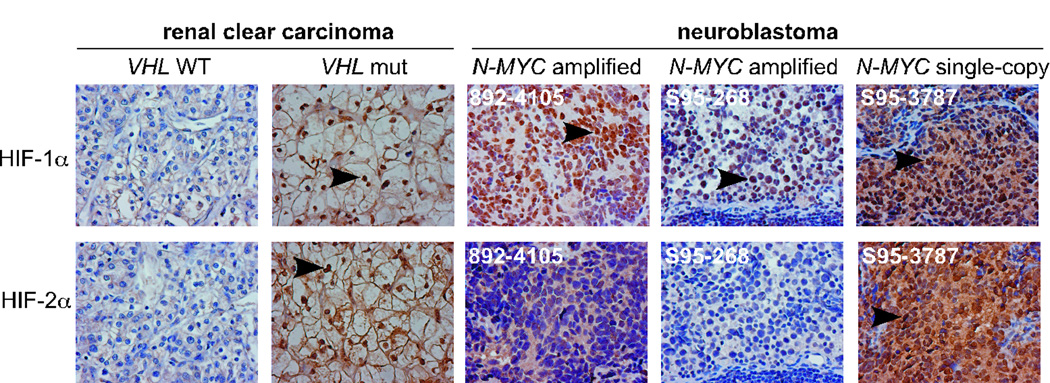
HIF-1α,而不是HIF-2α,优先表达于原代 MYCN公司 放大的神经母细胞瘤肿瘤 为了证实我们的观察结果代表了人类神经母细胞瘤中天然存在的HIF-α状态,我们通过免疫化学分析了原发性神经母细胞肿瘤中HIF-β的表达。 我们首先评估了抗体在透明细胞肾癌(ccRCC)中的特异性和疗效。 VHL(甚高频) ccRCC的突变导致HIF-1α和/或HIF-2α的结构稳定( 图2 和参考 14 ). 然后我们分析了15例神经母细胞瘤肿瘤(13例)的HIF-α水平 MYCN公司 放大和2份单拷贝)( 图2 和 补充表1 ). 同样,HIF-1α优先表达于 MYCN公司 扩增的肿瘤。 HIF-2α分布于细胞质和细胞核,而HIF-1α主要分布于细胞核( 图2 和数据未显示)。 综上所述,这些数据表明HIF-1α而非HIF-2α是参与缺氧适应的主要HIF-α亚单位 MYCN公司 肿瘤放大。
图2。 MYCN公司 扩增的神经母细胞瘤肿瘤优先表达HIF-1α。
神经母细胞瘤肿瘤的代表性HIF-α免疫化学染色。 肾透明细胞癌作为特异性HIF-α染色的对照。 放大倍数:400×。 箭头表示细胞核HIF-α染色阳性。
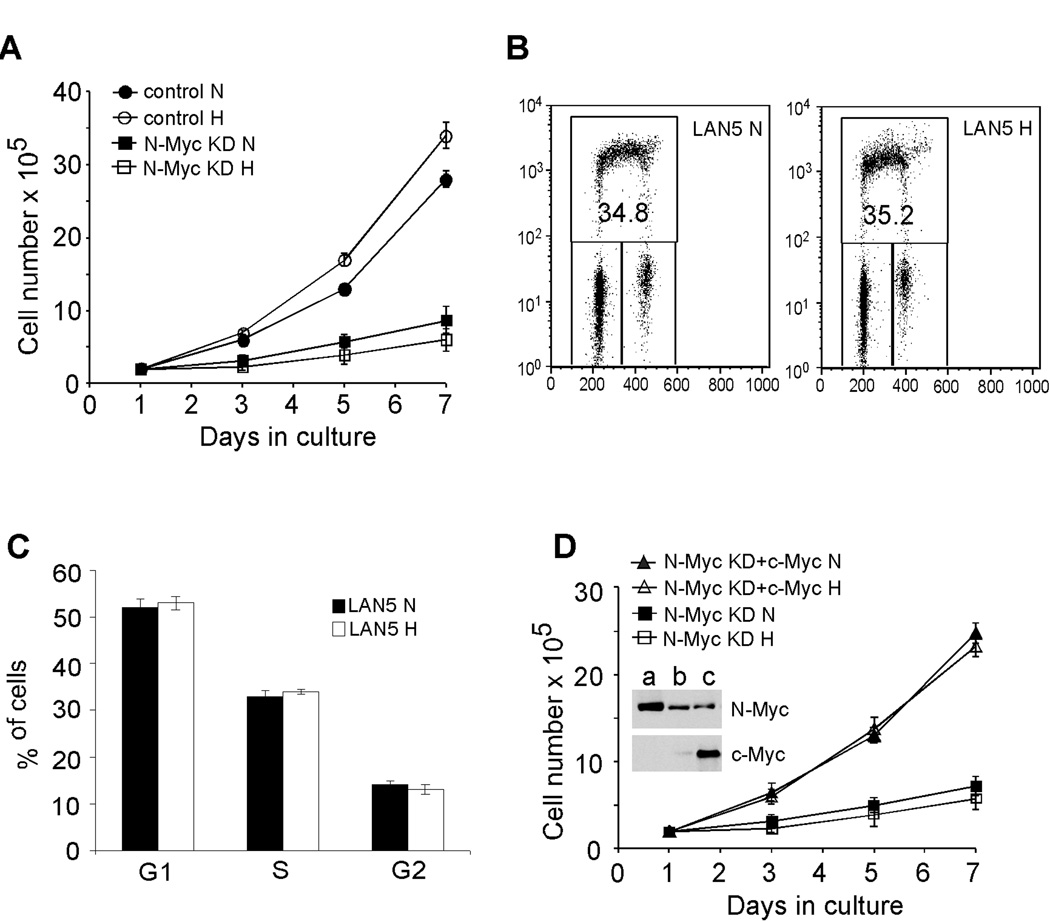
扩散 MYCN公司 扩增的神经母细胞瘤细胞 在体外 自相矛盾的是,在缺氧条件下未发生变化 中度缺氧(约1.5%O 2 )通过HIF-1α介导的c-Myc活性抑制增殖( 17 , 18 ). 作为 MYCN公司 扩增后的细胞优先表达HIF-1α,我们检测了这些细胞对O 2 剥夺。 有趣的是,我们观察到在1.5%的氧浓度下培养时,LAN5细胞的增殖没有明显变化 2 ( 图3A )或0.5%O 2 ( 图S4D ). 我们进一步分析了另外三个 MYCN公司 扩增细胞系,发现细胞数量并没有因低O而减少 2 ( 图S4A–C ). 重要的是, MYCN公司 扩增的神经母细胞瘤细胞高度依赖N-Myc活性,因为在常氧或缺氧条件下,N-Myc表达的缺失会显著降低其增殖( 图3A ). 然后我们通过BrdU掺入评估LAN5细胞的细胞周期进展。 LAN5细胞G1期或S期均无明显变化( 图3B和3C )与通过连续细胞计数测量的细胞增殖相一致( 图3A ). 此外,c-Myc的过度表达挽救了N-Myc缺失的LAN5细胞的增殖( 图3D ),确认 MYCN公司 扩增的神经母细胞瘤细胞依赖于Myc活性来抵消缺氧对细胞增殖的抑制。
图3。 扩散 MYCN公司 扩增的神经母细胞瘤细胞在缺氧条件下维持。
(A) 在21%O下通过连续细胞计数测量的对照组和N-Myc敲低LAN5细胞在七天内的生长 2 (N) 和1.5%O 2 (H) ●●●●。
(B) 在21%O下生长的LAN5细胞的代表性FACS图 2 (N) 和1.5%O 2 (H) 48小时。
(C) 缺氧48小时后LAN5细胞中BrdU掺入变化总结。 结果是3个独立实验的平均值。
(D) c-Myc的过度表达挽救了N-Myc击倒LAN5细胞的增殖。 插图:a)LAN5细胞; b) N-Myc击倒LAN5细胞; c) N-Myc通过c-Myc过度表达击倒LAN5细胞。
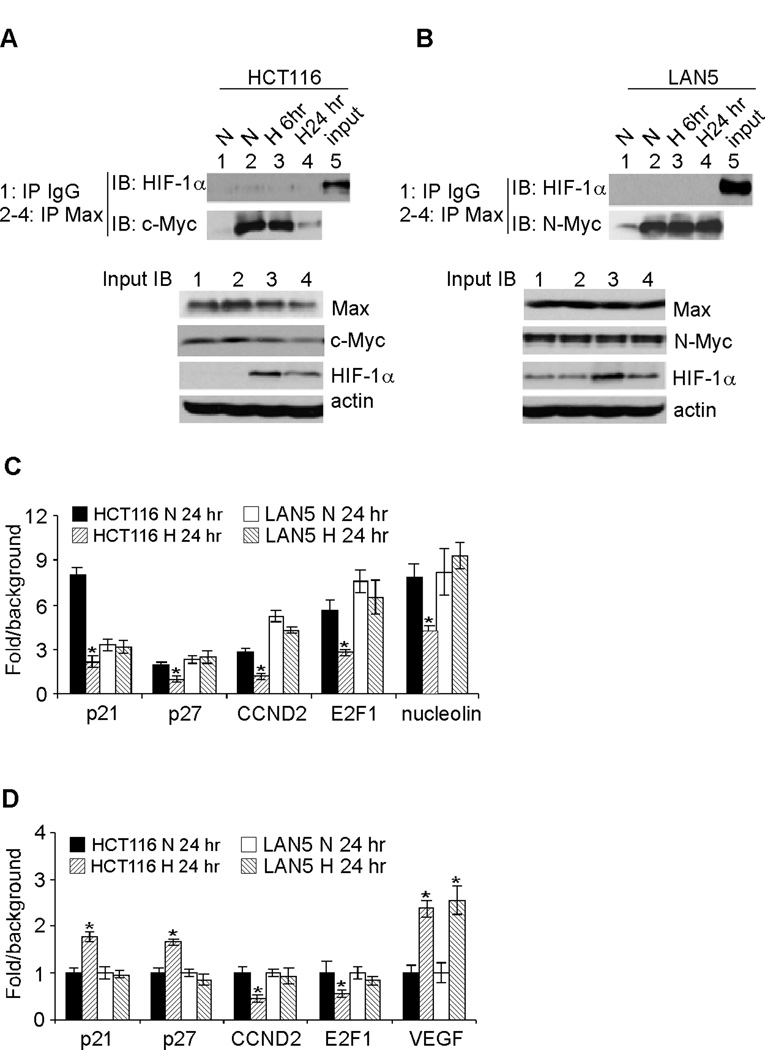
N-Myc替代缺氧条件下HIF-1α对细胞周期进程的抑制 我们假设高水平的N-Myc可以抵消HIF-1α对细胞增殖的抑制。 基于这一推理,我们检查了Myc与其结合伙伴Max之间的相互作用。我们选择HCT116结肠癌细胞进行比较,因为之前已经确定HCT116细胞增殖受缺氧抑制( 17 , 18 ). 此外,缺氧的HCT116细胞可重复地表现出Myc活性降低和Myc/Max相互作用( 17 , 18 ). 注意,HCT116细胞表达c-Myc,而LAN5细胞仅表达N-Myc。 我们使用针对Max的抗体通过免疫沉淀法检测到Myc(c-Myc或N-Myc)与其伴侣Max的特异性结合( 图4A和B ,将通道2与IP面板中的通道1进行比较)。 在HCT116细胞中,慢性缺氧显著降低c-Myc和Max之间的相互作用( 图4A ,将通道4与IP面板中的通道2–3进行比较)。 相反,缺氧24小时后,LAN5细胞中N-Myc与Max的相互作用没有明显变化( 图4B ,将通道4与IP面板中的通道2–3进行比较)。 我们没有观察到HIF-1α和Max之间可检测到的相互作用( 图4A和B )作为Max-specific抗体,在HCT116或LAN5细胞中有效共沉淀Myc(c-Myc或N-Myc),而不是HIF-1α。 未能检测到Max/HIF-1α相互作用并不是因为细胞裂解物中缺乏HIF-1β蛋白( 图4A和B ,输入面板)。 此外,使用HIF-1α特异性抗体的双向免疫沉淀也未能降低Max; 相反,大量HIF-1β(HIF-1α的结合伙伴)被共沉淀(数据未显示)。 我们也无法使用内源性或 在体外 翻译蛋白(数据未显示)。 这些数据表明,HIF-1α直接破坏Myc/Max相互作用在神经母细胞瘤细胞中不太可能发生,如ccRRC所示( 18 ). 相反,慢性缺氧降低了c-Myc蛋白的丰度( 图4A ,比较输入面板中的泳道2、3和4),而N-Myc的泳道没有明显变化( 图4B ,比较输入面板中的通道2、3和4)。 值得注意的是,Myc丰度的变化与Myc/Max相互作用的变化相关,表明Myc蛋白水平 就其本身而言 测定了缺氧结肠癌和神经母细胞瘤细胞中Myc/Max复合物的化学计量。
图4。 生长于21%O的LAN5和HCT116细胞中Myc/Max相互作用的变化及其对靶基因表达的影响 2 (N) 和1.5%O 2 (H) ●●●●。
将不同时间点的HCT116(A)和LAN5(B)细胞裂解物与Max抗体共沉淀,并对特异性c-Myc、N-Myc和HIF-1α抗体进行免疫印迹。
(C) 通过ChIP分析分析Myc(C-Myc或N-Myc)与靶启动子的结合。 HCT116和LAN5细胞在21%O下生长 2 (N) 和1.5%O 2 (H) 24小时,然后用特异性Myc抗体或同型对照IgG通过ChIP进行分析。 图表显示了Myc IP和IgG对照(背景)之间的倍数差异,以及从三次检测中获得的结果* p<0.01。
(D) 参与细胞周期进展的Myc靶点的表达。 HCT116和LAN5细胞在21%O下生长 2 (N) 和1.5%O 2 (H) 24小时,用QRT-PCR分析相关基因表达。 结果是三倍的平均值* p<0.01。
确认这些 在体外 结果反映了情况 体内 ,我们通过ChIP分析评估目标基因启动子的Myc占有率,并通过QRT-PCR定量相对结合。 一贯地,HCT116细胞中c-Myc与靶基因启动子的结合在缺氧6小时时没有明显变化(数据未显示),但在24小时时显著降低( 图4C ). 相反,缺氧在任一时间点都不能降低N-Myc与靶基因启动子的结合( 图4C 和数据未显示)。 接下来,我们测试了参与细胞周期进展的Myc靶点的缺氧调节:p21和p27(被Myc抑制),以及E2F1和cyclin D2(被Myc激活)。 在上述条件下,我们观察到缺氧HCT116细胞在24小时时p21和p27 mRNA表达增加,细胞周期蛋白D2和E2F1 mRNA水平降低( 图4D ). 当测试相同的靶基因时,缺氧LAN5细胞的mRNA丰度没有检测到变化( 图4D ). 作为阳性对照,缺氧显著增加了两种细胞系中VEGF的表达( 图4D ). 综上所述,这些结果提供了新的机制见解,解释了 MYCN公司 扩增后的神经母细胞瘤细胞在缺氧应激下生长旺盛。
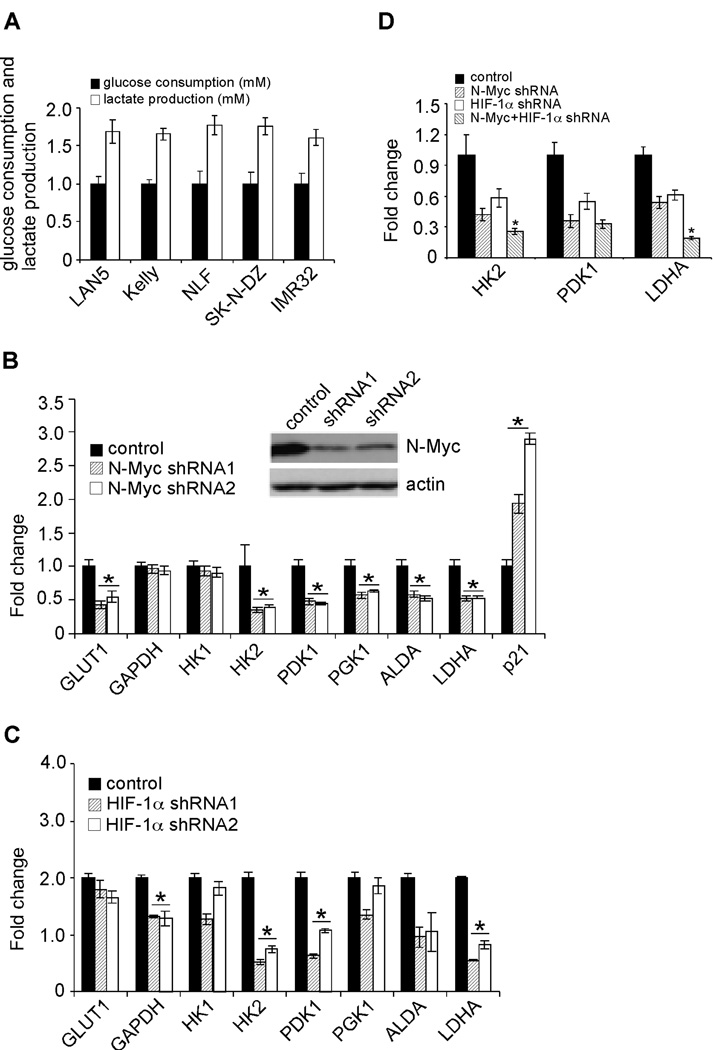
N-Myc和HIF-1α调节神经母细胞瘤的Warburg效应 与所有实体瘤一样,神经母细胞瘤必须满足特定的代谢要求,才能促进其失调的生长和侵袭周围组织。 当O 2 是丰富的,分化细胞主要通过氧化磷酸化从葡萄糖中提取能量,而大多数(60-70%)肿瘤细胞更贪婪地消耗葡萄糖,将其转化为乳酸( 29 , 30 ). 这种长期观察到的现象称为有氧糖酵解(Warburg效应)。 调查是否 MYCN公司 扩增的神经母细胞瘤细胞表现出Warburg表型,我们测量了5个细胞系在21%O 2 ( 图5A ). 所有细胞系主要表现出糖酵解代谢,因为每消耗一个葡萄糖分子,它们平均释放1.6个乳酸分子。
图5。 N-Myc和HIF-1α有助于 MYCN公司 扩增的神经母细胞瘤细胞。
(A) MYCN公司 扩增的神经母细胞瘤细胞表现出Warburg表型。 在常氧下培养24小时的LAN5、Kelly、NLF、SK-N-DZ和IMR32细胞的葡萄糖消耗量和乳酸生成量。数据从三倍中取平均值。
(B) N-Myc调节参与糖酵解的特定基因的表达。 在LAN5细胞中,N-Myc被对照或特异性shRNA抑制。 糖酵解基因的表达通过QRT-PCR测定,显示为平均三倍* p<0.001。
(C) HIF-1α调节正常氧下特定糖酵解基因的表达。 通过QRT-PCR测定糖酵解基因在对照细胞和HIF-1α敲除细胞中的表达,并显示为平均三倍* p<0.005。
(D) 同时抑制HIF-1α和N-Myc对 香港2号 , PDK1系列 和 LDHA公司 表达式。 LAN5细胞中的N-Myc和HIF-1α被对照或特异性shRNAs耗尽。 的表达式 香港2号 , PDK1系列 和 LDHA公司 通过QRT-PCR测定,显示为平均三倍* p<0.01。
然后,我们试图研究神经母细胞瘤细胞促进有氧糖酵解的机制。 在这方面,原发性神经母细胞瘤肿瘤的免疫染色显示,HIF-1α在多个不同的肿瘤区域强烈表达( 图2 ). HIF-1α激活的一个结果是通过糖酵解和血管生成基因的转录增加刺激糖酵化和血管生成( 6 ). 在 MYCN公司 神经母细胞瘤放大 MYCN公司 该基因经常导致高N-Myc蛋白水平。 尽管c-Myc明显刺激糖酵解( 31 ),没有详细的研究表明N-Myc在这一过程中的作用类似,因为对细胞系或原发性肿瘤中与N-Myc过度表达相关的基因表达的全基因组分析表明,N-Myc主要调控参与细胞周期进展和核糖体生物发生的基因( 21 , 32 ). 此外,N-Myc和c-Myc仅共享约40%的目标基因,根据该分析,其中没有一个包含参与糖酵解的基因( 21 ). 为此,我们在LAN5细胞中通过特异性shRNAs分别抑制了N-Myc和HIF-1α的表达( 图5B 和 第5章 ). 击倒N-Myc选择性降低葡萄糖转运蛋白1编码基因的表达( GLUT1公司 ), 香港2号 , PDK1系列 , PGK1系列 ,醛缩酶A二磷酸果糖( 阿尔达 )和 LDHA公司 在常氧状态下,但对 GAPDH公司 ( 图5B ). 有趣的是,HIF-1α缺失( 图S5 )特别减少了 GAPDH公司 , 香港2号 , PDK1型 , 阿尔达 、和 LDHA公司 在常压下( 图5C ). 同时击倒N-Myc和HIF-1α表明,它们可以额外调节 香港2号 和 LDHA公司 表达,因为抑制这两个因子会导致表达进一步降低( 图5D ). 如所示 图4 ,HIF-1α和N-Myc不形成物理相互作用。 然而, 香港2号 , PDK1系列 、和 LDHA公司 港口HRE和E箱相互靠近( 20 ). 综合起来,我们的数据和Dang实验室的数据( 20 )提示过表达的Myc和HIF-1α会聚集在这些基因的启动子上,以调节其转录,从而结合在一些共同靶点的反式激活中。
如上所述, MYCN公司 扩增的神经母细胞瘤细胞优先表达HIF-1α,而不是HIF-2α。 确定HIF-2α对 MYCN公司 扩增的神经母细胞瘤细胞,我们稳定地将表达野生型HIF-2α的质粒转染到 MYCN公司 放大细胞以模拟内源性HIF-2α的“再激活”( 图S6A ). 我们首先检测了许多HIF-α靶基因在1.5%O下的表达 2 ( 图S6B ). HIF-2α的表达进一步增加 GLUT1公司 表达,但对其他糖酵解基因没有影响( 图S6B )表明HIF-1α而非HIF-2α主要控制神经母细胞瘤中糖酵解基因的表达。 然后我们分析了葡萄糖消耗( 图S6C ). 有趣的是,与对照组相比,HIF-2α的表达并没有增加葡萄糖摄取。 我们确实观察到缺氧显著增加了对照细胞和HIF-2α转染细胞的葡萄糖消耗,这表明HIF-1α足以维持神经母细胞瘤细胞在缺氧条件下的糖酵解表型。 此外,缺氧条件下HIF-2α对细胞周期进程无明显影响( 图S6D ). 与这些一致 在体外 数据显示,HIF-2α的表达对异种移植瘤模型中SK-N-BE2细胞的致瘤能力没有明显影响( 图S6E ). 综上所述,这些数据表明HIF-1α和HIF-2α的功能在 MYCN公司 放大的神经母细胞瘤,HIF-1α在这些肿瘤中起主导作用。 即使HIF-2α被“重新激活”,由于HIF-1α的高水平存在,也不一定会导致显著的表型。
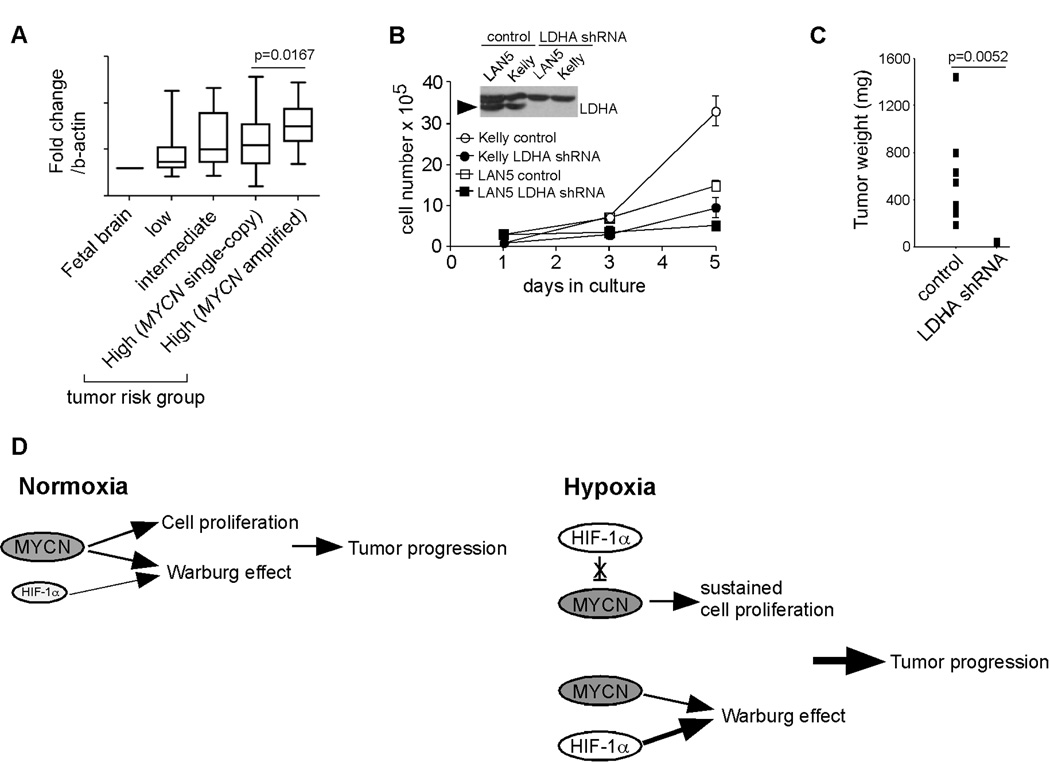
LDHA是一种很有希望的治疗靶点 MYCN公司 放大神经母细胞瘤 基于上述数据,我们分析了101例原发性神经母细胞瘤中糖酵解基因的表达( 33 ). 有趣的是 LDHA公司 , 香港2号 和 PGK1系列 在 MYCN公司 放大肿瘤与 MYCN公司 单副本样本( 图6A 和数据未显示)。 我们对LDHA特别感兴趣,原因如下:(1)LDHA表达在 MYCN公司 扩增神经母细胞瘤亚类( 图6A ); (2) 研究表明,在其他肿瘤情况下,它可以保持Warburg表型( 34 , 35 ); (3)缺乏LDHA表达的个体在正常条件下没有明显的表型( 36 ). 基于这一推理,我们在两个方面耗尽了LDHA的表达 MYCN公司 通过特定shRNAs扩增细胞株LAN5和Kelly( 图6B ). 令人惊讶的是,这两种细胞株都表现出对LDHA活性的依赖性,因为其表达的缺失显著抑制了它们在常压下的增殖( 图6B ). 更重要的是,LDHA的缺失完全抑制了Kelly细胞的致瘤能力 体内 ( 图6C ). 综上所述,这些数据表明靶向LDHA可能为神经母细胞瘤治疗提供一种有效、无毒的方法。
图6。 LDHA是神经母细胞瘤患者有希望的治疗靶点。
(A) LDHA在原发性神经母细胞瘤肿瘤中的相对表达。 以胎脑LDHA水平作为对照。 肿瘤数量:低危组( 28 ),中间( 21 ), MYCN公司 单拷贝,高风险( 32 )和 MYCN公司 放大,高风险( 20 ).
(B) LDHA表达减少会严重抑制 MYCN公司 扩增的神经母细胞瘤细胞。 LDHA蛋白由箭头表示* p<0.01。
(C) LDHA表达减少抑制Kelly细胞的致瘤能力(每组分析8个肿瘤)。
(D) 描述神经母细胞瘤肿瘤进展中N-Myc和HIF-1α协同作用的模型。 详见正文。
讨论 在这项研究中,我们发现N-Myc/HIF-1α协同作用在神经母细胞瘤肿瘤进展中以前被低估的作用。 基于这些数据,我们提出以下模型( 图6D ):在常压下,N-Myc通过激活参与细胞周期进程的基因促进神经母细胞瘤细胞的增殖。 同时,N-Myc和低水平HIF-1α通过调节糖酵解基因共同促进Warburg效应。 缺氧条件下,HIF-1α因蛋白质降解减少而进一步稳定。 一方面,基因组扩增产生的高水平N-Myc蛋白覆盖了HIF-1α对细胞周期进程的抑制,从而实现了持续的细胞增殖。 另一方面,稳定的HIF-1α与N-Myc一起,进一步增加葡萄糖摄取,同时产生乳酸。 值得注意的是,N-Myc和HIF-1α也可能协同促进其他过程,例如血管生成。
通过氟脱氧葡萄糖正电子发射断层扫描(FDG-PET)在许多癌症中推断出Warburg效应( 37 ). 事实上,糖酵解能力增强和整体肿瘤侵袭性被认为是大多数实体肿瘤的共同特征。 我们在这里证明了N-Myc和HIF-1α协同促进神经母细胞瘤的Warburg效应( 图5 和 6 ). 晚期神经母细胞瘤 MYCN公司 由于细胞凋亡机制的异常,扩增常常对传统治疗药物产生耐药性( 38 )这使得在这种肿瘤类型中寻找新的药物靶点变得至关重要。 Ras诱导的肺腺癌小鼠模型中c-Myc的系统性抑制表明靶向c-Myc作为一种有效的肿瘤特异性癌症治疗的可行性,c-Myc是许多致癌信号的常见下游管道( 39 ); 然而,靶向非激酶癌基因的小分子 MYC公司 从未实现。 MYCN公司 放大的神经母细胞瘤具有高度血管性( 1 ). 原则上,阻断血管生成(例如使用抗VEGF药物)可以提供另一种有前景的治疗方法。 然而,最近的研究表明,在一些肿瘤模型中,抗血管生成药物显著增加了侵袭和转移( 40 , 41 ),在一定程度上降低了靶向血管生成治疗神经母细胞瘤等癌症的积极性。 许多癌细胞贪婪地吸收葡萄糖并通过LDHA产生乳酸。 然而,鉴于30-40%的人类肿瘤没有表现出Warburg表型,LDHA在肿瘤进展中是否发挥更广泛的作用仍不清楚。 在本研究中,我们首先系统地分析了一系列 N-马来西亚 扩增的神经母细胞瘤细胞显示,它们始终表现出Warburg表型。 然后我们证明了靶向LDHA可能是治疗神经母细胞瘤患者的另一种有吸引力的方法 MYCN公司 放大,鉴于已有针对LDHA的小分子抑制剂( 42 ). 因为 MYCN公司 单拷贝神经母细胞瘤经常表达c-Myc(但不表达N-Myc)( 43 )可以想象,c-Myc和HIF-2α如ccRCC所示合作( 18 ). 因此,我们提出神经母细胞瘤可以根据Myc和HIF-α的表达模式分为两类,N-Myc/HIF-1α协同表达 MYCN公司 c-Myc/HIF-2α协同扩增神经母细胞瘤 MYCN公司 单拷贝肿瘤。 应考虑将靶向代谢的抑制剂单独或与其他化疗药物联合用于神经母细胞瘤患者的临床试验。
致谢 我们感谢西蒙实验室的成员提出的有益建议。 这项工作得到了霍华德·休斯医学院、NIH拨款CA104838(给M.C.Simon)、NIH赠款CA097323(给J.M.Maris)和NIH F32培训拨款1F32CA137988(给G.L.Qing)的支持。 M.C.Simon是霍华德·休斯医学研究所的研究员。
脚注
潜在利益冲突的披露
提交人声明没有潜在的利益冲突。
工具书类
1 Maris JM、Hogarty MD、Bagatell R、Cohn SL、神经母细胞瘤。 柳叶刀。 2007; 369:2106–2120. doi:10.1016/S0140-6736(07)60983-0。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
2 Mahler YY、Williams JP、Baird WH等。神经母细胞瘤细胞系含有多能干肿瘤起始细胞,对靶向溶瘤病毒敏感。 普洛斯一号。 2009; 1:1–10. doi:10.1371/journal.pone.0004235。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
三。 MosséYP,Laudenslager M,Longo L,等。ALK作为主要家族性神经母细胞瘤易感基因的鉴定。 自然。 2008; 455:930–935. doi:10.1038/nature07261。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
4 Capasso M、Devoto M、Hou C等。BARD1的常见变异影响高危神经母细胞瘤的易感性。 自然遗传学。 2009; 41:718–723. doi:10.1038/ng.374。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
5. Weiss WA、Aldape K、Mohapatra G、Feuerstein BG、Bishop JM。MYCN的靶向表达会在转基因小鼠中引起神经母细胞瘤。 EMBO J.1997; 16:2985–2995. doi:10.1093/emboj/11.11.2985。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
6 Simon MC,Keith B.《氧可用性在胚胎发育和干细胞功能中的作用》。 Nat Rev Mol细胞生物学。 2008; 9:285–296. doi:10.1038/nrm2354。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
7 Hu CJ,Wang LY,Chodosh LA,Keith B,Simon MC。低氧诱导因子1alpha(HIF-1α)和HIF-2α在低氧基因调控中的差异作用。 分子细胞生物学。 2003; 23:9361–9374. doi:10.1128/MCB.23.24.9361-9374.2003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
8 Qing G,Simon M.缺氧诱导因子-2α:侵袭性肿瘤表型的关键介质。 2009年通用操作基因开发; 19:60–66. doi:10.1016/j.gde.2008.12.001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
9. Sowter HM、Raval RR、Moore JW、Ratcliffe PJ、Harris AL.低氧诱导转录因子(Hif)-1alpha与Hif-2alpha在调节低氧转录反应中的主要作用。 2003年癌症研究; 63:6130–6134. [ 公共医学 ] [ 谷歌学者 ]
10 Covello KL、Kehler J、Yu H等。HIF-2alpha调节Oct-4:缺氧对干细胞功能、胚胎发育和肿瘤生长的影响。 基因开发2006; 20:557–570. doi:10.1101/gad.1399006。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Xia X,Lemieux ME,Li W,等。HIF结合和反式激活的综合分析揭示了其在维持组蛋白甲基化稳态中的作用。 美国国家科学院院刊2009; 106:4260–4265. doi:10.1073/pnas.0810067106。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
12 Gruber M,Hu CJ,Johnson RS,Brown EJ,Keith B,Simon MC。Hif-2alpha的急性产后消融导致贫血。 美国国家科学院院刊2007; 104:2301–2306. doi:10.1073/pnas.0608382104。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
13 Mole DR、Blancher C、Copley RR等。低氧诱导因子(HIF)-1alpha和HIF-2alpha DNA结合与低氧诱导转录物表达谱的全基因组关联。 生物化学杂志。 2009; 284:16767–16775. doi:10.1074/jbc。 M901790200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
14 Wiesener MS、Berger I、Morgan NV等。透明细胞肾癌中与低氧诱导因子-1α过度表达相关的低氧诱导基因的组成性激活。 2001年癌症研究; 61:5215–5222. [ 公共医学 ] [ 谷歌学者 ]
15 Adhikary S,Eliers M.Myc蛋白的转录调控和转化。 Nat Rev Mol细胞生物学。 2005; 6:635–645. doi:10.1038/nrm1703。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
16 Dang CV,Kim JW,Gao P,Yustein J.癌症中MYC和HIF之间的相互作用。 Nat Rev癌症。 2008; 8:51–56. doi:10.1038/nrc2274。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
17. Koshiji M、Kageyama Y、Pete EA、Horikawa I、Barrett JC、Huang LE。 HIF-1α通过功能性对抗Myc诱导细胞周期阻滞。 EMBO J.2004; 23:1949–1956. doi:10.1038/sj.emboj.7600196。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
18 Gordan JD、Bertout JA、Hu CJ、Diehl JA和Simon MC。HIF-2alpha通过增强c-myc转录活性促进缺氧细胞增殖。 癌细胞。 2007; 11:335–347. doi:10.1016/j.ccr.2007.02.006。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
19. Gordan JD,Lai P,Dondeti VR,等。HIF-α对c-Myc的影响可区分散发性VHL缺乏型透明细胞肾癌的两种亚型。 癌细胞。 2009; 14:435–446. doi:10.1016/j.cr.2008.10.016。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
20 Kim JW,Gao P,Liu YC,Semenza GL,Dang CV.低氧诱导因子1和失调的c-Myc协同诱导血管内皮生长因子和代谢开关己糖激酶2和丙酮酸脱氢酶激酶1。 分子细胞生物学。 2007; 27:7381–7393. doi:10.128/MCB.00440-07。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
21 Boon K、Caron HN、van Asperen R等。N-myc增强了在核糖体生物生成和蛋白质合成中起作用的大量基因的表达。 EMBO J.2001; 20:1383–1393. doi:10.1093/emboj/20.6.1383。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
22 Holmquist-Mengelbier L、Fredlund E、Löfstedt T等。神经母细胞瘤中HIF-1alpha和HIF-2alpha向共同靶基因的招募受到差异调节:HIF-2alpha促进侵袭性表型。 癌细胞。 2006; 10:413–423. doi:10.1016/j.ccr.2006.08.026。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
23 Pietras A、Hansford LM、Johnsson AS等。HIF-2alpha在神经嵴样人类神经母细胞瘤起始细胞中保持未分化状态。 美国国家科学院院刊2009; 106:16805–16810. doi:10.1073/pnas.0904606106。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
24 Noguera R、Fredlund E、Piqueras M等。HIF-1alpha和HIF-2alpha在神经母细胞瘤体内的调节存在差异:高HIF-1alpha与晚期临床分期和肿瘤血管化负相关。 2009年临床癌症研究; 15:7130–7136. doi:10.1158/1078-0432.CCR-09-0223。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
25 Ginouvès A、IIC K、Macías N、Pouysségur J、Berra E.慢性缺氧期间PHD过度激活可“脱敏”HIFalpha并保护细胞免受坏死。 美国国家科学院院刊2008; 105:4745–4750. doi:10.1073/pnas.0705680105。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
26 Rius J、Guma M、Schachtrup C等。NF-kappaB通过HIF-1α的转录调节将先天免疫与缺氧反应联系起来。 自然。 2008; 453:807–811. doi:10.1038/nature06905。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
27 赵涛,张春平,刘志华,等。胚胎神经干/祖细胞低氧驱动增殖——低氧诱导转录因子-1α的作用。 FEBS J.2008; 275:1824–1834. doi:10.1111/j.1742-4658.2008.06340.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
28. Hoebeeck J、Michels E、Pattyn F等。神经母细胞瘤候选抑癌基因的异常甲基化。 癌症快报。 2008; 273:336–346. doi:10.1016/j.canlet.2008.08.019。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
29 Vander Heiden MG、Cantley LC、Thompson CB。 了解Warburg效应:细胞增殖的代谢需求。 科学。 2009; 324:1029–1033. doi:10.1126/science.1160809。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
30 Hsu PP,Sabatini D.癌症细胞代谢:Warburg及其后。 单元格。 2008; 134:703–707. doi:10.1016/j.cell.2008.08.021。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
31 Dang CV、O'Donnell KA、Zeller KI、Nguyen T、Osthus RC、Li F.c-Myc靶基因网络。《塞米癌症生物学》。 2006; 16:253–264. doi:10.1016/j.semcancer.2006.07.014。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
32 Alaminos M,Mora J,Cheung NK,等。人类神经母细胞瘤中与MYCN相关的基因表达的全基因组分析。 2003年癌症研究; 63:4538–4546. [ 公共医学 ] [ 谷歌学者 ]
33 Wang Q,Diskin S,Rappaport E,et al.综合基因组学确定了神经母细胞瘤的不同分子类别,并显示DNA拷贝数的区域性改变以多个基因为靶点。 癌症研究,2006年; 66:6050–6062. doi:10.1158/0008-5472.CAN-05-4618。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
34 Fantin VR,St Pierre,Leder P.LDH-A表达的减弱揭示了糖酵解、线粒体生理学和肿瘤维持之间的联系。 癌细胞。 2006; 9:425–434. doi:10.1016/j.ccr.2006.04.023。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
35 Shim H、Dolde C、Lewis BC等。LDH-A的C-Myc反式激活:对肿瘤代谢和生长的影响。 美国国家科学院院刊,1997年; 94:6658–6663. doi:10.1073/pnas.94.13.6658。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
36. Nishimura Y、Honda N、Ohyama K等。乳酸脱氢酶A亚单位缺乏症。 同工酶Curr Top Biol Med Res.1983; 11:51–64. [ 公共医学 ] [ 谷歌学者 ]
37 Gatenby RA,Gillies RJ。为什么癌症有高需氧糖酵解? Nat Rev癌症。 2004; 4:891–899. doi:10.1038/nrc1478。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
38 Teitz T,Wei T,Valentine MB等。随着MYCN的扩增,Caspase 8在儿童神经母细胞瘤中优先被删除或沉默。 自然。 2000; 6:529–535. doi:10.1038/75007。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
39 Soucek L,Whitfield J,Martins CP等人,将Myc抑制作为癌症治疗建模。 自然。 2008; 455:679–683. doi:10.1038/nature07260。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
40 Ebos JM、Lee CR、Cruz-Munoz W、Bjarnason GA、Christensen JG、Kerbel RS。使用有效的肿瘤血管生成抑制剂进行短期治疗后加速了转移。 癌细胞。 2009; 15:232–239. doi:10.1016/j.ccr.2009.01.021。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
41 Páez-Ribes M,Allen E,Hudock J,等。抗血管生成治疗导致肿瘤恶性进展,增加局部侵袭和远处转移。 癌细胞。 2009; 15:3384–3395. doi:10.1016/j.ccr.2009.01.027。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
42 Le A、Cooper CR、Gouw AM等。抑制乳酸脱氢酶A可诱导氧化应激并抑制肿瘤进展。 美国国家科学院院刊2010; 107:2037–2042. doi:10.1073/pnas.0914433107。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
43 Liu X,Mazanek P,Dam V,等。未经MYCN扩增的高危神经母细胞瘤中的Wnt/β-catenin程序解除调控。 致癌物。 2008; 27:1478–1488. doi:10.1038/sj.onc.1210769。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]
关联数据 本节收集本文中包含的任何数据引用、数据可用性声明或补充材料。