介绍 雄激素缺乏已成为前列腺癌局部或转移性疾病临床治疗的金标准疗法[ 1 , 2 ]。 由于雄激素是维持前列腺功能和前列腺肿瘤初始生长所必需的,这种雄激素依赖性癌(AD-Ca)的治疗会迅速导致肿瘤缩小。 不幸的是,在2年内,大多数患者确实表现出复发,导致肿瘤复发,这可能是最好的描述[ 三 ]作为雄激素非依赖性癌症(ADI-Ca)。 前列腺癌细胞如何在低雄激素环境下生存和增殖尚不清楚,尽管存在多种机制,例如癌细胞中雄激素受体(AR)表达水平的增加、AR的突变或翻译后修饰,这些都会扩大其配体特异性, 通过利用替代途径等在一定程度上绕过雄激素-AR信号传导[ 4 —— 7 ].
目前,人们对将从人类前列腺癌分析中获得的知识应用于小鼠前列腺癌建模产生了浓厚兴趣。 为了重述前列腺癌发生和发展的自然过程,基于人类前列腺癌中常见的基因改变,已经开发出了几种前列腺癌小鼠模型[ 8 —— 13 ]。 在这些模型中,条件 铂族 删除鼠标模型(c 铂族 −/− )显示腺癌发生的潜伏期短[ 14 ]。 A精炼(c 铂族 −/− L(左) )模型进一步提高了条件的效用 铂族 通过将其与条件荧光素酶表达相结合的删除模型,该条件荧光素酶表达由相同的 Cre公司 / LoxP公司 前列腺上皮细胞中激活的调节系统[ 15 ]。 在这个模型中,可以使用生物发光成像(BLI)技术在活体动物中纵向监测肿瘤的发展和生长过程。 重要的是,阉割后肿瘤的消退和复发也可以在这些动物中进行类似的监测。
对于癌症机制的研究,癌细胞系是强有力的工具。 已经从原发性或转移性癌症中建立了数量有限的人类前列腺癌细胞系[ 16 —— 19 ],并且确实缺乏从AD-Ca期和ADI-Ca期发育的平行细胞系。 前列腺癌小鼠模型可以很容易地为建立疾病不同发展阶段的细胞系提供组织材料。 然而,迄今为止,只有少数小鼠前列腺癌细胞系是从原发肿瘤中获得的[ 20 —— 22 ]ADI-Ca阶段无。 在这里,我们报告了四种前列腺癌细胞系的建立和特征 cPten公司 −/− L(左) 小鼠模型,两个来源于AD Ca,另两个来源于单独的ADI-Ca。
材料和方法 动物 前列腺上皮特异性失活小鼠 铂族 与荧光素酶报告基因激活以及肿瘤生长后的去势实验一致,如前所述[ 15 ]。 所有小鼠均保持在相同的条件下,根据美国国立卫生研究院(NIH)《实验动物护理和使用指南》,使用人道护理标准进行动物实验。
从c细胞生成细胞系 铂族 −/− L(左) 前列腺癌模型 用交叉手术刀(11号刀片)将新收集的前列腺肿瘤组织切碎,转移到50 ml试管中,并在37°C的5 ml消化介质中在旋转器(37°C,140 rpm)上培养过夜。 消化培养基包含Dulbecco改良Eagle's培养基(DMEM)/F12(Invitrogen)、10%胎牛血清(FBS;Gemini)、胶原酶(1 mg/ml)、透明质酸酶(1毫克/毫升)和DNase I(1微克/毫升)。 胶原酶、透明质酸酶和DNase I购自美国密苏里州圣路易斯的Sigma-Aldrich。低速离心后,收集单个细胞和细胞团,并在37°C下用0.05%胰蛋白酶-EDTA处理10分钟,然后依次通过100μm和40μm细胞过滤器(BD Bioscience)。 然后将该制剂在含有DMEM、10%FBS、25µg/ml牛垂体提取物(Invitrogen)、5µg/ml胰岛素(Sigma-Aldrich)和6ng/ml重组人表皮生长因子(rhEGF;Invitrogen)的维持培养基中培养。 当观察到具有上皮细胞形态的细胞集落时,将细胞进行胰蛋白酶化,用培养基稀释,以获得大约每100µl一个细胞的浓度,并将其接种在96 well板中(每孔100µl)。 在37°C下培养过夜后,在明亮的显微镜下仔细检查每个孔。 标记含有上皮形态单细胞的微孔,每隔3天更换一次微孔中的培养基。 从这些菌落中获得的扩大细胞群需要进一步鉴定。
定量RT-PCR 用RNAqueous-4PCR试剂盒(Ambion)提取的总细胞RNA(1µg)用随机六聚体使用qScript™cDNA合成试剂盒(Quanta)进行逆转录,然后用FastStart Universal SYBR Green Master(Roche)对逆转录反应(1μl)进行聚合酶链反应(PCR)扩增。 用MxPro软件(Stratagene;v4.01)在Stratagene-MX3000P qPCR系统中记录并分析PCR信号。 底漆组列于表中 1 .
表1。
基因 正向引物(5′至3′) 反向底漆(5′至3′)
CK5型 ACCTTCGAAAACACAACGAC公司 TTGGCACTACTGCTTCTTGAC公司
第63页 GAAGGCAGATGAGACACA公司 GGAAGTCTCTGTATTCCGT公司
应收账 AACCAACCAGATTCCTTGC公司 ATTAGTGAGGACCGCCAAC公司
CK14型 GACTTCCGGACCAAGTTA公司 CCTTGAGGCTCTCAATCTGC公司
CK8(CK8) ATCGAGATCACCACCTACCG公司 TGAAGCCAGGGCTAGTGAGT公司
CK18型 ACTCGCAAGGTGTAGTATG公司 GCCTCGATTTCTTCCAG公司
PSCA公司 GCTGCTACTCGACCTGTGC公司 ttcacaatcggctatggta公司
CgA公司 GGGAGCTGGAACATAGCG公司 TGTCCTCCCATTCTCTGGAC公司
西弗 CTTTGTGAAGGTGCTGCAAT公司 GTCTTGTTGGCACAATCAC公司
E-钙粘蛋白 TCCAGGAACCTCCGTGATG公司 GGGTAACTCTCTCGGTCCAG公司
N-钙粘蛋白 AGCCTGAGAGTATGTGAG公司 ATGTTGGGTGAAGGTGCT公司
波形蛋白 CAAGTCAAGTTGCTGACCT公司 TCTTCCATCTCCACGCATCTG公司
扭曲 CTCGGACAAGCTGAAGAGAG公司 ACGGAGAGCGTAGCTGAG公司
斯奈伊1 ACCCACTGTGAGAGC公司 GACCAAGGCTGGAAGGAGTC公司
鼻塞 CACAGTTATTATTTCCCATATCT公司 GCAGTCTCTCCTCTTCGTCA公司
β-肌动蛋白 一 AGTGTGACGTTGACATCCGT公司 CTTGCTGATCACACATCTGCT公司
铂族 AAGCAAGCACTCTGGAAACTG公司 关贸总协定
Cre公司 GATCCTGGCAATTTCGGCTAT公司 TTGCCTGCATTACCGTCGAT(TTGCCTGC附件)
PCR基因分型 使用Pten和Cre的特异性引物组,将从细胞系提取的DNA用作PCR反应的模板。 表中也列出了这些底漆组 1 .
Western Blot分析 按说明制备全细胞裂解物[ 23 ]。 免疫印迹中使用的抗体是抗AR(1:100;圣克鲁斯)和抗肌动蛋白(1:1000;圣克鲁兹)。
无血清培养基中的生长测定 为了测试这些细胞系在无雄激素环境中的生长效率,使用了改良的无血清培养基(SFM)[ 24 ]。 它由补充有0.5%葡萄糖(Sigma)和2mM谷氨酰胺的DMEM/F-12、10g/ml胰岛素、5.5g/ml转铁蛋白、6.5ng/ml硒和6ng/ml rhEGF(均来自Invitrogen)组成。 最初,细胞(5×10 4 )在六孔板中在维持培养基中培养过夜,用1×PBS洗涤两次,然后在SFM中培养5天。 每2天更换一次培养基,通过细胞计数测定这些时间点的细胞增殖率。 使用含有1或5 nM甲基三烯酮(R1881;Perkin Elmer)(一种合成雄激素激动剂)的SFM来确定雄激素对细胞增殖的影响。
致瘤性试验 电池(1×10 6 )以1:1的比例与100µl Matrigel(BD bioscience)/维持培养基混合,然后皮下接种到NOD中。 8-12周龄SCID小鼠。 在安乐死后8周通过手术从动物身上采集移植物。
免疫染色 按照公布的方案,对固定在4%PFA中的组织石蜡切片(5µm)进行H&E或免疫组织化学(IHC)或免疫荧光(IF)染色[ 15 ]。 通过将载玻片在pH 6.0的10 mM柠檬酸盐缓冲液中煮沸15分钟,然后冷却至室温,进行IHC抗原检索。 允许切片在4°C下与AR(1:200;Santa Cruz)、CK8(1:100;TROMA-1抗体;衣阿华大学发育研究杂交瘤库)、vimentin(1:50;细胞信号)或Ki67(1:200,载体实验室)的一级抗体反应过夜,然后与生物素化二级抗体(1:200)孵育 对抗兔或大鼠IgG(Vector Laboratories)30分钟,然后使用ABC Elite Kit(Vectors Laboratory)和3,3′-二氨基联苯胺(Dako)作为底物进行染色。 通过使用CK8、E-钙粘蛋白(1:100;细胞信号)、N-cadherin(1:200;Abcam)和α-平滑肌肌动蛋白(SMA;Cy3-共轭;1:200;Sigma-Aldrich)的一级抗体对平行切片进行IF分析。 然后应用针对兔或大鼠IgG的FITC-结合二级抗体(1:80;Sigma-Aldrich)。 染色后,用含有DAPI的培养基贴装切片以标记细胞核。
核型分析 核型分析基本上按照[ 25 ]。 简单地说,在0.05µg/ml秋水仙素(Invitrogen)存在下培养活跃生长的细胞4小时,在胰蛋白酶分离后收获,并收集在15-ml锥形离心管中。 将细胞颗粒悬浮在1.5 ml新鲜生长培养基中; 缓慢添加10 ml 37°C氯化钾溶液(0.075 M),然后在37°C下培养17分钟。 然后,将两到三滴冰镇固定剂(甲醇/冰醋酸=3:1)混合到细胞悬浮液中。 立即离心后,用10-ml冰镇新鲜固定剂重复固定步骤三次。 最后,将细胞颗粒悬浮在1至0.5 ml固定剂中,将70µl滴到玻片上,进行染色体扩散。 使用×100或×40油浸物镜对Giemsa染料染色的玻片进行计数。 每个细胞系至少有25次传播。 使用InStat 3.05(GraphPad)进行统计分析。
统计分析 细胞生长和标记物分析的结果被评估为至少两个不同实验的平均值±SE(一式三份)。 使用Microsoft Excel分析工具进行统计计算。 独立分析各组之间的差异 t吨 测试。 P(P) <0.05的值被认为具有统计学意义。
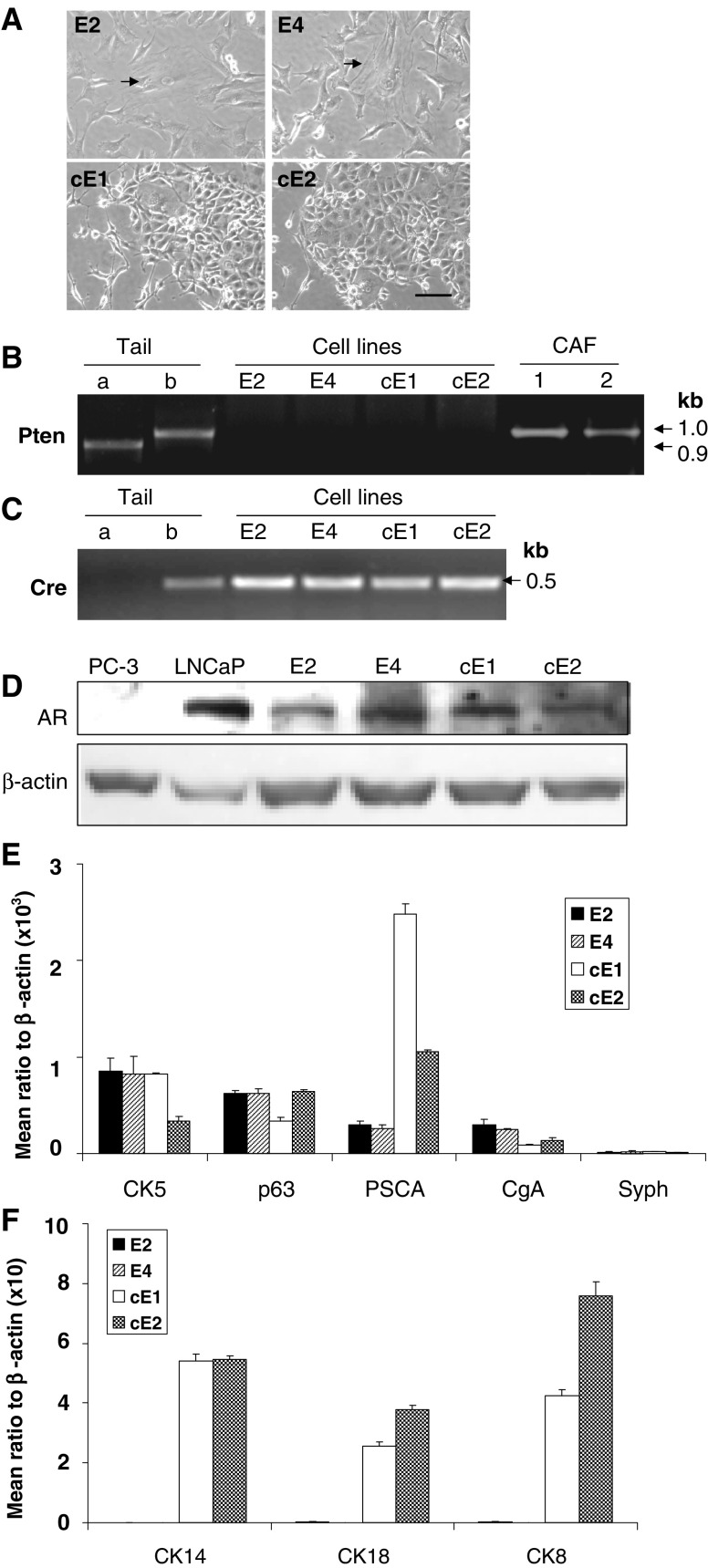
结果 新型小鼠前列腺肿瘤细胞系的鉴定 我们首先从一只8个月大的完整小鼠的AD-Ca组织中分离出细胞。 将单个细胞培养在96周的平板上后,从不同的孔中获得五个菌落并进行培养以扩大种群,其中两个命名为E2和E4,用于进一步表征。 通过使用相同的方法,从一只13个月大的雄性小鼠收集的ADI-Ca肿瘤中获得细胞系,该小鼠在8个月大时被阉割。 在去势后5个月的观察期间,监测该小鼠BLI信号的最初减少后增加,以观察复发肿瘤的生长情况。 从原发部位的复发肿瘤中,产生了三个单细胞集落,其中两个被命名为cE1和cE2,并进行了进一步的表征。 如图所示 1a个 、E2和E4细胞通常显示为多边形形态,同时存在一小部分细胞(<5%),呈扁平和细长形状(箭头所示)。 cE1和cE2细胞大多呈多边形,但由于这些细胞在培养中倾向于成簇生长,细胞内粘附明显增加。
图1。
E2和E4以及cE1和cE2细胞系的特征。 一 显微镜下亮场下细胞形态的比较。 虽然所有细胞株都显示出不同于上皮细胞的多边形细胞,但E2或E4细胞也表现出少量形态细长的细胞,如下所示 箭头 . 酒吧 ,100微米。 b 细胞系的PCR基因分型 铂族 -特异性引物。 ( 一 正常小鼠尾部组织; b c(c) 铂族 −/− L(左) 小鼠尾部组织)。 c(c) PCR检测 Cre公司 细胞系中的基因。 d日 小鼠细胞系AR表达的Western blots分析; 作为对照的人前列腺癌细胞系为:PC3,阴性; LNCaP,阳性。 e(电子) , (f) 标记基因表达的比较实时PCR分析,包括基底(CK5,p63,CK14)、管腔(CK18,CK8)、神经内分泌细胞标记(CgA,Syph)和PSCA。
要确定 铂族 对这四个细胞系的基因状态进行基因分型分析。 从这些细胞系细胞中提取的基因组DNA经过PCR反应,引物集特异性用于 铂族 floxed等位基因。 这组引物能够在没有DNA重组的情况下扩增出1 kb长的DNA片段。 然而,如果在固定位点发生Cre介导的重组,则不应存在任何扩增产物。 从小鼠尾部组织中提取基因组DNA 铂族 −/− L(左) 将小鼠及其正常对照小鼠作为PCR产物的对照。 漂浮等位基因和野生型等位基因的大小预计分别为1.0 kb和0.9 kb。 如图所示 1亿 ,在从c 铂族 −/− L(左) 和正常小鼠,没有证据表明从细胞系分离出的任何DNA中有此类产物。 结果表明floxed基因纯合子缺失 铂族 每个上皮细胞系中的等位基因。 从同一小鼠模型的癌相关成纤维细胞中分离出的DNA进行了类似的分析,结果显示只有未重组的漂浮等位基因存在,再次证实了前列腺上皮细胞的特异性 Cre公司 / 液氧磷 模型中的系统[ 23 ]。 结果支持所建立的四种细胞系中的每一种都有上皮起源。 保留 Cre公司 PCR分析也证实了细胞系中的基因(图。 1c个 ). 当细胞系进行核型分析时,一些个体差异变得明显。 如表所示 2 E2、E4和cE2出现在四倍体附近,而cE1明显是非整倍体。
表2。
细胞系 染色体数目 样品编号
E2级 4N附近(79.3±14.9) 40
E4类 4N附近(76.1±23) 31
cE1基因 3N附近(63.8±15.1) 26
cE2级 4N附近(78.6±29.5) 25
为了确定分子表达的特征,我们使用Western blot分析AR和实时PCR技术分析mRNA的基底细胞标记(CK5、p63、CK14)、管腔细胞标记(CK18、CK8)、神经内分泌表型标记[ 26 —— 28 ]即嗜铬粒蛋白A(CgA)和突触素(Syph),以及所谓的前列腺干细胞抗原(PSCA)[ 29 ],一种中间上皮细胞分化的标志物。 将每个PCR反应获得的值归一化为β-肌动蛋白的值。 如图所示 1天 AR在所有这些细胞系中的表达水平相当相似。 每个细胞株只表达极低水平的CK5、p63、CgA和PSCA,几乎检测不到Syph(图 第1页 ). cE1和cE2细胞,而不是E2和E4细胞,显示出显著水平的CK8、CK14和CK18(图 第1页 ).
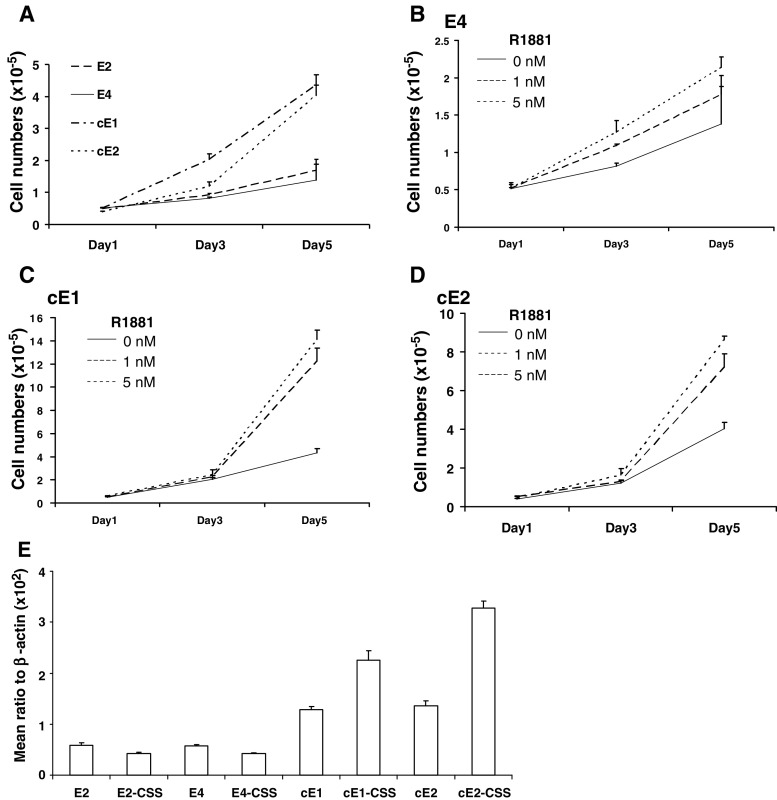
接下来我们检查了这些细胞系中雄激素对增殖率的影响。 在SFM中,E2和E4细胞生长缓慢。 然而,在相同条件下,cE1和cE2细胞的增殖率较高,在培养5天后,细胞数量增加了约5倍(图 2a个 ). 通过添加1-5-nM浓度的雄激素(R1881),SFM中E2和E4细胞的细胞增殖率可增加约1.2-1.7倍,如图中E4细胞所示 2亿 cE1和cE2细胞对相同水平雄激素的反应更高,显示增殖率增加了3.0倍和3.5倍(图 2c、d ). 为了确定雄激素对这些细胞系中AR表达的影响,我们将细胞培养在由DMEM和10%炭化血清(CSS)组成的培养基中长达18天。 从维持培养基或CSS培养基中培养的细胞中提取的RNA用AR特异引物进行实时PCR检测。如图所示 2e、a 显著(2.0至2.5倍; P(P) < 0.01)在CSS培养基中培养的cE系列细胞系中,相对于维持培养基中的细胞,AR转录物增加。 然而,与cE细胞相比,在维持培养基和CSS培养基中培养的E细胞之间AR表达水平没有显著增加; 观察到略有下降。
图2。
培养物中细胞系增殖率的比较。 一 SFM的增长率。 E系列和cE系列在第5天计数的细胞数差异显著( P(P) < 0.01). b 低浓度雄激素(R1881)对SFM中E4细胞生长的影响的说明(E2细胞也获得了类似的结果)。 增长速度显著提高( P(P) < 0.05),但不是1 nM R1881。 c(c) 相似浓度雄激素对cE1和cE2细胞生长的影响( d日 ). 第5天,雄激素刺激显著( P(P) < 0.01)。 e(电子) 分析E和cE系列在维持培养基或无雄激素培养基中培养的AR表达水平,该培养基由炭化血清代替正常血清(CSS)获得。 cE1和cE1-CSS之间以及cE2和cE2-CSS之间的差异显著( P(P) < 0.01).
细胞系的致瘤性 为了测试细胞系的致瘤性,我们对雄性和雌性NOD进行了移植。 SCID患者检查性别对移植物摄入和肿瘤组织学的影响。 8周后处死小鼠,收集移植物并称重,准备组织切片。 我们的数据表明,所有细胞系的肿瘤发病率为100%(表 三 )一般来说,男性的移植物比女性的移植物大。 当比较来自不同细胞系的雄性肿瘤时,E2、cE1和cE2细胞的肿瘤重量似乎相似,而来自E4的移植物重量则高出三倍; 在女性中,E系列移植物的重量是cE系列的3倍到18倍。
表3。
主机 细胞系 发病率(%) 肿瘤重量(g)
男性 E2级 4/4 (100) 0.25 ± 0.24
男性 E4类 4/4 (100) 0.80±0.54
男性 cE1级 4/4 (100) 0.25 ± 0.08
男性 cE2级 4/4 (100) 0.26±0.07
女性 E2级 4/4 (100) 0.17 ± 0.03
女性 E4类 8/8 (100) 0.56 ± 0.15
女性 cE1级 8/8 (100) 0.05 ± 0.01
女性 cE2级 4/4(100) 0.03 ± 0.02
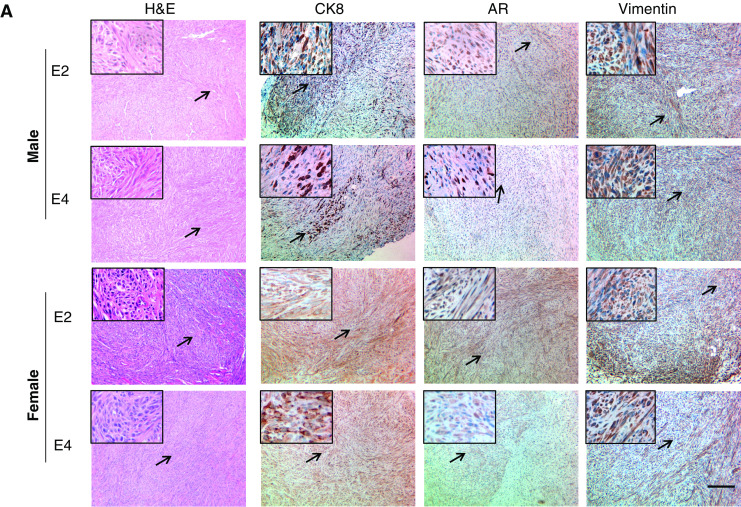
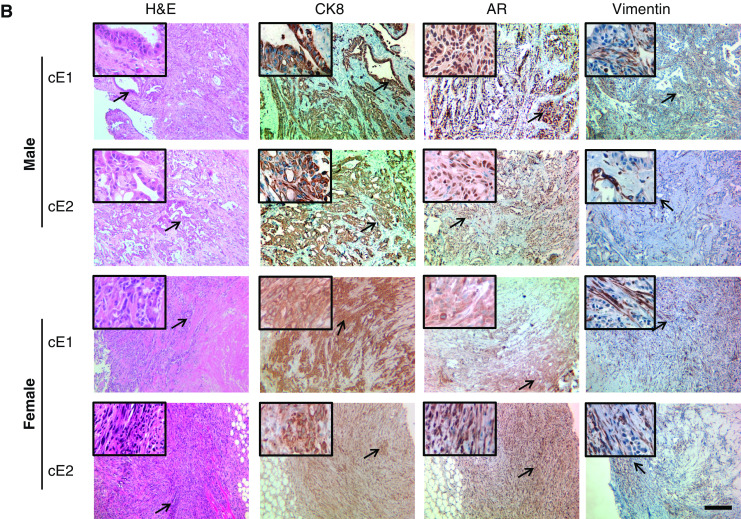
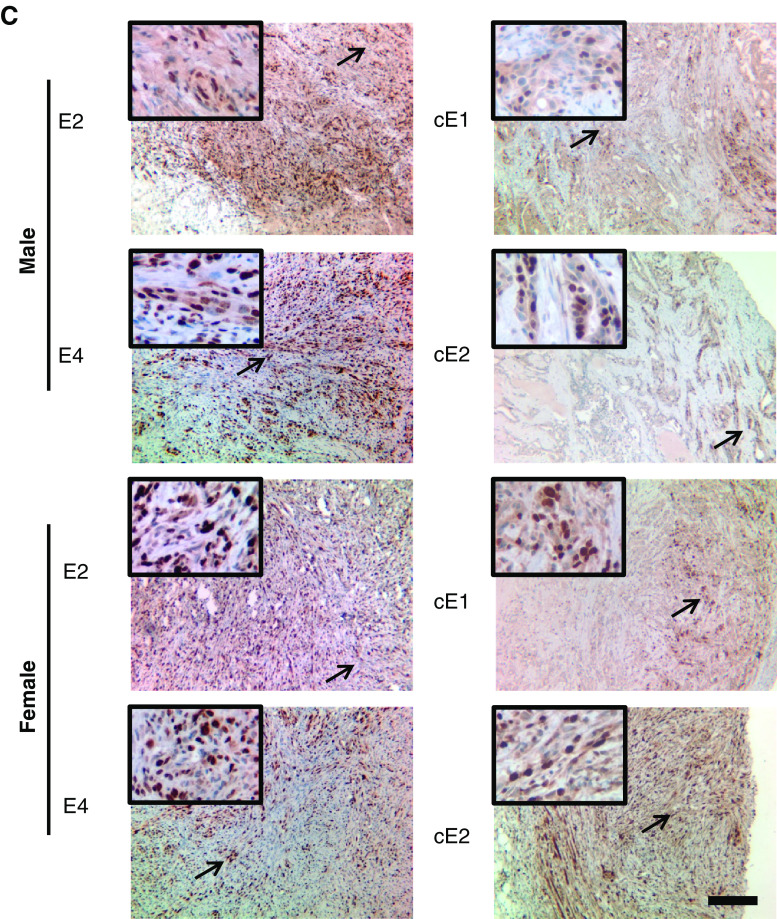
当对雄性小鼠的移植物进行病理学检查时,发现AD-Ca和ADI-Ca系列的细胞系之间存在重大差异。 如图所示 3a、H &E2和E4移植物的E染色显示梭形细胞肿瘤。 由于肿瘤细胞不仅表达AR,还表达波形蛋白和CK8,这些肿瘤被诊断为肉瘤样癌[ 30 ]根据“基因工程小鼠前列腺病变的病理分类”[ 31 ]。 与E2和E4移植物不同(图 3a年 cE1和cE2移植物显示了腺癌的组织学特征,其腺体结构由表达AR和CK8的圆形肿瘤上皮细胞组成(图 3亿 )并且这种上皮细胞已经渗入基质层。 波形蛋白阳性细胞可以在基质区检测到,但不能在上皮层内检测到。 雌性小鼠E2和E4移植物的切片也显示肉瘤样癌的组织病理学,但CK8的百分比 + 雄性小鼠的细胞数高于E2和E4移植物(图 3a年 ). 虽然cE1和cE2细胞也能在雌性小鼠中形成肿瘤,但这些移植物中的腺体结构的形态不如在雄性小鼠中观察到的那样清晰。 IHC染色显示,男性cE1和cE2移植物的AR核染色阳性,而女性移植物的核染色大多为弥漫性胞质AR染色。 Ki67阳性,细胞增殖标记物,在所有移植物中检测到细胞(图 3厘米 ).
图3。
NOD中男性或女性细胞系诱发肿瘤的显微解剖分析。 SCID小鼠。 一 E2和E4移植物切片的H&E和IHC染色检测AR、CK8和波形蛋白。 标记为 箭头 显示在每个部分的左上角。 酒吧 ,100微米。 b cE1和cE2移植物切片的类似染色实验。 酒吧 ,100微米。 c(c) Ki67移植物的IHC染色。 酒吧 ,100微米。
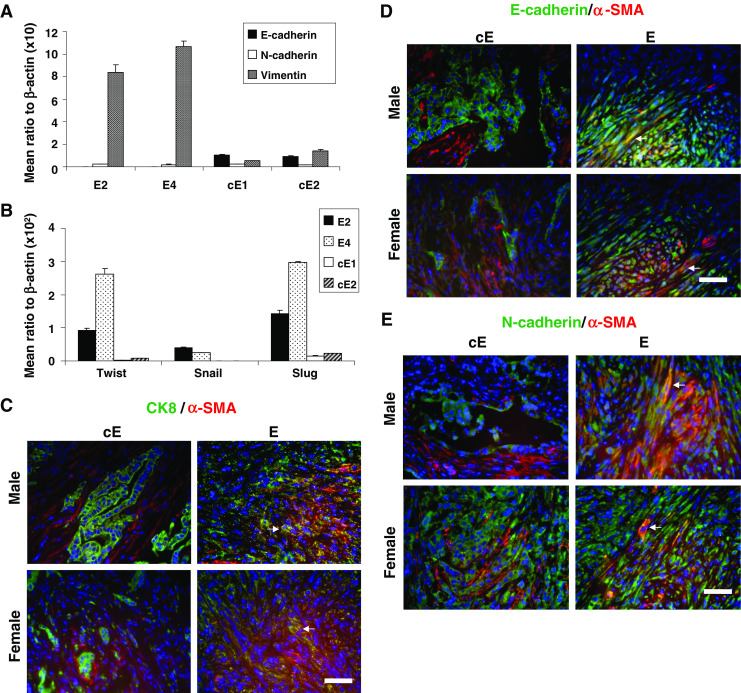
EMT标记分析 我们怀疑E2和E4细胞在培养物中可能经历了某种程度的上皮-间充质转化(EMT),因此我们进一步使用实时PCR检测了所有细胞系中某些EMT标记的表达水平。 如图所示 4a类 虽然E-cadherin在cE1和cE2细胞中表达,但在E2和E4细胞中几乎不表达; 所有细胞系的N-钙粘蛋白水平都很低。 E2和E4细胞似乎比cE1和cE2细胞产生显著更多的波形蛋白。 已知EMT转录抑制因子Twist、Slug和Snail的表达[ 28 —— 31 ]与cE1和cE2细胞相比,E2和E4细胞也增加(图 4b个 ). 还使用体内形成的移植物在蛋白质水平上检测了一些标记物。 使用CK8、E-cadherin、N-cadherin和α-SMA抗体,通过IF分析与H&E和IHC染色相邻的组织切片。 如图所示 4c–e段 在雄性或雌性小鼠的cE1和cE2移植物切片上,α-SMA染色的细胞似乎没有同时表达CK8、E-cadherin或N-cadherin。 然而,在E2和E4移植物的切片中检测到许多这样的细胞(箭头)。
图4。
细胞系中EMT相关标记的表达分析。 一 E-cadherin、N-cadherin和vimentin的相对表达 b 实时PCR测定的扭曲、蜗牛和鼻涕虫。 与cE序列相比,E序列中波形蛋白、扭曲蛋白、蜗牛蛋白或Slug的表达水平差异显著( P(P) < 0.01). c(c) —— e(电子) 对来自E和cE细胞系的肿瘤移植物进行染色时的共免疫荧光结果的说明 红色 对于α-SMA和 绿色 对于任一CK8( c(c) ),E-钙粘蛋白( d日 )或N-钙粘蛋白( e(电子) ). 白色箭头 显示细胞共表达( 黄色的 ). 酒吧 ,50微米。
讨论 本报告的重要性在于,它描述了从两种不同的肿瘤中分离出的新致瘤细胞系的分离和性质 cPten公司 −/− L(左) 小鼠模型。 这些细胞系增加了目前用于前列腺癌研究的有限细胞系。 在我们在这里描述的四种细胞系中,E2和E4来自一个AD-Ca,cE1和cE2来自一个单独的小鼠的ADI-Ca。 虽然每个细胞系都具有较强的AR生成能力,但这两个系列在生长速度、某些细胞标记物的表达水平以及对雄激素暴露的敏感性方面有所不同。 一般来说,E2和E4细胞表达低水平的基础细胞标志物(CK5和p63),但实际上没有管腔细胞标志物,显示出对雄激素的需求,以在细胞培养中实现最佳生长。 E2和E4细胞似乎表达了一些EMT标记,即波形蛋白、扭曲、鼻涕虫和蜗牛,其表达水平明显高于cE系列。 cE1和cE2细胞表达两种管腔细胞标记物(CK8和CK18)以及一种基底细胞标记物的水平显著高于E2和E4细胞, 在没有雄激素的情况下生长良好,同时在缺乏雄激素时保持产生增加AR转录物的能力,在补充雄激素时增加增殖。 由于AR在两个系列中的表达相似,雄激素敏感性的差异可能受机制的调节,而不仅仅受AR水平的调节。据报道,AR对于不依赖雄激素促进生长的人类前列腺癌细胞系的细胞周期进展仍然至关重要[ 32 , 33 ]在一组小鼠肿瘤上皮细胞系中PTEN功能的丧失增强了雄激素的独立性[ 21 ]。 在 铂族 -删除了我们生成的细胞株,也没有得到雄激素对细胞生长影响的清晰图像。 我们发现,从小鼠前列腺肿瘤雄激素依赖期获得的两种细胞系在雄激素缺乏的情况下可以在有限的时间内缓慢增殖, 而来自肿瘤ADI期的细胞株显示出在这种环境下能够更有效地生长,同时保留了暴露于雄激素时增加增殖的潜力。 由于该研究是使用来自两种不同小鼠的E和cE系进行的,因此尚不清楚cE细胞是从雄激素依赖状态演变而来,与疾病的线性进展相关,还是完全独立的现象。 为了解决这个问题,有必要在从AD-Ca到ADI-Ca的连续发展阶段分析同一肿瘤的样本和来自单个动物的衍生细胞系。
我们所做的另一个有趣的观察是,这两个系列的细胞系在体内试验中诱导肿瘤类型的能力有很大差异。 E系列细胞系在雄性和雌性小鼠中均形成肉瘤样癌,而cE系列细胞株在雄性小鼠中形成腺癌,但在雌性小鼠中形成未分化肿瘤(图 3亿 ). 与E系列体外培养物中检测到的细胞-细胞粘附性降低以及少量细长扁平细胞一致,这些细胞的实时PCR结果也表明一些EMT标记物水平增加,如上所述。 E系列细胞可能获得一定程度的EMT的可能性得到了以下证明的支持:在这些细胞体内形成的肿瘤中可以很容易地检测到同时存在上皮和间充质标记物的纺锤形细胞。 cE细胞系未获得此类证据(图 4c–e类 ). 然而,在cE系列诱发的肿瘤中,宿主动物性别的主要影响显而易见。 cE细胞在雄性体内诱导的肿瘤呈现明显的腺体结构,管腔内外均存在CK8阳性细胞,而在雌性体内形成的未分化肿瘤中,尤其是cE2移植物中,CK8阳性的细胞密集分布(图 3亿 ). 这些结果表明,cE细胞保留了产生类似前列腺腺癌的病变的能力,这种特性似乎取决于男性激素的水平。 在这方面,在雄性小鼠体内形成的E和cE细胞系的肿瘤切片中,AR染色主要位于细胞核中,但主要在雌性小鼠体内形成移植物的肿瘤细胞细胞质中检测到,此处的循环雄激素水平预计较低。 因此,雄激素的调节在cE1和cE2细胞的腺癌形成中更为显著,而在E2和E4细胞诱导的肿瘤的组织病理学表型中则较少。 然而,E系列诱导肉瘤样癌仍然非常有趣。 首先,前列腺肉瘤样癌在人类和小鼠中都很罕见[ 31 ]。 第二,与我们的预期相反,这些来自前列腺肿瘤发生相对早期的细胞系似乎比那些来自ADI-Ca晚期的细胞系分化更少。 因此,目前尚不清楚E2和E4细胞的分离是否与克隆变异有关,克隆变异可能不代表大多数癌细胞,但在培养物中偶然选择,或者它们在肿瘤中的存在可能对由 铂族 前列腺上皮中的基因激活。 从AD-Ca期分离和鉴定额外的肿瘤细胞克隆对于进一步评估这些问题是必要的。
总之,我们已经产生了两对新的小鼠前列腺癌细胞系,其中含有 铂族 来自两种不同前列腺肿瘤的抑癌基因:一对来自雄激素依赖性肿瘤的细胞系,另一对来自雄激素耗竭非依赖性(复发)肿瘤的细胞系。 特定的细胞系来源于具有相似遗传背景的自发性肿瘤模型,显示出独特的特性。 来自复发性肿瘤的两种细胞系中的每一种在没有雄激素的情况下生长良好,在缺乏雄激素时显示出增加AR转录的能力,保持对雄激素水平的敏感性以增加增殖,并且可以在男性NOD中产生腺癌。 SCID小鼠。 从雄激素依赖期获得的这对细胞系需要雄激素才能实现最佳生长,在体外表现出某些类似EMT的特性,并且当移植到男性或女性宿主体内时,可以诱导肉瘤样癌在体内表现出上皮-间充质细胞混合表型。 这些细胞株可能是探索前列腺癌进展机制和不同组织病理学表型表现的重要资源。
确认 拨款支持:NIH RO1 CA113392和NIH ROI CA59705(P.Roy-Burman)和NIH RO1 CA96823(A.Nikitin)。
我们感谢Roy-Burman实验室的所有成员在这项工作的各个方面提供的帮助,特别是Lauren Geary设计的初级蜗牛和鼻涕虫,以及Erik Haw的基因分型。 我们还感谢周宗祥博士对核型分析的初步贡献。
工具书类
1 Heinlein CA,Chang C.前列腺癌雄激素受体。 Endocr Rev.2004; 25:276–308. doi:10.1210/er.2002-0032。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
2 Bonkhoff H,Berges R.从去势抵抗前列腺癌的发病机制到预防。 前列腺。 2009; 70:100–112. doi:10.1002/pros.21042。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
三。 Roy-Burman P、Tindall DJ、Robins DM等。雄激素和前列腺癌:描述符有效吗? 癌症生物治疗。 2005; 4:4–5. doi:10.4161/cbt.4.11563。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
4 Brooke GN,Bevan CL.雄激素受体突变在前列腺癌进展中的作用。 当前基因组学。 2009; 10:18–25. doi:10.2174/138920209787581307。 [ DOI程序 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
5 Linja MJ、Savinainen KJ、Saramaki OR、Tammela TL、Vessella RL、Visakorpi T.激素难治性前列腺癌雄激素受体基因的扩增和过度表达。 2001年癌症研究; 61:3550–3555. [ 公共医学 ] [ 谷歌学者 ]
6 Waltering KK、Helenius MA、Sahu B等。雄激素受体表达增加使前列腺癌细胞对低水平雄激素敏感。 2009年癌症研究; 69:8141–8149. doi:10.1158/0008-5472.CAN-09-0919。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
7 Chen Y,Clegg NJ,Scher HI。 前列腺癌中的抗雄激素和雄激素消除疗法:针对既定靶点的新药物。 柳叶刀Oncol。 2009; 10:981–991. doi:10.1016/S1470-2045(09)70229-3。 [ DOI程序 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
8 Roy-Burman P、Wu H、Powell WC、Hagenkord J、Cohen MB。 模仿人类前列腺癌发展的自然方面的转基因小鼠模型。 内分泌相关癌。 2004; 11:225–254. doi:10.1677/erc.0.0110225。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
9 Abate-Shen C、Brown PH、Colburn NH等。基因工程小鼠模型在化学预防研究中尚未开发的潜力:机遇与挑战。 癌症预防研究(Phila Pa)2008; 1:161–166. doi:10.1158/1940-6207.CAPR-08-0076。 [ DOI程序 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
10 Trotman LC、Niki M、Dotan ZA等。铂剂量决定前列腺癌的进展。 《公共科学图书馆·生物》。 2003; 1:385–396. doi:10.1371/journal.pbio.0000059。 [ DOI程序 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
11 Ma X,Ziel van der Made AC,Autar B等。小鼠前列腺中Pten的靶向双等位基因失活导致前列腺癌,伴有上皮细胞增殖增加,但不伴有细胞凋亡减少。 2005年癌症研究; 65:5730–5739. doi:10.1158/0008-5472.CAN-04-4519。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
12 Zhou Z,Flesken-Nikitin A,Corney DC,等。转移性前列腺癌条件小鼠模型中p53和Rb缺乏的协同作用。 2006年癌症研究; 66:7889–7898. doi:10.1158/0008-5472.CAN-06-0486。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
13 Bruxvoort KJ,Charbonneau HM,Giambernardi TA等。小鼠前列腺中Apc的失活导致前列腺癌。 癌症研究2007; 67:2490–2496. doi:10.1158/0008-5472.CAN-06-3028。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
14 王仕,高杰,雷庆,等。小鼠前列腺癌抑癌基因前列腺特异性缺失导致前列腺癌转移。 癌细胞。 2003; 4:209–221. doi:10.1016/S1535-6108(03)00215-0。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
15 廖CP,钟C,Saribekyan G,等。具有生物发光或荧光监测自发致癌能力的前列腺癌小鼠模型。 癌症研究2007; 67:7525–7533. doi:10.1158/0008-5472.CAN-07-0668。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
16 van Bokhoven A,Varella Garcia M,Korch C等。人类前列腺癌细胞系的分子表征。 前列腺。 2003; 57:205–225. doi:10.1002/pros.10290。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
17 Navone NM、Olive M、Ozen M等。两种来源于单个骨转移的人前列腺癌细胞系的建立。 1997年临床癌症研究; 3:2493–2500. [ 公共医学 ] [ 谷歌学者 ]
18 Chen ME、Lin SH、Chung LW、Sikes RA。 PAGE-1和GAGE-7的分离和表征。 LNCaP前列腺癌进展模型中表达的新基因与黑色素瘤相关抗原具有同源性。 生物化学杂志。 1998; 273:17618–17625. doi:10.1074/jbc.273.28.17618。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
19 Ishikura N、Kawata H、Nishimoto A、Nakamura R、Ishii N、Aoki Y(2009)雄激素受体依赖性、雄激素依赖性人类前列腺癌细胞系LNCaP-CS10的建立和鉴定。 前列腺(印刷中) [ DOI程序 ] [ 公共医学 ]
20 Foster BA、Gingrich JR、Kwon ED、Madias C、Greenberg NM。 小鼠前列腺转基因腺癌(TRAMP)模型前列腺上皮细胞系的特征。 1997年癌症研究; 57:3325–3330. [ 公共医学 ] [ 谷歌学者 ]
21 焦J,王S,乔R,等。来自Pten缺失前列腺癌的小鼠细胞系显示Pten在激素难治性前列腺癌发展中的关键作用。 癌症研究2007; 67:6083–6091. doi:10.1158/0008-5472.CAN-06-4202。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
22 Choi J、Burns AA、Williams RM等,核壳二氧化硅纳米颗粒作为纳米药物的荧光标签。 J生物识别选项。 2007; 12:1–12. doi:10.1117/1.2823149。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
23 Wu X,Wu J,Huang J,等。用于组织特异性基因消融的前列腺上皮细胞特异性Cre转基因小鼠模型的产生。 机械开发2001; 101:61–69. doi:10.1016/S0925-4773(00)00551-7。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
24 Leong KG、Wang BE、Johnson L、Gao WQ。 从单个成体干细胞生成前列腺。 自然。 2008; 456:804–808。 doi:10.1038/nature07427。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
25 Nagy A、Gertsenstein M、Vintersten K、Behringer R。操纵小鼠胚胎。 实验室手册。 3.《冷泉港》:冷泉港实验出版社; 2003年,第389页。 [ 谷歌学者 ]
26 Leiblich A、Cross SS、Catto JW、Pesce G、Hamdy FC、Rehman I。人类前列腺癌细胞表达神经内分泌细胞标记物PGP 9.5和嗜铬粒蛋白A前列腺。 2007; 67:1761–1769. doi:10.1002/pros.20654。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
27 Zhou Z、Flesken Nikitin A、Nikitin AY。 与p53和Rb缺乏相关的前列腺癌起源于前列腺导管干/祖细胞富集的近端区域。 癌症研究2007; 67:5683–5690. doi:10.1158/0008-5472.CAN-07-0768。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
28 Isayeva T,Chanda D,Kallman L,Eltoum IE,Ponnazhagan S。TRAMP模型中持续抗血管生成治疗对多期前列腺癌的影响。 癌症研究2007; 67:5789–5797. doi:10.1158/0008-5472.CAN-06-3637。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
29 Tran CP,Lin C,Yamashiro J,Reiter RE。前列腺干细胞抗原是晚期中间前列腺上皮细胞的标记物。 2002年Mol Cancer Res; 1:113–121. [ 公共医学 ] [ 谷歌学者 ]
30 Hansel DE、Herawi M、Montgomery E、Epstein JI。 成人前列腺梭形细胞病变。 Mod病理学。 2007; 20:148–158. doi:10.1038/modpathol.3800676。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
31 Shappell SB、Thomas GV、Roberts RL等。转基因小鼠前列腺病理学:定义和分类。 人类癌症小鼠模型联合会前列腺病理委员会Bar Harbor会议的共识报告。 癌症研究2004; 64:2270–2305. doi:10.1158/0008-5472.CAN-03-0946。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
32 Chen CD、Welsbie DS、Tran C等。抗雄激素治疗耐药的分子决定因素。 2004年《国家医学》; 10:33–39. doi:10.1038/nm972。 [ DOI程序 ] [ 公共医学 ] [ 谷歌学者 ]
33 袁X,李涛,王华,等。雄激素受体对雄激素依赖性CWR22前列腺癌细胞的细胞周期进展仍然至关重要。 《美国病理学杂志》。 2006; 169:682–696. doi:10.25353/ajpath.2006.051047。 [ DOI程序 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]
34 He W,Dai C,Li Y,Zeng G,Monga SP,Liu Y.Wnt/beta-catenin信号传导促进肾间质纤维化。 《美国肾脏病杂志》。 2009; 20:765–776. doi:10.1681/ASN.2008060566。 [ DOI程序 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]