摘要
介绍
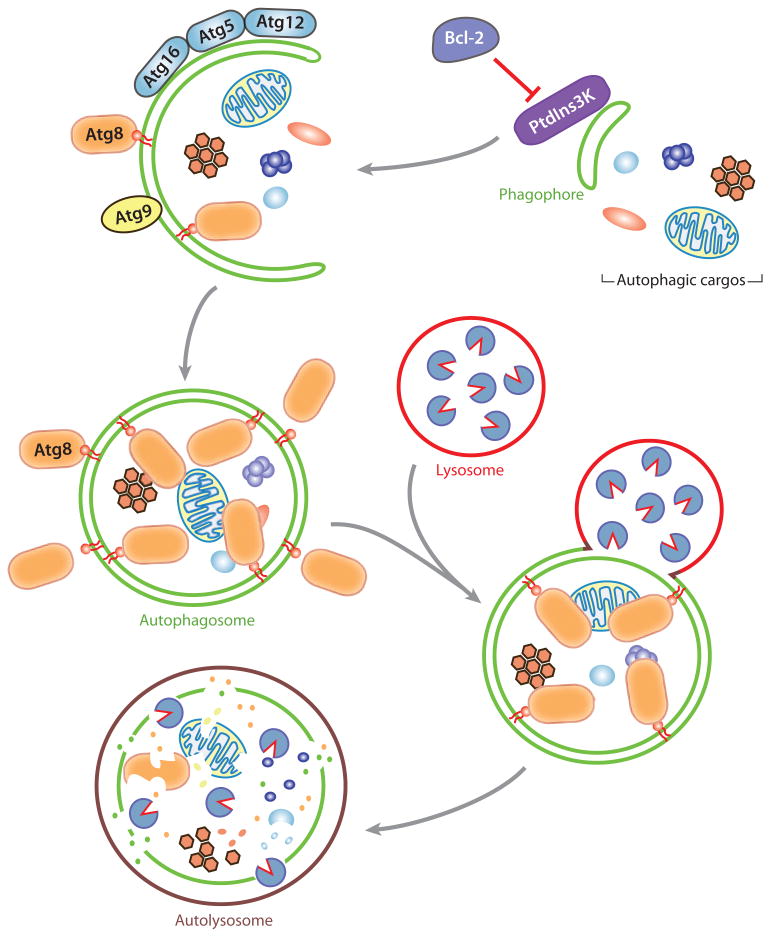
图1。
自噬的分子机制
自噬相关(Atg)蛋白质:核心机制
归纳
图2。
货物识别和选择性
自噬体形成
囊泡融合和自噬体分解
自噬所需的非自噬组件
分泌和内吞途径
细胞骨架
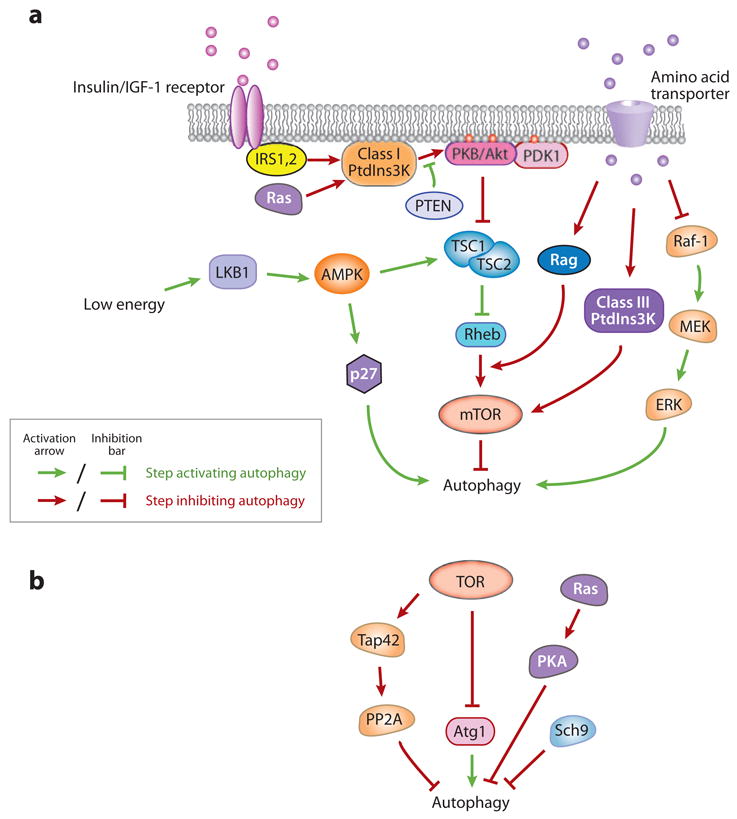
调节自噬的信号通路
营养素信号
TOR复合体1
Ras/PKA途径
胰岛素/生长因子途径
能量传感
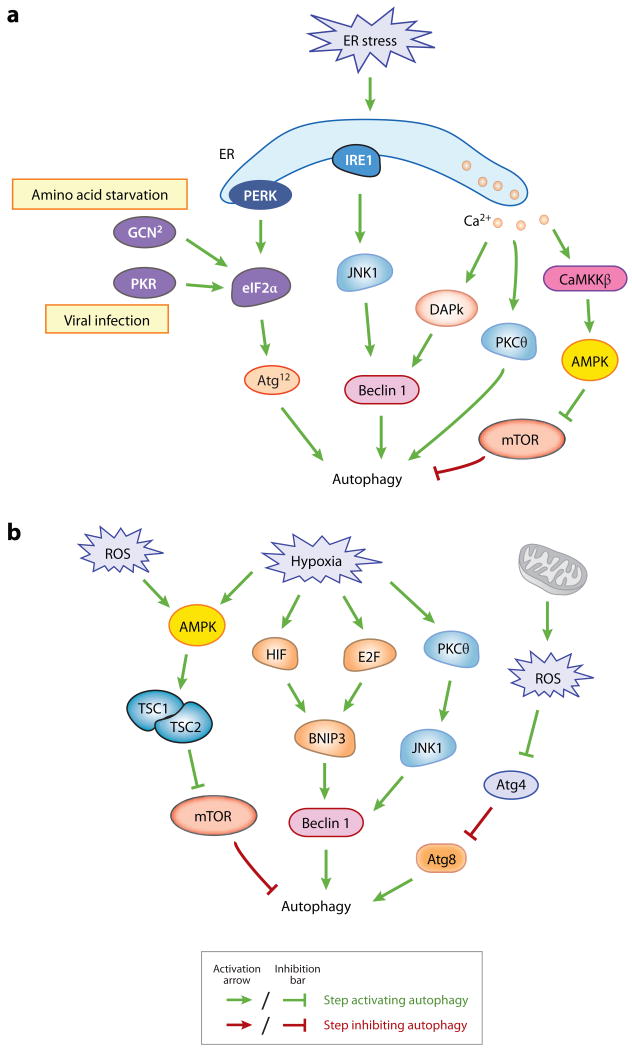
压力响应
ER应力
缺氧
图3。
氧化应激
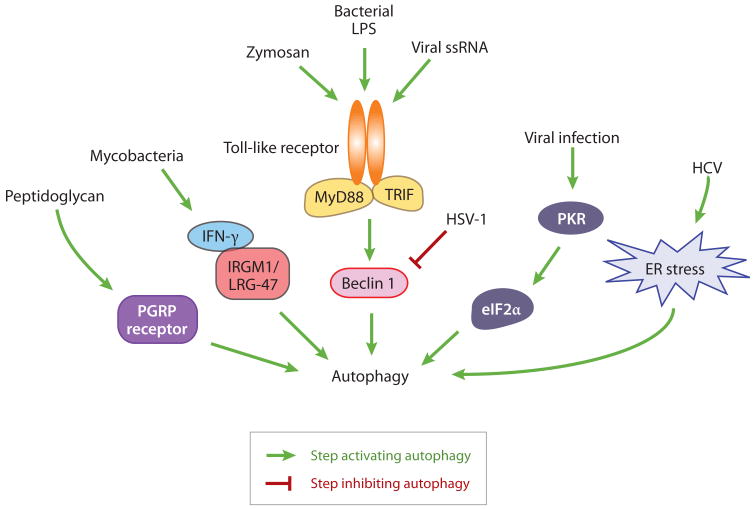
病原体感染
图4。
自噬的转录和表观调控
转录
染色体修饰
自噬机械的后翻译规则
磷酸化
乙酰化
结束语
总结要点
自噬介导溶酶体降解胞质蛋白质、受损或过量的细胞器、蛋白质聚集体和入侵微生物。 自噬可以通过受体和衔接蛋白非选择性地降解大量胞液或选择性地靶向特定货物。 自噬相关( 自动液位计 )基因产物在多个步骤中协同作用,促进双膜自噬体的形成。 各种应激条件刺激自噬诱导,自噬的信号转导机制正在被确定。 关于自噬基因的转录调控知之甚少,但有人建议使用几种转录因子来激活或抑制某些基因的表达 自动液位计 酵母中的基因, 果蝇属 和哺乳动物组织。 自噬蛋白经历磷酸化和乙酰化修饰,调节自噬活性。
未来的问题
需要进一步探索控制自噬的信号通路之间的串扰,并对几个上游通路的潜在收敛分子进行详细研究,例如TOR下调和自噬诱导之间的联系。 酵母和高等真核生物中Atg1激酶底物和Atg1复合体中新组分的表征将为这一重要激酶在自噬过程中的确切功能提供有用的信息。 在各种情况下,如细胞周期进展、细胞分裂、发育、分化和疾病,如何通过选择性自噬降解实现底物特异性,值得广泛研究。 应该注意的是,许多 自动液位计 酵母中选择性自噬所需的基因,如Atg11,在高等真核生物中尚未被鉴定。 因此,它们可能具有功能和结构相似性,但不具有序列同源性。 今后对自噬体形成机制的研究可以在体内或体外进行。 例如,重要的是要确定小的GTPase和SNARE蛋白在吞噬细胞组装过程中如何与自噬机制协作(如果涉及其中任何一个),以及是什么调节各种Atg蛋白与完整自噬体的分离。 自噬基因的转录和翻译调控,如mRNA表达和稳定性,以及是否存在组织特异性,需要在生理和病理应激条件下更好地理解。 Atg蛋白新的翻译后修饰及其调控机制的发现将增加我们目前对自噬基因调控的理解。
致谢
溶酶体 高等真核生物中的一种降解细胞器,可分隔一系列水解酶并保持高酸性pH值 真空管 溶酶体的酵母和植物等效物; 这种细胞器还具有储存和渗透调节功能 自噬体 一种细胞溶质双膜囊泡,用于隔离细胞内成分,以便在溶酶体/液泡中降解 Atg公司 自噬相关 噬菌体组装现场(PAS) 自噬体在酵母中形成自噬小体和类似类型的隔离小泡的空泡周围隔室或位置 细胞质-空泡靶向(Cvt) 酵母中的一种生物合成途径,通过选择性自噬样过程将驻留水解酶运输到液泡 吞咽Pexophagy 一种选择性自噬,涉及过氧化物酶体的螯合和降解; 可以通过微观或宏观自噬过程发生 任务大纲 雷帕霉素靶点 吞噬者 最初的隔离室,扩展成自噬体 生命周期3 微管相关蛋白1轻链3 磷脂酰肌醇3-激酶(PtdIns3K) 磷酸化磷脂肌醇环上3′羟基的酶。III类PtdIns3K刺激自噬,而I类抑制自噬 体育课 磷脂酰乙醇胺 Amphisome公司 由自噬体与内体或多泡体融合而形成的中间囊泡 PKA公司 cAMP依赖性蛋白激酶A UPR(不间断电源) 未折叠蛋白反应 JNK公司 c-Jun N-末端激酶 eIF2α 真核生物起始因子2α DAPk公司 钙调素调节的丝氨酸/苏氨酸激酶死亡相关蛋白激酶 玫瑰红 活性氧物种 TLR公司 Toll样受体
脚注
引用的文献
-
1 Abeliovich H,Darsow T,Emr SD。氨肽酶I从细胞质到液泡的转运需要由Tlg2p和Vps45p组成的T-SNARE-Sec1p复合物。 EMBO J.1999; 18:6005–16. doi:10.1093/emboj/18.21.6005。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
2 Alessi DR、James SR、Downes CP、Holmes AB、Gaffney PR等。磷酸化并激活蛋白激酶Ba.Curr Biol的3-磷酸肌醇依赖性蛋白激酶的表征。 1997; 7:261–69. doi:10.1016/s0960-9822(06)00122-9。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
三。 Arico S、Petiot A、Bauvy C、Dubbelhuis PF、Meijer AJ等。抑癌基因PTEN通过抑制磷脂酰肌醇3-激酶/蛋白激酶B途径,积极调节大分子自噬。 生物化学杂志。 2001; 276:35243–46. doi:10.1074/jbc。 C100319200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
4 Azad MB,Chen Y,Henson ES,Cizeau J,McMillan-Ward E,等。缺氧通过涉及BNIP3的机制诱导凋亡活性细胞的自噬细胞死亡。 自噬。 2008; 4:195–204. doi:10.4161/auto.5278。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
5 Bernales S、McDonald KL、Walter P.自噬在未展开蛋白反应期间抵消内质网扩张。 《公共科学图书馆·生物》。 2006; 4:e423。 doi:10.1371/journal.pbio.0040423。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
6 Björköy G、Lamark T、Brech A、Outzen H、Perander M等。p62/SQSTM1形成通过自噬降解的蛋白质聚集体,对亨廷顿蛋白诱导的细胞死亡具有保护作用。 细胞生物学杂志。 2005; 171:603–14. doi:10.1083/jcb.200507002。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]; 首次证明p62/SQSTM1是哺乳动物中泛素化聚集倾向蛋白的自噬降解所必需的。 -
7 Brugarolas J、Lei K、Hurley RL、Manning BD、Reiling JH等。REDD1和TSC1/TSC2抑癌复合物对缺氧反应中mTOR功能的调节。 基因开发2004; 18:2893–904. doi:10.10101/gad.1256804。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
8 Budovskaya YV,Stephan JS,Deminoff SJ,Herman PK。进化蛋白质组学方法识别cAMP依赖性蛋白激酶底物。 美国国家科学院院刊2005; 102:13933–38. doi:10.1073/pnas.0501046102。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
9 Budovskaya YV、Stephan JS、Reggiori F、Klonsky DJ、Herman PK。Ras/cAMP依赖性蛋白激酶信号通路调节酿酒酵母自噬过程的早期步骤。 生物化学杂志。 2004; 279:20663–71. doi:10.1074/jbc。 M400272200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
10 Byfield MP、Murray JT、Backer JM。hVps34是一种营养调节型脂激酶,激活p70 S6激酶所需。 生物化学杂志。 2005; 280:33076–82. doi:10.1074/jbc。 M507201200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
11 Cao Q,Yu C,Xue R,Hsueh W,Pan P,等。亚甲酰苯胺羟肟酸诱导Hela S3细胞自噬涉及蛋白激酶B的抑制和Beclin 1的上调。 国际生物化学与细胞生物学杂志。 2008; 40:272–83. doi:10.1016/j.biocel.2007.07.020。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
12 Carew JS、Nawrocki ST、Kahue CN、Zhang H、Yang C等。靶向自噬增强组蛋白脱乙酰酶抑制剂SAHA的抗癌活性,以克服Bcr-Abl介导的耐药性。 鲜血。 2007; 110:313–22. doi:10.1182/bloud-2006-10-050260。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
13 Chan EYW,Longatti A,McKnight NC,Tooze SA。激酶激活的ULK蛋白通过其保守的C末端结构域使用Atg13非依赖机制抑制自噬。 分子细胞生物学。 2009; 29:157–71. doi:10.1128/MCB.01082-08。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
14 Chang CY、Huang WP。 Atg19介导选择性自噬中的双重相互作用货物分拣机制。 分子生物学细胞。 2007; 18:919–29. doi:10.1091/mbc。 E06-08-0683。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
15 Chang YY,Neufeld TP公司。 在TOR介导的自噬调节中具有多重作用的Atg1/Atg13复合物。 分子生物学细胞。 2009; 20:2004–14. doi:10.1091/mbc。 E08-12-1250。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
16 Chen JL,Lin HH,Kim KJ,Lin A,Forman HJ,Ann DK。蛋白激酶Cd依赖性信号通路在急性缺氧应激诱导自噬中的新作用。 生物化学杂志。 2008; 283:34432–44. doi:10.1074/jbc。 M804239200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
17 Chen Y,McMillan-Ward E,Kong J,Israels SJ,Gibson SB.复合物I和II的线粒体电子转运抑制剂诱导活性氧介导的自噬细胞死亡。 细胞科学杂志。 2007; 120:4155–66. doi:10.1242/jcs.011163。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
18 Chen Y,McMillan-Ward E,Kong J,Israels SJ,Gibson SB.氧化应激诱导自噬细胞死亡,与转化细胞和癌细胞的凋亡无关。 细胞死亡不同。 2008; 15:171–82. doi:10.1038/sj.cdd.402233。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
19 Chen ZH、Kim HP、Sciurba FC、Lee SJ、Feghali-Bostwick C等。Egr-1调节吸烟诱导的慢性阻塞性肺疾病中的自噬。 《公共科学图书馆·综合》。 2008; 3:e3316。 doi:10.1371/journal.pone.0003316。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
20 Cheong H,Nair U,Geng J,Klinsky DJ。Atg1激酶复合物参与调节蛋白质募集,以启动隔离囊泡的形成,从而在酿酒酵母中实现非特异性自噬。 分子生物学细胞。 2008; 19:668–81. doi:10.1091/mbc。 E07-08-0826。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
21 Cheong H、Yorimitsu T、Reggiori F、Legakis JE、Wang CW、Klonsky DJ。Atg17调节自噬反应的大小。 分子生物学细胞。 2005; 16:3438–53. doi:10.1091/mbc。 E04-10-0894。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
22 Delgado MA、Elmaoued RA、Davis AS、Kyei G、Deretic V.Toll样受体控制自噬。 EMBO J.2008; 27:1110–21. doi:10.1038/emboj.2008.31。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
23 丁文轩,倪HM,高伟,侯义夫,梅兰玛,等。内质网应激诱导的自噬对细胞存活的差异影响。 生物化学杂志。 2007; 282:4702–10. doi:10.1074/jbc。 M609267200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
24 丁文新,倪HM,高伟,吉森T,斯托尔茨DB,等。自噬与泛素蛋白酶体系统的联系对内质网应激和细胞存活的调节至关重要。 《美国病理学杂志》。 2007; 171:513–24. doi:10.25353/ajpath.2007.070188。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
25 Dunn WA,Jr,Cregg JM,Kiel JAKW,van der Klei IJ,Oku M,等。Pexophagy:过氧化物酶体的选择性自噬。 自噬。 2005; 1:75–83. doi:10.4161/auto.1.2.1737。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
26 Epple UD、Suriapranata I、Eskelinen EL、Thumm M.Aut5/Cvt17p,一种假定的脂肪酶,对液泡内自噬体的分解至关重要。 细菌杂志。 2001; 183:5942–55. doi:10.1128/JB.183.20.5942-5955.2001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
27. Fader CM,Sanchez D,Furlan M,Colombo MI。自噬诱导促进k562细胞中多泡体与自噬空泡的融合。 交通。 2008; 9:230–50. doi:10.1111/j.1600-0854.2007.00677.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
28 Farre JC、Manjithaya R、Mathewson RD、Subramani S.PpAtg30通过选择性自噬标记过氧化物酶体进行周转。 开发单元。 2008; 14:365–76. doi:10.1016/j.devcel.2007.12.011。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
29 Fass E、Shvets E、Degani I、Hirschberg K、Elazar Z。微管支持饥饿诱导的自噬体的产生,但不支持其靶向和与溶酶体的融合。 生物化学杂志。 2006; 281:36303–16. doi:10.1074/jbc。 M607031200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
30 Filimonenko M、Stuffers S、Raiborg C、Yamamoto A、Malerod L等。功能性多泡体需要自噬清除与神经退行性疾病相关的蛋白质聚集体。 细胞生物学杂志。 2007; 179:485–500. doi:10.1083/jcb.200702115。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
31 Fujita E、Kouroku Y、Isoai A、Kumagai H、Misutani A等。突变型dysferrin新变体的两种内质网相关降解(ERAD)系统:泛素/蛋白酶体ERAD(I)和自噬/溶酶体ERAD。 2007; 16:618–29. doi:10.1093/hmg/ddm002。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
32 Fujita N、Itoh T、Omori H、Fukuda M、Noda T、Yoshimori T。Atg16L复合物为自噬中的膜生物生成指定LC3脂质氧化的位置。 分子生物学细胞。 2008; 19:2092–100. doi:10.1091/mbc。 E07-12-1257。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
33 Furuta S、Hidaka E、Ogata A、Yokota S、Kamata T.Ras通过I类PI3-激酶参与自噬的阴性控制。 癌基因。 2004; 23:3898–904. doi:10.1038/sj.onc.1207539。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
34 Geng J,Klinsky DJ。大自噬中的Atg8和Atg12泛素样结合系统。 2008年EMBO代表; 9:859–64. doi:10.1038/embor.2008.163。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
35. Gozuacik D、Bialik S、Raveh T、Mitou G、Shohat G等。DAP激酶是内质网应激诱导caspase活化和自噬细胞死亡的介体。 细胞死亡不同。 2008; 15:1875–86. doi:10.1038/cdd.2008.121。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
36 Gutierrez MG、Master SS、Singh SB、Taylor GA、Colombo MI、Deretic V.自噬是抑制感染巨噬细胞中卡介苗和结核分枝杆菌存活的防御机制。 单元格。 2004; 119:753–66. doi:10.1016/j.cell.2004.11.038。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
37 Hanada T、Noda NN、Satomi Y、Ichimura Y、Fujioka Y等。Atg12-Atg5结合物在自噬中具有新型的E3类蛋白脂质氧化活性。 生物化学杂志。 2007; 282:37298–302. doi:10.1074/jbc。 C700195200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
38 Hara T、Takamura A、Kishi C、Iemura S、Natsume T等。FIP200是一种ULK相互作用蛋白,是哺乳动物细胞形成自噬体所必需的。 细胞生物学杂志。 2008; 181:497–510. doi:10.1083/jcb.200712064。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
39 He C,Baba M,Cao Y,Klinsky DJ。自噬过程中,自身相互作用对Atg9在吞噬细胞组装部位的转运和功能至关重要。 分子生物学细胞。 2008; 19:5506–16. doi:10.1091/mbc。 E08-05-0544。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
40 He C,Song H,Yorimitsu T,Monastirska I,Yen WL,等。Atg11将Atg9招募到前自噬体结构对芽殖酵母的选择性自噬至关重要。 细胞生物学杂志。 2006; 175:925–35. doi:10.1083/jcb.200606084。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
41 Hosokawa N、Hara T、Kaizuka T、Kishi C、Takamura A等。自噬所需的ULK1-Atg13-FIP200复合物与营养依赖型mTORC1的关联。 分子生物学细胞。 2009; 20:1981–91. doi:10.1091/mbc。 E08-12-1248。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]; 提供mTOR对自噬蛋白营养依赖性磷酸化的直接证据。 -
42 Höyer-Hansen M、Bastholm L、Szyniarowski P、Campanella M、Szabadkai G等。通过钙、钙调素依赖性激酶激酶-b和Bcl-2控制大分子自噬。 分子细胞。 2007; 25:193–205. doi:10.1016/j.molcel.2006.12.009。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
43 Hrzenjak A、Kremser ML、Strohmeier B、Moinfar F、Zatloukal K、Denk H。SAHA通过影响mTOR途径诱导子宫内膜间质肉瘤细胞的caspase非依赖性自噬细胞死亡。 病理学杂志。 2008; 216:495–504. doi:10.1002/path.2434。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
44 黄Q,吴玉田,谭和林,翁春恩,沈HM.聚ADP-核糖聚合酶-1在氧化应激下调节自噬和坏死的新功能。 细胞死亡不同。 2009; 16:264–77. doi:10.1038/cdd.2008.151。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
45 Inoki K,Li Y,Xu T,Guan KL。Rheb GTPase是TSC2 GAP活性的直接靶点,调节mTOR信号。 基因开发2003; 17:1829–34. doi:10.1101/gad.110003。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
46. Inoki K,Zhu T,Guan KL.TSC2介导细胞能量反应以控制细胞生长和存活。 单元格。 2003; 115:577–90. doi:10.1016/s0092-8674(03)00929-2。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
47 Ishihara N、Hamasaki M、Yokota S、Suzuki K、Kamada Y等。自噬体的形成需要特定的早期Sec蛋白,而NSF/SNARE需要空泡融合。 分子生物学细胞。 2001; 12:3690–702. doi:10.1091/mbc.12.11.3690。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
48 Itakura E、Kishi C、Inoue K、Mizushima N.Beclin 1与哺乳动物Atg14和UVRAG.Mol Biol细胞形成两种不同的磷脂酰肌醇3-激酶复合物。 2008; 19:5360–72. doi:10.1091/mbc。 E08-01-0080。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
49 Itoh T、Fujita N、Kanno E、Yamamoto A、Yoshimori T、Fukuda M.Golgi-resident小GTPase Rab33B与Atg16L相互作用并调节自噬体的形成。 分子生物学细胞。 2008; 19:2916–25. doi:10.1091/mbc。 E07-12-1231。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
50 岩田A、莱利BE、约翰斯顿JA、科皮托RR.HDAC6和微管是聚集的亨廷顿蛋白自噬降解所必需的。 生物化学杂志。 2005; 280:40282–92. doi:10.1074/jbc。 M508786200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
51 Jager S、Bucci C、Tanida I、Ueno T、Kominami E等。Rab7在晚期自噬液泡成熟中的作用。 细胞科学杂志。 2004; 117:4837–48. doi:10.1242/jcs.01370。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
52. Jahreiss L、Menzies FM、Rubinsztein DC。 自噬体的行程:从外周形成到与溶酶体的kiss-and-run融合。 交通。 2008; 9:574–87. doi:10.1111/j.1600-0854.2008.00701.x。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
53 Juhasz G、Hill JH、Yan Y、Sass M、Baehrecke EH等。III类PI(3)K Vps34促进果蝇的自噬和内吞,但不促进TOR信号传导。 细胞生物学杂志。 2008; 181:655–66. doi:10.1083/jcb.200712051。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
54 Juhasz G,Neufeld TP。 自噬:寻找缺失的膜源长达四十年。 《公共科学图书馆·生物》。 2006; 4:e36。 doi:10.1371/journal.pbio.0040036。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
55 Juhasz G、Puskas LG、Komonyi O、Erdi B、Maroy P等。基因表达谱分析确定FKBP39是果蝇幼虫脂肪体自噬抑制剂。 细胞死亡不同。 2007; 14:1181–90. doi:10.1038/sj.cdd.4402123。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
56 Jung CH、Jun CB、Ro SH、Kim YM、Otto NM等。ULK-Atg13-FIP200复合物介导mTOR信号传导至自噬机制。 分子生物学细胞。 2009; 20:1992–2003. doi:10.1091/mbc。 E08-12-1249。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]; 提供mTOR对自噬蛋白营养依赖性磷酸化的直接证据。 -
57 Kabeya Y、Kamada Y、Baba M、Takikawa H、Sasaki M、Ohsumi Y。Atg17在酵母自噬中与Atg1和Atg13协同作用。 分子生物学细胞。 2005; 16:2544–53. doi:10.1091/mbc。 E04-08-0669。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
58 Kabeya Y、Mizushima N、Ueno T、Yamamoto A、Kirisako T等。LC3是酵母Apg8p的哺乳动物同源物,加工后定位于自噬体膜。 EMBO J.2000; 19:5720–28. doi:10.1093/emboj/19.21.5720。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
59 Kamada Y、Funakoshi T、Shintani T、Nagano K、Ohsumi M、Ohsimi Y。通过Apg1蛋白激酶复合物介导自噬诱导。 细胞生物学杂志。 2000; 150:1507–13. doi:10.1083/jcb.150.6.1507。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
60 Kawamata T,Kamada Y,Kabeya Y,Sekito T,Ohsumi Y。负责自噬体形成的自噬前结构的组织。 分子生物学细胞。 2008; 19:2039–50. doi:10.1091/mbc。 E07-10-1048。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
61 Kihara A,Noda T,Ishihara N,Ohsumi Y。酿酒酵母中两种不同的Vps34磷脂酰肌醇3-激酶复合物在自噬和羧肽酶Y分选中起作用。 细胞生物学杂志。 2001; 152:519–30. doi:10.1083/jcb.152.3.519。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
62 Kim E,Goraksha-Hicks P,Li L,Neufeld TP,Guan KL.Rag GTPases在营养反应中对TORC1的调节。 自然细胞生物学。 2008; 10:935–45. doi:10.1038/ncb1753。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
63 Kim I、Rodriguez-Enriquez S、Lemasters JJ。 线粒体通过有丝分裂选择性降解。 生物化学与生物物理学Arch Biochem Biophys。 2007; 462:245–53. doi:10.1016/j.abb.2007.03.034。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
64 Kim PK、Hailey DW、Mullen RT、Lippincott-Schwartz J.泛素信号细胞溶质蛋白和过氧化物酶体的自噬降解。 美国国家科学院院刊2008; 105:20567–74. doi:10.1073/pnas.081061105。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
65 Kirisako T、Baba M、Ishihara N、Miyazawa K、Ohsumi M等。用酵母中的Apg8/Aut7p追踪自噬体的形成过程。 细胞生物学杂志。 1999; 147:435–46. doi:10.1083/jcb.147.2.435。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
66. Kirisako T、Ichimura Y、Okada H、Kabeya Y、Mizushima N等。可逆修饰调节自噬所必需的Apg8/Aut7的膜结合状态和细胞质到液泡靶向途径。 细胞生物学杂志。 2000; 151:263–76. doi:10.1083/jcb.151.2.263。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
67 自噬的分子机制:尚未解答的问题。 细胞科学杂志。 2005; 118:7–18. doi:10.1242/jcs.01620。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
68 自噬:在不到十年的时间里从现象学到分子理解。 Nat Rev Mol细胞生物学。 2007; 8:931–37. doi:10.1038/nrm2245。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
69 Klionsky DJ、Cuervo AM、Dunn WA、Jr、Levine B、van der Klei I、Seglen PO。 我该怎么吃你? 自噬。 2007; 3:413–16. doi:10.4161/auto.4377。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
70 Klonsky DJ,Emr SD。自噬作为细胞降解的调节途径。 科学。 2000; 290:1717–21. doi:10.1126/science.290.5497.1717。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
71 Köchl R,Hu XW,Chan EYW,Tooze SA。微管促进自噬体的形成和自噬体内体的融合。 交通。 2006; 7:129–45. doi:10.1111/j.1600-0854.2005.00368.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
72 Kouroku Y、Fujita E、Tanida I、Ueno T、Isoai A等。内质网应激(PERK/eIF2a磷酸化)介导聚谷氨酰胺诱导的LC3转化,这是自噬形成的重要步骤。 细胞死亡不同。 2007; 14:230–39. doi:10.1038/sj.cdd.4401984。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
73 Kraft C、Deplazes A、Sohrmann M、Peter M。成熟核糖体在饥饿时通过需要Ubp3p/Bre5p泛素蛋白酶的自噬途径选择性降解。 自然细胞生物学。 2008; 10:602–10. doi:10.1038/ncb1723。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
74 Kubota H、Obata T、Ota K、Sasaki T、Ito T。雷帕霉素诱导GCN4 mRNA翻译去表达涉及eIF2α激酶GCN2激活的新机制。 生物化学杂志。 2003; 278:20457–60. doi:10.1074/jbc。 C300133200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
75 Lee IH,Cao L,Mostoslavsky R,Lombard DB,Liu J,等。NAD依赖性脱乙酰酶Sirt1在自噬调节中的作用。 美国国家科学院院刊2008; 105:3374–79. doi:10.1073/pnas.0712145105。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
76 Lee IH,Finkel T.通过p300乙酰转移酶调节自噬。 生物化学杂志。 2009; 284:6322–28. doi:10.1074/jbc。 M807135200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
77 Lee SB、Kim S、Lee J、Park J、Lee G等。ATG1是一种自噬调节器,通过负调控S6激酶抑制细胞生长。 2007年EMBO代表; 8:360–65. doi:10.1038/sj.embor.7400917。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
78 Legakis JE,Yen WL,Klonsky DJ。选择性自噬所需的循环蛋白复合物。 自噬。 2007; 3:422–32. doi:10.4161/auto.4129。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
79 Li J,Ni M,Lee B,Barron E,Hinton DR,Lee AS。哺乳动物细胞内质网完整性和应激诱导自噬需要未折叠蛋白反应调节器GRP78/BiP。 细胞死亡不同。 2008; 15:1460–71. doi:10.1038/cdd.2008.81。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
80 梁杰,邵世华,徐志新,轩尼诗B,丁Z,等。能量感应LKB1-AMPK通路调节p27kip1磷酸化,介导进入自噬或凋亡的决定。 自然细胞生物学。 2007; 9:218–24. doi:10.1038/ncb1537。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]; 第一个将细胞周期停滞与能量剥夺过程中的自噬诱导联系起来的证据。 -
81. Liang XH,Jackson S,Seaman M,Brown K,Kempkes B等。beclin 1诱导自噬和抑制肿瘤发生。 自然。 1999; 402:672–76. doi:10.1038/45257。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
82 Long J,Zhao J,Yan Z,Liu Z,Wang N.新型含硫羟肟酸组蛋白脱乙酰酶抑制剂H40的抗肿瘤作用。 国际癌症杂志。 2009; 124:1235–44. doi:10.1002/ijc.24074。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
83 Long X、Lin Y、Ortiz-Vega S、Yonezawa K、Avruch J.Rheb结合并调节mTOR激酶。 当前生物量。 2005; 15:702–13. doi:10.1016/j.cub.2005.02.053。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
84 Long X,Ortiz-Vega S,Lin Y,Avruch J.Rheb与哺乳动物雷帕霉素靶标(mTOR)的结合受氨基酸充足性的调节。 生物化学杂志。 2005; 280:23433–36. doi:10.1074/jbc。 C500169200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
85 Lum JJ,Bauer DE,Kong M,Harris MH,Li C等。生长因子在没有细胞凋亡的情况下对自噬和细胞存活的调节。 单元格。 2005; 120:237–48. doi:10.1016/j.cell.2004.11.046。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]; 证明当细胞被剥夺生长因子时,自噬对细胞生存至关重要。 -
86 Ma Y,Hendershot LM。 蛋白质反应展开的故事。 单元格。 2001; 107:827–30. doi:10.1016/s0092-8674(01)00623-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
87 Mammucari C、Milan G、Romanello V、Masiero E、Rudolf R等。FoxO3控制体内骨骼肌的自噬。 单元格元数据。 2007; 6:458–71. doi:10.1016/j.cmet.2007.11.001。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]; 证明哺乳动物中转录因子FoxO3对自噬基因的转录调控。 -
88 Manning BD,Tee AR,Logsdon MN,Blenis J,Cantley LC。作为磷脂酰肌醇3-激酶/Akt途径靶点的结节性硬化症复合物-2肿瘤抑制基因产物tubin的鉴定。 分子细胞。 2002; 10:151–62. doi:10.1016/s1097-2765(02)00568-3。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
89 Marks PA、Richon VM、Miller T、Kelly WK。 组蛋白脱乙酰酶抑制剂。 2004年癌症研究进展; 91:137–68. doi:10.1016/S0065-230X(04)91004-4。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
90 Meiling-Wesse K、Epple UD、Krick R、Barth H、Appelles A等。Trs85(Gsg1)是TRAPP复合物的一种成分,是通过Cvt途径在选择性自噬过程中组织前自噬体结构所必需的。 生物化学杂志。 2005; 280:33669–78. doi:10.1074/jbc。 M501701200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
91 Mercer CA、Kaliappan A、Dennis PB。 一种新的人类Atg13结合蛋白,Atg101,与ULK1相互作用,对大分子自噬至关重要。 自噬。 2009年doi:10.4161/auto.5.5.8249。 按。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
92 Mizushima N、Kuma A、Kobayashi Y、Yamamoto A、Matsube M等。小鼠Apg16L是一种新型WD-重复蛋白,以Apg12-Apg5结合物为自噬隔离膜靶点。 细胞科学杂志。 2003; 116:1679–88. doi:10.1242/jcs.00381。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
93 Mizushima N,Noda T,Ohsumi Y.在酵母自噬途径中,Apg12p-Apg5p结合物的功能需要Apg16p。 EMBO J.1999; 18:3888–96. doi:10.1093/emboj/18.14.3888。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
94 Monastirska I,He C,Geng J,Hoppe AD,Li Z,Klinsky DJ。Arp2将自噬机制与肌动蛋白细胞骨架联系起来。 分子生物学细胞。 2008; 19:1962–75. doi:10.1091/mbc。 E07-09-0892。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
95 Munoz Gamez JA、Rodriguez Vargas JM、Quiles Perez R、Aguilar Quesada R、Martin Oliva D等。PARP-1参与DNA损伤诱导的自噬。 自噬。 2009; 5:61–74. doi:10.4161/auto.5.1.7272。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
96 Narendra D、Tanaka A、Suen DF、Youle RJ。Parkin被选择性地招募到受损线粒体并促进其自噬。 细胞生物学杂志。 2008; 183:795–803. doi:10.1083/jcb.200809125。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
97 Natarajan K、Meyer MR、Jackson BM、Slade D、Roberts C等。转录谱分析表明Gcn4p是酵母氨基酸饥饿期间基因表达的主要调节器。 分子细胞生物学。 2001; 21:4347–68. doi:10.1128/MCB.211.4347-4368.2001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
98 Nazarko TY,Huang J,Nicaud JM,Klonsky DJ,Sibirny AA。Trs85是溶脂雅罗华酵母和酿酒酵母中大分子自噬、嗜酸细胞和细胞质到液泡靶向所必需的。 自噬。 2005; 1:37–45. doi:10.4161/auto.1.1.1512。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
99 Nezis IP,Simonsen A,Sagona AP,Finley K,Gaumer S,et al.Ref(2)P,哺乳动物p62的果蝇同源物,是在成人大脑中形成蛋白质聚集体所必需的。 细胞生物学杂志。 2008; 180:1065–71. doi:10.1083/jcb.200711108。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
100 Nice DC、Sato TK、Stromhaug PE、Emr SD、Klinsky DJ。选择性自噬需要细胞质与空泡靶向途径蛋白Cvt13和Cvt20以及自噬前结构中的磷脂酰肌醇3-磷酸的协同结合。 生物化学杂志。 2002; 277:30198–207. doi:10.1074/jbc。 M204736200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
101 Nicklin P、Bergman P、Zhang B、Triantafeallow E、Wang H等。氨基酸的双向转运调节mTOR和自噬。 单元格。 2009; 136:521–34. doi:10.1016/j.cell.2008.11.044。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
102. Nobukuni T、Joaquin M、Roccio M、Dann SG、Kim SY等。氨基酸通过激活3类磷脂酰肌醇3OH激酶介导mTOR/猛禽信号。 美国国家科学院院刊2005; 102:14238–43. doi:10.1073/pnas.0506925102。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
103 Noda NN、Kumeta H、Nakatogawa H、Satoo K、Adachi W等。选择性自噬过程中Atg8/LC3识别目标的结构基础。 基因细胞。 2008; 13:1211–18. doi:10.1111/j.1365-2443.2008.01238.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
104 Noda T,Ohsumi Y.Tor,一种磷脂酰肌醇激酶同源物,控制酵母中的自噬。 生物化学杂志。 1998; 273:3963–66. doi:10.1074/jbc.273.7.3963。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
105 Obara K,Sekito T,Niimi K,Ohsumi Y。Atg18-Atg2复合物通过磷脂酰肌醇3-磷酸补充到自噬膜,并发挥重要功能。 生物化学杂志。 2008; 283:23972–80. doi:10.1074/jbc。 M803180200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
106 Ogata M、Hino S、Saito A、Morikawa K、Kondo S等。内质网应激后激活自噬以促进细胞存活。 分子细胞生物学。 2006; 26:9220–31. doi:10.1128/MCB.01453-06。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]; 证明内质网应激触发自噬以促进哺乳动物细胞的细胞存活。 -
107 哦,M,Choi IK,Kwon HJ。 组蛋白脱乙酰酶1的抑制可诱导自噬。 生物化学与生物物理研究委员会。 2008; 369:1179–83. doi:10.1016/j.brc.2008.03.019。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
108 Orvedahl A、Alexander D、Tallóczy Z、Sun Q、Wei Y等。HSV-1 ICP34.5通过靶向Beclin 1自噬蛋白而产生神经毒性。 细胞宿主微生物。 2007; 1:23–35. doi:10.1016/j.chom.2006.12.001。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
109 Pandey UB、Nie Z、Batlevi Y、McCray BA、Ritson GP等。HDAC6拯救神经变性,并在自噬和UPS之间提供重要联系。 自然。 2007; 447:859–63. doi:10.1038/nature05853。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
110 Pankiv S、Clausen TH、Lamark T、Brech A、Bruun JA等。p62/SQSTM1直接与Atg8/LC3结合,以通过自噬促进泛素化蛋白聚集体的降解。 生物化学杂志。 2007; 282:24131–45. doi:10.1074/jbc。 M702824200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
111 Papandreou I,Lim AL,Laderoute K,Denko NC。缺氧通过AMPK活性在肿瘤细胞中发出自噬信号,与HIF-1、BNIP3和BNIP3L无关。 细胞死亡不同。 2008; 15:1572–81. doi:10.1038/cdd.2008.84。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
112 Pattinger S、Bauvy C、Carpentier S、Levade T、Levine B、Codogno P。JNK1-依赖性Bcl-2磷酸化在神经酰胺诱导的大自噬中的作用。 生物化学杂志。 2009; 284:2719–28. doi:10.1074/jbc。 M805920200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
113 Pattinger S,Bauvy C,Codogno P.氨基酸通过控制人类结肠癌HT-29细胞中Raf-1的激活,干扰ERK1/2依赖性的宏观自噬控制。 生物化学杂志。 2003; 278:16667–74. doi:10.1074/jbc。 M210998200。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
114 Pohl C,Jentsch S.通过自噬处理中体环是胞质分裂的脱落后事件。 自然细胞生物学。 2009; 11:65–70. doi:10.1038/ncb1813。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
115 Priault M、Salin B、Schaeffer J、Vallette FM、di Rago JP、Martinou JC。 破坏线粒体的生物能量状态和生物生成会触发酵母的有丝分裂。 细胞死亡不同。 2005; 12:1613–21. doi:10.1038/sj.cdd.4401697。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
116 Ramirez-Vale F、Braunstein S、Zavadil J、Formenti SC、Schneider RJ.eIF4GI将mTOR的营养感应与细胞增殖和自噬抑制联系起来。 细胞生物学杂志。 2008; 181:293–307. doi:10.1083/jcb.200710215。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
117 Ravikumar B、Acevedo-Arozena A、Imarisio S、Berger Z、Vacher C等。Dynein突变损害聚集倾向蛋白的自噬清除。 自然遗传学。 2005; 37:771–76. doi:10.1038/ng1591。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
118. Reggiori F,Monastyrska I,Shintani T,Klinsky DJ。在酿酒酵母中,肌动蛋白细胞骨架是选择性自噬所必需的,但不是非特异性自噬。 分子生物学细胞。 2005; 16:5843–56. doi:10.1091/mbc。 E05-07-0629。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
119 Reggiori F、Shintani T、Nair U、Klinsky DJ。酵母中线粒体和自噬前体结构之间的Atg9循环。 自噬。 2005; 1:101–9. doi:10.4161/auto.1.2.1840。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
120 Reggiori F,Tucker KA,Stromhaug PE,Klinsky DJ。Atg1-Atg13复合物从自噬前结构调节Atg9和Atg23的回收转运。 开发单元。 2004; 6:79–90. doi:10.1016/s1534-5807(03)00402-7。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
121. Reggiori F,Wang CW,Nair U,Shintani T,Abeliovich H,Klonsky DJ。酿酒酵母中的Cvt囊泡和自噬体组装需要分泌途径的早期阶段,但不需要内体。 分子生物学细胞。 2004; 15:2189–204. doi:10.1091/mbc。 E03-07-0479。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
122 Reggiori F,Wang CW,Stromhaug PE,Shintani T,Klinsky DJ。Vps51是酵母Vps 53栓系复合体的一部分,对早期内体和Cvt囊泡的逆行运输至关重要。 生物化学杂志。 2003; 278:5009–20. doi:10.1074/jbc。 M210436200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
123 Reiling JH,Hafen E.低氧诱导的副log锡拉和Charybdis通过下调果蝇TSC上游的S6K活性来抑制生长。 基因开发2004; 18:2879–92. doi:10.1101/gad.322704。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
124 Rodriguez-Hernandez A、Cordero MD、Salviati L、Artuch R、Pineda M等。辅酶Q缺乏通过有丝分裂触发线粒体降解。 自噬。 2009; 5:19–32. doi:10.4161/auto.5.1.7174。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
125 Rusten TE、Vaccari T、Lindmo K、Rodahl LM、Nezis IP等。ESCRTs和Fab1调节自噬的不同步骤。 当前生物量。 2007; 17:1817–25. doi:10.1016/j.cub.2007.09.032。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
126 Sakaki K,Wu J,Kaufman RJ。蛋白激酶Cθ是内质网应激反应中自噬所必需的。 生物化学杂志。 2008; 283:15370–80. doi:10.1074/jbc。 M710209200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
127 Sancak Y、Peterson TR、Shaul YD、Lindquist RA、Thoreen CC等。Rag GTPases结合猛禽并介导氨基酸信号传导至mTORC1。 科学。 2008; 320:1496–501. doi:10.1126/science.1157535。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
128 Sandoval H、Thiagarajan P、Dasgupta SK、Schumacher A、Prchal JT等。尼克斯在红细胞自噬成熟中的重要作用。 自然。 2008; 454:232–35. doi:10.1038/nature07006。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
129 Sanjuan MA、Dillon CP、Tait SW、Moshiach S、Dorsey F等。巨噬细胞中的Toll样受体信号将自噬途径与吞噬作用联系起来。 自然。 2007; 450:1253–57. doi:10.1038/nature06421。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
130 Scherz-Shouval R、Shvets E、Fass E、Shorer H、Gil L、Elazar Z。活性氧物种对自噬至关重要,并专门调节Atg4的活性。 EMBO J.2007; 26:1749–60. doi:10.1038/sj.emboj.7601623。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
131 Schmelzle T,Beck T,Martin DE,Hall MN。激活RAS/环AMP途径抑制酵母中TOR缺乏。 分子细胞生物学。 2004; 24:338–51. doi:10.1128/MCB.24.1338-351.2004。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
132 Schweers RL、Zhang J、Randall MS、Loyd MR、Li W等。NIX是网织红细胞成熟过程中程序化线粒体清除所必需的。 美国国家科学院院刊2007; 104:19500–5. doi:10.1073/pnas.0708818104。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
133 Scott RC、Juhasz G、Neufeld TP。 Atg1直接诱导自噬抑制细胞生长并诱导凋亡细胞死亡。 当前生物量。 2007; 17:1–11. doi:10.1016/j.cub.2006.10.053。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
134 Scott SV、Guan J、Hutchins MU、Kim J、Klonsky DJ。Cvt19是细胞质-空泡靶向途径的受体。 分子细胞。 2001; 7:1131–41. doi:10.1016/s1097-2765(01)00263-5。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
135 邵毅,高Z,马克斯·帕,江霞。组蛋白去乙酰化酶抑制剂诱导的凋亡和自噬细胞死亡。 美国国家科学院院刊2004; 101:18030–35. doi:10.1073/pnas.0408345102。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
136 Shi CS,Kehrl JH。 MyD88和Trif靶向Beclin 1以触发巨噬细胞中的自噬。 生物化学杂志。 2008; 283:33175–82. doi:10.1074/jbc。 M804478200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
137 Shintani T,Huang WP,Stromhaug PE,Klinsky DJ。细胞质到液泡靶向途径中的货物选择机制。 开发单元。 2002; 3:825–37. doi:10.1016/s1534-5807(02)00373-8。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
138 Singh SB,Davis AS,Taylor GA,Deretic V.人类IRGM诱导自噬以消除细胞内分枝杆菌。科学。 2006; 313:1438–41. doi:10.1126/science.1129577。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
139 D先生、陈先生、崔先生、Wakita T先生、Yen TS先生、Ou JH先生。 丙型肝炎病毒通过未折叠蛋白反应诱导不完全自噬反应。 肝病学。 2008; 48:1054–61. doi:10.1002/hep.22464。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
140 Stokoe D、Stephens LR、Copeland T、Gaffney PR、Reese CB等。磷脂酰肌醇-3,4,5-三磷酸在蛋白激酶B活化中的双重作用。科学。 1997; 277:567–70. doi:10.1126/science.277.5325.567。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
141 Stromhaug PE,Reggiori F,Guan J,Wang CW,Klionsky DJ。Atg21是一种磷酸肌醇结合蛋白,在选择性自噬摄取氨基肽酶I过程中,Atg8的有效脂质化和定位所需。 分子生物学细胞。 2004; 15:3553–66. doi:10.1091/mbc。 E04-02-0147。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
142 孙强,范伟,陈坤,丁X,陈S,钟奇。鉴定Barkor是Beclin 1和III类磷脂酰肌醇3-激酶的哺乳动物自噬特异性因子。 美国国家科学院院刊2008; 105:19211–16. doi:10.1073/pnas.0810452105。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
143 Suzuki K、Kirisako T、Kamada Y、Mizushima N、Noda T、Ohsumi Y。APG基因协同功能组织的自噬前结构对自噬体的形成至关重要。 EMBO J.2001; 20:5971–81. doi:10.1093/emboj/202.15971。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
144 Suzuki K,Kubota Y,Sekito T,Ohsumi Y。自噬前结构组织中Atg蛋白的层次结构。 基因细胞。 2007; 12:209–18. doi:10.1111/j.1365-2443.2007.01050.x。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
145 Tallóczy Z、Jiang W、Virgin HW、IV、Leib DA、Scheuner D等。eIF2a激酶信号通路对饥饿和病毒诱导自噬的调节。 美国国家科学院院刊,2002年; 99:190–95. doi:10.1073/pnas.012485299。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]; 第一种认为饥饿或病毒感染诱导自噬需要eIF2α激酶途径。 -
146 Tallóczy Z,Virgin HW,IV,Levine B.单纯疱疹病毒1型的PKR依赖性自噬降解。 自噬。 2006; 2:24–29. doi:10.4161/auto.2176。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
147 Tanaka Y、Guhde G、Suter A、Eskelinen EL、Hartmann D等。LAMP-2缺陷小鼠自噬空泡的积聚和心肌病。 自然。 2000; 406:902–6. doi:10.1038/35022595。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
148 Tanida I、Minematsu-Ikeguchi N、Ueno T、Kominami E.内源性LC3的溶酶体周转(但不是细胞水平)是自噬的标志。 自噬。 2005; 1:84–91. doi:10.4161/auto.1.2.1697。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
149 Teter SA、Eggerton KP、Scott SV、Kim J、Fischer AM、Klinsky DJ。酵母液泡中脂质小泡的降解需要假定脂肪酶Cvt17的功能。 生物化学杂志。 2001; 276:2083–87. doi:10.1074/jbc。 C000739200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
150 Tracy K、Dibling BC、Spike BT、Knabb JR、Schumacker P、Macleod KF。 BNIP3是低氧诱导自噬所需的RB/E2F靶基因。 分子细胞生物学。 2007; 27:6229–42. doi:10.1128/MCB.02246-06。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
151 Twig G、Elorza A、Molina AJ、Mohamed H、Wikstrom JD等。裂变和选择性融合通过自噬控制线粒体分离和消除。 EMBO J.2008; 27:433–46. doi:10.1038/sj.emboj.7601963。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
152 Vasseur S、Afzal S、Tardivel-Lacombe J、Park DS、Iovanna JL、Mak TW。DJ-1/PARK7是低氧诱导细胞反应的重要介质。 美国国家科学院院刊2009; 106:1111–16. doi:10.1073/pnas.0812745106。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
153 Wang Y,Weiss LM,Orlofsky A.弓形虫诱导宿主细胞自噬并促进寄生虫生长。 生物化学杂志。 2009; 284:1694–701. doi:10.1074/jbc。 M807890200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
154 Wang Z、Wilson WA、Fujino MA、Roach PJ。 Snf1p、AMP活化蛋白激酶的酵母同源物和细胞周期素依赖性激酶Pho85p对自噬和糖原积累的拮抗控制。 分子细胞生物学。 2001; 21:5742–52. doi:10.1128/MCB.21.17.5742-5752.2001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
155 Watanabe M、Adachi S、Matsubara H、Imai T、Yui Y等。组蛋白脱乙酰酶抑制剂FK228通过AIF易位诱导恶性横纹肌样肿瘤细胞自噬。 国际癌症杂志。 2009; 124:55–67. doi:10.1002/ijc.23897。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
156 Wei Y,Pattinger S,Sinha S,Bassik M,Levine B.JNK1介导的Bcl-2磷酸化调节饥饿诱导的自噬。 分子细胞。 2008; 30:678–88. doi:10.1016/j.molcel.2008.06.001。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
157 Wu H,Yang JM,Jin S,Zhang H,Hait WN。 延伸因子-2激酶调节人类胶质母细胞瘤细胞的自噬。 2006年癌症研究; 66:3015–23. doi:10.1158/0008-5472.CAN-05-1554。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
158 Xie Z,Nair U,Klinsky DJ。Atg8控制自噬体形成过程中吞噬细胞的扩张。 分子生物学细胞。 2008; 19:3290–98. doi:10.1091/mbc。 E07-12-1292。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
159 Xu Y,Jagannath C,Liu XD,Sharafkhaneh A,Kolodziejska KE,Eissa NT。Toll样受体4是与先天免疫相关的自噬传感器。 免疫。 2007; 27:135–44. doi:10.1016/j.immuni.2007.05.022。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ]; 证明Toll样受体信号刺激巨噬细胞自噬。 -
160 Yang Z,Huang J,耿J,Nair U,Klionsky DJ。Atg22回收氨基酸,将自噬的降解和回收功能联系起来。 分子生物学细胞。 2006; 17:5094–104. doi:10.1091/mbc。 E06-06-0479。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
161 Yano T,Mita S,Ohmori H,Oshima Y,Fujimoto Y等。通过果蝇细胞内先天免疫识别对李斯特菌的自噬控制。 国家免疫组织。 2008; 9:908–16. doi:10.1038/ni.1634。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
162 Yen WL,Klonsky DJ。如何长寿和繁荣:自噬、线粒体和衰老。 生理学。 2008; 23:248–62. doi:10.1152/physical.00013.2008。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
163 Yen WL、Legakis JE、Nair U、Klinsky DJ。Atg27是Atg9的自噬依赖性循环所必需的。 分子生物学细胞。 2007; 18:581–93. doi:10.1091/mbc。 E06-07-0612。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
164 Yorimitsu T,He C,Wang K,Klonsky DJ。Tap42相关蛋白磷酸酶2A型负调控自噬诱导。 自噬。 2009年doi:10.4161/auto.5.5.8091。 按。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
165 Yorimitsu T,Klinsky DJ。自噬:自噬的分子机制。 细胞死亡不同。 2005; 12:1542–52. doi:10.1038/sj.cdd.4401765。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
166 Yorimitsu T,Nair U,Yang Z,Klinsky DJ。内质网应激触发自噬。 生物化学杂志。 2006; 281:30299–304. doi:10.1074/jbc。 M607007200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
167 Yorimitsu T、Zaman S、Broach JR、Klonsky DJ。蛋白激酶A和Sch9协同调节酿酒酵母自噬的诱导。 分子生物学细胞。 2007; 18:4180–9. doi:10.1091/mbc。 E07-05-0485。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
168 Young ARJ、Chan EYW、Hu XW、Köchl R、Crawshaw SG等。哺乳动物Atg9在TGN和内体之间的饥饿和ULK1依赖性循环。 细胞科学杂志。 2006; 119:3888–900. doi:10.1242/jcs.03172。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
169. Zalckvar E、Berissi H、Mizrachy L、Idelchuk Y、Koren I等。DAP-激酶介导的beclin 1 BH3结构域磷酸化促进beclin L从Bcl-XL中分离并诱导自噬。 EMBO代表,2009年; 10:285–92. doi:10.1038/embor.2008.246。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] -
170 Zaman S,Lippman SI,Zhao X,Broach JR。酵母菌对营养的反应。 基因年度修订。 2008; 42:27–81. doi:10.1146/annurev.genet.41.110306.130206。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
171 Zhang H、Bosch-Marce M、Shimoda LA、Tan YS、Baek JH等。线粒体自噬是HIF-1依赖的缺氧适应性代谢反应。 生物化学杂志。 2008; 283:10892–903. doi:10.1074/jbc。 M800102200。 [ 内政部 ] [ PMC免费文章 ] [ 公共医学 ] [ 谷歌学者 ] [ 已缩回 ] -
172 Zhang Y,Gao X,Saucedo LJ,Ru B,Edgar BA,Pan D.Rheb是结节性硬化肿瘤抑制蛋白的直接靶点。 自然细胞生物学。 2003; 5:578–81. doi:10.1038/ncb999。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
173 Zhang Y,Yan L,Zhou Z,Yang P,Tian E,等。SEPA-1通过自噬介导秀丽线虫对P颗粒成分的特异性识别和降解。 单元格。 2009; 136:308–21. doi:10.1016/j.cell.2008.12.022。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ] -
174 Zhao J、Brault JJ、Schild A、Cao P、Sandri M等。FoxO3通过自噬/溶酶体和蛋白酶体途径协同激活萎缩肌肉细胞中的蛋白质降解。 单元格元数据。 2007; 6:472–83. doi:10.1016/j.cmet.2007.11.004。 [ 内政部 ] [ 公共医学 ] [ 谷歌学者 ]; 证明哺乳动物中转录因子FoxO3对自噬基因的转录调控。